一种靶向线粒体的硫氧还蛋白还原酶荧光探针及其制备方法和应用与流程
本发明荧光探针技术领域,更具体地,涉及一种靶向线粒体的硫氧还蛋白还原酶荧光探针及其制备方法和应用。
背景技术:
硫氧还蛋白还原酶(thioredoxinreductase,trxr)属于吡啶核苷酸二硫化合物氧化还原酶家族成员,与其天然底物硫氧还蛋白(thioredoxin,trx)以及还原型烟酰胺嘌呤二核苷磷酸(nicotinamideadeninedinucleotidephosphate,nadph),共同组成trx系统。trx系统(调节ros水平的主要酶系统)对细胞增殖、抵御氧化应激、维持细胞内正常的氧化还原平衡以及在肿瘤的发生发展中具有重要的作用。硫氧还蛋白还原酶作为该系统的核心成员,一方面的作用是将线粒体呼吸作用的底物烟酰胺嘌呤二核苷磷酸(nadp+)还原为nadph;另一方面的作用是结合电子传递体还原谷胱甘肽过氧化物酶。因此,硫氧还蛋白还原酶的表达和活性的改变是维持细胞氧化还原平衡的一个重要决定因素。硫氧还蛋白还原酶与多种疾病关系密切,在肿瘤的发生和发展过程中尤其重要。在人类多种原发性肿瘤的研究中发现,肿瘤组织中的trxr的表达水平普遍较高,且其表达量与肿瘤的恶性程度呈正相关。此外,硫氧还蛋白还原酶还参调控肿瘤细胞耐药性的发生。
荧光分子探针对研究靶标的生物学功能、药物的研发及作用机制、肿瘤检测、活体成像等方面都具有重要的应用研究价值。由于硫氧还蛋白还原酶在调控细胞氧化应激过程中起着关键作用,参与并调控肿瘤细胞的增殖、耐药、凋亡等进程,研究开发可在体内外原位靶向硫氧还蛋白还原酶的新型高效并具有治疗功能的荧光探针分子具有重要的临床意义。
目前大量的硫氧还蛋白还原酶抑制剂及少数分子探针则是通过亲电子化合物选择性地和不可逆地修饰-seh活性位点的。尽管硫氧还蛋白还原酶抑制剂报道较多,但国内外针对硫氧还蛋白还原酶探针的报道稀缺,主要有fang组设计合成了具有“开-关”效应的trxr探针trfs-green和mito-trfs(zhang,l.etal.,highlyselectiveoff-onfluorescentprobeforimagingthioredoxinreductaseinlivingcells.journaloftheamericanchemicalsociety2014,136,226-233;zhang,b.etal.,selectiveselenolfluorescentprobes:design,synthesis,structuraldeterminants,andbiologicalapplications.journaloftheamericanchemicalsociety2015,137,757-69),但该探针是基于对二硫键的切割而释放荧光,基团来实现的,而非通过共价作用产生的特异性。已报道的探针还存在灵敏度和选择性不高、容易发生荧光淬灭、发射波长较短,不足以用于体内试验研究等方面的缺点,如tr-green(huang,l.etal.,afuranylacrylconjugatedcoumarinasanefficientinhibitorandahighlyselectiveoff-onfluorescentprobeforcovalentlabellingofthioredoxinreductase.chemicalcommunications2014,50,6987-90)。此外,已报道的分子探针虽然可以在细胞内实现对硫氧还蛋白还原酶成像与诊断,但并不具备治疗的功能。
技术实现要素:
本发明的目的在于提供一种靶向线粒体的硫氧还蛋白还原酶荧光探针。本发明所述荧光探针可与硫氧还蛋白还原酶共价结合,荧光成像效果好,且选择性高、灵敏度高,能够定性和定量的检测硫氧还蛋白还原酶,同时还对硫氧还蛋白还原酶具有优异的抑制作用,可制备成为硫氧还蛋白还原酶抑制剂进行应用;且制备过程简单,产率高,成本低廉,适于工业化生产。
本发明的第二目的在于提供所述靶向线粒体的硫氧还蛋白还原酶荧光探针的制备方法。
本发明的第三目的在于提供所述靶向线粒体的硫氧还蛋白还原酶荧光探在硫氧还蛋白还原酶的定性和定量检测中的应用。
本发明的第四目的在于提供所述靶向线粒体的硫氧还蛋白还原酶荧光探制备成为硫氧还蛋白还原酶抑制剂药物的应用。
本发明的第五目的在于提供所述靶向线粒体的硫氧还蛋白还原酶荧光探制备成为抗肿瘤药物的应用。
本发明的上述目的是通过以下方案予以实现的:
一种靶向线粒体的硫氧还蛋白还原酶荧光探,其结构如式(ⅰ)所示或其药学上可接受的盐:
本发明所述荧光探针为的化学名称为:(1e,4z,6e)-5-羟基-1-(5-甲基呋喃-2-基)-7-(4-(4-吡啶基)苯基)庚-1,4,6-三烯基-3-酮六氟磷酸盐,分子式为c24h22f6no3p,以下简称其为cur-fy。
本发明所述cur-fy同时含有含药效团呋喃丙烯酰基团和可靶向线粒体的六氟磷酸盐,其通过迈克尔加成反应共价结合到硫氧还蛋白还原酶碳末端的硒半胱氨上,对硫氧还蛋白还原酶有较高的抑制活性和选择性,可广泛应用于样品中硫氧还蛋白还原酶定性和定量的检测,以及硫氧还蛋白还原酶的同家族酶、同工酶、结构相似酶的活性和含量检测,尤其适用于检测活体肿瘤细胞中硫氧还蛋白还原酶定性和定量的检测。
优选地,式(ⅰ)化合物在药学上可接受的盐为其钠盐、乙酸盐、乙二酸盐、丙酸盐、锂盐、钾盐、钙盐、镁盐、铁盐、铜盐、硫酸盐、盐酸盐、有机铵盐、磷酸盐或柠檬酸盐。
优选地,所述有机铵盐为甲胺盐、乙胺盐、三乙基胺盐、n,n-二异丙基乙胺盐或六氟磷酸盐。
所述靶向线粒体的硫氧还蛋白还原酶荧光探的制备方法也在本发明的保护范围之内,包括以下步骤:
s1:乙酰丙酮和5-甲基-2-呋喃甲醛,在氧化硼的保护下,加热至70-120度反应;再加入硼酸三丁酯混匀反应,然后滴加正丁胺,滴加完毕升温至80-120度;反应结束后分离,得到中间体a1;
s2:将中间体a1和4-吡啶基苯甲醛溶于溶剂,在氧化硼的保护下,加热至70-120度反应;再加入硼酸三丁酯混匀反应,然后滴加正丁胺,滴加完毕升温至80-120度;待反应结束后分离,得到中间体a2;
s3:将中间体a2和碘甲烷混溶于溶剂后加热至80-120度反应;待反应结束后分离,得到目标化合物;
其中中间体a1和中间体a2的结构如下所示:
其路线如下所示:
优选地,步骤s1中,乙酰丙酮和5-甲基-2-呋喃甲醛,在氧化硼的保护下,加热至70度反应;再加入硼酸三丁酯混匀反应,然后滴加正丁胺,滴加完毕升温至100度;反应结束后分离,得到中间体a1。
优选地,步骤s1中,反应结束后的分离过程为:反应液降温至室温,加入hcl调ph至3,然后乙酸乙酯萃取,分离并干燥有机层,然后去除溶剂,所得固体经柱层析纯化,得中间体a1。
优选地,步骤s2中,将中间体a1和4-吡啶基苯甲醛溶于溶剂,在氧化硼的保护下,加热至70度反应;再加入硼酸三丁酯混匀反应,然后滴加正丁胺,滴加完毕升温至100度;待反应结束后分离,得到中间体a2。
优选地,步骤s2中,反应结束后的分离过程为:反应液降温至室温,加入hcl调ph至3,然后乙酸乙酯萃取,分离并干燥有机层,然后去除溶剂,所得固体经柱层析纯化,得中间体a2。
优选地,步骤s3中,将中间体a2和碘甲烷混溶于溶剂后加热至100度反应;待反应结束后分离,得到目标化合物。
优选地,步骤s3中,反应结束后的分离过程为:反应液冷却到室温,过滤,所得固体用正己烷洗涤,然后溶于丙酮,滴加饱和的napf6溶液,搅拌后过滤,得目标化合物。
优选地,步骤s1和s2的反应在乙酸乙酯中进行;步骤s3的反应在四氢呋喃中进行。
优选地,步骤s1中,乙酰丙酮和5-甲基-2-呋喃甲醛的反应摩尔比为5~8:1~1.2;更优选地为5:1;
步骤s2中,中间体a1和4-吡啶基苯甲醛的反应摩尔比为1:1-1.5:1;更优选地为1:1;
步骤s3中,中间体a2和碘甲烷的反应摩尔比为1:1.5-2.5:3.2;更优选地为1:1.5。
本发明同时还保护所述靶向线粒体的硫氧还蛋白还原酶荧光探在硫氧还蛋白还原酶的定性和定量检测中的应用。
优选地,所述靶向线粒体的硫氧还蛋白还原酶荧光探在制备硫氧还蛋白还原酶检测试剂和/或检测试剂盒中的应用。
本发明同时还保护所述靶向线粒体的硫氧还蛋白还原酶荧光探制备成为硫氧还蛋白还原酶抑制剂药物的应用。
本发明同时还保护所述靶向线粒体的硫氧还蛋白还原酶荧光探制备成为抗肿瘤药物的应用。
优选地,所述抗肿瘤药物为抗宫颈癌、肺癌、肝癌或卵巢癌等肿瘤·。
与现有技术相比,本发明具有以下有益效果:
(1)本发明所述cur-fy同时含有含药效团呋喃丙烯酰基团和可靶向线粒体的六氟磷酸盐,其通过迈克尔加成反应共价结合到硫氧还蛋白还原酶碳末端的硒半胱氨上,且荧光成像效果好,选择性高、灵敏度高,能够定性和定量的检测硫氧还蛋白还原酶,以及硫氧还蛋白还原酶的同家族酶、同工酶、结构相似酶的活性和含量的检测,尤其适用于检测活体肿瘤细胞中硫氧还蛋白还原酶定性和定量的检测;对制备新型荧光探针用于可视化检测硫氧还蛋白还原酶及其同家族酶、同工酶、结构相似酶具有重要的应用价值;
(2)本发明所述cur-fy同时还对硫氧还蛋白还原酶具有优异的抑制作用,可制备成为硫氧还蛋白还原酶抑制剂进行应用,具有抗肿瘤作用;
(3)本发明提供的靶向线粒体的硫氧还蛋白还原酶荧光分子探针合成步骤少、产率高,成本低廉,适于工业化生产。
附图说明
图1为荧光探针cur-fy的氢谱图。
图2为荧光探针cur-fy的碳谱图。
图3为荧光探针cur-fy的紫外吸收光谱。
图4为荧光探针cur-fy和硫氧还蛋白还原酶结合前后的荧光发射光谱图。
图5为荧光探针cur-fy对硫氧还蛋白还原酶的抑制活性图。
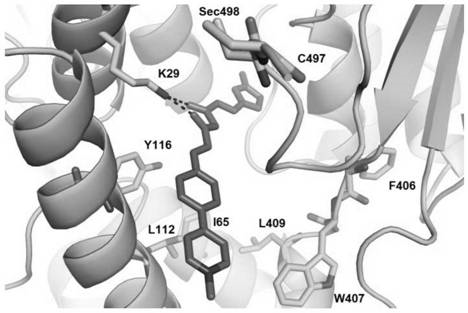
图6为荧光探针cur-fy与硫氧还蛋白还原酶计算机分子对接图。
图7为分离出连接着biam的硫氧还蛋白还原酶的sds-page电泳图。
图8为在纯酶水平和细胞内,荧光探针cur-fy与硫氧还蛋白还原酶结合后检测到明显的荧光现象。
图9为荧光探针cur-fy对硫氧还蛋白还原酶的高选择性结果。
图10为荧光分子cur-fy在细胞内对硫氧还蛋白还原酶的成像图。
具体实施方式
下面结合具体实施例对本发明做出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
实施例1荧光探针cur-fy的制备
荧光探针cur-fy的制备过程,具体如下:
步骤一:乙酰丙酮(5g,50mmol)溶于乙酸乙酯在氧化硼(2.5g,36mmol,0.7eq.)的保护下,70度搅拌30min。加入5-甲基-2-呋喃甲醛(1.1g,10mmol),硼酸三丁酯(2.3g,10mmol)继续搅拌30min.滴加溶有正丁胺(0.73g,10mmol)的乙酸乙酯(3ml),滴加完毕升温至100度,反应5h。降温至室温,加入1nhcl调ph至3,乙酸乙酯萃取,有机层用无水硫酸钠干燥,旋蒸乙酸乙酯,固体用柱层析纯化得黄色固体目标化合物中间体a11.5g,产率81%。
中间体a1:1hnmr(400mhz,cdcl3)δ15.40(s,1h),7.36–7.29(m,1h),6.52–6.39(m,1h),6.28(d,j=15.54hz,1h),6.10–6.16(m,1h),5.59(s,1h),2.35(s,3h),2.14(s,3h).hrms(tof)calculatedforc11h12o3[m]+192.0786,found192.0793.
步骤二:将a1(1.0g,5.2mmol)溶于乙酸乙酯在氧化硼(0.25g,3.6mmol,0.7eq.)的保护下,70度搅拌30min。加入4-吡啶基苯甲醛(0.95g,5.2mmol),硼酸三丁酯(1.2g,5.2mmol,1.0eq.)继续搅拌30min.滴加溶有正丁胺(0.38g,5.2mmol,1.0eq.)的乙酸乙酯(3ml),滴加完毕升温至100度,反应5h。降温至室温,加入1nhcl调ph至3,乙酸乙酯萃取,有机层用无水硫酸钠干燥,旋蒸乙酸乙酯,固体用柱层析纯化,得橙红色固体目标化合物中间体a21.30g,产率70%。
中间体a2:1hnmr(400mhz,cdcl3)δ15.96(s,1h),8.69-8.67(t,2h),7.70-7.63(t,5h),7.54-7.52(t,2h),7.38(d,j=15.41hz,2h),7.26(s,1h),6.67(d,j=16.05hz,1h),6.56(d,j=3.27hz,1h),6.46(d,j=15.36hz,1h),6.12-6.11(m,1h),5.80(s,1h),2.38(s,3h).13cnmr(150mhz,cdcl3)δ184.26,181.83,155.99,150.44,150.41,147.63,139.44,139.00,136.14,128.89,127.64,127.60,125.25,121.59,120.12,117.37,109.44,102.36,14.14。hrms(tof)calculatedforc23h20no3[m]+358.1438,found358.1459。
步骤三:在50ml的圆底烧瓶中加入a2(300mg,1.0eq.),四氢呋喃15ml,碘甲烷(177mg,1.5eq.),100度搅拌8h。待反应液冷却到室温,过滤,固体用正己烷洗涤。将固体用丙酮(10ml)溶解,滴加10ml饱和的napf6溶液,搅拌1h,过滤,得红色固体终产物cur-fy412mg,产率94%。
红色固体终产物cur-fy:1hnmr(400mhz,meod)δ8.90(d,j=6.90hz,2h),8.42(d,j=6.90hz,2h),8.06(d,j=8.47hz,2h),7.89(d,j=8.36hz,2h),7.68(d,j=15.68hz,1h),7.41(d,j=15.55hz,1h),6.96(d,j=16.05hz,1h),6.52(d,j=15.46hz,1h),6.21(dd,j=3.31hz,0.96hz,1h),6.04(s,1h),4.40(s,3h),2.38(s,3h),13cnmr(150mhz,meod)δ193.85,189.98,165.46,162.55,158.94,154.89,147.55,147.32,143.69,138.50,137.90,136.88,135.87,133.28,128.83,127.86,119.16,111.54,56.35,22.97。hrms(tof)calculatedforc24h22no3[m]+372.1594,found372.1286。
固体产物cur-fy的h谱和c谱分别如图1和图2所示。
该探针合成步骤短、产率高,可通过迈克尔加成反应共价结合到硫氧还蛋白还原酶上。通过该荧光探针对硫氧还蛋白还原酶的选择性检测,发现其选择性高,荧光成像效果好,因此可广泛应用于样品中硫氧还蛋白还原酶含量的检测。
实施例2荧光探针cur-fy的紫外吸收光谱和荧光发射光谱的测定
经检测荧光探针cur-fy紫外最大特征吸收峰在440nm,荧光发射波长为540nm,如图3所示。在进一步的研究中发现,加入硫氧还蛋白还原酶与荧光探针反应后,荧光在540nm处显著增强,如图4所示。
(1)荧光探针cur-fy紫外吸收光谱的测定方法
酶标仪,型号:synergyh1,biotek,usa。磷酸钾缓冲液(pbs)配制:氯化钠(nacl),8g;氯化钾(kcl),0.2g;磷酸氢二钠(na2hpo4),1.44g;磷酸二氢钾(kh2po4),0.24g,调ph7.4,定容1l,高压蒸汽灭菌,室温保存。
实验方法:用pbs配荧光探针cur-fy为10μm,在96孔酶标板中加入100μlcur-fy,在酶标仪中对cur-fy的紫外吸收光谱进行扫描并记录。
(2)荧光探针cur-fy荧光发射光谱的测定方法
试剂与仪器:酶标仪,型号:synergyh1,biotek,usa。磷酸钾缓冲液(pbs)。
实验方法:荧光探针cur-fy浓度为10μm,以440nm为激发波长,激发狭缝为5nm,发射狭缝为5nm,扫描记录荧光发射光谱。
实施例3.cur-fy对硫氧还蛋白还原酶抑制活性测定
荧光探针cur-fy抑制硫氧还蛋白还原酶活性测定采用dtnb法,cur-fy对硫氧还蛋白还原酶的抑制活性ic50是2.48μm(图5),表明cur-fy对硫氧还蛋白还原酶具有较好的抑制作用。
实验方法:测试缓冲溶液的配制:取200ul1m的磷酸钾溶液、0.2ml500mm的edta溶液、20ul20mg/ml的bsa、10ul48mm的nadph,加入到1.73ml的双蒸水中,混匀。取35.5ul测试缓冲溶液到384孔板中,加入硫氧还蛋白还原酶(t9698,sigma)0.3ul,1ulcur-fy(终浓度为0.3125,0.625,1.25,2.5,5,10μm)孵育5min,最后加入3.2ul63mm的dtnb,412nm处读取吸光度,每隔10s记录一次,记录2min,根据动力学曲线斜率计算荧光探针对硫氧还蛋白还原酶的抑制率。
实施例4.荧光探针cur-fy与硫氧还蛋白还原酶计算机分子对接分析
为了更好的解析荧光探针cur-fy与硫氧还蛋白还原酶的结合模式,我们在计算机中利用moe(molecularoperatingenvironment)软件,分析了荧光探针cur-fy与硫氧还蛋白还原酶的相互作用。研究结果发现,将荧光探针与硫氧还蛋白还原酶中的sec498进行共价连接后,荧光探针可很好地存在于硫氧还蛋白还原酶二聚体界面,且构象呈现出发卡的构型,荧光探针cur-fy结构中的疏水基团嵌入硫氧还蛋白还原酶的疏水口袋(由其中一个亚基的f406,l409和w407残基与另一个亚基的i65,l112和y116残基所形成),而荧光探针中的β-二酮与酶上的k29形成稳定的氢键(图6)。
实验方法:荧光探针cur-fy与硫氧还蛋白还原酶的对接采用moe分子模拟及药物设计综合软件,人源硫氧还蛋白还原酶晶体结构数据来自于pdb数据库(pbdcode2zzb),荧光探针cur-fy构象优化采用moe中的mmff94xforcefield模块分析计算。将荧光探针与硫氧还蛋白还原酶中sec498进行对接,硫氧还蛋白还原酶碳端ile492到gly499的构象用lowmodemd方法经行处理,最终对接结果用pymol进行作图。
实施例5.荧光探针cur-fy与硫氧还蛋白还原酶结合位点为硒半胱氨酸残基
采用biam(生物素标记的碘乙酰胺,biotinylatediodoacetamide)法检测荧光探针cur-fy对细胞内硫氧还蛋白还原酶作用位点。biam可以选择性地生物素化硫氧还蛋白还原酶的活性位点的残基。在高ph值(ph=8.5)的缓冲溶液中,cys-sh和cys-seh两个残基被同时生物素化;而低ph值(ph=6.5)的缓冲溶液中,只有cys-seh才能被biam生物素化。因此,我们将不同浓度的荧光探针cur-fy跟硫氧还蛋白还原酶在一起孵化2个小时之后,各抽取一部分加入到不同ph值(8.5和6.5)的含有biam的缓冲溶液中,在37℃孵化30分钟使得剩余的酶和biam充分结合。当我们用sds-page电泳分离出连接着biam的硫氧还蛋白还原酶并通过westernblot分析进行检测后发现(图7),在ph值6.5的缓冲溶液中,随着荧光探针cur-fy浓度的增加(10-50μm),条带强度减弱。在ph值8.5的缓冲溶液中,随着荧光探针cur-fy浓度的增加条带强度增强。由于ph值6.5时只有cys-seh才能被biam生物素化,因此结果表明荧光探针cur-fy跟硫氧还蛋白还原酶的碳末端-seh残基结合,并且随着浓度的增加,结合度也增大。
实验方法:用100umbiam与硫氧还蛋白还原酶室温下孵育10min,然后将浓度为10um和50um的荧光探针cur-fy分别与上述酶溶液在25℃孵育2h。对照组中加入了相同体积的dmso。之后各取1ul分别加入到19ul含有biam的tris-hcl缓冲溶液(20mm,ph8.5)和bis-tris-hcl缓冲溶液(20mm,ph6.5)中并在37℃水浴中恒温孵育30min使酶溶液中的的-sh和-seh与biam充分结合。然后取20ul被biam标记的酶溶液与20ul样品还原溶液在90℃加热10min,从中取20ul用10%的sds-page凝胶电泳分离,之后转印到pvdf膜上,加入辣根过氧化酶交联的抗生蛋白链菌素作用后并用增强化学发光法进行检测。
实施例6.荧光探针cur-fy与硫氧还蛋白还原酶共价结合作用评价
主要采用的方法有sds/page法检测荧光探针在纯酶水平和细胞内的作用模式。硫氧还蛋白还原酶自身是55kd,同时由于只有以共价结合方式与蛋白结合的化合物才能在sds/page电泳中保留下来。通过观察该位置的荧光探针cur-fy的荧光可帮助分析荧光探针与硫氧还蛋白还原酶的是否共价结合的。研究发现,在纯酶水平和细胞内的荧光探针能够在硫氧还蛋白还原酶的分子量位置检测了明显的荧光(图8)。说明荧光探针是以共价结合方式与硫氧还蛋白还原酶结合的。
实验方法:纯酶水平,取4μm硫氧还蛋白还原酶先用含nadph的磷酸钾缓冲溶液室温孵育20min,分为两份,编号为1,2号。2号加入分子探针室温孵育2h,1号加入等量体积的双蒸水。样品用超滤管进行超滤至母液为40ul,每个样品加入10ulloadingbuffer,100℃煮沸5min,然后进行电泳。电泳完后,用凝胶成像系统进行拍照(激发波长为490nm),为了检测凝胶上的硫氧还蛋白还原酶蛋白,用考马斯亮蓝溶液进行染色,37℃过夜,最后用考马斯亮蓝脱色液进行脱色,拍照记录。细胞内的检测,首先是将培养好的hela细胞裂解,取100μg蛋白与荧光探针孵育2h,用超滤管进行超滤至40ul,后续步骤同上。
实施例7.荧光探针cur-fy对硫氧还蛋白还原酶的高选择性
做为一个有效的靶向性探针需要对靶点具有较高的选择性,因此我们在研究中也对荧光探针cur-fy对硫氧还蛋白还原酶的选择性进行了检测。通过对比荧光探针cur-fy与各种小分子和蛋白孵育后荧光强度的不同,我们可以得出荧光探针cur-fy与硫氧还蛋白还原酶的荧光强度显著高于其他物质(图9),这表明荧光探针cur-fy具有高的选择性,有利于开发作为硫氧还蛋白还原酶探针的应用。
结合前面的实验结果,cur-fy对硫氧还蛋白还原酶的高选择性主要是由于cur-fy能够与硫氧还蛋白还原酶碳末端-seh残基特异性共价结合,由此产生较强的酶抑制活性(ic50=2.48μm),不含-seh基团的小分子化合物和蛋白则没有产生荧光的变化。在研究过程中,我们也对中间体a1检测了对硫氧还蛋白还原酶的抑制活性,其ic50是15.7μm。在纯酶水平的检测中,不涉及线粒体的靶向性,所以化合物对酶的抑制作用由化合物的整体分子结构决定的。同时,结合计算机分子对接结果,只有cur-fy整体结构与硫氧还蛋白还原酶共价结合才能起到较优的抑制活性,因此发挥高选择性。
实验方法:将荧光探针cur-fy与硫氧还蛋白还原酶及小分子如氨基酸类(lys、leu、arg、val、met、pro等);常见小分子如还原型谷胱甘肽(gsh)、氧化型谷胱甘肽(gssg);蛋白类如微管蛋白等孵育后,检测其荧光发射情况,以440nm为激发波长,540nm为发射波长,测试各组的荧光强度。
实施例8.荧光分子cur-fy在细胞内对硫氧还蛋白还原酶的成像作用
由于荧光探针cur-fy具有聚集诱导发光的荧光特性,我们采用激光共聚焦显微镜观察了荧光探针cur-fy在细胞内对硫氧还蛋白还原酶的荧光成像作用。细胞模型选用人宫颈癌细胞株hela,我们将荧光探针(10μm)在hela细胞中孵育6h,用激光共聚焦显微镜检测成像效果,结果如图10所示。前面已证实荧光探针cur-fy能够与硫氧还蛋白还原酶共价结合,随着结合得越多,荧光会越强,我们观察到荧光探针cur-fy在hela细胞胞质内展示清晰的荧光,表明荧光探针能够对细胞能的硫氧还蛋白还原酶进行成像。同时,由于荧光探针分子结构中具有正电荷,因此具有靶向线粒体的功能。我们通过线粒体特异性指示探针mitotrackerred定位线粒体,荧光探针能够与线粒体探针mitotrackerred指示的线粒体位置较好的重叠,证明荧光探针在细胞中具有靶向线粒体的能力。
实验方法:收集对数期细胞,以每孔10万个细胞的密度接种于激光共聚焦实验专用皿中,5%co2,37℃孵育24min。用移液枪吸走旧培养基,加入新培养基,含荧光探针cur-fy终浓度为10μm,继续培养6h。孵育完后,除去含荧光探针的培养基,用pbs洗三遍细胞,再加入含mitotrackerred(0.2μm)的培养基,孵育30min。最后,用pbs洗三遍细胞,加入新pbs,于激光共聚焦显微镜观察并拍照。实验中激光共聚焦显微镜使用油镜,放大倍数为63倍,mitotrackerred激发波长为633nm,荧光分子cur-fy激发波长为488nm。
综上所述,本发明公开了一种靶向线粒体的硫氧还蛋白还原酶荧光探针及其制备方法和用途。该探针合成步骤短、产率高,可通过迈克尔加成反应共价结合到硫氧还蛋白还原酶上。通过该荧光探针对硫氧还蛋白还原酶的选择性检测,发现其选择性高,荧光成像效果好,因此可广泛应用于样品中硫氧还蛋白还原酶含量的检测。
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,对于本领域的普通技术人员来说,在上述说明及思路的基础上还可以做出其它不同形式的变化或变动,这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!