同型半胱氨酸荧光探针及其制备方法和用途与流程
本发明涉及同型半胱氨酸(hcy)荧光探针及其制备方法和用途,以实现同型半胱氨酸(hcy)荧光探针高选择性检测含有氨基酸、阴离子、金属阳离子和活性氧的复杂溶液中的同型半胱氨酸(hcy),具有选择性专一、灵敏度高、检测限低的优点。
背景技术:
半胱氨酸(cys)、同型半胱氨酸(hcy)及谷胱甘肽(gsh)普遍存在于正常哺乳动物细胞内及细胞外流体中,其巯基基团的特性也被证明对哺乳动物,植物,甚至各种微观的生命形式有益。半胱氨酸(cys)在蛋白质构建与代谢过程中作为重要的必需氨基酸与机体健康密不可分,同时也是谷胱甘肽(gsh)的前体,此外,它还参与细胞内氧化还原稳态的调节,并可作为酶及其他辅助因子的活性位点。同型半胱氨酸(hcy)的重要性源自其再甲基化与转硫化的代谢途径中,尽管它是一种非蛋白氨基酸,但其含量的异常也是致使诸多疾病的危险因素。作为细胞内最丰富的游离硫醇,谷胱甘肽(gsh)在细胞内也承担多种功能,例如细胞内信号传导,缓解氧化还原气氛和参与多种代谢过程等。随着健康科学的深入,细胞内生物硫醇的研究价值也逐渐突显。因此,也就需要开发新型有效的检测工具,来对相应硫醇实施传感与分析。
在报道的多种检测方法中,荧光探针由于其简便性和灵敏性而极具有吸引力。由于半胱氨酸(cys)、同型半胱氨酸(hcy)和谷胱甘肽(gsh)的结构与化学性质非常相似,能够专一响应半胱氨酸(cys)、同型半胱氨酸(hcy)或谷胱甘肽(gsh)的荧光探针还为数不多,因此开发一种能够专一响应同型半胱氨酸(hcy)的荧光探针是当下需要的。
技术实现要素:
本发明旨在提供一种同型半胱氨酸(hcy)荧光探针及其制备方法和用途,所要解决的技术问题是通过分子设计得到一种可以专一响应同型半胱氨酸荧光探针的结构,以实现在含有氨基酸、阴离子、金属阳离子和活性氧的复杂溶液中专一响应同型半胱氨酸,具有选择性专一、灵敏度高、检测限低的优点。
本发明同型半胱氨酸荧光探针,是以咔唑为母体,其结构式为如下结构中的一种:
本发明同型半胱氨酸荧光探针的制备方法,包括如下步骤:
步骤1:将3-溴咔唑(19.20g,78mmol),研磨后的氢氧化钾(21.88g,390mmol)与丙酮(380ml)在30℃下混合加热并搅拌4个小时,再向其中加入溴乙烷(16.99g,156mmol)并继续搅拌反应6小时;反应结束后过滤,旋蒸后制样,使用柱色谱提纯(石油醚:二氯甲烷=100:1),得到中间体1,18.18g,产率为85%。
步骤2:在冰水浴的条件下将中间体1(18.09g,66mmol)以及三氯化铝(22.67g,170mmol)溶解于二氯甲烷(75ml)中并充分搅拌,再加入乙酸酐(8.17g,80mmol)并继续在冰水浴下搅拌反应12个小时;反应完成后水洗,干燥处理后制样,使用柱色谱提纯(石油醚:二氯甲烷=10:1),得到白色固体中间体2,7.93g,产率为38%。
步骤3:在施莱克瓶中加入中间体2(7.90g,25mmol),二(三苯基膦)二氯化钯(0.70g,1mmol),碘化亚铜(0.38g,2mmol),再在氩气保护条件下注入n,n-二甲基甲酰胺(45ml),三乙胺(10ml)和4-氟苯乙炔(3.60g,30mmol),并于110℃下搅拌反应24小时;反应结束后减压蒸馏除去溶剂,水洗后制样,用柱色谱提纯(石油醚:二氯甲烷=2:1),得到中间体3,1.78g,产率为20%。
步骤4:将中间体3(0.44g,1mmol),叔丁醇钾(0.11g,1mmol)溶解于四氢呋喃(6ml)中并搅拌10分钟,再加入吡啶甲醛(0.11g,1mmol),在40℃下反应12个小时;反应完成后旋干反应液,水洗后制样,用柱色谱提纯(石油醚:乙酸乙酯=1:1),得到目标产物0.21g,产率为46%。
步骤4中,所述吡啶甲醛为4-吡啶甲醛、3-吡啶甲醛或2-吡啶甲醛。
本发明同型半胱氨酸荧光探针的合成过程如下:
本发明同型半胱氨酸荧光探针的用途,是在含有氨基酸、阴离子、金属阳离子和活性氧的复杂溶液中作为检测同型半胱氨酸(hcy)使用。检测方法如下:
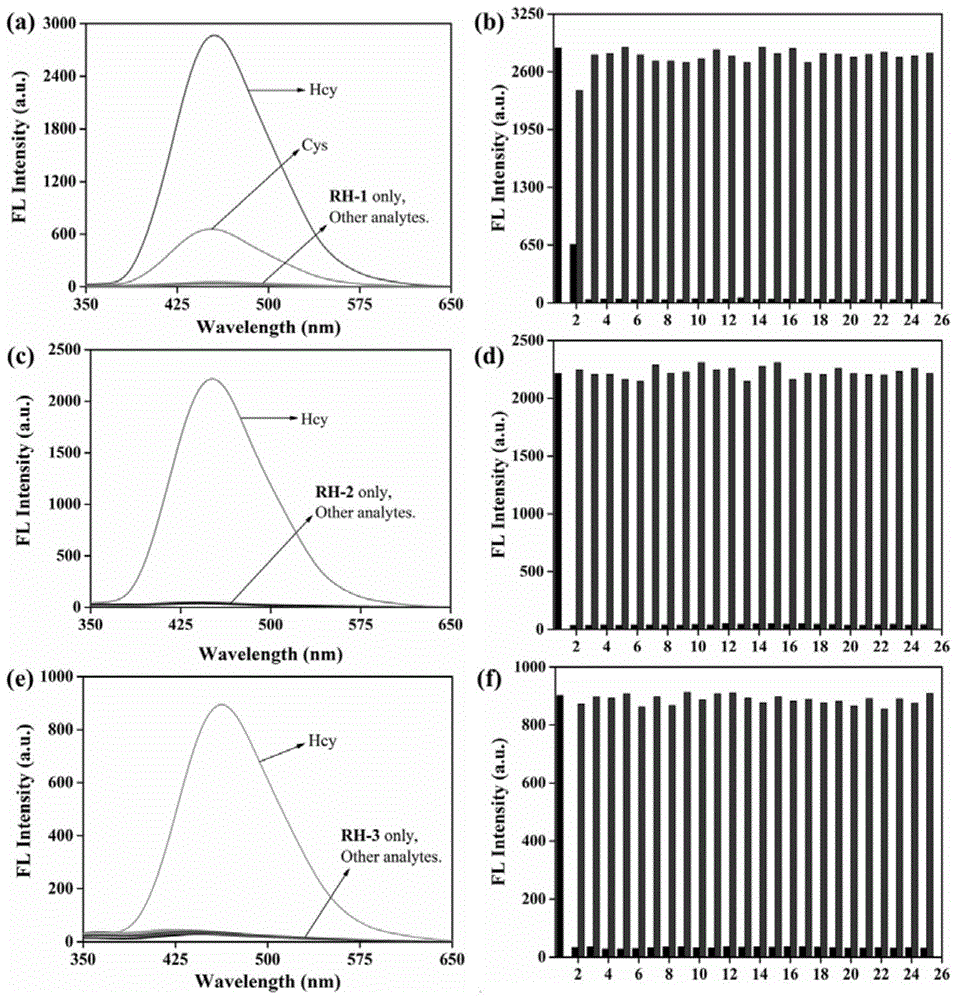
将本发明双光子荧光探针溶于dmso中制得2mm的母液,各取15μl母液于3ml的溶剂中,分别获得探针rh-1、rh-2、rh-3在溶液中的紫外谱图。专一性的荧光响应性能是引入各种氨基酸,各种离子,活性氧与活性氮分子来分别测试rh-1、rh-2和rh-3的识别性能。rh-1表现出对hcy最明显的荧光响应,但cys也引起了一定的荧光增强。rh-2和rh-3也相同地呈现出对hcy的最大荧光增强信号,但却并没有产生对cys和gsh的荧光响应。实验中其他底物的加入与空白组相当,即表明三种探针均具有选择性识别性能。此外,在进一步的干扰分析实验中,我们研究了各种底物的存在是否会影响探针对hcy的传感性能。rh-1对hcy的响应仅受到cys的干扰,而对于rh-2和rh-3,所加分析物对hcy的荧光干扰几乎可以忽略。上述实验即说明三种探针均可作为hcy的选择性检测工具,其中rh-2和rh-3可区分cys和hcy。在357nm波长激发下,其在456nm处的荧光强度随着测试体系极性的增大逐渐增强,并且rh-1、rh-2、rh-3的检测限分别为17nm、18nm、20nm,这表明探针可用于低浓度hcy溶液的检测。测量465nm处的荧光光谱为了探究探针rh-1、rh-2、rh-3的光学的稳定性。在不加入hcy的情况下,三种探针本身无明显荧光,向体系中分别加入20μm、50μm和100μm的hcy后,可观察到荧光强度逐渐提升,在60min后可达至响应平衡。另外,延长测试时间至180min,其响应hcy后的荧光强度并未衰减或继续增强,表明三种探针适合于对hcy的长时间检测。使用hcl溶液和naoh溶液来调节ph,制备了范围从3至11的测试液。三种探针本身不受ph的影响。rh-1在所测ph范围内均可产生对hcy良好的荧光响应,且荧光强度在ph为4-5.5的范围内维持平稳。rh-2与rh-3也具有相似结果,响应hcy后的荧光强度在ph为3-5.5的范围内保持稳定。表明三种探针在酸至碱性的条件下均可作为hcy的检测工具。
本发明可以用于检测hcy的原理是利用探针结构中吡啶旁边的双键可以和hcy上的巯基发生迈克尔加成反应。当探针与硫醇分子发生加成反应后,该体系中由羰基-双键-吡啶形成的a-π-a的共轭结构会被破坏,同时使另一侧的对氟苯基-乙炔基-咔唑形成的a-π-d的推拉效应恢复,出现荧光打开(turn-on)的荧光信号(以rh-2为例)。
本发明同型半胱氨酸荧光探针分子在与其他干扰因素共存的体系中,表现出对hcy的专一性响应。荧光强度测试rh-1、rh-2和rh-3对hcy的响应时间表明三种探针适合于对hcy的长时间检测。rh-1、rh-2和rh-3的检测限表明探针可以检测低浓度的hcy。ph稳定性测试结果表明三种探针在酸至碱性的条件下均可作为hcy的检测工具。
附图说明
图1是探针(10μm)rh-1(a,b)、rh-2(c,d)、rh-3(e,f)在不同氨基酸(hcy,cys,gsh,leu,tyr,asp,met,phe,his,ser,pro,trp,thr,val,hyp,ala;100μm)、阴离子(so32-,s2o32-,so42-,ch3coo-;100μm)、金属阳离子(ca2+,zn2+,cu2+,mn2+,mg2+;100μm)、活性氧(clo-,h2o2;50μm)在dmso/pbs(8:2,v:v)溶液中的荧光发射光谱图和荧光强度图。
图2是探针(10μm)rh-1(a,b)、rh-2(c,d)、rh-3(e,f)在dmso/pbs(8:2,v:v)溶液中的hcy紫外滴定和荧光滴定光谱图。
图3是探针探针(10μm)rh-1(a)、rh-2(b)、rh-3(c)对hcy(20,50,100μm)响应的荧光强度(i456nm)时间图。
图4是rh-1(a)、rh-2(b)、rh-3(c)荧光强度与hcy浓度(0~10μm)的关系。
图5是探针的ph干扰测试图。rh-1(a)、rh-2(b)、rh-3(c)的在不同ph值下对hcy的荧光强度。
图6是rh-1(a)、rh-1-hcy(b)、rh-2(c)、rh-2-hcy(d)、rh-3(e)、rh-3-hcy(f)的esi-ms质谱验证。
具体实施方式
下面通过实施例对本发明做进一步说明。
实施例1:荧光探针分子rh-1,rh-2,rh-3的合成
将化合物1-(9-乙基-6-(((4-氟苯基)乙炔基)-9h-咔唑-3-基)乙-1-酮(0.44g,1mmol),叔丁醇钾(0.11g,1mmol)溶解于四氢呋喃(6ml)中并搅拌10分钟,再加入4-吡啶甲醛/3-吡啶甲醛/2-吡啶甲醛(0.11g,1mmol),在40℃下反应12个小时。反应完成后旋干反应液,水洗后制样,用柱色谱提纯(石油醚:乙酸乙酯=1:1)得到黄色固体0.21g,产率为46%。
rh-1:1hnmr(400mhz,cdcl3,ppm)δ8.79(s,1h),8.71(s,2h),8.36(s,1h),8.24(d,j=8.4hz,1h),7.88(d,j=15.7hz,1h),7.75(d,j=15.7hz,1h),7.68(d,j=8.4hz,1h),7.53(s,4h),7.46(d,j=8.5hz,1h),7.41(d,j=8.2hz,1h),7.06(t,j=8.1hz,2h),4.39(d,j=6.9hz,2h),1.48(t,j=6.7hz,3h).13cnmr(151mhz,dmso-d6,ppm)δ187.53,150.31,142.90,142.14,139.98,133.38,129.62,129.04,126.96,126.62,124.30,123.38,122.89,122.43,121.58,119.28,116.10,115.88,113.35,110.34,109.88,90.22,86.80,37.55,13.79.esi-msm/z:calcd.forc30h22fn2o+{[rh-1+h]+}445.1716,found,445.1694.
rh-2:1hnmr(400mhz,dmso-d6,ppm)δ9.30(d,j=1.3hz,1h),9.12(d,j=1.9hz,1h),8.65(m,2h),8.41(d,1h),8.32(m,2h),7.84(d,j=8.0hz,1h),7.82–7.74(m,2h),7.71(m,1h),7.65(m,2h),7.54(m,1h),7.31(t,j=8.9hz,2h),4.55(q,j=6.9hz,2h),1.37(t,j=7.1hz,3h).13cnmr(151mhz,dmso-d6,ppm)δ187.43,150.76,150.08,142.81,140.06,139.36,135.08,133.38,130.81,129.59,129.23,126.93,124.18,123.87,123.23,122.91,121.57,119.29,116.10,115.88,113.30,110.32,109.83,90.25,86.78,37.54,13.79.esi-msm/z:calcd.forc30h22fn2o+{[rh-2+h]+}445.1716,found,445.1740.
rh-3:1hnmr(400mhz,cdcl3,ppm)δ8.93(s,1h),8.75(d,j=4.3hz,1h),8.36(m,3h),7.85(d,j=15.2hz,1h),7.78(t,j=7.6hz,1h),7.68(d,j=8.4hz,1h),7.61–7.50(m,3h),7.48(d,j=8.7hz,1h),7.42(d,j=8.5hz,1h),7.36–7.30(m,1h),7.07(t,j=8.6hz,2h),4.42(q,j=7.1hz,2h),1.49(t,j=7.2hz,3h).13cnmr(151mhz,dmso-d6,ppm)δ188.05,153.24,149.95,142.83,142.12,140.07,137.10,133.38,129.60,129.31,126.91,125.60,124.56,123.11,122.88,121.65,119.33,116.09,115.87,113.32,110.24,109.82,90.32,86.72,37.53,13.77.esi-msm/z:calcd.forc30h22fn2o+{[rh-3+h]+}445.1716,found,445.1723.
实施例2:荧光探针分子的选择性与竞争性比较测试
将本发明荧光探针rh-1,rh-2,rh-3溶于dmso中制得2mm的母液,各取15μl母液于3ml测试溶剂中得到10μm测试液。引入各种氨基酸,各种离子,活性氧与活性氮分子来分别测试rh-1,rh-2和rh-3的识别性能。如图1所示,在选择性测试中,rh-1表现出对hcy最明显的荧光响应,但cys也引起了一定的荧光增强。rh-2和rh-3也相同地呈现出对hcy的最大荧光增强信号,但却并没有产生对cys和gsh的荧光响应(图1c,1e)。实验中其他底物的加入与空白组相当,即表明三种探针均具有选择性识别性能。此外,在进一步的干扰分析实验中,rh-1对hcy的响应仅受到cys的干扰(图1b),而对于rh-2和rh-3,所加分析物对hcy的荧光干扰几乎可以忽略(图1d,1f)。即表明三种探针均可作为hcy的选择性检测工具,其中rh-2和rh-3可区分cys和hcy。
实施例3:荧光探针分子的紫外与荧光滴定测试
测试浓度梯度的hcy对探针紫外吸收性质的影响(图2a,2c,2e)。随hcy浓度的提高(0-110μm),光谱显示在380nm处的吸收均降低,而340nm处的吸收增高,并均在357nm处出现等吸收点,可归因为hcy与探针反应生成了新化合物。实验中当hcy达到10倍当量时(100μm),紫外吸收曲线基本不再变化,表明到达滴定终点。荧光滴定测试以等吸收点357nm为激发波长,分别记录三个探针对hcy的荧光响应。如图2b,2d,2f所示,随hcy浓度的提升(0-110μm),探针在456nm处均显示荧光增强。当hcy达到10倍当量后(100μm),荧光曲线趋于稳定,即表明对hcy达到了饱和滴定当量。滴定实验证明rh-1,rh-2和rh-3均可对hcy产生开启型荧光信号。
实施例4:荧光探针分子的响应时间测试
记录在456nm处的荧光强度来分别测试rh-1,rh-2和rh-3对hcy的响应时间。在不加入hcy的情况下,三种探针本身无明显荧光。如图3所示,向体系中分别加入20μm,50μm和100μm的hcy后,可观察到荧光强度逐渐提升,在60min后可达至响应平衡。另外,延长测试时间至180min,其响应hcy后的荧光强度并未衰减或继续增强,即表明三种探针适合于对hcy的长时间检测。
实施例5:荧光探针分子的检测限测试
为了选用足够灵敏的探针,分别测试rh-1,rh-2和rh-3的检测限。如图4所示,探针响应hcy后的荧光强度与其浓度(0-10μm)符合线性关系,拟合方程为:y=17.3358x+19.9946(rh-1),y=16.3492x+25.5235(rh-2),y=15.3525x+33.7053(rh-3)。根据3σ/k可计算出检测限分别为17nm,18nm,20nm。即表明三种探针的检测限满足细胞内检测hcy的要求。
实施例6:荧光探针分子的ph稳定性测试
为了探究探针在溶液中的ph稳定性,这里使用hcl溶液和naoh溶液来调节ph,制备了范围从3至11的测试液。如图5所示,三种探针本身不受ph的影响。rh-1在所测ph范围内均可产生对hcy良好的荧光响应,且荧光强度在ph为4-5.5的范围内维持平稳。rh-2与rh-3也具有相似结果,响应hcy后的荧光强度在ph为3-5.5的范围内保持稳定。上述测试结果表明三种探针在酸至碱性的条件下均可作为hcy的检测工具。
实施例7:荧光探针分子的响应机理验证
这里,我们进行了rh-1,rh-2和rh-3对hcy响应的质谱验证(图6)。三种探针本身呈现对应于[rh+h]+质荷比分别为445.1694,445.1740和445.1723的峰。在向三种体系中加入过量hcy后,分别出现了新的质荷比为580.2162,580.2072和580.2173的峰。该质谱验证结果均符合预期产物[rh-hcy+h]+的理论值580.2065。
- 还没有人留言评论。精彩留言会获得点赞!