基于Halo-tag特异性脱卤反应的蛋白质一步定向固定化方法与流程
本发明涉及一种蛋白质固定化方法,具体涉及一种基于卤代烷烃脱卤素酶(halo-tag)特异性脱卤反应的蛋白质一步定向固定化方法,属于蛋白质固定技术领域。
背景技术:
目前,文献报道的蛋白质固定化方法可分为:物理吸附法、化学键合法和基于特异性标签亲和作用的固定化方法。在上述三种方法中:
(1)物理吸附法就是通过非特异性吸附作用将蛋白质固定在固体基质表面。虽然该方法在蛋白质的固定化过程中操作最为简便,但是由于该方法是通过非特异性吸附作用将蛋白质固定于固体材料表面,对于目的蛋白质的选择性较低,在进行固定化时,首先需对目的蛋白质进行纯化,因此往往造成蛋白质固定化方法操作周期长、操作冗杂的不足。
(2)化学键合法就是通过与蛋白质表面暴露出的氨基、羧基、巯基等发生化学反应,进而将蛋白质固定于载体表面。该方法同样需要大量高纯度的蛋白质,并且固定化后蛋白质的活性位点易于被掩盖,蛋白质活性损失大。
(3)基于特异性标签亲和作用的固定化方法就是将常用蛋白质标签(如组氨酸标签、谷胱甘肽转移酶标签、麦芽糖结合蛋白标签、链霉亲和素标签等)重组在目的蛋白质的非活性末端,通过利用上述蛋白质标签与其配基之间的特异性亲和作用,从而实现目标蛋白质的固定化。该方法需要对目标蛋白质进行分离纯化,且单一标签难以实现目的蛋白的精细分离,往往需要配合离子交换色谱或尺寸排阻色谱进行进一步分离。
众所周知,蛋白质的固定化过程应具备以下几个特点:
1、特异性强,即尽可能减弱非特异性吸附作用,排除杂质蛋白的干扰;
2、尽量简化蛋白质的纯化过程,保证蛋白质损失少;
3、固定化蛋白质的方法应可靠、可控并可重复;
4、尽量将蛋白质的活性位点暴露出来,以达到增加结合的药物分子数量的目的。
因此,开发一种新型蛋白质固定化方法至关重要。
卤代烷烃脱卤素酶(halo-tag)是由微生物紫红红球菌的脱卤素酶演化而来,该酶在催化脱卤反应中,酶活性位点asp106亲核取代卤代烷烃中的卤素基团生成asp酯,形成共价烷烃酶中间体。酶中his272可催化该中间体水解,再生脱卤素酶,生成脂肪醇。如将his272定点突变为phe等,共价烷烃-酶中间体则不发生水解。目前,已有大量研究表明halo-tag可在蛋白质分离纯化过程中定向捕获目标蛋白,因此可作为一种理想蛋白标签融合表达至目标蛋白的非活性c-末端或n-末端。
g蛋白偶联受体(gpcrs)是一大类跨膜蛋白质的统称,在已上市的国际市场药物销售领域,销量最好的前50种药物中,有20%是以gpcrs为药物作用靶点,通过与其结合,进而启动级联式信号传导通路,发挥药效。
技术实现要素:
本发明的目的在于提供一种基于halo-tag特异性脱卤反应的蛋白质一步定向固定化方法,该方法可有效解决目前的蛋白质固定化方法存在的特异性低和周期长的问题。
为了实现上述目标,本发明采用如下的技术方案:
一种基于halo-tag特异性脱卤反应的蛋白质一步定向固定化方法,其特征在于,包括以下步骤:
step1:卤代烷酸修饰分离介质
将卤代烷酸修饰至分离介质表面,获得卤代烷酸修饰的分离介质;
step2:halo-tag融合蛋白质的一步定向固定化
将step1获得的卤代烷酸修饰的分离介质与细胞裂解液中表达的halo-tag融合蛋白质在ph=7.0、浓度为5mm的乙酸铵溶液中孵育15min。
前述的基于halo-tag特异性脱卤反应的蛋白质一步定向固定化方法,其特征在于,在step1中,前述卤代烷酸为:6-氯己酸、6-溴己酸、6-氟己酸、6-碘己酸或上述卤素的所有饱和酸;前述分离介质为:羟基化、氨基化、巯基化或羧基化修饰的树脂微球或多孔微球。
前述的基于halo-tag特异性脱卤反应的蛋白质一步定向固定化方法,其特征在于,在step1中,前述卤代烷酸为6-氯己酸,前述分离介质为氨基化多孔微球,将6-氯己酸修饰至氨基化多孔微球表面的方法具体如下:
将6-氯己酸、氨基化多孔微球和二异丙基乙胺溶于dmf中,然后加入hatu,室温搅拌2h。
前述的基于halo-tag特异性脱卤反应的蛋白质一步定向固定化方法,其特征在于,在step2中,前述蛋白质为gpcrs,前述gpcrs包括:视紫红质样受体、分泌素受体家族、代谢型谷氨酸受体、真菌交配信息素受体、环腺苷酸受体和frizzled/smoothened家族所有成员,其中,视紫红质样受体又包括:β2-肾上腺素受体和血管紧张素ii受体i型受体。
本发明的有益之处在于:
本发明提供的基于halo-tag特异性脱卤反应的蛋白质一步定向固定化方法,将halo-tag基因重组至目标受体蛋白(例如:gpcrs)非活性c末端,通过酰化反应将卤代烷酸修饰至分离介质表面,诱导表达后利用重组受体c末端脱卤素酶与分离介质表面卤代烷的特异性脱卤反应,实现了细胞裂解液中halo-tag重组受体的一步定向共价固定化,建立了蛋白质一步定向固定化新方法,由于通过细胞裂解液即可实现蛋白质的一步高特异性固定,所以有效解决了蛋白质固定化周期长及蛋白质固定化方法特异性低的问题。
附图说明
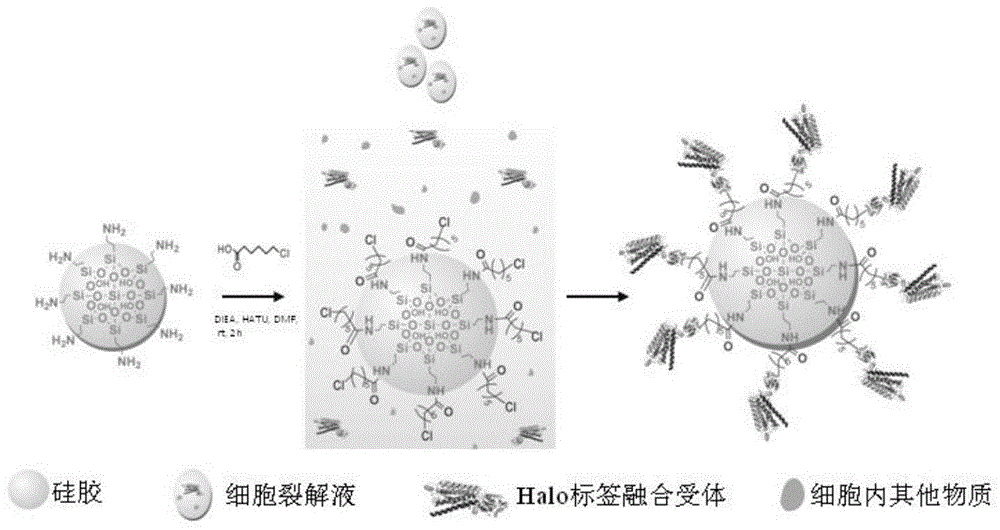
图1是halo-tag融合gpcrs的一步固定化反应路线图;
图2是固定化his-tag融合β2-ar微球的免疫扫描电镜图;
图3是固定化halo-tag融合β2-ar微球的免疫扫描电镜图;
图4是缬沙坦在固定化at1r色谱模型上的表征行为图;
图5是坎地沙坦在固定化at1r色谱模型上的表征行为图。
具体实施方式
以下结合附图和具体实施例对本发明作具体的介绍。
实施例1
参照图1,本发明提供的基于halo-tag特异性脱卤反应的蛋白质一步定向固定化方法,具体包括如下步骤:
step1:卤代烷酸修饰分离介质
卤代烷酸可以选用:6-氯己酸、6-溴己酸、6-氟己酸、6-碘己酸以及上述卤素的所有饱和酸。
分离介质可以选用:羟基化、氨基化、巯基化、羧基化等功能基团修饰的树脂微球、多孔微球等。
在该实施例中,卤代烷酸选用的是6-氯己酸,分离介质选用的是氨基化多孔微球。
6-氯己酸修饰氨基化多孔微球的过程具体如下:
将6-氯己酸(1.2eq)、氨基化多孔微球(1.0eq)和二异丙基乙胺(3.0eq)溶于dmf(5ml)中,然后加入2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(hatu,1.2eq),室温搅拌2h,即可将6-氯己酸修饰至氨基化多孔微球表面,获得6-氯己酸修饰的微球。
step2:halo-tag融合蛋白质的一步定向固定化
蛋白质可以选用gpcrs,gpcrs包括:视紫红质样受体、分泌素受体家族、代谢型谷氨酸受体、真菌交配信息素受体、环腺苷酸受体和frizzled/smoothened家族所有成员,其中,视紫红质样受体又包括:β2-肾上腺素受体(β2-ar)和血管紧张素ii受体i型受体(at1r)。
在该实施例中,蛋白质选用的是gpcrs中的β2-肾上腺素受体(β2-ar)。
细胞裂解液中halo-tag融合β2-ar的一步定向固定化过程具体如下:
将step1获得的6-氯己酸修饰的微球(1.0eq)与细胞裂解液中表达的halo-tag融合β2-ar(1.0eq)在ph=7.0、浓度为5mm的乙酸铵溶液中孵育15min,发生脱卤反应,实现β2-ar的一步定向固定化,得到固定化β2-ar微球。
实施例2
参照图1,本发明提供的基于halo-tag特异性脱卤反应的蛋白质一步定向固定化方法,具体包括如下步骤:
step1:卤代烷酸修饰分离介质
在该实施例中,卤代烷酸选用的是6-氯己酸,分离介质选用的是氨基化多孔微球。
6-氯己酸修饰氨基化多孔微球的过程具体如下:
将6-氯己酸(1.2eq)、氨基化多孔微球(1.0eq)和二异丙基乙胺(3.0eq)溶于dmf(5ml)中,然后加入hatu(1.2eq),室温搅拌2小时,即可将6-氯己酸修饰至氨基化多孔微球表面,获得6-氯己酸修饰的微球。
step2:halo-tag融合蛋白质的一步定向固定化
在该实施例中,蛋白质选用的是gpcrs中的血管紧张素ii受体i型受体(at1r)。
细胞裂解液中halo-tag融合at1r的一步定向固定化过程具体如下:
将step1所得6-氯己酸修饰的微球(1.0eq)与细胞裂解液中表达的halo-tag融合at1r(1.0eq)在ph=7.0、浓度为5mm的乙酸铵溶液中孵育15min,发生脱卤反应,实现at1r的一步定向固定化,得到固定化at1r微球。
采用免疫扫描电子显微镜技术对实施例1得到的固定化β2-ar微球进行检测。检测方法具体如下:
取实施例1得到的固定化β2-ar微球50mg置于离心管中,置换溶液体系为1×tbst缓冲溶液,向上述离心管中加入含有5%脱脂奶粉的封闭液500μl,室温孵育1h,100μl1×tbst缓冲溶液洗涤3次,离心除去上清液,得到封闭后的固定化β2-ar微球,按照1:200的稀释比例用1×tbst缓冲溶液稀释获得β2-ar抗体溶液,4℃条件下将上述封闭后的固定化β2-ar微球与300μl的β2-ar抗体溶液孵育过夜,然后1×tbst缓冲溶液洗涤3次,离心去掉沉淀,得到抗体孵育后的固定化halo-tag融合β2-ar微球;
采用同样的方法,获得抗体孵育后的固定化his-tag融合β2-ar微球;
采用1×tbst缓冲溶液按照1:25的比例稀释山羊抗兔igg胶体金抗体,制备获得igg胶体金抗体溶液,分别向上述抗体孵育后的固定化halo-tag融合β2-ar微球和抗体孵育后的固定化his-tag融合β2-ar微球中加入250μl的igg胶体金溶液,室温孵育1h,1×tbst缓冲溶液洗涤3次,每次100μl,离心去除上清液,沉淀60℃干燥过夜,分别得到相应的微球;
采用免疫扫描电子显微镜技术对上述相应的微球进行测定。
免疫扫描电子显微镜的测定结果见图2和图3。
由图2和图3可以看出:图2中的微球(固定化his-tag融合β2-ar微球)表面光滑,而图3中的微球(固定化halo-tag融合β2-ar微球)表面附着有白色小点,该白色小点为igg胶体金抗体。
这证明了:本发明提供的固定化方法特异性强,无非特异性吸附作用,且经过固定化后受体仍具有特异性抗体识别活性。
以at1r特异性配体缬沙坦和坎地沙坦对实施例2得到的固定化at1r色谱模型进行表征。
表征结果见图4和图5。
由图4和图5可以看出:at1r特异性配体缬沙坦和坎地沙坦两种药物在固定化at1r微球的色谱柱上的色谱保留时间不相同,且差异较大。
这说明:经过固定化后,受体仍具有特异性配体识别功能。
此外,我们还借助实施例1和实施例2将本发明提供的固定化方法(简称halo-tag法)与传统的固定化方法(例如:随意固定化方法、化学键合法、特异性标签法)进行了对比,对比结果见表1。
表1蛋白质固定化方法比较
由表1可以看出:本发明提供的基于halo-tag的蛋白质一步定向固定化方法无需对目的蛋白质进行纯化即可实现目的蛋白质的快速定向固定,并且蛋白质固定化过程操作周期显著缩短。
综上,本发明提供的方法具有蛋白质固定化周期短和特异性强且无需对目的蛋白质进行纯化即可实现目的蛋白质的一步化快速固定等优点。
需要说明的是,上述实施例不以任何形式限制本发明,凡采用等同替换或等效变换的方式所获得的技术方案,均落在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种在鱼类生殖系细胞中特异性表达基因的3’UTR区序列及其应用的制造方法与工艺
- 一种氯霉素分子印迹聚合物的制备方法与制造工艺
- 含有与前列腺抗原特异性结合短肽的噬菌体及其应用的制造方法与工艺
- 一种多级肝靶向智能化纳米递药系统的制备方法和应用与制造工艺
- 体外检测肿瘤新生抗原特异性T细胞的方法、试剂盒以及肿瘤疫苗与制造工艺
- 双特异性T细胞活化性抗原结合分子的制造方法与工艺
- 一种特异性识别及灵敏检测人血清蛋白的荧光试剂合成方法及应用与制造工艺
- 运用核酸适配体与溶菌酶特异性识别并形成G四链体进行荧光显现潜指纹的方法与制造工艺
- 双芘修饰苝酰亚胺衍生物荧光探针及其合成方法和应用与制造工艺
- 一种脂质体疫苗制剂及其用途和生产IgG抗体的方法与制造工艺
- 与CD56分子特异性结合的多肽及其应用的制造方法与工艺
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 避免信号干扰的肌原纤维蛋白丝氨酸磷酸化水平的测定方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 活化人CD40的抗体和针对人PD‑L1的抗体的组合疗法的制造方法与工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺