幽门螺旋杆菌检测用核酸适配体与筛选检测方法及用途与流程
本发明属病原微生物检测技术领域,具体涉及一种可用于特异性检测幽门螺旋杆菌的核酸适配体,本发明还涉及用核酸适配体检测幽门螺旋杆菌的方法与用途。
背景技术:
大量研究表明,超过90%的十二指肠溃疡和80%的胃溃疡是由幽门螺旋杆菌感染引起的,可引起胃粘膜轻度慢性炎症,甚至胃、十二指肠溃疡、胃癌。自1983年胃镜活检标本成功分离培养以来,细菌学、基因组学、同位素示踪、病理学、血清学、分子生物学等多种诊断幽门螺杆菌感染的方法不断发展。但一般从标本采集的角度来看,可分为两类:侵入性和非侵入性。侵入性方法主要是指通过胃镜进行活检标本检查的方法,是目前消化疾病学科的一种常规方法,包括细菌的分离培养、直接涂片、快速脲酶试验、药敏试验等;非侵入性方法主要是指不用胃镜取活检标本诊断幽门螺旋杆菌感染的方法,包括抗体检测、抗原检测、尿素13c/14c呼气试验等。虽然这些方法对幽门螺杆菌的检测是有效的,但大多数都需要复杂的仪器和专业的操作人员,极大地限制了早期检测和预防健康造成的致命后果和经济损失。因此,开发一种简单、快速、高度特异性和实用的检测幽门螺杆菌的方法至关重要。
核酸适配体是通过体外筛选技术筛选的单链功能化核酸,selex是适配体的指数富集系统进化。其典型的三维结构和靶标特异性使其成为一种潜在的新型分子受体。与抗体相比,适配体具有分子量小、不具有免疫原性、稳定性好、易于合成、靶点广泛、特异性高、亲和力强等优点。基于这些优异的特性,适配体已成为免疫诊断、药理学、生物传感器、纳米材料等诸多领域的研究热点。特别是新型核酸药物的出现,使人们逐渐摆脱了传统药物的毒副作用,为人类诊断和治疗癌症等疾病提供了新的研究平台。
技术实现要素:
本发明的目的在于针对现有技术的不足,提供一种新的用于幽门螺旋杆菌快速检测的ssdna核酸适配体。
本发明的又一目的是提供用所述核酸适配体进行检测幽门螺旋杆菌的方法,用于幽门螺旋杆菌快速检测。
本发明的再一目的是提供上述单链dna核酸适配体的筛选方法与用途。
为实现上述发明目的,本发明提供如下技术方案:
本发明公开了一种用于幽门螺旋杆菌特异性检测的单链dna核酸适配体,所述核酸适配体的核苷酸序列如hpa-2中所示:
hpa-2:5’-aaggagcagcgtggaggttaccaggaggaccctattctcg
tgtatcgacgagatccagtgaccacgacgacacaccctaa-3’。
本发明所述的所述的用于幽门螺旋杆菌特异性检测的单链dna核酸适配体,进一步优选的技术方案是:对核酸适配体进行突变或改造,使其能用于幽门螺旋杆菌的检测。
本发明所述的所述的用于幽门螺旋杆菌特异性检测的单链dna核酸适配体,进一步优选的技术方案是:所述的突变或改造方法选自:改造、磷酸化、甲基化、氨基化、巯基化、同位素化修饰;或者添加生物素、地高辛、荧光物质、淬灭基团、纳米材料、聚乙二醇、肽段、蛋白、叶酸或酶标记以用于幽门螺旋杆菌的检测。
本发明所述的所述的用于幽门螺旋杆菌特异性检测的单链dna核酸适配体,进一步优选的技术方案:荧光标记的核酸适配体互补链长度在10%-25%之间。
本发明所述的所述的用于幽门螺旋杆菌特异性检测的单链dna核酸适配体,进一步优选的技术方案:荧光标记的核酸适配体互补链如下:
本发明设计了以上6个不同比例的互补序列,在5’端携带fam作为探针链。荧光(fam)和淬灭基团1(bhq1)结合于hpa-2的互补序列的5’端和一个适配体的3’端。将适配体和fam标记的互补序列在94℃退火后形成适配体复合物。在幽门螺旋杆菌缺失的情况下,适配体复合物中的fam和bhq1紧密结合,荧光猝灭。在幽门螺旋杆菌存在的情况下,fam标记的互补序列和适配体形成竞争性组合,适配体与幽门螺旋杆菌结合,fam和bhq1分离,互补序列的荧光被释放。幽门螺旋杆菌的检测是通过适配体探针的荧光变化来实现的。
本发明还公开了一种用以上技术方案所述的用于幽门螺旋杆菌特异性检测的单链dna核酸适配体进行幽门螺旋杆菌检测的方法:将待测样品与标记的核酸适配体混合后检测相应的数值,与空白比较并作出判断。
本发明所述的检测方法,其进一步优选的技术方案是:将标记了淬灭基团的核酸适配体与荧光标记的互补链固定在聚苯乙烯板,用于检测,待测样品加在含有核酸适配体板上后,混合,在波长为450-500nm的蓝光下检测,与空白比较并作出判断。优选的fam荧光素标签标记在核酸适配体互补序列的5’端,bhq1标签标记在核酸适配体序列的3’端。
本发明还公开了一种如以上技术方案所述的用于幽门螺旋杆菌特异性检测的单链dna核酸适配体的筛选方法,具体步骤如下:
(1)合成一个长度为80nt的初始文库和pcr所需引物;
(2)用10%变性聚丙烯酰胺凝胶dpage纯化所有寡核苷酸,用dna洗脱缓冲液从凝胶中提取,提取的dna文库通过乙醇沉淀进一步浓缩;
(3)将步骤(2)处理的文库用结合缓冲液浓度稀释为600pm,在95℃变性5分钟,立即冰浴10分钟;
(4)用200μl缓冲液洗幽门螺旋杆菌两次,然后100μl缓冲液重悬;
(5)将步骤(3)处理的文库取100μl加入步骤(4)重悬沉淀溶液混合,37℃以120rpm孵育60分钟;
(6)步骤(5)结合后,以5000g离心5分钟,去除未结合的ssdna,用结合缓冲液漂洗三次;悬浮液95℃孵育5min,置于冰上10min,
(7)步骤(6)漂洗后,用100μl水重悬,在95℃变性5分钟,立即冰浴10分钟,5000g离心10min,回收上清;
(8)用糖原为载体的冰乙醇将步骤(7)处理的溶液醇沉并干燥,加入超纯水重溶;
(9)将步骤(8)纯化得到的溶液作为模板进行pcr扩增;
(10)用冰乙醇将步骤(9)处理的溶液醇沉并干燥,加入超纯水重溶;
(11)将步骤(10)得到的pcr产物经2%琼脂糖凝胶电泳和bio-radgeldoctmez成像仪检测;
(12)将步骤(11)检测后的pcr扩增产物按步骤(10)进行醇沉;
(13)将步骤(12)得到的产物作为模板进行不对称pcr;
(14)重复步骤(3)至步骤(13)9轮,第九轮至步骤(11)时进行2%琼脂糖凝胶电泳检测,并进行高通量测序;
(15)将测序得到的序列进行聚类分析,合成出现拷贝数高的序列,并在5’端添加fam标签;
(16)将步骤(15)合成的9条序列用结合缓冲液稀释至100nm并与幽门螺旋杆菌结合,选出结合量较多的序列;
(17)将步骤(16)中亲和力较高的序列稀释为不同浓度,与相同浓度的幽门螺旋杆菌合进行亲和力分析;得到亲和力最高的一条序列hpa-2。
筛选得到亲和力最高的的序列hpa-2后,将序列hpa-2与大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌结合,再进行特异性分析。
本发明中适配体浓度测定中使用的仪器优选为超微量紫外分光光度计(q5000,美国)。适配体结合荧光强度检测实验的仪器为酶标仪。
与现有技术相比,本发明的有益效果是:
1、本发明提供了对幽门螺旋杆菌的亲和力高而对其他细菌的表观结合亲和力低的一条核酸适配体,能够快速的对幽门螺旋杆菌菌体细胞进行检测。
2、本发明核酸适配体对幽门螺旋杆菌菌体表面蛋白的亲和力达到19.3±3.2nm。本发明的核酸适配体能特异性与幽门螺旋杆菌结合,因此该核酸适配体针对幽门螺旋杆菌具有高特异性的特点,可用于对幽门螺旋杆菌的快速检测。
3、本发明公开的基于核酸适配体的检测幽门螺旋杆菌的方法,以核酸适配体修饰的淬灭基团作为识别探针,以核酸适配体互补链修饰的荧光作为荧光探针。幽门螺旋杆菌的检测是通过核酸适配体探针的荧光变化来实现的。
附图说明:
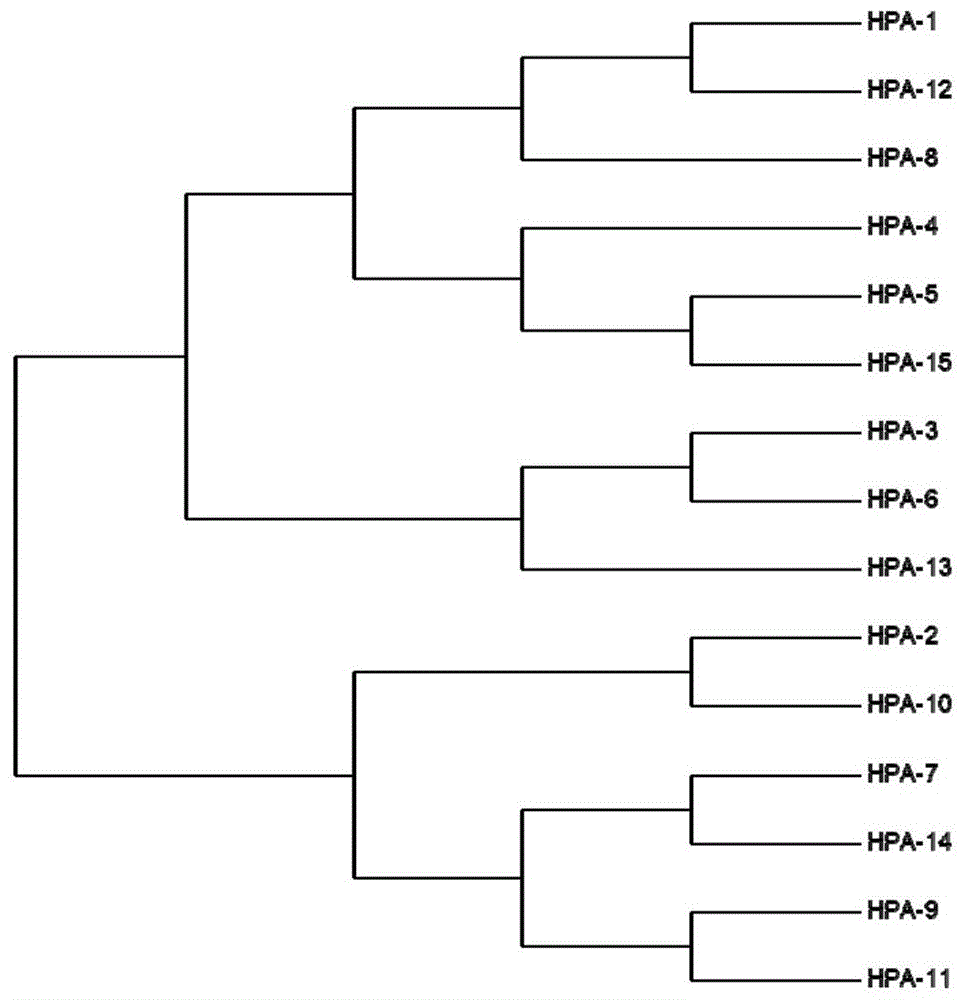
图1为本发明中筛选得到候选适配体序列的聚类分析图;
图2为本发明中筛选得到候选适配体与幽门螺旋杆菌结合量比较;
图3为本发明中筛选得到的核酸适配体hpa-2幽门螺旋杆菌结合亲和力;
图4为本发明中筛选得到核酸适配体hpa-2在3种对照菌中的特异性检测对比图;
图5为本发明中筛选得到的与幽门螺旋杆菌菌体细胞具有高特异性、高亲和力的核酸适配体hpa-2及互补序列chpa-2的二级结构预测图;
图6为本发明适配体快速检测的原理图;
图7为本发明中对设计的六条探针进行优化选择图;
图8为本发明中可视化快速检测幽门螺旋杆菌。
具体实施方式:
下面结合附图和具体实施方式,对发明的特异性识别幽门螺旋杆菌的核酸适配体的性质鉴定进行详细说明。
实施例1:ssdna文库的构建和引物的设计与合成
构建了长度为80nt,库容量1012-1024ssdna文库,由中间为40nt的随机序列两端为20nt的固定序列区组成,其核酸序列如下:5’-aaggagcagcgtggaggtta-n40-accacgacgacacaccctaa-3’,其中两端为固定序列,中间40个核苷酸为随机序列;
上游引物序列为5’-aaggagcagcgtggaggtta-3’;
下游引物序列为5’-ttagggtgtgtcgtcgtggt-3’。
ssdna文库及引物均由上海生工生物有限公司合成。
实施例2:基于selex技术幽门螺旋杆菌核酸适配体的筛选
(1)细菌培养及全细胞菌体制备
根据幽门螺旋杆菌(atcc®43504tm)产品说明书,幽门螺旋杆菌生长培养基由atcc®18培养基(胰蛋白酶豆汤)和atcc®260培养基(胰蛋白酶大豆琼脂,5%去纤维绵羊血)组成,幽门螺旋杆菌应在两相倾斜的肉汤和琼脂界面上3-4天内生长,生长条件:37℃,微量需氧(3-5%o2-10%co2)。其他对照菌根据其生长条件进行培养,直到培养物的光密度(od600)约为1。
(2)用10%变性聚丙烯酰胺凝胶(dpage)纯化所有寡核苷酸,用dna洗脱缓冲液(10mmtris-hcl,200mmnacl,1mmedta,ph7.5)从凝胶中提取,提取的dna文库通过乙醇沉淀进一步浓缩。
(3)将纯化后的ssdna文库用100μl结合缓冲液稀释,将该稀释液95℃变性5min后立即冰浴10min以保证dna呈单链状态;
(4)用2×结合缓冲液洗涤幽门螺旋杆菌菌体两次,并在室温下5000g离心5min,后用100μl2×结合缓冲液重悬;
(5)将步骤(3)变性处理后的dna与悬浮物混合,并置于dna混合仪上30℃孵育结合60min以形成菌体-ssdna复合物。
(6)结合后,将菌体-ssdna复合物5000g离心5min,去除未结合的ssdna。用2×结合缓冲液洗涤三次菌体-ssdna复合物,
(7)步骤(6)漂洗后,用100μl水重悬,在95℃变性5分钟,立即冰浴10min,5000g离心10min,回收上清;
(8)加入40μl超纯水将纯化的ssdna溶解并作为模板进行pcr扩增,50μl的pcr体系包括:2μl模板(终浓度为20~50ng/μl),各2μl10μm的引物,8μl10×pcr反应缓冲液(含有mgcl2),1.5μl10mm的dntp混合液,1μl5u/μltaqdna聚合酶,33.5μl超纯水。pcr扩增条件如下:95℃预变性5min,95℃变性30s,57.5℃退火30s,72℃延伸1min,以最优循环数为扩增轮数扩增,最终72℃延伸2min。
(9)所得pcr产物用2%琼脂糖凝胶电泳检测(120v,50min),geldoctmez凝胶成像系统分析扩增结果,所有pcr产物经乙醇沉淀纯化回收。
(10)将纯化后的ssdna用于下一轮筛选。
(11)在引入反筛选时先将文库与反筛菌株结合,后将没有结合上的上清作为正筛选文库与幽门螺旋杆菌进行孵育结合。
(12)在每一轮筛选中利用q5000微量分光光度计检测文库孵育前后的浓度变化,并以此计算dna的结合率(结合率=结合洗脱后dna量÷结合前dna量),按照结合率的趋势选择最后一轮pcr产物送上海生工进行高通量测序。
实施例3:核酸适配体性质鉴定
(1)序列结合能力分析
将测序得到的出现次数最多的15条序列用clustal软件进行聚类分析,选出每分组中出现次数最高的序列,在其5’端添加fam标签并分析结合能力。
(2)亲和力检测
为了进一步分析适配体对幽门螺旋杆菌的亲和能力,将不同浓度的候选适配体与相同浓度的幽门螺旋杆菌孵育结合,利用全波长多功能酶标仪进行荧光检测,以不含适配体的菌体作为对照,用sigmaplot12.5拟合得出kd值。
(3)特异性检测
将相同浓度的适配体分别于不同菌体孵育结合,利用全波长多功能酶标仪进行荧光检测。
(4)二级结构分析
为了更好地理解适配体与细菌之间的结合特异性,通过idtoligonanlyzer3.1在线分析系统对具有较高亲和力的适配体进行二级结构分析。
实施例4:幽门螺旋杆菌的快速检测
设计6个不同互补比例的互补序列:
图6展示了核酸适配体检测的原理。在互补序列的5’端标记荧光fam作为探针链。淬灭基团1(bhq1)标记在核酸适配体的3’端。将核酸适配体和fam标记的互补序列在94℃退火后形成核酸适配体复合物。在幽门螺旋杆菌缺失的情况下,核酸适配体复合物中的fam和bhq1紧密结合,荧光猝灭。在幽门螺旋杆菌存在的情况下,fam标记的互补序列和核酸适配体形成竞争性组合,核酸适配体与幽门螺旋杆菌结合,fam和bhq1分离,互补序列的荧光被释放。幽门螺旋杆菌的检测是通过核酸适配体探针的荧光变化来实现的。
将40μl核酸适配体复合物滴于聚苯乙烯板孔上,在50℃的烘箱中固定,形成无色透明固体膜,其在室温下放置在干燥的地方保藏。将40μl幽门螺旋杆菌菌悬液与空白对照分别加到孔中,37℃反应30min,在蓝光下(波长为450-500nm)检测,与空白对照判断结果。
核酸适配体性质鉴定:
聚类分析:
将测序得到的出现拷贝数最多的15条序列用clustal软件进行聚类分析,将相似性较高的序列排为一组,根据序列相似则结构与功能相近的原理,选出每分组中出现次数最高的序列,分别为hpa-1,hpa-2,hpa-3,hpa-4,hpa-5,hpa-7,hpa-8,hpa-9和hpa-13(参见图1)。
结合能力检测:
根据聚类分析结果,将hpa-1,hpa-2,hpa-3,hpa-4,hpa-5,hpa-7,hpa-8,hpa-9和hpa-13由sangon(shanghai,china)合成,并将fam标签固定在其5'
端。随后,我们分析了它们对幽门螺旋杆菌细胞的结合能力,hpa-2、hpa-3、
hpa-5和hpa-9对幽门螺旋杆菌细胞的结合能力高,结合能力顺序为hpa-2>hpa-3>hpa-5>hpa-9(参见图2)。
亲和力检测:
在相同条件下,不同浓度hpa-2(最终浓度分别为0、5、15、45、120、150、200nm)对幽门螺旋杆菌的结合亲和力,hpa-2在不同浓度下的亲和力用sigmaplot12.5拟合,结果表明,hpa-2对幽门螺旋杆菌具有良好的结合亲和力。因此,hpa-2作为幽门螺旋杆菌的最佳核酸适配体,该核酸适配体的动力学检测,最大解离常数(kd)为19.3±3.2nm(参见图3)。
特异性检测:
为了确定所选核酸适配体的特异性,对hpa-2进行了多种其他细菌的测试,包括金黄色葡萄球菌、枯草芽孢杆菌和大肠杆菌。幽门螺旋杆菌的荧光强度明显高于其他对照菌,说明所选择的核酸适配体具有良好的特异性(参见图4)。
二级结构检测:
由于常规pcr的使用,推测候选核酸适配体的互补序列也可能具有结合能力,因此我们也分析了这些互补序列对幽门螺旋杆菌的结合能力及其二级结构。结果表明,hpa-2和c-hpa-2对幽门螺旋杆菌细胞均有较高的结合能力。虽然二级结构显示这些dna序列都具有相似的结构,但c-hpa-2的结合能力远远低于hpa-2,hpa-2是识别幽门螺旋杆菌的理想的核酸适配体(参见图5)。
快速检测:
在六组实验中,目标菌的荧光强度明显高于其他菌,说明该检测方法检测幽门螺旋杆菌快速、灵敏。互补链探针在10%-25%都可以用于检测,其中探针4最灵敏(参见图7)。
加入幽门螺旋杆菌的检测板产生强烈的荧光信号,而仅加入反应缓冲液的则没有荧光信号,加入幽门螺旋杆菌荧光信号强度是加入缓冲液荧光信号的5倍(参见图8)。
序列表
<110>江苏海洋大学
<120>幽门螺旋杆菌检测用核酸适配体与筛选检测方法及用途
<160>7
<170>siposequencelisting1.0
<210>1
<211>80
<212>dna
<213>人工序列(2ambystomalateralexambystomajeffersonianum)
<400>1
aaggagcagcgtggaggttaccaggaggaccctattctcgtgtatcgacgagatccagtg60
accacgacgacacaccctaa80
<210>2
<211>26
<212>dna
<213>人工序列(2ambystomalateralexambystomajeffersonianum)
<400>2
ttagggtttttttttttttttttttt26
<210>3
<211>28
<212>dna
<213>人工序列(2ambystomalateralexambystomajeffersonianum)
<400>3
ttagggtgtttttttttttttttttttt28
<210>4
<211>30
<212>dna
<213>人工序列(2ambystomalateralexambystomajeffersonianum)
<400>4
ttagggtgtgtttttttttttttttttttt30
<210>5
<211>32
<212>dna
<213>人工序列(2ambystomalateralexambystomajeffersonianum)
<400>5
ttagggtgtgtctttttttttttttttttttt32
<210>6
<211>35
<212>dna
<213>人工序列(2ambystomalateralexambystomajeffersonianum)
<400>6
ttagggtgtgtcgtctttttttttttttttttttt35
<210>7
<211>40
<212>dna
<213>人工序列(2ambystomalateralexambystomajeffersonianum)
<400>7
ttagggtgtgtcgtcgtggttttttttttttttttttttt40
- 还没有人留言评论。精彩留言会获得点赞!
- 一种特异识别链霉素的核酸适配子及其在链霉素检测中的应用
- 用于识别结缔组织生长因子的核酸适配子及其应用
- 结合丁型肝炎病毒的核酸适配子及其应用
- 可适配的pci-e控制器核及其方法
- 一种心肌肌钙蛋白i核酸适配子及其应用、试剂盒的制作方法
- 一种与人表皮生长因子受体iii型突变体特异性结合的核酸适配子及其应用的制作方法
- 用于海产品中有机砷化物检测的基于核酸适配子的分子印迹膜电极的制备方法及应用的制作方法
- 基于核酸适配子的海产品中有机砷化物分子印迹膜基片及其制备方法和应用的制作方法
- 一种基于核酸适配子的海产品中有机砷化物分子印迹柱的制备方法及应用的制作方法
- 用于海产品中有机砷化物检测的基于核酸适配子的分子印迹膜电极的制作方法