一种血红素加氧酶基因及其在调控灵芝多糖生物合成中的作用的制作方法
cbs 质粒后混匀,电击转化。将转化完的原生质体加入cym上层培养基混匀后,倒入平板中,于28℃培养箱培养进行原生质体再生。
[0040]
(3)将cym平板上长出的菌落移入含有潮霉素抗性的平板中,经连续5次在不含有潮霉素的cym培养基上转接后培养,获得生长稳定的转化子。
[0041]
4.hmx1沉默菌株的筛选鉴定
[0042]
将步骤3中在潮霉素抗性平板上生长稳定的转化子,在cym培养基中连续转接5次培养后,收集菌丝提取rna,并反转录为cdna(具体方法参考takara试剂盒,货号 rr014a),用real-time-pcr检测hmx1基因的转录水平。
[0043]
5.real-time pcr具体操作及数值计算方法如下所示。
[0044]
(1)扩增体系:根据takara试剂盒(货号rr0036a)中的方法进行。
[0045]
(2)real-time pcr程序
[0046]
根据荧光定量pcr的原理,根据takara公司的real-time pcr扩增程序,对待测基因转录水平进行检测,基因扩增的特异性通过溶解曲线来检测。
[0047]
(3)real-time pcr数据处理
[0048]
根据real time pcr的原理,目标基因的相对表达量按2-δδct
公式来计算,表示实验组目的基因的表达相对于对照组的变化倍数。其中
△△
ct=
△
ct(实验组)
-△
ct(对照),
△
ct (实验组)为样品目的基因的ct值与同一样品的内参基因ct值的差值,
△
ct(对照)为对照组目的基因的ct值与内参基因ct值之差。
[0049]
结果如附图4所示,我们通过qrt-pcr筛选了两个沉默效率为91%和85%的沉默菌株,分别为hmx1i1和hmx1i2。
[0050]
实施例2:血红素加氧酶基因hmx1沉默后对灵芝血红素加氧酶活和一氧化碳含量的影响
[0051]
血红素加氧酶在动物和植物中研究的较为清楚,是一种诱导性蛋白,容易被外界刺激诱导它表达,多被报道有抗氧化和细胞保护作用。一氧化碳(co)是血红素加氧酶的重要产物,是一种气体信号分子,能够通过多种方式来响应外界刺激。
[0052]
在本专利中我们检测了hmx1沉默菌株中血红素加氧酶活性和co含量。
[0053]
血红素加氧酶酶活性的具体检测方法如下:
[0054]
(1)我们取在cym平板上生长7天的菌丝,用液氮研磨成粉,然后溶于含有 250mmol/l甘露醇,10%(v/v)甘油,1%(w/v)聚乙烯吡咯烷酮,1mmol/l edta,1mmol/l二硫苏糖醇的25mmol/l hepes-tris(ph=7.4)缓冲液中,震荡混匀,整个提取过程需在低温下操作:
[0055]
(2)匀浆在10000g离心10min,取上清液测定ho活性。总体积为80μl,含20μl上清液、10μmol/l血红素、0.15mg/ml牛血清蛋白、50μg/ml(4.2μmol/l)菠菜铁氧还蛋白、 0.025unit/ml菠菜铁氧还蛋白-nadp
+
还原酶、5mmol/l抗坏血酸和2mmol/l去铁氧胺和 100mm hepes-naoh(ph 7.2)。当nadph在最终浓度为100μmol/l时,反应开始;
[0056]
(3)在37℃下孵育30min,低温中止反应。测量650nm处的吸光值变化来计算胆绿素的生成,用bsa法测定上清液中的蛋白含量。
[0057]
co含量的检测方法具体如下:
[0058]
(1)我们取cym平板上生长7天的菌丝,用液氮研磨成粉,溶于1ml水中,3000g 离心
5min;
[0059]
(2)将0.1ml的上清与0.1ml的溶于0.24mol/l氨水的1mg/ml血红蛋白混合;
[0060]
(3)然后再加入0.02ml 0.2g/ml新制备的二硫酸钠溶液,待反应10min后测定420nm 和432nm处的吸光值。
[0061]
通过a420和a432的比值计算出co含量,空白对照管是用等量的水代替上清。
[0062]
结果如图5所示,我们检测了各菌株中的血红素加氧酶酶活和一氧化碳含量。沉默 hmx1基因,血红素加氧酶酶活和一氧化碳含量都有显著的降低。与野生型相比,hmx1i1 和hmx1i2菌株中的血红素加氧酶酶活分别降低了85%和43%(图5a)。与野生型相比,
[0063]
hmx1i1和hmx1i2菌株中的一氧化碳含量分别减少了20%和16%,与血红素加氧酶酶活的变化趋势是一致的。
[0064]
实施例3:血红素加氧酶基因hmx1沉默后对灵芝多糖生物合成的影响
[0065]
灵芝hmx1对灵芝多糖生物合成的重要作用
[0066]
在本专利中我们检测了hmx1沉默菌株中灵芝胞外多糖含量和胞内多糖含量。
[0067]
苯酚-硫酸法测定胞外多糖含量的方法具体如下:
[0068]
(1)选择pda平板中菌丝生长最外沿的菌丝块接种于液体pda中,150rpm,28℃培养7天。将制备好的液体菌种用匀浆机进行无菌打碎,按5%(v/v)的接种量接种于cym 液体培养基中,150rpm 28℃发酵7天。
[0069]
(2)取发酵后的培养物滤液0.5ml与4倍体积的95%乙醇混合,剧烈振荡,-20℃醇沉过夜,3000g离心10分钟,去上清,沉淀烘干,再取0.5ml 1m naoh溶解沉淀,60℃放置 1小时。
[0070]
(3)取0.5ml样品与0.5ml的5%(w/v,g/100ml)的苯酚混匀后,加3ml浓硫酸反应,室温静置30min后,在od490下进行测定。
[0071]
标准曲线的绘制:精确称取100mg预先在烘箱中烘干至恒重的分析纯葡萄糖,在容量瓶中定容到100ml,配置成1mg/ml的标准液,分别添加0,0.1,0.2,0.3,0.4,0.5ml的1mg/ml 标准液,绘制标准曲线。
[0072]
苯酚-硫酸法测定胞内多糖含量的方法如下:
[0073]
(1)选择pda平板中菌丝生长最外沿的菌丝块接种至液体pda中,150rpm,28℃培养7天。将制备好的液体菌种用匀浆机进行无菌打碎,按5%(v/v)的接种量接种于cym 液体培养基中,150rpm 28℃发酵7天,用水多次冲洗菌丝去除多糖后放入烘箱烘干至恒重。
[0074]
(2)取0.1g烘干的灵芝菌丝粉,用15ml 1m naoh溶解,混匀的悬浊液在65℃放置3 小时,间或摇匀,10000g离心10分钟。
[0075]
(3)取0.5ml上清与0.5ml的5%(w/v)的苯酚混匀后,加3ml浓硫酸反应,室温静置 30min后,在od490下进行测定。
[0076]
标准曲线的绘制:精确称取100mg预先在烘箱中烘干至恒重的分析纯葡萄糖,在容量瓶中定容到100ml,配置成1mg/ml的标准液,分别添加0,0.1,0.2,0.3,0.4,0.5ml的1mg/ml 标准液,绘制标准曲线。
[0077]
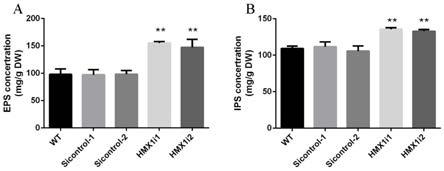
结果如图5所示,我们检测了各实验菌株中胞外多糖和胞内多糖的含量。在hmx1基因沉默后,灵芝胞外多糖和胞内多糖的含量均显著升高。两个hmx1沉默菌株中的胞外多糖含量对比野生型菌株的胞外多糖含量提高了59%和51%(图6a)。同时,与野生菌株相比,胞
内多糖含量分别提高了约24%和22%(图6b)。这些结果表明将hmx1基因沉默后能够显著提高灵芝多糖的含量,这一结果能为在生产实践中,通过基因工程手段提高灵芝多糖的生物合成量提供重要的理论基础。
[0078]
灵芝hmx1基因(seq id no.1)
[0079]
atgtccaccagcaagacttcaattgtagatgtcgacctcacacaaccaatcgctgtcatc cttcgcgaaggcactcatgcagcacacgaacgtgcagagcactccaagggcgcacaac agctcacccgtggcgagctcgatcgggaagaatacgtacgcttcctcatgatgctctgg cacgtctacgatgctttcgaacgtgccctcgaggagcacgccacccacccagtcctcgc cccgacgcataacccagggctcttcgcccgctccgccaacctggccgccgacatcagct acatcctcgaaatccccgagtcgtcctggcagtcccaccccatccacatcacgctgacg acggcagcgcagccgcccgcgctctcacgctacgtcgggcggatacaggaactcgctg ccagccgtgatcccgcacggcttctcgcacacgcgtacgtgcgctacctcggcgacctc tctggcgggcagttcatccggcgggccatctccaaggcgtacgacctcgaggtgggcgt tggcggactcagcttctttgacttccggaccttgtcaggagccgtgggccaggctgcga acgccggtgagatgaagcgaatcaaggagtggtaccgggagggcatgaacgcgggcgt tggggacgacacggagcttaaagctgccatcttggatgaagcgaacaccgcgtttgag ttcaacacggcgctctttgacgagctgaagccaccctcgaagcctaagtcgatcgctac cgcgactacagtcgaactgccttccccccttcactcgcccgtcgactctacgtcccctcc gtctactcccctcttggaagatatggggaactcgcctctgctcgcggcaatcaaggcgc aaggcggatcgaagacggtgtacgaggcggaagcggccccgtccacaacctattctgc aacatctgtcattgcgtttatcgtggccgtttcaatagcccactttgctctggtcgttggc gggttcaccggtgccaagggattcgccaaactcgagcttttcacccagtggctggacga tctcttcgcctctgctcctgcccacgcataa
[0080]
灵芝hmx1蛋白(seq id no.2)
[0081]
mstsktsivdvdltqpiavilregthaaheraehskgaqqltrgeldreeyvrflmmlwhv ydaferaleehathpvlapthnpglfarsanlaadisyileipesswqshpihitlttaaqppa lsryvgriqelaasrdparllahayvrylgdlsggqfirraiskaydlevgvgglsffdfrt lsgavgqaanagemkrikewyregmnagvgddtelkaaildeantafefntalfdelkpp skpksiatattvelpsplhspvdstsppstplledmgnspllaaikaqggsktvyeaeaapstt ysatsviafivavsiahfalvvggftgakgfaklelftqwlddlfasapaha*
[0082]
正向上游引物(seq id no.3):atcgactagtacatcacgctgacgacg
[0083]
反向上游引物(seq id no.4):atcgggtaccgaggggagtagacgga。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1