一种适用于免疫细胞培养的金针菇多糖/大豆蛋白复合凝胶及其制备方法和应用与流程
[0001]
本发明属于凝胶技术领域,具体涉及一种适用于免疫细胞培养的金针菇多糖/大豆蛋白复合凝胶及其制备方法和应用。
背景技术:
[0002]
在水溶液中,蛋白质和多糖之间的相互作用主要由带相反电荷的大分子之间的静电力(排斥力和吸引力)驱动,分别对应两大分子之间发生分离和缔合作用。由于外界条件(如ph和离子强度)的不同,蛋白质和多糖在水中混合可发生两种不同类型的相互作用:分离型相分离导致的热力学不相容性和结合型相分离导致的热力学相容性。当蛋白质和中性多糖之间没有结合相互作用或者多糖与蛋白质带有相似的电荷(阴离子多糖和蛋白质的ph>等电点(pi))时,分离状态占优势。另一方面,当两种生物大分子携带相反的电荷时,通常会发生由蛋白质和多糖之间的静电结合相互作用诱导的热力学相容性。这些相互作用发生在蛋白质的pi和多糖的pka之间。在这些条件下,根据制备条件,可以形成不同类型的结构,包括凝聚物,复合物和凝胶。蛋白和多糖的静电相互作用受到多种因素的影响,如盐离子浓度、蛋白和多糖所带电荷数、蛋白和多糖的比例。因此这些因素决定了相互作用的方式和强度。探究这些因素对蛋白和多糖的相互作用的影响可以更好的利用天然蛋白和多糖的功能开发。
[0003]
凝胶具有多孔性和良好的持水性,这些特点使得凝胶能够为细胞的培养提供良好的透气温润生长环境。针对这一点,近年来凝胶在医疗的应用和产品的开发得到飞速发展,例如凝胶创可贴的出现,就是利用凝胶的持水性搭载可治疗创伤的药物,同时凝胶还可以隔绝细菌与创口的接触,多孔温润的环境为细胞提供了多水透气的生长环境。但是现有的凝胶制备在原料和方法上存在成胶能力差,持水力弱,药物搭载率低等缺点。
技术实现要素:
[0004]
有鉴于此,本发明的目的在于提供一种适用于免疫细胞培养的金针菇多糖/大豆蛋白复合凝胶及其制备方法和应用,利用所述制备方法制备得到的金针菇多糖/大豆蛋白复合凝胶具有良好的持水性和结构的有序完整性,可将其应用于生物降解和细胞培养。
[0005]
为了实现上述发明目的,本发明提供以下技术方案:
[0006]
本发明提供了一种金针菇多糖/大豆蛋白复合凝胶的制备方法,包括以下步骤:(1)将大豆蛋白的水溶液和金针菇多糖的水溶液混合,调节ph值为4.5~6,添加nacl至浓度为10~15mmol/l,得多糖/蛋白质的混合溶液;所述多糖/蛋白质的混合溶液中大豆蛋白和金针菇多糖的质量比为10:1~15:1;
[0007]
(2)将所述多糖/蛋白质的混合溶液于85~90℃加热20~25min,得蛋白质/多糖热聚体;
[0008]
(3)将所述蛋白质/多糖热聚体与葡萄糖内酯混合、搅拌,流动水快速降温,冷却后
于4℃环境中静置8~12h,得所述金针菇多糖/大豆蛋白复合凝胶。
[0009]
优选的,步骤(1)中大豆蛋白的水溶液中大豆蛋白的质量体积浓度为8~10%;金针菇多糖的水溶液中的金针菇多糖的质量体积浓度为3~5%。
[0010]
优选的,步骤(1)中大豆蛋白的水溶液中大豆蛋白的质量体积浓度为8.5~9.5%;金针菇多糖的水溶液中的金针菇多糖的质量体积浓度为3.5~4.5%。
[0011]
优选的,步骤(1)中多糖/蛋白质的混合溶液中大豆蛋白和金针菇多糖的总质量体积浓度为6~8%。
[0012]
优选的,步骤(3)中葡萄糖内酯的质量为所述蛋白质/多糖热聚体质量的3~6%。
[0013]
优选的,步骤3)中所述搅拌为磁力搅拌,转速为200rpm,时间为1~2min。
[0014]
本发明还提供了利用上述制备方法制备得到的金针菇多糖/大豆蛋白复合凝胶。
[0015]
本发明还提供了上述金针菇多糖/大豆蛋白复合凝胶在制备持水性基材中的应用。
[0016]
本发明还提供了上述金针菇多糖/大豆蛋白复合凝胶在免疫细胞培养中的应用。
[0017]
本发明提供了一种金针菇多糖/大豆蛋白复合凝胶的制备方法,通过对金针菇多糖和大豆蛋白复合凝聚的质量比例、ph和氯化钠浓度的精准控制,将金针菇多糖和大豆蛋白溶液混合,通过葡萄糖内酯诱导制备出的金针菇多糖/大豆蛋白复合凝胶具备更好的持水性,更加完整有序的微观网络结构,更低的生物降解速率等特点。同时,本发明制备的金针菇多糖/大豆蛋白复合凝胶能提供温润多孔的培养外环境,适用于免疫细胞的生长和增殖。
附图说明
[0018]
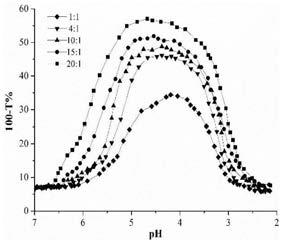
图1为金针菇多糖和大豆蛋白比例对多糖/蛋白质的混合溶液浊度曲线图;
[0019]
图2为多糖/蛋白质的混合溶液在不同离子强度下浊度曲线图;
[0020]
图3为ph值为7和6.5时制备的凝胶随金针菇多糖添加量的持水力变化图;
[0021]
图4为不同金针菇多糖添加量和ph下凝胶的x射线衍射图,其中a表征ph值为7时的x射线衍射图,b表征ph值为6.5时的x射线衍射图;
[0022]
图5为不同ph值和金针菇多糖添加量对复合凝胶的溶胀(a)和降解(b)的影响;
[0023]
图6为不同ph和金针菇多糖添加量下复合凝胶的细胞毒性。
具体实施方式
[0024]
本发明提供了一种金针菇多糖/大豆蛋白复合凝胶的制备方法,包括以下步骤:(1)将大豆蛋白的水溶液和金针菇多糖的水溶液混合,调节ph值为4.5~6,添加nacl至浓度为10~15mmol/l,得多糖/蛋白质的混合溶液;所述多糖/蛋白质的混合溶液中大豆蛋白和金针菇多糖的质量比为10:1~15:1;
[0025]
(2)将所述多糖/蛋白质的混合溶液于85~90℃加热20~25min,得蛋白质/多糖热聚体;
[0026]
(3)将所述蛋白质/多糖热聚体与葡萄糖内酯混合、搅拌,流动水快速降温,冷却后于4℃环境中静置8~12h,得所述金针菇多糖/大豆蛋白复合凝胶。
[0027]
本发明将大豆蛋白的水溶液和金针菇多糖的水溶液混合,调节ph值为4.5~6,添
加nacl至浓度为10~15mmol/l,得多糖/蛋白质的混合溶液;所述多糖/蛋白质的混合溶液中大豆蛋白和金针菇多糖的质量比为10:1~15:1。本发明将大豆蛋白的水溶液和金针菇多糖的水溶液混合,所述大豆蛋白的水溶液中大豆蛋白的质量体积浓度优选为8~10%,更优选为8.5~9.5%。本发明对所述大豆蛋白的水溶液的制备方法并没有特殊限定,优选将大豆蛋白与水混合后搅拌并静置,所述搅拌优选为磁力搅拌,所述搅拌的转速优选为900rpm;所述搅拌的时间优选为2.5~3h;所述静置优选为在3~5℃的环境中静置10~14h。
[0028]
本发明所述金针菇多糖的水溶液中的金针菇多糖的质量体积浓度优选为3~5%,更优选为3.5~4.5%。本发明对所述金针菇多糖的水溶液的制备方法并没有特殊限定,优选与上述大豆蛋白的水溶液的制备方法相同,在此不再赘述。
[0029]
在本发明中,多糖/蛋白质的混合溶液中大豆蛋白和金针菇多糖的总质量体积浓度优选为6~8%。
[0030]
得多糖/蛋白质的混合溶液后,本发明将所述多糖/蛋白质的混合溶液于85~90℃加热20~25min,得蛋白质/多糖热聚体。本发明对所述加热的方法并没有特殊限定。
[0031]
得蛋白质/多糖热聚体后,本发明将所述蛋白质/多糖热聚体与葡萄糖内酯混合、搅拌,流动水快速降温,冷却后于4℃环境中静置8~12h,得所述金针菇多糖/大豆蛋白复合凝胶。本发明所述葡萄糖内酯的质量优选为所述蛋白质/多糖热聚体质量的3~6%,更优选为3.5~5.5%。本发明所述搅拌优选为磁力搅拌,转速为200rpm,时间为1~2min。本发明实施例中,将经流动水快速降温,冷却后的物料于4℃冰箱中静置过夜,得所述金针菇多糖/大豆蛋白复合凝胶。
[0032]
本发明还提供了利用上述制备方法制备得到的金针菇多糖/大豆蛋白复合凝胶。本发明所述金针菇多糖/大豆蛋白复合凝胶的x-射线衍射图如图4所示,其中横坐标表示x-射线衍射的衍射角度,纵坐标表示凝胶的衍射峰的强度,在ph=6.5和7的x-射线衍射均表现出大豆蛋白的衍射峰型,其中在15
°
~25
°
之间强且宽度较大的衍射峰出现,主峰位于20
°
,在10
°
有宽度较窄且强度不大的衍射峰出现。较大的峰宽意味着样品中结晶部分中具有多种类晶体形态和晶格种类。因此金针菇多糖/大豆蛋白复合凝胶分子具有复杂的聚集态,既具有相对规律的结晶态,又具有无定形态。当大豆蛋白和金针菇多糖质量比例为10:1和15:1时,10
°
的衍射峰的强度要小于其他比例下的强度,且衍射峰也更加尖锐,表明此时凝胶的结构相对更加有序,晶型结构更加完整。
[0033]
本发明还提供了上述金针菇多糖/大豆蛋白复合凝胶在制备持水性基材中的应用。本发明所述金针菇多糖/大豆蛋白复合凝胶,较高的持水性有利于水溶性药物的搭载,较低的生物降解率使得凝胶具有较高的稳定性和持久的药物释放时间。
[0034]
本发明还提供了上述金针菇多糖/大豆蛋白复合凝胶在免疫细胞培养中的应用。本发明所述免疫细胞培养优选包括免疫细胞的生长和增殖,本发明实施例中,在金针菇多糖/大豆蛋白复合凝胶下培养巨噬细胞,其活性与正常条件培养下的巨噬细胞相比,生物活性最低为72%,最高达到89%。
[0035]
下面结合实施例对本发明提供的一种适用于免疫细胞培养的金针菇多糖/大豆蛋白复合凝胶及其制备方法和应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
[0036]
实施例1
[0037]
本实施例提供了金针菇多糖/大豆蛋白物料质量比分别为1:1、4:1、10:1和20:1的复合凝聚。
[0038]
将1g的大豆蛋白溶于100ml蒸馏水中,磁力搅拌2h,放置于4℃冰箱12h,保证大豆蛋白充分水化,获得1%(w/v)大豆蛋白溶液;
[0039]
将1g的金针菇多糖溶于100ml蒸馏水中,磁力搅拌2h,放置于4℃冰箱12h,保证金针菇多糖充分水化,获得1%(w/v)金针菇多糖溶液。
[0040]
由于蛋白和多糖的复合凝聚行为是不受总的生物浓度影响的,只和蛋白多糖的比例有关,在较高的生物浓度下无法追踪溶液的浊度变化,所以选择较低浓度:将1%(w/v)大豆蛋白溶液和1%(w/v)金针菇多糖溶液分别以不同体积比混合,使得蛋白和多糖物料质量比依次为1:1、4:1、10:1和20:1,总生物质量浓度为0.05%(w/v)的金针菇多糖和大豆蛋白混合物水溶液。
[0041]
将金针菇多糖和大豆蛋白混合溶液使用0.5mol/l的naoh溶液调整其ph为中性,以0.1、0.05和0.01mol/l的hcl溶液为滴定液,ph计测定溶液动态ph,溶液ph每变化0.05~0.2,吸取该ph下的溶液200μm,使用酶标仪测定波长为600nm下吸光度,以去离子水为校准液浊度为100%,样品浊度为100-t%。整个滴定过程在磁力搅拌下进行。
[0042]
在不添加盐离子的情况蛋白质-多糖比例对于金针菇多糖和大豆蛋白混合物浊度的影响如图1所示,其中横坐标表示混合溶液随盐酸滴定的ph,纵坐标表示混合溶液的浊度,从图中可以看出,在大豆蛋白-金针菇多糖比例从1:1到20:1整个变化过程,浊度曲线的变化趋势是一致的。随着金针菇多糖-大豆蛋白比例的增加,phc、phopt、phφ1均向高ph移动。表明随着金针菇多糖在体系内比例的增加,可利用的大豆分离蛋白逐渐增多,可能所需要的正电荷离子相对较少,从而能在较高的ph条件结合导致浊度发生变化,且整个复合物形成的浊度ph跨度呈现变窄的趋势。
[0043]
实施例2
[0044]
本实施例提供了氯化钠浓度为0、50、100和200mmol/l的金针菇多糖/大豆蛋白复合凝胶的制备方法。
[0045]
将1g的大豆蛋白溶于100ml蒸馏水中,磁力搅拌2h,放置于4℃冰箱过夜12h保证大豆蛋白充分水化,获得1%(w/v)大豆蛋白溶液;
[0046]
将1g的金针菇多糖溶于100ml蒸馏水中,磁力搅拌2h,放置于4℃冰箱过夜12h保证金针菇多糖充分水化,获得1%(w/v)金针菇多糖溶液。
[0047]
将1%(w/v)大豆蛋白溶液和1%(w/v)金针菇多糖溶液以不同体积比混合,蛋白和多糖物料质量比为10:1,氯化钠浓度为0、50、100和200mmol/l,总生物质量浓度为0.05%(w/v)的金针菇多糖和大豆蛋白混合物水溶液。
[0048]
将金针菇多糖和大豆蛋白混合溶液使用0.5mol/l的naoh溶液调整其ph为中性,以0.1、0.05和0.01mol/l的hcl溶液为滴定液,ph计测定溶液动态ph,溶液ph每变化0.05~0.2,吸取该ph下的溶液200μm,使用酶标仪测定波长为600nm下吸光度,以去离子水为校准液浊度为100%,样品浊度为100-t%。整个滴定过程在磁力搅拌下进行。
[0049]
在不同氯化钠浓度下蛋白质-多糖比例对于金针菇多糖和大豆蛋白混合物浊度的影响如图2所示,其中横坐标表示混合溶液随盐酸滴定的ph,纵坐标表示混合溶液的浊度。从图中可以看出,在氯化钠浓度从0到200mmol/l整个变化过程,浊度曲线的变化趋势是一
致的。但是在氯化钠浓度为10~50mmol/l时,浊度值是升高的,且这个浊度变化区间是最大的。
[0050]
实施例3
[0051]
本实施例提供的金针菇多糖/大豆蛋白复合凝胶,组成成分:混合溶液中总生物质量分数为6~8%(w/v),大豆蛋白和金针菇多糖质量比为10:1、15:1、32:1、20:1和1:0,ph分别为7,6.5。
[0052]
制备的具体过程如下:
[0053]
将8%大豆蛋白溶液与3%多糖溶液混合、搅拌得到质量比为10:1,15:1大豆蛋白和金针菇多糖混合溶液、调节ph为6.5和nacl浓度为10mmol/l得到多糖/蛋白质的混合溶液。
[0054]
将金针菇多糖/大豆蛋白混合溶液置于85~90℃加热20~25min获得蛋白质/多糖热聚体;
[0055]
将3%~6%的葡萄糖内酯加入到蛋白质/多糖热聚体混合、搅拌,流动水快速降温,冷却后放入4℃冰箱过夜,得到金针菇多糖/大豆蛋白复合凝胶。
[0056]
对本实施例中得到的多种金针菇多糖/大豆蛋白复合凝胶进行特性研究:
[0057]
1、持水力
[0058]
凝胶持水力的测定方法如下:用不锈钢小刀将各凝胶切成规整小块称取一定质量g
1
放于4ml离心管,分别在离心力为1000
×
g下离心10min后,用滤纸将胶体表面水吸干,称量得到g
2
。
[0059]
持水力=(g
1-g
2
)/g
1
×
100。
[0060]
持水力测定结果如图3所示,其中横坐标表示不同的蛋白和多糖的比例,纵坐标表示凝胶的持水力,可以看出随着金针菇多糖添加量的增加,ph为7和6.5的条件下制备的冷凝胶持水力均呈现增大的趋势。在不同的金针菇多糖添加量下,ph为6.5时制备的凝胶持水能力均比ph为7的持水力要强。表明金针菇多糖的添加能提高以大豆分离蛋白为主体的冷凝胶的持水能力,并且在ph为6.5时添加金针菇多糖制备的冷凝胶持水性增强作用要大于在ph为7时制备的冷凝胶的强度。
[0061]
2、晶型
[0062]
晶型的测定方法如下:将得到的不同ph和蛋白多糖比例的凝胶经过-20℃预冻过夜,真空冻干磨碎得到凝胶粉末,过400目分子筛,使用x-射线衍射仪测定5
°-
50
°
衍射峰的强度。
[0063]
晶型结构如图4所示,其中横坐标表示x-射线衍射的衍射角度,纵坐标表示凝胶的衍射峰的强度,在ph=6.5和7的x-射线衍射均表现出大豆蛋白的衍射峰型,其中在15
°
~25
°
之间强且宽度较大的衍射峰出现,主峰位于20
°
,在10
°
有宽度较窄且强度不大的衍射峰出现,较大的峰宽意味着样品中结晶部分中具有多种类晶体形态和晶格种类。以上分析表明,金针菇多糖/大豆蛋白复合凝胶分子具有复杂的聚集态,既具有相对规律的结晶态,又具有无定形态。当大豆蛋白和金针菇多糖比例为10:1和15:1时,10
°
的衍射峰的强度要小于其他比例下的强度,且衍射峰也更加尖锐,表明此时凝胶的结构相对更加有序,晶型结构更加完整。
[0064]
3、生物降解率
[0065]
凝胶溶胀和生物降解率的测定方法如下:将水凝胶样品存储在37℃的h
2
o中直至达到平衡重量,记为w
1
,并在80℃下真空干燥过夜,得到干燥凝胶,称重得质量为w
2
。
[0066]
溶胀率=(w
1-w
2
)/w
2
×
100。
[0067]
将水凝胶样品置于细胞培养液中,置于37℃培养箱中培养,每隔12h取样一次,未放入培养液前凝胶干重记为w
1
,恒重后凝胶干重为w
2
。
[0068]
生物降解率=(w
1-w
2
)/w
1
×
100。
[0069]
生物降解率结果如图5所示,其中a和b的横坐标分别表示不同的蛋白和多糖的比例,纵坐标分别表示凝胶的溶胀性(a)和生物降解率(b),可以看出,随着金针菇多糖添加量的增加在ph为6.5条件下制备出的凝胶的溶胀比例适中,保持在11%左右,而ph为7时,随着金针菇多糖添加量的增加,凝胶的溶胀比增大。在相同蛋白和多糖比例下,ph为7的凝胶溶胀比ph为6.5的要高。在生物降解方面,少量的金针菇多糖会加速凝胶的降解。但是更多的金针菇多糖的添加凝胶的降解反而减慢了,ph为7的凝胶降解速率要比ph为6.5的要快。这现象与凝胶的晶型结构的测定结果保持一致,表明有序的晶型结构能减缓凝胶的生物降解。
[0070]
4、巨噬细胞的培养
[0071]
凝胶的细胞毒性测定方法如下:取一定量添加葡萄糖酸内酯的蛋白多糖热聚体快速转移覆盖于96孔细胞板表面,4℃过夜。取含有一定数量的巨噬细胞置于96孔板面上进行培养,在37℃下经过24h培养箱培养后,通过细胞毒性mtt试剂盒测定各孔细胞在570nm处的吸光度,确定凝胶对巨噬细胞的毒性。
[0072]
图6横坐标表示不同的蛋白和多糖的比例,纵坐标表示巨噬细胞的生长活性,从中可以看出,金针菇多糖/大豆蛋白复合凝胶下培养的巨噬细胞活性与正常条件培养下的巨噬细胞相比,生物活性最低为72%,最高达到89%。大豆蛋白制成的凝胶用于巨噬细胞的培养活性最低,表明大豆蛋白对巨噬细胞的生长产生一定的影响,且ph为6.5制备的金针菇多糖/大豆蛋白复合凝胶对巨噬细胞的生长要比ph为7的大。但是与大豆蛋白凝胶相比,一定金针菇多糖的添加反而促进巨噬细胞的生长,在质量比为10:1时达到最大。在金针菇多糖添加量较小时,不同ph下制备的凝胶会对巨噬细胞的生长产生影响,但是随着金针菇添加量的增大,制备的凝胶对巨噬细胞的生长几乎无显著性影响。
[0073]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1