一种Vero细胞培养流感病毒的纯化方法
本发明属于病毒液纯化技术领域,具体涉及一种vero细胞培养流感病毒的纯化方法,特别涉及一种适用于vero细胞培养流感病毒(包括vero细胞适应株、vero细胞低温适应流感病毒)及其载体重组病毒的纯化方法。
背景技术:
流行性感冒病毒,简称流感病毒,属正粘病毒科(orthomyxoviridae)有包膜的单负链rna病毒。根据流感病毒基质蛋白(m)和病毒核蛋白(np)的不同可划分为甲(a)、乙(b)和丙(c)三种型。其中甲型和乙型流感病毒的基因含有8个rna节段;甲型又可根据流感病毒血凝素(ha)和神经氨酸酶(na)的不同,再分为若干亚型。除人以外,流感病毒还在动物间广泛传播,如在鸡、猪、马等动物间传播流行,导致动物大量死亡,给养殖业带来了巨大损失。
流感疫苗的使用是预防和控制流感最经济有效的措施。目前被广泛使用的是鸡胚流感裂解灭活疫苗。世界上主要国家和地区使用的流感疫苗是通过鸡胚培养获得,但是使用鸡胚生产的流感疫苗存在一系列的危险因素,包括:卵清蛋白过敏、流感病毒抗原变异、合格鸡胚的及时供应(特别是大流行发生时)、部分疫苗株鸡胚低产量等问题。早在1995年,who就推荐用细胞,尤其是哺乳动物细胞作为流感疫苗的生产基质。细胞作为流感疫苗的培养基质,克服鸡胚培养的局限性,其生产一致性更好,培养过程易于控制,且可通过发酵罐放大培养,能在短时间内生产出足够量的流感疫苗来应对流感的大流行。
来源于非洲绿猴肾的vero传代细胞系,是who推荐用于人用疫苗生产的细胞基质,是近几年研究流感病毒细胞培养疫苗的热点。vero细胞系已被用于狂犬、脊髓灰质炎疫苗的制备,且超过60年的使用历史,其安全性可以确认。采用vero细胞制备流感减毒活疫苗,可以克服鸡胚可能带来的风险,值得深入研究。但是杂质是引起疫苗副反应的主要原因。
vero细胞具有无限传代的能力,其携带基因的dna存在使人的正常细胞产生突变的潜在风险。为了确保疫苗的安全性,目前世界上许多机构组织对生物制品中细胞基质dna残留量都制定了相关标准。随着各项科技技术的进步与发展,世界卫生组织以及各国药品生产及监管部门对以哺乳动物细胞基质生产的疫苗纯度测定及杂质含量分析日益关注,同时也是疫苗质量评价的重要指标。通过合理的纯化方案,制备出符合甚至于超过世界卫生组织以及各国药品生产及监管部门所制定的质量标准,是疫苗研发生产中至关重要的一环。
而现有纯化技术如密度梯度离心,一方面难于线性放大,由于离心机容积的限制,只能通过简单的增加设备的方式提高生产率。这使得在大规模生产时对设备及产房面积提出了较高的要求。而同样采用层析纯化的技术又面临回收率较低或纯度不足等问题。因此如何克服现有技术的不足是目前病毒液纯化技术领域亟需解决的问题。
技术实现要素:
本发明的目的是为了解决现有技术的不足,本发明旨在提供一种以vero细胞为病毒培养基质培养的病毒浓缩液的纯化方法,以期生产出杂质低,纯度高、活性好、安全有效的流感疫苗。
为实现上述目的,本发明采用的技术方案如下:
一种vero细胞培养流感病毒的纯化方法,包括如下步骤:
将病毒收获液澄清;
对获得的澄清病毒液超滤浓缩;
对所获浓缩液采用含captocore700填料的层析柱进行一级纯化,收获穿透峰,得到一级病毒纯化液;
将所收获一级病毒纯化液上样至含captoq填料的层析柱进行二级纯化,待样品完全挂柱后,使用洗脱液洗脱目的峰,所收获目的峰即为纯化的流感病毒液。
进一步,优选的是,将病毒收获液澄清的具体方法有三种:
其一,假设病毒培养是采用静置培养方式,所获得病毒收获液采用0.45μm或0.65μm的滤柱进行一级澄清过滤即可获得澄清病毒液;
其二,假设病毒培养是采用的微载体生物反应器进行培养,所获得病毒收获液采用一级0.65μm、二级0.45μm的两级澄清过滤的方式进行澄清过滤即可获得澄清病毒液;
其三,将所获得病毒收获液先经9000~12000g连续流离心,进液速度为900~950ml/分钟,再经0.45μm过滤澄清即可获得澄清病毒液。
进一步,优选的是,对澄清病毒液使用300kd的超滤膜包进行洗滤及超滤浓缩。
进一步,优选的是,先使用3~5倍病毒收获液体积的ph为7.2±0.2的0.01mol/lpbs进行洗滤,洗滤结束后,再对病毒液进行20~50倍超滤浓缩,收获浓缩病毒液。
进一步,优选的是,对所获浓缩液采用含captocore700填料的层析柱进行一级纯化时,上样量为5~10倍柱体积。
进一步,优选的是,captocore700装柱柱高为10~80cm,装柱流速≤500cm/h,压力<0.2mpa。
进一步,优选的是,一级纯化前,装柱后,需要进行在位消毒、在位清洗;
一级纯化时,先采用ph为7.2±0.2的0.01mol/lpbs平衡层析柱,工作流速为装柱流速的60~80%,压力<0.2mpa,平衡体积为2~10倍柱体积;
待层析柱平衡后,以相同工作流速将病毒浓缩液上样,根据280nm或260nm紫外吸收峰,当紫外吸收斜率在5.26±3.0mau/min时开始收获病毒纯化液,当紫外吸收值回归基线时结束病毒纯化液的收获,所收获纯化液即为一级病毒纯化液。
进一步,优选的是,将所收获穿透峰上样至含captoq填料的层析柱进行二级纯化时,上样量为5~10倍柱体积。
进一步,优选的是,captoq装柱柱高为10~30cm,装柱流速≤1200cm/h,压力<0.3mpa。
进一步,优选的是,二级纯化前,装柱后,需要进行在位消毒、在位清洗;
二级纯化时,先采用ph为7.2±0.2的0.01mol/lpbs平衡层析柱,工作流速为装柱流速的60~80%,压力<0.3mpa,平衡体积为2~10倍柱体积;
待层析柱平衡后,以相同工作流速将一级病毒纯化液上样,持续走2~3柱体积的ph为7.2±0.2的0.01mol/lpbs,至280nm或260nm紫外吸收值回归基线后,以20mmol/lpbs为a相,以1mol/lnacl为b相进行洗脱,b相体积占比为11~14%;根据280nm或260nm紫外吸收峰,当紫外吸收斜率在5.26±3.0mau/min时开始收获病毒纯化液,当紫外吸值回归基线时结束病毒纯化液的收获,所得即为纯化的流感病毒液。
本发明对所获浓缩液先使用含同时具备分子筛和离子交换两种特性的captocore700填料或者类似的层析柱进行一级纯化,收获穿透峰。将所收获穿透峰上样至含captoq填料的层析柱,待样品完全挂柱后,使用洗脱液洗脱目的峰,所收获目的峰即为纯化的流感病毒。通过该方法对vero细胞培养制备的vero细胞适应流感病毒、vero细胞低温适应流感病毒及其基因重组流感病毒浓缩液进行纯化,制备季节性流感病毒疫苗和大流行流感病毒疫苗,也可以用于mdck细胞等细胞培养的流感病毒悬液的纯化。该方法适用于使用细胞工厂、微载体-发酵罐、片状载体发酵、悬浮培养等多种病毒培养方式培养收获的流感病毒悬液或者其它有囊膜的细胞培养病毒悬液的纯化工艺。
本发明病毒收获液通过0.45μm的滤柱、0.65μm的滤柱、连续流离心等方式进行澄清后,有效去除颗粒状杂质,能避免超滤膜包及层析柱的堵塞。
本发明两次纯化前,均需要做在位消毒(disinfectioninplace,dip)和在位清洗(cleaning-in-place,cip)。一级纯化时,病毒颗粒大于captocore700排阻孔径,完整的病毒颗粒将完全流穿,根据280nm、260nm紫外吸收峰,收获第一级病毒纯化液。
由于层析技术是近代生物化学最常用的纯化方法之一。其方法简单,条件温和,重复性好,在获得高纯度目的成分的同时,还保持其该有的生物学活性,在生物大分子的分离纯化中起着重要的作用。本发明拟通过超滤浓缩,将病毒收获液进行浓缩后,使用captocore700进行分子筛纯化及离子交换纯化,去除部分杂质,再用captoq强离子交换介质进一步去除杂蛋白及宿主细胞dna。通过血凝素含量、总蛋白含量、残余dna含量、牛血清白蛋白以及宿主蛋白残余含量的检测,以确定纯化效果。从而制备出符合世界卫生组织以及各国药品生产及监管部门要求的优质疫苗。
本发明与现有技术相比,其有益效果为:
本发明纯化方法采用了captocore700层析介质纯化及captoq离子交换介质纯化,两步纯化工艺,最大限度的增加了病毒血凝效价的回收率,以及杂质的去除率,提高工作效率,减低时间成本。利用本发明生产的流感疫苗具有纯度高,安全性高,均一性好,免疫效果好等优点。同时本发明具有工艺简便,重复性高,耗时低等优点,具有突出的规模化应用前景。
附图说明
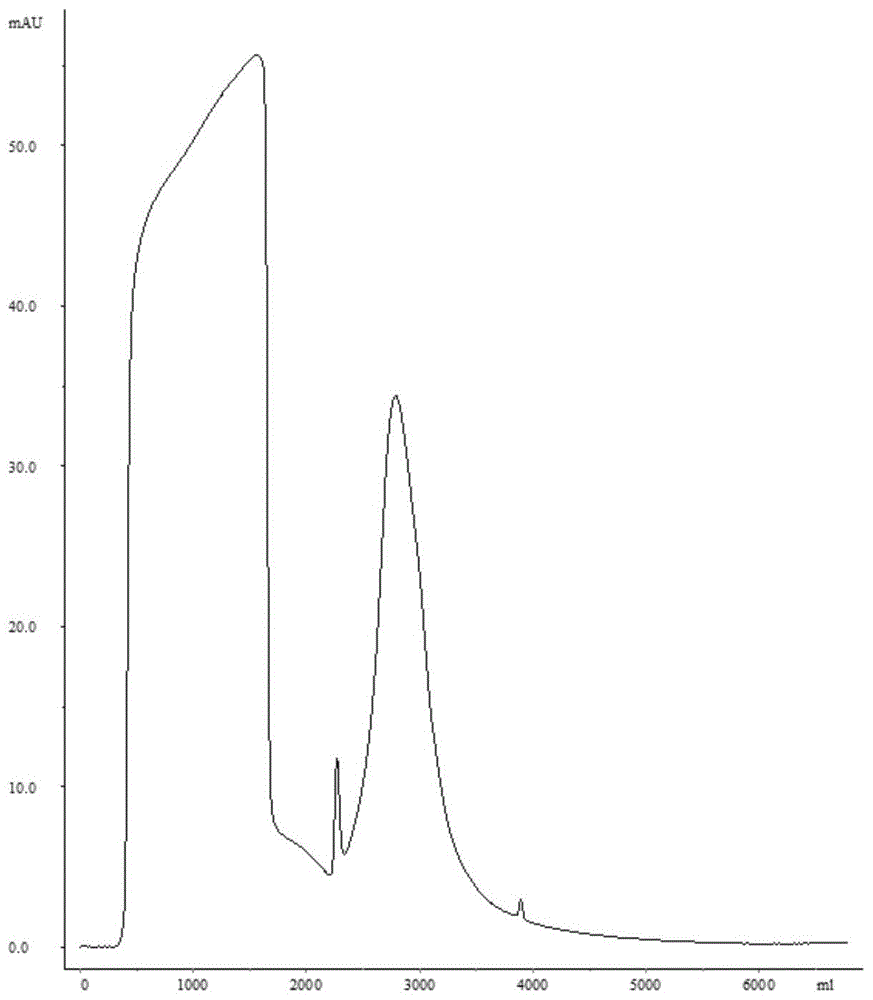
图1为captocore700层析纯化图谱;
图2为captoq层析纯化图谱。
具体实施方式
下面结合实施例对本发明作进一步的详细描述。
本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用材料或设备未注明生产厂商者,均为可以通过购买获得的常规产品。
实施例1
一种vero细胞培养流感病毒的纯化方法,包括如下步骤:
将病毒收获液澄清;
对获得的澄清病毒液超滤浓缩;
对所获浓缩液采用含captocore700填料的层析柱进行一级纯化,收获穿透峰,得到一级病毒纯化液;
将所收获一级病毒纯化液上样至含captoq填料的层析柱进行二级纯化,待样品完全挂柱后,使用洗脱液洗脱目的峰,所收获目的峰即为纯化的流感病毒液。
实施例2
一种vero细胞培养流感病毒的纯化方法,包括如下步骤:
将病毒收获液澄清;
对获得的澄清病毒液超滤浓缩;
对所获浓缩液采用含captocore700填料的层析柱进行一级纯化,收获穿透峰,得到一级病毒纯化液;
将所收获一级病毒纯化液上样至含captoq填料的层析柱进行二级纯化,待样品完全挂柱后,使用洗脱液洗脱目的峰,所收获目的峰即为纯化的流感病毒液。
将病毒收获液澄清的具体方法有三种:
其一,假设病毒培养是采用静置培养方式,所获得病毒收获液采用0.45μm或0.65μm的滤柱进行一级澄清过滤即可获得澄清病毒液;
其二,假设病毒培养是采用的微载体生物反应器进行培养,所获得病毒收获液采用一级0.65μm、二级0.45μm的两级澄清过滤的方式进行澄清过滤即可获得澄清病毒液;
其三,将所获得病毒收获液先经90000g连续流离心,进液速度为900ml/分钟,再经0.45μm过滤澄清即可获得澄清病毒液。
进一步,优选的是,对澄清病毒液使用300kd的超滤膜包进行洗滤及超滤浓缩。
先使用3倍病毒收获液体积的ph为7.2±0.2的0.01mol/lpbs进行洗滤,洗滤结束后,再对病毒液进行20倍超滤浓缩,收获浓缩病毒液。
对所获浓缩液采用含captocore700填料的层析柱进行一级纯化时,上样量为5倍柱体积。
captocore700装柱柱高为10cm,装柱流速≤500cm/h,压力<0.2mpa。
一级纯化前,装柱后,需要进行在位消毒、在位清洗;
一级纯化时,先采用ph为7.2±0.2的0.01mol/lpbs平衡层析柱,工作流速为装柱流速的60%,压力<0.2mpa,平衡体积为2倍柱体积;
待层析柱平衡后,以相同工作流速将病毒浓缩液上样,根据280nm紫外吸收峰,当紫外吸收斜率在5.26±3.0mau/min时开始收获病毒纯化液,当紫外吸收值回归基线时结束病毒纯化液的收获,所收获纯化液即为一级病毒纯化液。
将所收获穿透峰上样至含captoq填料的层析柱进行二级纯化时,上样量为5倍柱体积。
captoq装柱柱高为10cm,装柱流速≤1200cm/h,压力<0.3mpa。
二级纯化前,装柱后,需要进行在位消毒、在位清洗;
二级纯化时,先采用ph为7.2±0.2的0.01mol/lpbs平衡层析柱,工作流速为装柱流速的60%,压力<0.3mpa,平衡体积为2倍柱体积;
待层析柱平衡后,以相同工作流速将一级病毒纯化液上样,持续走2柱体积的ph为7.2±0.2的0.01mol/lpbs,至260nm紫外吸收值回归基线后,以20mmol/lpbs为a相,以1mol/lnacl为b相进行洗脱,b相体积占比为11%;根据260nm紫外吸收峰,当紫外吸收斜率在5.26±3.0mau/min时开始收获病毒纯化液,当紫外吸值回归基线时结束病毒纯化液的收获,所得即为纯化的流感病毒液。
实施例3
一种vero细胞培养流感病毒的纯化方法,包括如下步骤:
将病毒收获液澄清;
对获得的澄清病毒液超滤浓缩;
对所获浓缩液采用含captocore700填料的层析柱进行一级纯化,收获穿透峰,得到一级病毒纯化液;
将所收获一级病毒纯化液上样至含captoq填料的层析柱进行二级纯化,待样品完全挂柱后,使用洗脱液洗脱目的峰,所收获目的峰即为纯化的流感病毒液。
将病毒收获液澄清的具体方法有三种:
其一,假设病毒培养是采用静置培养方式,所获得病毒收获液采用0.45μm或0.65μm的滤柱进行一级澄清过滤即可获得澄清病毒液;
其二,假设病毒培养是采用的微载体生物反应器进行培养,所获得病毒收获液采用一级0.65μm、二级0.45μm的两级澄清过滤的方式进行澄清过滤即可获得澄清病毒液;
其三,将所获得病毒收获液先经12000g连续流离心,进液速度为950ml/分钟,再经0.45μm过滤澄清即可获得澄清病毒液。
进一步,优选的是,对澄清病毒液使用300kd的超滤膜包进行洗滤及超滤浓缩。
先使用5倍病毒收获液体积的ph为7.2±0.2的0.01mol/lpbs进行洗滤,洗滤结束后,再对病毒液进行50倍超滤浓缩,收获浓缩病毒液。
对所获浓缩液采用含captocore700填料的层析柱进行一级纯化时,上样量为10倍柱体积。
captocore700装柱柱高为80cm,装柱流速≤500cm/h,压力<0.2mpa。
一级纯化前,装柱后,需要进行在位消毒、在位清洗;
一级纯化时,先采用ph为7.2±0.2的0.01mol/lpbs平衡层析柱,工作流速为装柱流速的80%,压力<0.2mpa,平衡体积为10倍柱体积;
待层析柱平衡后,以相同工作流速将病毒浓缩液上样,根据280nm紫外吸收峰,当紫外吸收斜率在5.26±3.0mau/min时开始收获病毒纯化液,当紫外吸收值回归基线时结束病毒纯化液的收获,所收获纯化液即为一级病毒纯化液。
将所收获穿透峰上样至含captoq填料的层析柱进行二级纯化时,上样量为10倍柱体积。
captoq装柱柱高为30cm,装柱流速≤1200cm/h,压力<0.3mpa。
二级纯化前,装柱后,需要进行在位消毒、在位清洗;
二级纯化时,先采用ph为7.2±0.2的0.01mol/lpbs平衡层析柱,工作流速为装柱流速的80%,压力<0.3mpa,平衡体积为10倍柱体积;
待层析柱平衡后,以相同工作流速将一级病毒纯化液上样,持续走3柱体积的ph为7.2±0.2的0.01mol/lpbs,至280nm紫外吸收值回归基线后,以20mmol/lpbs为a相,以1mol/lnacl为b相进行洗脱,b相体积占比为14%;根据280nm紫外吸收峰,当紫外吸收斜率在5.26±3.0mau/min时开始收获病毒纯化液,当紫外吸值回归基线时结束病毒纯化液的收获,所得即为纯化的流感病毒液。
实施例4
一种vero细胞培养流感病毒的纯化方法,包括如下步骤:
将病毒收获液澄清;
对获得的澄清病毒液超滤浓缩;
对所获浓缩液采用含captocore700填料的层析柱进行一级纯化,收获穿透峰,得到一级病毒纯化液;
将所收获一级病毒纯化液上样至含captoq填料的层析柱进行二级纯化,待样品完全挂柱后,使用洗脱液洗脱目的峰,所收获目的峰即为纯化的流感病毒液。
将病毒收获液澄清的具体方法有三种:
其一,假设病毒培养是采用静置培养方式,所获得病毒收获液采用0.45μm或0.65μm的滤柱进行一级澄清过滤即可获得澄清病毒液;
其二,假设病毒培养是采用的微载体生物反应器进行培养,所获得病毒收获液采用一级0.65μm、二级0.45μm的两级澄清过滤的方式进行澄清过滤即可获得澄清病毒液;
其三,将所获得病毒收获液先经10000g连续流离心,进液速度为920ml/分钟,再经0.45μm过滤澄清即可获得澄清病毒液。
进一步,优选的是,对澄清病毒液使用300kd的超滤膜包进行洗滤及超滤浓缩。
先使用4倍病毒收获液体积的ph为7.2±0.2的0.01mol/lpbs进行洗滤,洗滤结束后,再对病毒液进行30倍超滤浓缩,收获浓缩病毒液。
对所获浓缩液采用含captocore700填料的层析柱进行一级纯化时,上样量为8倍柱体积。
captocore700装柱柱高为50cm,装柱流速≤500cm/h,压力<0.2mpa。
一级纯化前,装柱后,需要进行在位消毒、在位清洗;
一级纯化时,先采用ph为7.2±0.2的0.01mol/lpbs平衡层析柱,工作流速为装柱流速的70%,压力<0.2mpa,平衡体积为8倍柱体积;
待层析柱平衡后,以相同工作流速将病毒浓缩液上样,根据280nm或260nm紫外吸收峰,当紫外吸收斜率在5.26±3.0mau/min时开始收获病毒纯化液,当紫外吸收值回归基线时结束病毒纯化液的收获,所收获纯化液即为一级病毒纯化液。
将所收获穿透峰上样至含captoq填料的层析柱进行二级纯化时,上样量为8倍柱体积。
captoq装柱柱高为20cm,装柱流速≤1200cm/h,压力<0.3mpa。
二级纯化前,装柱后,需要进行在位消毒、在位清洗;
二级纯化时,先采用ph为7.2±0.2的0.01mol/lpbs平衡层析柱,工作流速为装柱流速的70%,压力<0.3mpa,平衡体积为8倍柱体积;
待层析柱平衡后,以相同工作流速将一级病毒纯化液上样,持续走2.5柱体积的ph为7.2±0.2的0.01mol/lpbs,至280nm或260nm紫外吸收值回归基线后,以20mmol/lpbs为a相,以1mol/lnacl为b相进行洗脱,b相体积占比为12%;根据280nm或260nm紫外吸收峰,当紫外吸收斜率在5.26±3.0mau/min时开始收获病毒纯化液,当紫外吸值回归基线时结束病毒纯化液的收获,所得即为纯化的流感病毒液。
实施例5
一种流感病毒的纯化方法,该方法通过层析纯化工艺来实现,过程如下:
1.病毒收获液的澄清
1.1.如病毒培养的是采用一次性培养瓶、细胞工厂和转瓶等静置培养方式所获得,可采用0.45μm或0.65μm的滤柱进行一级澄清过滤即可获得澄清病毒液。
1.2.如病毒培养是采用的微载体生物反应器等方式进行的培养,可采用一级0.65μm、二级0.45μm的两级澄清过滤的方式进行澄清过滤即可获得澄清病毒液。
1.3.如细胞培养的病毒悬液杂质含量高,可以先经9000~12000g连续流离心,进液速度为900~950ml/分钟,再经0.45μm过滤澄清即可获得澄清病毒液。
2.澄清病毒收获液的超滤浓缩
对澄清病毒液使用300kd的超滤膜包进行洗滤及超滤浓缩。先使用3~5倍病毒收获液体积的0.01mol/lpbs(ph7.2±0.2)进行洗滤,洗滤结束后,再对病毒液进行20~50倍超滤浓缩,收获浓缩病毒液。
3.captocore700一级纯化
3.1.captocore700层析介质填充(装柱)
视病毒液体积,选择适当大小的层析柱,进行captocore700层析填料的装填。控制上样量在5~10倍柱体积。captocore700装柱柱高在10~80cm,装柱流速≤500cm/h,压力<0.2mpa。
取适量captocore700填料用注射用水制成凝胶悬液,装入层析柱中,以注射用水作为流动相,利用纯化系统,以≤500cm/h的流速,视柱子及纯化系统的压力,调整流速至适宜的范围,柱压不可超过0.2mpa。待凝胶平面稳定后,按1:1.15的压缩比,下压柱头至合适位置。
3.2.captocore700dip
装柱完成后,用2~10倍柱床体积(columnvolume,简称cv)1mol/lnaoh溶液,以60%~80%的装柱流速清洗消毒凝胶柱,确保柱床整体浸泡于1mol/lnaoh溶液中超过1个小时,此时置换流动相为0.1mol/lnaoh溶液,用2~10cv1mol/lnaoh溶液,以60~80%的装柱流速置换柱床中1mol/lnaoh溶液。此后1周以内凝胶填料可保存于0.1mol/lnaoh溶液中,随时备用。
3.3.captocore700一级纯化
3.3.1.captocore700柱平衡
设置流速为60~80%的装柱流速,用2~10cv0.01mol/lpbs(ph7.2±0.2)平衡层析柱。
3.3.2.captocore700上样
设置流速为60~80%的装柱流速,将病毒浓缩液上样,上样量≤10cv。
3.3.3.一级纯化病毒纯化液收获
根据280nm或260nm紫外吸收峰,当紫外吸收斜率在5.26±3.0mau/min时开始收获病毒纯化液,当紫外吸值回归基线时结束病毒纯化液的收获,此为第一级病毒纯化液。
3.4.captocore700cip
待收获吸收峰回归基线后,以2~10cv1mol/lnacl溶液清洗复性captocore700,直至基线走平。
3.5.captocore700保存
cip后按3.2.captocore700dip操作对柱子进行dip后,用2~10cv25%乙醇溶液,以60~80%的装柱流速置换柱床中naoh溶液。此后1~5个月凝胶填料可保存于20%乙醇溶液中,随时备用。超过5个月或期间发现填料干涸,需重新装柱。
4.captoq二级纯化
4.1.captoq层析介质填充(装柱)
视病毒收获液体积,选择适当大小的层析柱,进行captoq层析填料的装填。控制上样量在5~10倍柱体积。captoq装柱柱高在10~30cm,装柱流速≤1200cm/h,压力<0.3mpa。
取适量captoq填料用注射用水制成凝胶悬液,倒入层析柱中,以注射用水作为流动相,利用纯化系统,以≤1200cm/h的流速,视柱子及纯化系统的压力,调整流速至适宜的范围,柱压不可超过0.3mpa。待胶平面稳定后,按1:1.15的压缩比,下压柱头至合适位置。
4.2.captoqdip
装柱完成后,用2~10cv1mol/lnaoh溶液,以60~80%的装柱流速清洗消毒凝胶柱,确保柱床整体浸泡于1mol/lnaoh溶液中超过1个小时,此时置换流动相为0.1mol/lnaoh溶液,用2~10cv1mol/lnaoh溶液,以60~80%的装柱流速置换柱床中1mol/lnaoh溶液。此后1周以内凝胶填料可保存于0.1mol/lnaoh溶液中,随时备用。
4.3.captoq一级纯化
4.3.1.captoq柱平衡
设置流速为60~80%的装柱流速,用2~10cv0.01mol/lpbs(ph7.2±0.2)平衡层析柱。
4.3.2.captoq上样
设置流速为60~80%的装柱流速,将一级纯化的病毒纯化液上样,上样量≤10cv。待上样结束后继续用2~3cv0.01mol/lpbs(ph7.2±0.2)冲洗柱子至280nm、260nm紫外吸收值回归基线。
4.3.3.二级纯化病毒纯化液收获
更换流动相,以20mmol/lpbs为a相,以1mol/lnacl为b相进行洗脱,b相体积占比为11~14%,余量为a相,总计为100%;根据280nm或260nm紫外吸收峰,当紫外吸收斜率在5.26±3.0mau/min时开始收获病毒纯化液,当紫外吸值回归基线时结束病毒纯化液的收获,即为第二级病毒纯化液。
4.4.captoqcip
待收获吸收峰回归基线后,以2~10cv2mol/lnacl溶液清洗复性captoq。直至基线走平。
4.5.captoq保存
cip后按4.2.captocore700dip操作对柱子进行dip后,用2~10cv25%乙醇溶液,以60~80%的装柱流速置换柱床中naoh溶液。此后1~5个月凝胶填料可保存于25%乙醇溶液中,随时备用。超过5个月或期间发现填料干涸,需重新装柱。
填装层析柱所需的层析介质根据所选型号的层析柱规格及预备填装高度通过圆柱体积计算公式计算而来。计算出所需层析介质体积后,按50~70%体积浓度胶悬液浓度制备胶悬液,充分混匀后缓慢倒入层析柱中(或采用自动装柱系统装柱),以注射用水作为流动相,以层析填料的说明书中线性流速恒流装柱。
纯化过程中的上样体积可根据实际需要进行调整,但不能超过柱体积10倍。
上述制备的病毒纯化液成品检测方法如下:
以vero细胞适应基因改造流感病毒收获的病毒纯化液,对病毒纯化液样品进行血凝效价,总蛋白含量,残余宿主蛋白,残余牛血清白蛋白及残余dna进行检测,以分析纯化工艺的有效性。
以红细胞凝集试验来测定血凝效价,结果显示从病毒浓缩液到病毒纯化液,病毒回收率在45%以上。
利用lorry法和酶标法,使用不同残余蛋白检测试剂盒对纯化液中宿主蛋白,残余牛血清白蛋白进行检测,利用dna标记及检测试剂盒对纯化液中的残余dna进行检测,结果显示杂质去除率达到98%以上。
效价回收率和杂质去除率表明该纯化工艺有效。
应用实例1.流感裂解疫苗的制备
1.将流感病毒vero细胞低温适应株,接种于细胞工厂静置培养的vero细胞上,于33±1℃培养48~96h后,视细胞cpe情况,当细胞cpe大于60%可收获病毒液。
2.收获后的病毒液,使用0.65μm滤柱或者先经9000~12000g连续流离心,进液速度为900~950ml/分钟,再经0.45μm进行澄清,最终收获病毒液45l。
3.澄清后的病毒收获液,使用300kd的超滤膜包进行超滤浓缩。使用150l0.01mol/lpbs(ph7.2±0.2)进行洗滤。将病毒收获液浓缩至200ml,再通过膜包进液端补加0.01mol/lpbs(ph7.2±0.2)至5l,之后再超滤浓缩至200ml,重复3次。
4.最后使用1~2l0.01mol/lpbs(ph7.2±0.2)彻底冲洗膜包,自回流端收获1.5l病毒浓缩液,浓缩倍数约30倍。
5.captocore700层析纯化
实施例所用仪器耗材如下:
纯化仪器:akta.prime纯化系统
层析柱:xk26/50
填料:captocore700
以上所述均购自ge公司
5.1.装柱
取200mlcaptocore700填料用注射用水制成凝胶悬液,倒入层析柱中,以注射用水作为流动相,利用akta.prime纯化系统,以300cm/h的流速,装柱至柱高38cm。
5.2.柱子cip
装柱完成后,用5cv1mol/lnaoh溶液,以180cm/h的流速清洗消毒凝胶柱,之后静置1h,后用5cv0.1mol/lnaoh溶液以180cm/h的流速置换层析柱内1mol/lnaoh溶液,并将凝胶填料保存于0.1mol/lnaoh溶液中,备用。
5.3.captocore700柱平衡
以10cv0.01mol/lpbs(ph7.2±0.2),180cm/h的流速平衡层析柱至基线走平。
5.4.captocore700病毒浓缩液纯化
基线平后将1.5l病毒浓缩液通过上样口,完全上样,根据280nm或260nm紫外吸收峰,当紫外吸收斜率在5.26±3.0mau/min时开始收获病毒纯化液。待样品完全上柱后,换0.01mol/lpbs(ph7.2±0.2)继续走至紫外吸收峰回至基线,则停止收样。此为一级纯化样品。到吸收峰回至基线,共收获病毒纯化液1.8l。
5.5.captocore700cip
待收获吸收峰回归基线后,以2~10cv1mnacl溶液清洗复性captocore700。直至基线走平。完整的captocore700纯化图如图1所示(260nm)。
6.captoq层析纯化
实施例所用仪器耗材如下:
纯化仪器:akta.prime纯化系统
层析柱:xk26/50
填料:captoq
以上所述均购自ge公司
6.1.装柱
取200mlcaptoq填料用注射用水制成凝胶悬液,倒入层析柱中,以注射用水作为流动相,利用akta.prime纯化系统,以800cm/h的流速,装柱至柱高37cm。
6.2.柱子cip
装柱完成后,用5cv1mol/lnaoh溶液,以600cm/h的流速清洗消毒凝胶柱,之后静置1h,后用5cv0.1mol/lnaoh溶液以600cm/h的流速置换层析柱内1mol/lnaoh溶液,并将凝胶填料保存于0.1mol/lnaoh溶液中,备用。
6.3.captoq柱平衡
以10cv0.01mol/lpbs(ph7.2±0.2),600cm/h的流速平衡层析柱至基线走平。
6.4.captoq纯化
6.4.1captoq病毒纯化液上样
基线平后将1.8lcaptocore700病毒纯化液通过上样口,完全上样。待样品完全上柱后,换0.01mol/lpbs(ph7.2±0.2)继续走至紫外吸收峰回至基线。
6.4.2captoq目的峰收获
待基线走平后,更换流动相,以20mmol/lpbs为a相,以1mol/lnacl为b相进行洗脱,b相体积占比为11~14%,余量为a相,总计为100%;根据280nm或260nm紫外吸收峰,当紫外吸收斜率在5.26±3.0mau/min时开始收获病毒纯化液,当紫外吸值回归基线时结束病毒纯化液的收获,即为第二级病毒纯化液,共收获病毒纯化液400ml。
6.5.captoqcip
待收获吸收峰回归基线后,以2~10cv1mol/lnacl溶液清洗复性captoq,直至基线走平。完整的captoq纯化图如图2所示(260nm)。
表1两步层析纯化各峰血凝素含量及杂质含量
如表1所示,病毒收获液在100倍浓缩后,最终经captocore700和captoq两级纯化后,vero细胞残余dna含量<50pg/ml,牛血清白蛋白含量为24ng/ml,小于药典规定的50ng/ml,蛋白含量为43.6μg/ml,小于药典规定的60μg/ml,纯化液在配置为疫苗的过程中,还有进一步的稀释约为5~10倍稀释,最终成品每剂杂质还将更低,完全满足药典对以vero细胞为基质制备疫苗的质量要求。
以血凝效价,牛血清白蛋白和宿主蛋白为考查指标,计算captocore700分子筛纯化回收率为75.0%,杂质去除率为85.5%和87.3%,captoq离子交换,回收率为62.7%,杂质去除率为97.9%和98.3%。从病毒收获液到病毒纯化液,其总体回收率为47.0%,杂质去除率为99.7%和99.6%。
7.病毒裂解灭活
经离子柱纯化后,收集的样品即为病毒纯化液。纯化后的病毒液中加入tritonx-100至终浓度为0.5±0.05%,室温搅拌2小时,裂解后,裂解液采用相对离心力6000~10000g离心120分钟,离心温度2~8℃。离心后取上清,用0.01mol/lpbs(ph7.2±0.2)和50kd超滤膜进行透析,以去除tritonx-100。
然后用0.45μm囊式过滤器过滤,用0.01mol/lpbs(ph7.2±0.2)稀释后进行微生物限度和总蛋白含量测定,微生物限度不大于10cfu/ml,蛋白含量30~1200μg/ml。检测合格后,加入2mg/ml甲醛储备液至终浓度为100μg/ml甲醛,室温搅拌灭活至15天,即为病毒原液,于2~8℃保存。
应用实例2.以流感病毒vero细胞适应株为载体的新型冠状病毒减毒活疫苗的制备
1.将vero细胞适应株载体重组sars-cov-2s蛋白的流感减毒株,接种于15l生物反应器培养的vero细胞上,于25±1℃培养48~168h后,视细胞cpe情况,当细胞cpe在60%以上时可进行病毒液的收获,共收获病毒液40l。
2.收获病毒原液后,根据实施例1的方法对病毒原液进行纯化,但不对病毒进行灭活,根据tcid50测定减毒活疫苗的滴度。即为减毒活疫苗原液,根据tcid50稀配后即可制备减毒活疫苗。
3.tcid50的检测方法
①vero细胞的制备:将细胞瓶中成片生长的vero用edta-胰酶消化计数,按照3×104/孔接种vero细胞于96孔细胞板中,37℃5%co2孵育24h;
②病毒的稀释:可采取对数或者半对数稀释的方法。其中半对数稀释法:先将病毒原液做1:100稀释,然后在96孔稀释板上,吸取46μl病毒液加入到下一列中,且下一列已经预加油100μl的稀释液。做系列半对数稀释,使之成为10-2、10-2.5、10-3、10-3.5……10-7。每孔含有100μl病毒液;
③病毒稀释液中应当含有终浓度为2μg/mltpck-胰酶,因为流感病毒一般在胰酶存在的条件下才能感染vero细胞。另外某些毒性很高的禽流感病毒在无胰酶存在条件下即可感染vero细胞,因此在测定新病毒滴度时,最好配制含有和不含有胰酶的两种稀释液,以获得最佳结果;
④洗细胞:使用多道加样器,每孔加入300μlhank’s液洗细胞两遍,有学者提出使用1000μlhank’s液洗细胞,可能存在不能将细胞培养液中血清清洗干净的风险。
⑤加样:将稀释板上的病毒液,对应地接种于96孔vero细胞板,每稀释度4复孔,于35℃(流感病毒)孵育2h,每间隔半小时晃动细胞板一次。
⑥二次洗细胞:弃全部液体,每孔用300μlhank’s液洗细胞2次后,每孔加入含有终浓度为2μg/mltpck-胰酶的病毒培养液,35℃(流感病毒)孵育,每日观察细胞病变。
⑦计算:当细胞病变停止发展时,通常在72h左右,一方面显微镜镜检每孔的cpe,另一方面使用鸡红细胞检测病毒的红细胞凝集滴度(ha)。
⑧结果判读:根据reed和muench方法对病毒滴度进行计算,计算出病毒的tcid50/100ml情况。
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
- 还没有人留言评论。精彩留言会获得点赞!
- 人源抗H7N9禽流感病毒中和性抗体1F7L及其应用的制造方法与工艺
- 吲哚衍生物及其制备方法和其抗流感病毒作用与制造工艺
- 检测H5亚型禽流感病毒与鸡细小病毒的成套试剂与方法与制造工艺
- 检测禽流感病毒与鸡细小病毒的成套试剂与方法与制造工艺
- 一种流感病毒逆转录环介导等温扩增试剂盒及其应用的制造方法与工艺
- 用于快速检测流感病毒的狗肾细胞MDCK-NS1的离心小瓶及其应用方法与制造工艺
- 一种保护和稳定病毒RNA的采血管的制造方法与工艺
- H6亚型禽流感病毒荧光定量RT‑PCR检测方法与制造工艺
- 表达H7N9亚型禽流感病毒血凝素蛋白的重组火鸡疱疹病毒株rHOH及构建方法与制造工艺
- 一种提高禽流感疫苗毒株增殖滴度的方法与制造工艺