一种流感病毒逆转录环介导等温扩增试剂盒及其应用的制作方法
技术领域:
本发明涉及微生物检测
技术领域:
,具体说是涉及一种快速、可视化并且可实时定量检测流感病毒的逆转录环介导等温扩增试剂盒及其应用。
背景技术:
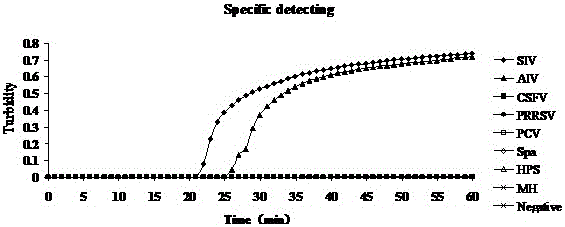
:流感病毒可引起人、禽、猪、马、蝙蝠等多种动物感染和发病,是人流感、禽流感、猪流感、马流感等人与动物疫病的病原。流感病毒对外界抵抗力不强。动物流感病毒通常不感染人,人流感病毒通常不感染动物,但是猪比较例外,猪既可以感染人流感病毒,也可以感染禽流感病毒,但它们主要感染的还是猪流感病毒。少数动物流感病毒适应人后,可以引起人流感大流行。猪流感是一种急性、传染性呼吸道疾病,其特征为疾病突发,高热,精神沉郁,食欲废绝,呼吸困难,阵发性咳嗽。禽流感病毒(AIV)属甲型流感病毒,引起禽类的一种从呼吸系统到严重全身败血症等多种症状的传染病。禽流感容易在鸟类间流行,过去在民间称为“鸡瘟”,国际兽疫局将其定为甲类传染病。禽流感1994年、1997年、1999年和2003年分别在澳大利亚、意大利、中国香港、荷兰等地暴发,2005年则主要在东南亚和欧洲暴发。近年来,随着集约化养殖规模的不断扩大,流感对养殖业构成了较大的威胁。此外,高致病性禽流感在人流感和禽流感之间发挥着关键性作用,具有重大的公共卫生意义,自1918年首次报道以来,流感一直受到人们的广泛关注。目前,流感病毒的检测技术主要有常规方法和分子生物学方法。常规方法是病毒的分离鉴定,其结果准确可靠,但常规鉴定方法存在操作复杂,需要复杂的仪器设备,所需时间长的缺点,不利于流感的快速诊断。分子生物学的方法是通过逆转录聚合酶链式反应(RT-PCR)方法检测流感病毒的特异性基因,虽然RT-PCR方法较常规方法快速准确,但需要昂贵的仪器设备,成本较高,在结果判定上需要进行琼脂糖凝胶电泳,容易造成实验室污染导致出现假阳性结果。技术实现要素:本发明的目的是提供一种为快速、准确并且实时检测流感病毒的方法,提供一种快速、可视化并且可实时定量检测流感病毒的逆转录环介导等温扩增试剂盒。为实现本发明目的所使用的技术方案为:一种流感病毒逆转录环介导等温扩增试剂盒,该试剂盒包括RT-LAMP引物、2×反应缓冲液、酶混合物EM、荧光目视检测试剂、超纯水和流感病毒RNA模板,所述的RT-LAMP引物包括外引物F3与B3、内引物FIP与BIP;其中引物的序列分别为:F3TCTGGAGGGGTGAAAATGGAB3GTGCAACTGATCCCCTCAGFIPGCCCTCTGGGCAGCTGTTTGCGAAGGACAAGGGTTGCTTABIPAAGTCGAAACCCAGGAAACGCTAATGAGTGCTGACCGTGC;所述的2×反应缓冲液包括Tris-HCL、KCL、MgSO4、(NH4)2SO4、Tween20、Betaine和dNTPs。以上所述的流感病毒RNA模板是使用病毒基因组DNA/RNA提取试剂盒提取的流感病毒RNA。以上所述的荧光目视检测试剂采用钙黄绿素荧光试剂,荧光试剂在反应前加入。以上所述的2×反应缓冲液包括Tris-HCL35-50mM、KCL15-35mM、MgSO415-20mM、(NH4)2SO415-25mM、Tween200.4-0.8℅、Betaine1.5-3.0M和dNTPs2.5-4mM,其配制方法在pH为8.7条件下,将上述溶剂混合均匀获得。一种流感病毒逆转录环介导等温扩增试剂盒的应用,用于检测流感病毒以及疑似流感病变组织是否感染流感病毒,具体检测步骤包括:(1)RT-LAMP引物的设计与合成(2)流感病毒RNA模板的提取(3)RT-LAMP反应体系建立(4)RT-LAMP检测方法。以上所述的RT-LAMP反应体系建立以25μl计,2×反应缓冲液12.5μLEM1μLFIP40pmolBIP40pmolF35pmolB35pmol流感病毒RNA5μL超纯水补足25μL。以上所述的RT-LAMP检测方法是采用特异性检测、敏感性检测和荧光可视化检测的方法。以上所述的RT-LAMP检测方法采用LoopampLA-320C实时浊度仪进行密闭全程监控,反应温度为63℃、反应在20-25分钟间出现扩增。本发明的实质性特点和显著的进步是:1)特异性强本发明的RT-LAMP检测方法特异性检测出流感病毒,而所检测的阴性对照病毒、阴性对照支原体和水对照均无阳性结果出来,与RT-PCR检测结果一致。且操作简便、快速获得检测结果、无需昂贵复杂的仪器,普通RT-PCR法需先进行反转录(RT),然后再以RT产物为模板进行PCR反应,使用了两个反应程序,而RT-LAMP方法可在一个反应管内同时完成两个反应程序,一个小时即可完成扩增。2)灵敏度高提取的流感病毒RNA原始浓度为6.8ng/μL,普通RT-PCR检测试剂盒的检测限约为6.8×10-2ng/μL,而使用本发明检测方法,检测限约为6.8×10-3ng/μL,敏感性是普通RT-PCR方法的10倍。3)迅速获得结果普通的RT-PCR整个过程在24小时左右才能得出结果,目前多数建立的RT-LAMP反应方法在反应结束后,须采用琼脂糖凝胶电泳紫外线分析显像来判定结果,从病毒基因组DNA/RNA提取到获取试验结果,需要5-6小时左右。本发明提供的RT-LAMP检测方法反应在20分钟左右出现扩增,60分钟内即可完成扩增,且结果判读方式简便:依据反应管浊度值的变化情况即可判读结果,扩增反应结束即可获得试验结果,不需要再进行琼脂糖凝胶电泳紫外线显像分析或者反应结束后加入荧光染料来判读结果,从病毒基因组DNA/RNA提取到获得最终结果可在2-3小时内完成。4)不造成污染目前RT-LAMP方法用于直接观察的荧光染料为反应后加入,而本发明的荧光染料是在反应前加入的钙黄绿素商用染料(非syber-green),检测过程不需要开盖,能有效避免气溶胶污染实验环境。此外,本发明的RT-LAMP检测方法在结果判定上,直接通过浊度仪检测反应管的浊度值来判定结果,可不进行荧光染料法检测结果或者进行琼脂糖凝胶电泳检测结果,不需要开盖,能有效避免污染。5)可实时定量本发明利用Tubidimeterreal-timeLA-320C浊度仪来实时分析RT-LAMP反应过程,不同的标准样品的浓度对应的浊度值的时间绘制成的标准曲线,代入标准曲线方程,即可求出各时间的流感病毒拷贝数,达到定量检测产物的目的。附图说明图1是本发明RT-LAMP方法特异性检测结果;其中试验病毒有猪流感病毒(SIV)和禽流感病毒(AIV);对照毒株有:猪瘟病毒(CSFV)、猪繁殖障碍与呼吸综合征病毒(PRRSV)、圆环病毒2型(PCV2)、巴氏杆菌(Pm)、副猪嗜血杆菌(HPS)、猪支原体(MH),灭菌超纯水作为阴性对照(Negative)。结果显示,只有流感病毒反应管出现浊度的上升曲线,6个对照反应管和阴性对照反应管均无扩增。图2是使用本发明RT-LAMP方法进行的流感病毒敏感性检测结果,图3是普通RT-PCR检测方法进行的流感病毒敏感性检测结果;其中1:6.8ng/μL;2:6.8×10-1ng/μL;3:6.8×10-2ng/μL;4:6.8×10-3ng/μL;5:6.8×10-4ng/μL;6:6.8×10-5ng/μL;7:6.8×10-6ng/μL;8:6.8×10-7ng/μL。流感病毒原始RNA的起始浓度为6.8ng/μL,经10倍倍比连续稀释后,进行RT-LAMP和RT-PCR扩增,结果显示本发明的RT-LAMP法检测限约为6.8×10-3ng/μL,而RT-PCR检测限约为6.8×10-2ng/μL。图4是加入荧光染料后肉眼观察结果:左管为以流感病毒基因组RNA为模板的反应情况,为阳性结果,右管为阴性对照的反应情况,为阴性结果。图5是本发明定量检测流感病毒的标准曲线:利用不同的标准样品的浓度对应的浊度值对时间绘制成的标准曲线,代入标准曲线方程,即可进行定量。具体实施方式1、材料的准备猪流感病毒(SIV)、禽流感病毒(AIV)由广西大学动物科学技术学院馈赠,对照毒株包括猪瘟病毒、猪繁殖障碍与呼吸综合征病毒、猪圆环病毒2型,对照细菌包括巴氏杆菌、副猪嗜血杆菌、猪支原体,为市售疫苗毒株,或为广西兽医研究所分离鉴定和保存。LAMP法RNA扩增试剂盒购自北京蓝谱生物科技有限公司,货号SLP246,病毒基因组DNA/RNA提取试剂盒购自康为世纪生物科技有限公司,货号CW0548。2、RT-LAMP引物的设计与合成根据GenBank中的流感病毒编码非结构蛋白NP1的基因序列,利用RT-LAMP法引物辅助设计软件PrimerExplorerV4软件设计一套RT-LAMP引物,其中F3、B3为外引物,FIP、BIP为内引物,其中F3TCTGGAGGGGTGAAAATGGAB3GTGCAACTGATCCCCTCAGFIPGCCCTCTGGGCAGCTGTTTGCGAAGGACAAGGGTTGCTTABIPAAGTCGAAACCCAGGAAACGCTAATGAGTGCTGACCGTGC;3、病毒DNA/RNA提取或细菌基因组DNA提取使用病毒基因组DNA/RNA提取试剂盒,提取流感病毒RNA以及对照病毒毒株的病毒基因组DNA/RNA,或者疑似流感病变组织的RNA,使用细菌基因组提取试剂盒(北京康为试剂,货号CW0552)提取对照菌株的基因组DNA。4、RT-LAMP反应体系建立按照试剂盒说明书,按25μl体系配置:2×反应缓冲液12.5μLEM1μLFIP40pmolBIP40pmolF35pmolB35pmol流感病毒RNA5μL超纯水补足25μL。RT-LAMP反应在以实时浊度仪(LA-320C,日本荣研公司)进行密闭全程监控的形式监测本方法的检出情况,浊度仪实时监控扩增情况,可绘制标准曲线,通过获得未知样品达到0.1浊度值对应的时间值,即可从标准曲线上计算出该样品的起始拷贝数,反应温度为63℃。5、RT-LAMP检测方法1)特异性检测使用病毒基因组DNA/RNA提取试剂盒分别提取流感病毒、猪繁殖障碍与呼吸综合征病毒、圆环病毒2型的基因组DNA/RNA。使用细菌基因组DNA提取试剂盒提取巴氏杆菌、副猪嗜血杆菌、猪支原体的基因组DNA,作为RT-LAMP反应的模板,同时进行各毒株和菌株的RT-LAMP扩增,同时以水作为阴性对照,检验RT-LAMP方法的特异性。2)敏感性检测测定流感病毒RNA的起始浓度,用RNA-FreeWater连续10倍倍比稀释成8个稀释度,以各RNA稀释度作为模板,同时进行RT-LAMP扩增和RT-PCR扩增,对比两种检测方法的敏感性。3)荧光可视化检测根据浊度仪监控优化的条件,在反应前加入钙黄绿素商用染料,63℃下反应60分钟后,在紫外灯下观察,不采用琼脂糖凝胶电泳紫外线分析显像,避免开盖跑电泳观察造成的气溶胶污染实验室。实施例1RT-LAMP检测方法的特异性结果结果如图1所示,流感病毒反应管在20分钟左右出现浊度的上升曲线,为阳性结果,6株对照毒株反应管和阴性对照反应管曲线均无扩增情况出现,为阴性结果。实施例2RT-LAMP检测方法的敏感性结果流感病毒原始RNA的起始浓度为6.8ng/μL,经10倍倍比连续稀释后,进行RT-LAMP和RT-PCR扩增,结果如图2和图3所示,结果显示本发明的RT-LAMP法检测限约为6.8×10-3ng/μL,而普通RT-PCR法检测限为6.8×10-2ng/μL。实施例3RT-LAMP检测方法的荧光可视化检测结果根据浊度仪监控优化的条件,反应前加入荧光染料,63℃反应60分钟后,在紫外灯下观察,图4为观察结果,左管为以流感病毒为模板的反应情况,为阳性结果,右管为阴性对照,为阴性结果。试验结果表明,本发明建立的RT-LAMP方法方便基层使用,只需使用试剂盒配合本方法设计的RT-LAMP引物,加入样品后,用低廉的水浴锅来保持63℃60分钟,即可快速观察结果,且无需开盖,避免了污染。实施例4RT-LAMP检测流感病毒定量标准曲线的绘制以流感病毒RNA为模板,用RNA-FreeWater进行连续10倍倍比稀释,各稀释度溶液作为标准样品,进行RT-LAMP扩增。设置对照:浓度为0.68×101ng/μL、0.68×100ng/μL、0.68×10-1ng/μL、0.68×10-2ng/μL标准样品各一个,因为标准样品浓度的负对数值与其扩增浊度值为0.1的时间值成线性关系,可以将浊度仪捕捉到的值与时间(如表1)做成标准曲线,获得标准曲线方程,y=0.3014x-8.1342,如图5所示。从标准曲线方程来看相关系数R2为0.9945,呈良好的线性关系。以时间为X值,可求出Y值即浓度的负次方数,则浓度为10-y,再乘以基数0.68,即为0.68×10-yng/μL。如某试验样品达到浊度值为0.1的时间为30分钟时,带入所建立的标准曲线方程,求出Y等于0.9078,则浓度为10-0.9078,再乘以基数0.68,即为该样品的浓度0.68×10-0.9078ng/μL,从而达到定量的效果。表1时间(min)23.926.929.933.9标准值(-LOG)-1012<110>广西壮族自治区兽医研究所<120>一种流感病毒逆转录环介导等温扩增试剂盒及其应用<160>4<210>1<211>20<212>DNA<213>人工序列<400>1TCTGGAGGGGTGAAAATGGA<210>2<211>19<212>DNA<213>人工序列<400>2GTGCAACTGATCCCCTCAG<210>3<211>40<212>DNA<213>人工序列<400>3GCCCTCTGGGCAGCTGTTTGCGAAGGACAAGGGTTGCTTA<210>4<211>40<212>DNA<213>人工序列<400>4AAGTCGAAACCCAGGAAACGCTAATGAGTGCTGACCGTGC当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1