检测H5亚型禽流感病毒与鸡细小病毒的成套试剂与方法与流程
本发明涉及生物技术领域中,检测H5亚型禽流感病毒与鸡细小病毒的成套试剂与方法。
背景技术:
禽流感(Avian influenza,AI)是正黏病毒科A类禽流感病毒,根据血凝素(HA)和神经氨酸酶(NA)的抗原关系差异,可将其分为18种HA亚型和11种NA亚型;根据禽流感致病性的不同,可分为高致病性禽流感(HPAI)和低致病性禽流感(LPAI)。其中H5亚型AIV属于LPAIV,可引起家禽全身出血性症状的烈性传染病,1997年香港H5N1亚型AIV到2014年四川H5N6亚型AIV,提示该病毒不仅会在家禽中迅速传播,造成极高的死亡率,还会跨越物种传染屏障,从禽类直接传染到了人类进而危害人类健康。鸡细小病毒(Chincken parvovirus,ChPV)是一种线性单链DNA病毒。Goodwin M A等研究发现ChPV临床症状类似于(runting-stunting syndrome,RRS)综合征,表现为骨骼脆弱、腹泻、免疫功能障碍、饲料报酬率低以及后续发病率和死亡率增高,增加生产成本和治疗费用。
病原分离是检测病毒的常见方法,但是该方法耗时长,针对多种病毒混合感染时难以分离辨别,尤其是ChPV在细胞和鸡胚中难以增值。可见,建立一种能快速检测H5亚型禽流感病毒与鸡细小病毒的方法对我国公共卫生事业健康发展具有重要指导意义。
技术实现要素:
本发明所要解决的技术问题是如何同时检测H5亚型禽流感病毒与鸡细小病毒。
为解决上述技术问题,本发明首先提供了检测或辅助检测禽流感病毒与鸡细小病毒的成套试剂。
本发明所提供的检测或辅助检测禽流感病毒与鸡细小病毒的成套试剂,包括名称为M-P的引物对和名称为ChPV-P的引物对;
所述M-P由序列表中SEQ ID No.1和SEQ ID No.2所示的两条单链DNA组成;所述ChPV-P由序列表中SEQ ID No.5和SEQ ID No.6所示的两条单链DNA组成。
上述成套试剂中,所述禽流感病毒可为H5亚型禽流感病毒,所述成套试剂还可包括名称为H5-P的引物对;所述H5-P由序列表中SEQ ID No.3和SEQ ID No.4所示的两条单链DNA组成。
上述成套试剂可由所述M-P与所述ChPV-P组成,还可由所述M-P、所述H5-P与所述ChPV-P组成。
上述成套试剂中,所述M-P、所述H5-P与所述ChPV-P均可独立包装。所述M-P的两条单链DNA均可独立包装。所述M-P的两条单链DNA的摩尔比可为1:1。所述H5-P的两条单链DNA均可独立包装。所述H5-P的两条单链DNA的摩尔比可为1:1。所述ChPV-P的两条单链DNA均可独立包装。所述ChPV-P的两条单链DNA的摩尔比可为1:1。
上述成套试剂中,所述M-P与所述ChPV-P可以单独使用分别进行单独的PCR,也可以组合使用进行二重PCR。这两种引物对单独使用时,本申请的检测或辅助检测禽流感病毒与鸡细小病毒的成套试剂中这两种引物对的配比没有要求。这两种引物对组合使用时,所述M-P与所述ChPV-P的摩尔比为2:5。
所述M-P、所述H5-P与所述ChPV-P可以单独使用分别进行单独的PCR,也可以组合使用进行三重PCR。这三种引物对单独使用时,本申请的检测或辅助检测禽流感病毒与鸡细小病毒的成套试剂中这三种引物对的配比没有要求。这三种引物对组合使用时,所述M-P、所述H5-P与所述ChPV-P的摩尔比为2:2:5。
为解决上述技术问题,本发明还提供了检测或辅助检测禽流感病毒的成套试剂。
本发明所提供的检测或辅助检测禽流感病毒的成套试剂,由所述M-P和所述H5-P组成。
为解决上述技术问题,本发明还提供了PCR引物对。
本发明所提供的PCR引物对,为所述M-P或所述H5-P或所述ChPV-P。
为解决上述技术问题,本发明还提供了下述R1-R5中的任一系统:
R1、检测或辅助检测禽流感病毒与鸡细小病毒的系统,包括所述M-P和所述ChPV-P;
R2、检测或辅助检测H5亚型禽流感病毒与鸡细小病毒的系统,包括所述M-P、所述H5-P和所述ChPV-P;
R3、检测或辅助检测禽流感病毒的系统,包括所述M-P;
R4、检测或辅助检测H5亚型禽流感病毒的系统,包括所述M-P和所述H5-P;
R5、检测或辅助检测鸡细小病毒的系统,包括所述ChPV-P。
上述各系统还均可包括DNA聚合酶。所述DNA聚合酶具体可为北京全式金生物技术有限公司的2×Easy Taq PCR Super Mix中DNA聚合酶。
上述各系统还均可包括进行PCR扩增的仪器。
上述系统中,R1所述系统可由所述M-P和所述ChPV-P与所述DNA聚合酶组成。R2所述系统可由所述M-P、所述H5-P和所述ChPV-P与所述DNA聚合酶组成。R3所述系统可由所述M-P与所述DNA聚合酶组成。R4所述系统可由所述M-P和所述H5-P与所述DNA聚合酶组成。R5所述系统可由所述ChPV-P与所述DNA聚合酶组成。
上述各系统均可为试剂或试剂盒。
为解决上述技术问题,本发明还提供了下述X1-X5中任一方法:
X1、非诊断目的的检测或辅助检测禽流感病毒与鸡细小病毒的方法,包括利用所述M-P和所述ChPV-P对待测样品进行PCR扩增,根据PCR产物确定所述待测样品是否含有禽流感病毒和鸡细小病毒:所述PCR产物含有655bp和225bp的DNA片段,所述待测样品含有或候选含有禽流感病毒和鸡细小病毒;所述PCR产物含有655bp的DNA片段且不含225bp的DNA片段,所述待测样品含有或候选含有禽流感病毒且不含或候选不含鸡细小病毒;所述PCR产物不含655bp的DNA片段且含有225bp的DNA片段,所述待测样品不含或候选不含禽流感病毒且含有或候选含有鸡细小病毒;所述PCR产物不含655bp和225bp的DNA片段,所述待测样品不含或候选不含禽流感病毒和鸡细小病毒;
X2、非诊断目的的检测或辅助检测H5亚型禽流感病毒与鸡细小病毒的方法,包括利用所述M-P、所述H5-P和所述ChPV-P对待测样品进行PCR扩增,根据PCR产物确定所述待测样品是否含有H5亚型禽流感病毒和鸡细小病毒:所述PCR产物含有655bp、327bp和225bp的DNA片段,所述待测样品含有或候选含有H5亚型禽流感病毒和鸡细小病毒;所述PCR产物含有655bp和327bp的DNA片段且不含225bp的DNA片段,所述待测样品含有或候选含有H5亚型禽流感病毒且不含或候选不含鸡细小病毒;所述PCR产物含有655bp和225bp的DNA片段且不含327bp的DNA片段,所述待测样品含有或候选含有非H5亚型禽流感病毒和鸡细小病毒;所述PCR产物含有655bp的DNA片段且不含327bp和225bp的DNA片段,所述待测样品含有或候选含有非H5亚型禽流感病毒且不含或候选不含鸡细小病毒;所述PCR产物含有225bp的DNA片段且不含655bp和225bp的DNA片段,所述待测样品含有或候选含有鸡细小病毒且不含或候选不含禽流感病毒;所述PCR产物不含655bp、327bp和225bp的DNA片段,所述待测样品不含或候选不含禽流感病毒和鸡细小病毒;
X3、非诊断目的的检测或辅助检测H5亚型禽流感病毒的方法,包括利用所述M-P和所述H5-P对待测样品进行PCR扩增,根据PCR产物确定所述待测样品是否含有禽流感病毒:所述PCR产物含有655bp和327bp的DNA片段,所述待测样品含有或候选含有H5亚型禽流感病毒;所述PCR产物含有655bp的DNA片段且不含327bp的DNA片段,所述待测样品含有或候选含有非H5亚型禽流感病毒;所述PCR产物不含655bp和327bp的DNA片段,所述待测样品不含或候选不含禽流感病毒;
X4、非诊断目的的检测或辅助检测禽流感病毒的方法的方法,包括利用所述M-P对待测样品进行PCR扩增,根据PCR产物确定所述待测样品是否含有禽流感病毒:所述PCR产物含有655bp的DNA片段,所述待测样品含有或候选含有禽流感病毒;所述PCR产物不含655bp的DNA片段,所述待测样品不含或候选不含禽流感病毒;
X5、非诊断目的的检测或辅助检测鸡细小病毒的方法,包括利用所述ChPV-P对待测样品进行PCR扩增,根据PCR产物确定所述待测样品是否含有鸡细小病毒:所述PCR产物含有225bp的DNA片段,所述待测样品含有或候选含有鸡细小病毒;所述PCR产物不含225bp的DNA片段,所述待测样品不含或候选不含鸡细小病毒。
所述PCR扩增的退火温度均可为55-58℃。所述PCR扩增的退火温度具体均可为55℃。所述PCR扩增的反应条件具体均可为:95℃预变性5min;94℃变性30s,55℃-58℃退火30s,72℃延伸1min,共32-35个循环;72℃延伸10min;4℃结束扩增。所述32-35个循环具体可为35、32、33或34个循环。所述退火温度可为55℃、56℃、57℃或58℃。
上述X1的方法中,所述利用所述M-P和所述ChPV-P对待测样品进行PCR扩增可为在同一个PCR扩增体系中,以所述待测样品的核酸(RNA或DNA)为模板,用所述M-P和所述ChPV-P进行PCR扩增得到PCR产物。所述PCR扩增体系中,所述M-P的两条单链DNA的浓度均可为0.1-0.5pmol/μL,如0.2pmol/μL。所述ChPV-P的两条单链DNA的浓度均可为0.3-0.7pmol/μL。所述ChPV-P的两条单链DNA的浓度具体均可为0.2-0.5pmol/μL,如0.5pmol/μL、0.4pmol/μL或0.3pmol/μL。所述PCR扩增体系具体可含有:2×Easy Taq PCR Super Mix(北京全式金生物技术有限公司);所述M-P的两条单链DNA;所述ChPV-P的两条单链DNA;所述待测样品,超纯水。
上述X2的方法中,所述利用所述M-P、所述H5-P和所述ChPV-P对待测样品进行PCR扩增可为在同一个PCR扩增体系中,以所述待测样品的核酸(RNA或DNA)为模板,用所述M-P、所述H5-P和所述ChPV-P进行PCR扩增得到PCR产物。所述PCR扩增体系中,所述M-P的两条单链DNA的浓度均可为0.1-0.5pmol/μL,如0.2pmol/μL。所述H5-P的两条单链DNA的浓度均可为0.1-0.5pmol/μL,如0.2pmol/μL。所述ChPV-P的两条单链DNA的浓度具体均可为0.2-0.5pmol/μL,如0.5pmol/μL、0.4pmol/μL或0.3pmol/μL。所述PCR扩增体系具体可含有:2×Easy Taq PCR Super Mix(北京全式金生物技术有限公司);所述M-P的两条单链DNA;所述H5-P的两条单链DNA;所述ChPV-P的两条单链DNA;所述待测样品,超纯水。
上述X3的方法中,所述利用所述M-P和所述H5-P对待测样品进行PCR扩增可为在同一个PCR扩增体系中,以所述待测样品的核酸(RNA或DNA)为模板,用所述M-P和所述H5-P进行PCR扩增得到PCR产物。所述PCR扩增体系中,所述M-P的两条单链DNA的浓度均可为0.1-0.5pmol/μL,如0.2pmol/μL。所述H5-P的两条单链DNA的浓度均可为0.1-0.5pmol/μL,如0.2pmol/μL。所述PCR扩增体系具体可含有:2×Easy Taq PCR Super Mix(北京全式金生物技术有限公司);所述M-P的两条单链DNA;所述H5-P的两条单链DNA;所述待测样品,超纯水。
上述X4的方法中,所述利用所述M-P对待测样品进行PCR扩增可为以所述待测样品的核酸(RNA或DNA)为模板,用所述M-P进行PCR扩增得到PCR产物。所述PCR扩增体系中,所述M-P的两条单链DNA的浓度均可为0.1-0.5pmol/μL,如0.2pmol/μL。所述PCR扩增体系具体可含有:2×Easy Taq PCR Super Mix(北京全式金生物技术有限公司);所述M-P的两条单链DNA;所述待测样品,超纯水。
上述X5的方法中,所述利用所述ChPV-P对待测样品进行PCR扩增可为以所述待测样品的核酸(RNA或DNA)为模板,用所述ChPV-P进行PCR扩增得到PCR产物。所述PCR扩增体系中,所述ChPV-P的两条单链DNA的浓度具体均可为0.2-0.5pmol/μL,如0.5pmol/μL、0.4pmol/μL或0.3pmol/μL。所述PCR扩增体系具体可含有:2×Easy Taq PCR Super Mix(北京全式金生物技术有限公司);所述ChPV-P的两条单链DNA;所述待测样品,超纯水。
为解决上述技术问题,本发明还提供了所述成套试剂或所述PCR引物对的制备方法。
本发明所提供的所述成套试剂或所述PCR引物对的制备方法,包括将各引物对的所述两条单链DNA分别单独包装。
为解决上述技术问题,本发明还提供了所述系统的制备方法。
本发明所提供的所述系统的制备方法,包括将各PCR引物对的所述两条单链DNA分别单独包装。
本发明中,655bp的DNA片段、327bp的DNA片段和225bp的DNA片段均可通过电泳进行检测。在电泳中,655bp的DNA片段可体现为在600-700bp间有一条带,327bp的DNA片段可体现为在300-400bp间有一条带,225bp的DNA片段可体现为在200-300bp间有一条带。
本发明提供了检测或辅助检测H5亚型禽流感病毒与鸡细小病毒的成套试剂,并通过优化反应条件,建立了能同时检测H5亚型禽流感病毒与鸡细小病毒二重PCR检测方法。实验证明,本发明的检测H5亚型禽流感病毒与鸡细小病毒的成套试剂与方法特异性好,既能够同时检测H5亚型AIV和ChPV,又能检测AIV、H5亚型AIV、ChPV,对其它常见的禽病病原体均未扩增出目的片段;敏感性高,检测AIV和H5亚型AIV的敏感性均为10pg,检测ChPV的敏感性为100fg;准确性好,对178份临床样品检测结果与利用现有技术中的方法进行检测的结果一致。本发明建立的检测或辅助检测H5亚型禽流感病毒与鸡细小病毒的成套试剂与方法具有特异性好、灵敏度高的特点,能够快速、便捷、直观地检测H5亚型禽流感病毒、禽流感病毒与鸡细小病毒,为同时检测这些病毒具有重要的临床意义,对禽流感病毒与鸡细小病毒以及H5亚型禽流感病毒的防制具有重大意义。
附图说明
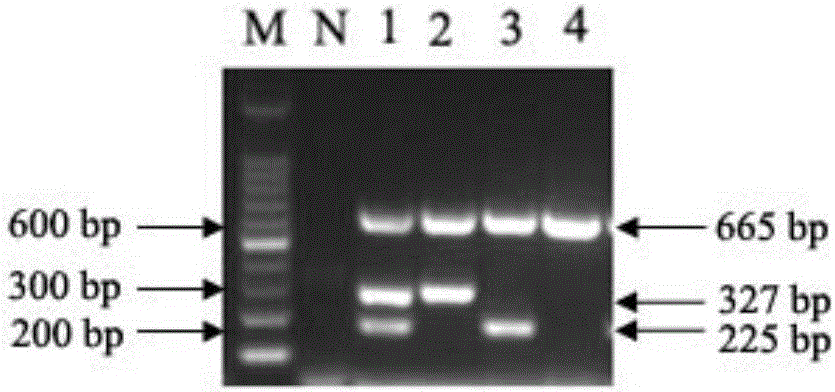
图1为三重PCR扩增结果。
图2为特异性检测结果。
图3为敏感性检测结果。
图4为临床样品检测结果。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。
下述实施例中的实验方法,如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂、仪器等,如无特殊说明,均可从商业途径得到。
以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
下述实施例中的H1N1亚型、H3N2亚型、H4N6亚型、H6N6亚型、H9N2亚型和H11亚型禽流感病毒(AIV)、新城疫病毒(NDV)、传染性支气管炎病毒(IBV)和鸡细小病毒(ChPV)公众可从申请人处获得;H5N2、H5N3、H5N7、H5N9、H7N2、H9N6、H14N5、H15N9和H16N3亚型禽流感病毒AIV灭活抗原经美国康涅狄格州大学禽病诊断研究室同意后,公众可从申请人处获得;H2N3、H8N4、H10N3、H12N5和H13N6亚型禽流感病毒AIV经香港大学同意后,公众可从申请人处获得。以上生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
H1N1亚型AIV:参考文献:Yi P,Xie Z,Liu J,et al.Visual detection of H3subtype avian influenza viruses by reverse transcription loop-mediated isothermal amplification assay[J].Virology Journal,2011,8(1):1-10.,H1N1亚型AIV在该参考文献中的名称为“A/Duck/Guangxi/030D/2009(H1N1)”。
H2N3亚型AIV:参考文献:Yi P,Xie Z,Liu J,et al.Visual detection of H3subtype avian influenza viruses by reverse transcription loop-mediated isothermal amplification assay[J].Virology Journal,2011,8(1):1-10.,H2N3亚型AIV在该参考文献中的名称为“A/Mallard/Alberta/77(H2N3)”。
H3N2亚型AIV:参考文献:Yi P,Xie Z,Liu J,et al.Visual detection of H3subtype avian influenza viruses by reverse transcription loop-mediated isothermal amplification assay[J].Virology Journal,2011,8(1):1-10.,H3N2亚型AIV在该参考文献中的名称为“A/Duck/Guangxi/N42/2009(H3N2)”。
H4N6亚型AIV:参考文献:Luo S,Xie Z,Xie L,et al.Reverse-transcription,loop-mediated isothermal amplification assay for the sensitive and rapid detection of H10 subtype avian influenza viruses[J].Virology Journal,2014,12(12):1-7.,H4N6亚型AIV在该参考文献中的名称为“A/Duck/Guangxi/070D/2010(H4N6)”。
H5N2亚型AIV:参考文献:Yi P,Xie Z,Liu J,et al.Visual detection of H3subtype avian influenza viruses by reverse transcription loop-mediated isothermal amplification assay[J].Virology Journal,2011,8(1):1-10.,H5N2亚型AIV在该参考文献中的名称为“A/Turkey/GA/209092/02(H5N2)”。
H5N3亚型AIV:参考文献:Luo S,Xie Z,Xie L,et al.Reverse-transcription,loop-mediated isothermal amplification assay for the sensitive and rapid detection of H10subtype avian influenza viruses[J].Virology Journal,2014,12(12):1-7.,H5N3亚型AIV在该参考文献中的名称为“A/Turkey/CA/35621/84(H5N3)”。
H5N7亚型AIV:参考文献:Yi P,Xie Z,Liu J,et al.Visual detection of H3subtype avian influenza viruses by reverse transcription loop-mediated isothermal amplification assay[J].Virology Journal,2011,8(1):1-10.,H5N7亚型AIV在该参考文献中的名称为“A/waterfowl/GA/269452-56/03(H5N7)”。
H5N9亚型AIV:参考文献:Yi P,Xie Z,Liu J,et al.Visual detection of H3subtype avian influenza viruses by reverse transcription loop-mediated isothermal amplification assay[J].Virology Journal,2011,8(1):1-10.,H5N9亚型AIV在该参考文献中的名称为“A/Turkey/WI/68(H5N9)”。
H6N6亚型AIV:参考文献:Luo S,Xie Z,Xie L,et al.Reverse-transcription,loop-mediated isothermal amplification assay for the sensitive and rapid detection of H10 subtype avian influenza viruses[J].Virology Journal,2014,12(12):1-7.,H6N6亚型AIV在该参考文献中的名称为“A/duck/Guangxi/GXd-4/2009(H6N6)”。
H7N2亚型AIV:参考文献:Luo S,Xie Z,Xie L,et al.Reverse-transcription,loop-mediated isothermal amplification assay for the sensitive and rapid detection of H10 subtype avian influenza viruses[J].Virology Journal,2014,12(12):1-7.,H7N2亚型AIV在该参考文献中的名称为“A/Chicken/NY/273874/03(H7N2)”。
H8N4亚型AIV:参考文献:Yi P,Xie Z,Liu J,et al.Visual detection of H3subtype avian influenza viruses by reverse transcription loop-mediated isothermal amplification assay[J].Virology Journal,2011,8(1):1-10.,H8N4亚型AIV在该参考文献中的名称为“A/Turkey/Ontario/6118/67(H8N4)”。
H9N2亚型AIV:参考文献:Yi P,Xie Z,Liu J,et al.Visual detection of H3subtype avian influenza viruses by reverse transcription loop-mediated isothermal amplification assay[J].Virology Journal,2011,8(1):1-10.,H9N2亚型AIV在该参考文献中的名称为“A/Duck/Guangxi/RX/09(H9N2)”。
H10N3亚型AIV:参考文献:Xie Z,Pang Y S,Liu J,et al.A multiplex RT-PCR for detection of type a influenza virus and differentiation of avian H5,H7and H9hemagglutinin subtypes[J].Mol Cell Probes,2006,20(3-4):245-249.,H10N3亚型AIV在该参考文献中的名称为“A/duck/HK/876/80(H10N3)”。
H11亚型AIV:参考文献:Yi P,Xie Z,Liu J,et al.Visual detection of H3subtype avian influenza viruses by reverse transcription loop-mediated isothermal amplification assay[J].Virology Journal,2011,8(1):1-10.,H11亚型AIV在该参考文献中的名称为“A/Chicken/Guangxi/43C/09(H11)”。
H12N5亚型AIV:参考文献:Yi P,Xie Z,Liu J,et al.Visual detection of H3subtype avian influenza viruses by reverse transcription loop-mediated isothermal amplification assay[J].Virology Journal,2011,8(1):1-10.,H12N5亚型AIV在该参考文献中的名称为“A/Duck/Alberta/60/76(H12N5)”。
H13N6亚型AIV:参考文献:Yi P,Xie Z,Liu J,et al.Visual detection of H3subtype avian influenza viruses by reverse transcription loop-mediated isothermal amplification assay[J].Virology Journal,2011,8(1):1-10.,H13N6亚型AIV在该参考文献中的名称为“A/Gull/MD/704/77(H13N6)”。
H14N5亚型AIV:参考文献:Luo S,Xie Z,Xie L,et al.Reverse-transcription,loop-mediated isothermal amplification assay for the sensitive and rapid detection of H10 subtype avian influenza viruses[J].Virology Journal,2014,12(12):1-7.,H14N5亚型AIV在该参考文献中的名称为“A/mallard duck/Astrakhan/263/1982(H14N5)”。
H15N9亚型AIV:参考文献:Luo S,Xie Z,Xie L,et al.Reverse-transcription,loop-mediated isothermal amplification assay for the sensitive and rapid detection of H10 subtype avian influenza viruses[J].Virology Journal,2014,12(12):1-7.,H15N9亚型AIV在该参考文献中的名称为“A/wedge-tailed shearwater/Western Australia/2576/1979(H15N9)”。
H16N3亚型AIV:参考文献:Luo S,Xie Z,Xie L,et al.Reverse-transcription,loop-mediated isothermal amplification assay for the sensitive and rapid detection of H10 subtype avian influenza viruses[J].Virology Journal,2014,12(12):1-7.,H16N3亚型AIV在该参考文献中的名称为"A/shorebird/Delaware/168/2006(H16N3)”。
新城疫病毒(NDV):参考文献:Yi P,Xie Z,Liu J,et al.Visual detection of H3subtype avian influenza viruses by reverse transcription loop-mediated isothermal amplification assay[J].Virology Journal,2011,8(1):1-10.,新城疫病毒(NDV)在该参考文献中的名称为“Newcastle disease virus(Lasota)”。
传染性支气管炎病毒(IBV):参考文献:Yi P,Xie Z,Liu J,et al.Visual detection of H3subtype avian influenza viruses by reverse transcription loop-mediated isothermal amplification assay[J].Virology Journal,2011,8(1):1-10.,传染性支气管炎病毒(IBV)在该参考文献中的名称为“Infectious bronchitis virus(M41)”。
鸡细小病毒(ChPV)GX-CH-PV-7和GX-Tu-PV-2:参考文献:Genetic and phylogenetic analysis of a novel parvovirus isolated from chickens in Guangxi,China[J].Arch Virol(2016)161:3285–3289.。
实施例1、检测或辅助检测H5亚型禽流感病毒与鸡细小病毒的成套试剂的制备
本发明所提供的检测或辅助检测H5亚型禽流感病毒与鸡细小病毒的成套试剂,由检测或辅助检测禽流感病毒的引物对M-P、检测或辅助检测H5亚型禽流感病毒的引物对H5-P和检测或辅助检测鸡细小病毒的引物对ChPV-P组成;M-P由序列表中SEQ ID No.1所示的单链DNA(M-F)和SEQ ID No.2所示的单链DNA(M-R)组成,M-P可从禽流感病毒中扩增出大小为655bp的条带;H5-P由序列表中SEQ ID No.3所示的单链DNA(H5-F)和SEQ ID No.4所示的单链DNA(H5-R)组成,H5-P可从H5亚型禽流感病毒中扩增出大小为327bp的条带;ChPV-P由序列表中SEQ ID No.5所示的单链DNA(ChPV-F)和SEQ ID No.6所示的单链DNA(ChPV-R)组成,ChPV-P可从鸡细小病毒中扩增出大小为225bp的条带。SEQ ID No.5中,Y为C或T,S为C或G。
上述成套试剂中,M-P、H5-P和ChPV-P均独立包装。每种引物对中的两条单链DNA的摩尔比均为1:1。
实施例2、检测或辅助检测H5亚型禽流感病毒与鸡细小病毒的成套试剂检测条件的优化
提取H5N2亚型AIV与H1N1亚型AIV的基因组RNA和鸡细小病毒(ChPV)的基因组DNA,并将对H5N2亚型AIV的基因组RNA进行反转录得到cDNA,检测或辅助检测禽流感病毒与鸡细小病毒的成套试剂的检测条件进行优化。
25μL三重PCR扩增体系:2×Easy Taq PCR Super Mix(北京全式金生物技术有限公司)12.5μL;M-F和M-R;H5-F和H5-R;ChPV-F和ChPV-R;模板(H5N2亚型AIV的基因组cDNA 1μL,鸡细小病毒(ChPV)的基因组DNA等体积混合)2μL,以超纯水补足25μL。
反应程序:95℃预变性5min;95℃变性30s,退火温度退火30s,72℃延伸1min,共35个循环;72℃延伸10min;4℃结束扩增。
1、引物浓度的优化
按照上述反应体系,调整H5-F和H5-R、M-F和M-R以及ChPV-F和ChPV-R在反应体系中的浓度,共有以下浓度:M-F和M-R浓度均为0.2pmol/μL、H5-F和H5-R浓度均为0.2pmol/μL、ChPV-F和ChPV-R浓度均为0.5pmol/μL;
M-F和M-R浓度均为0.2pmol/μL、H5-F和H5-R浓度均为0.2pmol/μL、ChPV-F和ChPV-R浓度均为0.2pmol/μL;
M-F和M-R浓度均为0.2pmol/μL、H5-F和H5-R浓度均为0.2pmol/μL、ChPV-F和ChPV-R浓度均为0.3pmol/μL;
M-F和M-R浓度均为0.2pmol/μL、H5-F和H5-R浓度均为0.2pmol/μL、ChPV-F和ChPV-R浓度均为0.4pmol/μL。
结果:当M-F和M-R浓度均为0.2pmol/μL、H5-F和H5-R浓度均为0.2pmol/μL、ChPV-F和ChPV-R浓度均为0.2pmol/μL时,AIV及H5亚型AIV出现两条清晰的目的条带,但ChPV的目的条带亮度比较暗,进一步推断ChPV-F和ChPV-R浓度低,因此逐步增加ChPV-F和ChPV-R浓度;当M-F和M-R浓度均为0.2pmol/μL、H5-F和H5-R浓度均为0.2pmol/μL、ChPV-F和ChPV-R浓度均为0.5pmol/μL时,出现三条清晰的目的条带。
2、退火温度的优化
按照上述反应程序,调整退火温度,共有以下退火温度:52℃、53℃、54℃、55℃、56℃、57℃、58℃。
结果:当退火温度为52℃、53℃、54℃时,PCR扩增产物的特异性低、背景深;当退火温度为56℃、57℃、58℃时,PCR扩增产物目的条带亮度较暗;当退火温度为55℃时,PCR扩增产物的目的条带清晰、特异性强。
3、扩增循环数的优化
按照上述反应程序,调整扩增循环数,共有以下扩增循环数:32、33、34、35、36。
结果:当扩增循环数在32、33、34时,PCR扩增产物目的条带亮度较暗;当扩增循环数在36时,出现非特异性扩增;当扩增循环数在35时,PCR扩增产物的目的条带清晰,且无非特异性扩增。
通过对引物浓度、扩增温度和扩增循环数的优化,最终确定三重PCR中最佳反应体系(25μL)为:2×Easy Taq PCR 12.5μL;M-F和M-R(25pmol/μL)各0.2μL;H5-F和H5-R(25pmol/μL)各0.2μL;ChPV-F和ChPV-R(25pmol/μL)各0.5μL;模板(H5N2亚型AIV的基因组cDNA和鸡细小病毒(ChPV)的基因组DNA等体积混合)2μL,以超纯水补足25μL。
三重PCR最佳扩增反应程序为:95℃预变性5min;95℃变性30s,55℃退火30s,72℃延伸1min,共35个循环;72℃延伸10min;4℃结束扩增。
利用最佳反应体系与最佳扩增反应程序对H5N2亚型AIV、H1N1亚型AIV和ChPV基因组核酸扩增,所用模板分别为H5N2亚型AIV的基因组cDNA和鸡细小病毒(ChPV)的基因组DNA等体积混合(图1中泳道1)、H5N2亚型AIV的基因组cDNA(图1中泳道2)、H1N1亚型AIV的基因组cDNA和鸡细小病毒(ChPV)的基因组DNA等体积混合(图1中泳道3)、H1N1亚型AIV的基因组cDNA(图1中泳道4),其结果与大小均与预期一致(图1)。图1中,M为DNA分子量标准;N为阴性对照(以水代替模板)。
实施例3、检测或辅助检测H5亚型禽流感病毒与鸡细小病毒的成套试剂的特异性
提取H1-H16AIV(H1N1亚型AIV、H2N3亚型AIV、H3N2亚型AIV、H4N6亚型AIV、H5N2亚型AIV、H5N3亚型AIV、H5N7亚型AIV、H5N9亚型AIV、H6N6亚型AIV、H7N2亚型AIV、H8N4亚型AIV、H9N2亚型AIV、H10N3亚型AIV、H11亚型AIV、H12N5亚型AIV、H13N6亚型AIV、H14N5亚型AIV、H15N9亚型AIV和H16N3亚型AIV)、新城疫病毒(NDV)以及传染性支气管炎病毒(IBV)的基因组RNA,并反转录得到cDNA,提取鸡细小病毒(ChPV)的基因组DNA,检测实施例1的成套试剂的特异性。
按照实施例2的最佳反应体系,将模板分别替换为模板1、模板2、模板3、模板4、H5N3亚型AIV、H5N9亚型AIV、H1N1亚型AIV、H2N3亚型AIV、H3N2亚型AIV、H4N6亚型AIV、H6N6亚型AIV、H7N2亚型AIV、H8N4亚型AIV、H9N2亚型AIV、H10N3亚型AIV、H11亚型AIV、H12N5亚型AIV、H13N6亚型AIV、H14N5亚型AIV、H15N9亚型AIV和H16N3亚型AIV基因组cDNA以及IBV基因组cDNA和NDV基因组cDNA,按照实施例2的最佳扩增反应程序进行三重PCR扩增,将得到的PCR扩增产物进行电泳,结果如图3所示。其中,模板1为H5N2亚型AIV基因组cDNA与ChPV基因组DNA 1等体积混合物,模板2为H5N7亚型AIV基因组cDNA与ChPV基因组DNA 1等体积混合物,模板3为H1N1亚型AIV基因组cDNA与ChPV基因组DNA 1等体积混合物,模板4为H1N1亚型AIV基因组cDNA与ChPV基因组DNA 2等体积混合物,ChPV基因组DNA 1为ChPV GX-CH-PV-7的基因组DNA,ChPV基因组DNA 2为ChPV GX-Tu-PV-2的基因组DNA。
图2中,M为DNA分子量标准;泳道1-4分别为模板1-4;泳道5-21分别为H5N3亚型AIV、H5N9亚型AIV、H1N1亚型AIV、H2N3亚型AIV、H3N2亚型AIV、H4N6亚型AIV、H6N6亚型AIV、H7N2亚型AIV、H8N4亚型AIV、H9N2亚型AIV、H10N3亚型AIV、H11亚型AIV、H12N5亚型AIV、H13N6亚型AIV、H14N5亚型AIV、H15N9亚型AIV和H16N3亚型AIV;泳道22为IBV;泳道23为NDV;泳道24为阴性对照(以水代替模板)。
结果显示,泳道1和2均含有大小分别为655bp、327bp和225bp的三条带;泳道3和4均含有大小分别为655bp和225bp的两条带;泳道5和6均含有大小分别为655bp和327bp的三条带;泳道7-21均只含有大小为655bp的条带;泳道22、23和24均不含有任何条带。表明本发明的成套试剂可用来检测禽流感病毒、H5亚型禽流感病毒与鸡细小病毒:PCR产物中若有655bp、327bp和225bp的条带,表明待测样品中含有H5亚型禽流感病毒与鸡细小病毒;PCR产物中若有655bp和225bp的条带且不含327bp的条带,表明待测样品中含有禽流感病毒与鸡细小病毒,且该禽流感病毒不为H5亚型;PCR产物中若有655bp和327bp的条带且不含225bp的条带,表明待测样品中含有H5亚型禽流感病毒、不含有鸡细小病毒;PCR产物中若含有655bp的条带且不含327bp和225bp的条带,表明待测样品中含有禽流感病毒、不含有鸡细小病毒,且该禽流感病毒不为H5亚型;PCR产物中若含有225bp的条带且不含655bp和327bp的条带,表明待测样品中含有鸡细小病毒、不含有禽流感病毒;PCR产物中若无655bp、327bp和225bp的任何条带,表明待测样品中不含有禽流感病毒与鸡细小病毒。该实验结果说明实施例1的成套试剂能特异性地检测禽流感病毒、H5亚型禽流感病毒与鸡细小病毒。
实施例4、检测或辅助检测H5亚型禽流感病毒与鸡细小病毒的成套试剂的敏感性
提取H5N2亚型AIV的基因组RNA,并反转录得到cDNA,提取鸡细小病毒(ChPV)的基因组DNA,将H5N2亚型AIV的基因组cDNA与鸡细小病毒(ChPV)的基因组DNA等量混合,得到H5N2亚型AIV cDNA与ChPV DNA浓度相同的混合物,将该混合用去离子水按10倍倍比稀释后作为模板,模板为以下模板A-F:模板A中H5N2亚型AIV cDNA与ChPV DNA浓度均为10ng/2μL,模板B中H5N2亚型AIV cDNA与ChPV DNA浓度均为1ng/2μL,模板C中H5N2亚型AIV cDNA与ChPV DNA浓度均为100pg/2μL,模板D中H5N2亚型AIV cDNA与ChPV DNA浓度均为10pg/2μL,模板E中H5N2亚型AIV cDNA与ChPV DNA浓度均为1pg/2μL,模板F中H5N2亚型AIV cDNA与ChPV DNA浓度均为100fg/2μL,检测实施例1的成套试剂的敏感性。其中,模板A中每微升H5N2亚型AIV cDNA的含量相当于5.24×106拷贝H5N2亚型AIV,ChPV DNA的含量相当于5.24×106拷贝ChPV;模板B中每微升H5N2亚型AIV cDNA的含量相当于5.24×105拷贝H5N2亚型AIV,ChPV DNA的含量相当于5.24×105拷贝ChPV;模板C中每微升H5N2亚型AIV cDNA的含量相当于5.24×104拷贝H5N2亚型AIV,ChPV DNA的含量相当于5.24×104拷贝ChPV;模板D中每微升H5N2亚型AIV cDNA的含量相当于5.24×103拷贝H5N2亚型AIV,ChPV DNA的含量相当于5.24×103拷贝ChPV;模板E中每微升H5N2亚型AIV cDNA的含量相当于5.24×102拷贝H5N2亚型AIV,ChPV DNA的含量相当于5.24×102拷贝ChPV;模板F中每微升H5N2亚型AIV cDNA的含量相当于52.4拷贝H5N2亚型AIV,ChPV DNA的含量相当于52.4拷贝ChPV。
按照实施例2的最佳反应体系,将模板分别替换为模板A-F,按照实施例2的最佳扩增反应程序进行三重PCR扩增,将得到的PCR扩增产物进行电泳,结果如图3所示。图3中,M为DNA分子量标准;泳道1-6分别为模板A-F;泳道7为阴性对照(以水代替模板)。
结果显示,对模板A-D进行扩增均可以扩增出大小分别为655bp、327bp和225bp的目的条带,对模板E和模板F进行扩增均可以扩增出大小为225bp的目的条带、不能得到655bp和327bp的目的条带,表明,实施例1的成套试剂检测H5亚型AIV的敏感性为10pg/25μL的AIV基因组cDNA,检测ChPV的敏感性为100fg/25μL的ChPV基因组DNA。
实施例5、利用检测或辅助检测H5亚型禽流感病毒与鸡细小病毒的成套试剂检测实际样品
1、样品采集
从活禽市场采集鸡口腔和泄殖腔棉拭子178份,分别用含有抗生素的PBS溶液(PBS溶液中青霉素的浓度为0.8万单位/mL,硫酸链霉素的浓度为1.0万单位/mL,庆大霉素的浓度为0.5mg/mL,制霉菌素的浓度为0.5mg/mL)充分浸泡棉拭子(约4小时),反复挤压和清洗棉拭子,8000rpm/min离心5min,得到178份棉拭子的上清液。
2、三重PCR检测禽流感病毒与鸡细小病毒
取步骤1的178份棉拭子的上清液(样品1-178),按照MiniBEST Viral RNA/DNA Extraction试剂盒说明书,分别提取并得到178份样品的核酸,对178份样品的核酸消化DNA后进行反转录,得到178份样品的cDNA,分别调整每份样品cDNA的浓度,使这178份样品的cDNA的浓度均为50ng/μL。对178份样品的核酸消化RNA后得到178份样品的基因组DNA,调整每份样品基因组DNA的浓度,使这178份样品的基因组DNA的浓度均为50ng/μL。
将同一样品编号的cDNA与基因组DNA等体积混合,作为模板,按照实施例2的最佳反应体系与最佳扩增反应程序进行PCR扩增,将得到的PCR扩增产物进行电泳,并将178份样品的PCR产物进行测序。重复检测3次以确保试验的准确性。利用实施例2中H5N2亚型AIV的基因组cDNA和ChPV的基因组DNA1等体积混合液及H5N7亚型AIV的基因组cDNA和ChPV的基因组DNA1等体积混合液作为阳性对照。
根据电泳结果统计,178份临床样品中,3份样品(标注样品1-3)均含有655bp与225bp的条带且不含有327bp的条带,表明样品1-3为非H5亚型AIV与ChPV混合感染样品,28份样品(标注样品4-31)含有655bp的条带、不含有327bp和225bp的条带,表明样品4-31为AIV感染样品,9份样品(标注样品32-40)不含有655bp和327bp的条带、含有225bp的条带,表明样品32-40为ChPV感染样品,剩余138份样品(标注样品41-178)不含有655bp、327bp与225bp的条带,表明样品41-178既不含禽流感病毒,也不含鸡细小病毒(表1);测序结果显示,上述样品的655bp的DNA片段的序列与AIV的目的片段的同源性均高达99%以上,上述样品的225bp的DNA片段的序列与ChPV的目的片段的同源性高达98%以上,表明所建立三重PCR具有较好的临床实用性。
部分临床样品检测结果如图4所示。图4中,M为DNA分子量标准;1为阴性对照(以水代替模板);2、10为阳性对照;泳道3、4、6、9、11、13、15和17为不含AIV和ChPV的样品的结果;泳道5、8、12和16为只含有AIV的样品的结果,且AIV均不为H5亚型;泳道7和14为只含有ChPV的样品的结果。
3、常规方法检测禽流感病毒与鸡细小病毒
按照如下病毒分离方法检测棉拭子的上清液中AIV:取步骤1的178份棉拭子的上清液(样品1-178)分别接种SPF鸡胚,收集24-96h致死的鸡胚尿囊液和96h以上未致死的鸡胚尿囊液,取尿囊液进行血凝试验。结果显示(表1),样品1-31具有血凝性,表明样品1-31含有禽流感病毒。
取有血凝价的样品(样品1-31)进行血凝抑制试验,确定感染的AIV的HA亚型(表1)。结果显示,样品1-31中的禽流感病毒的HA亚型均不为H5亚型。
同时对相同178份样品用L.Zsak等人《Partial genome sequence analysis of parvoviruses associated with enteric disease in poultry》文中引物(NS1F:5’-TATGATCTGTCAATGATTGACCAGCTGA-3’;NS2R:5’-GTACCACTCGAGAGGGTTCAGGGAGAT-3’)及反应条件(94℃预变性15min;94℃变性30s,55℃退火1min,68℃延伸3min,共33个循环;72℃延伸10min;4℃结束扩增)进行PCR扩增;PCR阳性产物送去上海Invitrogen公司进行序列鉴定。
结果显示,样品1-3与样品32-40均含有目的条带,用本发明的成套试剂进行检测ChPV结果与L.Zsak等人文献中检测ChPV的结果完全一致。
结果表明,用实施例1的成套试剂检测H5亚型禽流感病毒、禽流感病毒与鸡细小病毒结果与利用现有技术中的方法确定的H5亚型禽流感病毒、禽流感病毒与鸡细小病毒结果是完全一致的。因此,实施例1的成套试剂可以用来检测H5亚型禽流感病毒、禽流感病毒与鸡细小病毒。
表1、178份棉拭子中H5亚型禽流感病毒与鸡细小病毒的检测
对比例1、利用AIV对比引物和ChPV对比引物检测AIV和ChPV
利用表2中的引物对检测AIV和ChPV,模板均为实施例3中H1-H16AIV(H1N1亚型AIV、H2N3亚型AIV、H3N2亚型AIV、H4N6亚型AIV、H5N2亚型AIV、H6N6亚型AIV、H7N2亚型AIV、H8N4亚型AIV、H9N2亚型AIV、H10N3亚型AIV、H11亚型AIV、H12N5亚型AIV、H13N6亚型AIV、H14N5亚型AIV、H15N9亚型AIV和H16N3亚型AIV),ChPV基因组DNA 1、ChPV基因组DNA 2,进行PCR扩增,然后进行1.5%凝胶电泳。
PCR扩增的反应条件均为:95℃预变性5min;94℃变性30s,56℃退火30s,72℃延伸1min,共35个循环;72℃延伸10min;4℃结束扩增。
表2、AIV对比引物和ChPV对比引物
结果显示,引物对ChPV-F1与ChPV-R1以及引物对ChPV-F2与ChPV-R2对ChPV基因组DNA 1和ChPV基因组DNA 2进行扩增均未扩增出目的条带;引物对AIV-F1与AIV-R1对H8N4亚型AIV、H12N5亚型AIV、H13N6亚型AIV、H14N5亚型AIV、H15N9亚型AIV和H16N3亚型AIV进行扩增均未扩增出目的条带;引物对AIV-F2与AIV-R2只能对H1N1亚型AIV、H3N2亚型AIV、H4N6亚型AIV、H6N6亚型AIV和H9N2亚型AIV扩增出目的条带;引物对H5-F1与H5-R1对H5N2亚型AIV的扩增产物出现1条清晰的非目的条带;引物对H5-F2与H5-R2对H9N2亚型AIV的扩增产物出现1条清晰的目的条带。
<110> 广西壮族自治区兽医研究所
<120> 检测H5亚型禽流感病毒与鸡细小病毒的成套试剂与方法
<160> 6
<170> PatentIn version 3.5
<210> 1
<211> 23
<212> DNA
<213> 人工序列
<220>
<223>
<400> 1
cgtacgttct ctctatcatc ccg 23
<210> 2
<211> 23
<212> DNA
<213> 人工序列
<220>
<223>
<400> 2
gcactagagt taggatgagt ccc 23
<210> 3
<211> 21
<212> DNA
<213> 人工序列
<220>
<223>
<400> 3
tgggggattc accattccaa c 21
<210> 4
<211> 21
<212> DNA
<213> 人工序列
<220>
<223>
<400> 4
cgcccctatt ggagtttgac a 21
<210> 5
<211> 20
<212> DNA
<213> 人工序列
<220>
<223>
<400> 5
tggggagaay tagasggcat 20
<210> 6
<211> 19
<212> DNA
<213> 人工序列
<220>
<223>
<400> 6
cccggattca gaaccagta 19
- 还没有人留言评论。精彩留言会获得点赞!
- H9亚型禽流感病毒抗原偶联磁性微粒及其制备方法和应用与流程
- 抗H9亚型禽流感病毒的单克隆抗体、杂交瘤细胞株及其应用的制作方法与工艺
- 一种H5亚型禽流感病毒的增殖方法与流程
- 一种新的H5亚型禽流感卵黄抗体代替血清抗体监测的方法与流程
- 方便拆解的双驱动耦合模式的亚型猪流感检测装置的制作方法
- 一种包含疏水基片的亚型猪流感检测用微流控芯片装置的制作方法
- 一种联合检测禽流感H7N9和H9N2的四通道荧光定量PCR检测方法及试剂盒与流程
- 一种以杆状病毒为载体的H7N9亚型禽流感基因工程疫苗及其制备方法与应用与流程
- 一种联合检测H5亚型禽流感病毒与新城疫强毒的一步法实时荧光定量PCR试剂盒的制作方法与工艺
- 表达H7N9亚型禽流感病毒嵌合型血凝素蛋白的重组火鸡疱疹病毒株rHMW及构建方法与流程