禽流感病毒NA亚型多重探针组合荧光定量RT‑PCR分型方法与流程
本发明属于生物检测领域,具体涉及一种禽流感病毒NA亚型多重探针组合荧光定量RT-PCR分型方法。
背景技术:
禽流感病毒分为16个HA亚型和9个NA亚型,可组合成不同的HA和NA亚型,如H5N1,H5N2,H5N5,H5N5,H5N8等。NA亚型需要通过神经氨酸酶抑制试验来确定,也可以通过RT-PCR扩增后测序分型。前者需要特异性的NA抗血清,后者耗时较长,而且RT-PCR扩增后通常需要利用琼脂糖凝胶电泳显示出目的条带的大小,与预期产物大小相比较,得出结果,耗时较长;或者采用普通SYBR Green法,即通过每个组合中溶解曲线的TM值来判断阴阳性,再通过多个组合的结果间接判断出样品的NA亚型。这种SYBR Green方法相比与探针法,灵敏性和特异性要低的多。而且需多次不同组合的实验,才能最终判断出NA亚型,不能通过一次实验,迅速、直观的得出结果。因此需要建立一种快速的NA分型方法。
技术实现要素:
有鉴于此,本发明的第一目的在于提供一种禽流感病毒NA亚型RT-PCR单重检测引物组,所述禽流感病毒NA亚型RT-PCR单重检测引物组包括一对特异性引物对和一个荧光基团标记的探针。
优选地,本发明所述的禽流感病毒NA亚型RT-PCR单重检测引物组包括针对9种NA亚型N1~N9的9对特异性引物与带有荧光探针基团标记的探针,其中,所述特异性引物对与探针分别具有SEQ ID NO 1~27所示的序列。
即本发明的针对9种NA亚型N1~N9的9对特异性引物与带有荧光探针基团标记的探针分别为下表N1~N9所示(分别对应序列表SEQ ID NO 1~27):
兼并碱基:R=A/G,Y=C/T,S=G/C,H=A/C/T,V=A/G/C
本发明的另一目的在于提供禽流感病毒NA亚型RT-PCR多重检测引物组,所述禽流感病毒NA亚型RT-PCR多重检测引物组包括3组禽流感病毒NA亚型RT-PCR检测引物组,每组禽流感病毒NA亚型RT-PCR检测引物组包括一对特异性引物对和一个荧光基团标记的探针。
优选地,本发明所述的禽流感病毒NA亚型RT-PCR多重检测引物组,包括针对9种NA亚型N1~N9的9对特异性引物与带有荧光探针基团标记的探针,其中,所述特异性引物对与探针分别具有SEQ ID NO 1~27所示的序列。
优选地,本发明所述的禽流感病毒NA亚型RT-PCR多重检测引物组,包括三组所述禽流感病毒NA亚型RT-PCR单重检测引物组。
优选地,本发明所述的禽流感病毒NA亚型RT-PCR多重检测引物组中,第一组禽流感病毒NA亚型RT-PCR单重检测引物组包括基因型N1、N4与N5禽流感病毒NA亚型RT-PCR单重检测引物组;第二组禽流感病毒NA亚型RT-PCR单重检测引物组包括基因型N3、N2与N6禽流感病毒NA亚型RT-PCR单重检测引物组;第三组禽流感病毒NA亚型RT-PCR单重检测引物组包括基因型N7、N9与N8禽流感病毒NA亚型RT-PCR单重检测引物组,分别为下表2所示:
兼并碱基:R=A/G,Y=C/T,S=G/C,H=A/C/T,V=A/G/C
本发明还提供了一种禽流感病毒NA亚型RT-PCR多重检测试剂盒,包括反转录试剂、PCR试剂、超纯水,其中,所述PCR试剂中包括如上所述的禽流感病毒NA亚型RT-PCR多重检测引物组;
优选地,本发明所述的禽流感病毒NA亚型RT-PCR多重检测试剂盒中,所述PCR试剂中的禽流感病毒NA亚型RT-PCR多重检测引物组配制为:
优选地,本发明所述的禽流感病毒NA亚型RT-PCR多重检测试剂盒中,所述PCR试剂为25μl,分别为Taqprobe 2×qPCR MasterMix 12.5μl,上下游引物(0.4μmol/L)各1μl,探针(0.4μmol/L)1μl,模板cDNA 2μl,加水至25μl。
优选地,本发明所述的禽流感病毒NA亚型RT-PCR多重检测试剂盒中,所述PCR反应条件为95℃10min,95℃15s,60℃20s,扩增40个循环,在60℃结束开始收集荧光信号。
本发明还提供了上述禽流感病毒NA亚型RT-PCR单重检测引物组、禽流感病毒NA亚型RT-PCR多重检测引物组、禽流感病毒NA亚型RT-PCR多重检测试剂盒在鉴别禽流感病毒中的应用。
由上可见,本发明至少有以下优点:
1、本发明针对9个NA亚型设计了Taqman探针,显著提高了检测的特异性;
2、本发明建立了3个多重探针荧光定量组合RT-PCR体系,每个体系中的各个成分互不干扰,且都能特异地检测出3个不同NA亚型。
3、本发明只需要同时进行3个体系的荧光定量PCR,根据CT值就能直接判断出NA亚型,实验流程更加省时、方便,实验结果更加直观、可信。
附图说明
图1为本发明实验设计流程图;
图2为普通RT-PCR特异性试验;
图3为9个单重探针法荧光定量PCR体系扩增曲线;
图4为多重探针荧光定量PCR灵敏度检验结果。
具体实施方式
如图1所示,在本发明的一个实施例中给出了本发明实验设计流程图。
以下通过具体实施例进一步对本发明的技术方案进行说明,应理解以下仅为本发明的示例性说明,并不用于限制本发明权利要求的保护范围。
实施例1禽流感病毒NA亚型RT-PCR多重检测
(1)引物的设计
根据实验目的,选择了流行的禽流感病毒9种不同NA的基因序列,包括不同动物源性和不同年代的毒株序列。再通过每个NA亚型序列同源性的比较,选取其保守序列,设计型特异性引物和不同荧光基团标记的探针。引物、探针序列及产物大小如表1:
表1 9种AIV NA亚型分型引物和探针
兼并碱基:R=A/G,Y=C/T,S=G/C.,H=A/C/T,V=A/G/C
(2)病毒核酸的提取
1、加入20μl Proteinase K于一个无菌的1.5ml离心管中。
2、样品为鸡胚尿囊液,来自于临床分离得到的阳性禽流感病毒,经过鸡胚传代后由实验室冻存的禽流感病毒尿囊液。
在离心管中加入200μl样品。(注意:如果样品量不足200μl,用PBS或0.9%NaCl补充)
3、加入200μl Binding Buffer 5(包含5.6μg Carrier RNA(购自北京全式金公司,EasyPure Viral DNA/RNA Kit,货号为ER201),漩涡混合15min,室温放置5min。
4、56℃孵育15min。
5、加入250μl无水乙醇(此时可能会出现絮状沉淀),涡旋混合15s,室温放置5min。
6、将溶液和沉淀一起加入离心柱中,12000×g离心1min,弃掉流出液。
7、加入500μl Wash Buffer 5 12000×g离心1min,弃掉流出液。
8、重复步骤7一次。
9、室温12000×g离心1min,彻底去除残留的乙醇,在室温静置数分钟彻底晾干离心柱。
10、将离心柱转入一个新1.5ml RNase-free的离心管中,并向离心柱中央加20~50μl RNase-free Water,室温静置1min。
11、室温12000×g离心1min,洗脱RNA。
12、将RNA置于-80℃保存。
13、RNA反转录
RNA反转录使用诺唯赞生物公司的HiScript Reverse Transcriptase试剂盒。
反应体系如下:2μl 5×qRT SuperMix(包括Buffer、dNTP、HiScipt、Reverse Trancriptase、RNase inhibitor、Random primers/Oligo dT Primer mix),模板RNA(Total RNA)1pg~500ng,加入RNase free ddH2O至10μl。反应程序:25℃10min,50℃30min,85℃5min。得到的cDNA可立即用于PCR反应,或在-20℃保存。
(3)普通RT-PCR验证引物的特异性
取1μl上述获得的cDNA作为模板进行PCR扩增,体系如下:12.5μl 2×Taq Plus Master Mix,引物F、R各1μl(0.4μmol/L),加入ddH2O至25μl。反应程序:预变性温度为94℃5min,然后按94℃30s,55℃30s,72℃30s,进行35个循环,最后72℃延伸10min。
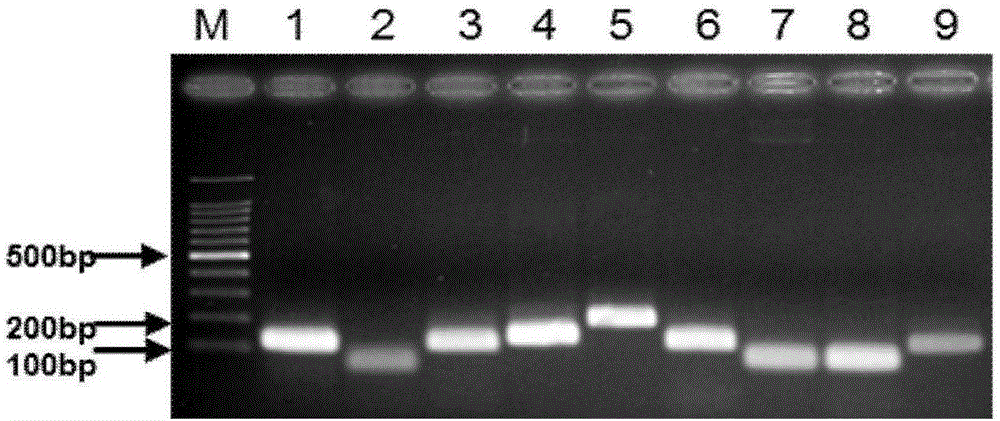
取PCR扩增产物10μl,点样于1.5%琼脂糖凝胶(含0.5μg/mL溴化乙锭),以100bp Ladder marker作为标准参照,电泳后可见普通RT-PCR检测N1~N9流感毒株均出现100bp-200bp左右的型特异条带,目的条带大小正确。结果表明设计的针对各个NA亚型的引物具有良好的特异性,结果见图2,其中M:100bp Marker;1:N1 AIV;2:N2 AIV;3:N3 AIV;4:N4 AIV;5:N5 AIV;6:N6 AIV;7:N7 AIV;8:N8 AIV;9:N9 AIV.。
(4)单重探针荧光定量PCR体系的建立
本实验所采用的荧光定量PCR反应体系为25μl,分别为Taq probe 2×qPCR MasterMix 12.5μl(镇江爱必梦生物技术有限公司,货号:MasterMix-ps),按照表1中的探针和引物进行反应,上下游引物(0.4μmol/L)各1μl,探针(0.4μmol/L)1μl,模板cDNA 2μl,加水至25μl。LightCycler Nano(Roche)实时荧光定量PCR仪反应参数:95℃10min,95℃15s,60℃20s,扩增40个循环,在60℃结束开始收集荧光信号。单重探针荧光定量PCR体系扩增曲线见图3(a~i),其中图3a~图3i分别为引物组N1~N9PCR体系扩增曲线。
结果表明,9个单重探针法荧光定量PCR体系具有良好的特异性、灵敏性和重复性。
(5)3个多重探针荧光定量体系的建立及优化
根据已经建立好的单重探针法荧光定量PCR体系和3种不同荧光基团,将9个体系分成3组,每个组中包含3种不同荧光基团标记的探针。经过反复摸索,最终确定3个组合,见表3:
表3 3个多重探针荧光定量体系
(6)多重探针荧光定量PCR特异性检验结果
尿囊液样本来自于临床分离得到的阳性禽流感病毒,经过鸡胚传代后由实验室冻存的禽流感病毒尿囊液,其他几种禽类病原体如禽传染性支气管炎病毒(IBV),传染性法氏囊病病毒(IBDV),新城疫病毒(NDV,Lasota毒株)和细菌菌株(沙门氏菌和大肠杆菌)作为对照。其中禽流感病毒的NA 基因已经经过基因测序确定其NA亚型。使用全式金公司的EasyPure Viral DNA/RNA Kit提取尿囊液样本中的病毒核酸,提取20个N1 AIV阳性样本,30个N2 AIV阳性样本,5个N3 AIV阳性样本,2个N4 AIV阳性样本,2个N5 AIV阳性样本,20个N6 AIV阳性样本,2个N7 AIV阳性样本,30个N8 AIV阳性样本,20个N9 AIV阳性样本和其他禽类病原体核酸。使用特异性引物与Taq Man探针,完成多重荧光定量RT-PCR实验。结果表明,本方法具有良好的特异性,各个NA亚型均鉴定正确,且无交叉反应,其他禽类病原体均未被检测出,结果见表4。
表4 多重荧光定量PCR特异性试验结果
(7)多重探针荧光定量PCR灵敏度检验结果
本方法是用不同EID50的尿囊液提取核酸,进行多重荧光定量PT-PCR灵敏度试验,从而得到用该方法能检测出的最低EID50。灵敏度检验结果见表5,灵敏度检验扩增图见图4,表明该方法对不同亚型禽流感病毒具有较高的灵敏度。
表5多重荧光定量PCR灵敏度试验结果
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
SEQUENCE LISTING
<110> 扬州大学
<120> 禽流感病毒NA亚型多重探针组合荧光定量RT-PCR分型方法
<160> 27
<170> PatentIn version 3.5
<210> 1
<211> 22
<212> DNA
<213> 人工序列
<400> 1
tgtgtgtgca grgayaaytg sc 22
<210> 2
<211> 24
<212> DNA
<213> 人工序列
<400> 2
ggaccrcaac tscctgthcc rtcv 24
<210> 3
<211> 29
<212> DNA
<213> 人工序列
<400> 3
ccacgcccca atgatggaac aggcagttg 29
<210> 4
<211> 25
<212> DNA
<213> 人工序列
<400> 4
acgagttggg tgtcccgttt cattt 25
<210> 5
<211> 25
<212> DNA
<213> 人工序列
<400> 5
ttctatcatc cccagtgaca caaac 25
<210> 6
<211> 31
<212> DNA
<213> 人工序列
<400> 6
tgggaaccaa acaagtgtgc atagcatggt c 31
<210> 7
<211> 21
<212> DNA
<213> 人工序列
<400> 7
agcagttgct tcgatggaaa g 21
<210> 8
<211> 25
<212> DNA
<213> 人工序列
<400> 8
cattgacatt cagactcttg agttc 25
<210> 9
<211> 29
<212> DNA
<213> 人工序列
<400> 9
atgaccggga acgacaatga tgcgagtgg 29
<210> 10
<211> 25
<212> DNA
<213> 人工序列
<400> 10
atggtgtttg gatagggagg acaaa 25
<210> 11
<211> 25
<212> DNA
<213> 人工序列
<400> 11
caccatttga atccttgtct gtcga 25
<210> 12
<211> 32
<212> DNA
<213> 人工序列
<400> 12
agcttggaat ccagaagcgg ttttgagatg gt 32
<210> 13
<211> 25
<212> DNA
<213> 人工序列
<400> 13
agaacacaag agtcttcgtg tgttt 25
<210> 14
<211> 25
<212> DNA
<213> 人工序列
<400> 14
tgggataaca ggaacattct tcaat 25
<210> 15
<211> 31
<212> DNA
<213> 人工序列
<400> 15
agagtgttat tgggtaatga cggacggtcc a 31
<210> 16
<211> 25
<212> DNA
<213> 人工序列
<400> 16
aagggtgcag gatgtttgct ctaag 25
<210> 17
<211> 25
<212> DNA
<213> 人工序列
<400> 17
cctagtatta tatggactgg gtgct 25
<210> 18
<211> 32
<212> DNA
<213> 人工序列
<400> 18
aaggcacaac actcagaggg cgacatgcaa at 32
<210> 19
<211> 25
<212> DNA
<213> 人工序列
<400> 19
actcaggagt cagaatgtgt atgcc 25
<210> 20
<211> 25
<212> DNA
<213> 人工序列
<400> 20
tcaatatgtt tggctgatcc cttta 25
<210> 21
<211> 30
<212> DNA
<213> 人工序列
<400> 21
tggcacatgt gcagttgtaa tgactgacgg 30
<210> 22
<211> 25
<212> DNA
<213> 人工序列
<400> 22
aagaagtgga tgacgattgg tgtaa 25
<210> 23
<211> 25
<212> DNA
<213> 人工序列
<400> 23
agtccttaat atatctcctg cccag 25
<210> 24
<211> 30
<212> DNA
<213> 人工序列
<400> 24
cagggccaga ttctaaagca gtagcagtag 30
<210> 25
<211> 20
<212> DNA
<213> 人工序列
<400> 25
gccctgataa gctggccact 20
<210> 26
<211> 25
<212> DNA
<213> 人工序列
<400> 26
tgcattgttg tttggtcctg atata 25
<210> 27
<211> 30
<212> DNA
<213> 人工序列
<400> 27
atcaccgccc acagtgtaca acagcagggt 30
- 还没有人留言评论。精彩留言会获得点赞!
- Mgb探针多重荧光定量pcr检测大肠杆菌o157的方法
- 检测食品沙门氏菌的Taqman探针荧光定量PCR方法
- 猪源衣原体Taqman-MGB探针实时荧光定量PCR检测用引物、试剂盒和检测方法
- 流产嗜衣原体Taqman-MGB探针实时荧光定量PCR检测用引物、试剂盒和检测方法
- 家畜衣原体Taqman-MGB探针实时荧光定量PCR检测用引物、试剂盒和方法
- 用于猪细小病毒5型实时荧光定量pcr方法的引物及探针的制作方法
- 绵羊痘病毒Taqman-MGB探针实时荧光定量PCR检测用引物、试剂盒和检测方法
- 山羊痘病毒Taqman-MGB探针实时荧光定量PCR检测用引物、试剂盒和检测方法
- 猪细环病毒ii型检测的引物、探针及实时荧光pcr检测方法
- 基于AllGlo探针荧光定量PCR的microRNA检测试剂盒及其检测方法
- 猪源衣原体Taqman-MGB探针实时荧光定量PCR检测用引物、试剂盒和检测方法
- 流产嗜衣原体Taqman-MGB探针实时荧光定量PCR检测用引物、试剂盒和检测方法
- 家畜衣原体Taqman-MGB探针实时荧光定量PCR检测用引物、试剂盒和方法
- 微小隐孢子虫的检测方法及检测试剂盒的制作方法
- 绵羊痘病毒Taqman-MGB探针实时荧光定量PCR检测用引物、试剂盒和检测方法
- 山羊痘病毒Taqman-MGB探针实时荧光定量PCR检测用引物、试剂盒和检测方法
- 基于AllGlo探针荧光定量PCR的microRNA检测试剂盒及其检测方法
- 基于AllGlo探针荧光定量PCR的hsa-miR-625-5p检测试剂盒及其检测方法
- 基于AllGlo探针荧光定量PCR的hsa-miR-629-5p检测试剂盒及其检测方法
- 基于AllGlo探针荧光定量PCR的hsa-miR-646检测试剂盒及其检测方法
- H9亚型禽流感病毒抗原偶联磁性微粒及其制备方法和应用与流程
- 抗H9亚型禽流感病毒的单克隆抗体、杂交瘤细胞株及其应用的制作方法与工艺
- 一种H5亚型禽流感病毒的增殖方法与流程
- 一种新的H5亚型禽流感卵黄抗体代替血清抗体监测的方法与流程
- 方便拆解的双驱动耦合模式的亚型猪流感检测装置的制作方法
- 一种包含疏水基片的亚型猪流感检测用微流控芯片装置的制作方法
- 一种联合检测禽流感H7N9和H9N2的四通道荧光定量PCR检测方法及试剂盒与流程
- 一种以杆状病毒为载体的H7N9亚型禽流感基因工程疫苗及其制备方法与应用与流程
- 一种联合检测H5亚型禽流感病毒与新城疫强毒的一步法实时荧光定量PCR试剂盒的制作方法与工艺
- 表达H7N9亚型禽流感病毒嵌合型血凝素蛋白的重组火鸡疱疹病毒株rHMW及构建方法与流程