一种检测牛副流感病毒3型抗体的间接竞争酶联适配体方法与流程
本发明属于生物工程领域,具体涉及一种检测牛副流感病毒3型抗体的间接竞争酶联适配体方法。
背景技术:
牛副流感病毒3型(BPIV-3)是副黏病毒科、呼吸道病毒属的成员,能引起牛和其他反刍动物的呼吸道疾病综合征(BRDC)。牛在运输及处于其他应激环境时容易发生感染,表现出发热和严重的鼻腔分泌物,甚至引发肺炎,是引起舍饲牛发病和死亡的主要原因,给养牛业造成了巨大的经济损失。该病在世界范围内广泛流行,我国多数省份也严重流行。据王海勇对临床千余份牛血清样品的检测结果显示我国牛群BPIV-3抗体总体阳性率为77.6%,说明我国牛群已经普遍感染BPIV。目前尚无治疗BPIV3感染的有效药物。随着集约化饲养模式的迅速发展,牛呼吸道疾病综合征的发病率也在不断升高,控制BPIV-3感染、及时诊断,降低发病率成为目前亟待解决的问题。目前,该病的初步诊断依赖于血清学方法,确诊需要进行病原分离和鉴定。常用的血清学方法主要基于病毒中和试验、荧光抗体试验、血凝抑制试验等。病毒中和试验和荧光抗体试验操作复杂、耗时,不适于大规范样品快速诊断;血凝抑制试验虽然操作简单,但需要在对病毒进行增殖的前提下,以BPIV-3病毒粒子为抗原进行检测,不但耗时而且要求实验室条件较高。因此,寻找快速、灵敏、可靠的诊断方法,对BPIV-3感染的控制及治疗至关重要。
核酸适配体可与靶物质以类似抗原-抗体的方式特异性结合,发挥生物学效应,是一种新兴的具有识别功能的分子。适配体与抗体均具有结合靶物质的功能,相比下来适配体具有分子量小、易于合成、筛选简便、修饰多样、亲和力高、稳定性强等优点。适配体的大部分应用也是从抗体应用衍生而来,如光学适配体生物传感器、质量灵敏传感器、电化学适配生传感器、酶联适配体学说、纳米材料传感器等。目前,核酸适配体已广泛应用于化学分析与检测、临床诊断与治疗及药学等研究领域。最近几年来,各种新型适配体检测平台和适配体治疗药物层出不穷。核酸适配体抗肿瘤药物AS1411、具有凝血作用的核酸适配体ARC183、针对金黄色葡萄球菌外毒素B(SEB)的适配体等已经到临床应用阶段。在兽医学研究领域,结果显示以核酸适配体建立的酶联适配体方法具有很高的特异性和敏感性。为了获得优良的牛副流感病毒3型抗体检测方法,我们应用前期研究筛选获得的HN蛋白核酸适配体,优化各步骤反应条件,建立了间接竞争酶联适配体方法。
技术实现要素:
本发明的目的是为了解决现有技术的不足,而提供一种检测牛副流感病毒3型抗体的间接竞争酶联适配体方法,该方法具有良好的特异性,与商品化ELISA试剂盒相比,Ic-ELAA具有更高的阳性检出率,更适合进行临床牛副流感疾病的血清学调查。
本发明采用如下技术方案:
检测牛副流感病毒3型抗体的间接竞争酶联适配体方法,包括如下步骤:
步骤一,包被:确定HN蛋白包被浓度,吸取HN蛋白溶液包被于ELISA微孔板中,过夜;
步骤二,洗板:甩去包被液,用HEPEST洗涤微孔板三次,甩干;
步骤三,封闭:确定封闭液,向微孔中加入封闭液,37℃孵育2h;
步骤四,加核酸适配体和牛血清:确定核酸适配体Bio-WC-2浓度,并确定牛血清的稀释倍数;甩去封闭液,用HEPEST洗涤三次,甩干,同时将Bio-WC-2和牛血清加入到封闭好的微孔中,孵育;
步骤五,洗板:甩去核酸适配体和牛血清,用HEPEST洗涤微孔板三次,甩干;
步骤六,加二抗:确定二抗的稀释度,向微孔中加入稀释的HRP-SA,孵育;
步骤七,显色:甩去二抗,用HEPEST洗涤微孔板四次,拍干孔中残留的洗涤液,将显色液A、显色液B等体积混合,吸取显色液加入到微孔中,显色;
步骤八,终止:每孔加入终止液终止显色;
步骤九,读数:使用自动酶标检测仪读取每孔在450nm波长处生物吸光度值(OD);
步骤十,阴阳性临界值的确定;
步骤十一,Ic-ELAA方法特异性检测;
步骤十二,临床牛血清检测。
更进一步地,所述的检测牛副流感病毒3型抗体的间接竞争酶联适配体方法,包括如下步骤:步骤一,包被:吸取浓度为80ug/mL的HN蛋白溶液包被于96孔ELISA微孔板中,4℃过夜;
步骤二,洗板:甩去包被液,用300μL HEPEST洗涤微孔板三次,甩干,其中所述HEPEST为含0.05%Tween 20的HEPES;
步骤三,封闭:向微孔中加入200μL含1%BSA的HEPES液,37℃孵育2h;
步骤四,加核酸适配体和牛血清:确定核酸适配体Bio-WC-2浓度,并确定牛血清的稀释倍数;甩去封闭液,用HEPEST洗涤三次,甩干,同时将50μL浓度为100nM的Bio-WC-2和50μL牛血清原液加入到封闭好的微孔中,37℃孵育1h;
步骤五,洗板:甩去核酸适配体和牛血清,用300μL HEPEST洗涤微孔板三次,甩干,其中所述HEPEST为含0.05%Tween 20的HEPES;
步骤六,加二抗:向微孔中加入100μL 1:6000稀释的HRP-SA,37℃孵育1h;
步骤七,显色:甩去二抗,用300μL HEPEST洗涤微孔板四次,拍干孔中残留的洗涤液,将显色液A、显色液B等体积混合,吸取100μL显色液加入到微孔中,37℃显色10min;
步骤八,终止:每孔加入50μL终止液(2M H2SO4)终止显色;
步骤九,读数:使用自动酶标检测仪读取每孔在450nm波长处生物吸光度值(OD);
步骤十,阴阳性临界值的确定;
步骤十一,Ic-ELAA方法特异性检测;
步骤十二,临床牛血清检测。
更进一步地,步骤一中所述HN蛋白包被浓度和步骤四中所述Bio-WC-2浓度的确定具体如下:将不同浓度的HN蛋白(10ug/mL、20ug/mL、40ug/mL、80ug/mL和160ug/mL)与不同适配体Bio-WC-2浓度(200nM、100nM、50nM)建立棋盘方阵进行I-ELAA试验,用酶标仪检测各孔OD450值,通过计算Positive/Negative值来确定HN蛋白包被浓度和核酸适配体Bio-WC-2浓度,确定标准为P/N比值最高且阳性OD450值在1.0左右,实验程序同Ic-ELAA类似,区别是一抗为100μL Bio-WC-2,不加牛血清;HN蛋白包被条件为4℃过夜。
更进一步地,步骤三中所述封闭液的确定具体如下:将80ug/mL的HN蛋白包被酶标板,4℃包被过夜,洗涤,分别加入不同封闭液5%脱脂奶、10%脱脂奶、1%BSA、3%BSA或10%马血清,进行I-ELAA试验,用酶标仪检测各孔OD450值,通过计算P/N值来确定封闭液。
更进一步地,步骤六中所述二抗稀释度的确定具体如下:将80ug/mL的HN蛋白包被酶标板,4℃包被过夜,1%BSA封闭并洗涤,加入100μL浓度为50nM的适配体Bio-WC-2,二抗HRP-SA按1:2000、1:4000、1:6000、1:8000倍比稀释进行I-ELAA试验,用酶标仪检测各孔OD450值,通过计算P/N值来确定封闭液。
更进一步地,步骤四中所述牛血清稀释倍数的确定具体为:将80ug/mL的HN蛋白包被酶标板,4℃包被过夜后进行Ic-ELAA试验,血清为已被证实的强阳性和阴性牛血清,分别做1:1、1:2、1:5、1:10倍稀释,加入50μL浓度为100nM的Bio-WC-2和50μL不同稀释倍数的牛血清,测定OD450值,通过公式:PI(%)=(1-样本OD450/适配体对照OD450)×100%,计算PI值,由PI值的高低确定牛血清释释倍数。
更进一步地,步骤十中所述阴阳性临界值的确定具体为:使用20份临床采集的牛副流感阴性血清进行Ic-ELAA试验,计算PI平均值,通过公式:PICut-off=PI平均值+2×方差(SD)计算阴、阳性临界值,同时使用20份牛副流感阳性血清检验阴、阳性临界值。
更进一步地,步骤十一中所述建立的Ic-ELAA方法特异性检测具体为:用所述Ic-ELAA方法分别检测牛呼吸道合胞体病毒、牛冠状病毒、牛传染性支气管炎病毒感染牛的阳性血清。
更进一步地,步骤十二中所述临床牛血清检测具体为:选取50份临床牛血清样本,使用所述Ic-ELAA方法和商品化的BPIV3ELISA试剂盒进行检测,并对检测结果进行比较分析。
更进一步地,所述核酸适配体Bio-WC-2的序列如SEQ ID NO.1所示。
与现有技术相比,本发明的有益效果:
本发明应用前期研究筛选获得的HN蛋白核酸适配体,优化了蛋白包被浓度、适配体浓度、包被液、牛血清稀释倍数及二抗稀释度等各步骤反应条件,建立了检测牛副流感病毒3型抗体的间接竞争酶联适配体方法。该方法具有良好的特异性,与商品化ELISA试剂盒相比,Ic-ELAA方法具有更高的阳性检出率,更适合进行临床牛副流感疾病的血清学调查,及时诊断、隔离饲养阳性牛,减少由于呼吸道疾病的发生造成的经济损失。同时本发明建立的Ic-ELAA方法为进一步研发Ic-ELAA试剂盒和疫苗提供了物质和技术保障。
附图说明
图1为40份阴性血清和阳性血清抑制率分布图;
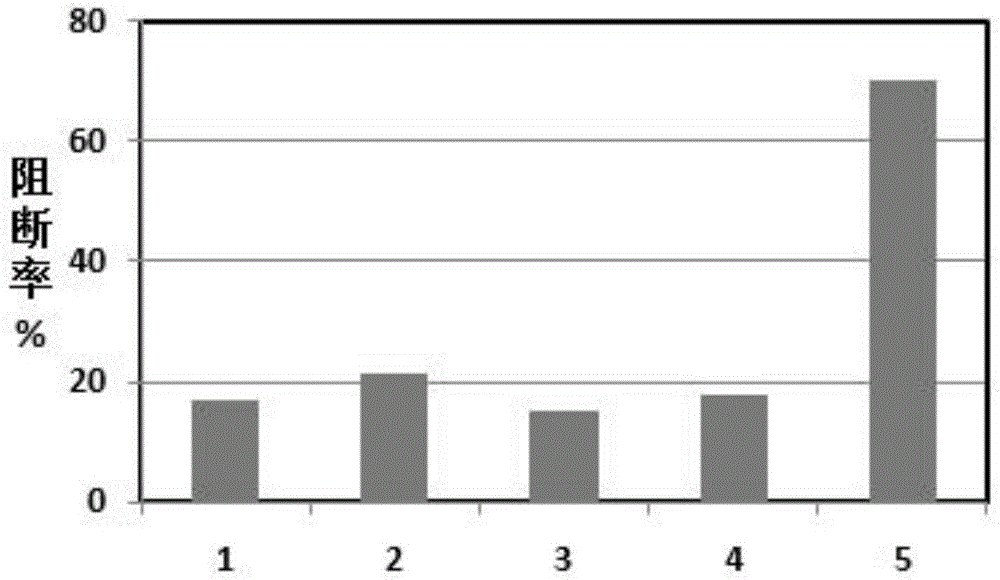
图2为Ic-ELAA检测不同病原抗血清,其中横坐标1-5分别代表牛呼吸道合胞体病毒、牛冠状病毒、牛传染性支气管炎病毒抗血清、牛副流感阴性血清和牛副流感阳性血清。
具体实施方式
下面结合实施例对本发明作进一步的详细描述。
本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。
实施例1
本申请中所述HN蛋白溶液,由本实验室原核表达和保存;
核酸适配体序列WC-2:
5’-BIO-CGGCGCATGCGTCGACCTGCAGCTAGTTAAAGGATAAGCAAGTCGCCGAGGCAACCAATGTGGGATCCGTCGACGAATTCCCTA,由上海生工生物工程股份公司合成。合成方式:单管合成10OD,摩尔量为12nmol。使用时溶于200μL HEPES缓冲液,95℃孵育10min。迅速冰浴10min后备用。
1、检测牛副流感病毒3型抗体的间接竞争酶联适配体方法如下:
包被:吸取100μL HN蛋白溶液包被于96孔ELISA微孔板中,4℃过夜。
洗板:甩去包被液,用300μL HEPEST(含0.05%Tween 20的HEPES)洗涤微孔板三次,甩干。
封闭:向微孔中加入200μL含3%BSA的HEPES液,37℃孵育2h。
加核酸适配体和牛血清:甩去封闭液,用HEPEST洗涤三次,甩干。同时将50μL Bio-WC-2和牛血清加入到封闭好的微孔中,37℃孵育1h。
洗板:甩去核酸适配体和牛血清,用300μL HEPEST(含0.05%Tween 20的HEPES)洗涤微孔板三次,甩干。
加二抗:向孔中加入100μL稀释的HRP-SA,37℃孵育1h。
显色:甩去二抗,用300μL HEPEST洗涤微孔板四次,拍干孔中残留的洗涤液,将显色液A、显色液B等体积混合,吸取100μL显色液加入到微孔中,37℃显色10min。
终止:每孔加入终止液2M H2SO450μL终止显色。
读数:使用自动酶标检测仪读取每孔在450nm波长处生物吸光度值(OD)。
阴阳性临界值的确定:使用20份临床采集的牛副流感阴性血清进行Ic-ELAA试验,计算PI平均值,通过公式:PICut-off=PI平均值+2×方差(SD)计算阴、阳性临界值。同时使用20份牛副流感阳性血清检验阴、阳性临界值。
建立的Ic-ELAA方法特异性检测:用优化的Ic-ELAA方法分别检测牛呼吸道合胞体病毒、牛冠状病毒、牛传染性支气管炎病毒感染牛的阳性血清,验证本研究建立的Ic-ELAA方法与其他病毒阳性血清之间是否存在交叉反应。
临床牛血清检测:选取50份临床牛血清样本,使用建立的Ic-ELAA方法和商品化BPIV3ELISA试剂盒进行检测,并对检测结果进行比较分析。
商品化BPIV3ELISA试剂盒操作程序如下:
(1)加样:吸取100μL 1:100倍稀释的血清样本、阳性对照和阴性对照至反应孔。
(2)孵育:21±3℃孵育30min。
(3)洗涤:吸取300μL wash solution洗板三次,拍干。
(4)二抗:吸取100μL 1:50倍稀释的二抗至每个反应孔,21±3℃孵育30min。
(5)洗涤:重复步骤(3)。
(6)显色:加入100μL底物至每孔,21±3℃避光反应10min。
(7)终止:加入50μL终止液。
(8)读数:15min内在450nm处读取各孔OD450值。
2、HN蛋白包被浓度和Bio-WC-2浓度的确定
将不同浓度的HN蛋白(10ug/mL、20ug/mL、40ug/mL、80ug/mL和160ug/mL)与不同适配体Bio-WC-2浓度(200nM、100nM、50nM)建立棋盘方阵进行I-ELAA试验,用酶标仪检测各孔OD450值,通过计算Positive/Negative值来确定最佳HN蛋白包被浓度和核酸适配体Bio-WC-2浓度。确定标准为P/N比值最高且阳性OD450值在1.0左右。实验程序与Ic-ELAA类似,区别是一抗为100μL Bio-WC-2,不加牛血清;HN蛋白包被条件为4℃过夜。
3、封闭液的确定
将80ug/mL的HN蛋白包被酶标板,4℃包被过夜。洗涤,加入不同封闭液如5%脱脂奶、10%脱脂奶、1%BSA、3%BSA和10%马血清,进行I-ELAA试验,用酶标仪检测各孔OD450值,通过计算P/N值来确定最佳封闭液。
4、二抗稀释度的确定
将80ug/mL的HN蛋白包被酶标板,4℃包被过夜,1%BSA封闭并洗涤,加入最佳浓度的适配体Bio-WC-2和最优稀释度的牛血清,洗涤,二抗HRP-SA按1:2000、1:4000、1:6000、1:8000倍比稀释进行I-ELAA试验,用酶标仪检测各孔OD450值,通过计算P/N值来确定最佳封闭液。
5、牛血清稀释倍数的确定
将最佳浓度的HN蛋白包被酶标板,4℃包被过夜后进行Ic-ELAA试验,血清为已被证实强阳性和阴性牛血清,分别做1:1、1:2、1:5、1:10倍稀释。加入最佳浓度Bio-WC-2和稀释好的牛血清各50μL。测定OD450值,通过公式:PI(%)=(1-样本OD450/适配体对照OD450)×100%,计算PI,PI值越高,阴阳性血清之间差异越大,则为最佳牛血清释释倍数。
实施例2
1、最佳HN包被浓度和Bio-WC-2浓度的确定
将不同浓度的HN蛋白4℃过夜包被酶标板,1%BSA为封闭液,以I-ELAA试验优化最佳HN蛋白包被浓度和核酸适配体Bio-WC-2最佳反应浓度。结果如表1所示,选择OD450值接近1,且P/N值最大的条件为最佳条件,即HN蛋白包被浓度为80ug/mL,Bio-WC-2最佳浓度为50nM。在此实验中,Bio-WC-2加入量为100μL,而在Ic-ELAA中Bio-WC-2加入量为50μL,则Bio-WC-2在后续的Ic-ELAA中浓度应为100nM。
表1最佳HN包被浓度和Bio-WC-2浓度的确定
2、封闭液的确定
将80ug/mL的HN蛋白包被酶标板,4℃包被过夜。洗涤,加入不同封闭液进行I-ELAA试验,测定适配体Bio-WC-2和阴性对照孔的OD450。测定结果如表2所示,当使用1%BSA为封闭液时,P/N值最高,且阳性值在1.0左右,因此,选择1%BSA为封闭液。
表2最佳封闭液的确定
3、二抗稀释度的确定
将80ug/mL的HN蛋白包被酶标板,4℃包被过夜,1%BSA封闭并洗涤,加入浓度为50nM的适配体Bio-WC-2,不同稀释度二抗进行I-ELAA试验。结果如表3所示,当二抗稀释度为1:6000时,P/N值最高,且阳性值在1.0左右。因此,确定二抗稀释度为1:6000。
表3 Ic-ELAA二抗稀释度的确定
4、牛血清稀释倍数的确定
将80ug/mL的HN蛋白包被酶标板,4℃包被过夜,1%BSA为封闭液,进行Ic-ELAA。其中适配体对照值平均值为1.050。根据公式PI(%)=(1-样本OD450/适配体对照OD450)×100%,计算阳性血清和阴性血清在不同稀释度下的PI值。计算结果如表4所示,当血清样本稀释倍数为1:1,即使用血清原液时,阳性血清PI较高,且阴、阳性血清间差别最大。基于此结果,判定牛血清最佳稀释度为1:1,即使用血清原液进行测定。
表4 Ic-ELAA牛血清最佳稀释度的确定
5、阴阳性临界值的确定
使用20份临床采集的牛副流感阴性血清,按照上述最优反应程序进行Ic-ELAA试验,计算PI平均值,20份阴性血清PI计算结果如表5所示,20份阴性牛血清PI平均值为20.75%,SD为5.11%。由此计算得出PICut-off值为30.97%。同时使用20份牛副流感阳性牛血清检验阴阳性临界值,20份阳性血清PI计算结果如表5所示,所有阳性血清PI均大于31%,为更清楚准确的区分阴、阳性血清,如图1所示,本方法设定35%为阴阳性临界值。
表5 40份阴阳性血清PI值
6、Ic-ELAA方法特异性检测
使用牛呼吸道合胞体病毒、牛冠状病毒、牛传染性支气管炎病毒感染牛的阳性血清进行Ic-ELAA试验,以检验Ic-ELAA特异性。检测结果如图2所示,仅有牛副流感阳性血清PI值大于35%,其余血清PI值均在临界值以下,说明本研究建立的Ic-ELAA方法具有良好的特异性。
7、临床牛血清的检测
使用本研究建立的Ic-ELAA方法和商品化ELISA,对临床采集的50份牛血清进行牛副流感病毒抗体检测,并将检测结果进行比较分析。检测结果如表6所示,50份临床血清样本中,Ic-ELAA法检测阳性数32,商品化ELISA为30个阳性,其中两种方法检测均为阳性的样28个,Ic-ELAA方法与商品化试剂盒的符合率=44/50*100%=88%。建立的Ic-ELAA方法相对商品化ELISA试剂盒,阳性检测率稍高。
表6建立的Ic-ELAA方法和商品化ELISA检测临床牛血清样本
本申请利用前期研究筛选的牛副流感病毒3型HN蛋白核酸适配体Bio-WC-2,建立了间接竞争ELAA检测方法。该方法的最优反应条件为HN蛋白包被浓度为80ug/mL,Bio-WC-2最佳浓度为50nM,封闭液为1%BSA,牛血清稀释倍数为血清原液,二抗稀释度为1:6000,阴阳性临界值为35%。该方法具有良好的特异性,与商品化ELISA试剂盒相比,Ic-ELAA具有更高的阳性检出率,更适合进行临床牛副流感疾病的血清学调查。
本申请中涉及的核苷酸序列如下表7所示:
表7序列表
本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
- 还没有人留言评论。精彩留言会获得点赞!