用于临床检验的方法和设备与流程
1.本发明涉及用于确定药物与细胞类型的细胞之间的相互作用的方法和设备(apparatus),特别是涉及抗微生物敏感性和引起感染的生物体的身份的快速和准确的剖析(profiling)。
背景技术:
2.对引起感染的微生物的快速准确的剖析是医疗保健领域的一项重大挑战。血培养分析仍然是诊断感染例如败血症的金标准。然而,这种方法通常过于缓慢和繁琐,无法对患者的初始管理产生任何重大影响。患者通常会立即接受广谱抗生素治疗,同时等待血培养结果。需要一种能够快速捕获临床相关生物体并表征抗微生物抗性特性例如特定药物的最小抑制浓度(mic)的诊断测试。
3.已经提出了微流体平台来解决这种需求,但是迄今为止还没有方法被证明在临床环境中是实用和可靠的。特别是,对多个不同的药物和细胞进行同时多路测定的能力已被证明是飘忽不定的。
4.显示了使用微流体确定mic采用了连续流动微流体,例如,choi等人,“rapid antibiotic susceptibility testing by tracking single cell growth in a microfluidic agarose channel system”,lab chip,2013,13,280-287。然而,连续流动微流体不允许使用微滴操作平台的广泛而精细的测试面板成为可能。
5.lyu等人,“phenotyping antibiotic resistance with single-cell resolution for the detection of heteroresistance”,sensors and actuators b:chemical 270 2018 369-404,描述了通过将来自异质群体的单个细菌细胞封装到微流体液滴中来定量表型的异质抗性的微流体方法。然而,可以同时操作的液滴数量,以及可以同时评估的抗生素数量和浓度是有限的。流通量受到限制的部分原因是由于没有丢弃空液滴的机制,其在该方法中必须与包含细胞的那些液滴一起进行。
6.sabhachandani等人,“integrated microfluidic platform for rapid antimicrobial susceptibility testing and bacterial growth analysis using bead-based biosensor via fluorescence imaging”,microchimica acta 184 2017,12,4619-4628中也存在类似的限制,其描述了用于基于表型的抗微生物敏感性检验(ast)的基于液滴的微流体方法。只能实现低存活的液滴计数,而无法从微流体芯片表面去除不需要的液滴。
7.显然需要一种表征抗微生物抗性特性例如mic的方法,该方法足够快速和准确以在临床环境中实用。基于现有技术,没有方法被证明能够可靠地做到这一点。在此上下文中阐述了本发明的方法和设备。
技术实现要素:
8.根据本发明的第一方面,提供了用于确定药物和细胞类型之间的相互作用的方
法,所述方法包括:
9.提供第一微滴的阵列,每个微滴包含源自生物样品的细胞类型;
10.提供第二微滴的阵列,每个微滴包含一个或多个预定浓度的一种或多种药物,
11.合并所述第一微滴的阵列和所述第二微滴的阵列以形成合并的微滴的阵列;
12.使用光学检测系统监测所述合并的微滴中一个或多个细胞的特性,以检测细胞类型和药物之间的相互作用。
13.在一些实施方案中,所述第二微滴的阵列包含对于每种药物具有多种不同浓度的微滴。
14.在一些实施方案中,每个微滴可以包含一个或多个细胞。
15.在一些实施方案中,所述一个或多个细胞可以是单一类型或株系和/或混合物。
16.在一些实施方案中,提供所述第一微滴的阵列的步骤包括:
17.用不混溶的载体流体乳化生物样品以形成水性第一微滴,其中至少一些含有一个或多个细胞类型的细胞;
18.将第一微滴加载到微流体芯片上,所述微流体芯片被配置为使用真实或虚拟电润湿电极操纵微滴;
19.确定含有细胞的微滴含有用于增殖的至少一个活细胞;和
20.从所述至少一个活细胞产生所述第一微滴的阵列。
21.在一些实施方案中,提供所述第一微滴的阵列包括:
22.将第一微滴的第一部分移动到被配置为提供需氧条件的细胞增殖位置;
23.将第一微滴的第二部分移动到第二细胞增殖位置,所述第二细胞增殖位置与所述第一细胞增殖位置分开并且被配置为提供厌氧条件;和
24.监测和记录第一微滴的第一和第二部分的细胞行为,以确定第一微滴是否含有活的需氧细胞或活的厌氧细胞。
25.在一些实施方案中,选择第一和第二细胞增殖位置处的环境条件以促进细胞类型的细胞增殖,所述环境条件包括温度和环境流体组成。
26.在一些实施方案中,提供第二水性微滴的阵列的步骤包括以下一项或多项:
27.用不混溶的载体流体乳化一种或多种药物以形成水性第二微滴,每个微滴包含至少一种药物类型;
28.将第二微滴加载到微流体芯片上,所述微流体芯片被配置为使用真实或虚拟电润湿电极操纵微滴;
29.对第二微滴执行一系列稀释操作以创建阵列。
30.在一些实施方案中,该方法进一步包括对来自一个或多个微滴的一个或多个细胞的子样品进行测定。
31.在一些实施方案中,测定是以下中的一种或多种:革兰氏染色、破坏性裂解测定、氧化酶测试或麦胚凝集素(wga)测定。
32.在一些实施方案中,在合并第一和第二阵列之前进行测定。
33.在一些实施方案中,该方法还包括利用分类算法对来自生物样品的细胞进行至少一种细胞识别测定。
34.在一些实施方案中,细胞识别步骤包括分析来自生物样品的细胞的一种或多种特
征,所述一种或多种特征包括以下的至少一种:细胞运动性、细胞形状和细胞增殖行为。
35.在一些实施方案中,该方法进一步包括:基于在合并的微滴中检测到的一个或多个细胞随时间推移的特征,确定至少一种药物对细胞类型的细胞的最小抑制浓度(mic)。
36.在一些实施方案中,药物是用于治疗败血症的抗生素或抗真菌药物。
37.在一些实施方案中,该方法进一步包括至少部分地基于确定的mic来确定用于治疗败血症的抗生素或抗真菌治疗方案。
38.在一些实施方案中,第一和/或第二微滴进一步包括生长培养基。培养基可以是细胞生长培养基并且选自以下中的一种或多种,但不限于此,rpmi 1640、emem、dmem、ham's f12、ham's f10、f12-k、hat培养基或其修改版本。
39.在一些实施方案中,该方法可以进一步包括分裂包含一个或多个细胞的合并的微滴以形成克隆集落的步骤。
40.在一些实施方案中,一个或多个细胞可被染色以用于成活力或检测研究和/或表达荧光蛋白。例如,可以使用核酸染色如碘化丙啶、to-pro
tm-3碘化物、zombie green tm或膜染色。在一些实施方案中,核酸或膜染色可用于计数细胞数。在一些实施方案中,可以将死亡染色用于成活力度量。
41.根据本发明的另一个方面,提供了微流体芯片设备(device),其被配置为执行任一项前述实施方案的方法,所述设备包括:
42.分选组件,其被配置为将含有细胞的微滴与空的微滴分开;
43.微滴操纵组件,其被配置为使用真实或虚拟电润湿电极操纵微滴;
44.光学检测系统,其被配置为通过一个或多个检测窗口监测包含在微流体芯片中的微滴。
45.在一些实施方案中,该设备进一步包括细胞培养组件,其被配置为保持第一微滴并提供有利于细胞增殖的条件。
46.在一些实施方案中,该设备还包括样品制备组件,其被配置为在不混溶的载体流体中从生物样品产生微滴乳液。
47.在一些实施方案中,可以提供检测系统以检测一个或多个微滴。一个或多个微滴可以利用光或光学光谱,例如荧光光谱。在一些实施方案中,检测器可以被配置为检测一个或多个微滴的荧光。在一些实施方案中,检测器可以是荧光检测器。
48.在一些实施方案中,微滴操纵组件包括一个或多个oewod结构,所述oewod结构包含:
49.第一复合壁,其包含:
50.第一基板;
51.第一透明导体层,其位于基板上,所述第一透明导体层的厚度范围为70至250nm;和
52.第一介电层,其位于光敏层上,所述第一介电层的厚度范围为30至280nm;
53.第二复合壁,其包含:
54.第二基板;
55.第二导体层,其位于基板上,所述第二导体层的厚度范围为70至250nm;
56.光敏层,其位于第二导体层上由波长范围为400-850nm的电磁辐射激活,所述光敏
层的厚度范围为300-1500nm,和
57.任选地,第二介电层,其位于第二导体层上,所述第二介电层的厚度范围为30至280nm
58.其中第一和第二介电层的暴露表面被配置为相距1-180μm以限定适合包含微滴的微流体空间;
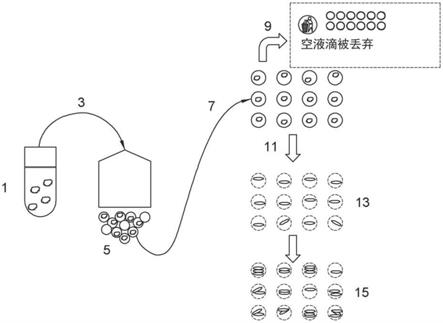
59.a/c电源,用于跨越连接第一和第二导体层的第一和第二复合壁提供电压;
60.至少一个电磁辐射源,其能量高于光敏层的带隙,适于撞击光敏层以在第一介电层的表面上诱导相应的虚拟电润湿位置;和
61.装置,其用于操纵光敏层上的电磁辐射的撞击点,以便改变虚拟电润湿位置的布置,从而产生至少一个电润湿路径,使得微滴沿着所述路径移动。
62.根据本发明的另一个方面,提供了微滴的阵列,所述阵列包括:
63.多个药物微滴,每个药物微滴包含预定浓度范围内的来自一组不同药物类型的一种或多种药物;和
64.对照微滴,其数量小于或等于多个药物微滴中微滴的数量,所述对照微滴不包含药物。
附图说明
65.图1示出了实施例实验工作流程的第一部分,其中样品细胞被乳化成多个含有细胞的微滴,然后将这些微滴加载到微流体芯片上;
66.图2示出了实验工作流程的第二部分,其中监测细胞行为以鉴定适合于产生第一微滴的阵列的活细胞,并且对来自样品的一个或多个细胞进行任选的测定;
67.图3示出了实验工作流程的第三部分,其中培养的细胞被分裂成第一微滴的阵列;
68.图4示出了实验工作流程的第四部分,其中制备了包含不同浓度药物的第二微滴的阵列;
69.图5示出了实验工作流程的第五部分,其中合并第一和第二阵列并且监测合并的微滴中的细胞行为以表征相互作用;
70.图6示出了用于执行本发明的方法的微流体芯片的实施例配置的侧视图;
71.图7示出了图6的微流体芯片的实施例配置的俯视图,并说明了可以在其上执行的实施例工作流程;
72.图8示出了根据本发明的方法产生的实施例阵列,所述阵列包括一定范围的液滴尺寸,每个液滴具有一定范围的细菌。
73.图9示出了根据本发明的方法获得的微滴中细菌生长的实验结果。
74.图10示出了使用根据本发明的方法和设备执行的面板合并的实施例。
75.图11示出了使用根据本发明的方法和设备获得的一组实施例实验结果,其允许在大肠杆菌菌株和庆大霉素抗生素之间进行mic确定。
76.发明详述
77.为进一步说明本发明的各个方面,现结合附图对本发明的具体实施方式进行详细说明。
78.本发明提供了用于确定细胞与药物之间的相互作用并由此获得可用于开发使用
所述药物的治疗方案的信息的方法和设备。
79.参考图1,图示了根据本发明的方法的实施例工作流程的第一部分,该工作流程包括多个步骤。尽管实施例工作流程的步骤以特定顺序提供,但是本领域技术人员将理解本发明的方法可以以任意数量的不同顺序执行。
80.在第一步骤1中,将一个或多个样品细胞悬浮在营养液中,例如luria-bertani(lb)培养基、胰酶大豆培养基(tsb)、mueller-hinton培养基或super optimal broth(sob)。
81.在第二步骤3中,细胞被乳化并分配到氟碳油中以形成多个微滴。通常,氟碳油是hfe-7500、hfe-7700、fc-40或fc-70中的一种。选择此类油以包含合适的氟化表面活性剂,例如ran-008、picosurf 1、picosurf 2或dsurf。油可以任选地另外用营养液处理以向乳化细胞提供更有利的环境。本领域技术人员将理解所使用的特定营养液将取决于所研究的特定细胞类型。
82.最初,乳液包含含细胞的微滴和空的微滴两者。
83.在第三步骤5中,将微滴加载到设备例如微流体芯片上。例如,可以将微滴加载到包括光介导的设备上电润湿(optically-mediated electrowetting-on-device,oewod)堆叠结构的芯片上。
84.在一个实施例中,乳化剂被集成到设备例如微流体芯片中。例如,可以将乳化剂集成到包括光介导的设备上电润湿(oewod)堆叠结构的芯片中。
85.在一个实施例中,乳化是涡旋乳化。在另一个实施例中,乳化是分步乳化。
86.微流体芯片将第一微滴分类为含细胞微滴和空微滴7,空微滴被丢弃9。丢弃空的微滴可以包括将它们从芯片中完全去除或将它们存储在微流体芯片的保持区域中。可以通过对每个微滴的光学检查来进行分类。每个包含细胞的微滴可以包含一个或多个细胞。在一些实施例中,可以通过自动化软件促进分选并且通过oewod诱导力沿着微流体芯片的表面操纵微滴。
87.将含有细胞的微滴移动到芯片表面上的细胞增殖位置11。细胞增殖位置可以包括第一细胞增殖位置和第二细胞增殖位置,第一细胞增殖位置包括被配置为提供有利于需氧细胞增殖的环境条件的芯片的靶标区域,并且第二细胞增殖位置包括被配置为提供有利于厌氧细胞增殖的环境条件的芯片的靶标区域。
88.一旦就位,一个或多个细胞在靶标区域处保持就位13。在培养步骤中允许细胞增殖15。在一些实施方案中,培养步骤需要将细胞在一个或多个靶标区域保持就位持续特定的时间长度,这将取决于所研究的特定病原体的产生时间。在理想的实验条件下,培养步骤可能需要将细胞保持就位15分钟到1小时之间。然而,人们认识到在实践中各种因素可能会延长该孵育时间,但预计培养阶段不会超过12小时。本领域技术人员将理解,细胞在一个或多个靶标区域保持的具体时间长度将根据所研究的细胞的确切类型和获得足够数量的样品细胞所需的生成周期数而变化。
89.在工作流程中的任何时候,都可以根据特定采样测定的需要以任何数量的方式操纵微滴中包含的细胞。这种操纵可以包括改变微滴的电润湿条件,使得微滴从表面去湿或部分去湿。如本文所用,术语“去湿”是指液滴和芯片表面之间的接触角的变化,使得液滴被拉离表面。
90.oewod力也可用于搅动和“搅拌”液滴以分散其中包含的细胞,或拉伸和拉长液滴以变为较小的子液滴(如果需要从培养的集落中测定单个细胞)。该过程可以通过对靶标区域的表面保持润湿或部分润湿的母液滴而有所帮助。然后可以检查子液滴的细胞占有率,并且如果未达到所需的细胞分布,则可以重新合并液滴并再次分裂。
91.参考图2,在允许细胞增殖足够长的时间后,光学地询问微滴以确定哪些细胞是存活的以用于创建阵列17。在一些实施方案中,活细胞是那些被确定具有合适增殖率的细胞,而被确定为经历过少量分裂的细胞被归类为非存活的。在其他实施方案中,被确定经历了少量分裂的细胞可以被确定为挑剔的——即,生长缓慢的细胞,或者仅当生长培养基中存在特殊营养物或满足特定条件时才会生长的细胞。在实施方案中,其中确定存在挑剔的细胞,这些细胞可以在合适的条件下进一步孵育。
92.确定含有活细胞的微滴与其他微滴分离19,剩余的含有非活细胞的微滴被丢弃21,或如上所述进一步孵育。如果此时确定没有细胞是活的,则停止该过程并使用一组新的一个或多个样品细胞重复步骤1-17,或者确定原始样品不含活细胞。在确定原始样品不含活细胞的一些实施方案中,停止样品检查并将结果报告为阴性。
93.任选地,如果确定存在活细胞,则可以将含有这些活细胞的微滴分成两部分23,其中对第一部分进行测定25以表征其中包含的细胞,例如革兰氏染色测试或基于图像的细胞鉴定,并且第二部分被进一步培养以生成更多细胞,用于芯片上涉及的更多测定。基于图像的细胞鉴定可以在微滴的第一部分或第二部分上进行,或者可以在所有含有活细胞的微滴上进行,而不需要像23中那样将微滴分成两部分。该测定25可提供用于确定一组药物以针对细胞进行测试的信息。
94.在测定25是基于图像的细胞鉴定的实施方案中,基于图像的鉴定可以由人执行或者它可以使用软件算法自动执行。本领域技术人员将理解,使用已知细胞的数据库,可以训练软件算法以基于算法源自所述数据库的特征将细胞分类为已知类别。
95.参考图3,进一步培养含有活细胞的微滴27以产生足够数量的细胞来测试一组不同浓度的不同类型的药物。一旦确定已经产生了足够数量的细胞,则对微滴进行多路分裂29以获得多个第一微滴,每个第一微滴包含至少一个活细胞,然后将其形成阵列31。任选地,在这个阶段,可以选择一个或多个微滴用于以测定的形式进行进一步评估,其可以是25的补充或代替25。微滴可以进一步分裂以构建子微滴的面板,每个子微滴包含至少一个细胞。然后可以将来自测定阵列的一个或多个微滴与子微滴合并,所述阵列包含含有用于所讨论的测定的在适当浓度的适当测定试剂的微滴,同时继续培养31的剩余的微滴。
96.形成测定阵列所需的操纵可以在芯片上或芯片外进行。在实施方案中,其中在芯片外制备测定阵列,然后将测定阵列带到与第一阵列相同的芯片上。在实施方案中,其中在芯片外制备微滴的测定阵列,测定阵列可以任选地存储在盒中,其中所述盒在多个芯片之间共享并且可以按需分配所需的测定阵列。在一些实施方案中,测定阵列可以包括存储在芯片上的一组预液滴化的测定试剂,每个测定试剂都伴随有不含测定试剂的一个或多个对照液滴。
97.在一些实施方案中,微滴的测定阵列被“预加载”到芯片上,并且芯片在适合维持测定试剂的完整性和活性的条件下储存。例如,这样的条件可以是受控的温度。在一些实施例中,温度可以被控制为大约4℃,选择性地在测定试剂存储区域中。
98.在一些实施方案中,第一微滴被进一步分裂33,使得阵列35中的微滴各自最初仅包含单个活细胞。
99.在一些实施方案中,每当已达到最小细胞数量时,可反复分裂含有活细胞的微滴并与空的含有培养基的微滴合并以防止细胞进入细胞生长曲线的稳定期。本领域技术人员将理解包含活细胞的微滴可以被分裂并与空的包含培养基的液滴合并的最小细胞数量可以根据所研究的特定细胞类型而变化。
100.参考图4,与第一微滴的阵列分开,第二微滴的阵列43通过合并41含有已知浓度/体积的药物的微滴37与含有已知浓度/体积的稀释剂的微滴39而形成。或者,可以通过一系列交替的合并和分裂操作来形成第二微滴的阵列43。因此,创建了包括具有已知浓度药物的微滴的阵列,包括用作对照的含有0%浓度药物的微滴。如上所述,如果对第一微滴进行测定,则包含在第二微滴的阵列中的药物可以基于从所述测定获得的一个或多个结果。
101.形成第二微滴的阵列43所需的操作可以在芯片上或芯片外进行。在实施方案中,其中在芯片外制备微滴的第二阵列,然后将第二阵列带到与第一阵列相同的芯片上。在实施方案中,其中在芯片外制备微滴的第二阵列,第二阵列可以任选地存储在盒中,其中所述盒在多个芯片之间共享并且可以按需分配所需的第二阵列。在一些实施方案中,第二阵列可以包括存储在芯片上的一组预液滴化的药物,每种药物以两种或多种稀释水平存在,并伴随有不含药物的一个或多个对照液滴。
102.在一些实施方案中,将微滴的第二阵列“预加载”到芯片上,并且将芯片储存在适合维持药物的完整性和药理活性的条件下。例如,这样的条件可以是受控的温度。在一些实施例中,温度可以被控制在大约4℃,选择性地在药物储存区域中。
103.在一些实施方案中,第二阵列包含一种和十种之间的不同药物。在其他实施方案中,第二阵列包含一种和十五种之间的不同药物。在其他实施方案中,第二阵列包含一种和二十种之间的不同药物。
104.在一些实施方案中,第二阵列可包含例如含有苯唑西林、万古霉素、亚胺培南、庆大霉素、环丙沙星、头孢西丁、甲硝唑、氨苄青霉素、达托霉素、利奈唑胺、制霉菌素或伏立康唑中的一种或多种的不同稀释度的微滴。
105.本领域技术人员将进一步理解,第二阵列可包含不含药物的一个或多个对照微滴。这些对照微滴可以进一步包括细胞培养所需的生长培养基。
106.参考图5,第一微滴的阵列45与第二微滴的阵列49合并47。然后培养合并的阵列51,并且以光学或其他方式监测包含在合并的微滴内的一个或多个细胞,以确定细胞的抗微生物抗性特性。例如,可以确定与每种药物有关的细胞的mic,并且可以确定药物对该细胞类型的细胞是抑菌的、杀菌的、抑真菌的或杀真菌的。
107.参考图6,说明了包括适合实施根据本发明的方法的oewod堆叠的微流体芯片的实施例配置。
108.该实施例设备适用于操纵已经乳化成油的水性微滴53,例如烃油或氟碳油,在250℃下具有5厘沲或更小的粘度并且在它们的无约束状态下具有例如在20μm和50μm之间的直径。在其他实施方案中,该设备可适用于具有4μm和100μm之间的无约束直径的液滴。在一些实施方案中,油可以是具有2%ran的氟碳油hfe7500,或者也可以是含有高达5%abil的氢化rtm6。
109.该设备的oewod堆叠可以包括顶部55a和底部55b玻璃板,各自500μm厚并涂有厚度为130nm的导电铟锡氧化物(ito)的透明层57。每一个导电铟锡氧化物(ito)层57连接到a/c电源59,底部玻璃板55b上的ito层接地。底部玻璃板55b涂有800nm厚的非晶硅层61。顶部玻璃板55a和非晶硅层61各自涂有160nm厚的高纯度氧化铝或hafnia层63,它们又涂有单层聚(3-(三甲氧基甲硅烷基)丙基甲基丙烯酸酯)65以使高纯度氧化铝或hafnia层63的表面疏水。在一些实施方案中,底部板55b可以由不透明材料例如硅制成。
110.顶部玻璃板55a和非晶硅层61使用间隔物(未示出)间隔8μm,使得微滴在被引入设备腔时经受一定程度的压缩。在一些实施方案中,55a和61之间的距离在5-50μm之间、5-40μm之间、7-30μm之间、5-20μm之间或1-10μm之间。因此,本领域技术人员将理解,所使用的间隔物的尺寸将取决于55a和61之间的距离的所需尺寸。由led光源67照明的反射像素化屏幕的图像通常设置在顶部玻璃板55a的上方,并且从每个二极管69发出0.01wcm2水平的可见光(波长660或830nm),并通过顶部玻璃板55a和中间层的多个向下箭头的方向上的传播引起在非晶硅层61上的撞击。
111.在各个撞击点,在非晶硅层61中产生电荷的光激发区71,这在相应的电润湿位置73处在高纯度氧化铝或hafnia层63上引起改变的液-固接触角。这些改变的特性提供了将微滴53从一个电润湿位置73推进到另一个所需的毛细力。led光源67由微处理器75控制,微处理器75通过预编程算法确定阵列中的哪些二极管69在任何给定时间被照亮。
112.有利地,这种配置提供了用于以高准确度同时操纵大量微滴的灵活平台。特别是,由于不需要通过预定路径操纵微滴(这是使用静态电极阵列或流动路径来影响微滴行进方向的传统微流体平台的限制),所述平台可能是有利的。消除这些限制能够实现复杂和精确的操作,这些操作对于微滴的芯片上分选以及用于实施根据本发明的方法的大阵列的形成和合并是必要的。
113.适用于实施本发明方法的微流体芯片的进一步具体细节可以在我们公布的专利wo 2018/234445中找到,该专利通过引用纳入本文。
114.本发明的设备还可以实施环境控制特征以创建特别适合细胞增殖的芯片表面的靶标区域,例如:受控的温度、不同流动的区域、控制载体流体以连续地为培养的细胞供给营养物,以及控制培养细胞周围的载体流体中的局部气体浓度。此外,载体流体可包含表面活性剂或含氟表面活性剂。表面活性剂尤其可能因为表面活性剂可用于稳定乳液液滴是有利的。载体流体可以是油。油载体流体可以包括氟碳油,例如hfe7500。
115.例如,细胞培养物可位于低流动区域并被包含营养物和化学物质并向培养物供应营养物和化学物质以促进生长的较快流动区域包围。这些机制可能构成图1的步骤11中描述的需氧和厌氧条件的一部分,用于通过选择性地提供有利于这些细胞类型的条件来促进不同细胞类型的增殖。
116.图7图示了根据本发明的方面在oewod微流体芯片设备的表面上执行的实施例工作流程。
117.图示的视图是oewod微流体芯片的表面,其被配置为通过真实或虚拟电润湿电极在表面上的不同位置之间同时操纵包含各个乳化细胞样品和试剂的多个微滴。
118.在工作流程开始时,流体入口77接纳空的和含有细胞的第一微滴的混合物在碳氟油载体流体中的乳液79。
119.然后通过例如芯片的oewod结构将这些第一微滴转移到分选区81,在分选区81将它们分选成空的微滴83和包含细胞的微滴85。此后,每个含有细胞的微滴85被转移到合并区87。
120.在促进细胞生长和分裂的条件下,将一个或多个细胞在靶标区域上保持预定的时间段,在第一微滴内形成细胞集落。如前所述,这些第一微滴然后经历进一步的操作,以形成第一阵列。
121.在该阶段结束时,第二入口89接纳第二微滴。第二微滴可以是碳氟油和一种或多种药物的乳液,每个微滴在水溶液中含有一种或多种已知浓度的药物。
122.然后第二微滴与包含细胞的第一微滴85在合并区87合并以形成合并的微滴91,然后将其放置预定时间。例如,一旦合并,合并的微滴可以在37℃的温度下孵育5到30分钟。在孵育期间,通过光学检测系统监测液滴。
123.因此,所公开的设备有利地允许在广泛的尺寸范围内操纵微滴,并且是数字控制的,提供动态可重新编程的操作步骤。与传统方法相比,该设备的微流体基板没有图案化的电极,去除了几个复杂的低产率制造步骤,并简化了电气互连。从而也消除了由相邻电极之间的介电击穿引起的设备故障。
124.与传统方法相比,由此产生的设备结构允许更精细和集成的工作流程,例如独立控制载体相和液滴,以及允许在微流控芯片表面的区域内控制更大密度的液滴。
125.实验细节
126.现在将描述使用本发明的设备和方法获得的许多实验结果。
127.1.液滴中的细菌生长:
128.对于该实验,将细菌大肠杆菌dh5-α(具有编码绿色荧光蛋白gfpmut3和赋予对100μg/ml氨苄青霉素抗性的氨苄青霉素抗性基因(bla)的多拷贝载体)在37℃在补充有100μg/ml氨苄青霉素的luria-bertani(lb)液体培养基的瓶中培养。
129.为了估计细菌浓度,在600nm(od600=1.6至1.9)测量培养物的光密度(od),并达到每10μl 20x106个细菌的浓度。这对应于每10μm液滴约1个细胞。
130.使用涡旋乳化产生液滴以产生50μl的40μl油载体相/10μl细菌悬浮液。
131.将由fluorinert
tm fc-40不混溶的碳氟油作为载体相(含有5%ran氟表面活性剂以促进液滴形成)加上细菌悬浮液组成的0.6μl乳液添加到具有1μm间隔物的oewod设备中并孵育。
132.图8a示出了阵列,该阵列包含一系列液滴尺寸,在0分钟时具有宽范围的起始浓度(每个液滴的细菌数)。
133.图8b示出在40℃孵育50分钟后相同的阵列,可见生长(细菌复制)。
134.图8c示出了相同的阵列,在40℃孵育100分钟后,与图8a相比时,细菌的进一步生长清晰可见。
135.图8d示出了相同的阵列,在40℃下孵育150分钟后,细菌的进一步生长清晰可见。
136.2.追踪液滴中的生长:
137.通过光学检查监测液滴中的细菌生长,并使用三种不同的数据分析方法来分析光学数据:
138.i.平均强度——该方法涉及仅挑选具有一个或多个细菌细胞的液滴并测量整个
液滴的平均荧光强度。
139.ii.液滴亮度分数——这种方法涉及仅挑选具有一个或多个细菌细胞的液滴,并选择高于背景但低于大多数细菌的强度阈值。然后测量作为总液滴面积的分数的强度大于阈值的面积。
140.iii.每个液滴的光斑计数——这种方法涉及仅挑选具有一个或多个细菌细胞的液滴,选择上述阈值。光斑被定义为高于阈值强度的连接区域。
141.图9示出了使用在前面描述的实验中的上述三种方法中的每一种追踪的细菌生长。这两种颜色代表不同的液滴大小范围;绘制的每个点都是一个框架的平均值。光斑尺寸是包含的液滴数量,即小光斑表示在这个框架中这个尺寸的少数液滴。上升趋势在约60分钟后变得具有统计学显著性(p《0.05)(在此数据收集速率下;仅适度依赖于分析方法),最终达到p《2e-5。
142.3.面板合并和mic确定:
143.图10示出了根据本发明在设备上执行的面板合并的实例。液滴配对在一起,以使合并后的液滴都具有大致均匀的尺寸。每个第三液滴被标记为对照并且保持未配对。在这个实施例中,较小的液滴包含在胰酶大豆培养基(tsb)中的浓度为500ng/ml的抗生素庆大霉素,而每个较大的液滴含有在tsb中的1-3个细菌。
144.图11示出了抗生素庆大霉素的浓度如何降低到大肠杆菌样品菌株显示出抗性的水平。在降低浓度的三个小时内,观察到稳健的生长行为模式,从而允许确定mic。在这种具体情况下,mic被确定为大约300pg/ml。
145.如本文所用,术语“阵列”在提及微滴阵列时旨在具体指包含待测定物质的微滴,并且不包括用作对照但实际上不进行测试的任何额外的微滴。
146.如本文所用,术语药物是指包含至少一种药物活性化合物的药物制剂,或候选药物制剂或用于制剂的候选药物。
147.如本文所用,术语样品/生物样品是指包含至少一种细胞类型的任何人、动物、环境(天然的、人为的或修饰的)或甚至食物样品。样品/生物样品可以选自:粪便、外周血、血清、血浆、腹水、尿液、脑脊液(csf)、痰、唾液、骨髓、滑液、房水、羊水、耳垢、母乳、支气管肺泡灌洗液、精液、前列腺液、库珀氏液(cowper's fluid)或射精前液、女性射精、汗液、粪便物、头发、眼泪、囊液、胸膜和腹膜液、心包液、淋巴液、食糜、乳糜、胆汁、间质液、月经、脓液、皮脂、呕吐物、阴道分泌物、乳腺分泌物、黏膜分泌物、大便水、胰液、来自鼻窦腔的灌洗液、支气管肺吸液、胚泡腔液和脐带血。
148.环境样品可以选自:水样品、空气样品、土壤样品或表面的表面拭子。
149.如本文所用,术语抑菌剂/抑菌试剂是指阻止细菌繁殖但不一定杀死它们的药物。类似地,术语抑真菌剂/抑真菌试剂是指阻止真菌繁殖但不一定杀死它们的药物。
150.如本文所用,术语杀菌剂/杀菌试剂是指杀死细菌的药物。类似地,术语杀真菌剂/杀真菌试剂是指杀死真菌的药物。
151.如本文所用的术语需氧条件是指需氧生物可以在其中生存和生长的氧化条件。
152.如本文所用,术语厌氧条件是指氧浓度降低的条件,厌氧生物可以在该条件下生存和生长。
153.如本文所用,术语环境条件包括ph、温度、压力、渗透性、盐浓度、培养基类型和可
添加的任何额外营养补充剂的浓度。
154.此处使用的术语分类算法是指能够自动进行图像分析的算法。此类算法的操作可能像基于强度的阈值确定一样简单,或者它们可能是机器学习操作,例如逻辑回归、随机森林、决策树或支持向量机(svm),或者它们可能像卷积神经网络(cnn)识别算法一样复杂。这样的算法在本领域中是已知的。
155.鉴于本公开内容,本发明的各种其他方面和实施方案对于本领域技术人员将是显而易见的。
156.在本文中使用的“和/或”应被视为对具有或不具有另一个的两个特定特征或组件中的每一个的具体公开。例如,“a和/或b”将被视为对(i)a、(ii)b和(iii)a和b中的每一个的具体公开,就好像每一个在本文中单独列出一样。
157.除非上下文另有说明,否则上述特征的描述和定义不限于本发明的任何特定方面或实施方案,并且同样适用于所描述的所有方面和实施方案。
158.本领域的技术人员将进一步理解,虽然本发明已通过实施例的方式参考若干实施方案进行了描述,但本发明不限于所公开的实施方案,并且可以在不背离本发明范围的情况下构建替代实施方案,如在所附权利要求中限定的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1