水稻OsORM基因及其蛋白的应用
水稻osorm基因及其蛋白的应用
技术领域
1.本发明属于植物基因工程技术领域,更具体地,本发明涉及一种水稻osorm基因及其蛋白在提高水稻镉抗性中的应用。
背景技术:
2.镉是最受关注的环境污染物之一。作为一种致癌物质,镉在人体内会导致骨骼变脆和肾功能衰竭,镉元素在肾脏中的生物半衰期较长(约10-30年),即使低摄入量的镉的持续摄入往往也会导致慢性中毒。
3.植物源性镉是膳食所摄入镉的主要来源。镉的膳食摄入主要来自叶菜和谷物类食物,尤其是谷类,后者在亚洲地区的日常摄入量较高。土壤镉被水稻吸收后,高镉积累的大米进入人体,严重威胁着世界上以稻米为主食的半数人口。因此降低谷物中镉积累对人类健康来说非常重要。
4.目前在水稻中仅鉴定出为数不多的参与镉转运的基因。挖掘水稻抗镉基因,培育抗镉水稻种质,是降低大米中的镉含量,发展绿色农业,实现食品与环境安全和提高农业产值的基础。
技术实现要素:
5.基于此,本发明的目的之一是提供一种水稻osorm基因在提高水稻镉抗性中的应用。
6.实现上述发明目的的具体技术方案包括如下:
7.水稻osorm基因在提高水稻镉抗性中的应用,所述水稻osorm基因包括osorm1基因、和/或osorm2基因;所述osorm1基因编码如seq id no.2所示的氨基酸序列,所述osorm2基因编码如seq id no.4所示的氨基酸序列。
8.在其中一些实施例中,所述水稻osorm1基因的核苷酸序列如seq id no.1所示,和/或所述水稻osorm2基因的核苷酸序列如seq id no.3所示。
9.本发明还提供了水稻osorm蛋白在提高水稻镉抗性中的应用,所述水稻osorm蛋白包括:如seq id no.2所示氨基酸序列的osorm1蛋白、和/或如seq id no.4所示氨基酸序列的osorm2蛋白。
10.本发明还提供了一种水稻osorm基因突变载体,所述基因突变载体是利用crispr-cas9编辑技术构建而得,使水稻osorm基因的功能丧失;所述水稻osorm基因包括osorm1基因、和/或osorm2基因;所述水稻osorm1基因的核苷酸序列如seq id no.1所示,和/或所述水稻osorm2基因的核苷酸序列如seq id no.3所示。
11.在其中一些实施例中,所述crispr-cas9编辑技术编辑水稻osorm1基因的第二外显子区域的靶序列,使靶序列产生缺失1个碱基的突变,以及编辑水稻osorm2基因的第二外显子区域的靶序列,使靶序列产生插入1个碱基的突变;所述靶序列如seq id no.5所示。
12.在其中一些实施例中,针对所述靶序列的sgrna序列如seq id no.6所示。
13.本发明还提供了上述水稻osorm基因突变载体在提高水稻镉抗性中的应用。
14.本发明还提供了水稻osorm基因、水稻osorm蛋白、水稻osorm基因突变载体在水稻遗传育种中的应用。
15.一种提高水稻镉抗性的制剂,所述制剂的活性成分包括上述水稻osorm基因突变载体。
16.一种提高水稻镉抗性的方法,所述方法包括步骤:利用crispr-cas9编辑技术构建水稻osorm基因突变载体,使水稻osorm基因的功能丧失;所述水稻osorm基因包括osorm1基因、和/或osorm2基因;所述水稻osorm1基因的核苷酸序列如seq id no.1所示,和/或所述水稻osorm2基因的核苷酸序列如seq id no.3所示。
17.一种培育抗镉水稻的方法,所述方法包括步骤:利用crispr-cas9编辑技术构建水稻osorm基因突变载体,使水稻osorm基因的功能丧失;所述水稻osorm基因包括osorm1基因、和/或osorm2基因;所述水稻osorm1基因的核苷酸序列如seq id no.1所示,和/或所述水稻osorm2基因的核苷酸序列如seq id no.3所示。
18.在其中一些实施例中,所述crispr-cas9编辑技术编辑水稻osorm1基因的第二外显子区域的靶序列,使靶序列产生缺失1个碱基的突变,以及编辑水稻osorm2基因的第二外显子区域的靶序列,使靶序列产生插入1个碱基的突变;所述靶序列如seq id no.5所示。
19.在其中一些实施例中,针对所述靶序列的sgrna序列如seq id no.6所示。
20.与现有技术相比,本发明具有以下有益效果:
21.在本发明中,选取水稻osorm两个同源基因osorm1和osorm2中同源性非常高的片段设计靶点,利用crispr-cas9编辑技术,同时编辑osorm1和osorm2第二外显子区域的靶序列,得到基因突变植株osorm1 osorm2,发现其对镉的外排能力增强,可以抵抗高浓度镉胁迫。水稻osorm基因的克隆和新功能的发现,为水稻遗传育种提供了新的基因靶点和资源。
附图说明
22.图1中的a为本发明实施例1中水稻osorm1基因和osorm2基因的外显子区域信息,b为水稻osorm基因的编辑结果。
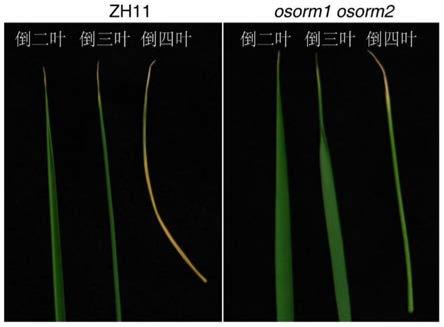
23.图2为本发明实施例2中野生型zh11和基因突变osorm1 osorm2株系对高浓度镉胁迫的抗性研究结果。
24.图3为本发明实施例3中野生型zh11和基因突变osorm1 osorm2株系对镉转运能力的研究结果,其中infflux表示镉离子内流;efflux表示镉离子外排。
具体实施方式
25.为了便于理解本发明,下面将对本发明进行更全面的描述。本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明公开内容的理解更加透彻全面。
26.下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(newyork:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。实施例中所用到的各种常用化学试剂,均为市售产品。
27.除非另有定义,本发明所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不用于限制本发明。本发明所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
28.在本发明的其中一个方面,提供了水稻osorm基因在提高水稻镉抗性中的应用,所述水稻osorm基因包括osorm1基因、和/或osorm2基因;所述水稻osorm1基因的核苷酸序列如seq id no.1所示,编码如seq id no.2所示的氨基酸序列;和/或所述水稻osorm2基因的核苷酸序列如seq id no.3所示,编码如seq id no.4所示的氨基酸序列。
29.osorm1基因:
30.seq id no.1:
31.atggcgaagctgtacgtgcaggcggtgcagccggcggatctgaacaagaacacggagtggttcatgtaccccggggtgtggacgacctacatcctcatcctcttcttctcctggctgctcgtcctctccgtcttcggctgcacccccggcatggcgtggacgttcgtcaacctcgcccacttcgcgatgacataccatttttttcactggaagaagggaactccgtttgctgatgaccaggggatgtataatagattgacttggtgggagcaaatggacaatgggaagcagcttactcgcaacagaaaatttctgaccgtggttcctttggtcctatacttgatagccttgcacacgacagattatcaacatcctatgctcttcctcaacaccattgcagttgttgtgctggttgttgcaaaactaccgaacatgcacaaggtccggatctttggaatcaatgctggcaactag
32.seq id no.2
33.maklyvqavqpadlnkntewfmypgvwttyililffswllvlsvfgctpgmawtfvnlahfamtyhffhwkkgtpfaddqgmynrltwweqmdngkqltrnrkfltvvplvlylialhttdyqhpmlflntiavvvlvvaklpnmhkvrifginagn
34.osorm2基因
35.seq id no.3
36.atggcgaagctgtacgtgcaggcggtgccgccgccggatctgaacaggaacacggagtggttcatgtacccgggcgtctggacgacctacatctgcatcctcttcttctcctggctcctcgtcctctccgtcttcggctgcacgcccggcatggcctggaccgtcgtcaatctcttccacttcgcgatcacataccactttttccattggaagaagggaacaccttttgctgatgaccagggaatgtacaacacattgacttggtgggagcaaatggacaatggcaaacagcttactcgcaacaggaagttccttgttgtagttcctgttgtcctgtatttgatagcttcacacactacagactaccaacatcctatgctcttcctcaacacccttgcagtcgcagtgctcgtggtcgctaaactaccgaacatgcacaaggtccggatttttggaattaatgctgggaactag
37.seq id no.4
38.maklyvqavpppdlnrntewfmypgvwttyicilffswllvlsvfgctpgmawtvvnlfhfaityhffhwkkgtpfaddqgmyntltwweqmdngkqltrnrkflvvvpvvlyliashttdyqhpmlflntlavavlvvaklpnmhkvrifginagn
39.应理解,考虑到密码子的简并性及不同物种密码子的偏爱性,在不改变氨基酸序列的前提下,对本发明的编码基因的核苷酸序列进行修改,也属于本发明的保护范围内。
40.本发明的另一方面提供了一种培育抗镉水稻的方法,所述方法包括步骤:利用crispr-cas9编辑技术,在针对水稻osorm基因第二外显子区域靶序列的sgrna序列(seq id no.6)指导下,编辑水稻osorm1基因第二外显子区域的靶序列(seq id no.5),使osorm1基
因靶序列产生缺失1个碱基的突变,编辑水稻osorm2基因第二外显子区域的靶序列(seq id no.5),使osorm2基因靶序列产生插入1个碱基的突变(图1中的b),从而使水稻osorm基因的功能丧失,构建获得水稻osorm基因突变载体。
41.靶序列(seq id no.5):5'-tggtgggagcaaatggacaa-3'
42.sgrna序列(seq id no.6):
43.ttttttcctgtagttttcccacaaccattttttaccatccgaatgataggataggaaaaatatccaagtgaacagtattcctataaaattcccgtaaaaagcctgcaatccgaatgagccctgaagtctgaactagccggtcacctgtacaggctatcgagatgccatacaagagacggtagtaggaactaggaagacgatggttgattcgtcaggcgaaatcgtcgtcctgcagtcgcatctatgggcctggacggaataggggaaaaagttggccggataggagggaaaggcccaggtgcttacgtgcgaggtaggcctgggctctcagcacttcgattcgttggcaccggggtaggatgcaatagagagcaacgtttagtaccacctcgcttagctagagcaaactggactgccttatatgcgcgggtgctggcttggctgccggttttagagctagaaatagcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgcttttttt
44.以下结合具体实施例来详细说明本发明。
45.实施例1水稻osorm基因突变载体的构建和基因突变水稻t0植株的获得
46.本实施例首先构建得到了水稻osorm基因突变载体,再继而获得了基因突变水稻t0植株。具体包括以下步骤:
47.1、菌种活化和质粒提取制备
48.将携带pylcrispr/cas9pubi-h载体(实验室保存,华南农业大学刘耀光院士馈赠)的大肠杆菌(top10f’)在含有卡那霉素(25μg/ml)的lb培养基上划线培养过夜,将携带pylsgrna1-osu6a/lacz载体(所述pylsgrna1-osu6a/lacz载体为携带seq id no.6的sgrna序列、osu6a启动子序列、lacz基因序列的puc18载体,可通过本领域常规技术构建)的大肠杆菌(dh5α)在含有氨苄青霉素(50μg/ml)的lb培养基上划线培养过夜,分别挑取单菌落培养种子液,再扩大培养,提取质粒pylcrispr/cas9pubi-h和pylsgrna1-osu6a/lacz;
49.2、构建sgrna表达盒
50.(1)、第一轮pcr反应
51.以2-5ngpylsgrna1-osu6a/lacz质粒为模板,u-f(seq id no.7)、osu6at1r(seq id no.8)、gr-r(seq id no.9)和osu6at1f(seq id no.10)为引物(引物u-f和osu6at1r在反应体系中的浓度各为0.2μm,引物gr-r和osu6at1f在反应体系中的浓度各为0.1μm),扩增体系为10μl(2x pcrbuffer for kod fx 5μl、2mm dntps 2μl、u-f 0.2μl、osu6at1r 0.2μl、gr-r 0.2μl、osu6at1f 0.2μl、pylsgrna1-osu6a/lacz质粒0.2μl、kod fx 0.2μl、灭菌超纯水1.8μl),进行overlapping pcr扩增,得到扩增产物;pcr反应程序为:94℃10s,58℃15s,68℃20s,28个循环;
52.u-f(seq id no.7):5'-ctccgttttacctgtggaatcg-3'
53.osu6at1r(seq id no.8):
54.5'-ttgtccatttgctcccaccacggcagccaagccagca-3'
55.gr-r(seq id no.9):5'-cggaggaaaattccatccac-3'
56.osu6at1f(seq id no.10):
57.5'-tggtgggagcaaatggacaagttttagagctagaaat-3'
58.(2)、第二轮pcr反应
59.取1μl第一轮pcr反应产物,用h2o稀释10倍,然后取1μl作为模板,pps-ggl(seq id no.11)和pgs-gg2(seq id no.12)作为引物,用高保真酶primestar max pcr酶进行扩增,扩增体系为50μl(2x primestar max premix 25μl、pps-ggl1.5μl、pgs-ggr1.5μl、模板1μl、灭菌超纯水21μl),得到sgrna表达盒;pcr反应程序如下:20个循环:95℃10s,58℃15s,68℃20s;
60.pps-ggl(seq id no.11)
61.5'-ttcagaggtctctctcgactagtatggaatcggcagcaaagg-3'
62.pgs-ggr(seq id no.12):
63.5'-agcgtgggtctcgaccgacgcgtatccatccactccaagctc-3'
64.3、步骤(1)获得的pylcrispr/cas9pubi-h载体与步骤(2)获得的sgrna表达盒进行酶切-连接反应,得到连接产物(即:水稻osorm基因突变载体);所述酶切-连接反应为:37℃10min,10℃5min,20℃5min,3个循环;再37℃3min,10℃5min,20℃5min,10个循环;最后37℃5min。所述pylcrispr/cas9pubi-h载体与sgrna表达盒的质量比为8:1;
65.连接反应体系如表1所示:
66.表1酶切-连接反应体系
[0067][0068]
4、连接产物转化e.coli感受态细胞
[0069]
从超低温冰箱中取出一管大肠杆菌感受态dh5α,放置在冰上约10min待感受态融化。按1:10的比例,将步骤3获得的连接产物,加入e.coli dh5α大肠杆菌感受态细胞中,冰浴30min后,42℃热激90s,破坏感受态细胞的双分子膜结构,再冰浴5min;然后加入1ml lb培养基,37℃培养1~1.5h后,5000g离心1min,弃500μl上清后重悬细菌。将细菌涂平板(涂板培养基为lb+25μg/ml kan,0.3~0.5mm iptg,适量x-gal),倒置于37℃培养箱中过夜。挑选蓝斑阳性克隆;
[0070]
5、冻融转化农杆菌
[0071]
将步骤4的阳性克隆扩大培养后提取质粒,加入农杆菌eha105感受态中,1750v电击0.5秒,然后加入1mlyeb培养基,28℃培养3~4h后涂平板(同步骤4),28℃黑暗培养2-3天,pcr鉴定阳性农杆菌;
[0072]
6、将步骤5的阳性农杆菌eha105侵染水稻野生株中花11号(zh11,实验室保存)的愈伤,得到基因突变水稻t0植株。具体步骤如下:
[0073]
a、水稻愈伤的诱导
[0074]
(1)、去除中花11号水稻野生株(zh11)种子的壳,并保持水稻胚的完整;
[0075]
(2)、用70%的乙醇处理去壳的种子1-2分钟,轻轻摇晃多次,然后用灭菌的蒸馏水
冲洗两次,再加入适量20%的漂渍液(每50ml加入一滴吐温20),在恒温摇床上120rpm,22℃慢摇45-60分钟,用灭菌蒸馏水轻柔冲洗10次左右,去除种子表面的漂渍液(该操作在超净工作台内完成);
[0076]
(3)、用高压灭菌的镊子将消毒完的种子均匀的放置在含有2mg/ml nb培养基平板表面(愈伤诱导培养基);nb培养基配方如表2所示。
[0077]
表2水稻愈伤形成及农杆菌介导水稻转化中所用培养基的配方
[0078]
[0079]
[0080][0081]
(4)、用封口膜将平板封口后,放置在密闭避光的纸箱25℃,诱导15天左右;
[0082]
(5)、将愈伤从水稻小苗上剥离下来,在相同的诱导培养基上继代培养,直到获得活性较强浅黄色愈伤。
[0083]
b、农杆菌的转化
[0084]
(1)、挑取含有目标质粒的单克隆(步骤5中的阳性农杆菌eha105)接种于5ml液体细菌培养基,培养基中加入50μg/ml的利福平和50mg/l卡那霉素,在28℃,200rpm培养至od
600
约0.5左右;
[0085]
(2)、按1:100的比例加入至100ml含50μg/ml的利福平和50mg/l卡那霉素的细菌培养基中,在28℃,200rpm培养过夜,让农杆菌生长至od
600
=0.8-1.0;
[0086]
(3)、4000rpm,离心10分钟收集菌体,去上清,用同样体积的aam培养基重悬菌体,然后在同样条件下离心,去上清;aam培养基配方如表2所示;
[0087]
(4)、用aam培养基重悬菌体至od
600
=0.4左右,并转入新的灭菌的250ml三角瓶中;
[0088]
(5)、选择淡黄色,不易碎的,直径约为5mm的胚性愈伤,将其浸入农杆菌菌液中,大约浸泡30分钟,偶尔轻柔晃动,使愈伤均匀接触菌液。
[0089]
(6)、将侵染过的愈伤放在灭菌的滤纸上吸干残留的菌液,稍微晾干,将其均匀放置在已配制好的2n6-as固体平板表面,每个平板上大约放置25颗愈伤,用封口膜封口后置于25℃下暗培养2-3天。在共培养时,要注意检查防止农杆菌的过度生长;2n6-as培养基配方如表2所示。
[0090]
c、选择培养和植株的再生
[0091]
(1)、将共培养完的愈伤转移新的灭菌250ml三角瓶中,用含有500mg/l头孢菌素和200mg/l羧苄青霉素的灭菌蒸馏水洗至少10次,每次用50-75ml水,清洗时要轻微晃动三角瓶,最后加入100ml灭菌蒸馏水(含相同的抗生素),25℃,120rpm慢摇两小时,倒去水,将愈伤转移至灭菌的滤纸上吸除多余的水分,稍微晾干;
[0092]
(2)、转移愈伤至新的选择培养基中,培养基中加入250mg/l头孢菌素,250mg/l羧苄青霉素和50mg/l潮霉素,将培养皿置于避光的纸箱内,25℃培养三周,经常检查污染情况,应及时将同一培养皿中未污染的愈伤转移至新的培养基中;选择培养基配方如表3所示。
[0093]
表3农杆菌介导水稻转化中抗性愈伤选择及再生所用培养基的配方
[0094]
[0095][0096]
(3)、经2-3周的选择培养,将抗性愈伤切下转移至新的固体的前再生培养基中,置于25℃,16h光照/8h黑暗条件下继续培养2-3周;然后将愈伤转移到再生培养中平板上,让其再生成水稻小苗;前再生培养基和再生培养基配方如表3所示。
[0097]
(4)、转移再生出小苗至新的ms培养基中,在25℃,16h光照/8h条件下培养,使小苗长至可以移栽的大小;ms培养基配方如表2所示。
[0098]
(5)、移植约10cm高的小苗至盛有土壤的小盒中,转移至温室中正常生长,即得基因突变水稻t0植株。
[0099]
7、基因突变水稻t0植株的打靶效果检测
[0100]
以基因突变水稻t0植株(幼苗)的dna为模板,针对osorm1基因第二外显子区域靶序列(位置如图1中的a所示)的seq id no.13(5'-tccctattgccactgcctact-3')和seq id no.14(5'-tggaacttggatttggggcta-3')为引物,针对osorm2基因第二外显子区域靶序列(位置如图1中的a所示)的seq id no.15(5'-caaacacaagtaaagcca-3')和seq id no.16(5'-tgtggaatactaccgtta-3')为引物,进行pcr扩增,扩增体系为20μl(2x taq master mix(vazyme)10μl、seq id no.151μl、seq id no.161μl、dna模板1μl、灭菌超纯水7μl)。pcr反应程序如下:95℃5min,30个循环:95℃30s,55℃30s,72℃30s;72℃5min。对扩增产物进行测序。
[0101]
经测序检测,本实施例获得的基因突变水稻t0植株可在osorm1基因第二外显子靶点位置产生如图1中的b所示的缺失1个碱基的突变,在osorm2基因第二外显子靶点位置产生如图1中的b所示的插入1个碱基的突变,命名为基因突变水稻orm1 orm2株系。
[0102]
实施例2基因突变水稻orm1 orm2株系对高浓度镉的抗性
[0103]
本实施例研究了基因突变水稻orm1 orm2株系对高浓度镉的抗性。
[0104]
将野生型zh11种子和基因突变水稻orm1 orm2的种子表面消毒萌发后,用水稻营养液培养至两周龄幼苗,然后在水培液中添加300μm氯化镉继续水培5天,取水稻倒二叶,倒三叶,倒四叶观察表型,结果如图2所示。
[0105]
从图2可以看出,相比野生型zh11水稻幼苗,基因突变水稻orm1 orm2株系对高浓度的镉胁迫,其叶片发生卷曲发黄的程度低,表现出更强的抗性。
[0106]
实施例3基因突变水稻orm1 orm2株系对镉的转运能力
[0107]
本实施例研究了基因突变水稻orm1 orm2株系对镉的转运能力。
[0108]
将野生型zh11种子和基因突变水稻orm1 orm2的种子表面消毒萌发后,用水稻营养液培养至两周龄幼苗,利用非损伤微测系统对野生型zh11幼苗和基因突变水稻orm1 orm2幼苗的镉转运能力进行评估。其中,非损伤微测系统测定镉离子流速的具体步骤如下:
[0109]
1、用lix载体,在装有镉离子lix的试剂瓶中迅速蘸一下,使其尖端充满。
[0110]
2、取一支玻璃流速传感器,用电解液灌充注射器从后端注入电解液,产生10毫米液柱。
[0111]
3、将流速传感器尖端与lix载体尖端在同一水平面上相对。由于毛细作用,lix进入离子选择性流速传感器,通过推拉流速传感器压力调节装置调整lix的长度至6-10毫米,得到制作好的镉离子流速传感器。
[0112]
4、将配置好的镉离子校正液放置载物台上,开始校正镉离子流速传感器。
[0113]
5、截取两周大zh11和orm1 orm2的主根根尖,测定其分生区部位5分钟内的镉离子流速。
[0114]
结果如3所示,从图3可知,相比野生型zh11水稻幼苗,基因突变水稻orm1 orm2株系对镉的外排能力增强。
[0115]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0116]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1