从植物的毛状根生产重组病毒载体的制作方法
1.本发明涉及一种从毛状根,特别是属于十字花科(brassicaceae)的植物的毛状根生产重组病毒载体的方法。
背景技术:
2.重组病毒载体用于基因疗法和dna疫苗接种应用的进步已经产生了对高效生产系统的需求。具有治疗意义的重组病毒载体的示例包括基于慢病毒的载体和基于腺相关病毒的载体。
3.在正在开发的基因疗法产品中,基于重组腺相关病毒(aav)的载体目前使用最广泛,而且显示了最大的体内递送潜力。优选使用raav载体系统部分是由于不存在与野生型病毒相关的疾病、aav能够转导非分裂细胞和分裂细胞,以及在若干i/ii/iii期试验中观测到所产生的长期稳健转基因表达。此外,可以利用不同的raav载体血清型特异性地靶向不同的组织、器官和细胞。欧美近期批准上市的重组腺相关病毒基因疗法(如或)代表了基因疗法领域的里程碑式成就。
4.aav是含有单链dna基因组的无包膜二十面体颗粒。aav属于依赖性细小病毒,该属依赖于辅助病毒来反式提供生产性感染的必需基因(weitzman和linden,2011)。4.7kb基因组包含两个主要开放阅读框,即调控(rep)和结构衣壳(cap)基因,它们编码病毒复制、衣壳结构和病毒基因组包装所需的多种蛋白质。三种蛋白质,即vp1、vp2和vp3,是通过交替剪接和p40启动子转录物泄漏扫描相结合而由cap基因天然产生的。它们都共有相同的c末端序列。aav衣壳由60个单位的vp1、vp2和vp3构成,比率约为1:1:10。一种被称为组装激活蛋白(aap)的蛋白质是从cap基因中的不同开放阅读框翻译而来,并且是衣壳组装所需的(sonntag等人,2010)。rep基因产生四种蛋白质:最大的两种蛋白质rep 78和rep 68来自使用p5启动子引发的转录,而其他两种蛋白质rep 52和rep 40来自使用p19启动子的转录。除了rep蛋白以外,aav dna的复制和封装还需要反向末端重复序列(itr)(balakrishnan和jayandharan,2014;robert等人,2017)。
5.在raav的情况下,存在众多生产策略来生成病毒载体。
6.将质粒dna瞬时转染到哺乳动物细胞中以生产aav病毒载体是这些病毒载体的临床级制造中最常用的策略。raav载体通常在人胚胎肾293细胞(hek293)中、在转染通常三个携带rep和cap基因、raav转基因和提供辅助腺病毒功能的特定基因的dna质粒后产生。
7.通过引入rep和cap基因两者和/或raav基因组生成稳定的工程改造细胞系产生了包装或生产细胞系。
8.urabe等人(2006)已经开发了用于生产aav的昆虫细胞/杆状病毒系统。第一代是基于插入多角体基因座的三种不同的杆状病毒(bv)。三种重组bv载体分别编码rep、cap和raav基因组的转基因。开发了第二代bv,其中bv的数目被减到两个(smith等人,2009)。在该方法中,rep和cap序列以头对头的位置插入单个杆状病毒中。
9.此外,barajas等人2017年在酵母中建立了使用共表达的aav生产系统。
10.尽管这些系统在过去几年中有所改进,但必须提高载体的生产力和/或质量以允许常规使用基因疗法。
11.因此,需要一种用于生产诸如raav载体等重组病毒载体的替代系统。
技术实现要素:
12.本发明的第一方面涉及一种从植物的毛状根生产重组哺乳动物病毒载体的方法,包括以下步骤:
13.a)诱导所述植物形成毛状根;
14.和
15.b)用至少一种含有一个或多个表达盒的载体转化所述植物;其中所述一个或多个表达盒包含编码所述重组病毒载体生产所需的蛋白质组分的基因;
16.其中所述植物属于十字花科。
17.具体来说,属于十字花科的所述植物可以选自萝卜(raphanus sativus)、西班牙黑萝卜(raphanus sativus var.niger)、甘蓝(brassica oleracea l.convar)、欧洲油菜(brassica napus)、拟南芥(arabidopsis thaliana)和芜菁(brassica rapa),所述植物具体来说是芜菁。
18.在一个具体实施方案中,步骤a)通过用包含rol基因的细菌菌株转化所述植物来进行,其中所述细菌菌株能够感染所述植物。
19.在一个具体实施方案中,所述细菌菌株是发根根瘤菌(rhizobium rhizogenes)或根癌农杆菌(agrobacterium tumefaciens)。
20.在一个具体实施方案中,所述重组病毒载体是重组腺相关病毒(aav)病毒载体。
21.在一个具体实施方案中,所述一个或多个表达盒包含aav rep和cap基因。在一个具体实施方案中,所述aav rep和cap基因各自在衍生自感染十字花科植物的病毒的启动子如花椰菜花叶病毒35s(camv35s)启动子的控制之下。
22.在另一个具体实施方案中,所述一个或多个表达盒包含编码vp1、vp2、vp3、aap(组装激活蛋白)、rep52和rep78蛋白的基因。在一个具体实施方案中,编码vp1、vp2、vp3、aap、rep52或rep78蛋白的基因各自在组成型启动子如花椰菜花叶病毒35s(camv35s)启动子或胭脂碱合酶(nos)启动子的控制之下,或者在诱导型启动子如乙醇脱氢酶(alca)启动子的控制之下。
23.在一个具体实施方案中,编码vp1的基因在nos启动子的控制之下,编码vp2的基因在nos启动子的控制之下,编码vp3的基因在camv35s启动子或其功能变体的控制之下,并且编码aap的基因在camv35s启动子或其功能变体的控制之下。
24.在一个具体实施方案中,编码vp3的基因在与seq id no:13的核苷酸序列具有至少80%、85%、90%、95%、99%或100%同一性的camv35s启动子功能变体的控制之下,并且编码aap的基因在与seq id no:13的核苷酸序列具有至少80%、85%、90%、95%、99%或100%同一性的camv35s启动子功能变体的控制之下。
25.在一个具体实施方案中,编码vp1、vp2、vp3和aap的基因各自在alca启动子的控制之下。
26.在一个具体实施方案中,编码vp3的基因还在增强子,特别是烟草花叶病毒ω(tmv
ω)增强子的控制之下。
27.在一个具体实施方案中,编码rep52和rep78的基因各自在alca启动子的控制之下。
28.在一个具体实施方案中,编码rep52的基因还在增强子,特别是烟草花叶病毒ω(tmvω)增强子的控制之下。
29.在一个具体实施方案中,编码vp1、vp2、vp3、aap、rep52和/或rep78蛋白的基因经过密码子优化。
30.在一个具体实施方案中,所述植物还用编码病毒有效复制所需的病毒辅助功能的载体,特别是编码腺病毒辅助功能的载体进行转化。
31.在一个具体实施方案中,所述植物还用包含包括编码目标产物的基因的病毒基因组的载体,特别是包含侧接有两个aav-itr序列的编码目标产物的基因的载体进行转化。
32.本发明的另一个方面涉及一种毛状根培养物,所述毛状根培养物通过以下方式可获得:
33.a)诱导植物形成毛状根;
34.和
35.b)用至少一种含有一个或多个表达盒的载体转化所述植物;其中所述一个或多个表达盒包含编码重组病毒载体生产所需的蛋白质组分的基因;
36.其中所述植物属于十字花科。
37.在一个具体实施方案中,所述毛状根培养物通过转化属于十字花科的植物可获得,其中所述植物选自萝卜、西班牙黑萝卜、甘蓝、欧洲油菜、拟南芥和芜菁,所述植物具体来说是芜菁。
38.在一个具体实施方案中,所述重组哺乳动物病毒载体是重组腺相关病毒(aav)病毒载体。在另一个具体实施方案中,所述一个或多个表达盒如上文所定义。
39.本发明的另一方面涉及一种通过上述方法可获得的重组哺乳动物病毒载体。在一个具体实施方案中,所述重组哺乳动物病毒载体由属于十字花科植物的植物的毛状根产生,其中所述植物选自萝卜、西班牙黑萝卜、甘蓝、欧洲油菜、拟南芥和芜菁,所述植物具体来说是芜菁。在一个具体实施方案中,所述重组哺乳动物病毒载体是重组腺相关病毒(aav)病毒载体。在另一个具体实施方案中,所述重组哺乳动物病毒载体由属于十字花科的植物的毛状根产生,其中所述植物用至少一种含有一个或多个表达盒的载体进行转化;其中所述一个或多个表达盒包含编码所述重组病毒载体生产所需的蛋白质组分的基因,并且其中所述一个或多个表达盒如上文所定义。
40.本发明的另一个方面涉及一种用至少一种含有一个或多个表达盒的载体转化的转基因植物;其中所述一个或多个表达盒包含编码重组哺乳动物病毒载体生产所需的蛋白质组分的基因;
41.并且其中所述植物属于十字花科。
42.在一个具体实施方案中,属于十字花科的所述转基因植物选自萝卜、西班牙黑萝卜、甘蓝、欧洲油菜、拟南芥和芜菁,所述植物具体来说是芜菁。
43.在一个具体实施方案中,所述重组哺乳动物病毒载体是重组腺相关病毒(aav)病毒载体。在另一个具体实施方案中,所述一个或多个表达盒如上文所定义。
附图说明
44.图1:针对在毛状根中产生aav蛋白而设计的构建体的示意图。
45.此图示出了设想用于测试芜菁毛状根产生aav蛋白的能力的五个构建体示例。
46.构建体1包含:(i)第一表达盒,包括camv35s启动子(“p35s”)、cap基因(“cap”)和camv35s终止子(“t35s”),以及(ii)第二表达盒,包括camv35s启动子(“p35s”)、rep基因(“rep”)和nos终止子(“tnos”)。
47.构建体2包含:(i)第一表达盒,包括nos启动子(“pnos”)、vp1基因(“vp1”)和nos终止子(“tnos”);(ii)第二表达盒,包括nos启动子(“pnos”)、vp2基因(“vp2”)和nos终止子(“tnos”);(iii)第三表达盒,包括camv35s启动子变体(称为“p2*35s”)、vp3基因(“vp3”)和camv35s终止子(“t35s”);以及(iv)第四表达盒,包括camv35s启动子变体(称为“p2*35s”)、aap基因(“aap”)和camv35s终止子(“t35s”)。“p2*35s”启动子是包含-343至-90bp片段的复制物的camv35s启动子变体,如kay等人,1987所述。
48.构建体3包含(i)第一表达盒,包括乙醇脱氢酶诱导型启动子(“palca”)、rep52基因(“rep52”)和camv35s终止子(“t35s”);(ii)第二表达盒,包括乙醇脱氢酶诱导型启动子(“palca”)、rep78基因(“rep78”)和nos终止子(“tnos”);以及(iii)第三表达盒,包括camv35s启动子(“p35s”)、编码激活乙醇脱氢酶启动子所必需的alcr蛋白的基因(“alcr”)和camv35s终止子(“t35s”)。
49.构建体4包含(i)第一表达盒,包括乙醇脱氢酶诱导型启动子(“palca”)、烟草花叶病毒ω增强子(“tmvω”)、rep52基因(“rep52”)和camv35s终止子(“t35s”);(ii)第二表达盒,包括乙醇脱氢酶诱导型启动子(“palca”)、rep78基因(“rep78”)和nos终止子(“tnos”);以及(iii)第三表达盒,包括camv35s启动子(“p35s”)、编码激活乙醇脱氢酶启动子所必需的alcr蛋白的基因(“alcr”)和camv35s终止子(“t35s”)。
50.构建体5包含(i)第一表达盒,包括乙醇脱氢酶诱导型启动子(“palca”)、vp1基因(“vp1”)和nos终止子(“tnos”);(ii)第二表达盒,包括乙醇脱氢酶诱导型启动子(“palca”)、vp2基因(“vp2”)和nos终止子(“tnos”);(iii)第三表达盒,包括乙醇脱氢酶的诱导型启动子(“palca”)、烟草花叶病毒ω增强子(“tmvω”)、vp3基因(“vp3”)和camv35s终止子(“t35s”);(iv)第四表达盒,包括乙醇脱氢酶诱导型启动子(“palca”)、aap基因(“aap”)和camv35s终止子(“t35s”);以及(v)第五表达盒,包括camv35s启动子(“p35s”)、编码激活乙醇脱氢酶启动子所必需的alcr蛋白的基因(“alcr”)和camv35s终止子(“t35s”)。
具体实施方式
51.本发明的第一方面涉及一种从植物的毛状根生产重组哺乳动物病毒载体的方法,包括以下步骤:
52.a)诱导所述植物形成毛状根;
53.和
54.b)用至少一种含有一个或多个表达盒的载体转化所述植物;其中所述一个或多个表达盒包含编码所述重组病毒载体生产所需的蛋白质组分的基因;
55.其中所述植物属于十字花科。
56.重组哺乳动物病毒载体
57.根据本发明,术语“病毒载体”涉及一种载体,即衍生自病毒的“载体”。该术语包括携带或缺乏病毒基因组的任何病毒颗粒。
58.在本发明的上下文中,缺乏病毒基因组的病毒载体又称为病毒样颗粒(vlp)。vlp是由病毒衍生的结构蛋白自组装而成的高度组织化结构。这些稳定的多用途纳米颗粒具有优良佐剂特性,能够诱导先天性和获得性免疫应答。在过去几年中,已经将vlp应用于生物技术的其他分支,从而利用它们的结构稳定性和对操纵的耐受性来携带和呈现异源分子或作为新颖纳米材料的构建块。vlp可以由多种病毒科的组分产生,包括细小病毒科(例如腺相关病毒)、逆转录病毒科(例如hiv)、黄病毒科(例如丙型肝炎病毒)、副粘病毒科(例如尼帕病毒)和噬菌体。
59.术语“携带病毒基因组的病毒载体”具体来说是指感染性病毒颗粒。与野生型(wt)病毒基因组相比,重组病毒载体的基因组通过用目标转基因替换wt基因组的一部分而得以修饰。术语“目标转基因”是指其核酸序列非天然存在于病毒基因组中的基因。目标转基因可以是编码序列或非编码序列。具体来说,重组病毒载体将用于基因疗法。如本文所用,术语“基因疗法”是指将目标遗传物质(例如,dna或rna)转移到宿主中以治疗或预防遗传性或获得性疾病或疾患。所述目标遗传物质编码需要在体内产生的产物(例如,多肽或功能性rna)。举例来说,所述目标遗传物质可以编码具有治疗价值的激素、受体、酶或多肽。替代地,所述目标遗传物质可以编码具有治疗价值的功能性rna,诸如反义rna(例如适用于外显子跳跃的反义rna)或具有治疗价值的shrna。
60.在本发明的上下文中,所述病毒载体是哺乳动物病毒载体,即它衍生自能够感染哺乳动物,特别是人类的病毒。因此,在本发明的上下文中,所述病毒载体并非衍生自能够感染植物的病毒。
61.具体来说,所述重组病毒载体可能衍生自腺病毒、细小病毒(特别是腺相关病毒)、逆转录病毒(特别是慢病毒或泡沫病毒)、单纯疱疹病毒、甲病毒、黄病毒、弹状病毒、麻疹病毒、新城疫病毒、小核糖核酸病毒或痘病毒。
62.在一个具体实施方案中,所述重组病毒载体是重组aav(raav)载体。
63.在本发明中,所述aav载体的衣壳可以衍生自天然或非天然存在的血清型。在一个具体实施方案中,所述aav载体衣壳的血清型选自aav天然血清型。作为使用aav天然血清型的替代方案,在本发明的上下文中可以使用人工aav衣壳,包括但不限于具有非天然存在的衣壳蛋白的aav。此类人工衣壳可以通过任何合适的技术,使用所选aav序列(例如,vp1衣壳蛋白的片段)与可以从不同的所选aav血清型、相同aav血清型的不连续部分、从非aav病毒来源或从非病毒来源获得的异源序列组合来产生。来自人工aav血清型的衣壳可以是但不限于嵌合aav衣壳、重组aav衣壳或“人源化”aav衣壳。
64.根据一个具体实施方案,所述aav载体衣壳属于aav-1、aav-2、aav-2变体(诸如ling等人,2016公开的包括具有y44+500+730f+t491v变化的工程改造衣壳的四重突变体衣壳优化aav-2)、aav-3和aav-3变体(诸如vercauteren等人,2016公开的包括具有两个氨基酸变化s663v+t492v的工程改造aav3衣壳的aav3-st变体)、aav-3b和aav-3b变体、aav-4、aav-5、aav-6和aav-6变体(诸如rosario等人,2016公开的aav6变体,包括三突变aav6衣壳y731f/y705f/t492v形式)、aav-7、aav-8、aav-9和aav-9变体(诸如aavhu68)、aav-2g9、aav-10如aav-cy10和aav-rh10、aav-rh39、aav-rh43、aav-rh74、aav-dj、anc80、lk03、aav.php、
aav2i8、猪aav如aavpo4和aavpo6,以及aav血清型的酪氨酸、赖氨酸和丝氨酸衣壳突变体。此外,通过改组、原理设计、易错pcr和机器学习技术获得的其他非天然工程改造变体(诸如aav-spark100)、嵌合aav或aav血清型的衣壳也可能有用。
65.在一个具体实施方案中,所述aav载体是嵌合载体,即其衣壳包含衍生自至少两种不同aav血清型的vp衣壳蛋白,或包含组合了衍生自至少两种aav血清型的vp蛋白区域或结构域的至少一种嵌合vp蛋白。举例来说,嵌合aav载体可以衍生自aav8衣壳序列与不同于aav8血清型的aav血清型的序列的组合,诸如上文具体提到的那些。在另一个实施方案中,所述aav载体的衣壳包含一种或多种变体vp衣壳蛋白,诸如wo2015013313所述的那些,特别是rhm4-1、rhm15-1、rhm15-2、rhm15-3/rhm15-5、rhm15-4和rhm15-6衣壳变体。在一个具体实施方案中,所述aav载体的衣壳是aav血清型9(aav9)和aav血清型74(aavrh74)衣壳蛋白之间的杂合体。举例来说,所述aav血清型可以是wo2019/193119公开的-rh74-9血清型(诸如wo2019/193119的实施例中所述的杂合cap rh74-9血清型;rh74-9血清型在本文中又称为
“‑
rh74-9”、“aavrh74-9”或“aav-rh74-9”)或wo2019/193119公开的-9-rh74血清型(诸如wo2019/193119的实施例中所述的杂合cap 9-rh74血清型;-9-rh74血清型在本文中又称为
“‑
9-rh74”、“aav9-rh74”、“aav-9-rh74”或“rh74-aav9”)。在一个具体实施方案中,所述aav载体的衣壳是aav血清型9(aav9)和aav血清型74(aavrh74)衣壳蛋白之间的肽修饰杂合体,如pct/ep2019/076958所述,诸如aav9-rh74杂合体衣壳或经p1肽修饰的aavrh74-9杂合体衣壳。
66.在另一个实施方案中,所述修饰衣壳还可以衍生自通过易错pcr和/或肽插入来插入的衣壳修饰(例如,如bartel等人,2011所述)。此外,衣壳变体可能包括单个氨基酸变化,诸如酪氨酸突变体(例如,如zhong等人,2008所述)。
67.在一个具体实施方案中,所述aav载体具有天然存在的衣壳,诸如aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav-cy10、aavrh10衣壳。在一个具体实施方案中,所述重组aav载体具有aav8衣壳。
68.所述aav载体的基因组包含任选地侧接于目标遗传物质的5'-和3'-aav反向末端重复序列(itr)。itr可以来源于任何aav基因组,诸如aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav-cy10或aavrh10基因组。在一个具体实施方案中,所述aav载体的基因组包含5'-和3'-aav2 itr。
69.此外,所述aav载体的基因组可以是单链或自互补双链基因组(mccarty等人,gene therapy,2003)。自互补双链aav载体通过从aav末端重复序列之一缺失末端解析位点(trs)来生成。这些复制基因组是野生型aav基因组长度一半的修饰载体具有包装dna二聚体的趋势。
70.aav血清型衣壳和itr的任何组合在本发明的上下文中都可以实施,意味着aav载体可能包含衍生自相同aav血清型的衣壳和itr,或衍生自第一血清型的衣壳和衍生自与所述第一血清型不同的血清型的itr。此类具有衍生自不同血清型的衣壳itr的载体又称为“假型载体”。
71.属于十字花科的植物
72.如本文所用,表述“属于十字花科的植物”具有其在本领域的一般含义。它涵盖十字花科(又称十字花科、芥菜科或白菜科)的任何植物。
73.根据皇家植物园邱园的数据,它含有超过330个属和约3,700个种。最大的属是葶苈属(draba)(365个种)、碎米荠属(cardamine)(200个种)、糖芥属(erysimum)(225个种)、独行菜属(lepidium)(230个种)和庭荠属(alyssum)(195个种)。
74.众所周知的物种包括但不限于甘蓝(brassica oleracea)(卷心菜、花椰菜等)、芜菁(大头菜、大白菜等)、欧洲油菜(油菜籽等)、萝卜(普通萝卜)、欧洲辣根(armoracia rusticana)(辣根)、紫罗兰属(紫罗兰)、拟南芥(模式生物)等等。在这些物种中,有若干种产生可食用块根(大头菜、萝卜
……
)。
75.在一个优选实施方案中,属于十字花科的所述植物选自芜菁、萝卜、西班牙黑萝卜、甘蓝、欧洲油菜和拟南芥。
76.更优选地,属于十字花科的所述植物是芜菁或欧洲油菜。
77.甚至更优选地,属于十字花科的所述植物是芜菁。
78.步骤a)诱导所述植物形成毛状根;
79.能够在植物中诱导毛状根形成的任何技术都可以用于本发明。
80.毛状根是在被革兰氏阴性土壤细菌发根农杆菌(agrobacterium rhizogenes)引起的感染后在植物创伤部位出现的一种增殖性根。毛状根表型以非激素依赖性快速生长、侧向分支、遗传稳定性和缺乏向地性为特征。
81.应当注意,随着农杆菌属和根瘤菌科的分类学发生变化,发根农杆菌(agrobacterium rhizogenes)已更名为发根根瘤菌(rhizobium rhizogenes)。发根根瘤菌也可以通过名称发根农杆菌来鉴定。
82.毛状根最初被鉴定为所选植物中由可以从土壤分离的发根根瘤菌引起的疾病。革兰氏阴性细菌将dna从其根诱导(ri)质粒转移到受感染植物细胞的基因组中,从而形成根。具体来说,含有基因rola、rolb和rolc基因的rol基因(f.f.white等人,1983)存在于发根根瘤菌ri质粒的t-dna中,而这些基因的表达诱导了毛状根形成。
83.在一个具体实施方案中,通过用包含rol基因的细菌菌株转化所述植物来诱导毛状根形成,其中所述细菌菌株能够感染所述植物。
84.如本文所用的表述“rol基因”具有其在本领域中的一般含义。它是指能够诱导毛状根形成的一组细菌基因(schm
ü
lling等人,1988;bulgakov等人,2008)。通常,rol基因由质粒如pri质粒携带。
85.在一个具体实施方案中,所述细菌菌株在其基因组中天然包含rol基因,或通过引入异源rol基因加以修饰。
86.在一个具体实施方案中,所述细菌菌株属于根瘤菌属。
87.在一个优选实施方案中,使用发根根瘤菌菌株。
88.发根根瘤菌的若干个菌株可用于实施本发明。合适的菌株包括但不限于发根根瘤菌菌株tr7(也称为atcc 25818)和菌株lba 9402、a4t、a4、lba1334、atcc 11325、atcc 15834、lmg 155、hri、tr105、atcc 39207、r1000、lba 9422、菌株1072、bl311、r1600、r1601、c58c1、a4rs、msu440、arqua1、8194、tr101、2659、lba8490、niaes1724、c8(maff03-10268)和dc-ar2。
89.在一个优选实施方案中,所述发根根瘤菌菌株是菌株atcc 15834或atcc 25818。
90.甚至更优选地,发根根瘤菌菌株是菌株atcc 15834。
91.在另一个实施方案中,使用根癌农杆菌菌株。在一个具体实施方案中,所用根癌农杆菌菌株已进行了修饰以便在其基因组中引入rol基因。在一个具体实施方案中,根癌农杆菌已经通过用包含rol基因的pri质粒转化而进行了修饰。
92.在另一个实施方案中,所用根癌农杆菌菌株不包含rol基因。在这个实施方案中,用根癌农杆菌转化所述植物诱导了愈伤组织形成。然后所述愈伤组织在加入一种或多种激素物质后分化成毛状根。在一个具体实施方案中,所述激素物质是生长素家族的激素,诸如1-萘乙酸(naa)、吲哚-3-乙酸(iaa)或吲哚-3-丁酸(iba)。
93.根癌农杆菌的若干个菌株可用于实施本发明。合适的菌株包括但不限于根癌农杆菌c58、c58c1、lba4404、gv2260、gv3100、a136、gv3101、gv3850、eha101、eha105、agl-1。
94.通过诸如发根根瘤菌和/或根癌农杆菌的细菌菌株进行转化是本领域已知的技术。技术人员熟悉常用于进行所述转化步骤的不同技术。根据要转化的植物种类,可以将不同的植物部分用于感染。此类植物部分可以包括例如但不限于种子、植物茎、叶、叶柄、子叶节、下胚轴或其他植物部分或细胞。
95.通常,通过将发根根瘤菌和/或根癌农杆菌接种物施用于先前已经受伤的植物组织来进行发根根瘤菌和/或根癌农杆菌的感染。
96.优选使用半固体培养基或液体营养液,所述半固体培养基或液体营养液针对毛状根保持进行了优化,从而与未感染的植物细胞相比,增加了毛状根的生长率和生产力。尽管许多类型的材料和溶液以及培养基是已知的并且可以用于本发明,但若干个优选示例包括murashige和skoog培养基(ms)以及gamborg b5培养基。可以使用为了满足用于制造可持续毛状根培养物的宿主植物的营养需求而优化的若干种培养基改良。
97.在一个具体实施方案中,步骤a)诱导毛状根形成在步骤b)用至少一种包含一个或多个表达盒的载体转化所述植物之前进行,其中所述一个或多个表达盒包含编码重组病毒载体生产所需的蛋白质组分的基因。
98.在另一个具体实施方案中,步骤a)诱导毛状根形成在步骤b)用至少一种包含一个或多个表达盒的载体转化所述植物之后进行,其中所述一个或多个表达盒包含编码重组病毒载体生产所需的蛋白质组分的基因。在该实施方案中,可以通过用包含rol基因并能够感染如上定义的植物的细菌菌株转化表达编码重组病毒载体生产所需的蛋白质组分的基因的转基因植物来获得毛状根。
99.在一个优选实施方案中,步骤a)和步骤b)同时进行。
100.在一个具体实施方案中,包含rol基因并能够感染如上定义的植物的细菌菌株在其基因组中还包含一个或多个表达盒,其中所述一个或多个表达盒包含编码重组病毒载体生产所需的蛋白质组分的基因。
101.因此,在该实施方案中,从植物的毛状根生产重组哺乳动物病毒载体的方法包括用细菌菌株如发根根瘤菌或根癌农杆菌转化所述植物的步骤;
102.其中所述细菌菌株在其基因组中包含rol基因和一个或多个表达盒;
103.其中所述一个或多个表达盒包含编码重组病毒载体生产所需的蛋白质组分的基因;
104.并且其中所述植物属于十字花科。
105.在另一个具体实施方案中,同时使用两种细菌菌株,其中一种细菌菌株包含rol基
因,并且其中另一种细菌菌株包含一个或多个编码重组病毒载体生产所需的蛋白质组分的表达盒。
106.在另一个具体实施方案中,同时使用两种或更多种细菌菌株,其中所述两种或更多种细菌菌株包含编码重组病毒载体生产所需的蛋白质组分的不同表达盒,并且其中至少一种细菌菌株包含rol基因。
107.在一个具体实施方案中,同时使用三种或更多种细菌菌株,其中一种细菌菌株包含rol基因;并且至少两种或更多种细菌菌株包含编码重组病毒载体生产所需的蛋白质组分的不同表达盒。
108.步骤b)用至少一种含有一个或多个表达盒的载体转化所述植物
109.如上所述,本发明的方法包括步骤b)用至少一种包含一个或多个表达盒的载体转化所述植物,其中所述一个或多个表达盒包含编码重组病毒载体生产所需的蛋白质组分的基因。
110.在一个具体实施方案中,所述植物还用编码病毒有效复制所需的病毒辅助功能的载体,诸如当重组病毒载体是raav载体时用于编码腺病毒辅助功能的载体进行转化。
111.在一个具体实施方案中,所述植物还用包含包括编码目标产物的基因的病毒基因组的载体进行转化。在另一个具体实施方案中,所述载体包含侧接有两个aav-itr序列的编码目标产物的基因。
112.可以使用能够转化植物,特别是属于十字花科的植物的任何技术。具体来说,可以使用任何物理方法,诸如基因枪法或基因枪系统、电穿孔、显微注射或超声介导的转化。还可以使用化学方法,诸如脂质体介导的转化、碳化硅纤维介导的转化、peg介导的转化、磷酸钙共沉淀、聚阳离子dmso技术或deae葡聚糖程序。还可以使用pei介导的转化。
113.在一个优选实施方案中,用天然地将位于肿瘤诱导(ti)质粒上的dna(t-dna)转移到植物细胞的细胞核中,并将所述dna稳定地并入到植物基因组中的细菌菌株如发根根瘤菌或根癌农杆菌进行转化。在一个具体实施方案中,发根根瘤菌或根癌农杆菌包含二元载体,所述二元载体在其t-dna区域中包含如下定义的一个或多个表达盒。所述发根根瘤菌或根癌农杆菌还包含含有来源于农杆菌ti质粒的vir基因的辅助质粒。这些基因编码一系列蛋白质,所述蛋白质在左右边界序列处切割所述二元质粒,并促进t-dna转导到宿主植物的细胞中。
114.在一个优选实施方案中,包含编码重组病毒载体生产所需蛋白质组分的一个或多个表达盒的细菌菌株如发根根瘤菌或根癌农杆菌还包含形成毛状根所需的rol基因。
115.在一个具体实施方案中,使用两种或更多种细菌菌株,其中所述两种或更多种细菌菌株包含不同的表达盒,所述表达盒编码重组病毒载体生产所需的蛋白质组分。
116.如本文所用,术语“表达盒”具有其在本领域的一般含义。它是指一个或多个基因表达所需的元件的组合。
117.在一个方面,本发明还涉及此类表达盒。
118.所述表达盒可以包含在任何合适的表达载体中。通常,所述表达载体可以是适合在植物细胞中表达的二元载体,诸如prd400、pbin19、pbinplus或pcambia二元载体,所述二元载体已经过修饰以包括本发明的一个或多个表达盒。bahramnejad等人,2019的表2描述了二元载体的其他示例。在一个具体实施方案中,所述二元载体是prd400。
119.在一个实施方案中,所述表达盒包括启动子、编码重组病毒载体生产所需的蛋白质组分的一个或多个基因和多聚腺苷酸化序列。在一个具体实施方案中,所述表达盒还包括增强子。
120.可以使用适合在植物细胞中表达的任何启动子。在一个具体实施方案中,所述启动子是适合在真核细胞如昆虫或哺乳动物细胞中表达而且还适合在植物细胞中表达的启动子。本领域技术人员能够基于他在分子生物学方面的一般知识就确定真核启动子是否能够驱动基因在植物细胞中表达。举例来说,通过用包含报告基因和启动子的构建体转染植物细胞,所述报告基因可以用于测试构建体中与它可操作地连接的所述启动子的能力。在一个具体实施方案中,所述启动子可以是p19 aav启动子。
121.在一个具体实施方案中,编码重组病毒载体生产所需的蛋白质组分的基因在适合在植物细胞中表达的组成型启动子的控制之下。适合在植物细胞中表达的组成型启动子的非详尽列表包括以下的启动子:花椰菜花叶病毒35s(camv35s)(odell等人,1985)、木薯脉花叶病毒(cvmv)(verdaguer等人,1996)、木尔坦棉花曲叶病毒(clcumv)的c1(xie等人,2003)、紫云英矮缩病毒的组分8(shirasawa-seo等人,2005)、澳大利亚香蕉条纹病毒(bsv)(schenk等人,2001)、紫茉莉花叶病毒(mmv)(dey和maiti,1999)、玄参花叶病毒(fmv)(sanger等人,1990)、玉米聚泛素-1(christensen等人,1992)、水稻肌动蛋白(mcelroy等人,1990)、来自拟南芥的肌动蛋白(an等人,1996)、来自农杆菌的胭脂碱合酶(nos)(an等人,1988)、来自农杆菌的rold(fei等人,2003)或其任何功能变体。
122.在另一个具体实施方案中,编码重组病毒载体生产所需的蛋白质组分的基因在适合在植物细胞中表达的诱导型启动子的控制之下。适合在植物细胞中表达的启动子的非详尽列表包括:原始霉素响应性(frey等人,2001)、来自玉米的in2-2(de veylder等人,1997)、来自马铃薯的wun1(siebertz等人,1989)、来自农杆菌的甘露碱合酶(langridge等人,1989)、来自大豆的热休克启动子gmshp17.3(等人,1989)、乙醇脱氢酶(felenbok等人,1988)或其任何功能变体。
123.在一个具体实施方案中,所述诱导型启动子是乙醇脱氢酶启动子(felenbok等人,1988)或其任何功能变体。
124.在一个具体实施方案中,所述编码重组病毒载体生产所需的蛋白质组分的基因在衍生自感染十字花科植物的病毒的启动子如花椰菜花叶病毒35s(camv35s)启动子或其功能变体的控制之下。
125.在一个具体实施方案中,所述启动子是camv35s启动子的功能变体,与野生型camv35s启动子相比具有增强的转录活性。具体来说,camv35s的功能变体包含-343至-90bp片段的复制物,如kay等人,1987所述。在一个具体实施方案中,所述camv35s功能变体与seq id no:13的核苷酸序列具有至少80%、85%、90%、95%、99%或100%同一性。
[0126]“其功能变体”是指保持其衍生的启动子的功能,即能够引发特定基因转录的任何变体。具体来说,与野生型启动子相比,所述功能变体可以具有至少50%、60%、70%、80%、90%、95%、99%或至少100%的转录诱导活性。功能变体的转录诱导活性甚至可以是野生型启动子活性的100%以上,诸如110%、120%、130%、140%以上或甚至150%以上。
[0127]
在一个具体实施方案中,所述启动子是camv35s启动子,诸如序列seq id no:9的camv35s或其功能变体。与seq id no:9的野生型camv25s启动子相比,所述camv35s功能变
体可以具有至少50%、60%、70%、80%、90%、95%、99%或至少100%的转录诱导活性。所述功能变体的转录诱导活性甚至可以是seq id no:9的野生型camv25s启动子活性的100%以上,诸如110%、120%、130%、140%以上或甚至150%以上。
[0128]
在一个具体实施方案中,所述启动子是胭脂碱合酶(nos)启动子,诸如序列seq id no:11的nos启动子或其功能变体。与seq id no:11的野生型nos启动子相比,所述nos功能变体可以具有至少50%、60%、70%、80%、90%、95%、99%或至少100%的转录诱导活性。所述功能变体的转录诱导活性甚至可以是seq id no:11的野生型nos启动子活性的100%以上,诸如110%、120%、130%、140%以上或甚至150%以上。
[0129]
在一个具体实施方案中,所述启动子是乙醇脱氢酶启动子,诸如序列seq id no:14的乙醇脱氢酶启动子或其功能变体。与seq id no:14的野生型乙醇脱氢酶启动子相比,所述乙醇脱氢酶启动子功能变体可以具有至少50%、60%、70%、80%、90%、95%、99%或至少100%的转录诱导活性。所述功能变体的转录诱导活性甚至可以是seq id no:14的野生型乙醇脱氢酶启动子活性的100%以上,诸如110%、120%、130%、140%以上或甚至150%以上。
[0130]
在一个具体实施方案中,所述表达盒包含在编码重组病毒载体生产所需的蛋白质组分的基因下游的终止子序列。“终止子序列”意指包含3'utr序列和用以终止转录的多聚腺苷酸化信号的序列。可以使用能够在植物细胞中介导转录终止的任何终止子序列。
[0131]
在一个具体实施方案中,所述终止子序列是胭脂碱合酶(nos)终止子或camv35s终止子。
[0132]
编码重组病毒载体生产所需的蛋白质组分的基因对本领域技术人员是众所周知的。技术人员能够调整说明书的实验部分所用的表达盒以适应他们希望生产的特定病毒载体。
[0133]
可以对编码重组病毒载体生产所需的蛋白质组分的基因进行密码子优化以提高它们在植物细胞中的表达。
[0134]
编码重组病毒载体生产所需的蛋白质组分的基因包含起始密码子。举例来说,所述起始密码子可以是atg三核苷酸或替代起始密码子,诸如acg、ctg、gtg和ttg起始密码子。
[0135]
在一个具体实施方案中,如上所述的一个或多个表达盒包含编码重组aav病毒载体生产所需的蛋白质组分的基因。
[0136]
在一个具体实施方案中,本发明的一个或多个表达盒包含aav cap和rep基因。
[0137]
在一个具体实施方案中,本发明的一个或多个表达盒包含编码对应于raav载体的结构衣壳(cap)蛋白的aav vp1蛋白、vp2蛋白和/或vp3蛋白的基因。在一个具体实施方案中,本发明的一个或多个表达盒还包含编码衣壳组装所需的aap蛋白的基因。
[0138]
在一个具体实施方案中,本发明的一个或多个表达盒包含编码对应于病毒复制所需的蛋白的rep52蛋白和/或rep78的基因。
[0139]
在一个具体实施方案中,所述aav cap和rep基因包含在同一表达盒中。在一个具体实施方案中,第一表达盒包含aav cap基因,并且第二表达盒包含aav rep基因。所述包含aav cap基因的第一表达盒和包含aav rep基因的第二表达盒可以包含如上所述适合在植物细胞中表达的任何启动子序列。在一个具体实施方案中,aav cap基因和/或aav rep基因在适合在植物细胞中表达的组成型启动子的控制之下。在另一个具体实施方案中,aav cap
基因和/或aav rep基因在适合在植物细胞中表达的诱导型启动子的控制之下。
[0140]
在一个具体实施方案中,所述aav cap和rep基因各自在衍生自感染十字花科植物的病毒的启动子如花椰菜花叶病毒35s(camv35s)启动子的控制之下。在这个实施方案中,第一表达盒包含在camv35s启动子控制之下的aav cap基因,并且第二表达盒包含在camv35s启动子控制之下的aav rep基因。
[0141]
在一个具体实施方案中,分别包含aav cap基因和aav rep基因的第一表达盒和第二表达盒还包含如上所述的终止子序列。可以使用能够在植物细胞中介导转录终止的任何终止子序列。在一个具体实施方案中,包含aav cap基因的第一表达盒包含camv35s终止子序列。在一个具体实施方案中,包含aav rep基因的第二表达盒包含胭脂碱合酶(nos)终止子序列。
[0142]
在一个具体实施方案中,第一表达盒包含camv35s启动子、aav cap基因和camv35s终止子序列。
[0143]
在一个具体实施方案中,第二表达盒包含camv35s启动子、aav rep基因和nos终止子序列。
[0144]
在一个具体实施方案中,第一表达盒和第二表达盒还包含增强子,诸如衍生自烟草花叶病毒的增强子,诸如烟草花叶病毒ω(tmvω)增强子。
[0145]
在一个具体实施方案中,将第一表达盒和第二表达盒克隆到一个或两个表达载体中。在一个优选实施方案中,将第一表达盒和第二表达盒克隆到单个表达载体中。在一个具体实施方案中,将第一表达盒和第二表达盒克隆到二元载体如prd400二元载体中。
[0146]
可以使用任何aav血清型的cap和rep基因。cap和rep基因可以是天然或人工序列。
[0147]
在本发明中,aav载体的cap基因或编码vp1、vp2或vp3衣壳蛋白的基因可以衍生自天然或非天然存在的血清型。在一个具体实施方案中,所述aav载体衣壳的血清型选自aav天然血清型。作为使用aav天然血清型的替代方案,在本发明的上下文中可以使用人工aav血清型,包括但不限于具有非天然存在的衣壳蛋白的aav。此类人工衣壳可以通过任何合适的技术,使用所选aav序列(例如,vp1衣壳蛋白的片段)与可以从不同的所选aav血清型、相同aav血清型的不连续部分、从非aav病毒来源或从非病毒来源获得的异源序列组合来产生。来自人工aav血清型的衣壳可以是但不限于嵌合aav衣壳、重组aav衣壳或“人源化”aav衣壳。
[0148]
根据一个具体实施方案,所述cap基因或编码vp1、vp2或vp3的基因编码以下的衣壳:aav-1、aav-2、aav-2变体(诸如ling等人,2016公开的包括具有y44+500+730f+t491v变化的工程改造衣壳的四重突变体衣壳优化aav-2)、aav-3和aav-3变体(诸如vercauteren等人,2016公开的包括具有两个氨基酸变化s663v+t492v的工程改造aav3衣壳的aav3-st变体)、aav-3b和aav-3b变体、aav-4、aav-5、aav-6和aav-6变体(诸如rosario等人,2016公开的aav6变体,包括三突变aav6衣壳y731f/y705f/t492v形式)、aav-7、aav-8、aav-9和aav-9变体(诸如aavhu68)、aav-2g9、aav-10如aav-cy10和aav-rh10、aav-rh39、aav-rh43、aav-rh74、aav-dj、anc80、lk03、aav.php、aav2i8、猪aav如aavpo4和aavpo6,以及aav血清型的酪氨酸、赖氨酸和丝氨酸衣壳突变体。此外,cap基因可以编码通过改组、原理设计、易错pcr和机器学习技术获得的其他非天然工程改造变体(诸如aav-spark100)、嵌合aav或aav血清型的衣壳。在一个具体实施方案中,所述cap基因编码衍生自至少两种不同aav血清型的vp衣
壳蛋白,或编码组合了衍生自至少两种aav血清型的vp蛋白区域或结构域的至少一种嵌合vp蛋白。举例来说,嵌合aav衣壳可以衍生自aav8衣壳序列与不同于aav8血清型的aav血清型的序列的组合,诸如上文具体提到的那些。在另一个实施方案中,所述aav载体的衣壳包含一种或多种变体vp衣壳蛋白,诸如wo2015013313所述的那些,特别是rhm4-1、rhm15-1、rhm15-2、rhm15-3/rhm15-5、rhm15-4和rhm15-6衣壳变体。在一个具体实施方案中,所述aav载体的衣壳是aav血清型9(aav9)和aav血清型74(aavrh74)衣壳蛋白之间的杂合体。举例来说,所述aav血清型可以是wo2019/193119公开的-rh74-9血清型(诸如wo2019/193119的实施例中所述的杂合cap rh74-9血清型;rh74-9血清型在本文中又称为
“‑
rh74-9”、“aavrh74-9”或“aav-rh74-9”)或wo2019/193119公开的-9-rh74血清型(诸如wo2019/193119的实施例中所述的杂合cap 9-rh74血清型;-9-rh74血清型在本文中又称为
“‑
9-rh74”、“aav9-rh74”、“aav-9-rh74”或“rh74-aav9”)。在一个具体实施方案中,所述aav载体的衣壳是aav血清型9(aav9)和aav血清型74(aavrh74)衣壳蛋白之间的肽修饰杂合体,如pct/ep2019/076958所述,诸如aav9-rh74杂合体衣壳或经p1肽修饰的aavrh74-9杂合体衣壳。
[0149]
在一个具体实施方案中,所述cap基因或编码vp1、vp2或v3的基因编码天然存在的衣壳,诸如aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav-cy10、aavrh10衣壳。在一个具体实施方案中,本发明所用的cap基因或编码vp1、vp2或vp3的基因编码aav8衣壳。
[0150]
在一个具体实施方案中,可以使用任何天然aav载体的rep基因。具体来说,使用了aav2载体的rep基因。在一个具体实施方案中,使用了编码aav2的rep52和rep78的基因。
[0151]
在一个具体实施方案中,所述表达盒中包含的cap基因编码功能性衣壳蛋白,所述基因与seq id no:1的核苷酸序列具有至少60%、65%、70%、75%、80%、85%、90%、95%、99%、99.8%或100%同一性。
[0152]
在一个具体实施方案中,所述表达盒中包含的rep基因编码功能性rep蛋白,所述基因与seq id no:2的核苷酸序列具有至少60%、65%、70%、75%、80%、85%、90%、95%、99%、99.8%或100%同一性。
[0153]
在一个具体实施方案中,所述表达盒中包含的编码vp1蛋白的基因编码功能性vp1蛋白,所述基因与seq id no:3的核苷酸序列具有至少60%、65%、70%、75%、80%、85%、90%、95%、99%、99.8%或100%同一性。
[0154]
在一个具体实施方案中,所述表达盒中包含的编码vp1蛋白的基因编码与seq id no:17的氨基酸序列具有至少60%、65%、70%、75%、80%、85%、90%、95%、99%、99.8%或100%同一性的功能性vp1蛋白。
[0155]
在一个具体实施方案中,表达盒中包含的编码vp2蛋白的基因编码功能性vp2蛋白,所述基因与seq id no:4的核苷酸序列具有至少60%、65%、70%、75%、80%、85%、90%、95%、99%、99.8%或100%同一性。
[0156]
在一个具体实施方案中,所述表达盒中包含的编码vp2蛋白的基因编码与seq id no:18的氨基酸序列具有至少60%、65%、70%、75%、80%、85%、90%、95%、99%、99.8%或100%同一性的功能性vp2蛋白。
[0157]
在一个具体实施方案中,表达盒中包含的编码vp3蛋白的基因编码功能性vp3蛋白,所述基因与seq id no:5的核苷酸序列具有至少60%、65%、70%、75%、80%、85%、
90%、95%、99%、99.8%或100%同一性。
[0158]
在一个具体实施方案中,所述表达盒中包含的编码vp3蛋白的基因编码与seq id no:19的氨基酸序列具有至少60%、65%、70%、75%、80%、85%、90%、95%、99%、99.8%或100%同一性的功能性vp3蛋白。
[0159]
在一个具体实施方案中,表达盒中包含的编码aap蛋白的基因编码功能性aap蛋白,所述基因与seq id no:6的核苷酸序列具有至少60%、65%、70%、75%、80%、85%、90%、95%、99%、99.8%或100%同一性。
[0160]
在一个具体实施方案中,所述表达盒中包含的编码aap蛋白的基因编码与seq id no:20的氨基酸序列具有至少60%、65%、70%、75%、80%、85%、90%、95%、99%、99.8%或100%同一性的功能性aap蛋白。
[0161]
在一个具体实施方案中,表达盒中包含的编码rep52蛋白的基因编码功能性rep52蛋白,所述基因与seq id no:7的核苷酸序列具有至少60%、65%、70%、75%、80%、85%、90%、95%、99%、99.8%或100%同一性。
[0162]
在一个具体实施方案中,所述表达盒中包含的编码rep52蛋白的基因编码与seq id no:21的氨基酸序列具有至少60%、65%、70%、75%、80%、85%、90%、95%、99%、99.8%或100%同一性的功能性rep52蛋白。
[0163]
在一个具体实施方案中,表达盒中包含的编码rep78蛋白的基因编码功能性rep78蛋白,所述基因与seq id no:8的核苷酸序列具有至少60%、65%、70%、75%、80%、85%、90%、95%、99%、99.8%或100%同一性。
[0164]
在一个具体实施方案中,所述表达盒中包含的编码rep78蛋白的基因编码与seq id no:22的氨基酸序列具有至少60%、65%、70%、75%、80%、85%、90%、95%、99%、99.8%或100%同一性的功能性rep78蛋白。
[0165]
在一个具体实施方案中,本发明的一个或多个表达盒包含编码vp1蛋白、vp2蛋白、vp3蛋白、aap(组装激活蛋白)、rep52蛋白和/或rep78蛋白的基因。
[0166]
编码vp1蛋白、vp2蛋白、vp3蛋白、aap(组装激活蛋白)、rep52蛋白和/或rep78蛋白的基因可以进行密码子优化以提高它们在植物细胞中的表达。
[0167]
编码vp1蛋白、vp2蛋白、vp3蛋白、aap(组装激活蛋白)、rep52蛋白和/或rep78蛋白的基因可以在使它们能够在植物细胞中表达的任何启动子的控制之下。
[0168]
在一个具体实施方案中,编码vp1、vp2、vp3、aap、rep52和rep78的基因中有至少两个在相同启动子的控制之下。
[0169]
在另一个实施方案中,所述编码vp1的基因包含在包含与所述编码vp1的基因可操作地连接的启动子的表达盒中;所述编码vp2的基因包含在包含与所述编码vp2的基因可操作地连接的启动子的表达盒中;所述编码vp3的基因包含在包含与所述编码vp3的基因可操作地连接的启动子的表达盒中;所述编码aap的基因包含在包含与所述编码aap的基因可操作地连接的启动子的表达盒中;所述编码rep52的基因包含在包含与所述编码rep52的基因可操作地连接的启动子的表达盒中;而所述编码rep78的基因包含在包含与所述编码rep78的基因可操作地连接的启动子的表达盒中。
[0170]
在一个具体实施方案中,将包含选自编码vp1、vp2、vp3、aap、rep52或rep78蛋白的基因的一个基因的每一个盒都克隆到一个或多个载体中。优选地,将包含选自编码vp1、
vp2、vp3、aap、rep52或rep78蛋白的基因的每一个基因中所有的盒都克隆到同一载体中。在一个具体实施方案中,将所有的盒都克隆到二元载体如prd400二元载体中。
[0171]
在一个具体实施方案中,所述编码vp1、vp2、vp3、aap、rep52或rep78蛋白的基因在适合在植物细胞中表达的组成型启动子的控制之下。适合在植物细胞中表达的组成型启动子的非详尽列表包括以下的启动子:花椰菜花叶病毒35s(camv35s)(odell等人,1985)、木薯脉花叶病毒(cvmv)(verdaguer等人,1996)、木尔坦棉花曲叶病毒(clcumv)的c1(xie等人,2003)、紫云英矮缩病毒的组分8(shirasawa-seo等人,2005)、澳大利亚香蕉条纹病毒(bsv)(schenk等人,2001)、紫茉莉花叶病毒(mmv)(dey和maiti,1999)、玄参花叶病毒(fmv)(sanger等人,1990)、玉米聚泛素-1(christensen等人,1992)、水稻肌动蛋白(mcelroy等人,1990)、来自拟南芥的肌动蛋白(an等人,1996)、来自农杆菌的胭脂碱合酶(nos)(an等人,1988)、来自农杆菌的rold(fei等人,2003)或其任何功能变体。
[0172]
在另一个具体实施方案中,所述编码vp1、vp2、vp3、aap、rep52或rep78蛋白的基因在适合在植物细胞中表达的诱导型启动子的控制之下。适合在植物细胞中表达的启动子的非详尽列表包括:原始霉素响应性(frey等人,2001)、来自玉米的in2-2(de veylder等人,1997)、来自马铃薯的wun1(siebertz等人,1989)、来自农杆菌的甘露碱合酶(langridge等人,1989)、来自大豆的热休克启动子gmshp17.3(等人,1989)、乙醇脱氢酶(felenbok等人,1988)或其任何功能变体。
[0173]“其功能变体”是指保持其衍生的启动子的功能,即能够引发特定基因转录的任何变体。
[0174]
在一个具体实施方案中,编码vp1、vp2、vp3、aap、rep52或rep78蛋白的基因在衍生自感染十字花科植物的病毒的启动子如花椰菜花叶病毒35s(camv35s)启动子或其功能变体的控制之下。在一个具体实施方案中,所述启动子是camv35s启动子的功能变体,与野生型camv35s启动子相比具有增强的转录活性。具体来说,camv35s的功能变体包含-343至-90bp片段的复制物,如kay等人,1987所述。在一个具体实施方案中,所述camv35s功能变体与seq id no:13的核苷酸序列具有至少80%、85%、90%、95%、99%或100%同一性。
[0175]
在一个具体实施方案中:
[0176]-编码vp1的基因在弱启动子如胭脂碱合酶(nos)启动子或其功能变体的控制之下;
[0177]-编码vp2的基因在弱启动子如胭脂碱合酶(nos)启动子或其功能变体的控制之下;
[0178]-编码vp3的基因在强启动子如camv35s启动子或其功能变体,优选与seq id no:13的核苷酸序列具有至少80%、85%、90%、95%、99%或100%同一性的功能变体的控制之下;和/或
[0179]-编码aap的基因在强启动子如camv35s启动子或其功能变体,优选与seq id no:13的核苷酸序列具有至少80%、85%、90%、95%、99%或100%同一性的功能变体的控制之下。
[0180]
在一个具体实施方案中,根据本发明的至少一种载体包括:
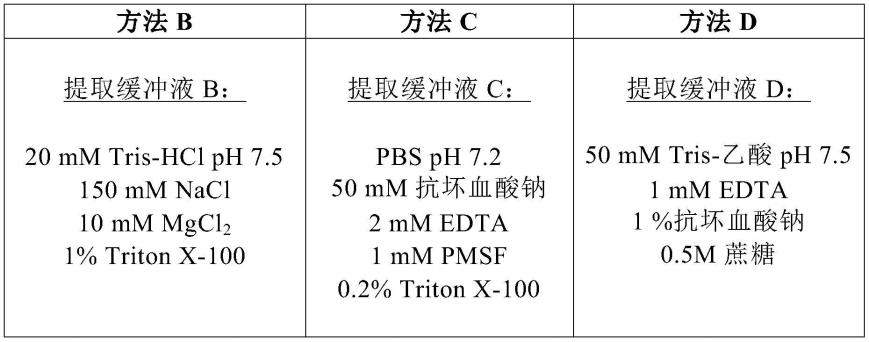
[0181]-包括nos启动子或其功能变体、编码vp1的基因和终止子序列如nos终止子序列的表达盒;
[0182]-包括nos启动子或其功能变体、编码vp2的基因和终止子序列如nos终止子序列的表达盒;
[0183]-包括camv35s启动子或其功能变体(优选与seq id no:13的核苷酸序列具有至少80%、85%、90%、95%、99%或100%同一性的功能变体)、编码vp3的基因和终止子序列如camv35s终止子序列的表达盒;和/或
[0184]-包括camv35s启动子或其功能变体(优选与seq id no:13的核苷酸序列具有至少80%、85%、90%、95%、99%或100%同一性的功能变体)、编码aap的基因和终止子序列如camv35s终止子序列的表达盒。
[0185]
在另一个具体实施方案中:
[0186]-编码vp1的基因在诱导型启动子,如乙醇脱氢酶启动子或其功能变体的控制之下;
[0187]-编码vp2的基因在诱导型启动子,如乙醇脱氢酶启动子或其功能变体的控制之下;
[0188]-编码vp3的基因在诱导型启动子,如乙醇脱氢酶启动子或其功能变体的控制之下;和/或
[0189]-编码aap的基因在诱导型启动子,如乙醇脱氢酶启动子或其功能变体的控制之下。
[0190]
在一个具体实施方案中,根据本发明的至少一种载体包括:
[0191]-包括乙醇脱氢酶启动子或其功能变体、编码vp1的基因和终止子序列如nos终止子序列的表达盒;
[0192]-包括乙醇脱氢酶启动子或其功能变体、编码vp2的基因和终止子序列如nos终止子序列的表达盒;
[0193]-包括乙醇脱氢酶启动子、编码vp3的基因、终止子序列如camv35s终止子序列和任选的增强子序列如tmvω增强子的表达盒;和/或
[0194]-包括乙醇脱氢酶启动子、编码aap的基因、终止子序列如camv35s终止子序列的表达盒。
[0195]
在一个具体实施方案中,所述tmvω增强子具有与seq id no:16的核苷酸序列具有至少80%、85%、90%、95%、99%或100%同一性的序列。
[0196]
在一个具体实施方案中,还对编码vp1、vp2、vp3和/或aap的基因进行了密码子优化以提高它们在植物细胞中的表达。
[0197]
当使用乙醇脱氢酶的诱导型启动子时,根据本发明的至少一种载体还包括编码激活乙醇脱氢酶启动子所必需的alcr蛋白的表达盒。在一个具体实施方案中,所述编码alcr蛋白的基因编码功能性alcr蛋白,所述基因与seq id no:15的核苷酸序列具有至少60%、65%、70%、75%、80%、85%、90%、95%、99%或100%同一性。在一个具体实施方案中,所述表达盒中包括的编码alcr蛋白的基因编码与seq id no:23的氨基酸序列具有至少60%、65%、70%、75%、80%、85%、90%、95%、99%、99.8%或100%同一性的功能性alcr蛋白。
[0198]
在一个具体实施方案中:
[0199]-编码rep52的基因在诱导型启动子,如乙醇脱氢酶启动子或其功能变体的控制之下;和/或
[0200]-编码rep78的基因在诱导型启动子,如乙醇脱氢酶启动子或其功能变体的控制之下。
[0201]
在一个具体实施方案中,根据本发明的至少一种载体包括:
[0202]-包括乙醇脱氢酶启动子或其功能变体、编码rep52的基因、终止子序列如camv35s终止子序列和任选的增强子如tmvω增强子的表达盒;
[0203]
和/或
[0204]-包括乙醇脱氢酶启动子或其功能变体、编码rep78的基因和终止子序列如nos终止子序列的表达盒。
[0205]
在一个具体实施方案中,还对编码rep52和/或rep78的基因进行了密码子优化以提高它们在植物细胞中的表达。
[0206]
当使用乙醇脱氢酶的诱导型启动子时,根据本发明的至少一种载体还包括编码激活乙醇脱氢酶启动子所必需的alcr蛋白的表达盒。
[0207]
重组病毒载体的回收
[0208]
在一个实施方案中,通过收集在其中培养毛状根的培养基来回收重组病毒载体。
[0209]
在一个具体实施方案中,收集了含有所述重组体的培养基并直接用于未来应用。
[0210]
有利地,根据这个实施方案的含有重组病毒载体的培养基适合人类和/或动物口服使用而无需任何纯化步骤。
[0211]
因此,本发明的另一个方面涉及一种通过上述方法可获得的含有重组病毒载体的培养基。
[0212]
在一个替代实施方案中,所述重组病毒载体在一个或若干个纯化步骤之后获得。适合各重组病毒载体的合适方案是本领域的标准技术,并且技术人员将容易地针对所需应用选择适当的纯化步骤(如果有的话)。
[0213]
在第二实施方案中,所述重组病毒载体是从毛状根提取而来。具体来说,所述病毒载体的回收可以通过化学提取或通过研磨所述毛状根来完成。
[0214]
在另一个具体实施方案中,生产重组哺乳动物病毒载体的方法还包括在经转化的植物的毛状根上诱导侧根出现的步骤,如wo16185122所述。
[0215]
具体来说,所述在经转化的植物的毛状根上诱导侧根出现的步骤可以通过在至少一种生长素的存在下培养经转化的毛状根来进行。
[0216]
在一个具体实施方案中,在包含至少一种生长素的液体培养基中培养所述毛状根。
[0217]
生长素可以选自:2,4-二氯苯氧乙酸(2,4-d)、3-吲哚乙酸(iaa)、吲哚-3-丁酸(iba)、1-萘乙酸(naa)、2,4,5-三氯苯氧乙酸(2,4,5-t)、2,3,5-三碘乙酸、4-氯苯氧乙酸、2-萘氧乙酸、1-萘乙酸、4-氨基-3,5,6-三氯吡啶甲酸、3,6-二氯-2-甲氧基苯甲酸(麦草畏)及其衍生物。
[0218]
本发明的另一个方面涉及通过以下方式可获得或获得的毛状根培养物:
[0219]
a)根据上文详述的任何实施方案诱导从植物形成毛状根;
[0220]
和
[0221]
b)根据上文详述的任何实施方案用至少一种包含一个或多个表达盒的载体转化所述植物;其中所述一个或多个表达盒包含编码所述重组病毒载体生产所需的蛋白质组分
的基因;
[0222]
其中所述植物属于十字花科。
[0223]
本发明的另一个方面涉及一种用至少一种含有一个或多个表达盒的载体转化的转基因植物;其中所述一个或多个表达盒包含编码所述重组病毒载体生产所需的蛋白质组分的基因;
[0224]
其中所述植物属于十字花科。
[0225]
本发明的另一个方面涉及一种通过上述方法可获得或获得的重组病毒载体。
[0226]
实施例
[0227]
材料和方法
[0228]
a.用于aav蛋白表达的重组二元质粒
[0229]
所用序列从质粒p5e18_vd2_8_kanr(repcap_cellules_293,由吉尼松公司提供)中提取。基于人类(起源生物体)和油菜(表达宿主生物体)物种中的密码子使用频率手动优化编码序列。
[0230]
设计了五种包含不同表达盒的构建体。图1示出了五种构建体的示意图。
[0231]
在构建体1中,cap(来自aav8)和rep(来自aav2)基因的表达由camv35s启动子驱动。
[0232]
在构建体2中,vp1和vp2基因各自在nos启动子的控制之下。vp3和aap基因各自在“2*camv35s”启动子的控制之下。“2*camv35s”启动子是包含-343至-90bp片段的复制物的camv35s启动子变体,如kay等人,1987所述。由于缺乏特异性抗aap抗体,因此给aap蛋白添加ha标签以使其能够被检测到。
[0233]
在构建体3中,rep52和rep78在乙醇诱导系统的控制之下。
[0234]
构建体4类似于构建体3,但添加了烟草花叶病毒ω(tmvω)增强子以增强rep52的表达。
[0235]
在构建体5中,用乙醇诱导系统驱动vp1、vp2、vp3和aap的表达。添加了烟草花叶病毒ω(tmvω)增强子以增加vp3的表达。由于缺乏特异性抗aap抗体,因此给aap蛋白添加ha标签以使其能够被检测到。
[0236]
然后在prd400植物表达载体(datla等人,1992)中分别克隆这五种构建体中的每一种。
[0237]
首先在电感受态大肠杆菌(escherichia coli)菌株jm101中,然后在发根根瘤菌菌株atcc 15834中克隆所得质粒prd400-aav。
[0238]
通过电穿孔,利用编码prd400质粒的aav(prd400-aav)转化发根根瘤菌菌株atcc 15834。
[0239]
b.转基因毛状根的产生、选择和培养
[0240]
1.植物物种和体外培养
[0241]
将来自芜菁(brassica rapa rapa)栽培品种
‘
navet des vertus marteau’的种子用增补了数滴triton x100的5%漂白剂表面灭菌10分钟,用无菌水洗涤至少5次,然后放在具有b5琼脂的培养皿上。在20℃下以16小时光/8小时暗的光周期进行萌芽和幼苗生长。
[0242]
2.通过发根根瘤菌进行植物感染
[0243]
我们使用了由巴斯德研究所提供的发根根瘤菌菌株15834(atcc15834)。使发根根
瘤菌在mgl平板(2.5g/l酵母提取物、5g/l胰蛋白胨、5g/l甘露醇、5g/l nacl、1.16g/l谷氨酸na、0.25g/l kh2po4、0.1g/l mgso4、1.0mg/l生物素、8g/l琼脂,ph 7.0)上生长,最后增补50mg/l卡那霉素以用于选择二元质粒。由在25℃下在mgl培养基中生长过夜的20ml液体细菌培养物制备接种物。将悬浮液以15,000rpm离心5分钟,将收集的细胞重悬在新鲜mgl培养基中并稀释至在600nm下获得1
±
0.1的光密度。
[0244]
通过用针刺破3-10日龄幼苗的下胚轴并通过用无菌棉拭子将根瘤菌接种物施用于受伤区域来进行植物感染。毛状根通常在感染之后约2周从受伤部位出现。
[0245]
3.表达aav蛋白的毛状根克隆的选择和培养
[0246]
从幼苗切下长出毛状根的受感染下胚轴,放在增补了3%蔗糖和头孢噻肟(300mg/l)、8g/l琼脂的b5(duchefa)ph 5.8上。7天之后,将独立的毛状根尖转移到新鲜b5-3%蔗糖+头孢噻肟(300mg/l)、8g/l琼脂上,使它们生长4至10天。
[0247]
为了开始在液体培养基中培养,然后将每一个毛状根克隆转移到6ml含3%蔗糖的b5中,持续10天。这之后进行培养基更新,所述培养基还包含2,4-二氯苯氧乙酸(2,4d)。将毛状根克隆再培养10天的时间段。培养20天之后,收集所有样品。使用100mg新鲜生物质进行蛋白质提取和rna提取。
[0248]
c.sds-page和蛋白质印迹
[0249]
使用商业试剂盒(macherey-nagel,参考号740933)并遵循供应商方案进行从毛状根提取蛋白质。取毛状根提取物等分试样,与1/3体积的3x莱姆利缓冲液混合并煮沸5分钟。将40μl各样品载入anykd mini protean tgx聚丙烯酰胺凝胶(bio-rad)。对于蛋白质印迹分析,使用bio-rad turbo trans-blot系统将蛋白质转移到硝酸纤维素膜(bio-rad,hercules,california)。将膜在含5%脱脂牛奶(印迹级阻断剂,bio-rad)的tbs缓冲液中阻断,与抗aav vp1/vp2/vp3小鼠单克隆抗体b1(61058,来自progen)的1:250稀释液一起、或与抗aav2复制酶小鼠单克隆抗体259,5(61071,来自progen)的1:100稀释液一起、或与抗ha标签抗体小鼠单克隆抗体(ab18181,来自abcam)的1:1000稀释液一起孵育,然后与m-iggκbp-hrp抗体(sc-516102,来自santa cruz biotechnology)的1:5000稀释液一起孵育。使用western clarity ecl显示试剂盒(170-5060,bio-rad)使染色显影。
[0250]
d.对芜菁的毛状根中aav颗粒的定量
[0251]
1.芜菁的毛状根中产生的raav2/8载体
[0252]
如前所述开发了芜菁的毛状根克隆。在来自克隆c1-38(包含如上所述的构建体n
°
1)以及来自克隆c2-8和c2-53(包含如上所述构建体n
°
2)的蛋白提取物中对组装的aav颗粒进行检测。包括野生型克隆(即,没有转基因)作为阴性对照。
[0253]
将所述克隆保持20天。简而言之,将1g新鲜毛状根种在100ml含30g/l蔗糖的gamborg b5培养基中,并在23℃和100rpm下培育10天。生长10天之后,将毛状根转移到100ml含30g/l蔗糖并增补了1mg/l 2,4d的新鲜gamborg b5培养基中,并在23℃和100rpm下再培育10天。在培养结束时,收集100mg新鲜生物质,在液氮中冷冻并储存在-80℃以用于随后的蛋白质提取。
[0254]
对生成的每一个样品,如表1所述测试并应用了3种不同的提取方法(下面的方法b、方法c和方法d)。
mwco盒(thermo scientific,illkirch,france)中透析而配制在含ca2+和mg2+的1
×
dpbs中。
[0262]
通过taqman实时pcr测定法从脱氧核糖核酸酶抗性颗粒测定浓度,以病毒基因组/ml(vg/ml)表示。通过使用下面所述的progen aav8衣壳elisa试剂盒测定病毒颗粒中的浓度(衣壳/ml)。
[0263]
根据上述提取方法(b、c或d),将5μl对照载体(对应于5
×
107个衣壳)掺在100μl提取缓冲液(b、c或d)中抑或从野生型克隆(即,没有转基因)获得的100μl毛状根蛋白提取物中。
[0264]
3.raav8-egfp变性载体制备
[0265]
使对照载体在90℃下热变性15分钟以用作阴性对照。这样,我们确保只有组装的衣壳才在elisa中产生信号。
[0266]
将5μl(对应于5
×
107个衣壳)变性载体掺在100μl提取缓冲液(b、c或d)中,或掺在来自野生型克隆(即,没有转基因)的100μl毛状根蛋白提取物中。
[0267]
4.通过elisa进行aav8衣壳滴定
[0268]
通过使用progen aav8衣壳elisa试剂盒(progen biotechnik,heidelberg,germany),遵照制造商的说明书进行通过elisa滴定aav8组装衣壳。
[0269]
结果
[0270]
目标是确定芜菁的毛状根是否能够产生形成aav所需的所有蛋白质(rep、cap和aap蛋白)。
[0271]
为了达到这个目标,设计了如上所述的分子构建体、克隆并使用发根根瘤菌引入芜菁中。生成并分析了芜菁的转基因毛状根。其后呈现了关于构建体1和构建体2的结果。
[0272]
1-对由含有构建体1的毛状根产生aav蛋白的分析
[0273]
对来自含有上文已详述的构建体1的毛状根克隆的蛋白提取物进行了蛋白质印迹分析。
[0274]
蛋白质印迹分析证明了毛状根产生vp1、vp2和vp3蛋白的能力。
[0275]
蛋白质印迹分析还证明了毛状根产生rep蛋白的能力。
[0276]
2-对由含有构建体2的毛状根产生aav蛋白的分析
[0277]
对来自含有上文已详述的构建体2的毛状根克隆的蛋白提取物进行了蛋白质印迹分析。设计了构建体2以使用不同的启动子测试芜菁表达vp1、vp2、vp3和aap(来自aav8)的能力:“2*35s”启动子或nos启动子。
[0278]
蛋白质印迹分析证明了毛状根产生vp1、vp2和vp3蛋白的能力。
[0279]
蛋白质印迹分析还证明了毛状根产生aap-ha蛋白的能力。
[0280]
3.对芜菁的毛状根中aav颗粒的定量
[0281]
我们因此证明了毛状根产生aav rep、vp1、vp2、vp3和aap蛋白的能力。然后目标是确定来自芜菁的毛状根是否能够产生组装的衣壳。
[0282]
对用3种提取方法(如材料和方法中所述)制备的毛状根蛋白提取物中存在的aav颗粒的定量是通过elisa从通过蛋白质印迹证明产生了vp和/或aap蛋白的克隆(c1-38/c2-8/c2-53)测定。
[0283]
包括野生型克隆(即,没有转基因)作为阴性对照。
[0284]
下面的表2中详述的结果证明了来自芜菁的毛状根能够产生组装的衣壳。
[0285][0286]
表2:毛状根蛋白提取物克隆c1-38、c2-8、c2-53中的aav8滴定elisa。
[0287]
将raav8_egfp对照载体掺在提取缓冲液b、c、d中或来自用缓冲液b、c、d制备的野生型克隆(即,没有转基因)的毛状根蛋白提取物中作为阳性对照。使相同的raav8_egfp载体制剂在90℃下热变性15分钟,并以相同方式掺在提取缓冲液b、c、d中或来自野生型克隆(即,没有转基因)的毛状根蛋白提取物中。na:不适用;nd:未测定。
[0288]
可以注意到,利用掺在(1)提取缓冲液中或(2)来自野生型毛状根克隆的蛋白提取物中的对照raav8-egfp载体获得的滴度几乎相同,从而验证了滴定方法。
[0289]
在来自克隆c1-38(指构建体n
°
1)以及来自克隆c2-8和c2-53(指构建体n
°
2)的蛋白提取物中获得的滴度(衣壳/ml)很高,而且与用对照raav8-egfp载体获得的滴度相当。
[0290]
鉴于没有进行浓缩步骤而且使用极少量的起始材料进行提取和定量,在毛状根克隆的蛋白提取物中获得的滴度出乎意料地高。
[0291]
此外,所述结果表明遵照三种不同的提取方法(b、c、d)检测到了aav组装衣壳,从而证明了所述方法的可再现性。
[0292]
参考文献
[0293]
an,g.,costa,m.a.,mitra,a.,ha,s.-b和marton,l.(1988).转基因烟草植物中胭脂碱合酶启动子的器官特异性和发育调控(organ-specific and developmental regulation of the nopaline synthase promoter in transgenic tobacco plants).plant physiology 88,547
–
552.
[0294]
bahramnejad b,naji m,bose r,jha s(2019)使用发根农杆菌及其相关二元载体进行植物转化的重要综述(a critical review on use of agrobacterium rhizogenes and their associated binary vectors for plant transformation.)biotechnol adv s0734
–
9750(19):30095.
[0295]
balakrishnan,b和jayandharan,g.r.(2014).用于基因疗法的腺相关病毒(aav)载体的基础生物学(basic biology of adeno-associated virus(aav)vectors used in gene therapy).curr gene ther 14,86
–
100.
[0296]
barajas d.,aponte-ubillus j.j.,akeefe h.,cinek t.,peltier j.,gold d.(2017)在酿酒酵母中产生感染性重组腺相关病毒(generation of infectious recombinant adeno-associated virus in saccharomyces cerevisiae).plos one.12:e0173010.
[0297]
bartel m.,schaffer d.,b
ü
ning h.(2011)通过衣壳工程改造增强aav载体的临床潜力以逃避预先存在的免疫(enhancing the clinical potential of aav vectors by capsid engineering to evade pre-existing immunity).front.microbiol.2:204.
[0298]
bulgakov vp,aminin dl,shkryl yn,gorpenchenko ty,veremeichik gn,dmitrenok ps,zhuravlev yn.(2008)表达rolc癌基因的茜草细胞中活性氧的抑制和增强的应激耐受性(suppression of reactive oxygen species and enhanced stress tolerance in rubia cordifolia cells expressing the rolc oncogene).mol plant microbe interact 21:1561
–
1570
[0299]
christensen,a.h.,sharrock,r.a和quail,p.h.(1992).玉米多泛素基因:结构、表达和转录物剪接的热扰动,以及通过电穿孔转移到原生质体后的启动子活性(maize polyubiquitin genes:structure,thermal perturbation of expression and transcript splicing,and promoter activity following transfer to protoplasts by electroporation).plant mol.biol.18,675
–
689.
[0300]
de veylder,l.,van montagu,m和inz
é
,d.(1997).在拟南芥中除草剂安全剂诱导的基因表达(herbicide safener-inducible gene expression in arabidopsis thaliana).plant cell physiol.38,568
–
577.
[0301]
dey,n和maiti,i.b.(1999).紫茉莉花叶病毒(mmv)全长转录启动子在转基因植物中的结构和启动子/前导缺失分析(structure and promoter/leader deletion analysis of mirabilis mosaic virus(mmv)full-length transcript promoter in transgenic plants).plant mol.biol.40,771
–
782.
[0302]
fei,h.,chaillou,s.,hirel,b.,mahon,j.d和vessey,j.k.(2003).在不同硝酸盐浓度下生长的豌豆植物中过表达与器官特异性启动子相关的大豆胞质谷氨酰胺合酶基因(overexpression of a soybean cytosolic glutamine synthetase gene linked to organ-specific promoters in pea plants grown in different concentrations of nitrate).planta 216,467
–
474.
[0303]
felenbok,b.,sequeval,d.,mathieu,m.,sibley,s.,gwynne,d.i和davies,r.w.(1988).构巢曲霉中的乙醇调节子:正调节基因alcr的表征和序列(the ethanol regulon in aspergillus nidulans:characterization and sequence of the positive regulatory gene alcr).gene 73,385
–
396.
[0304]
frey,a.d.,rimann,m.,bailey,j.e.,kallio,p.t.,thompson,c.j和fussenegger,m.(2001).植物细胞的新型原始霉素响应表达系统(novel pristinamycin-responsive expression systems for plant cells).biotechnol.bioeng.74,154
–
163.
[0305]
kay,r.,chan,a.,daly,m和mcpherson,j.(1987).camv 35s启动子序列的复制为植物基因创造了强大的增强子(duplication of camv35s promoter sequences creates a strong enhancer for plant genes).science 236,1299
–
1302.
[0306]
langridge,w.h.,fitzgerald,k.j.,koncz,c.,schell,j和szalay,a.a.(1989).根癌农杆菌甘露碱合酶基因的双重启动子受植物生长激素调控(dual promoter of agrobacterium tumefaciens mannopine synthase genes is regulated by plant growth hormones).proc.natl.acad.sci.u.s.a.86,3219
–
3223.
[0307]
ling,c.,li,b.,ma,w.,srivastava,a.(2016).开发优化的aav血清型载体以进一步降低剂量进行高效转导(development of optimized aav serotype vectors for high-efficiency transduction at further reduced doses).hum gene ther methods.aug;27(4):143-9.
[0308]
mccarty dm等人.(2003)腺相关病毒末端重复(tr)突变体产生自互补载体以克服体内转导的限速步骤(adeno-associated virus terminal repeat(tr)mutant generates self-complementary vectors to overcome the rate-limiting step to transduction in vivo).gene ther.10:2112
–
2118.
[0309]
mcelroy,d.,zhang,w.,cao,j和wu,r.(1990).用于水稻转化的有效肌动蛋白启动子的分离(isolation of an efficient actin promoter for use in rice transformation).plant cell 2,163
–
171.
[0310]
odell,j.t.,nagy,f和chua,n.h.(1985).鉴定花椰菜花叶病毒35s启动子活性所需的dna序列(identification of dna sequences required for activity of the cauliflower mosaic virus 35s promoter).nature313,810
–
812.
[0311]
robert,m.-a.,chahal,p.s.,audy,a.,kamen,a.,gilbert,r和gaillet,b.(2017).使用哺乳动物表达平台制造重组腺相关病毒(manufacturing of recombinant adeno-associated viruses using mammalian expression platforms).biotechnol j 12.
[0312]
rosario am等人.(2016).新型衣壳修饰aav6载体的小胶质细胞特异性靶向(microglia-specific targeting by novel capsid-modified aav6 vectors).mol ther methods clin dev.apr 13;3:16026.
[0313]
sanger,m.,daubert,s和goodman,r.m.(1990).玄参花叶病毒强启动子的特征:与类似的花椰菜花叶病毒35s启动子和调节甘露碱合酶启动子的比较(characteristics of a strong promoter from figwort mosaic virus:comparison with the analogous 35s promoter from cauliflower mosaic virus and the regulated mannopine synthase promoter).plant mol.biol.14,433
–
443.
[0314]
schenk,p.m.,remans,t.,s
á
gi,l.,elliott,a.r.,dietzgen,r.g.,swennen,r.,ebert,p.r.,grof,c.p和manners,j.m.(2001).香蕉条纹病毒前基因组rna的启动子在单子叶植物和双子叶植物中对转基因表达具有活性(promoters for pregenomic rna of banana streak badnavirus are active for transgene expression in monocot and dicot plants).plant mol.biol.47,399
–
412.
[0315]
schmulling,t.,schell,j和spena,a.(1988)发根农杆菌单基因影响植物发育
in the genome of uninfected plants).nature,301卷,348
–
350页.
[0326]
xie,y.,liu,y.,meng,m.,chen,l和zhu,z.(2003).棉花卷叶木尔坦病毒中超强植物启动子的分离鉴定(isolation and identification of a super strong plant promoter from cotton leaf curl multan virus).plant mol.biol.53,1
–
14.
[0327]
zhong l等人.(2008)下一代腺相关病毒2载体:酪氨酸点突变导致低剂量高效转导(next generation of adeno-associated virus 2vectors:point mutations in tyrosines lead to high-efficiency transduction at lower doses).proc.natl.acad.sci.u.s.a.105,7827
–
7832
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1