链球菌的无动物产物培养的制作方法
链球菌的无动物产物培养
1.相关申请的交叉引用
2.本技术要求2019年11月18日提交的美国临时申请号62/936,797的权益,该临时申请的公开内容据此通过引用整体并入。
技术领域
3.本公开涉及微生物学和细菌培养方法的领域。
背景技术:
4.动物源性材料(诸如血清和血液)常用于细菌培养过程。除了提供富营养环境之外,存在于动物血液中的血红蛋白还允许耐氧或兼性溶血细菌分解过氧化氢副产物并促进细菌细胞生长。然而,在疫苗生产的背景下在细菌培养过程中使用动物源性产物可导致向疫苗生产中利用的最终细菌组分中引入动物源性污染物,诸如朊病毒蛋白、支原体或病毒。因此,本领域需要不利用动物源性材料的细菌培养方法。
技术实现要素:
5.在一些实施方案中,本公开提供了一种体外细菌培养方法,该方法包括:(a)将过氧化氢酶阴性细菌接种于琼脂培养基上,其中琼脂培养基包含过氧化氢酶并且不含动物源性材料;以及(b)在允许一个或多个细菌菌落在琼脂培养基上生长的条件下在琼脂培养基上温育过氧化氢酶阴性细菌。在一些实施方案中,该方法还包括:(c)从琼脂培养基选择该一个或多个细菌菌落中的一个细菌菌落;(d)将选择的细菌菌落接种于液体培养基中以产生液体细菌培养物;(e)在允许生长的条件下温育液体细菌培养物;以及(f)从液体细菌培养物收获培养的过氧化氢酶阴性细菌。
6.在一些实施方案中,过氧化氢酶阴性细菌选自链球菌属(streptococcus spp.)、梭菌属(clostriudium spp.)、气球菌(aerococcus spp.)、肠球菌属(enterococcus spp.)、明串珠菌属(leuconostoc spp.)、片球菌属(pedioccus spp.)、乏养菌属(abiotrophia spp.)、颗粒链菌属(granulicatella spp.)、孪生球菌属(gemella spp.)、粘滑罗氏菌属(rothia mucilaginosa spp.)、乳球菌属(lactococcus spp.)、漫游球菌属(vagococcus spp.)、创伤球菌属(helcococcus spp.)、格鲁比卡氏菌属(globicatella spp.)和狡诈菌属(dolosigranulum spp.)。
7.在一些实施方案中,过氧化氢酶阴性细菌是选自痢疾志贺菌(s.dysenteriae)1型和鲍氏志贺菌(s.boydii)12型的志贺菌属(shigella spp.)。
8.在一些实施方案中,过氧化氢酶阴性细菌选自链球菌属、梭菌属、气球菌和肠球菌属。在一些实施方案中,链球菌属是a群链球菌(group a streptococcus bacteria)、c群链球菌(group c streptococcus bacteria)或草绿色链球菌(viridians streptococcus bacteria)。在一些实施方案中,a群链球菌是酿脓链球菌(s.pyogenes)。在一些实施方案中,a群链球菌是选自m1、m3、m4、m12、m28的血清型的a群链球菌。在一些实施方案中,链球菌
属是选自变异群、唾液群、牛群、缓症群和咽峡炎群的草绿色链球菌。
9.在一些实施方案中,链球菌属是肺炎链球菌(s.pneumonia)。在一些实施方案中,肺炎链球菌是选自1、2、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15a、15b、17f、18c、19a、19f、20、22f、23f、24f和33f的血清型的肺炎链球菌。在一些实施方案中,肺炎链球菌是选自1、3、14和19a的血清型的肺炎链球菌。在一些实施方案中,肺炎链球菌是选自1、2、3、4、5、6a、6b、6c、7c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、16f、17f、18c、19a、19f、20、20a、20b、21、22f、23a、23b、23f、24f、31、34、35b、33f和38的血清型的肺炎链球菌。
10.在一些实施方案中,气球菌是绿色气球菌(a.viridians)。
11.在一些实施方案中,过氧化氢酶以至少约500国际单位(iu)的浓度存在。在一些实施方案中,过氧化氢酶以约500iu至约10000iu的浓度存在。在一些实施方案中,过氧化氢酶以约4000iu至约6000iu、约4500iu至约6000iu、约5000iu至约6000iu、约5500iu至约6000iu、约4000iu至约5500iu、约4000iu至约5000iu、约4000iu至约4500iu、约4500iu至约5500iu、约4500iu至约5000iu或约5000iu至约5500iu的浓度存在。在一些实施方案中,过氧化氢酶以约4500iu、约4600iu、约4700iu、约4800iu、约4900iu、约5000iu、约5100iu、约5200iu、约5300iu、约5400iu或约5500iu的浓度存在。在一些实施方案中,过氧化氢酶以约5000iu的浓度存在。
12.在一些实施方案中,琼脂培养基还包含酵母提取物、大豆蛋白胨、葡萄糖、一种或多种盐和l-半胱氨酸。在一些实施方案中,该一种或多种盐选自na2co3、nacl和mgso4。
13.在一些实施方案中,l-半胱氨酸以至少约0.5g/l的浓度存在。在一些实施方案中,l-半胱氨酸以约0.5g/l至约5g/l的浓度存在。在一些实施方案中,l-半胱氨酸以约1g/l至约4g/l的浓度存在。在一些实施方案中,l-半胱氨酸以约0.5g/l至约1.5g/l的浓度存在。在一些实施方案中,l-半胱氨酸以约0.5g/l、1.0g/l、1.5g/l、2.0g/l、2.5g/l、3.0g/l、3.5g/l、4.0g/l、4.5g/l或5.0g/l的浓度存在。
14.在一些实施方案中,酵母提取物以至少约5g/l的浓度存在。在一些实施方案中,酵母提取物以约5g/l至约25g/l、约5g/l至约20g/l、约5g/l至约15g/l、约5g/l至约10g/l、约10g/l至约25g/l、约10g/l至约20g/l或约10g/l至约15g/l的浓度存在。在一些实施方案中,酵母提取物以约5g/l、约10g/l、约15g/l、约20g/l或约25g/l的浓度存在。
15.在一些实施方案中,大豆蛋白胨以至少约5g/l的浓度存在。在一些实施方案中,大豆蛋白胨以约5g/l至约25g/l、约5g/l至约20g/l、约5g/l至约15g/l、约5g/l至约10g/l、约10g/l至约25g/l、约10g/l至约20g/l或约10g/l至约15g/l的浓度存在。在一些实施方案中,大豆蛋白胨以约5g/l、约10g/l、约15g/l、约20g/l或约25g/l的浓度存在。
16.在一些实施方案中,允许细菌菌落生长的条件包括约37℃的温度。在一些实施方案中,允许细菌菌落生长的条件包括约34℃和39℃之间的温度。在一些实施方案中,允许细菌菌落生长的条件还包括厌氧培养环境。在一些实施方案中,允许细菌菌落生长的条件还包括至少约5%的co2水平。在一些实施方案中,co2水平介于约5%和约95%之间。在一些实施方案中,允许细菌菌落生长的条件还包括约0%的co2水平。
17.在一些实施方案中,液体培养基包含与琼脂培养基基本上相同的组分。
18.在一些实施方案中,该一个或多个细菌菌落包括不透明、半透明和透明细菌菌落。在一些实施方案中,选择的细菌菌落是不透明细菌菌落。
19.在一些实施方案中,在液体细菌培养物达到预定的光密度(od)阈值之后收获培养的过氧化氢酶阴性细菌。在一些实施方案中,在600nm的波长处测量光密度(od600)。在一些实施方案中,预定的od阈值为至少约1.0的od600。
20.在一些实施方案中,本公开提供了一种通过本文所述方法产生的培养的过氧化氢酶阴性细菌。在一些实施方案中,与使用包含动物源性材料的培养基培养的类似细菌相比,该细菌展现出增强的多糖生产。
21.在一些实施方案中,本公开提供了一种包含本文所述培养的过氧化氢酶阴性细菌的细菌储备液。
22.在一些实施方案中,本公开提供了一种用于体外细菌培养的试剂盒,该试剂盒包括:(a)不含动物源性材料的琼脂培养基;和(b)过氧化氢酶。在一些实施方案中,该试剂盒还包括具有与琼脂培养基基本上相同的组分的液体培养基。
23.在一些实施方案中,本公开提供了一种琼脂糖平板,该琼脂糖平板包含:(a)不含动物源性材料的琼脂培养基;和(b)过氧化氢酶。在一些实施方案中,该琼脂糖平板还包含过氧化氢酶阴性细菌。
24.在一些实施方案中,本公开提供了一种细菌储备液,该细菌储备液包含培养的过氧化氢酶阴性细菌、液体培养基和任选地甘油,其中该细菌储备液不包含动物源性材料。在一些实施方案中,该细菌储备液不包含动物源性血红素。在一些实施方案中,该细菌储备液不包含朊病毒蛋白、支原体或病毒。在一些实施方案中,与包含使用具有动物源性材料的培养基培养的类似细菌的细菌储备液相比,该细菌储备液展现出包含减少量的细胞壁多糖(cwps)污染。
附图说明
25.图1示出了在使用培养基1、2、3和4的阶段1液体培养基培养期间血清型14的od600随时间的变化。
26.图2示出了在使用培养基1、2、3和4的阶段1液体培养基培养期间血清型1的od600随时间的变化。
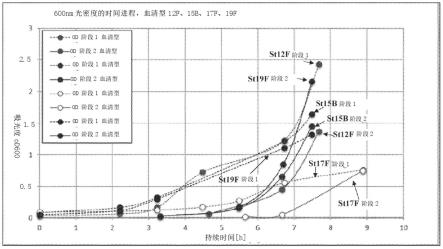
27.图3示出了在使用培养基1和培养基5的阶段1和2液体培养基培养期间血清型1的od600随时间的变化。
28.图4示出了在使用培养基4和培养基5的阶段1和2液体培养基培养期间血清型1的od600随时间的变化。
29.图5示出了使用培养基5的阶段1和2液体培养基培养期间血清型6a和23f的od600随时间的变化。
30.图6示出了使用培养基5的阶段1和2液体培养基培养期间血清型3和19a的od600随时间的变化。
31.图7示出了使用培养基5的阶段1和2液体培养基培养期间血清型6b、7f、9v和18c的od600随时间的变化。
32.图8示出了使用培养基5的阶段1和2液体培养基培养期间血清型8、9n、10a、11a的od600随时间的变化。
33.图9示出了使用培养基5的阶段1和2液体培养基培养期间血清型12f、15b、17f和
19f的od600随时间的变化。
34.图10示出了使用培养基5的阶段1和2液体培养基培养期间血清型2、20、22f和33f的od600随时间的变化。
35.图11示出了使用培养基5的阶段1和2液体培养基培养期间血清型15a、35b和23b的od600随时间的变化。
36.图12示出了使用培养基5的阶段1和2液体培养基培养期间血清型16f、7c和31的od600随时间的变化。
37.图13示出了使用培养基5的阶段1和2液体培养基培养期间血清型23a的od600随时间的变化。
38.图14示出了透明培养基上的表达血清型6a的菌落。
39.图15示出了在600ml规模的培养实验期间经热灭菌(hs)和过滤灭菌(fs)的培养基中的血清型20的od600的时间进程。
具体实施方式
40.概述
41.好氧环境中的细菌生长导致形成活性氧。活性氧(ros)诸如超氧化物(o
2-)会破坏细胞膜和dna并因此抑制生长。细菌细胞已进化成表达超氧化物歧化酶以将超氧化物转化为过氧化氢。遗憾的是,过氧化氢是反应性的并会对细菌细胞造成破坏。因此,为了在好氧环境中生长,一定存在一种机制,细菌可通过该机制将过氧化氢分解成水和氧以防止细菌细胞损伤。
42.一种此类机制是使用存在于血红蛋白中的血红素基团,这些血红素基团催化过氧化氢分解为水和氧。血琼脂平板可提供血红蛋白源。例如,肺炎链球菌在铺板于血琼脂上时是甲型溶血性的,其释放裂解酶,使红细胞部分地水解而释放血红蛋白。可在铺板于绵羊血琼脂平板上的肺炎链球菌菌落周围看到溶血环。当血琼脂平板上的血细胞发生裂解时,它们释放血红蛋白并且血红素基团催化过氧化氢分解为水和氧,从而允许肺炎链球菌在好氧环境中在平板上生长。
43.另一种此类机制是使用过氧化氢酶,这种酶使过氧化氢分解为水和氧。过氧化氢酶的蛋白结构含有促进该活性的血红素基团。若干过氧化氢酶阳性细菌是已知的,包括葡萄球菌属(staphylococci spp.)和微球菌属(micrococci spp.)。其他细菌是过氧化氢酶阴性的,例如链球菌属和肠球菌属,并且不会在好氧环境中在不含血红蛋白的通用实验室培养基上生长。虽然过氧化氢酶阴性细菌可在血琼脂平板上生长,但这增加了朊病毒蛋白污染的风险,这些朊病毒蛋白可引起慢性神经退行性疾病,诸如可传播性海绵状脑病(tse)和牛海绵状脑病(bse)。
44.世界卫生组织已为疫苗生产商发布了关于在疫苗生产中使用动物源性材料诸如血液的指南并且鼓励生产商尽可能避免使用动物来源的材料。(关于结合疫苗的who报告927)。如果需要动物来源的材料,则它们应当源自具有低感染性(ib)或无感染性(ic)的组织并且材料应当源自没有已知感染性的国家(即,新西兰)。各种组织的相对感染性水平提供于下表1中。
45.表1:组织样品的感染性类别
[0046][0047][0048]
本文所提供的方法和组合物使得在不使用动物源性材料的情况下培养过氧化氢酶阴性细菌成为可能,这些动物源性材料可导致药物和生物制品中使用的最终细菌产物的非期望污染。虽然已描述了使用牛源性过氧化氢酶的先前方法,但本文提供的方法允许使用100%无动物源性培养基培养过氧化氢酶阴性细菌,从而减少上述bse/tse担忧。这些方法进一步使得利用相变异技术选择细菌菌落成为可能并且允许在铺板和菌落选择阶段以及发酵阶段期间使用包含相同组分的培养基。这降低了发酵期间因培养基变化而不能生长的可能性,这一要素在采用血琼脂、血红素或其他动物源性材料时是不可能的。
[0049]
本文描述并要求保护的方法的使用也可使得选择在培养时多糖生产力提高的细菌菌落成为可能。多糖生产力提高的培养物可具有在多糖生产中提高效率和/或成本效益的有益效果。例如,效率提高可能是在收获之前培养中的细菌更快生长、培养基原料与所获得的多糖之间的转化率提高、每升发酵液更高的多糖产量等的结果。
[0050]
过氧化氢酶阴性细菌
[0051]
在一些实施方案中,本公开提供了用于过氧化氢酶阴性细菌的体外培养的方法、组合物和试剂盒。“过氧化氢酶阴性细菌”是指由下文所述和reiner等人.,“catalase test protocol”,american society for microbiology,asmmicrobelibrary(2010)中进一步描述的不表达过氧化氢酶并且常用过氧化氢酶测试鉴定为阴性的细菌。
[0052]
过氧化氢酶是存在于多种活生物体中的一种常见酶,其催化过氧化氢分解为水和氧,从而保护细胞免受活性氧造成的氧化损伤。过氧化氢酶具有所有酶的最高周转数之一;一个过氧化氢酶分子每秒可将数百万过氧化氢分子转化为水和氧。过氧化氢酶是四条多肽链的四聚物,每条多肽链超过500个氨基酸长。其含有允许酶与过氧化氢反应的四个含铁血红素基团。人过氧化氢酶的最适ph大约为7,并且其具有相当宽泛的最大值:反应速率在ph6.8和7.5之间不明显改变。来自其他物种的过氧化氢酶的最适ph根据物种的不同而在4和11之间变化。最适温度也因物种而异。
[0053]
过氧化氢酶测试是微生物学家用于鉴定细菌物种的三个主要测试之一。如果细菌拥有过氧化氢酶(即,为过氧化氢酶阳性),则在将少量细菌分离株添加到过氧化氢时会观
察到氧气泡。通过在显微镜载片上滴加一滴过氧化氢来进行过氧化氢酶测试。使涂抹棒接触菌落,然后将顶端涂抹到过氧化氢液滴上。
[0054]
如果混合物产生气泡或泡沫,则该生物体被称为“过氧化氢酶阳性的”。葡萄球菌和微球菌为过氧化氢酶阳性的。其他过氧化氢酶阳性生物体包括李斯特菌(listeria)、白喉棒杆菌(corynebacterium diphtheriae)、洋葱伯克氏菌(burkholderia cepacia)、诺卡菌(nocardia)、肠杆菌科(enterobacteriaceae)(柠檬酸杆菌(citrobacter)、大肠杆菌(e.coli)、肠杆菌(enterobacter)、克雷伯菌(klebsiella)、志贺菌(shigella)、耶尔森菌(yersinia)、变形杆菌(proteus)、沙门氏菌(salmonella)、沙雷氏菌(serratia)、假单胞菌(pseudomonas)、结核分枝杆菌(mycobacterium tuberculosis)、曲霉(aspergillus)、隐球菌(cryptococcus)和马红球菌(rhodococcus equi)。
[0055]
如果混合物不产生气泡或泡沫,则该生物体为“过氧化氢酶阴性的”。链球菌属、梭菌属、气球菌、肠球菌属、明串珠菌属、片球菌属、乏养菌属、颗粒链菌属、孪生球菌属、粘滑罗氏菌属、乳球菌属、漫游球菌属、创伤球菌属、格鲁比卡氏菌属和狡诈菌属是过氧化氢酶阴性细菌的实例。
[0056]
在一些实施方案中,本公开提供了用于过氧化氢酶阴性细菌的体外培养的方法、组合物、试剂盒。在一些实施方案中,过氧化氢酶阴性细菌是厌氧细菌。术语“厌氧菌”是指不需要氧就能生长的生物体。该术语包括专性厌氧菌以及兼性厌氧菌,专性厌氧菌在存在氧的情况下可作出负面反应(例如,死亡),而兼性厌氧菌可在不存在氧的情况下生长并且可在存在氧时通过有氧呼吸制备atp。
[0057]
在一些实施方案中,过氧化氢酶阴性细菌选自链球菌属(streptococcus spp.)、梭菌属(clostriudium spp.)、气球菌(aerococcus spp.)、肠球菌属(enterococcus spp.)、明串珠菌属(leuconostoc spp.)、片球菌属(pedioccus spp.)、乏养菌属(abiotrophia spp.)、颗粒链菌属(granulicatella spp.)、孪生球菌属(gemella spp.)、粘滑罗氏菌属(rothia mucilaginosa spp.)、乳球菌属(lactococcus spp.)、漫游球菌属(vagococcus spp.)、创伤球菌属(helcococcus spp.)、格鲁比卡氏菌属(globicatella spp.)和狡诈菌属(dolosigranulum spp.)。在一些实施方案中,过氧化氢酶阴性细菌是选自痢疾志贺菌(s.dysenteriae)1型和鲍氏志贺菌(s.boydii)12型的志贺菌属(shigella spp.)。
[0058]
在一些实施方案中,过氧化氢酶阴性细菌选自链球菌属、梭菌属、气球菌和肠球菌属。在一些实施方案中,气球菌是绿色气球菌(a.viridians)。在一些实施方案中,链球菌属是a群链球菌(group a streptococcus bacteria)、c群链球菌(group c streptococcus bacteria)或草绿色链球菌(viridians streptococcus bacteria)。在一些实施方案中,a群链球菌是酿脓链球菌(s.pyogenes)。在一些实施方案中,a群链球菌是选自m1、m3、m4、m12、m28的血清型的a群链球菌。
[0059]
在一些实施方案中,链球菌属是选自变异群、唾液群、牛群、缓症群和咽峡炎群的草绿色链球菌。在一些实施方案中,链球菌属是肺炎链球菌(s.pneumonia)。在一些实施方案中,肺炎链球菌是选自1、2、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15a、15b、17f、18c、19a、19f、20、22f、23f、24f和33f的血清型的肺炎链球菌。在一些实施方案中,肺炎链球菌是选自1、3、14和19a的血清型的肺炎链球菌。在一些实施方案中,肺炎链球菌是选自1、2、
3、4、5、6a、6b、6c、7c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、16f、17f、18c、19a、19f、20、20a、20b、21、22f、23a、23b、23f、24f、31、34、35b、33f和38的血清型的肺炎链球菌。
[0060]
培养基
[0061]
在一些实施方案中,本公开提供了利用不含动物源性产物的培养基进行体外细菌培养的方法。术语“动物源性产物”和“动物源性材料”可在本文中互换使用并且是指已从动物或动物细胞纯化的产物或材料。动物源性产物包括血液、血清、生长因子、细胞因子、白蛋白等。本公开的培养基不包含动物源性材料并因此是“无动物组分的培养基”或“无动物源性培养基”。这些术语可在本文中互换使用并且是指没有任何动物源性材料的培养基。具体地讲,此类培养基不含已从动物纯化的任何组分。
[0062]
术语“培养基”是指被设计为支持微生物或细胞的生长的液体或凝胶(例如,琼脂)。可定制这种培养基以满足生物体生长的特定要求和/或其生长的目的。该术语包括“琼脂培养基”和“液体培养基”,琼脂培养基是指固体或半固体培养基,诸如在细菌培养的初始铺板阶段期间使用的琼脂培养基(参见例如,实施例1),而液体培养基诸如为在细菌培养的稍后生长和发酵阶段中使用的液体培养基(参见例如,实施例2)。术语“液体培养基(liquid medium)”和“液体培养基(liquid culture medium)”也可在本公开通篇互换使用。
[0063]
在一些实施方案中,本公开的培养基包括琼脂培养基和液体培养基。
[0064]
当前良好生产规范(gmp)对在用于生产生物制剂(尤其是疫苗)的微生物发酵的培养基开发中若干标准的质量和选择很严格。按照gmp发酵程序,质量体现在整个过程中以确保在安全性、产品标识、质量和纯度方面满足监管机构的要求(fda美国联邦法规第21篇第210、211和600-680节)。理想情况下,培养基应当仅含有基本组分并且应当易于以可重现的方式制备。最后,培养基应当支持将所讨论的微生物培养到高细胞密度以提高体积生产力并且生成其组成和生理条件适合下游处理的最终培养物。因此培养基开发和培养方案开发是gmp生产的重要环节。
[0065]
肺炎链球菌的各种细胞培养基在文献中已有记载并且多种培养基可商购获得。肺炎链球菌是难养细菌,其在5%二氧化碳和复合培养基中生长最佳。接近20%的新鲜临床分离株需要完全厌氧条件。通常,大多数用于难养生物体(诸如肺炎链球菌)的生长的培养基都含有全血(巧克力色血琼脂、木炭培养基)、血液组分诸如血红素(罗伯逊熟肉汤(robertson’s cooked meat broth))、蛋黄(多尔塞特卵培养基(dorset egg media))或其他动物材料。这些组分使得基础培养基营养丰富并且支持难养细菌的生长。
[0066]
然而,在培养基中使用血液组分或其他动物材料可造成严重健康危害,因为可能传递给最终疫苗物质的污染物如外来病毒、朊病毒和支原体的风险增加。此外,动物源性组分(例如,血液、血清等)化学成分不明确。因此,这些组分可能存在批次间变化,从而在培养基的组成中带来批次间变化。培养基中存在这些动物源性组分可进一步增加纯化的复杂性和成本,因为将需要去除动物源性蛋白。
[0067]
因此,在开发不含动物源性材料并且允许以高纯度和产量大规模生产微生物的培养基方面面临挑战。
[0068]
在一些实施方案中,本公开的培养基包含碳源、氮源和磷源中的一种或多种。在一些实施方案中,本公开的培养基包含过氧化氢酶及碳源、氮源和磷源中的一种或多种。在一些实施方案中,本公开的培养基还包含一种或多种盐。
[0069]
碳源
[0070]
在一些实施方案中,本公开的培养基包含一种或多种碳源,该一种或多种碳源选自例如葡萄糖、果糖、乳糖、蔗糖、麦芽糖糊精、淀粉、甘油、植物油(诸如大豆油)、烃类、醇类(诸如甲醇和乙醇)以及有机酸(诸如醋酸)。在一些实施方案中,碳源选自葡萄糖、甘油、乳糖、果糖、蔗糖和大豆油。术语“葡萄糖”包括葡萄糖浆,例如,包含葡萄糖低聚物的葡萄糖组合物。可将碳源以固体或液体形式添加到培养物中。添加到培养基中的碳源的量是诸如技术人员已知和/或存在于可商购获得的培养基中的那些量(参见例如,himedia labs关于葡萄糖琼脂的方案,可在himedia labs网站上查阅,目录号m1589)。
[0071]
在一些实施方案中,碳源是葡萄糖。在一些实施方案中,葡萄糖以至少约5g/l的浓度存在。在一些实施方案中,葡萄糖以约5g/l与约20g/l之间、约5g/l与约15g/l之间、约5g/l与约10g/l之间、约10g/l与约20g/l之间、约15g/l与约20g/l之间或约10g/l与约15g/l之间的浓度存在。在一些实施方案中,葡萄糖以约5g/l、6g/l、7g/l、8g/l、9g/l、10g/l、11g/l、12g/l、13g/l、14g/l、15g/l、16g/l、17g/l、18g/l、19g/l或约20g/l的浓度存在。
[0072]
氮源
[0073]
在一些实施方案中,本公开的培养基包含一种或多种氮源,该一种或多种氮源选自例如尿素、氢氧化铵、铵盐(诸如硫酸铵、磷酸铵、氯化铵和硝酸铵)、其他硝酸盐、氨基酸(诸如谷氨酸和赖氨酸)、酵母提取物、酵母自溶产物、酵母氮源基础、蛋白水解物(包括但不限于蛋白胨、酪蛋白水解物诸如胰蛋白胨和酪蛋白氨基酸)、大豆粕、hy-soy、胰酶大豆肉汤、棉籽粕、麦芽提取物、玉米浆和糖蜜。添加到培养基中的氮源的量是诸如技术人员已知和/或存在于可商购获得的培养基中的那些量。(参见例如,himedia labs关于葡萄糖琼脂的方案,可在himedia labs网站上查阅,目录号m456;以及cold spring harbor关于lb液体培养基的方案,可在cold spring harb protoc上查阅;2006;doi:10.1101/pdb.rec8141)。
[0074]
在一些实施方案中,氮源是酵母提取物。在一些实施方案中,酵母提取物以至少约5g/l的浓度存在。在一些实施方案中,酵母提取物以约5g/l至约25g/l、约5g/l至约20g/l、约5g/l至约15g/l、约5g/l至约10g/l、约10g/l至约25g/l、约10g/l至约20g/l或约10g/l至约15g/l的浓度存在。在一些实施方案中,酵母提取物以约5g/l、约10g/l、约15g/l、约20g/l或约25g/l的浓度存在。
[0075]
在一些实施方案中,氮源是大豆蛋白胨。在一些实施方案中,大豆蛋白胨以至少约5g/l的浓度存在。在一些实施方案中,大豆蛋白胨以约5g/l至约25g/l、约5g/l至约20g/l、约5g/l至约15g/l、约5g/l至约10g/l、约10g/l至约25g/l、约10g/l至约20g/l或约10g/l至约15g/l的浓度存在。在一些实施方案中,大豆蛋白胨以约5g/l、约10g/l、约15g/l、约20g/l或约25g/l的浓度存在。
[0076]
在一些实施方案中,氮源是氨基酸,诸如l-半胱氨酸。在一些实施方案中,l-半胱氨酸以至少约0.5g/l的浓度存在。在一些实施方案中,l-半胱氨酸以约0.5g/l至约5.0g/l的浓度存在。在一些实施方案中,l-半胱氨酸以约0.5g/l至约5/0g/l、约1.0g/l至约5.0g/l、约2.0g/l至约5.0g/l、约3.0g/l至约5.0g/l、约4.0g/l至约5.0g/l、约1.0g/l至约4.0g/l、约1.0g/l至约3.0g/l、约1.0g/l至约2.0g/l、约2.0g/l至约4.0g/l、约3.0g/l至约4.0g/l或约2.0g/l至约3.0g/l的浓度存在。在一些实施方案中,l-半胱氨酸以约0.5g/l、约1.0g/l、约1.5g/l、约2.0g/l、约2.5g/l、约3.0g/l、约3.5g/l、约4.0g/l、约4.5g/l或约5.0g/l的
浓度存在。
[0077]
在一些实施方案中,增加培养基中的l-半胱氨酸浓度可促进培养瓶中的更好生长。在一些实施方案中,在接种之前直接将约1.0g/l、约2.0g/l或约3.0g/l的l-半胱氨酸添加到培养基最适于生长促进。在一些实施方案中,在接种之前直接将约1.0g/l、约2.0g/l或约3.0g/l的l-半胱氨酸添加到培养基促进了生长而不会导致非期望的沉淀。
[0078]
磷源
[0079]
在一些实施方案中,本公开的培养基包含一种或多种磷源。磷可为例如盐的形式,其可作为磷酸盐(诸如磷酸铵或磷酸钾)或多聚磷酸盐来添加。如果使用多聚磷酸盐,则其可为磷酸盐玻璃的形式,诸如多聚磷酸钠。此类磷酸盐玻璃是有用的,因为它们的溶解度特性使得可在混合时不产生沉淀的情况下制备浓缩营养培养基。添加到培养基中的磷源的量是诸如技术人员已知和/或存在于可商购获得的培养基中的那些量。(参见例如,himedia labs关于葡萄糖琼脂的方案,可在himedia labs网站上查阅,目录号m520)。
[0080]
过氧化氢酶
[0081]
在一些实施方案中,本公开的培养基包含过氧化氢酶。在一些实施方案中,包含过氧化氢酶的培养基是琼脂培养基。优选地,过氧化氢酶来源于非动物源。例如,在一些实施方案中,过氧化氢酶来源于黑曲霉(aspergillus niger)(uniprot id:p55303)、烟曲霉(aspergillus fumigatus)(uniprot id:q92405)或大肠杆菌(uniprot id:p13029)。过氧化氢酶可例如从sigma aldrich,ls bio,merck millipore和其他商业来源商购获得。
[0082]
在一些实施方案中,过氧化氢酶以至少约500国际单位(iu)的浓度存在。在一些实施方案中,过氧化氢酶以约500iu至约10000iu的浓度存在。在一些实施方案中,过氧化氢酶以约4000iu至约6000iu、约4500iu至约6000iu、约5000iu至约6000iu、约5500iu至约6000iu、约4000iu至约5500iu、约4000iu至约5000iu、约4000iu至约4500iu、约4500iu至约5500iu、约4500iu至约5000iu或约5000iu至约5500iu的浓度存在。在一些实施方案中,过氧化氢酶以约4500iu、约4600iu、约4700iu、约4800iu、约4900iu、约5000iu、约5100iu、约5200iu、约5300iu、约5400iu或约5500iu的浓度存在。在一些实施方案中,过氧化氢酶以约5000iu的浓度存在。
[0083]
示例性培养基
[0084]
在一些实施方案中,本公开提供了包含过氧化氢酶、酵母提取物、大豆蛋白胨、葡萄糖、一种或多种盐和l-半胱氨酸的琼脂培养基。在一些实施方案中,该一种或多种盐选自nacl、na2co3和mgso4。在一些实施方案中,琼脂培养基还包含hepes溶液(4-(2-羟乙基)-1-哌嗪乙磺酸)。
[0085]
在一些实施方案中,琼脂培养基包含以约4000国际单位(iu)与6000iu之间的浓度存在的过氧化氢酶、以至少约2.5g/l至约7.5g/l的浓度存在的酵母提取物、以约5g/l与约15g/l之间的浓度存在的大豆蛋白胨、以至少约2.5g/l至约7.5g/l的浓度存在的nacl、以至少约0.05g/l至约0.20g/l的浓度存在的na2co3、以至少约0.25g/l至约1.0g/l的浓度存在的mgso4、以至少约0.25g/l至约1.0g/l的浓度存在的l-半胱氨酸以及葡萄糖。在一些实施方案中,琼脂培养基包含以约5000iu的浓度存在的过氧化氢酶、以约5g/l的浓度存在的酵母提取物、以约10g/l的浓度存在的大豆蛋白胨、以约5g/l的浓度存在的nacl、以约0.10g/l的浓度存在的na2co3、以约0.5g/l的浓度存在的mgso4、以约0.5g/l的浓度存在的l-半胱氨酸
以及葡萄糖。
[0086]
在一些实施方案中,琼脂培养基包含以约4000国际单位(iu)与6000iu之间的浓度存在的过氧化氢酶、以至少约5g/l至约15g/l的浓度存在的酵母提取物、以约10g/l与约30g/l之间的浓度存在的大豆蛋白胨、以至少约0.05g/l至约0.20g/l的浓度存在的na2co3、以至少约0.25g/l至约1.0g/l的浓度存在的mgso4、以至少约0.25g/l至约1.0g/l的浓度存在的l-半胱氨酸以及葡萄糖。在一些实施方案中,琼脂培养基包含以约5000iu的浓度存在的过氧化氢酶、以约10g/l的浓度存在的酵母提取物、以约20g/l的浓度存在的大豆蛋白胨、以约0.10g/l的浓度存在的na2co3、以约0.5g/l的浓度存在的mgso4、以约0.5g/l的浓度存在的l-半胱氨酸以及葡萄糖。
[0087]
在一些实施方案中,琼脂培养基包含以约4000国际单位(iu)与6000iu之间的浓度存在的过氧化氢酶、以至少约10g/l至约30g/l的浓度存在的酵母提取物、以约5g/l与约15g/l之间的浓度存在的大豆蛋白胨、以至少约0.1g/l至约1.0g/l的浓度存在的na2co3、以至少约0.5g/l至约2.0g/l的浓度存在的l-半胱氨酸、葡萄糖以及以至少约40g/l至约50g/l的浓度存在的hepes溶液。在一些实施方案中,琼脂培养基包含以约5000iu的浓度存在的过氧化氢酶、以约20g/l的浓度存在的酵母提取物、以约10g/l的浓度存在的大豆蛋白胨、以约0.5g/l的浓度存在的mgso4、以约1.0g/l的浓度存在的l-半胱氨酸、葡萄糖以及以约47g/l的浓度存在的hepes溶液。
[0088]
在一些实施方案中,本公开提供了包含酵母提取物、大豆蛋白胨、葡萄糖、一种或多种盐、l-半胱氨酸和hepes溶液(4-(2-羟乙基)-1-哌嗪乙磺酸)的液体培养基。在一些实施方案中,该一种或多种盐选自na2co3和mgso4。在一些实施方案中,液体培养基还包含磷酸钾缓冲液。
[0089]
在一些实施方案中,液体培养基包含以至少约10g/l至约30g/l的浓度存在的酵母提取物、以至少约5g/l至约15g/l的浓度存在的大豆蛋白胨、以至少约0.1g/l至约1.0g/l的浓度存在的na2co3、以至少约0.5g/l至约2.0g/l的浓度存在的l-半胱氨酸、以至少约40g/l至约50g/l的浓度存在的hepes溶液以及葡萄糖。在一些实施方案中,液体培养基包含以约20g/l的浓度存在的酵母提取物、以约10g/l的浓度存在的大豆蛋白胨、以约0.4g/l的浓度存在的na2co3、以约1.0g/l的浓度存在的l-半胱氨酸、以约47g/l的浓度存在的hepes溶液以及葡萄糖。
[0090]
在一些实施方案中,液体培养基包含以至少约10g/l至约30g/l的浓度存在的酵母提取物、以至少约5g/l至约15g/l的浓度存在的大豆蛋白胨、以至少约0.1g/l至约1.0g/l的浓度存在的na2co3、以至少约2g/l至约8.0g/l的浓度存在的l-半胱氨酸、以至少约40g/l至约50g/l的浓度存在的hepes溶液以及葡萄糖。在一些实施方案中,液体培养基包含以约20g/l的浓度存在的酵母提取物、以约10g/l的浓度存在的大豆蛋白胨、以约0.4g/l的浓度存在的na2co3、以约4.0g/l的浓度存在的l-半胱氨酸、以约47g/l的浓度存在的hepes溶液以及葡萄糖。
[0091]
在一些实施方案中,液体培养基包含以至少约10g/l至约30g/l的浓度存在的酵母提取物、以至少约5g/l至约15g/l的浓度存在的大豆蛋白胨、以至少约0.1g/l至约1.0g/l的浓度存在的na2co3、以至少约2g/l至约8.0g/l的浓度存在的l-半胱氨酸、以至少约40g/l至约50g/l的浓度存在的hepes溶液以及葡萄糖。在一些实施方案中,液体培养基包含以约
20g/l的浓度存在的酵母提取物、以约10g/l的浓度存在的大豆蛋白胨、以约0.4g/l的浓度存在的na2co3、以约3.0g/l的浓度存在的l-半胱氨酸、以约47g/l的浓度存在的hepes溶液以及葡萄糖。
[0092]
在一些实施方案中,液体培养基包含以至少约10g/l至约30g/l的浓度存在的酵母提取物、以至少约5g/l至约15g/l的浓度存在的大豆蛋白胨、以至少约0.1g/l至约1.0g/l的浓度存在的na2co3、以至少约0.5g/l至约2.0g/l的浓度存在的l-半胱氨酸、以至少约40g/l至约50g/l的浓度存在的hepes溶液、葡萄糖以及以至少约0.01m至约0.075m的浓度存在的磷酸钾缓冲液。在一些实施方案中,液体培养基包含以约20g/l的浓度存在的酵母提取物、以约10g/l的浓度存在的大豆蛋白胨、以约0.4g/l的浓度存在的na2co3、以约1.0g/l的浓度存在的l-半胱氨酸、以约47g/l的浓度存在的hepes溶液、葡萄糖以及以约0.05m的浓度存在的磷酸钾缓冲液。
[0093]
在一些实施方案中,液体培养基包含以至少约10g/l至约30g/l的浓度存在的酵母提取物、以至少约5g/l至约15g/l的浓度存在的大豆蛋白胨、以至少约0.1g/l至约1.0g/l的浓度存在的na2co3、以至少约0.5g/l至约2.0g/l的浓度存在的l-半胱氨酸、以至少约40g/l至约50g/l的浓度存在的hepes溶液、葡萄糖以及以至少约0.05m至约0.2m的浓度存在的磷酸钾缓冲液。在一些实施方案中,液体培养基包含以约20g/l的浓度存在的酵母提取物、以约10g/l的浓度存在的大豆蛋白胨、以约0.4g/l的浓度存在的na2co3、以约1.0g/l的浓度存在的l-半胱氨酸、以约47g/l的浓度存在的hepes溶液、葡萄糖以及以约0.1m的浓度存在的磷酸钾缓冲液。
[0094]
培养方案
[0095]
在一些实施方案中,本公开提供了一种体外细菌培养方法,该方法包括将过氧化氢酶阴性细菌接种于琼脂培养基上,其中琼脂培养基包含过氧化氢酶并且不含动物源性材料;以及在允许一个或多个细菌菌落在琼脂培养基上生长的条件下在琼脂培养基上温育过氧化氢酶阴性细菌。在一些实施方案中,该方法还包括从琼脂平板选择该一个或多个细菌菌落中的一个细菌菌落;将选择的细菌菌落接种于液体培养基中以产生液体细菌培养物;在允许生长的条件下温育液体细菌培养物;以及从液体细菌培养物收获培养的过氧化氢酶阴性细菌。
[0096]
在一些实施方案中,本公开提供了一种体外细菌培养方法,该方法包括将过氧化氢酶阴性细菌接种于琼脂培养基上,其中琼脂培养基包含过氧化氢酶并且不含动物源性材料;在允许一个或多个细菌菌落在琼脂培养基上生长的条件下在琼脂培养基上温育过氧化氢酶阴性细菌;从琼脂平板选择该一个或多个细菌菌落中的一个细菌菌落;将选择的细菌菌落接种于液体培养基中以产生液体细菌培养物;在允许生长的条件下温育液体细菌培养物;以及从液体细菌培养物收获培养的过氧化氢酶阴性细菌。
[0097]
在一些实施方案中,允许细菌菌落生长的条件和/或液体培养基的允许生长的条件包括温度、存在于培养环境中的co2的量、存在于培养环境中的o2的量和/或搅拌或曝气速率,诸如本文所述的条件。
[0098]
在一些实施方案中,允许细菌菌落生长的条件和/或液体培养基的允许生长的条件包括约34℃与约39℃之间的温度。因此,可能有必要加热或冷却装有培养物的容器以确保保持恒定培养温度。温度可用于控制倍增时间(td),因此对于给定培养过程,温度在不同
阶段可不同。在一些实施方案中,允许细菌菌落生长的条件和/或液体培养基的允许生长的条件包括约34
°
、约35
°
、约36
°
、约37
°
、约38
°
或约39℃的温度。在一些实施方案中,允许细菌菌落生长的条件和/或液体培养基的允许生长的条件包括约37℃的温度。
[0099]
在一些实施方案中,允许细菌菌落生长的条件和/或液体培养基的允许生长的条件包括厌氧培养环境。在一些实施方案中,允许细菌菌落生长的条件和/或液体培养基的允许生长的条件包括约0%的co2水平。在一些实施方案中,允许细菌菌落生长的条件和/或液体培养基的允许生长的条件包括至少约5%的co2水平。在一些实施方案中,允许细菌菌落生长的条件和/或液体培养基的允许生长的条件包括约5%与约95%之间的co2水平。
[0100]
在一些实施方案中,根据本公开的方法使用的液体培养基和琼脂培养基包含基本上相同的组分。例如,在一些实施方案中,液体培养基和琼脂培养基各自包含酵母提取物、大豆蛋白胨、葡萄糖、一种或多种盐和l-半胱氨酸,并且不包含动物源性材料。
[0101]
在一些实施方案中,从琼脂平板选择的该一个或多个细菌菌落是不透明、半透明或透明菌落。在一些实施方案中,从琼脂平板选择的该一个或多个细菌菌落是不透明菌落。在一些实施方案中,使用立体显微镜选择该一个或多个细菌菌落。本公开的琼脂培养基允许选择不透明菌落,这些不透明菌落被认为包含可用于生产糖蛋白结合疫苗的更大浓度微生物碳水化合物。不可能在传统血琼脂上进行不透明菌落落的选择,因为血琼脂也是不透明的。本公开的琼脂培养基可允许选择具有更高浓度微生物碳水化合物的菌落。图14清晰示出了在本公开的培养基上生长的不透明菌落。选择和使用生产力更高的菌落可使得多糖生产的效率更高。
[0102]
在一些实施方案中,在液体细菌培养物达到预定的光密度(od)阈值之后收获培养的过氧化氢酶阴性细菌。在一些实施方案中,使用分光光度计测量光密度以确定存在于液体培养物中的细菌的量。在一些实施方案中,在600nm的波长处测量光密度(od600)。在一些实施方案中,预定的od阈值为至少约1.0的od600。
[0103]
在一些实施方案中,本文所述的方法在将选择的细菌菌落接种于液体培养基中之前利用了多轮琼脂糖铺板和培养。例如,在一些实施方案中,将过氧化氢酶阴性细菌接种于琼脂培养基上并且在允许一个或多个细菌菌落生长的条件下在琼脂培养基上培养。在此类实施方案中,从琼脂培养基选择细菌菌落并且将其重悬于适当缓冲溶液中。然后将重悬的细菌溶液接种于第二琼脂培养基上,在允许一个或多个细菌菌落在第二琼脂培养基上生长的条件下培养。可重复该过程总共1、2、3、4、5次或更多次以提高用于接种液体培养基的细菌的纯度。
[0104]
组合物和试剂盒
[0105]
在一些实施方案中,本公开提供了一种通过本文所述方法产生的培养的过氧化氢酶阴性细菌。术语“培养的细菌”是指已通过体外方法产生的细菌群。在一些实施方案中,与根据其他方法培养的类似细菌相比,培养的过氧化氢酶阴性细菌展现出增强的多糖生产。例如,在一些实施方案中,通过本文所述方法产生的培养的过氧化氢酶阴性细菌包含比根据其他方法培养的类似细菌的多糖含量高约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%、约100%、约150%、约200%或约250%的多糖含量。
[0106]
在一些实施方案中,本公开提供了一种细菌储备液,该细菌储备液包含通过本文
所述方法产生的培养的过氧化氢酶阴性细菌。一种或多种附加组分可存在于细菌储备液中,诸如液体培养基和/或甘油。在一些实施方案中,本公开提供了一种细菌储备液,该细菌储备液包含培养的过氧化氢酶阴性细菌、液体培养基和任选地甘油,其中该细菌储备液不包含动物源性材料。
[0107]
在一些实施方案中,该细菌储备液不包含污染物,诸如动物源性材料。例如,在一些实施方案中,该细菌储备液不包含动物源性血红素、朊病毒蛋白、支原体和/或病毒。在一些实施方案中,该细菌储备液包含减少的污染物,诸如细胞壁多糖(cwps)。例如,在一些实施方案中,该细菌储备液基本上不含cwps污染物。在一些实施方案中,该细菌储备液包含通过本文所述方法产生的培养的过氧化氢酶阴性细菌,并且与根据其他培养方法培养的类似细菌的细菌储备液相比,包含减少量的cwps污染。在一些实施方案中,与根据其他培养方法培养的类似细菌的细菌储备液相比,通过本文所述方法产生的细菌储备液包含少至少约20%的cwps污染。在一些实施方案中,与根据其他培养方法培养的类似细菌的细菌储备液相比,通过本文所述方法产生的细菌储备液包含少约20%与约70%之间的cwps污染。在一些实施方案中,与根据其他培养方法培养的类似细菌的细菌储备液相比,通过本文所述方法产生的细菌储备液包含少约20%、约30%、约40%、约50%、约60%或约70%的cwps污染。
[0108]
在一些实施方案中,本公开提供了一种琼脂糖平板,该琼脂糖平板包含:不含动物源性材料的琼脂培养基;和过氧化氢酶。在一些实施方案中,该琼脂糖平板还包含过氧化氢酶阴性细菌。
[0109]
在一些实施方案中,本公开提供了用于执行本文所述体外细菌培养方法的试剂盒。在一些实施方案中,试剂盒可包括以下的一者或多者:一种或多种培养基(例如,琼脂培养基和/或液体培养基)、一个或多个琼脂糖平板;过氧化氢酶;用于重构和/或稀释试剂盒组分的一种或多种试剂。试剂盒的组分可处于单独容器中或可在单个容器中组合。在一些实施方案中,试剂盒可包括以下的一者或多者:一种或多种培养基(例如,琼脂培养基和/或液体培养基)、一个或多个琼脂糖平板;过氧化氢酶;细菌储备液;用于重构和/或稀释试剂盒组分的一种或多种试剂。试剂盒的组分可处于单独容器中或可在单个容器中组合。
[0110]
在一些实施方案中,本公开提供了一种用于体外细菌培养的试剂盒,该试剂盒包括:不含动物源性材料的琼脂培养基;和过氧化氢酶。在一些实施方案中,该试剂盒还包括具有与琼脂培养基基本上相同的组分的液体培养基。在一些实施方案中,该试剂盒还包括过氧化氢酶阴性细菌的细菌储备液。
[0111]
除了上述组分之外,在一些实施方案中,试剂盒还包括用于使用试剂盒的组分来实践本公开的方法的说明。用于实践这些方法的说明通常记录在合适的记录介质上。例如,这些说明可印制在诸如纸张或塑料等的承印物上。因此,这些说明可以以包装说明书的形式存在于试剂盒中或存在于试剂盒或其组分(即,与包装或分包装相关联)的容器的标签中。在其他实施方案中,这些说明以电子存储数据文件的形式存在,该电子存储数据文件存在于合适的计算机可读存储介质(例如cd-rom、磁盘、闪存驱动器等)上。在又其他实施方案中,实际说明不存在于试剂盒中,但提供了用于例如经由互联网从远程源获得这些说明的方式。该实施方案的实例是包括web地址的试剂盒,可以在该web地址处查看这些说明和/或可以从该web地址下载这些说明。与这些说明一样,用于获得这些说明的该方式也记录在合适的承印物上。
[0112]
另外的编号的实施方案
[0113]
以下编号的实施方案中提供了本公开的另外实施方案。
[0114]
实施方案1.一种体外细菌培养方法,包括:(a)将过氧化氢酶阴性细菌接种于琼脂培养基上,其中所述琼脂培养基包含过氧化氢酶并且不含动物源性材料;以及(b)在允许一个或多个细菌菌落在所述琼脂培养基上生长的条件下在所述琼脂培养基上温育所述过氧化氢酶阴性细菌。
[0115]
实施方案2.根据实施方案1所述的方法,还包括:(c)从所述琼脂培养基选择所述一个或多个细菌菌落中的一个细菌菌落;(d)将所述选择的细菌菌落接种于液体培养基中以产生液体细菌培养物;(e)在允许生长的条件下温育所述液体细菌培养物;以及(f)从所述液体细菌培养物收获培养的过氧化氢酶阴性细菌。
[0116]
实施方案3.根据实施方案1或实施方案2所述的方法,其中所述过氧化氢酶阴性细菌选自链球菌属、梭菌属、气球菌、肠球菌属、明串珠菌属、片球菌属、乏养菌属、颗粒链菌属、孪生球菌属、粘滑罗氏菌属、乳球菌属、漫游球菌属、创伤球菌属、格鲁比卡氏菌属和狡诈菌属。
[0117]
实施方案4.根据实施方案1或实施方案2所述的方法,其中所述过氧化氢酶阴性细菌是选自痢疾志贺菌1型和鲍氏志贺菌12型的志贺菌属。
[0118]
实施方案5.根据实施方案1或实施方案2所述的方法,其中所述过氧化氢酶阴性细菌选自链球菌属、梭菌属、气球菌和肠球菌属。
[0119]
实施方案6.根据实施方案3或实施方案5所述的方法,其中所述链球菌属是a群链球菌、c群链球菌或草绿色链球菌。
[0120]
实施方案7.根据实施方案6所述的方法,其中所述a群链球菌是酿脓链球菌。
[0121]
实施方案8.根据实施方案6所述的方法,其中所述a群链球菌是选自m1、m3、m4、m12、m28的血清型的a群链球菌。
[0122]
实施方案9.根据实施方案3或实施方案5所述的方法,其中所述链球菌属是选自变异群、唾液群、牛群、缓症群和咽峡炎群的草绿色链球菌。
[0123]
实施方案10.根据实施方案3或实施方案5所述的方法,其中所述链球菌属是肺炎链球菌。
[0124]
实施方案11.根据实施方案10所述的方法,其中所述肺炎链球菌是选自1、2、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15a、15b、17f、18c、19a、19f、20、22f、23f、24f和33f的血清型的肺炎链球菌。
[0125]
实施方案12.根据实施方案10所述的方法,其中所述肺炎链球菌是选自1、3、14和19a的血清型的肺炎链球菌。
[0126]
实施方案13.根据实施方案10所述的方法,其中所述肺炎链球菌是选自1、2、3、4、5、6a、6b、6c、7c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、16f、17f、18c、19a、19f、20、20a、20b、21、22f、23a、23b、23f、24f、31、34、35b、33f和38的血清型的肺炎链球菌。
[0127]
实施方案14.根据实施方案3或实施方案5所述的方法,其中所述气球菌是绿色气球菌。
[0128]
实施方案15.根据实施方案1-14中任一项所述的方法,其中所述过氧化氢酶以至少约500国际单位(iu)的浓度存在。
[0129]
实施方案16.根据实施方案1-14中任一项所述的方法,其中所述过氧化氢酶以约500iu至约10000iu的浓度存在。
[0130]
实施方案17.根据实施方案16所述的方法,其中所述过氧化氢酶以约4000iu至约6000iu、约4500iu至约6000iu、约5000iu至约6000iu、约5500iu至约6000iu、约4000iu至约5500iu、约4000iu至约5000iu、约4000iu至约4500iu、约4500iu至约5500iu、约4500iu至约5000iu或约5000iu至约5500iu的浓度存在。
[0131]
实施方案18.根据实施方案16所述的方法,其中所述过氧化氢酶以约4500iu、约4600iu、约4700iu、约4800iu、约4900iu、约5000iu、约5100iu、约5200iu、约5300iu、约5400iu或约5500iu的浓度存在。
[0132]
实施方案19.根据实施方案15-18中任一项所述的方法,其中所述过氧化氢酶以约5000iu的浓度存在。
[0133]
实施方案20.根据实施方案1-19中任一项所述的方法,其中所述琼脂培养基还包含酵母提取物、大豆蛋白胨、葡萄糖、一种或多种盐和l-半胱氨酸。
[0134]
实施方案21.根据实施方案20所述的方法,其中所述一种或多种盐选自na2co3、nacl和mgso4。
[0135]
实施方案22.根据实施方案20或实施方案21所述的方法,其中所述l-半胱氨酸以至少约0.5g/l的浓度存在。
[0136]
实施方案23.根据实施方案20或实施方案21所述的方法,其中所述l-半胱氨酸以约0.5g/l至约5g/l的浓度存在。
[0137]
实施方案24.根据实施方案23所述的方法,其中所述l-半胱氨酸以约1g/l至约4g/l的浓度存在。
[0138]
实施方案25.根据实施方案23所述的方法,其中所述l-半胱氨酸以约0.5g/l至约1.5g/l的浓度存在。
[0139]
实施方案26.根据实施方案22-25中任一项所述的方法,其中所述l-半胱氨酸以约0.5g/l、1.0g/l、1.5g/l、2.0g/l、2.5g/l、3.0g/l、3.5g/l、4.0g/l、4.5g/l或5.0g/l的浓度存在。
[0140]
实施方案27.根据实施方案20-26中任一项所述的方法,其中所述酵母提取物以至少约5g/l的浓度存在。
[0141]
实施方案28.根据实施方案27所述的方法,其中所述酵母提取物以约5g/l至约25g/l、约5g/l至约20g/l、约5g/l至约15g/l、约5g/l至约10g/l、约10g/l至约25g/l、约10g/l至约20g/l或约10g/l至约15g/l的浓度存在。
[0142]
实施方案29.根据实施方案27或实施方案28所述的方法,其中所述酵母提取物以约5g/l、约10g/l、约15g/l、约20g/l或约25g/l的浓度存在。
[0143]
实施方案30.根据实施方案20-29中任一项所述的方法,其中所述大豆蛋白胨以至少约5g/l的浓度存在。
[0144]
实施方案31.根据实施方案30所述的方法,其中所述大豆蛋白胨以约5g/l至约25g/l、约5g/l至约20g/l、约5g/l至约15g/l、约5g/l至约10g/l、约10g/l至约25g/l、约10g/l至约20g/l或约10g/l至约15g/l的浓度存在。
[0145]
实施方案32.根据实施方案30或实施方案31所述的方法,其中所述大豆蛋白胨以
约5g/l、约10g/l、约15g/l、约20g/l或约25g/l的浓度存在。
[0146]
实施方案33.根据实施方案1-32中任一项所述的方法,其中允许细菌菌落生长的所述条件包括约37℃的温度。
[0147]
实施方案34.根据实施方案1-32中任一项所述的方法,其中允许细菌菌落生长的所述条件包括约34℃与39℃之间的温度。
[0148]
实施方案35.根据实施方案1-34中任一项所述的方法,其中允许细菌菌落生长的所述条件还包括厌氧培养环境。
[0149]
实施方案36.根据实施方案1-35中任一项所述的方法,其中允许细菌菌落生长的所述条件还包括至少约5%的co2水平。
[0150]
实施方案37.根据实施方案36所述的方法,其中所述co2水平介于约5%和约95%之间。
[0151]
实施方案38.根据实施方案1-35中任一项所述的方法,其中允许细菌菌落生长的所述条件还包括约0%的co2水平。
[0152]
实施方案39.根据实施方案2-38中任一项所述的方法,其中所述液体培养基包含与所述琼脂培养基基本上相同的组分。
[0153]
实施方案40.根据实施方案1-39中任一项所述的方法,其中所述一个或多个细菌菌落包括不透明、半透明和透明菌落。
[0154]
实施方案41.根据实施方案2-40中任一项所述的方法,其中所述选择的细菌菌落是不透明菌落。
[0155]
实施方案42.根据实施方案2-41中任一项所述的方法,其中在所述液体细菌培养物达到预定的光密度(od)阈值之后收获所述培养的过氧化氢酶阴性细菌。
[0156]
实施方案43.根据实施方案42所述的方法,其中在600nm的波长处测量光密度(od600)。
[0157]
实施方案44.根据实施方案42所述的方法,其中所述预定的od阈值为至少约1.0的od600。
[0158]
实施方案45.一种通过根据实施方案1-44中任一项所述的方法产生的培养的过氧化氢酶阴性细菌。
[0159]
实施方案46.根据实施方案45所述的培养的过氧化氢酶阴性细菌,其中与使用包含动物源性材料的培养基培养的类似细菌相比,所述细菌展现出增强的多糖生产。
[0160]
实施方案47.一种细菌储备液,包含根据实施方案45或实施方案46所述的培养的过氧化氢酶阴性细菌。
[0161]
实施方案48.一种用于体外细菌培养的试剂盒,包括:(a)不含动物源性材料的琼脂培养基;和(b)过氧化氢酶。
[0162]
实施方案49.根据实施方案48所述的试剂盒,还包括具有与所述琼脂培养基基本上相同的组分的液体培养基。
[0163]
实施方案50.一种琼脂糖平板,包含:(a)不含动物源性材料的琼脂培养基;和(b)过氧化氢酶。
[0164]
实施方案51.根据实施方案50所述的琼脂糖平板,还包含过氧化氢酶阴性细菌。
[0165]
实施方案52.一种细菌储备液,包含培养的过氧化氢酶阴性细菌、液体培养基和任
选地甘油,其中所述细菌储备液不包含动物源性材料。
[0166]
实施方案53.根据实施方案52所述的细菌储备液,其中所述细菌储备液不包含动物源性血红素。
[0167]
实施方案54.根据实施方案52或实施方案53所述的细菌储备液,其中所述细菌储备液不包含朊病毒蛋白、支原体或病毒。
[0168]
实施方案55.根据实施方案52-54中任一项所述的细菌储备液,其中与包含使用具有动物源性材料的培养基培养的类似细菌的细菌储备液相比,所述细菌储备液展现出包含减少量的细胞壁多糖(cwps)污染。
[0169]
实施例
[0170]
实施例1:琼脂平板上的培养
[0171]
评估不同种类琼脂平板上的不同生长条件的测试以便找到充分支持肺炎链球菌菌落生长的培养基和条件。这些实验中使用的血清型列于表2中。
[0172]
表2:铺板实验中使用的血清型
[0173]
uab名称确认的血清型solow id(rcb)mnk1173148/1/02mnk0240348/1/03mnk03301448/1/15mnk035919a49/2/03
[0174]
根据下表3、4和5制备三种固体琼脂培养基(yepd2、pye2和syg)。
[0175]
表3:yepd2琼脂的制备
[0176][0177][0178]
表4:pye2琼脂的制备
[0179][0180]
表5:syg琼脂的制备
[0181][0182][0183]
表6:盐溶液制备
[0184][0185]
除了这些平板之外,不同即用型平板或即用型琼脂混合物用作上述yepd2、pye2和syg琼脂的对照或替代。这些另外的平板和琼脂如下:
[0186]
(a)tsb(merck,1.00550.0500);
[0187]
(b)含5%绵羊血的tsaii琼脂(biomerieux,43009);以及
[0188]
(c)无动物源性tsa(merck,1460150020)。
[0189]
在细胞接种之前,将过氧化氢酶(5000u/平板)涂在所有无动物源性琼脂平板上。另外将过氧化氢酶涂在tsa和血琼脂平板上作为对照以排除该溶液对细胞生长的可能负面影响。
[0190]
按如下四种方式之一将细菌细胞接种于平板上:
[0191]
(a)从储存小瓶的表面刮取细胞并将其直接划线到琼脂平板上;
[0192]
(b)将细胞悬液解冻并直接划线到平板上;
[0193]
(c)将细胞悬液解冻并在划线到平板上之前在0.9%w/v nacl溶液中稀释到1:5或1:10或1:100;或
[0194]
(d)将细胞悬液解冻并在划线到平板上之前在过氧化氢酶储备溶液中稀释1:10或1:20。
[0195]
接种后,将平板在5%co2或厌氧条件下在37℃温育16至24小时。
[0196]
温育后,选择最多8个菌落以供挑取。使用立体显微镜鉴定并选择粗糙/不透明菌落。将挑取的菌落重悬于1ml或2ml无菌0.9%w/v nacl溶液中。
[0197]
按如下方式将来自平板的细菌悬液以不同体积(10μl、100μl、200μl)接种于第二轮琼脂平板上:
[0198]
(a)将从yepd琼脂平板选择的细菌悬液接种于yepd琼脂平板上和阳性对照平板上;
[0199]
(b)将从pye琼脂平板选择的细菌悬液接种于pye琼脂平板上和阳性对照平板上;
[0200]
(c)将从syg琼脂平板选择的细菌悬液接种于syg琼脂平板上和阳性对照平板上;
[0201]
(d)将从阳性对照平板选择的细菌悬液接种于pye、yepd或syg平板上。
[0202]
完整纯化过程包括在开始液体培养之前琼脂平板上的4个阶段。
[0203]
铺板、接种、环境条件和细菌生长的概要提供于下表7中。
[0204]
表7:实验生长条件概要
[0205]
[0206]
[0207][0208]
基于上述实验,得出下列结论:
[0209]
(a)yepd和pye琼脂不适合所选择的肺炎链球菌血清型的生长。
[0210]
(b)从tsb即用型无动物源性培养基制备的琼脂支持肺炎链球菌血清型3的生长,但不支持其他血清型1和14的生长。因此,不进一步使用该培养基。
[0211]
(c)含过氧化氢酶的syg琼脂支持所有测试的血清型在各种各样的条件下生长。因此,选择该琼脂用于24种不同肺炎链球菌血清型的纯化程序并用于生成每种血清型的亲本细胞库。
[0212]
(d)含5%绵羊血的tsaii琼脂和含过氧化氢酶的tsa琼脂均支持所有测试的血清型在所有条件下生长。含5%绵羊血但未添加过氧化氢酶的tsaii琼脂在亲本细胞库生成期间用作阳性对照,因为肺炎链球菌表现出非常典型的菌落生长并在血琼脂平板上的菌落周围具有α溶血环。
[0213]
(e)有趣的是,当在syg琼脂上培养时,所有测试的血清型都表现出在厌氧室中的生长好于在co2培养箱中的生长。在含5%绵羊血的tsaii琼脂上生长的菌落表现出在co2培养箱中的菌落生长好于在厌氧室中的菌落生长。
[0214]
纯化过程的最终程序使用用过氧化氢酶(5000u/平板)处理的syg琼脂平板和含5%绵羊血的tsaii琼脂作为阳性对照。将细菌储备液的小瓶解冻并且在2ml nacl 0.9%中稀释10μl的细胞悬液。
[0215]
将100μl的细胞悬液涂在含5%绵羊血的tsaii琼脂阳性对照平板上,并且将平板在5%co2和37℃下厌氧培养约24小时。将100μl的细胞悬液以及至多10-3
的稀释液涂在syg琼脂平板上并且将平板在37℃厌氧培养约24小时。
[0216]
再完成三次铺板和培养程序,总共重复四次。将来自每个平板的单一不透明菌落(通过显微镜观察确定)重悬于2ml nacl 0.9%溶液中。将100μl的细胞悬液涂在含5%绵羊血的tsaii琼脂阳性对照平板上并且在5%co2和37℃下厌氧培养约24小时。将100μl的细胞悬液稀释到10-2
与至多10-5
之间(取决于菌落大小)并涂在syg琼脂平板上并且在37℃厌氧培养约24小时。在第四阶段结束时,从平板刮取菌落并将菌落用作第一液体培养阶段的接种物。
[0217]
实施例2:从无动物源性平板选择的细菌的液体培养
[0218]
对于液体培养基中的所有初步实验,以下条件都保持相同:
[0219]
(a)温度:37.0
±
2.0℃
[0220]
(b)富含co2(5%)的气氛
[0221]
(c)振摇速度为2cm振摇直径下的200rpm
[0222]
(d)起始ph:7.5
±
0.2(在第一实验期间使用20%na2co3溶液调整ph)
[0223]
(e)在od600处执行光密度的所有测量,以未接种的培养基作为空白。
[0224]
(f)测试的血清型:1、4和14
[0225]
(g)使用来自琼脂平板培养阶段2或3的菌落。
[0226]
在初步实验中使用五种液体培养基。培养基1:含1.0g/l l-半胱氨酸的syg液体培养基(经热灭菌);培养基2:含1.0g/l l-半胱氨酸的syg液体培养基(经过滤灭菌);培养基3:含1.0g/l l-半胱氨酸和0.05m磷酸盐缓冲液的syg液体培养基(经过滤灭菌);培养基4:含1.0g/l l-半胱氨酸和0.1m磷酸盐缓冲液的syg液体培养基(经过滤灭菌);培养基5:含4.0g/l l-半胱氨酸的syg液体培养基(经过滤灭菌)。每种培养基的详情示于表8中。
[0227]
表8:液体培养基组分
[0228][0229]
ph调节后,搅拌培养基1并将其与类似量的基准水一起在≥122℃热灭菌≥30分钟,之后添加25ml/l的400g/l葡萄糖。ph调节后,搅拌培养基2-5并使用0.22μm过滤器过滤这些培养基。
[0230]
使用培养基1至4及血清型1和14执行第一实验(图1和图2)。将来自平板的菌落重
悬于5ml 0.9%nacl溶液中,并且将1ml的细胞悬液添加到100ml无挡板摇瓶中的25ml液体培养基中。液体培养物的起始od600介于0.01与0.02之间。第一阶段的最大光密度介于0.4与0.7之间。所有摇瓶中调节一次ph。第一液体培养阶段期间的ph调节对细胞生长具有不利影响。将来自第一阶段的2ml液体培养物接种于用于第二液体培养阶段的液体培养基的第二培养瓶中。第二阶段中的生长非常缓慢并且实验停止。基于该初始液体培养实验,得出的结论是,应在第一液体培养阶段接种更大量的细菌细胞悬液,不应在培养期间进行ph调节,并且第一阶段中的生长应在培养物转移到第二阶段之前达到指数期。
[0231]
使用培养基1和5及血清型1和4执行第二组实验(图3和图4)。将来自平板的菌落重悬于5ml 0.9%nacl溶液中,并且将4ml的细胞悬液添加到500ml无挡板摇瓶中的100ml培养基中。液体培养物的起始od600为约0.1。第一液体培养阶段的最大光密度对于培养基1而言为约0.4并且对于培养基5而言大于0.5。在第二阶段中,将来自第一阶段的10ml培养物接种于500ml无挡板摇瓶中的100ml培养基中。第二液体培养阶段的最大光密度对于培养基1而言为约0.4至0.5并且对于培养基5而言大于1.0。
[0232]
基于这些初步实验,得出了下列结论并且定义了用于生成亲本细胞库的下列程序:
[0233]
(a)选择培养基5用于生成亲本细胞库。
[0234]
(b)液体培养基应在使用前尽可能短的时间内制备(含l-半胱氨酸的培养基不应超过2天)。培养基的时长可对细胞生长产生负面影响(图6和图9)。
[0235]
(c)应在第一液体培养阶段中使用含60ml培养基的300ml无挡板摇瓶。
[0236]
(d)应在第二液体培养阶段中使用含180ml培养基的1000ml无挡板摇瓶。
[0237]
(e)对于第一液体培养阶段的接种,应使用2.4ml的细胞悬液(至多200个菌落(这取决于菌落大小),重悬于9ml的nacl 0.9%溶液中;起始od600介于0.02与0.1之间)。
[0238]
(f)对于第二液体培养阶段的接种,应使用来自第一阶段的od600高于0.3的18ml细胞悬液(有必要在第一阶段中至少倍增一次)。
[0239]
(g)温度应为37.0℃
±
2.0℃
[0240]
(h)气氛应富含co2(5%)
[0241]
(i)振摇速度应为2cm振摇直径下的200rpm(同时冷却电机)。排除低放热磁力搅拌器的使用(参见图8)。
[0242]
(j)起始ph应为7.5
±
0.2(在第一实验期间使用20%na2co3溶液调节ph)
[0243]
(k)在od600处执行光密度的所有测量,以未接种的培养基作为空白(对照)
[0244]
(l)收获前的最终光密度:1.0
[0245]
(m)添加甘油(30%v/v)达到12%v/v的最终浓度并且平衡至少10分钟
[0246]
(n)向35个小瓶装入4.5ml的培养物,最初冷冻于-140℃/-120℃以下(进一步储存于-80℃/-65℃以下)
[0247]
(o)阳性对照:将用于第一阶段和第二阶段的接种的细胞悬液铺板在syg上或含5%绵羊血的tsaii琼脂上,并且在厌氧条件下或5%co2气氛中于37℃温育。
[0248]
(p)在每个血清型四重组合(quartet)的纯化程序期间,测试了至少两种血清型在液体培养基中的生长行为。参见图5至图10。
[0249]
(q)在若干实验中通过测量未接种的培养基的od600来跟踪培养基的沉淀水平。
[0250]
增加培养基中l-半胱氨酸的浓度促进了培养瓶中的更好生长。在接种前直接添加到培养基中的3.0g/l的l-半胱氨酸最适于生长促进。如图15所示,添加到血清型20的培养基中的3.0g/l和4.0g/l的l-半胱氨酸提供了可比的活细胞计数和生长性能(示出了在600ml规模的培养实验期间经热灭菌(hs)和过滤灭菌(fs)的培养基中血清型20的od600的时间进程)。然而,对于大多数血清型而言,发现3.0g/l l-半胱氨酸是最适浓度,因为4.0g/l可导致非期望的沉淀。
[0251]
通过引用并入
[0252]
本文引用的所有参考文献、文章、出版物、专利、专利公开和专利申请通过引用整体并入用于所有目的。然而,提及本文引用的任何参考文献、文章、出版物、专利、专利公开和专利申请并非是且不应当看作它们构成有效现有技术或形成世界任何国家的公知常识的一部分的承认或任何形式的建议。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1