TK1抗体、试剂盒及其用途的制作方法
tk1抗体、试剂盒及其用途
技术领域
1.本发明涉及免疫学领域,特别涉及一种tk1抗体、试剂盒及其用途。
背景技术:
2.肝癌是我国常见的恶性肿瘤之一,其每年有超过50万的新增病例,且由于 治疗效率的低下,导致几乎同样数目的死亡率。肝细胞癌占所有肝癌的约80%, 且很少能医治。其5年的存活率仅为约10%,且确诊后的存活时间通常少于6 个月。
3.关于肝癌的治疗方法,有以可见病灶为对象的外科肝切除、无线电波烧灼 疗法、乙醇注入疗法及微波凝固坏死疗法等,但有时候这些局部疗法并不适合。
4.目前,对于不能适应上述疗法和肝动脉栓塞手术的晚期癌症患者、或者经 这些治疗后复发的患者,比较常见使用的化学疗法有cddp、adm或5
‑
fu的 动脉内注射(动注)疗法。但是,采用油性造影剂碘化罂粟油和上述药物联用的肝 动注化学疗法,据报道显著有效率为13.0%、有效率为30.0%;排除肝动脉栓 塞疗法与碘化罂粟油联用的化学疗法,据报道显著有效率仅为2.5%,有效率仅 为3.1%,治疗效果不算良好。而且,这种联用疗法还有产生溃疡等并发症的问 题。如上所述,对肝癌能稳定地保证一定程度疗效的标准治疗方法还不存在。特 别地,动脉内注射存在操作手法方面和患者负担方面的问题,所以希望开发取代 这种疗法的化学疗法。进一步地,由于肝癌对化学疗法抵抗性高,甚至通过治疗 达到暂时稳定肿瘤、即不使肿瘤增殖而延长生命都很困难。
5.因此,在该领域中仍然需要开发一种能够能特异性结合肝肿瘤细胞从而阻 断肝肿瘤细胞增殖的生物学诊疗手段。
技术实现要素:
6.针对前述问题,本发明提出了一种抗体、试剂盒及其应用。该抗体能特异 性结合肝肿瘤细胞,从而阻断肝肿瘤细胞增殖。
7.在第一方面,本发明提供了一种tk1抗体,其包含重链可变区,重链可变 区包含seq id no:1氨基酸序列的重链cdr1、seq id no:2氨基酸序列的 重链cdr2以及seq id no:3氨基酸序列的重链cdr3;以及轻链可变区,轻 链可变区包含seq id no:4氨基酸序列的轻链cdr1、seq id no:5氨基酸 序列的轻链cdr2以及seq id no:6氨基酸序列的轻链cdr3。
8.本发明的tk1抗体能特异性结合肝肿瘤细胞、亲和力强且表达稳定,能有 意义地降低人肝肿瘤细胞增殖的速率,增加了细胞凋亡频率。因此,大量生产本 发明的tk1抗体将为患者提供更稳定的中和性抗体,并且伴有更高的亲和性。
9.优选地,抗体包含重链可变区,重链可变区包含seq id no:7的氨基酸 序列。
10.优选地,抗体包含轻链可变区,轻链可变区包含seq id no:8的氨基酸 序列。
11.在第二方面,本发明提供了一种核酸,其编码上述抗体。
12.优选地,核酸包含编码重链可变区的第一核酸,第一核酸包含seq id no: 9的编
码序列。
13.优选地,核酸包含编码轻链可变区的第二核酸,第二核酸包含seq id no: 10的编码序列。
14.在第三方面,本发明提供了一种载体,其包含上述核酸。
15.在第四方面,本发明提供了一种宿主细胞,其包含上述核酸或上述载体。
16.在第五方面,本发明提供了一种试剂盒,其包含上述抗体。
17.在第六方面,本发明提供了一种上述抗体在制备用于治疗肝癌的药物/组合 物中的用途。
18.综上所述,本发明具有以下有益效果:本发明制备了肝细胞肿瘤特异性抗 体,其特异性结合肝肿瘤细胞且不阻断正常细胞的正常生存活力,亲和力强且表 达稳定,能有意义地降低人肝肿瘤细胞增殖的速率,增加细胞凋亡频率。本发明 的抗体可以用作诊断或治疗用,是一种新的阻断肿瘤细胞增殖的有效靶向治疗药 物,特别是肝癌。
附图说明
19.图1是示出ht29 tk1+和143b tk
‑
细胞裂解液的蛋白质印迹(western blot /wb)的示意图;
20.图2是纯化后tk1抗原的sds
‑
page电泳图;
21.图3是示出在用不同浓度的胸苷激酶1单克隆抗体(sstk小鼠杂交瘤细胞 株43#)处理72小时后所培养的肝肿瘤细胞hep g2的肿瘤细胞生存活力有统 计学意义的降低(p﹤0.05)示意图;
22.图4是示出在用不同浓度的胸苷激酶1单克隆抗体(sstk小鼠杂交瘤细胞 株43#)处理72小时后所培养的肝肿瘤细胞hep 3b的肿瘤细胞生存活力有统计 学意义的降低(p﹤0.05)示意图;
23.图5是43#单克隆抗体tk1免疫组化染色结肠恶性肿瘤的示意图;
24.图6是43#单克隆抗体tk1免疫组化染色结肠恶性肿瘤的示意图;
25.图7是43#单克隆抗体tk1免疫组化染色乳腺恶性肿瘤的示意图。
具体实施方式
26.以下将参考具体实施例对本发明进行进一步的说明。本领域的普通技术人 员将会理解,提供这些实施例的目的仅仅是为了举例说明本发明的可实现方式, 以便于本领域的普通技术人员能够更好地理解本发明,而无意于将本发明内容限 制于这些具体的实施例。
27.在本申请中,术语“特异性结合”是指两分子间的非随机结合反应,例如 抗体或其抗原结合片段将不显示任何显著的与来自除了其特异性结合配偶体之 外的其他分子的结合。
28.本发明所述的抗体意指任何能够特异性地结合tk1的抗体,包括天然的、 或者部分或全部合成产生的多肽或多肽片段。本发明所述的抗体还涵盖了包含抗 体的抗原结合片段的任何多肽或蛋白质。包含抗原结合片段的抗体片段是诸如 fab、fab’、f(ab’)2、scfv、fv、dab、fd、fd’、双特异性抗体分子、或多特异 性抗体分子等。所述抗体可以是单克
隆抗体或多克隆抗体,可以是鼠源或人源或 兔源或羊源或其它动物来源,或者可以是基因工程抗体,如人源抗体、人源化抗 体、嵌合抗体或单链抗体等。在一个具体的实施方式中,本发明所述的抗体是单 克隆抗体,例如鼠单克隆抗体。
29.本领域技术人员明了,可以采取单克隆抗体和其他抗体并使用重组dna技 术来产生保留原始抗体的特异性的其他抗体或嵌合分子。例如,可以将编码免疫 球蛋白可变区的dna与恒定区连接,或将抗体的互补性决定区(cdrs)引入不同 免疫球蛋白的恒定区加框架区内。另外,也可以对酵母细胞、杂交瘤或产生抗体 的其他细胞实施基因突变或其他改变,其可以改变或不可以改变所产生的抗体的 结合特异性。
30.胸苷激酶1(tk1)(atp:胸苷
‑
5'
‑
磷酸转移酶,ec2.7.1.21)是唯一通过补 救途径将胸苷(tdr)磷酸化成单磷酸胸苷(dtmp)的激酶,单磷酸胸苷进一 步磷酸化为二磷酸胸苷(dtdp)和三磷酸胸苷(dttp),为合成dna提供所需 要的dttp,确保dna的合成。因此,tk1是调控dna合成密切相关的关键酶 之一,与细胞的增殖速度密切相关,也称为细胞周期的s期的特殊酶。胸苷(tdr) 是dna合成的重要前体之一。已显示tdr在细胞内的浓度与细胞活力相关。细 胞中tk1酶的活性/浓度是可以通过tdr/ttp浓度方法进行检测。tk1基因已被 认为是自杀基因。其活性被抑制,则细胞增殖速率会降低。
31.胸苷激酶1是细胞周期依赖酶,与细胞增殖密切相关,是首个血清学细胞 增殖标志物,可以监测细胞异常增殖的速度。目前应用主要在应用于血清学检测 和免疫组化检测,适用于体检和癌前病变评估等,可以预估预后生存率、预测复 发风险率、评估癌变进程的风险度等。
32.肿瘤是一种慢性漫长的异常增殖性疾病。与细胞生长调节相关的多个基因 突变导致正常细胞生长失控,细胞异常增殖,最终进展为恶性肿瘤,历时可达 10
‑
30年。找到与肿瘤增殖相关的靶标是关键点。在研究中,本申请的发明人发 现,tk1可以作为一种评定肿瘤细胞增殖的可信标志物,在评估人肿瘤增殖速率 方面具有重要价值。tk1不仅在胞质中表达,在细胞外膜也会出现,其在膜外的 出现与肿瘤恶性程度有相关性。
33.tk1是细胞周期依赖酶,与细胞增殖密切相关。对此,本申请的发明人选 择重组人tk1做免疫抗原,经严格筛选和鉴定,成功地制备得到特异性的鼠抗 人胸苷激酶1单克隆抗体(来源于sstk小鼠杂交瘤细胞株43#)。进一步地,本 申请的发明人出乎意料地发现,利用该方法制备的鼠抗人胸苷激酶1单克隆抗体 可用于治疗肿瘤,尤其是肝肿瘤。因此,鼠抗人胸苷激酶1单克隆抗体可被视为 一种新型靶向药物,能够阻断人肿瘤细胞增殖,在未来将是治疗肝肿瘤有效靶向 治疗有效药物。基于该发现,完成了本发明。
34.本发明成功筛选得到小鼠杂交瘤细胞株43#,开发了特异性的鼠抗人tk1 单克隆抗体。细胞株送至中国典型培养物保藏中心进行专利程序的保藏物保藏, 专利保藏号为cctcc no:c2019267,保藏地址为中国、武汉大学,分类命名为 sstk小鼠杂交瘤细胞株43#,中国典型培养物保藏中心的收到日期为2019年 11月28日。
35.本发明所有肝肿瘤细胞系购自中国典型培养物保藏中心【hep g2,目录号 gdc0024;hep 3b,目录号gdc0070)】。
36.为确认使用于该抗体的特异性,在鉴定过程中我们采用培养的人结肠癌 tk1阳性株(ht29 tk1+)和人骨肉瘤tk1阴性细胞株(143b tk
‑
)的细胞裂 解液,通过凝胶电泳/蛋白质印迹(western blot)鉴定,验证ht29 tk1+株的细 胞裂解液,显示有tk1特异的一条明显
的电泳带,没有非特异性的免疫交叉反 应,但143b tk
‑
的细胞裂解液不显示任何tk1的电泳带(图1)。tk1细胞免疫 组化学染色鉴定方法,验证ht29 tk1+株中细胞,显示有tk1在细胞质中有不 同程度的特异的tk1棕黄染色,但143b tk
‑
株的细胞,没有特异的tk1棕黄染 色。小鼠杂交瘤细胞株43#制备的抗体具有高特异性。
37.制备例1:
38.步骤一:制备tk1抗原
39.接种:合成tk1全长基因序列至载体pet21a
‑
tk1
‑
c6his,pet21a
‑
tk1 bl21表达菌从
‑
80℃冰箱接种于5ml氨苄抗性lb培养基中,37℃220rpm过 夜培养(接种时表达菌勿融化)。
40.大量诱导:次日以1:200比例接种bl21(de3)菌液于1000ml氨苄抗性的 tb培养基中。37℃220rpm培养,待细菌进入对数生长期(od约0.6,培养 的细菌刚好看不透,云雾状态时)时,将培养瓶在冰水混合物中降温,加入终 浓度1mm的iptg,于25℃诱导15小时。
41.收表达菌:菌液6000rpm离心15min去上清,0.9%生理盐水重悬菌体 (200ml/l表达菌),6000rpm离心去上清。菌体冻存于
‑
80℃或者破碎用于纯化。
42.破碎菌体:破碎buffer(50mm tris
‑
cl ph8.0、500mm nacl、10mm咪唑、 1%tritonx
‑
100,1xpmsf)以15ml:1g菌的比例将表达菌重悬。放入烧杯中冰 水浴于超声细胞粉碎机破碎,φ10变幅杆,工作时间3秒,间歇时间3秒,工 作总时间25分钟,功率350瓦。破碎液转入50ml高速离心管,高速冷冻离心 机13000rpm离心20分钟。离心上清0.45μm/0.22μm过滤后待上柱。
43.上样:取ge ni
‑
sepharose 2.5ml/1000ml表达菌,纯水冲10倍柱体积三次, 利用平衡液50mm tris
‑
cl ph8.0、500mm nacl、10mm咪唑、1%tritonx
‑
100 平衡10倍柱体积。将填料与破碎过滤后样本液混合,在4℃360
°
摇床上混合 2小时。然后取出4000rpm常温离心5分钟,上清小心吸出加入叠氮钠保存, 填料转入纯化柱。
44.4℃淋洗:
45.50mm tris
‑
cl ph8.0、500mm nacl、10mm咪唑、1%tritonx
‑
100淋洗20 倍柱体积;
46.50mm tris
‑
cl ph8.0、500mm nacl、20mm咪唑、1%tritonx
‑
100淋洗10 倍柱体积;
47.50mm tris
‑
cl ph8.0、500mm nacl、30mm咪唑、淋洗10倍柱体积。
48.4℃洗脱:
49.洗脱液母液50mm tris
‑
cl ph8.0、500mm nacl、20%甘油。
50.洗脱液1:洗脱液母液+50mm咪唑,洗脱三个柱体积,每个柱体积收集 一管。
51.洗脱液2:洗脱液母液+100mm咪唑,洗脱三个柱体积,每个柱体积收集 一管。
52.洗脱液3:洗脱液母液+150mm咪唑,洗脱三个柱体积,每个柱体积收集 一管。
53.洗脱液4:洗脱液母液+300mm咪唑,洗脱八个柱体积,每个柱体积收集 一管。
54.sds
‑
page电泳检测洗脱各组分,合并较纯的洗脱收集组分(如图2)。
55.步骤二:动物免疫:取上述制备的tk1抗原与弗氏完全佐剂混合、乳化(抗 原100ul+佐剂100ul/只老鼠),抗原与佐剂1:1混合于2ml圆底离心管中并固定, 上接电动马达,马达端口绑住根一头环化的钢丝。圆环头深入离心管内,离底 部2毫米,接通电源,马达高速运转带动圆环搅拌乳化抗原。约30分钟后停 止搅拌,将离心管倒过来,若不流出则达到乳化效果。用针头将离心管底部扎 洞,2ml注射器活塞从离心管上端将乳化后抗原从底端推
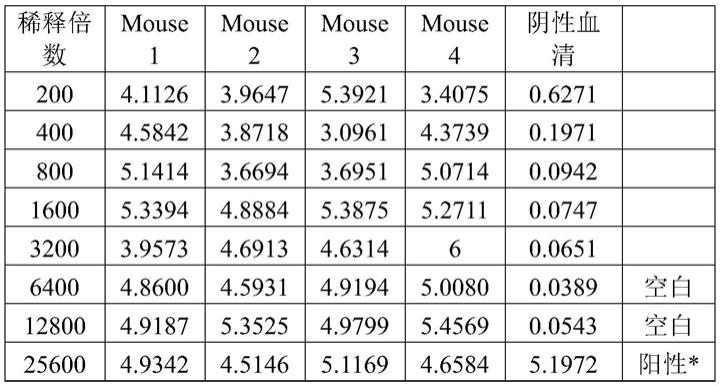
入注射器内准备免疫。 初次免疫四只6周龄balb/c雌性小鼠。在将上述制备的tk1抗原与弗氏不完 全佐剂充分混合后,加强免疫balb/c雌性小鼠。检测血清效价,用pbs稀释上 述制备的tk1抗原(结果见表1),选择免疫反应性好的小鼠进行抗原腹腔冲 击免疫,25ug抗原/只。三天后取脾细胞进行细胞融合。免疫计划见表2。
56.elisa效价检测:20170206鼠三免效价,包被重组tk11ug/ml,一抗小 鼠血清1h,二抗jackson hrp
‑
标羊抗鼠二抗1:1w 1h。
57.表1
[0058][0059]
*注:阳性对照孔为抗tk1鼠单克隆抗体,浓度为0.1ug/ml,用于判断整 个实验的检测样本全为阴性时确定不是实验操作或试剂加错导致。
[0060]
表2
[0061][0062]
步骤三:
[0063]
细胞融合及筛选:
[0064]
骨髓瘤细胞培养:实验室用骨髓瘤细胞是balb/c来源的sp2/0,待细胞 生长至对数期状态时收集细胞用1ml pbs悬起,选用6
‑
8周的健康小鼠经过皮 下多点注射,大约12天左右取瘤分离瘤细胞而来的(需大规模扩大培养及冻 存,瘤细胞分离过程同脾脏细胞分离过程)。融合时,使细胞处于对数生长期。
[0065]
1、提前一周以上复苏sp20细胞。
[0066]
2、视细胞多少和生长速率调整细胞状态,直至细胞圆润,状态较好,隔 天传代1:10以上生长速率。
[0067]
3、sp20状态良好时收集细胞融合。
[0068]
注:瘤细胞使用20%胎牛血清培养(20%fcs+dmem+青链双抗),收集 细胞融合前用无血清的dmem洗2遍。
[0069]
分离脾脏淋巴细胞:
[0070]
1、在超净工作台中准备一个1.5ml试管。加入1ml无血清培养基,两个 3.5cm培养皿,加入2ml无血清培养基(加少量抗生素),两根15ml离心管, 其中一根加入10ml无血清培养基,手术器械(高压湿热灭菌),绢网,移液器 (1ml),枪头。
[0071]
2、取1.5ml试管到动物操作间。取已经免疫的balb/c小鼠,摘除眼球采 血,并分离血清作为抗体检测时的阳性对照血清。同时通过断颈处死小鼠,浸 泡于75%酒精中5分钟,放蜡盘上固定后剪开脾脏上皮肤,用镊子取出脾脏, 放在1.5ml试管中。
[0072]
3、将脾脏转移到超净台里的其中一个3.5cm培养皿中,摘除脾脏上面的 脂肪和结缔组织,洗一遍,铺开一张绢网放在培养皿培养皿盖子上,将脾脏轻 轻挤破,放在绢网中间位置。将绢网两次对折,用移液器吸取无血清培养基轻 轻吹散,用研磨棒研磨,使脾脏内淋巴细胞透过绢网制成单细胞悬液,收集单 细胞悬液于15ml离心管中。800rpm离心5分钟。
[0073]
饲养细胞制备:
[0074]
分离胸腺中的淋巴细胞
[0075]
1、在超净工作台中准备一个1.5ml试管。加入1ml无血清培养基,两个 3.5cm培养皿,加入2ml无血清培养基(加少量抗生素庆大霉素),两根15ml 离心管,其中一根加入10ml无血清培养基,手术器械(高压湿热灭菌),绢网, 移液器(1ml),枪头。
[0076]
2、取4周龄以下雌性小鼠,断颈处死小鼠。浸泡于75%酒精中5分钟, 放蜡盘上固定后剪开胸部皮肤,打开胸腔,摘取胸腺放在1.5ml试管中。
[0077]
3、将胸腺转移到超净台里的其中一个3.5cm培养皿中,洗一遍,铺开一 张绢网放在培养皿盖子上,将胸腺放在绢网中间位置。将绢网两次对折,用移 液器吸取无血清培养基轻轻吹散,并用研磨棒研磨,使胸腺内淋巴细胞透过绢 网制成单细胞悬液,收集单细胞悬液于15ml离心管中。800rpm离心5分钟。
[0078]
细胞融合:
[0079]
1、将淋巴细胞与骨髓瘤细胞分别计数,sp2/0用无血清dmem稀释10倍 后计数,淋巴细胞用无血清dmem稀释100倍后计数;以sp2/0:b细胞=1: 2-1:10混合于一支50ml离心管中,充分混匀。
[0080]
2、800rpm离心5
‑
10分钟,将上清尽量吸净。
[0081]
3、轻击融合管底,使沉淀细胞松散均匀。
[0082]
4、用移液器在1分钟内滴加37℃的50%peg4000(ph 8.0)1ml,边加边 轻轻转动融合管。
[0083]
5、加完peg后,静置约1分钟。
[0084]
6、用移液器吸取1ml经水浴锅预热至37℃的无血清培养基,在一分钟内 滴加到融合管内,其余终止液在10分钟内加完且速度逐渐加快。
[0085]
7、800rpm 5分钟;弃去上清。
[0086]
8、加入500ul hat、500ul谷氨酰胺、10ml胎牛血清(fbs),轻轻悬 浮起饲养细胞,mc半固体培养基定容50ml,混匀。
[0087]
9、分装在3.5cm培养皿中,每个培养皿2ml左右,然后将培养皿放置在 经灭菌的湿盒,于37℃在5%co2培养箱内培养。
[0088]
一次亚克隆:
[0089]
从mc培养基皿中挑出克隆团至96孔培养板,用20%ht培养2
‑
3天后进 行第一次elisa检测,挑选出值高细胞状态好的孔进行第一次稀释。
[0090]
elisa检测融合转孔板&第一次亚克隆稀释板:
[0091]
1、96孔板标记抗原、包被日期。
[0092]
2、包被:重组tk1蛋白用1x cbs稀释,0.05ug/100ul/孔加入96孔板,4 ℃过夜。
[0093]
3、洗板:用洗液洗1次或直接甩掉包被液。
[0094]
4、封闭:200ul/孔37℃1小时。
[0095]
5、洗板:用洗液洗1次。
[0096]
6、加一抗(细胞培养上清):融合板100ul/孔,稀释板100ul/孔。96孔板 右下角2个孔做对照,阳性孔为tk1单抗057m 1:10000稀释,阴性孔加入培 养基。37℃温育1小时。
[0097]
洗板3次
[0098]
8、加二抗:用稀释液按1:20000稀释jackson二抗,100ul/孔,37℃温育 1小时。
[0099]
9、洗板3次,显色:单组份tmb显色液100ul/孔,37℃恒温箱放置10 ~15min。
[0100]
10、终止反应检测od:加50ul/孔终止液,颜色变黄;用酶标仪测定450nm 和630nm的吸光值(选取450nm为检测波长,630nm为参考波长)。
[0101]
11、数据处理:保存原始数据后,选择od值大于3.0的阳性孔,融合板 挑取值最高的50孔(平均每块板挑取约5个)进入第一次亚克隆稀释,第一 次亚克隆稀释板据检测结果挑取状态好,值最高,细胞少的孔进入第二次亚克 隆稀释。
[0102]
亚克隆:
[0103]
待第二次稀释的细胞形成细胞团后(5
‑
6天,细胞数量大于50个),显微 镜进行挑板,区分出单克隆和多克隆,分别标记后,进行第二次elisa检测(同 上检测步骤)。挑出阳性值高且状态好的单克隆,进行细胞计数有限稀释。
[0104]
细胞稀释方案如下(1.6个细胞/孔&0.8个细胞/孔,各半块96孔板)
[0105]
1、将细胞吹起转移至灭菌0.6ml的ep管中,留待计数。
[0106]
2、吸取10μl细胞悬液细胞计数板计数。如果细胞较多,应在稀释一次后 再计数,计数区内总数应控制在50以内较好。
[0107]
3、稀释至100个细胞/10ul(104个/ml)。例如计数为40,则细胞数为40
ꢀ×
104个/ml,在195μl dmem中加入5μl细胞悬液,则细胞浓度为104个/ ml。
[0108]
4、在15ml培养液中加入12μl步骤3中稀释好的细胞悬液,加入半块96 孔细胞培养板中,200μl/孔,则为1.6个细胞/孔。剩余5ml补入5ml培养基, 加入剩余半块96孔细胞培养板中,200μl/孔,则为0.8个细胞/孔。
[0109]
步骤四:抗体鉴定及扩培冻存:达定株标准的细胞板,elisa检测全阳(有 细胞的孔全阳性,且od高低值相差不超过0.5),挑取值高细胞状态最好的两 个单克隆孔,补液同时将细胞吹散,等细胞长到80﹪满后,转至24孔板中; 至80﹪满收取细胞上清做wb检测、亚型检测。转细胞至6孔板然后经6cm培 养皿最后转至10cm培养皿中培养,待细胞长至80%满,wb结果呈阳性,扩 培分两批共冻存四皿(细胞上清收集15ml用兔抗tk1多抗夹心ht29裂
解液、 143b tk
‑
裂解液检测与天然tk1反应),其余用于单抗生产。
[0110][0111]
阳性细胞株扩大培养并冻存,细胞上清用tk1阳性细胞系(ht29 tk1+) 裂解液,阴性细胞系(143b tk
‑
)裂解液western blot检测,筛选western blot 检测条带特异,背景干净的克隆进行无血清培养基转瓶培养生产抗体(见图 1)。
[0112]
步骤五:免疫组化鉴定:如图5
‑
7所示,tk1表达阳性的结肠肿瘤组织、 乳腺肿瘤组织切片,生产的抗tk1抗体稀释后作为一抗孵育,福州迈新的 elivisiontm plus polyer hrp(mouse/rabbit)ihc kit作为二抗反应,最后经过 dab显色和苏木精复染后观片,挑选出胞质反应特异、背景干净的43#克隆株。
[0113]
实施例1
[0114]
步骤一:将肝肿瘤细胞系hep g2、hep 3b与加入含本发明sstk小鼠杂交 瘤细胞株43#的0.1μg/ml单克隆抗体充分混合后(2
×
104),用0.22um无菌滤头(货 号:slgp033rb)在生物安全柜中过滤除菌,在含有15%胎牛血清(excell bio, 目录号fs500)且不含抗生素或其他试剂的mem alpha basic细胞培养基(gibco, 目录c12571500bt)中培养72h;
[0115]
步骤二:将肝肿瘤细胞系hep g2、hep 3b0.22um过滤除菌,然后将其在含 有15%胎牛血清(excell bio,目录号fs500)且不含抗生素或其他试剂的mem alpha basic细胞培养基(gibco,目录c12571500bt)中培养72h;
[0116]
步骤三:进行细胞生存活力测试(cell counting kit
‑
8,medchemexpress)
[0117]
活力计算:肿瘤细胞生存活力(%)=(实验孔的吸光度
‑
空白培养基对照 吸光度)/(未处理的对照孔的吸光度
‑
空白培养基对照吸光度)
×
100%
[0118]
实施例2
[0119]
步骤一:将肝肿瘤细胞系hep g2、hep 3b与加入含本发明sstk小鼠杂交 瘤细胞株43#的1μg/ml单克隆抗体充分混合后(2
×
104),在含有15%胎牛血清 (excell bio,目录号fs500)且不含抗生素或其他试剂的mem alpha basic细 胞培养基(gibco,目录c12571500bt)中培养72h;
[0120]
步骤二:将肝肿瘤细胞系hep g2、hep 3b在含有15%胎牛血清(excell bio, 目录号fs500)且不含抗生素或其他试剂的mem alpha basic细胞培养基(gibco, 目录c12571500bt)中培养72h;
[0121]
步骤三:进行细胞生存活力测试(cell counting kit
‑
8,medchemexpress) 活力计算:肿瘤细胞生存活力(%)=(实验孔的吸光度
‑
空白培养基对照吸光度) /(未处理的对照孔的吸光度
‑
空白培养基对照吸光度)
×
100%
[0136]
43#抗体对肝肿瘤细胞hep 3b作用72小时活力抑制 [0137][0138]
43#抗体对肝肿瘤细胞hep g2作用72小时活力抑制
[0139][0140]
43#抗体对肝肿瘤细胞hep 3b作用72小时活力抑制
[0141][0142]
按照公式计算的生存活力数据表明,在0ug/ml 43#抗体作用72小时为对照, 其活力为100%,随着抗体浓度从0.1增加到100ug/ml,其生存活力逐渐降低, 100ug/ml抗体浓度时,活力最低。
[0143]
以上所述,仅仅是对本发明的解释,其并不是对本发明的限制,本领域技 术人员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修 改,但只要在本发明的权利要求范围内都受到专利法的保护。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1