一种ssODN介导的牡蛎基因组定点突变或插入的方法
本发明属于海洋生物基因编辑技术领域,具体地涉及一种ssodn介导的牡蛎基因组定点突变和插入的方法。
背景技术:
crispr/cas9基因编辑技术因具有操作简单、靶点选择广、成本低、效率高等优点,自诞生以来便受到了广大科研人员的关注并得到迅速发展。目前已成为生命科学、医学等研究领域中最受瞩目、最具前景的技术之一。2020年诺贝尔化学奖授予crispr/cas9基因编辑技术,再一次证实了该技术的巨大影响力。在基础研究层面,crispr/cas9技术极大促进了模式物种尤其是非模式物种的基因功能研究。目前,研究者利用crispr/cas9技术已成功的在猪、羊、猴、高粱、牡蛎、脊尾白虾等多种动植物中实现基因编辑。
crispr/cas9系统由sgrna和cas9蛋白(或cas9mrna)组成,sgrna通过碱基互补配对识别特异性基因组序列,引导cas9蛋白结合靶点处产生基因组双链断裂,伴随着双链断裂的是细胞dna损伤修复。一般情况下,真核细胞dna修复有两种方式,同源重组修复(hdr)和非同源末端连接(nhej)。在没有模板存在的情况下,细胞会利用nhej方式修复,随机插入或缺失突变造成基因失活,实现基因敲除;当存在与损伤dna同源的dna模板时,细胞可通过hdr方式在断裂位置引入目的修饰基因,实现基因的定点敲入或定点突变。nhej机制不依靠外源模板,在大多数动物细胞中,hdr修复的效率远低于nhej修复,这就限制了hdr修复的应用。因此,精准定点基因修饰依然是一大难题。
牡蛎为世界性分布类群,是贝类中目前研究最多、受关注最多的一个类群。牡蛎由于其受精卵受限,基因编辑条件对比现有成功的研究对象要恶劣得多,目前牡蛎的crispr/cas9基因编辑技术已经取得重要突破,利用crispr/cas9技术能够实现目的基因的敲除,为牡蛎的基因功能研究提供了重要技术基础。
但是,目前牡蛎基因编辑的精准修饰还未有有效进展。牡蛎基因精准修饰技术的建立对于其基因功能研究和分子育种具有十分重要的意义。
技术实现要素:
本发明的目的在于提供一种牡蛎的基因精准修饰的方法,利用单链寡核苷酸(ssodn)介导结合crispr/cas9基因编辑技术,实现牡蛎的基因组定点突变或插入。
本发明的具体技术方案如下:
一种ssodn介导的牡蛎基因组定点突变或插入的方法,包括:合成外源供体模板-单链寡核苷酸(ssodn);体外转录合成crispr/cas9系统,该系统包括cas9mrna和靶基因sgrna;然后将ssodn、cas9mrna、靶基因sgrna和非同源修复抑制剂ku5778进行混合得到混合物,利用显微注射方法将该混合物导入至牡蛎受精卵中。
进一步的,所述单链寡核苷酸(ssodn)的长度≥120bp。
进一步的,所述ssodn的序列,以基因组中sgrna靶点序列及其左右侧翼序列进行设计,sgrna靶点序列位于中间位置,左右侧翼序列≥40bp,反向互补或正向序列均可。
进一步的,所述ssodn序列中,在sgrna靶点序列处进行碱基突变设计或者插入序列设计。
进一步的,所述ssodn序列中,对应的pam序列区进行一个碱基突变设计。
进一步的,体外转录合成cas9mrna和靶基因sgrna,与外源供体模板ssodn和非同源修复抑制剂ku5778混合,其中cas9mrna和靶基因sgrna的终浓度为500ng/μl,ssodn终浓度为2μm,非同源修复抑制剂ku5778终浓度为10μm。
进一步的,利用显微注射方法将上述混合物注射至牡蛎受精卵中,每个受精卵注射混合物的体积0.08-0.12nl,优选0.1nl。
另外,注射后的牡蛎受精卵,孵化至d形幼虫便可获得定点突变或插入的突变体,能够用于验证所述方法的有效性。
本发明的优点和有益效果:
本发明利用ssodn介导结合crispr/cas9基因编辑技术,以牡蛎为研究对象针对性地设计ssodn序列,并确定该序列的长度,最终通过显微注射成功实现了牡蛎的基因组定点突变或插入。本发明为以后开展牡蛎基因功能研究和遗传改良提供了强有力的技术支持。
附图说明
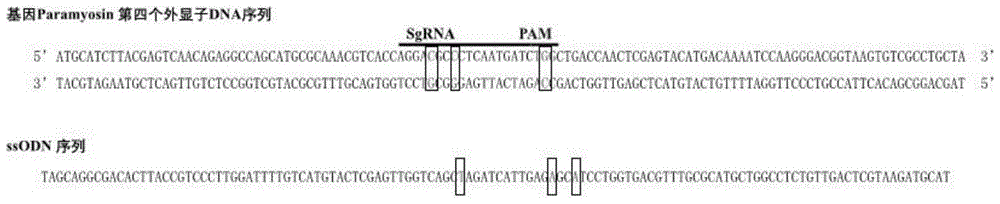
图1为实施例1中长牡蛎paramyosin基因第四外显子sgrna靶点序列和介导点突变的ssodn序列。
图2为实施例1中长牡蛎paramyosin基因第四外显子sgrna靶点序列和介导定点插入的ssodn序列。
图3为实施例2中长牡蛎点突变、定点插入和野生型测序结果图。
具体实施方式
以下通过具体实施例并结合附图对本发明进一步解释和说明。
本发明所述技术方案,如未特别说明,均为本领域的常规方案,所述试剂或材料,如未特别说明,均来源于商业渠道。
实施例1:
该实施例以长牡蛎paramyosin基因为例,进行定点突变和/或插入,下面做进一步详细阐述。
一种ssodn介导的长牡蛎paramyosin基因组定点突变或插入的方法,包括以下步骤:
1)长牡蛎受精卵的获得
挑选性腺发育成熟的长牡蛎亲贝,采用解剖法收集精卵,进行人工授精,获得的受精卵用于基因编辑定点修饰。
2)构建长牡蛎靶基因paramyosin的sgrna
针对长牡蛎靶基因paramyosin(geneid:loc105329634)的第四个外显子,在线设计sgrna靶点,为ggaggacgccctcaatgatctgg(gg为t7转录所加),其中pam序列为tgg。
体外转录合成sgrna,具体步骤如下:设计一条正向引物sg-para-f,引物序列为5’-gatcactaatacgactcactataggaggacgccctcaatgatcgttttagagctagaaat-3’(含t7启动子序列),以dr274质粒(addgeneplasmid42250)为模板,使用正向引物sg-para-f和通用引物sg-r(5’-aaaagcaccgactcggtgcc-3’)进行pcr扩增。pcr反应条件为:98℃30秒;35个循环包含98℃5秒,60℃10秒,72℃5秒;72℃5分钟。pcr扩增使用高保真酶(thermo,f530s),pcr产物采用常规方法纯化。以纯化后的pcr产物为模板,使用t7体外转录试剂盒(thermo,am1354)转录sgrna,使用常规苯酚氯仿法进行纯化。
3)定点突变的供体模板ssodn序列设计
以靶基因paramyosin第四个外显子为目的序列,在sgrna靶点序列位置,左侧翼序列长度45bp,右侧翼序列长度54bp,设计ssodn序列。将pam序列tgg变为tag,sgrna靶点序列设计两处点突变(见图1)。
整个ssodn长度120bp,为基因组dna序列的反向互补序列,ssodn120具体序列为:5’-tagcaggcgacacttaccgtcccttggattttgtcatgtactcgagttggtcagctagatcattgagagcatcctggtgacgtttgcgcatgctggcctctgttgactcgtaagatgcat-3’。
4)定点插入的供体模板ssodn序列设计
以靶基因paramyosin第四个外显子为目的序列,在pam序列的前四个碱基处设计待插入的6bp酶切位点序列aagctt,插入位点左右侧翼序列长度各60bp。将pam序列tgg改为tag(见图2)。
整个ssodn长度126bp,为基因组dna序列的正向序列,ssodn126具体序列为:5’-aatgcatcttacgagtcaacagaggccagcatgcgcaaacgtcaccaggacgccctcaataagcttgatctagctgaccaactcgagtacatgacaaaatccaagggacggtaagtgtcgcctgct-3’。
ssodn合成均由dna合成公司进行合成。
5)cas9mrna的合成
使用内切酶xbai(neb)酶切pt3ts-ncas9n质粒,酶切后用minelutepcrpurificationkit(qiagen)纯化;以上述线性化质粒为模板用t3rnapolymerasekit(ambion)进行体外转录产生加帽的cas9mrna;利用苯酚氯仿方法纯化cas9mrna。
6)显微注射长牡蛎受精卵
首先将cas9mrna、sgrna、ssodn和非同源修复抑制剂ku5778进行混合得到注射混合物,终浓度分别为500ng/μl、500ng/μl、2μm和10μm;所述ssodn分别为步骤3)设计的定点突变序列和步骤4)设计的定点插入序列。
即,受精卵实验组为定点突变序列组和定点插入序列组,另外还设有对比野生组,每组注射受精卵100个。
将步骤1)制备的不超过半小时的长牡蛎受精卵置于60mm直径的一次性塑料培养皿中央,滴加1-2滴海水,使用倒置显微镜将受精卵调至视野中。利用气压式手动显微注射仪调节吸持针压力为负压,吸持固定一枚受精卵,利用定量显微注射系统,将约等于0.1nl的上述注射混合物注射到长牡蛎受精卵中。注射完后,通过调节吸持针内压为正压将已注射的卵排掉,更换吸持针位置及吸持针内压吸持其他受精卵,逐枚进行注射。对比组注射混合物中不包括ssodn序列。
注射后的胚胎置于23-24℃的无菌海水中培养。
对比例:
该对比实验中,除步骤3)定点突变的供体模板ssodn序列设计区别于实施例1,其他步骤与实施例相同。
(1)以靶基因paramyosin第四个外显子为目的序列,在sgrna靶点序列位置,左侧翼序列长度19bp,右侧翼序列长度20bp,设计ssodn序列。将pam序列tgg变为tag,sgrna靶点序列设计两处点突变(同120bp设计位置)。
ssodn60具体序列为:
5’-catgtactcgagttggtcagctagatcattgagagcatcctggtgacgtttgcgcatgct-3’,该ssodn长度为:60bp。
(2)以靶基因paramyosin第四个外显子为目的序列,在pam序列的前四个碱基处设计待插入的6bp酶切位点序列aagctt,插入位点左右侧翼序列长度各30bp。将pam序列tgg改为tag。
ssodn66具体序列为:
5’-atgcgcaaacgtcaccaggacgccctcaataagcttgatctagctgaccaactcgagtacatgaca-3’,该ssodn长度为:66bp。
上述两组对比实验,结果均未检测到定点突变或定点插入。对于点突变实验的pcr产物利用foki内切酶进行酶切,插入实验的pcr产物利用hindiii内切酶进行酶切。没有出现预期酶切片段,进一步将pcr产物进行常规ta克隆,随机挑取20个单克隆纯化并测序,未检测到定点突变或定点插入的存在。
实施例2
上述实施例1中靶基因点突变或插入进行检测验证
定点突变序列、定点插入序列实验组,以及对比野生组长牡蛎受精卵显微注射后24小时后,收集牡蛎d形幼虫,使用常规方法提取牡蛎幼虫的基因组dna。设计引物pcr扩增包含靶位点的基因组片段,pcr反应条件为:94℃3分钟;45个循环包含94℃30秒,60℃30秒,72℃30秒;72℃5分钟。对于点突变实验的pcr产物利用foki内切酶进行酶切,插入实验的pcr产物利用hindiii内切酶进行酶切。选取出现成功酶切的pcr产物进行常规ta克隆,随机挑取15个单克隆送至测序公司进行纯化并测序。
结果验证:
靶位点处发生点突变或插入,如图3所示,检测到预期的同源重组修复结果,得到点突变或外源序列插入,从图3中可以看出,点突变实验组别经测序与实施例1中经设计的步骤3)中的突变序列一致‘t’、‘a’、‘a’,点插入组别与实施例1中经设计的步骤4)中的点插入序列一致‘aagctt’。
上述结果说明了,利用本发明提供的ssodn介导的牡蛎基因组定点突变或插入的方法能够产生定位修饰-点突变或插入,即本发明提供的方法能够实现定点靶基因修饰。
序列表
<110>中国海洋大学
<120>一种ssodn介导的牡蛎基因组定点突变或插入的方法
<160>7
<170>siposequencelisting1.0
<210>1
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>1
ggaggacgccctcaatgatctgg23
<210>2
<211>58
<212>dna
<213>人工序列(artificialsequence)
<400>2
gatcactaatacgactcactataggaggacgccctcaatgatcgttttagagctagaa58
<210>3
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>3
aaaagcaccgactcggtgcc20
<210>4
<211>120
<212>dna
<213>人工序列(artificialsequence)
<400>4
tagcaggcgacacttaccgtcccttggattttgtcatgtactcgagttggtcagctagat60
cattgagagcatcctggtgacgtttgcgcatgctggcctctgttgactcgtaagatgcat120
<210>5
<211>126
<212>dna
<213>人工序列(artificialsequence)
<400>5
aatgcatcttacgagtcaacagaggccagcatgcgcaaacgtcaccaggacgccctcaat60
aagcttgatctagctgaccaactcgagtacatgacaaaatccaagggacggtaagtgtcg120
cctgct126
<210>6
<211>60
<212>dna
<213>人工序列(artificialsequence)
<400>6
catgtactcgagttggtcagctagatcattgagagcatcctggtgacgtttgcgcatgct60
<210>7
<211>66
<212>dna
<213>人工序列(artificialsequence)
<400>7
atgcgcaaacgtcaccaggacgccctcaataagcttgatctagctgaccaactcgagtac60
atgaca66
- 还没有人留言评论。精彩留言会获得点赞!