一种富含几丁质的动物基因组DNA的提取方法
本发明属于分子生物学领域,特别涉及一种用于富含几丁质的动物,例如节肢动物基因组的提取方法。
背景技术:
随着测序技术的发展,人们对节肢动物(例如昆虫、蛛形纲动物)的基因组研究也更加广泛和深入,而获取高质量的基因组dna是进行后续研究的重要基础。节肢动物体内富含几丁质,这导致现有技术中大量适合于普通组织样本的基于酚氯仿抽提的dna提取方法在节肢动物的基因组提取中效果不佳,无法兼顾提取的基因组dna的浓度和纯度,特别是对于保存时间较长,dna降解严重的样品,提取效率非常低下。而基于二氧化硅膜吸附的dna提取试剂盒效率也并不高,稳定性差,而且价格昂贵,难以产业化应用。因此本领域迫切需要一种适合于富含有几丁质的动物个体或者组织样品的基因组dna提取方法。
技术实现要素:
发明人经过多年的研究,通过综合分析传统dna提取方法中存在的制约产量和纯度提高的缺陷,结合目标样本的特性,对dna提取方法进行了的创造性改进和优化,从而获得了一种适用于富含几丁质的动物,例如节肢动物样本的dna提取方法。本发明的方法获得的基因组dna总量大、纯度高并且成本低廉,效果不逊于甚至优于本领域普遍适用的商业化试剂盒,但是成本显著更低,因而具有广阔的产业化应用前景。具体的,本发明的第一个方面提供了一种包含几丁质外壳的动物基因组dna的提取方法,其包括下列步骤:
1)取包含几丁质外壳的动物个体样品或者组织样品;
2)加入溶液a和蛋白酶k;于50-70℃条件下,孵育8-16小时或者过夜(其中温度例如50℃、55℃、60℃、65℃或70℃;或者,孵育时间例如8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23或24小时);所述溶液a的组成为:0.1m三羟甲基氨基甲烷(tris-hcl),ph9.0、0.1m乙二胺四乙酸(edta)、1%(w/v)十二烷基硫酸钠(sds);
优选地,在加入所述溶液a以及蛋白酶之前或者之后,对所述样品进行破碎,更优选地,当所述样品为新鲜样品时,所述破碎为剪碎;当所述样品为干样品,例如标本时,所述破碎为研磨;
3)加入醋酸盐(例如醋酸钾)并混匀,0至4℃或者置于冰上孵育,离心取上清;
4)加入蛋白抽提剂并混匀,静置分层,离心取上清液;
5)向上清中加入dna沉淀剂以及糖原或糖原衍生物(例如糖原蓝)以沉淀dna,离心后取沉淀,即得到基因组dna。
在一个实施方案中,所述包含几丁质外壳的动物是节肢动物,优选地,所述节肢动物是昆虫纲或者蛛形纲的动物,例如蝴蝶、蜘蛛或二化螟,还优选地,所述组织是胸部、四肢、腹部、或者翅膀;
进一步优选地,所述个体样品或者组织样品的添加量为5-100mg,例如5mg、10mg、20mg、30mg、40mg、50mg、60mg、70mg、80mg、90mg或100mg。
在又一个实施方案中,所述溶液a的加入量为每10mg样品不少于200μl(例如200-500μl、例如200、250、300μl、350、400或500μl);
在又一个实施方案中,所述蛋白酶k的浓度为25mg/ml,优选地,所述蛋白酶k的添加量为1.5-20μl,例如1.5、2、2.5、3、3.5、4、4.5、5、6、6.5、7、7.5、8、8.5、9、9.5、10、11、12、13、14、15、16、17、18、19或20μl。
在又一个实施方案中,所述醋酸钾的浓度为6-10m(例如6、7、8、9或10m),添加量为20-50μl(例如20、25、30、35、40、45、50μl),优选地,添加所述醋酸钾后的终浓度为1m。
在又一个实施方案中,其中步骤3)中所述0至4℃或者置于冰上孵育的时间为10分钟至2小时,例如10分钟、20分钟、30分钟、40分钟、50分钟、60分钟、1.5小时或2小时。
在又一个实施方案中,其中在步骤2)中还同时添加rna酶;或者
在步骤2)和步骤3)之间,还包括去除rna的步骤,例如,所述去除rna的步骤为:向消化后的溶液中加入rna酶,于37℃下孵育10-30分钟(例如10分钟、15分钟、20分钟、25分钟或30分钟);
优选地,所述rna酶为rna酶a;优选地,所述rna酶a的浓度为10-20mg/ml,添加量为3-10μl(例如3、4、5、6、7、8、9或10μl)。
在又一个实施方案中,步骤4)中所述蛋白抽提剂为氯仿、或者酚与氯仿的等体积混合物、或者酚:氯仿:异戊醇=25:24:1的混合物;优选地,所述蛋白抽提剂的加入体积与步骤3)获得的上清体积相同;
还优选地,步骤4)重复进行1至5次(例如2次、3次、4次或者5次)。
在又一个实施方案中,其中步骤5)中,所述dna沉淀剂为乙醇、异丙醇或者乙醇或异丙醇与醋酸钠的混合液;优选的,所述乙醇的添加量为2-5倍溶液体积(例如2、3、4或者5倍)体积;或者,
异丙醇的体积为0.5-0.8倍溶液体积(例如0.5、0.6、0.7或者0.8倍);或者,
醋酸钠的添加量为0.1-0.3倍溶液体积(例如0.1、0.2或者0.3倍);或者,
醋酸钠的浓度为1-5m(例如1、2、3、4或者5m);或者,
所述糖原或者糖原衍生物(例如糖原蓝)的浓度为10-50mg/ml(例如10、15、20、25、30、35、40、45或50mg/ml)、加入体积为0.1-10μl、例如0.1、0.2、0.3、0.4、0.5、0.8、1、2、3、4、5、6、7、8、9或者10μl。
本发明的第二个方面提供了一种基因组dna提取试剂盒,其中包括本发明第一个方面中所使用的试剂。
本发明的第三个方面提供了一种适合于包含几丁质外壳的动物基因组dna提取的试剂盒,其包括溶液a、dna沉淀剂以及糖原或者糖原衍生物(例如糖原蓝),所述溶液a的组成为:0.1m三羟甲基氨基甲烷(tris-hcl,ph9.0),0.1m乙二胺四乙酸(edta),1%(w/v)十二烷基硫酸钠(sds);优选的,所述dna沉淀剂为为乙醇、异丙醇或者乙醇或异丙醇与醋酸钠的混合液;更优选的,所述提取试剂盒还包括蛋白质抽提试剂,所述蛋白质抽提试剂为氯仿、或者酚与氯仿的等体积混合液、或者酚:氯仿:异戊醇=25:24:1的混合液。
附图说明
为了更清楚地说明本申请实施例和现有技术的技术方案,下面对实施例和现有技术中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本申请的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
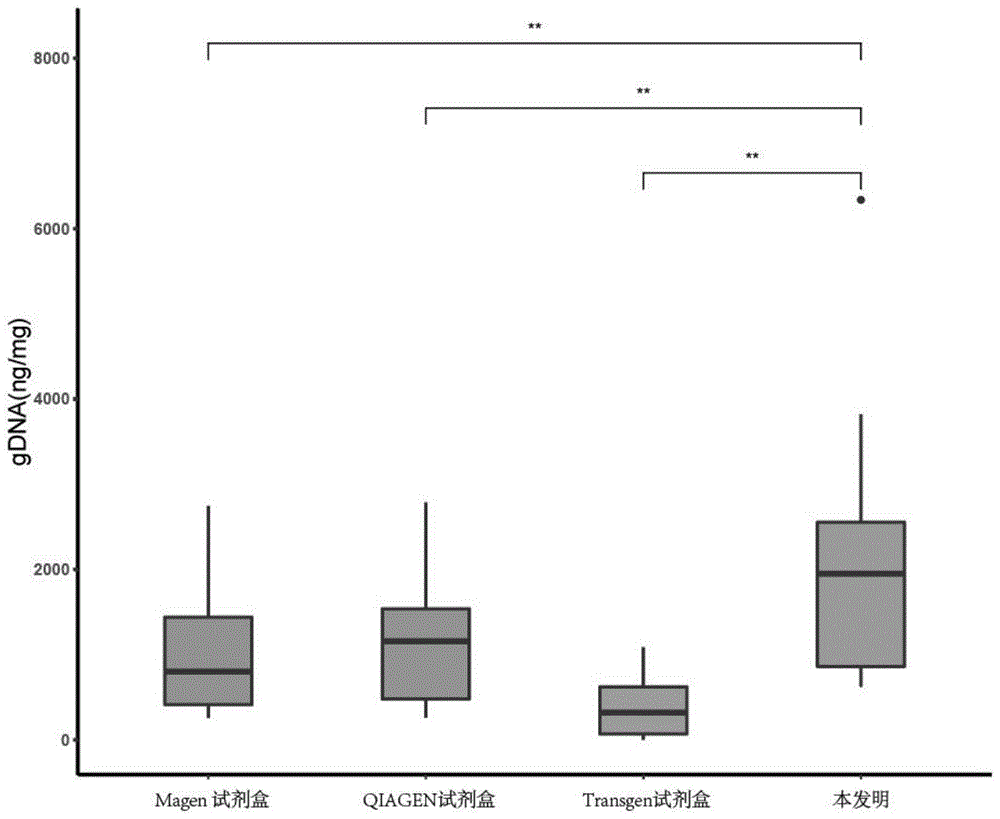
图1显示了本发明的方法与magen试剂盒、qiagen试剂盒和transgen试剂盒在提取蝴蝶胸部组织基因组dna的比较结果,纵坐标轴表示每mg组织能够提取的dna量。
图2本发明与qiagen试剂盒相比,提取蝴蝶标本dna时的结果。
图3a显示了使用实施例3所提取蜘蛛基因组dna进行pcr的结果;图3b显示了使用实施例2所提取的存放一年的蝴蝶标本的基因组dna进行pcr的结果;
图4显示了本发明提取的蝴蝶基因组建库结果(样品常温存放时间超过一年),图上所展示为基因组建库打碎后的片段长度和丰度的分布情况,x轴表示片段长度,y轴表示片段丰度,面积表示dna含量。
具体实施方式
为使本申请的目的、技术方案、及优点更加清楚明白,以下参照附图并举实施例,对本申请进一步详细说明。显然,所描述的实施例仅仅是本申请一部分实施例,而不是全部的实施例。基于本申请中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
以下实施例中所使用的蝴蝶均为枯叶蛱蝶,蝴蝶标本为枯叶蛱蝶标本,实施例1中所取蝴蝶组织均为新鲜组织。
实施例1蝴蝶组织基因组dna的提取
1.利用本发明方法提取蝴蝶胸部组织的基因组dna,具体步骤如下:
取新鲜的枯叶蛱蝶(kallimainachus)蝴蝶胸部组织10mg,置于1.5ml离心管中;
加入250μl的溶液a(0.1m三羟甲基氨基甲烷(tris-hcl,ph9.0),0.1m乙二胺四乙酸(edta),1%(w/v)十二烷基硫酸钠(sds)),及1.5μl25mg/ml蛋白酶k(roche)),将组织剪碎。(如果是保存较久的组织,可在加入溶液a之前剪碎)。
55℃孵育12小时;
孵育后加入3μl20mg/mlrnasea(transgen),37℃孵育15分钟,以去除rna。(该步骤为可选步骤,如果后续实验中少量rna的存在不会影响结果或者提取对象为非新鲜样品时,则可以不进行该步骤)。
加入35μl8m醋酸钾,手动上下晃匀;
置于冰上30分钟;13000rpm离心15分钟,然后将上清转移到一个新的1.5ml离心管中,尽可能不带有沉淀和中间状态的液体;
其中,醋酸钾使sds与蛋白形成的沉淀成为钾盐的形式,从而进一步降低了溶解度,使沉淀更为完全。
加入等体积(约250μl)氯仿,手动摇晃均匀(不要使用涡旋振荡器),13000rpm离心5分钟;
将上清转移到一个新的1.5ml离心管中,加入等体积(约250μl)氯仿,手动摇晃均匀,13000rpm条件下离心5分钟;
将上清转移到一个新的1.5ml离心管中,加入0.6倍体积的异丙醇(约150μl),0.1倍体积(约25μl)3m醋酸钠及2μl糖原蓝(ambion),手动晃匀;10000rpm离心5分钟,用移液器吸去上清,保留沉淀;
使用1ml浓度为70%的乙醇洗涤沉淀,13000转离心5分钟;弃去上清,将沉淀放在超净台中风干,使用20μlpcr级别的水溶解沉淀,通过电泳和分光光度计测量dna浓度。
进一步使用上述相同的方法进一步提取了另外9只蝴蝶胸部样品的dna,并分别进行电泳和dna浓度测量。
作为对比,采用市售的magen(magenhipureinsectdnakit昆虫dna提取试剂盒d3129-01)、transgen(transgeneasypureffpetissuegenomicdnakitee191-01)和qiagen(qiagendneasyblood&tissuekit(50)69504)dna提取试剂盒,对分别来源于本发明方法所使用的相同个体蝴蝶的胸部组织(同样提取相同质量(10mg)的10只蝴蝶胸部组织dna),按照说明书的操作方法提取基因组dna,并测量浓度和总dna量。
参见表1和图1可知,本发明方法所提取的基因组dna总量远高于所有市售试剂盒,针对每个蝴蝶组织样本的基因组dna提取量普遍达到了效果最好的试剂盒qiagen提取量的1.5至2倍以上,而且本发明方法所获得的基因组dna的纯度(参见表1中a260/a280和/或a260/a230的数值)远优于市售试剂盒magen和transgen,与qiagen不相上下。由以上结果可以看出,本发明基因组提取方法在产量和纯度方面达到了极佳的平衡。
表1
2.蝴蝶其它部位组织基因组dna的提取结果
为了进一步验证本发明方法对于蝴蝶所有部位的适用情况,进一步针对蝴蝶的腿部、腹部和翅膀使用本发明方法提取了基因组dna,具体地,
蝴蝶腿部组织dna的提取:
取蝴蝶腿部组织10mg,置于1.5ml离心管中;
加入250μl的溶液a(0.1m三羟甲基氨基甲烷(tris-hcl,ph9.0),0.1m乙二胺四乙酸(edta),1%(w/v)十二烷基硫酸钠(sds)),及2.5μl25mg/ml蛋白酶k),将组织剪碎;
65℃孵育过夜;
孵育后加入5μl20mg/mlrnasea(transgen),37℃孵育15分钟,以去除rna。
加入40μl8m醋酸钾,手动上下晃匀;
置于冰上30分钟;后13000rpm离心15分钟,然后将上清转移到一个新的1.5ml离心管中,尽可能不带有沉淀和中间状态的液体;
加入等体积(约240μl)氯仿,手动摇晃均匀(不要使用涡旋振荡器),13000rpm离心5分钟;
将上清转移到一个新的1.5ml离心管中,加入等体积(约250μl)氯仿,手动摇晃均匀,13000rpm条件下离心5分钟;
将上清转移到一个新的1.5ml离心管中,加入0.6倍体积的异丙醇(约150μl),0.1倍体积(约25μl)3m醋酸钠及5μl糖原蓝(ambion),手动晃匀;10000rpm离心5分钟,用移液器吸去上清,保留沉淀;
使用1ml浓度为70%的乙醇洗涤沉淀,13000转离心5分钟;弃去上清,将沉淀放在超净台中风干,使用20μlpcr级别的水溶解沉淀,通过电泳和分光光度计测量dna浓度。
蝴蝶腹部组织的dna提取:
1)取蝴蝶腹部组织10mg,置于1.5ml离心管中;
2)加入250μl的溶液a(0.1m三羟甲基氨基甲烷(tris-hcl,ph9.0),0.1m乙二胺四乙酸(edta),1%(w/v)十二烷基硫酸钠(sds)),及5μl25mg/ml蛋白酶k),将组织剪碎;
60℃孵育12小时;
孵育后加入10μl20mg/mlrnasea(transgen),37℃孵育15分钟,以去除rna。
加入30μl8m醋酸钾,手动上下晃匀;
置于冰上30分钟;后13000rpm离心15分钟,然后将上清转移到一个新的1.5ml离心管中,尽可能不带有沉淀和中间状态的液体;
加入等体积(约250μl)氯仿,手动摇晃均匀(不要使用涡旋振荡器),13000rpm离心5分钟;
将上清转移到一个新的1.5ml离心管中,加入等体积(约250μl)氯仿,手动摇晃均匀,13000rpm条件下离心5分钟;
将上清转移到一个新的1.5ml离心管中,加入0.6倍体积的异丙醇(约150μl),0.1倍体积(约25μl)3m醋酸钠及7.5μl糖原蓝(ambion),手动晃匀;10000rpm离心5分钟,用移液器吸去上清,保留沉淀;
使用1ml浓度为70%的乙醇洗涤沉淀,13000转离心5分钟;弃去上清,将沉淀放在超净台中风干,使用20μlpcr级别的水溶解沉淀,通过电泳和分光光度计测量dna浓度。
蝴蝶翅膀dna的提取:
取10mg蝴蝶翅膀,置于1.5ml离心管中;
加入500μl的溶液a(0.1m三羟甲基氨基甲烷(tris-hcl,ph9.0),0.1m乙二胺四乙酸(edta),1%(w/v)十二烷基硫酸钠(sds)),及3μl25mg/ml蛋白酶k),将组织剪碎;
70℃孵育8小时;
加入70μl8m醋酸钾,手动上下晃匀;
置于冰上30分钟;后13000rpm离心15分钟,然后将上清转移到一个新的1.5ml离心管中,尽可能不带有沉淀和中间状态的液体;
加入等体积(约250μl)氯仿,手动摇晃均匀(不要使用涡旋振荡器),13000rpm离心5分钟;
将上清转移到一个新的1.5ml离心管中,加入等体积(约250μl)氯仿,手动摇晃均匀,13000rpm条件下离心5分钟;
将上清转移到一个新的1.5ml离心管中,加入0.6倍体积的异丙醇(约150μl),0.1倍体积(约25μl)3m醋酸钠及5μl糖原蓝(ambion),手动晃匀;10000rpm离心5分钟,用移液器吸去上清,保留沉淀;
使用1ml浓度为70%的乙醇洗涤沉淀,13000转离心5分钟;弃去上清,将沉淀放在超净台中风干,使用20μlpcr级别的水溶解沉淀,通过电泳和分光光度计测量dna浓度。
结果如表2所示,本发明方法适用于以蝴蝶身体中主要组织部位为样本高质量的提取基因组dna。
表2
实施例2蝴蝶标本基因组dna的提取
在实际工作中,常常需要对一些特殊样本的基因组dna进行提取和分析,例如标本,由于标本经过了化学试剂的处理并且经过了长期放置,导致其dna提取难度相比于新鲜样本而言更大,因此迫切需要行之有效的dna提取方法。现有技术大部分的基因组dna提取方法在提取标本样品的基因组dna时,效果不佳,这也大大限制了标本基因组dna的分析工作和分析效果。
为了验证本发明方法对经过处理且长期放置的标本基因组dna的提取效果,本实施例进一步分别提取了常温储存超过一年的10个蝴蝶个体标本的dna,具体步骤如下:
取蝴蝶标本10mg,剪碎,置于1.5ml离心管中;
加入250μl的溶液a(0.1m三羟甲基氨基甲烷(tris-hcl,ph9.0),0.1m乙二胺四乙酸(edta),1%(w/v)十二烷基硫酸钠(sds)),及20μl25mg/ml蛋白酶k);
55℃孵育过夜;
加入45μl8m醋酸钾,手动上下晃匀;
置于冰上30分钟;后13000rpm离心15分钟,然后将上清转移到一个新的1.5ml离心管中,尽可能不带有沉淀和中间状态的液体;
加入等体积(约250μl)氯仿,手动摇晃均匀(不要使用涡旋振荡器),13000rpm离心5分钟;
将上清转移到一个新的1.5ml离心管中,加入等体积(约250μl)氯仿,手动摇晃均匀,13000rpm条件下离心5分钟;
将上清转移到一个新的1.5ml离心管中,加入0.6倍体积的异丙醇(约150μl),0.1倍体积(约25μl)3m醋酸钠及2.5μl糖原蓝(ambion),手动晃匀;10000rpm离心5分钟,用移液器吸去上清,保留沉淀;
使用1ml浓度为70%的乙醇洗涤沉淀,13000转离心5分钟;弃去上清,将沉淀放在超净台中风干,使用20μlpcr级别的水溶解沉淀,通过电泳和分光光度计测量dna浓度。
作为对比,发明人选择了在对比例1中表现最佳的qiagen试剂盒,同样提取常温储存超过一年的10个蝴蝶个体标本,具体步骤按说明书进行。
表3
结果如图2和表3所示,利用本发明方法和qiagen试剂盒各自分别针对10个质量相当的蝴蝶个体标本提取了基因组dna,本发明方法所能够提取的基因组dna总量远高于qiagen试剂盒,倍数普遍达到了2到4倍之间。不但如此,本发明方法所获得的基因组dna的纯度也显著优于qiagen(比较表2中的a260/280值以及a260/230值的差异)。
此外,考虑到效果最接近本发明方法的qiagendneasyblood&tissuekit,其单次使用价格超过人民币三十元,而实施例1和2的方法单次提取等量样本的基因组dna所需试剂价格不超过人民币十元,可见本发明方法在提取效果提升的同时,还能极大的降低成本。
实施例3蜘蛛基因组dna的提取
本实施例进一步验证了本发明方法对于同样包含几丁质的蜘蛛提取基因组dna的效果,具体操作如下:
1)取蛛形纲的温室拟肥腹蛛(parasteatodatepidariorum)摘除腹部后的其它部分组织10mg,置于1.5ml离心管中;
2)加入250μl的溶液a(0.1m三羟甲基氨基甲烷(tris-hcl,ph9.0),0.1m乙二胺四乙酸(edta),1%(w/v)十二烷基硫酸钠(sds)),及5μl25mg/ml蛋白酶k);将组织剪碎;
55℃孵育过夜;
孵育后加入3μl20mg/mlrnasea(transgen),37℃孵育15分钟,以去除rna。
加入35μl8m醋酸钾,手动上下晃匀;
置于冰上30分钟;后13000rpm离心15分钟,然后将上清转移到一个新的1.5ml离心管中,尽可能不带有沉淀和中间状态的液体;
加入等体积(约250μl)氯仿,手动摇晃均匀(不要使用涡旋振荡器),13000rpm离心5分钟;
将上清转移到一个新的1.5ml离心管中,加入等体积(约250μl)氯仿,手动摇晃均匀,13000rpm条件下离心5分钟;
将上清转移到一个新的1.5ml离心管中,加入0.6倍体积的异丙醇(约150μl),0.1倍体积(约25μl)3m醋酸钠及5μl糖原蓝(ambion),手动晃匀;10000rpm离心5分钟,用移液器吸去上清,保留沉淀;
使用1ml浓度为70%的乙醇洗涤沉淀,13000转离心5分钟;弃去上清,将沉淀放在超净台中风干,使用20μlpcr级别的水溶解沉淀,通过电泳和分光光度计测量dna浓度。
如表4所示,可见本发明方法同样能够成功提取大量纯度很高的蜘蛛基因组dna。
表4
实施例4利用本发明方法提取的基因组dna进行下游分析
本实施例验证了本发明方法提取的基因组dna用于下游dna分析时的情况。
以实施例2中本发明方法提取的蝴蝶标本基因组为模板,以实施例3中本发明方法提取的蜘蛛基因组dna为模板,分别针对co1基因进行了pcr扩增(上述引物序列如表5所示),pcr条件和程序如下:
pcr程序:
表5
利用电泳检测扩增结果显示,以实施例2提取的蝴蝶标本基因组和实施例3提取的蜘蛛基因组为模板进行pcr能够得到干净清晰的扩增条带,其中蜘蛛co1基因的扩增结果见图3a,蝴蝶co1基因的扩增结果如图3b所示,这表明上述基因组dna的质量适合于下游的检测分析。
随后,利用实施例2中提取的蝴蝶标本dna,使用kapahyperprepkit进行二代测序的建库,结果如图4所示,其中x轴表示片段长度,y轴表示片段丰度,面积表示dna含量,可见打碎后的dna片段多集中在200-500bp,且两端的未打断片段和降解严重片段含量较小,由此可见,本发明方法所提取的基因组dna的片段经超声波破碎后的长度和丰度完全符合建库要求。
实施例5去除基因组dna产品中rna污染的操作优化
本领域已知的是,基因组dna提取中常常会伴随着rna的污染,这是因为随着细胞的裂解,细胞内的rna会和基因组一起释放至溶液中,如果在dna提取过程中不包含去除rna的步骤,那么在核酸沉淀时,rna就会和基因组dna一起被沉淀下来。当然,由于rna本身并不稳定,如果基因组dna所来自的样本不是新鲜样本(比如标本等),则rna污染会比较少;或者所制备得到的基因组dna产品不是立即使用而是会长期放置,则共沉淀下来的rna也会被慢慢降解,污染问题也并不严重。但是如果基因组dna产品需要立即使用,并且该基因组dna是制备自大量的新鲜样本,那么种产品中所存在的rna就可能会对下游分析产生一定的干扰,这就需要在基因组dna的提取过程中去除rna。
通常而言,在dna提取中可以通过添加rna酶,例如rnasea去除rna污染。不过发明人意外的发现,添加rna酶的时机对于基因组dna的纯度非常重要。发明人以二化螟(chilosuppressalis)新鲜虫体为样本(其质量达到了几十mg,包含较多的rna)提取了基因组dna,并且分别测试了不去除rna、以及在不同的时机添加rna酶的方法,结果如表6所示,如果不添加rnase,其中rna污染会比较严重,a260/a280超过了2.0,表明了rna的含量较高。如果在溶液a和蛋白酶k孵育的同时或者之后(但是醋酸钾处理前)添加rnasea,能够获得非常好的去除效果(a260/a280在1.8左右,以dna为主);但是如果在醋酸钾处理后再添加rnasea,虽然后续还会包含氯仿抽提去除蛋白的步骤,但是所得到的终产品中仍然出现了大量的蛋白污染(a260/a280仅1.6左右)。这就表明,对于本发明方法而言,针对大量、新鲜样本时,如果打算添加rnasea去除rna,需要在醋酸钾处理步骤之前添加。
表6
- 还没有人留言评论。精彩留言会获得点赞!