一种花生半胱氨酸蛋白酶编码基因AhRD21B及在提高植物低温胁迫中的应用
一种花生半胱氨酸蛋白酶编码基因ahrd21b及在提高植物低温胁迫中的应用
技术领域
1.本发明属于植物基因工程技术领域,公开了一种花生半胱氨酸蛋白酶编码基因ahrd21b及其过表达载体的构建及在提高植物低温胁迫中的应用。
背景技术:
2.花生是我国重要的油料作物之一,营养价值丰富。我国花生种植面积达7500多万亩,产量约1700万吨,占世界总产量约40%,占全国油料作物总产(不含大豆)近50%,其种植业产值达1200亿元,居全国农作物(水稻、小麦、玉米之后)的第四位,在我国国民经济发展中起着举足轻重的地位。
3.花生作为喜温作物,在整个生长发育过程中对温度的要求较高,花生在萌发期若遭遇12℃以下的低温,发芽率降低,种子腐烂甚至死亡;幼苗期遭遇14
‑
16℃以下的低温时,植株生长缓慢甚至停止生长,叶片发生脱水,萎蔫,枯死等症状。但是目前由于市场需求、土地利用效率以及规避生长和收获阶段不良气候影响等因素的共同影响,近年来我国各春花生生产区的播种时间逐渐提前,花生种植区域的变化和春花生播种时间的提前导致我国各产区的花生在播种后遇到低温天气的概率日益增大。因此筛选获得花生响应低温胁迫相关基因,明确花生的耐冷机理,实现花生耐低温特性的遗传改良对我国花生生产至关重要。
4.木瓜类半胱氨酸蛋白酶(papain
‑
like cysteine proteases, plcps)是蛋白酶家族的重要成员之一,在植物响应非生物胁迫中起重要作用。northern印迹分析显示,拟南芥的两个与干旱相关的基因rd19a和rd21a均不受脱落酸诱导,但在高盐条件下二者mrna的转录水平会升高,并推测rd19和rd21基因可能是由植物细胞渗透式的变化引起的。对小麦幼苗进行冷胁迫低温处理后tacp的表达水平剧烈上升,并在处理72 h上调了40倍。豌豆植株plcp基因cyp15a与拟南芥的rd19同源,研究证明该基因可响应低温和干旱胁迫。因此,半胱氨酸蛋白酶活性的调节对于提高植物的抗逆性也至关重要。
5.本发明针对以上背景技术,以花生在4℃低温处理花生后进行转录组测序分析发现半胱氨酸蛋白酶基因ahrd21b的表达量显著上调,进一步通过过表达遗传转化拟南芥鉴定其响应低温的功能和调控作用。
技术实现要素:
6.本发现提供了一种受低温胁迫表达量显著上调的花生半胱氨酸蛋白酶编码基因ahrd21b及其过表达载体的构建及在在提高植物低温胁迫中的应用,将为植物的抗冷害胁迫基因工程育种提供理论基础和基因资源。
7.本发明提供了一种花生半胱氨酸蛋白酶编码基因,在4℃低温处理花生后的转录组数据分析发现一个半胱氨酸蛋白酶基因的表达量显著上调,命名为ahrd21b基因,该基因含有如seq id no.1所示的核苷酸序列,该基因位于花生基因组第16号染色体chr16:145086424..145090516 (
‑
strand),测序品种为狮头企。所述的ahrd21b基因编码的氨基酸
序列如seq id no.2 所示。
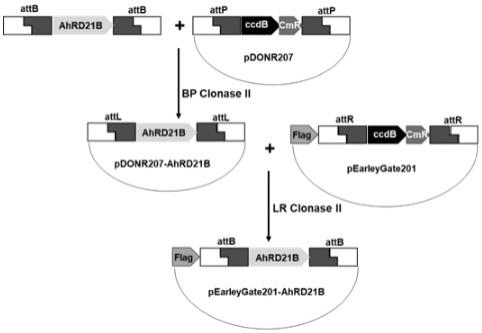
8.本发明还提供了包含所述花生半胱氨酸蛋白酶编码基因ahrd21b的过表达载体和遗传转化拟南芥;所述过表达载体的构建方法包括以下步骤:基于gateway系统通过bp反应构建入门载体pdonr207
‑
ahrd21b,再经过lr反应构建camv 35s启动子驱动的植物表达载体pearleygate201
‑
ahrd21b。将过表达载体转化农杆菌gv3101,通过浸花法转化拟南芥获得转基因纯合阳性植株。
9.最后,对转基因拟南芥株系进行低温胁迫处理的功能验证,结果表明花生ahrd21b基因能够显著提高拟南芥植株的抗冻能力,同时转基因株系在低温处理下冷胁迫信号通路标记基因较野生型显著上调,表明可以提高植物响应低温胁迫的抗性,这为植物的抗冷害胁迫基因工程供理论基础和基因资源。
10.有益效果:本发明是通过花生在4℃低温处理花生后进行转录组测序数据分析发现半胱氨酸蛋白酶基因ahrd21b的表达量显著上调,克隆获得该基因的cds序列,通过构建ahrd21b基因的过表达载体表达载体,转化gv3101农杆菌,浸花法转化拟南芥获得转基因纯合系,转基因植株在低温胁迫显著提高对冷害的抗性,而且转基因株系在低温处理下冷胁迫信号通路标记基因较野生型显著上调。采用本发明提供的方法还可以将该基因超表达转化花生、烟草或者其他喜温作物,从而提高植物在低温胁迫下的抗性,可以保护植株免受冷害胁迫,增加作物的产量和品质,在植物抗冷害胁迫基因工程中具有十分重要的应用前景。
附图说明
11.图1为低温胁迫下花生ahrd21b基因的相对表达差异*,**分别表明两两均值差异显著(p<0.05)和差异极显著(p<0.01)。
12.图2为pearleygate201
‑
ahrd21b过量表达载体构建过程示意图。
13.图3是低温胁迫中ahrd21b过表达转基因拟南芥提高冷害胁迫的抗性表型。
14.图4花生ahrd21b基因过表达和野生型拟南芥在冷害胁迫下植物响应冷害胁迫标记基因cbf1,cbf2和cbf3基因的表达差异。
具体实施方式
15.【实施例1】花生ahrd21b的cds序列的克隆和分析根据花生闽花8号品种在4℃低温处理前后的转录组测序数据分析发现一个半胱氨酸蛋白酶基因ahrd21b在低温处理后表达量显著上调,将该基因序列在栽培种花生基因组数据库(http://peanutgr.fafu.edu.cn/)比对发现该基因位于花生基因组第16号染色体chr16:145086424..145090516 (
‑
strand),下载其完整的cds序列,设计orf引物(ahrd21b
‑
f: atggcttcatccttcaccatcc,ahrd21b
‑
r: agcactgctcacaccattgaag),以花生叶片cdna为模板进行pcr扩增,采用takara公司高保真酶primestar
®
max进行扩增,pcr反应体系:1
ꢀµ
l的cdna为模板,10
ꢀµ
l的 2
×
primestar
®
max mix,正反引物各0.5
ꢀµ
l,补水到20
ꢀµ
l。反应条件:95℃预变性5 min;95℃ 30 s, 58℃ 30 s,72℃ 1 min 30 s,28个循环。pcr产物琼脂糖凝胶电泳检测后切胶纯化回收,将目的基因片段进行ta克隆,菌液pcr将阳性克隆送至福州铂尚生物技术有限公司测序,经拼接获得其全长的cds序列,ahcprd21b基因序
列cds长度为1242 bp,序列如seq id no.1所示,该基因编码414个氨基酸,序列如seq id no.2所示。将花生ahcprd21b基因编码的氨基酸序列分别放进smart网站进行在线分析,具有inhibitor
‑
i29,pept
‑
c1和gran等保守结构域,推断ahcprd21b属于plcp家族。
16.【实施例2】花生ahrd21b基因响应低温胁迫处理不同时间点的表达模式分析为了探究ahrd21b基因在花生响应低温胁迫不同时间点的表达差异,选取高产优质品种闽花8号进行4℃低温处理,利用qpcr分析ahrd21b基因在不同时间点的表达水平差异。设计该基因的荧光定量pcr引物(ahrd21b
‑
qpcr
‑
f:gaaggctaagaccaggagcaac,ahrd21b
‑
qpcr
‑
r:catcttcattgtatgatgtatc),采用ctab法提取低温胁迫的花生叶片的总rna,根据primescript
™ꢀ
reverse transcriptase逆转录酶(购自takara公司)说明书将1
ꢀµ
g的总rna进行逆转录合成单链cdna,将单链cdna稀释10倍,2
ꢀµ
l为模板,以ahactin为内参基因(ahactin
‑
f:gaggagaagcagaagcaagttg, ahactin
‑
r: agacagcatatcggcactcatc),采用abi7500实时荧光定量pcr仪进行定量pcr反应,按照takara公司sybr
®ꢀ
premix ex taq
™
试剂盒方案操作,20
ꢀµ
l的反应体系包括10
ꢀµ
l 2
×
sybr premix ex
‑
taq buffer,正反引物各0.5
ꢀµ
l,补水到20
ꢀµ
l。qrt
‑
pcr反应条件:95℃预变性5min;95℃ 15s, 60℃ 15 s,72℃ 30s,40个循环。相对表达量采用2
‑△△
ct
(livak)法计算。其中
△△
ct= (ct
gene
ꢀ‑ꢀ
ct
actin
)
处理
ꢀ‑ꢀ
(ct
gene
ꢀ‑ꢀ
ct
actin
)
对照
。结果显示ahrd21b基因在4℃低温胁迫处理下表达整体呈现出先上升后下降的趋势,其在初始阶段上调表达,处理后12 h达到表达最高峰即8.8倍,24 h表达急剧下调至1.7 倍,然后又逐渐开始上调至4.5倍左右(图1),说明该基因受低温胁迫的诱导表达。
17.【实施例3】ahrd21b过表达载体构建与验证根据ahrd21b全长基因cds序列,设计特异性引物(ahrd21b
‑
attb1
‑
f: ggggacaagtttgtacaaaaaagcaggcttcatggcttcatccttcaccatcc,ahrd21b
‑
attb2
‑
r: ggggaccactttgtacaagaaagctgggtcagcactgctcacaccattgaag)以优质高产花生品种闽花8号叶片的cdna为模板进行pcr扩增,采用takara公司高保真酶primestar
®
max进行扩增,pcr反应体系:1
ꢀµ
l的cdna为模板,10
ꢀµ
l的 2
×
primestar
®
max mix,正反引物各0.5
ꢀµ
l,补水到20
ꢀµ
l。反应条件:95℃预变性5 min;95℃ 30 s, 55℃ 30 s,72℃ 1 min 30 s,28个循环。pcr产物琼脂糖凝胶电泳检测后切胶纯化回收,将目的基因片段与pdonr207空载连接进行bp反应:ahrd21b的pcr产物1 μl,pdonr207空载1 μl,bp酶0.25 μl,25℃连接过夜,将连接产物转化到大肠杆菌dh5α感受态细胞,筛选阳性克隆进行测序,正确通读的克隆提取质粒,构建入门载体pdonr207
‑
ahrd21b。将入门载体质粒和过表达载体pearleygate201进行lr反应:pdonr207
‑
ahrd21b质粒1 μl,pearleygate201空载1 μl,lr酶0.25 μl,25℃连接过夜,转化大肠杆菌,验证阳性克隆,构建35s camv启动子驱动的过表达载体pearleygate201
‑
ahrd21b。其过表达载体的构建过程示意图如图2所示。
18.【实施例4】过表达ahrd21b转化基因拟南芥和鉴定将实施例2中超标表达载体转化农杆菌gv3101,鉴定阳性克隆,置于yeb液体培养基中(含有终浓度50 mg/l的利福平以及终浓度50 mg/l卡那霉素),于28℃培养过夜,至od600值为1.5~2.0,4℃,4,000 rpm离心10 min,菌体沉淀悬浮于5 %的蔗糖溶液(含有0.5% silwet l
‑
77(v/v),终浓度100 mm 乙酰丁香酮),至od600值为0.6
‑
0.8,待转化备用。参照浸花法转化一月龄的野生型col 0型拟南芥,具体做法是:取生长状况良好的植株,去
除大部分已经开放的花朵和结实的果荚,转化前一天浇足水,将将拟南芥花序浸泡于上述制备的农杆菌菌液中30 s,用吸水纸吸去多余的菌液,将转化的植株用保鲜膜包裹并黑色塑料袋罩住培养过夜。第二天将植物取出,竖直并转移到22℃温室内继续生长。根据情况可以将拟南芥侵染一到两次,每次侵染的时间间隔在一周左右。将转ahrd21b基因拟南芥代种子烘干,经春化后撒播在营养土中,22℃保湿培养1周,待植株长出4片叶子时,喷晒0.1%的basta溶液进行筛选。一周后对存活的拟南芥进行二次喷晒0.1%的basta溶液筛选获得转基因阳性植株,对转基因的阳性植株分别提取dna和rna,用camv 35s下游正向引物和ahrd21b基因特异性下游引物(35s
‑
f:tgatgtgatatctccactgacgtaag;ahrd21b
‑
r:cacatcctccttggtctttgactc)鉴定验证阳性植株,对不同的转基因株系进行rt
‑
pcr表达量分析,筛选获得3个表达量高的t0代转基因株系进行繁殖,并鉴定获得t1代转基因株系,ti代株系经过鉴定繁殖获得t2代转基因株系,t2代株系经鉴定繁殖获得t3代纯合的转基因株系(oe
‑
11,oe
‑
12和oe
‑
13)。
19.【实施例5】过表达ahrd21b转基因拟南芥在低温胁迫的抗性表型分析分别将野生型拟南芥col0和三个t3代转ahrd21b基因拟南芥纯合株系(oe
‑
11,oe
‑
12和oe
‑
13)的种子用75%的酒精和10%的次氯酸钠消毒,无菌水洗涤5次后,在超净工作台中用移液枪均匀的将4个材料分四格撒播种子于1/2ms固体培养基中,于22℃光照下培养14 d左右,放置4℃下黑暗处理24 h后采用梯度降温法处理上述材料,从0℃开始,1℃/h降温至
‑
9℃,之后置于4℃培养12 h转移至正常生长条件,分别在
‑
5℃和
‑
9℃处理后观察表型和拍照。如图3所示,野生型拟南芥在冷胁迫处理下叶片明显出现白化,在
‑
9℃下死亡率达到90%,而转基因株系均表现出较强的抗冻能力,尤其oe
‑
13株系表现更强的抗冻能力(图3)。
20.【实施例6】ahrd21b对冷胁迫信号通路标记基因cbf1,cbf2和cbf3表达量的影响分别将野生型拟南芥col0和oe
‑
13的t3代基因拟南芥纯合株系经消毒处理后种植在1/2ms培养基上,每个材料种植三个平板,于4℃下低温胁迫处理,以拟南芥actin为内参基因,qrt
‑
pcr检测处理后0 h、3 h、6 h、9 h、12 h和24 h不同时间点冷胁迫信号通路标记基因cbfs(cbf1,cbf2和cbf3)基因的表达,在低温处理的3~6 h内,oe
‑
13和野生型的cbfs基因都能迅速的上调且达到峰值, 相比于野生型,转基因材料cbfs基因的上调倍数更大,从处理6 h后,这些基因都会迅速的下降表达,整体上分析,转基因株系比野生型的上调倍数更大,达到极显著水平(图4)。表明花生ahrd21b可以提高植物在低温胁迫下的抗性,而且这种响应冷胁迫抗性是依赖于cbf的信号转导通路。
21.以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修改,皆应属本发明的涵盖范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1