一种咔唑类化合物及其在制备治疗脂肪肝及2型糖尿病等代谢相关疾病药物中的应用的制作方法
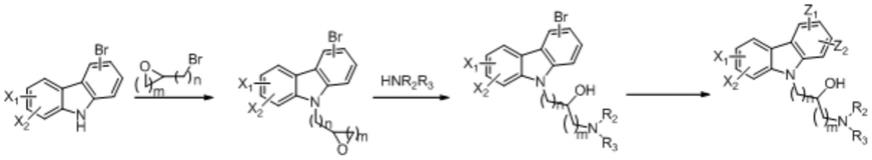
1.本发明涉及药物化合物领域,具体地说,涉及一种咔唑类化合物及其在制备治疗脂肪肝及2型糖尿病等代谢相关疾病药物中的应用。
背景技术:
2.随着肥胖及其代谢综合征全球化的流行,肥胖、糖尿病以及脂肪肝病等代谢性疾病现已成为欧美国家和我国富裕地区的重要疾病,是重大的卫生健康问题。脂肪肝包含单纯性脂肪肝和脂肪肝炎。部分单纯性脂肪肝患者逐步进展到脂肪肝炎,肝脏产生严重炎症和纤维化,导致肝纤维化、肝硬化甚至肝细胞癌。针对脂肪肝病的治疗主要是生活方式干预,包括减轻体重、改善饮食和锻炼。目前还没有药物获中国国家食品药品监督管理总局(cfda)、美国fda(food and drug administration)或欧洲医药局ema(european medicines agency)的批准用于治疗脂肪肝病。而糖尿病则是出现胰岛素分泌绝对不足或相对不足。以脂肪肝及2型糖尿病为代表的代谢相关疾病有着复杂的病因,但也有着相似的发病机制,有诸多共同之处。
3.本发明人前期申请的专利cn108619137b,公开了咔唑类化合物3,6
‑
二溴
‑
beta
‑
氟
‑
n
‑
(3
‑
甲氧基苯基)
‑
9h
‑
咔唑
‑9‑
丙胺(p7c3
‑
a20)在制备治疗代谢性疾病及其并发症的药物中的应用,我们使用高脂高糖饮食诱导的高脂血症、肥胖、脂肪肝动物模型证实p7c3
‑
a20可显著降低血脂、血糖、减轻肥胖、减轻脂肪肝病变,使用心肌细胞缺血缺氧模型模拟缺血性心肌损伤证实p7c3
‑
a20可显著降低缺血缺氧导致的心肌细胞损伤。该专利为代谢性疾病及其并发症提供了新的药物研发方向。因此,对p7c3
‑
a20类化合物进行化学改造,研发效果更加显著的类似物是有重要意义的。
技术实现要素:
4.本发明的目的是针对现有技术中的不足,提供一种咔唑类化合物及其药学上允许的盐,其用途和制备方法。
5.第一方面,本发明提供了一种咔唑类化合物,其结构通式如式(i)所示:
[0006][0007]
其中,
[0008]
r1选自卤素、羟基或c1‑
c6烷氧基;
[0009]
r2和r3中的每一个独立选自
[0010]
(a)氢或甲酰基;
[0011]
(b)c5‑
c8杂环基或芳基,其任选地被0
‑
4个r4取代;其中r4选自c1‑
c6烷氧基、c2‑
c6烯氧基、c2‑
c6炔氧基或卤素;
[0012]
x1和x2中的每一个独立选自氢或卤素;
[0013]
z1和z2中的每一个独立选自氢、氰基或
‑
sop
‑
r5;其中p选自0、1或2;r5选自c1‑
c6烷基、c2‑
c6烯基、c2‑
c6炔基;
[0014]
n和m中的每一个独立选自1、2、3或4。
[0015]
作为本发明的一种优选实施方式,
[0016]
r1选自卤素或羟基;
[0017]
r2和r3中的每一个独立选自
[0018]
(a)氢;
[0019]
(b)芳基,其任选地被0
‑
4个r4取代;其中r4选自c1‑
c6烷氧基或卤素;
[0020]
x1和x2中的每一个独立选自氢或卤素;
[0021]
z1和z2中的每一个独立选自氢、氰基或
‑
so2‑
r5;其中r5选自c1‑
c6烷基;
[0022]
n和m中的每一个独立选自1、2、3或4。
[0023]
作为本发明的另一种优选实施方式,
[0024]
r1选自卤素或羟基;
[0025]
r2选自氢;r3选自芳基,其任选地被0
‑
4个r4取代,其中r4选自c1‑
c3烷氧基;
[0026]
x1选自卤素,x2选自氢;
[0027]
z1选自
‑
so2‑
r5,其中r5选自c1‑
c3烷基;z2选自氢;
[0028]
n和m均为1。
[0029]
作为本发明的另一种优选实施方式,
[0030]
r1选自卤素或羟基;
[0031]
r2选自氢;r3选自芳基,其任选地被0
‑
4个r4取代,其中r4选自c1‑
c3烷氧基;
[0032]
x1选自卤素,x2选自氢;
[0033]
z1选自氰基;z2选自氢;
[0034]
n和m均为1。
[0035]
作为本发明的另一种优选实施方式,所述咔唑类化合物选自:
[0036]1‑
(3
‑
溴
‑6‑
甲磺酰基
‑
9h
‑
咔唑
‑9‑
基)
‑3‑
(3
‑
甲氧基苯基氨基)丙
‑2‑
醇;
[0037]
n
‑
(3
‑
(3
‑
溴
‑6‑
甲磺酰基
‑
9h
‑
咔唑
‑9‑
基)
‑2‑
氟丙基)
‑3‑
甲氧基苯胺;
[0038]1‑
(3
‑
溴
‑6‑
甲磺酰基
‑
9h
‑
咔唑
‑9‑
基)
‑3‑
(苯基氨基)丙
‑2‑
醇;
[0039]
n
‑
(3
‑
(3
‑
溴
‑6‑
氰基
‑
9h
‑
咔唑
‑9‑
基)
‑2‑
氟丙基)
‑3‑
甲氧基苯胺;
[0040]1‑
(3
‑
溴
‑6‑
氰基
‑
9h
‑
咔唑
‑9‑
基)
‑3‑
(苯基氨基)丙
‑2‑
醇。
[0041]
第二方面,本发明提供了如上所述的咔唑类化合物的药学上允许的盐。
[0042]
作为本发明的一种优选实施方式,所述药学上允许的盐为无机酸盐或有机酸盐。
[0043]
更优选地,所述无机酸包括盐酸、硫酸、磷酸、二磷酸、氢溴酸或硝酸;所述有机酸包括乙酸、马来酸、富马酸、酒石酸、琥珀酸、乳酸、对甲苯磺酸、水杨酸或草酸。
[0044]
第三方面,本发明提供了如上所述的咔唑类化合物或咔唑类化合物的药学上允许
的盐在制备治疗糖脂代谢性疾病及其并发症的药物中的应用。
[0045]
作为本发明的一种优选实施方式,所述糖脂代谢性疾病及其并发症为脂肪肝、糖尿病、高脂血症、肥胖或动脉硬化性心脑血管病。
[0046]
第四方面,本发明提供了如上所述的咔唑类化合物的制备方法:
[0047]
当所述咔唑类化合物为咔唑氨基醇化合物,可通过下述反应路线制备:
[0048][0049]
当所述咔唑类化合物为咔唑氟烷基化合物,可通过下述反应路线制备:
[0050][0051]
本文中,术语“c1‑
c6烷氧基”表示与氧连接的1至6个碳原子长的饱和碳链,该碳链可以是直链或分支的。例如,“c1‑
c6烷氧基”包括但不限于甲氧基、乙氧基、丙氧基和丁氧基。
[0052]
术语“c2‑
c6烯氧基”表示与氧连接的2至6个碳原子长的不饱和碳链,该碳链可以是直链或分支的。
[0053]
术语“c2‑
c6炔氧基”表示与氧连接的2至6个碳原子长的不饱和碳链,该碳链可以是直链或分支的,含有至少一个碳
‑
碳三键。
[0054]
术语“杂环基”表示4、5或6元完全饱和或者部分饱和的单环状环,其包含1、2或3个选自氮、氧或硫的杂原子,通过环碳原子或环氮原子连接。4、5或6元杂环状环的实例包括氮杂环丁烷、四氢呋喃、四氢吡喃、吡咯啉、吡咯烷、噻唑烷、吗啉、哌啶、哌嗪、二氢吡啶、二氢嘧啶和氮杂环庚烷。
[0055]
术语
“‑
sop
‑
r
5”,p选为0时,表示烷巯基;p选为1时,表示r5取代的亚砜;p选为2时,表示r5取代的磺酰基。
[0056]
本发明的化合物及其药学上允许的盐可按照常规药物制备方法制成颗粒剂、散剂、胶囊剂、片剂或口服液。可按剂型通过口服、腹腔注射、皮下注射、静脉注射、肌肉注射、粘膜用药等途径应用于需要治疗的个体。本发明的剂量一般为1~1000mg/公斤体重/天,具体可根据个体的年龄、病情等进行变化。
[0057]
本发明优点在于:
[0058]
发明人对p7c3
‑
a20类化合物进行化学改造,合成了一大类具有全新结构的氯丙基咔唑类化合物;随后,使用脂肪肝细胞模型(棕榈酸对肝细胞的脂肪毒性及炎症诱导作用)及2型糖尿病细胞模型(利用高浓度蔗糖在肝脏细胞上诱导胰岛素抵抗,模拟2型糖尿病的核心致病环节即外周代谢器官胰岛素抵抗)测试了这一类新化合物是否具有潜在保护作用。结果表明,本发明化合物对糖脂代谢类疾病具有显著的治疗作用,效果突出,具有临床应用潜力。
附图说明
[0059]
图1:化合物i1在细胞模型上对脂肪肝的潜在治疗作用。
##
p<0.01pa vs空白对照,**p<0.01vs pa单独给药。n=8。pa,棕榈酸。
[0060]
图2:化合物i2在细胞模型上对脂肪肝的潜在治疗作用。
##
p<0.01pa vs空白对照,*p<0.01vs pa单独给药。n=8。pa,棕榈酸。
[0061]
图3:化合物i3在细胞模型上对脂肪肝的潜在治疗作用。
##
p<0.01pa vs空白对照,*p<0.01vs pa单独给药。n=8。pa,棕榈酸。
[0062]
图4:化合物i4在细胞模型上对脂肪肝的潜在治疗作用。
##
p<0.01pa vs空白对照,*p<0.01vs pa单独给药。n=8。pa,棕榈酸。
[0063]
图5:油红o染色图片。
[0064]
图6:油红o染色统计柱状图。
[0065]
图7:i1‑
i4化合物在细胞模型上对2型糖尿病的潜在治疗作用。
[0066]
图8:化合物i1和a20对脂肪肝动物模型的肝脏组织甘油三酯含量的影响。
具体实施方式
[0067]
下面将结合具体实施方式对本发明的技术方案进行清楚、完整地描述,但是本领域技术人员将会理解,下列所描述的实施例是本发明一部分实施例,而不是全部的实施例,仅用于说明本发明,而不应视为限制本发明的范围。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
[0068]
实施例1
‑
5为新化合物的合成制备方法。实施例6
‑
10为新化合物的保护作用(活性)测试。
[0069]
本发明具体实施方式中采用的部分试剂等可以为下述:
[0070][0071][0072]
实施例1:1
‑
(3
‑
溴
‑6‑
甲磺酰基
‑
9h
‑
咔唑
‑9‑
基)
‑3‑
(3
‑
甲氧基苯基氨基)丙
‑2‑
醇(化合物i1)的制备
[0073][0074]
本实施例的化合物i1的制备路线如上所示,制备方法包括如下步骤:
[0075]
a、将6g 3,6
‑
二溴咔唑溶于60ml n,n
‑
二甲基甲酰胺中,加入1.2g氢氧化钾粉末,室温搅拌1h,滴加6.2g环氧溴丙烷,室温反应3h。反应液用100ml水稀释,过滤,收集固体,烘干得到白色固体化合物1(6g,85.7%)。
[0076]
b、将化合物1(6g)、间氨基苯甲醚(2.2g)和氯化铋(2.6g)加入到环己烷(120ml)中,90℃反应2天。反应液冷却至室温,加入乙酸乙酯(200ml)和水(200ml),静置,分离有机相,饱和食盐水洗一次,无水硫酸钠干燥,过滤,浓缩,柱层析分离,得到白色固体化合物2(1.9g,23.7%)。
[0077]
c、将化合物2(500mg)、甲烷亚磺酸钠(151mg)、碘化亚铜(37mg)和l
‑
脯氨酸(23mg)加入到二甲亚砜(10ml)中,氮气保护,150℃反应4h。反应液冷却至室温,加入水(40ml),用乙酸乙酯(50ml
×
2)萃取,合并有机相,饱和食盐水洗涤,无水硫酸钠干燥,过滤,浓缩,柱层析分离,得到化合物i1(210mg,46%)。
[0078]
对各个步骤得到的化合物进行常规分离提纯,将纯品进行表征,结构表征数据分别如下:
[0079]
化合物1:1h nmr(cdcl3)δ:8.16(d,j=1.8hz,2h),7.59(dd,j=8.7,1.9hz,2h),7.35
‑
7.37(m,2h),4.67(dd,j=15.9,2.7hz,1h),4.31(dd,j=15.9,5.1hz,1h),3.32
‑
3.36(m,1h),2.82
‑
2.85(m,1h),2.51
‑
2.53(m,1h);esi
‑
ms:m/z c
15
h
11
br2no[m+h]
+
计算值:381.9;实测值:381.9;
[0080]
化合物2:1h nmr(cdcl3)δ:8.17(d,j=1.8hz,2h),7.58(dd,j=8.7,1.9hz,2h),7.36
‑
7.38(m,2h),7.11(t,j=8.1hz,1h),6.36(dd,j=8.1,2.1hz,1h),6.26(dd,j=8.0,1.9hz,1h),6.17(t,j=2.2hz,1h),4.38
‑
4.45(m,3h),4.02(m,1h),3.76(s,3h),3.34
‑
3.38(m,1h),3.20
‑
3.24(m,1h),2.18(d,j=3.3hz,1h);esi
‑
ms:m/z c
22
h
20
br2n2o2[m+h]
+
计算值:504.9;实测值504.9;
[0081]
化合物i1:1h nmr(cdcl3)δ:8.66(d,j=1.6hz,1h),8.28(d,j=1.8hz,1h),8.00(dd,j=8.7,1.8hz,1h),7.61
‑
7.66(m,2h),7.45(d,j=8.7hz,1h),7.12(t,j=8.1hz,1h),6.36(dd,j=8.2,2.1hz,1h),6.27(dd,j=8.0,1.9hz,1h),6.18
‑
6.19(m,1h),4.41
‑
4.56(m,3h),4.05
‑
4.07(m,1h),3.77(s,3h),3.37
‑
3.41(m,1h),3.21
‑
3.26(m,1h),3.14(s,3h),2.35(d,j=3.3hz,1h);esi
‑
ms:m/z c
23
h
23
brn2o4s[m+h]
+
计算值:505.1/503.1;实测值505.1/503.1。
[0082]
实施例2:n
‑
(3
‑
(3
‑
溴
‑6‑
甲磺酰基
‑
9h
‑
咔唑
‑9‑
基)
‑2‑
氟丙基)
‑3‑
甲氧基苯胺(化合物i2)的制备
[0083][0084]
本实施例的化合物i2的制备路线如上所示,制备方法包括如下步骤:
[0085]
d、将p7c3
‑
a20(200mg)、甲烷亚磺酸钠(60mg)、碘化亚铜(14.8mg)和l
‑
脯氨酸(8.9mg)加入到二甲亚砜(4ml)中,氮气保护,150℃反应5h。反应液冷却至室温,加入水(20ml)稀释,用乙酸乙酯(20ml
×
2)萃取,合并有机相,饱和食盐水洗涤,无水硫酸钠干燥,过滤,浓缩,柱层析分离,得到化合物i2(85mg,43.3%)。
[0086]
化合物i2:1h nmr(cdcl3)δ:8.63(d,j=1.6hz,1h),8.25(d,j=1.7hz,1h),7.99(dd,j=8.7,1.7hz,1h),7.62(dd,j=8.7,1.8hz,1h),7.53(d,j=8.7hz,1h),7.36(d,j=8.7hz,1h),7.11(t,j=8.1hz,1h),6.36(dd,j=8.2,2.0hz,1h),6.25(dd,j=8.0,1.8hz,1h),6.15
‑
6.17(m,1h),5.04
‑
5.18(m,1h),4.61
‑
4.69(m,2h),3.91
‑
4.03(m,1h),3.76(s,3h),3.28
‑
3.53(m,2h),3.12(s,3h);esi
‑
ms:m/z c
23
h
22
fbrn2o3s[m+h]
+
计算值:507.1/505.1;实测值:507.1/505.1。
[0087]
实施例3:n
‑
(3
‑
(3
‑
溴
‑6‑
氰基
‑
9h
‑
咔唑
‑9‑
基)
‑2‑
氟丙基)
‑3‑
甲氧基苯胺(化合物i3)的制备
[0088][0089]
本实施例的化合物i3的制备路线如上所示,制备方法包括如下步骤:
[0090]
e、将p7c3
‑
a20(200mg)和氰化亚铜(35mg)加入到氮甲基吡咯烷酮(4ml)中,氮气保护,150℃反应6h。反应液冷却至室温,加入水(10ml)稀释,用乙酸乙酯(10ml
×
2)萃取,合并有机相,饱和食盐水洗涤,无水硫酸钠干燥,过滤,浓缩,柱层析分离,得到化合物i3(14mg,7.8%)。
[0091]
化合物i3:1h nmr(cdcl3)δ:8.35(d,j=1.0hz,1h),8.22(d,j=1.8hz,1h),7.71(dd,j=8.6,1.5hz,1h),7.62(dd,j=8.7,1.9hz,1h),7.48(d,j=8.6hz,1h),7.35(d,j=8.7hz,1h),7.12(t,j=8.1hz,1h),6.36(dd,j=8.1,2.1hz,1h),6.24(dd,j=8.1,1.9hz,1h),6.16(m,1h),5.05
‑
5.19(m,1h),4.60
‑
4.68(m,2h),3.96(t,j=6.4hz,1h),3.76(s,3h),3.30
‑
3.53(m,2h);esi
‑
ms:m/z c
23
h
19
fbrn3o[m+h]
+
计算值:452.1/454.1;实测值452.1/454.1。
[0092]
实施例4:1
‑
(3
‑
溴
‑6‑
甲磺酰基
‑
9h
‑
咔唑
‑9‑
基)
‑3‑
(苯基氨基)丙
‑2‑
醇(化合物i4)的制备
[0093][0094]
本实施例的化合物i4的制备路线如上所示,制备方法包括如下步骤:
[0095]
f、将p7c3(150mg)、甲烷亚磺酸钠(48.4mg)、碘化亚铜(12mg)和l
‑
脯氨酸(7.2mg)加入到二甲亚砜(3ml)中,氮气保护,150℃反应4h。反应液冷却至室温,加入水(10ml)稀释,用乙酸乙酯(10ml
×
2)萃取,合并有机相,饱和食盐水洗涤,无水硫酸钠干燥,过滤,浓缩,柱层析分离,得到化合物i4(25mg,16.7%)。
[0096]
化合物i4:1h nmr(meod)δ:8.68(d,j=1.5hz,1h),8.34(d,j=1.6hz,1h),7.94(dd,j=8.7,1.8hz,1h),7.71(d,j=8.8hz,1h),7.50
‑
7.57(m,2h),7.09
‑
7.13(m,2h),6.63
‑
6.66(m,3h),4.56
‑
4.60(m,1h),4.41
‑
4.46(m,1h),4.24
‑
4.30(m,1h),3.27
‑
3.28(m,1h),3.22
‑
3.27(m,1h),3.16(s,3h).;esi
‑
ms:m/z c
22
h
21
brn2o3s[m+h]
+
计算值:475.1/473.1;实测值475.1/473.1。
[0097]
实施例5:1
‑
(3
‑
溴
‑6‑
氰基
‑
9h
‑
咔唑
‑9‑
基)
‑3‑
(苯基氨基)丙
‑2‑
醇(化合物i5)的制备
[0098][0099]
本实施例的化合物i5的制备路线如上所示,制备方法包括如下步骤:
[0100]
g、将p7c3(150mg)和氰化亚铜(28.3mg)加入到氮甲基吡咯烷酮(3ml)中,氮气保护,150℃反应5h。反应液冷却至室温,加入水(10ml)稀释,用乙酸乙酯(10ml
×
3)萃取,合并有机相,饱和食盐水洗涤,无水硫酸钠干燥,过滤,浓缩,柱层析分离,得到化合物i5(25mg,18.9%)。
[0101]
化合物i5:1h nmr(meod)δ:8.50(s,1h),8.33(d,j=1.6hz,1h),7.67(m,2h),7.49
‑
7.57(m,2h),7.12(t,j=7.9hz,2h),6.64
‑
6.67(m,3h),4.55
‑
4.61(m,1h),4.39
‑
4.45(m,1h),4.24
‑
4.29(m,1h),3.27
‑
3.28(m,1h),3.18
‑
3.23(m,1h);esi
‑
ms:m/z c
22
h
18
brn3o[m+h]
+
计算值:420.1/422.1;实测值420.1/422.1。
[0102]
实施例6:i1‑
i4化合物在细胞模型上对脂肪肝的潜在治疗作用
[0103]
我们在培养的hepg2肝细胞上,采用棕榈酸(pa)诱导肝细胞建立细胞脂肪肝模型。
加入浓度0.3mm的pa及i1‑
i4化合物(浓度0.1、1、10μmol/l)处理细胞48h,通过检测脂质氧化应激标志物丙二醛(malondialdehyde,mda)水平判断细胞损伤程度。另外,还使用油红o染色判断脂质在细胞内的累计程度,方法如下:加入浓度pa(0.3mm)及i1‑
i4化合物(共5种,浓度1μmol/l)处理细胞48h后,使用油红o染色,红色面积越多,说明脂质沉积越多。
[0104]
细胞损伤指标1:脂质氧化应激标志物
‑
丙二醛(malondialdehyde,mda)
[0105]
(1)化合物i1的治疗作用如图1所示,0.1、1、10μm的化合物i1对于pa在肝细胞上诱导的脂质氧化应激有明显的抑制作用。
[0106]
(2)化合物i2的治疗作用如图2所示,10μm的化合物i3对于pa在肝细胞上诱导的脂质氧化应激有明显的抑制作用,在更低的两个浓度下则无统计学意义。
[0107]
(3)化合物i3的治疗作用如图3所示,10μm的化合物i3对于pa在肝细胞上诱导的脂质氧化应激有明显的抑制作用,在更低的两个浓度下存在一定效果,但无统计学意义。
[0108]
(4)化合物i4的治疗作用如图4所示,10μm的化合物i4对于pa在肝细胞上诱导的脂质氧化应激有明显的抑制作用,在更低的两个浓度下存在一定效果,但无统计学意义。
[0109]
综合来看:化合物i1‑4均有效果,化合物i1效果最好。
[0110]
细胞损伤指标2:油红o染色(脂质沉积量)
[0111]
油红o染色代表性图片如图5所示,统计学结果如图6所示。和对照组相比较pa处理组出现很多红色,说明pa处理后出现了细胞内脂质沉积。而pa处理组+化合物i1处理组、pa处理组+化合物i3处理组、pa处理组+化合物i4处理组的红色区域都明显减少,说明化合物i1、i3、i4对于pa在肝细胞上导致细胞内脂质沉积有明显的抑制作用。化合物i2在1μm浓度下有一定治疗作用,但不及i1、i3、i4强。
[0112]
实施例7i1‑
i4化合物在细胞模型上对2型糖尿病的潜在治疗作用
[0113]
高浓度葡萄糖在肝细胞上诱导胰岛素抵抗模型:将葡萄糖(上海生工公司产品)和地塞米松(美国sigma公司产品,货号d4902)溶入hepg2肝细胞株培养基,过滤除菌,使得培养基中的葡萄糖的终浓度达到60mm,地塞米松终浓度达到1μm,培养细胞共计48小时,即可成功制备2型糖尿病模型,用于模拟外周代谢组织的胰岛素抵抗现象。
[0114]
随后,我们在细胞上使用化合物i1、i2、i3、i4或者溶剂对照(0.1%终浓度的二甲亚砜dmso)进行刺激共计8小时,然后移入无酚红、无血清的正常葡萄糖浓度(25mm)培养基,使用胰岛素刺激0.1μm刺激4小时,随后将培养基倾出,使用南京建成公司的葡萄糖测定试剂盒(货号f006
‑1‑
1)对培养基的葡萄糖水平进行测定,以判断其消耗量,间接判断胰岛素敏感性,从而初步评价化合物i1、i2、i3、i4是否对2型糖尿病的潜在治疗作用。
[0115]
结果如图7所示。和对照组细胞相比较,胰岛素抵抗模型的培养基中葡萄糖的浓度下降值有明显下降,意味着细胞在胰岛素刺激条件下仍无法有效摄取葡萄糖。而化合物i1、i2、i3、i4对于这种胰岛素抵抗作用均有较为明显的抑制作用。这提示化合物i1、i2、i3、i4都有一定的拮抗2型糖尿病的作用。
[0116]
实施例8:i1化合物在动物模型上对脂肪肝的潜在治疗作用及与化合物a20的对比
[0117]
我们以60%脂肪供能的高脂饮食4个月在c57普通小鼠上诱导动物脂肪肝模型,然后测试化合物i1、化合物a20在整体动物疾病模型上的治疗作用。具体给药信息:剂量20mg/kg,灌胃给药,1天一次,共计2周。
[0118]
结果如图8所示。和对照组相比较,化合物i1、化合物a20给药组的肝脏组织的甘油
三酯含量均有明显下降,说明这2种化合物均可以有效逆转高脂饮食导致的肝脏细胞脂质沉积。而且,化合物i1的作用强于化合物a20。
[0119]
化合物i1、化合物a20对肝脏组织的胆固醇水平降低效果不明显,可能与给药时间较短有关系。
[0120]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1