检测1型、3型鸭甲型肝炎病毒和鸭坦布苏病毒的引物及应用的制作方法
1.本发明属于分子检测技术领域,具体涉及一种检测1型、3型鸭甲型肝炎病毒和鸭坦布苏病毒的引物及应用。
背景技术:
2.鸭病毒性肝炎(duck viral hepatitis,dvh)是由鸭肝炎病毒(duck hepatit
‑
is virus,dhv)引起3周龄内雏鸭的急性、高度接触性、致死性传染病。目前,已明确引起鸭肝炎的病原主要有鸭甲型肝炎病毒(duck hepatitis a virus,dhav)和鸭星状病毒(duck astrovirus,dastv)。dhav被分为3个类型,分别为1型dhav(dhav
‑
1)、2型dhav(dhav
‑
2)和3型dhav(dhav
‑
3)。其中,dhav
‑
1、dhav
‑
3在中国大陆地区流行,可单独或混合感染雏鸭。
3.鸭坦布苏病毒(duck tembusu virus,dtmuv),又称鸭黄病毒,是2010年4月以来在我国主要种鸭、蛋鸭养殖区福建、山东、浙江、上海、江苏、广西等地陆续爆发的以蛋鸭、种鸭产蛋骤然大幅下降为主要临床特征、以出血性卵巢炎为主要病变特征的一种新发的鸭急性传染病。由于该病是一种新发传染病,目前仍然是危害养鸭业的重要疫病。
4.dtmuv可感染家禽与其他鸟类,病毒感染的雏鸭表现一些临床症状和病理变化与dvh相似,当上述2种及2种以上病毒混合感染时,在临床诊断中很难做出准确判断,常规诊断方法(比如病原分离鉴定和血清学试验等)操作繁杂、费时费力,而且不易进行鉴别诊断,单重分子检测,在样品数量大时,操作繁琐,容易出错;但多重分子检测不同引物间容易相互干扰。
5.因此,如何提供一种快速、敏感检测1型、3型鸭甲型肝炎病毒和鸭坦布苏病毒方法是本领域亟待解决的问题。
技术实现要素:
6.本发明公开了一种检测1型、3型鸭甲型肝炎病毒和鸭坦布苏病毒的引物及应用。
7.为了实现上述目的,本发明采用如下技术方案:
8.一种检测1型、3型鸭甲型肝炎病毒和鸭坦布苏病毒的引物,引物序列为:
9.dhav
‑
1 f ggtgcaagggaccagaag,seq id no.1;
10.dhav
‑
1 r gtacctgcggaccaacag,seq id no.2;
11.dhav
‑
3 f aaggaagttcttgaaggcaa,seq id no.3;
12.dhav
‑
3 r cgaaagtggagattaggtgt,eq id no.4;
13.dtmuv f ttgctgccattttcataggc,seq id no.5;
14.dtmuv r acccctgtccacaaaatctt,seq id no.6;
15.一种基于1型、3型鸭甲型肝炎病毒和鸭坦布苏病毒引物的试剂盒包括:
16.pcr反应液含10
×
pcr buffer、10mm dntps、rtaq dna聚合酶、反应引物:dhav
‑
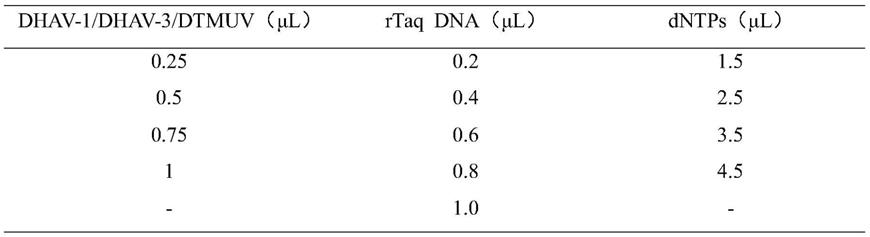
1 f、dhav
‑
1 r、dhav
‑
3 f、dhav
‑
3 r、dtmuv f、dtmuv r;
17.dhav
‑
1+dhav
‑
3+dtmuv模板;ddh2o
18.一种基于1型、3型鸭甲型肝炎病毒和鸭坦布苏病毒引物的试剂盒的检测方法,包括以下步骤:
19.(1)用dhav
‑
1 f、dhav
‑
1 r、dhav
‑
3 f、dhav
‑
3 r、dtmuv f、dtmuv r引物对步骤(1)中反转录的cdna模板进行扩增,以dhav
‑
1+dhav
‑
3+dtmuv模板扩增作为阳性对照,以ddh2o模板作为阴性对照;
20.(2)pcr产物经过电泳后,通过特异性扩增条带来判断样品携带病毒情况。
21.反应体系为:50μl,其中10
×
pcr buffer 4μl,dntps 3.5μl(10mm),rtaq dna聚合酶0.8μl(200u/μl),反应引物dhav
‑
1 f、dhav
‑
1 r、dhav
‑
3 f、dhav
‑
3 r、dtmuv f、dtmuv r终浓度均为1μm/ml,模板;
22.优选的,dntps浓度为0.7mm;
23.优选的,rtaq dna聚合酶为0.8μl;
24.扩增反应条件为:94℃预变性4min;94℃变性40s,54
‑
56℃退火40s,72℃延伸60s,35个循环;72℃最终延伸10min,4℃保存。
25.优选的,退火温度为55℃。
26.综上所述,本发明针对目前缺乏对1型、3型鸭甲型肝炎病毒和鸭坦布苏病毒同时进行检测可靠技术,发明人研究设计了三对特异性引物,据此建立了1型、3型鸭甲型肝炎病毒和鸭坦布苏病毒三重rt
‑
pcr检测方法,可用于检测样品中1型、3型鸭甲型肝炎病毒和鸭坦布苏病毒的污染情况,并制备了相应的检测试剂盒。本发明具有操作简便、敏感性高、特异性强和重复性好、克服了多重pcr多对引物之间的相互干扰。
附图说明
27.图1:三重pcr引物浓度优化试验结果电泳图,m:marker i 600bp;1
‑
4:dhav
‑
1/dhav
‑
3/dtmuv引物0.25μl、0.5μl、0.75μl、1μl;nc:阴性对照;
28.图2:三重pcr rtaq dna聚合酶浓度优化试验结果电泳图,m:marker i 600bp;1
‑
5:rtaq 0.2μl,0.4μl,0.6μl,0.8μl,1.0μl;nc:阴性对照;
29.图3:三重pcr dntps浓度优化试验结果电泳图,m:marker i 600bp;1
‑
4:dntps 1.5μl,2.5μl,3.5μl,4.5μl;nc:阴性对照;
30.图4:三重pcr退火温度优化试验结果电泳图,m:marker i 600bp;1:51℃;2:52℃;3:53℃;4:54℃;5:55℃;6:56℃;7:57℃;7:58℃;nc:阴性对照;
31.图5:三重pcr特异性试验结果电泳图,m:marker i 600bp;1:3型鸭甲肝病毒cdna;2:1型鸭甲肝病毒cdna;3:鸭坦布苏病毒cdna;4:3型鸭甲肝病毒cdna+1型鸭甲肝病毒cdna+鸭坦布苏病毒cdna;5:新城疫病毒cdna;6:禽流感病毒cdna;7:呼肠孤病毒cdna;8:大肠杆菌dna;nc:阴性对照;
32.图6:三重pcr敏感性试验结果电泳图,m:marker i 600bp;1
‑
8:
33.dhav
‑
1/dhav
‑
3/dtmuv的cdna 10ng、1ng、100pg、10pg、1pg、100fg、10fg、1fg;nc:阴性对照;
34.图7:人工混合感染分离病料样品检测结果电泳图,m:dl2000 marker;1:dhav
‑
3+dtmuv;2:dhav
‑
1+dtmuv;3:dhav
‑
1+dhav
‑
3;4:dhav
‑
1+dhav
‑
3+dtmuv;nc:阴性对照;
具体实施方式
35.下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
36.实施例1
37.核酸的提取及rna的反转录
38.按照rna抽提试剂盒[购自北京天根生化有限公司]操作说明方法提取1型鸭甲肝病毒(dhav
‑
1,gx050028)、3型鸭甲肝病毒(dhav
‑
3,gxnn201201)、鸭坦布苏病毒(dtmuv,gxd0915)、鸭副粘病毒(ndv)、禽流感病毒(aiv)、禽呼肠孤病毒(arv)的rna并按照reverse transciptase m
‑
ml v(rnaseh
‑
)[购自宝生物工程(大连)有限公司]反转录说明书反转录得到上述病毒的cdna,应体积为25μl,反应体系为:5
×
buffer 5μl,dntp(10mm)2μl,随机引物(randon primer)1μl,反转录酶(m
‑
mlv,200u/μl)1μl,抑制剂(rnase inhibitor)0.5μl,rna抽提物15.5μl。将上述体系置于42℃水浴锅中水浴70min,获得cdna,
‑
20℃保存,待用。按照dna抽提试剂盒操作说明抽提大肠杆菌dna,待用。
[0039]
实施例2
[0040]
一、三重rt
‑
pcr扩增体系的建立
[0041]
1、反应体系的优化
[0042]
分别对反应体系中引物浓度、rtaq dna聚合酶浓度、dntps浓度设置浓度梯度(如表1),使用pcr仪程序梯度去优化,探索最佳配比。
[0043]
表1
[0044][0045]
最终确定三重rt
‑
pcr反应体系为50μl:10
×
pcr buffer 4μl、10mm dntps 3.5μl、rtaq dna聚合酶0.8μl(200u/μl)、dhav
‑
1上下游引物各1μl(引物浓度均为50μm/ml,在反应体系中的最终浓度均为1μm/ml)、dhav
‑
3上下游引物各1μl(引物浓度均为50μm/ml,在反应体系中的最终浓度均为1μm/ml)、dtmuv上下游引物各1μl(引物浓度均为50μm/ml,在反应体系中的最终浓度均为1μm/ml)、加ddh2o至50μl。引物、rtaq dna聚合酶、dntps优化结果分别如图1、图2、图3所示,最终确定本体系的最佳引物含量均为1μl、最佳rtaq dna聚合酶含量为0.8μl、最佳dntps(10mm)含量为3.5μl。
[0046]
2、反应条件的优化
[0047]
按照上述反应体系,对退火温度设置梯度(51℃、52℃、53℃、54℃、55℃、56℃、57℃、58℃),进行单因素试验,探索最佳退火温度,模板为1型鸭甲肝病毒的cdna、3型鸭甲肝病毒的cdna以及鸭坦布苏病毒的cdna等体积混合物,将退火温度按51.0℃~58.0℃依次递
增,3次重复。结果如图4所示,可见,最佳退火温度为55.0℃。确定最佳的反应条件:94℃4min;94℃40s,55℃退火40s,72℃1min,35个循环;72℃10min,4℃保存。
[0048]
3.检测试剂盒的制备
[0049]
根据优化实验结果制备检测试剂盒:
[0050]
a液:pcr反应液含10
×
pcr buffer 4μl、dntps 3.5μl(10mm)、rtaq dna聚合酶0.8μl(200u/μl)、dhav
‑
1上下游引物各1μl(引物浓度均为50μm/ml,在反应体系中的最终浓度均为1μm/ml)、dhav
‑
3上下游引物各1μl(引物浓度均为50μm/ml,在反应体系中的最终浓度均为1μm/ml)、dtmuv上下游引物各1μl(引物浓度均为50μm/ml,在反应体系中的最终浓度均为1μm/ml),加ddh2o 35.7μl;
[0051]
b液:dhav
‑
1+dhav
‑
3+dtmuv模板,作为阳性对照;
[0052]
c液:ddh2o,作为阴性对照。
[0053]
二、三重rt
‑
pcr特异性试验
[0054]
使用检测试剂盒,分别对不同模板进行三重pcr扩增[模板:3型鸭甲肝病毒cdna、1型鸭甲肝病毒cdna、鸭坦布苏病毒cdna、3型鸭甲肝病毒cdna+1型鸭甲肝病毒cdna+鸭坦布苏病毒cdna(等体积混合)、新城疫病毒cdna、禽流感病毒的cdna、呼肠孤病毒的cdna、大肠杆菌dna、阴性对照]。结果如图5所示,可见,1
‑
4有523bp,395bp,201bp的目的片段,其余均没有目的片段。说明,本发明的引物和方法有高特异性,可应用于鉴定未知样本是否感染3型鸭甲肝病毒、1型鸭甲肝病毒和鸭坦布苏病毒:若出现523bp条带,则样本中含有3型鸭甲肝病毒,反之则没有;若出现395bp条带,则样本中含有鸭坦布苏病毒,反之则没有;若出现201bp条带,则样本中含有1型鸭甲肝病毒,反之则没有。对于混合感染,同样可以根据目的条带来进行判断。
[0055]
三、三重rt
‑
pcr的敏感性试验
[0056]
用du800紫外分光光度计测出1型鸭甲肝病毒、3型鸭甲肝病毒和鸭坦布苏病毒核酸的浓度,再将它们分别进行10倍梯度稀释,得到10ng、1ng、100pg、10pg、1pg、100fg、10fg、1fg的dhav
‑
1/dhav
‑
3/dtmuv cdna,使用检测试剂盒对样品进行三重扩增。结果如图6所示,可见,1
‑
5均有目的片段扩出,试剂盒对dhav
‑
3核酸的检测极限为10pg,对dtmuv核酸的检测极限为10pg,对dhav
‑
1核酸的检测极限为100pg。
[0057]
实施例4
[0058]
三重rt
‑
pcr检测病毒感染样本
[0059]
人工病毒感染样品4份,分别为:3型鸭甲肝病毒+鸭坦布苏病毒、1型鸭甲肝病毒+鸭坦布苏病毒、3型鸭甲肝病毒+1型鸭甲肝病毒、1型鸭甲肝病毒+3型鸭甲肝病毒+鸭坦布苏病毒。分别处理病料得病毒样品,提取各自病毒的总rna并反转录成为cdna模板,使用试剂盒进行扩增操作,扩增结果如图7所示,均可检测到预期扩增条带。
[0060]
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。
[0061]
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对上述实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一
致的最宽的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1