双特异性抗原结合分子及其医药用途的制作方法
1.本披露属于生物技术领域,更具体地,本披露涉及双特异性抗原结合分子及其应用。
背景技术:
2.这里的陈述仅是提供与本披露有关的背景信息,而不必然地构成现有技术。
3.肿瘤免疫治疗是充分利用、调动肿瘤患者体内的杀伤性t细胞,对肿瘤进行杀伤作用的治疗方法。与此同时,肿瘤细胞逃逸是肿瘤免疫治疗面临的一个巨大障碍,肿瘤细胞利用其自身对免疫系统的抑制作用促进了肿瘤的快速生长。肿瘤的免疫逃逸机制与机体对肿瘤的免疫应答之间存在着极为复杂的关系。在肿瘤免疫治疗早期肿瘤特异性的杀伤性t细胞是有其生物活性的,但随着肿瘤生长在后期失去了杀伤的功能。
4.人体内t细胞的活化采取了两条信号通路系统,除了需要通过抗原呈递细胞递呈mhc-抗原肽给t细胞提供第一信号外,还需要一系列协同刺激分子提供第二信号,进而才能使t细胞产生正常的免疫应答。这个双信号通路系统对体内免疫系统的平衡起着至关重要的作用,它严格调控机体对自身和非自身抗原产生不同的免疫应答。如果缺少协同刺激分子提供的第二信号,将会导致t细胞的无应答或持续特异性免疫应答,从而产生耐受。因此,第二信号通路在机体免疫应答的整个过程中起着非常关键的调节作用。
5.程序性死亡分子1(programmed death-l,pd-l)是1992年发现的表达在t细胞表面的一个蛋白受体,参与细胞的凋亡过程。pd-l属于cd28家族,与细胞毒性t淋巴细胞抗原4(cytotoxic t iymphocyte antigen 4,ctla-4)具有23%的氨基酸同源性,但其表达却与ctla不同,主要表达在活化的t细胞、b细胞和髓系细胞上。pd-1有两个配体,分别为pd-l1和pd-l2。pd-l1主要表达于t细胞、b细胞、巨噬细胞和树突状细胞(dendritic cell,dc)上,在活化后细胞上的表达能够进行上调。而pd-l2的表达相对较局限,主要表达在抗原呈递细胞上,如活化的巨噬细胞和树突状细胞。
6.vegf家族是一类能促进内皮细胞分裂增殖、促进新生血管的形成、提高血管通透性的生长因子。在肿瘤组织中,肿瘤细胞、肿瘤侵入的巨噬细胞和肥大细胞能分泌高水平的vegf,以旁分泌的形式刺激肿瘤血管内皮细胞。vegf家族能促进血管内皮细胞有丝分裂,刺激内皮细胞增殖、迁移,诱导血管形成,促进肿瘤持续生长。并提高血管尤其是微小血管的通透性,引起血浆蛋白(包括纤维蛋白原)释放,引起周围组织纤维蛋白沉着,为肿瘤生长、发展和转移提供了良好的基质。vegf家族还可以抑制机体的免疫反应,促进恶性肿瘤的浸润与转移。因而抑制肿瘤血管生成被认为是当前的肿瘤治疗方法之一。
技术实现要素:
7.本披露提供了一种双特异性抗原结合分子及其医药用途。
8.在一些可选的实施方案中,本披露提供一种双特异性抗原结合分子,其包含至少一个能够特异性结合pd-1的第一抗原结合域,和至少一个能够特异性结合vegf的第二抗原
结合域;
9.其中所述能够特异性结合pd-1的第一抗原结合域包含重链可变区pd-1-vh和轻链可变区pd-1-vl,其中:
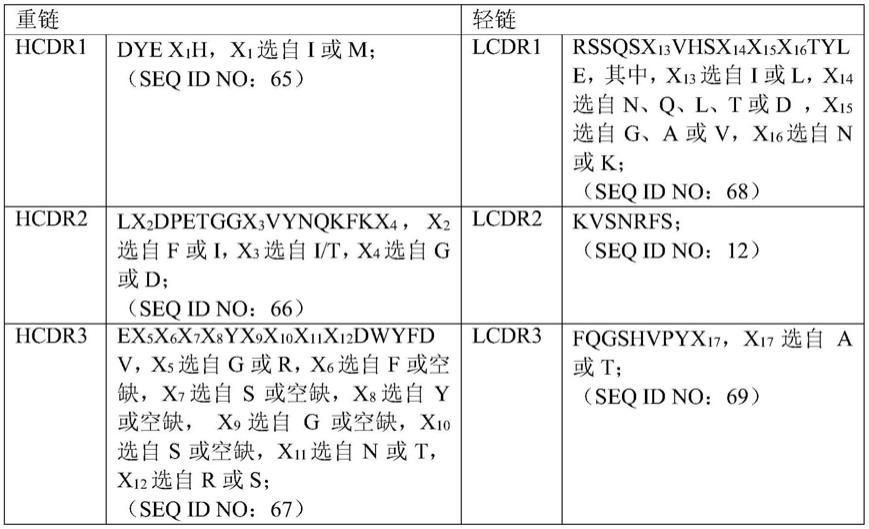
10.所述重链可变区pd-1-vh具有:包含seq id no:65的氨基酸序列的pd-1-hcdr1,包含seq id no:66的氨基酸序列的pd-1-hcdr2,和包含seq id no:67的氨基酸序列的pd-1-hcdr3;且
11.所述轻链可变区pd-1-vl具有:包含seq id no:68的氨基酸序列的pd-1-lcdr1,包含seq id no:12的氨基酸序列的pd-1-lcdr2,和包含seq id no:69的氨基酸序列的pd-1-lcdr3。序列见下表1:
12.表.1
[0013][0014]
在一些实施方式中,前述双特异性抗原结合分子以等于或小于10-7
m解离平衡常数与人pd-1结合,在一些实施方式中,以等于或小于10-8
m、10-9
m、10-10
m或10-11
m解离平衡常数与人pd-1结合。
[0015]
在一些实施方式中,前述双特异性抗原结合分子以等于或小于10-7
m解离平衡常数与人vegf结合,在一些实施方式中,以等于或小于10-8
m、10-9
m、10-10
m或10-11
m解离平衡常数与人vegf结合。在一些实施方式中,前述双特异性抗原结合分子以等于或小于10-8
m、10-9
m、10-10
m或10-11
m解离平衡常数与鼠vegf结合。
[0016]
在一些实施方式中,前述双特异性抗原结合分子,所述重链可变区pd-1-vh具有:包含seq id no:8的氨基酸序列的pd-1-hcdr1,包含seq id no:9的氨基酸序列的pd-1-hcdr2,和包含seq id no:10的氨基酸序列的pd-1-hcdr3;且所述轻链可变区pd-1-vl具有:包含seq id no:68的氨基酸序列的pd-1-lcdr1,包含seq id no:12的氨基酸序列的pd-1-lcdr2,包含seq id no:13的氨基酸序列的pd-1-lcdr3。
[0017]
在一些可选的实施方案中,前述双特异性抗原结合分子,是选自如下(a1)至(e1)任一项所述的双特异性抗原结合分子:
[0018]
(a1)一种双特异性抗原结合分子,所述重链可变区pd-1-vh具有:包含seq id no:8的氨基酸序列的pd-1-hcdr1,包含seq id no:9的氨基酸序列的pd-1-hcdr2,和包含seq id no:10的氨基酸序列的pd-1-hcdr3;且所述轻链可变区pd-1-vl具有:包含seq id no:11、47、48、49、50、51或52的氨基酸序列的pd-1-lcdr1,包含seq id no:12的氨基酸序列的pd-1-lcdr2,包含seq id no:13的氨基酸序列的pd-1-lcdr3;
[0019]
(b1)一种双特异性抗原结合分子,所述重链可变区pd-1-vh具有:包含seq id no:14的氨基酸序列的pd-1-hcdr1,包含seq id no:15的氨基酸序列的pd-1-hcdr2,和包含seq id no:16的氨基酸序列的pd-1-hcdr3;且所述轻链可变区pd-1-vl具有:包含seq id no:17的氨基酸序列的pd-1-lcdr1,包含seq id no:12的氨基酸序列的pd-1-lcdr2,包含seq id no:18的氨基酸序列的pd-1-lcdr3;
[0020]
(c1)一种双特异性抗原结合分子,所述重链可变区pd-1-vh具有:包含seq id no:21的氨基酸序列的pd-1-hcdr1,包含seq id no:22的氨基酸序列的pd-1-hcdr2,和包含seq id no:23的氨基酸序列的pd-1-hcdr3;且所述轻链可变区pd-1-vl具有:包含seq id no:24的氨基酸序列的pd-1-lcdr1,包含seq id no:25的氨基酸序列的pd-1-lcdr2,包含seq id no:26的氨基酸序列的pd-1-lcdr3;
[0021]
(d1)一种双特异性抗原结合分子,所述重链可变区pd-1-vh具有:包含seq id no:14的氨基酸序列的pd-1-hcdr1,包含seq id no:15的氨基酸序列的pd-1-hcdr2,和包含seq id no:16的氨基酸序列的pd-1-hcdr3;且所述轻链可变区pd-1-vl具有:包含seq id no:11、47、48、49、50、51或52的氨基酸序列的pd-1-lcdr1,包含seq id no:12的氨基酸序列的pd-1-lcdr2,包含seq id no:13的氨基酸序列的pd-1-lcdr3;和
[0022]
(e1)一种双特异性抗原结合分子,所述重链可变区pd-1-vh具有:包含seq id no:8的氨基酸序列的pd-1-hcdr1,包含seq id no:9的氨基酸序列的pd-1-hcdr2,和包含seq id no:10的氨基酸序列的pd-1-hcdr3;且所述轻链可变区pd-1-vl具有:包含seq id no:17的氨基酸序列的pd-1-lcdr1,包含seq id no:12的氨基酸序列的pd-1-lcdr2,包含seq id no:13的氨基酸序列的pd-1-lcdr3。
[0023]
在一些实施方式中,前述双特异性抗原结合分子,所述重链可变区pd-1-vh具有:包含seq id no:8的氨基酸序列的pd-1-hcdr1,包含seq id no:9的氨基酸序列的pd-1-hcdr2,和包含seq id no:10的氨基酸序列的pd-1-hcdr3;且所述轻链可变区pd-1-vl具有:包含seq id no:49的氨基酸序列的pd-1-lcdr1,包含seq id no:12的氨基酸序列的pd-1-lcdr2,包含seq id no:13的氨基酸序列的pd-1-lcdr3。
[0024]
在一些实施方式中,前述双特异性抗原结合分子,所述重链可变区pd-1-vh具有:包含seq id no:21的氨基酸序列的pd-1-hcdr1,包含seq id no:22的氨基酸序列的pd-1-hcdr2,和包含seq id no:23的氨基酸序列的pd-1-hcdr3;且所述轻链可变区pd-1-vl具有:包含seq id no:24的氨基酸序列的pd-1-lcdr1,包含seq id no:25的氨基酸序列的pd-1-lcdr2,包含seq id no:26的氨基酸序列的pd-1-lcdr3。
[0025]
在一些可选的实施方案中,本披露提供一种双特异性抗原结合分子,其为选自如下f1)至h1)任一项所述的双特异性抗原结合分子:
[0026]
f1)一种双特异性抗原结合分子,其重链可变区pd-1-vh与seq id no:4的氨基酸序列的重链可变区具有相同序列的pd-1-hcdr1、pd-1-hcdr2和pd-1-hcdr3,且轻链可变区
pd-1-vl与seq id no:5的氨基酸序列的轻链可变区具有相同序列的pd-1-lcdr1、pd-1-lcdr2和pd-1-lcdr3;
[0027]
g1)一种双特异性抗原结合分子,其重链可变区pd-1-vh与seq id no:6的氨基酸序列的重链可变区具有相同序列的pd-1-hcdr1、pd-1-hcdr2和pd-1-hcdr3,且轻链可变区pd-1-vl与seq id no:7的氨基酸序列的轻链可变区具有相同序列的pd-1-lcdr1、pd-1-lcdr2和pd-1-lcdr3;和
[0028]
h1)一种双特异性抗原结合分子,其重链可变区pd-1-vh与seq id no:19的氨基酸序列的重链可变区具有相同序列的pd-1-hcdr1、pd-1-hcdr2和pd-1-hcdr3,且轻链可变区pd-1-vl与seq id no:20的氨基酸序列的轻链可变区具有相同序列的pd-1-lcdr1、pd-1-lcdr2和pd-1-lcdr3。
[0029]
在一些实施方案中,所述双特异性抗原结合分子的重链可变区pd-1-vh或轻链可变区pd-1-vl包含来源自人抗体的框架区或其框架区变体。
[0030]
在一些实施方案中,所述框架区变体为在人抗体的轻链框架区和/或重链框架区基础上分别具有至多11个氨基酸的回复突变。
[0031]
在一些实施方案中,所述框架区变体包含选自以下(j1)至(l1)任一所述的突变:
[0032]
(j1)轻链可变区pd-1-vl中包含2g氨基酸回复突变,和/或重链可变区pd-1-vh中包含选自27y、48i、67t、69l、82f和93t中的一个或更多个氨基酸回复突变;
[0033]
(k1)轻链可变区pd-1-vl中包含2v氨基酸回复突变,和/或重链可变区pd-1-vh中包含选自26d、27f、30t、38k、43h、48i、66k、67a、69l、82f和93t中的一个或更多个氨基酸回复突变;和
[0034]
(l1)轻链可变区pd-1-vl中包含选自42g、44v和71y中的一个或更多个氨基酸回复突变,和/或重链可变区pd-1-vh中包含1k和/或94s氨基酸回复突变。
[0035]
在一些实施方案中,前述的双特异性抗原结合分子,其包含选自如下所述的抗体可变区:
[0036]
(a2)重链可变区pd-1-vh分别包含seq id no:8、seq id no:9和seq id no:10的氨基酸序列的pd-1-hcdr1、pd-1-hcdr2和pd-1-hcdr3,且重链框架区包含27y、48i、67t、69l、82f和93t中的一个或更多个氨基酸回复突变,和
[0037]
轻链可变区pd-1-vl分别包含seq id no:12和seq id no:13的氨基酸序列的pd-1-lcdr2和pd-1-lcdr3,和seq id no:11、47、48、49、50、51或52的氨基酸序列的pd-1-lcdr1,且轻链框架区包含2g氨基酸回复突变;
[0038]
(b2)重链可变区pd-1-vh分别包含seq id no:14、seq id no:15和seq id no:16的氨基酸序列的pd-1-hcdr1、pd-1-hcdr2和pd-1-hcdr3,且重链框架区包含选自26d、27f、30t、38k、43h、48i、66k、67a、69l、82f和93t中的一个或更多个氨基酸回复突变;和
[0039]
轻链可变区pd-1-vl分别包含seq id no:17、seq id no:12和seq id no:18的氨基酸序列的pd-1-lcdr1、pd-1-lcdr2和pd-1-lcdr3,且轻链框架区包含2v氨基酸回复突变;
[0040]
(c2)重链可变区pd-1-vh分别包含seq id no:21、seq id no:22和seq id no:23的氨基酸序列pd-1-hcdr1、pd-1-hcdr2和pd-1-hcdr3,且重链框架区包含1k和/或94s氨基酸回复突变,和
[0041]
轻链可变区pd-1-vl分别包含seq id no:24、seq id no:25和seq id no:26的氨
基酸序列的pd-1-lcdr1、pd-1-lcdr2和pd-1-lcdr3,且轻链框架区包含选自42g、44v和71y中的一个或更多个氨基酸回复突变。
[0042]
在一些实施方案中,前述的双特异性抗原结合分子,其包含选自如下(m1)至(o1)任一所述的抗体可变区;
[0043]
(m1)重链可变区pd-1-vh,其具有seq id no:4的氨基酸序列或与seq id no:4具有至少90%序列同一性,和/或
[0044]
轻链可变区pd-1-vl,其具有seq id no:5的氨基酸序列或与seq id no:5具有至少90%序列同一性;
[0045]
(n1)重链可变区pd-1-vh,其具有seq id no:6的氨基酸序列或与seq id no:6具有至少90%序列同一性,和/或
[0046]
轻链可变区pd-1-vl,其具有seq id no:7的氨基酸序列或与seq id no:7具有至少90%序列同一性;
[0047]
(o1)重链可变区pd-1-vh,其具有seq id no:19的氨基酸序列或与seq id no:19具有至少90%序列同一性,和/或
[0048]
轻链可变区pd-1-vl,其具有seq id no:20的氨基酸序列或与seq id no:20具有至少90%序列同一性;
[0049]
(p1)重链可变区pd-1-vh,其具有seq id no:27、30、31或32的氨基酸序列或分别与seq id no:27、30、31或32具有至少90%序列同一性,和/或
[0050]
轻链可变区pd-1-vl,其具有seq id no:28、29、53、54、55、56、57、58、59、60、61、62、63或64的氨基酸序列或分别与seq id no:28、29、53、54、55、56、57、58、59、60、61、62、63或64具有至少90%序列同一性;
[0051]
(q1)重链可变区pd-1-vh,其具有seq id no:33、36、37、38、39或40的氨基酸序列或分别与seq id no:33、36、37、38、39或40具有至少90%序列同一性,和/或
[0052]
轻链可变区pd-1-vl,其具有seq id no:34、35、28、29、53、54、55、56、57、58、59、60、61、62、63或64的氨基酸序列或分别与seq id no:34、35、28、29、53、54、55、56、57、58、59、60、61、62、63或64具有至少90%序列同一性;
[0053]
(r1)重链可变区pd-1-vh,其具有seq id no:41、45或46的氨基酸序列或分别与seq id no:41、45或46具有至少90%序列同一性,和/或
[0054]
轻链可变区pd-1-vl,其具有seq id no:42、43或44的氨基酸序列或分别与seq id no:42、43或44具有至少90%序列同一性;
[0055]
(s1)重链可变区pd-1-vh,其具有seq id no:70的氨基酸序列或与seq id no:70具有至少90%序列同一性,和/或
[0056]
轻链可变区pd-1-vl,其具有seq id no:71的氨基酸序列或与seq id no:71具有至少90%序列同一性;
[0057]
(t1)重链可变区pd-1-vh,其具有seq id no:27、30、31或32的氨基酸序列或分别与seq id no:27、30、31或32具有至少90%序列同一性,和/或
[0058]
轻链可变区pd-1-vl,其具有seq id no:34或35的氨基酸序列或分别与seq id no:34或35具有至少90%序列同一性;
[0059]
其中,序列seq id no:70和seq id no:71为通式序列见表2:
[0060]
表.2
[0061][0062]
在一些实施方案中,前述的双特异性抗原结合分子,其中所述重链可变区pd-1-vh包含seq id no:27的氨基酸序列或包含与seq id no:27具有至少95%,96%,97%,98%或99%的序列同一性的氨基酸序列,和所述轻链可变区pd-1-vl包含seq id no:55的氨基酸序列或包含与seq id no:55具有至少95%,96%,97%,98%或99%的序列同一性的氨基酸序列;
[0063]
在一些实施方案中,前述的双特异性抗原结合分子,其中所述重链可变区pd-1-vh包含seq id no:27的氨基酸序列,和所述轻链可变区pd-1-vl包含seq id no:55的氨基酸序列。
[0064]
在一些实施方案中,前述的双特异性抗原结合分子,其中所述重链可变区pd-1-vh包含seq id no:46的氨基酸序列或包含与seq id no:46具有至少95%,96%,97%,98%或99%的序列同一性的氨基酸序列,和所述轻链可变区pd-1-vl包含seq id no:43的氨基酸序列或包含与seq id no:43具有至少95%,96%,97%,98%或99%的序列同一性的氨基酸序列;
[0065]
在一些实施方案中,前述的双特异性抗原结合分子,其中所述重链可变区pd-1-vh具有seq id no:46的氨基酸序列,和所述轻链可变区pd-1-vl具有seq id no:43的氨基酸序列。
[0066]
在一些实施方案中,前述的双特异性抗原结合分子,其中所述双特异性抗原结合分子还包含重链恒定区和轻链恒定区。在另外一些实施方案中,所述重链恒定区选自人igg1、igg2、igg3和igg4恒定区及其常规变体,所述轻链恒定区选自人抗体κ和λ链恒定区及其常规变体;在另外一些实施方案中,所述重链恒定区包含引入s228p、f234a和l235a中的一个或更多个突变的igg4重链恒定区,例如含s228p、f234a和l235a三个氨基酸突变;在另外一些实施方案中,所述重链恒定区包含seq id no:72的氨基酸序列,和所述轻链恒定区包含seq id no:73的氨基酸序列。
[0067]
在一些实施方案中,前述的双特异性抗原结合分子,其中所述能够特异性结合vegf的第二抗原结合域包含重链可变区vegf-vh和轻链可变区vegf-vl,其中:
[0068]
所述重链可变区vegf-vh具有:包含seq id no:87的氨基酸序列的vegf-hcdr1,包含seq id no:88的氨基酸序列的vegf-hcdr2,和seq id no:89的氨基酸序列的vegf-hcdr3;且
[0069]
所述轻链可变区vegf-vl具有:包含seq id no:90的氨基酸序列的vegf-lcdr1,包含seq id no:91的氨基酸序列的vegf-lcdr2,和包含seq id no:92的氨基酸序列的vegf-lcdr3。
[0070]
hygmn(seq id no:87),
[0071]
wintytgeptyaadfkr(seq id no:88),
[0072]
ypyyygtshwyfdv(seq id no:89),
[0073]
sasqdisnyln(seq id no:90),
[0074]
ftsslhs(seq id no:91),
[0075]
qqystvpwt(seq id no:92)
[0076]
在一些实施方案中,前述的双特异性抗原结合分子,其中所述重链可变区vegf-vh包含seq id no:85的氨基酸序列或包含与seq id no:85具有至少95%,96%,97%,98%或99%的序列同一性的氨基酸序列,和所述轻链可变区vegf-vl包含如seq id no:86所示的氨基酸序列或包含与seq id no:86具有至少95%,96%,97%,98%或99%的序列同一性的氨基酸序列。
[0077]
在一些实施方案中,前述的双特异性抗原结合分子,其中所述重链可变区vegf-vh具有seq id no:85的氨基酸序列,和所述轻链可变区vegf-vl具有如seq id no:86所示的氨基酸序列。
[0078]
evqlvesggglvqpggslrlscaasgydfthygmnwvrqapgkglewvgwintytgeptyaadfkrrftfsldtskstaylqmnslraedtavyycakypyyygtshwyfdvwgqgtlvtvss(seq id no:85)
[0079]
diqltqspsslsasvgdrvtitcsasqdisnylnwyqqkpgkapkvliyftsslhsgvpsrfsgsgsgtdftltisslqpedfatyycqqystvpwtfgqgtkveik(seq id no:86)
[0080]
在一些实施方案中,前述的双特异性抗原结合分子,其中所述重链可变区pd-1-vh直接或通过连接子连接至重链可变区vegf-vh,并且轻链可变区pd-1-vl直接或通过连接子连接至轻链可变区vegf-vl。在一些实施方案中,所述重链可变区pd-1-vh的c端直接或通过连接子连接至重链可变区vegf-vh的n端,并且轻链可变区pd-1-vl的c端直接或通过连接子连接至轻链可变区vegf-vl的n端。
[0081]
在一些实施方案中,前述的双特异性抗原结合分子,其中所述重链可变区vegf-vh与所述轻链可变区vegf-vl直接或通过连接子连接形成vegf-scfv抗原结合域;并且所述重链可变区pd-1-vh与所述vegf-scfv抗原结合域分别直接或通过连接子连接至所述重链恒定区。在一些实施方案中,所述重链可变区vegf-vh的c端与所述轻链可变区vegf-vl的n端直接或通过连接子连接形成vegf-scfv抗原结合域;并且所述重链可变区pd-1-vh的c端直接或通过连接子连接至所述重链恒定区的n端,且所述vegf-scfv抗原结合域的n端直接或通过连接子连接至所述重链恒定区的c端。
[0082]
在一些实施方案中,前述的双特异性抗原结合分子,其中所述的双特异性抗原结合分子具有下式所示的结构或其组合:
[0083]
[重链可变区pd-1-vh]-[连接子]-[重链可变区vegf-vh]-[重链恒定区];或
[0084]
[轻链可变区pd-1-vl]-[连接子]-[轻链可变区vegf-vl]-[轻链恒定区];或
[0085]
[重链可变区vegf-vh]-[连接子]-[重链可变区pd-1-vh]-[重链恒定区];或
[0086]
[轻链可变区vegf-vl]-[连接子]-[轻链可变区pd-1-vl]-[轻链恒定区]。
id no:142组成的组的氨基酸序列。
[0106]
sdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhek(seq id no:94)
[0107]
sdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtnciidvvlspshgielsvgeklvlnctartclnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhek(seq id no:95)
[0108]
sdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaacsglmckknstfvrvhek(seq id no:96)
[0109]
sdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdcktqsgsemkcflstltidgvtrsdqglytcaassglmtkknstfvrvhek(seq id no:97)
[0110]
sdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtnttidvvlspshgielsageklvlnctartelnagidfnweypsskhqhkklvnrdlktqsqstmnkylstltidgvtrsdqglytcaassglmtkknstfvrvhek(seq id no:98)
[0111]
sdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqstsdmakrlstltidgvtrsdqglytcaassglmtkknstfvrvhek(seq id no:99)
[0112]
sdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqspssmekalstltidgvtrsdqglytcaassglmtkknstfvrvhek(seq id no:100)
[0113]
sdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtnt(seq id no:141)
[0114]
sdtgrpfvemcseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlykcnylthrqtnt(seq id no:142)
[0115]
在一些实施方案中,前述的双特异性抗原结合分子,其中所述能够特异性结合vegf的第二抗原结合域直接或通过连接子连接至所述重链恒定区。在一些实施方案中,所述能够特异性结合vegf的第二抗原结合域的n端直接或通过连接子连接至所述重链恒定区的c端。
[0116]
在一些实施方案中,前述的双特异性抗原结合分子,其中所述能够特异性结合vegf的第二抗原结合域直接或通过连接子连接至所述重链可变区pd-1-vh。在一些实施方案中,所述能够特异性结合vegf的第二抗原结合域的c端直接或通过连接子连接至所述重链可变区pd-1-vh的n端。
[0117]
在一些实施方案中,前述的双特异性抗原结合分子,其中所述的双特异性抗原结合分子具有下式所示的结构:
[0118]
[重链可变区pd-1-vh]-[重链恒定区]-[连接子]-[能够特异性结合vegf的第二抗原结合域];或
[0119]
[能够特异性结合vegf的第二抗原结合域]-[连接子]-[重链可变区pd-1-vh]-[重
链恒定区];或
[0120]
[轻链可变区pd-1-vl]-[轻链恒定区];
[0121]
在一些实施方案中,前述的双特异性抗原结合分子,所述的结构从n端到c端排列的。
[0122]
在一些实施方案中,前述的双特异性抗原结合分子,其中所述的双特异性抗原结合分子具有式(v)所示结构的第一链和式(iv)所示结构的第二链,
[0123]
(v)[重链可变区pd-1-vh]-[重链恒定区]-[连接子]-[能够特异性结合vegf的第二抗原结合域];
[0124]
(iv)[轻链可变区pd-1-vl]-[轻链恒定区];
[0125]
其中所述式(v)和式(iv)是从n端到c端排列的。
[0126]
在一些实施方案中,前述的双特异性抗原结合分子,其中所述的双特异性抗原结合分子具有式(vi)所示结构的第一链和式(iv)所示结构的第二链,
[0127]
(vi)[能够特异性结合vegf的第二抗原结合域]-[连接子]-[重链可变区pd-1-vh]-[重链恒定区];
[0128]
(iv)[轻链可变区pd-1-vl]-[轻链恒定区];
[0129]
其中所述式(vi)和式(iv)是从n端到c端排列的。
[0130]
在一些实施方案中,前述的双特异性抗原结合分子,其中所述重链可变区pd-1-vh包含seq id no:27的氨基酸序列,和所述轻链可变区pd-1-vl包含seq id no:55的氨基酸序列;和所述能够特异性结合vegf的第二抗原结合域包含重链可变区vegf-vh和轻链可变区vegf-vl;其中所述重链可变区vegf-vh包含seq id no:85的氨基酸序列,和所述轻链可变区vegf-vl包含seq id no:86的氨基酸序列。在一些实施方案中,所述双特异性抗原结合分子还包含重链恒定区和轻链恒定区;其中所述重链恒定区包含seq id no:72的氨基酸序列,和所述轻链恒定区包含seq id no:73的氨基酸序列。在一些实施方案中,所述双特异性抗原结合分子具有式(i)所示结构的第一链和式(ii)所示结构的第二链,
[0131]
(i)[重链可变区pd-1-vh]-[连接子]-[重链可变区vegf-vh]-[重链恒定区];
[0132]
(ii)[轻链可变区pd-1-vl]-[连接子]-[轻链可变区vegf-vl]-[轻链恒定区];
[0133]
其中所述式(i)和式(ii)是从n端到c端排列的。在一些实施方案中,前述的双特异性抗原结合分子,其中所述重链可变区pd-1-vh包含seq id no:27的氨基酸序列,和所述轻链可变区pd-1-vl包含seq id no:55的氨基酸序列;和所述能够特异性结合vegf的第二抗原结合域包含seq id no:96、seq id no:141或seq id no:142的氨基酸序列。在一些实施方案中,所述双特异性抗原结合分子还包含重链恒定区和轻链恒定区;其中所述重链恒定区包含seq id no:72的氨基酸序列,和所述轻链恒定区包含seq id no:73的氨基酸序列。在一些实施方案中,所述的双特异性抗原结合分子具有式(v)所示结构的第一链和式(iv)所示结构的第二链,
[0134]
(v)[pd-1-vh]-[重链恒定区]-[连接子]-[能够特异性结合vegf的第二抗原结合域];
[0135]
(iv)[pd-1-vl]-[轻链恒定区];
[0136]
其中所述式(v)和式(iv)是从n端到c端排列的。
[0137]
在一些实施方案中,所述的双特异性抗原结合分子具有式(vi)所示结构的第一链
和式(iv)所示结构的第二链,
[0138]
(vi)[能够特异性结合vegf的第二抗原结合域]-[连接子]-[重链可变区pd-1-vh]-[重链恒定区];
[0139]
(iv)[轻链可变区pd-1-vl]-[轻链恒定区];
[0140]
其中所述式(vi)和式(iv)是从n端到c端排列的。
[0141]
在一些可选的实施方案中,本披露提供一种双特异性抗原结合分子,其包含至少一个能够特异性结合pd-1的第一抗原结合域,和至少一个能够特异性结合vegf的第二抗原结合域;
[0142]
其中所述能够特异性结合vegf的第二抗原结合域具有选自由seq id no:95至seq id no:100、seq id no:141和seq id no:142组成的组的氨基酸序列。
[0143]
在一些实施方案中,前述的双特异性抗原结合分子,其中所述能够特异性结合pd-1的第一抗原结合域包含重链可变区pd-1-vh和轻链可变区pd-1-vl,其中:
[0144]
所述重链可变区pd-1-vh具有:包含seq id no:8的氨基酸序列的pd-1-hcdr1,包含seq id no:9的氨基酸序列的pd-1-hcdr2,和包含seq id no:10的氨基酸序列的pd-1-hcdr3;且
[0145]
所述轻链可变区pd-1-vl具有:包含seq id no:49的氨基酸序列的pd-1-lcdr1,包含seq id no:12的氨基酸序列的pd-1-lcdr2,包含seq id no:13的氨基酸序列的pd-1-lcdr3;
[0146]
在一些实施方案中,前述的双特异性抗原结合分子,所述重链可变区pd-1-vh具有seq id no:27的氨基酸序列,和所述轻链可变区pd-1-vl具有seq id no:55的氨基酸序列。
[0147]
在一些实施方案中,前述的双特异性抗原结合分子,所述重链可变区pd-1-vh具有seq id no:46的氨基酸序列,和所述轻链可变区pd-1-vl具有seq id no:43的氨基酸序列。
[0148]
在一些实施方案中,前述的双特异性抗原结合分子,其中所述双特异性抗原结合分子还包含重链恒定区和轻链恒定区;在一些实施方案中,所述重链恒定区包含seq id no:72的氨基酸序列,和所述轻链恒定区包含seq id no:73的氨基酸序列。
[0149]
在一些实施方案中,前述的双特异性抗原结合分子,其中所述的双特异性抗原结合分子具有式(v)所示结构的第一链和式(iv)所示结构的第二链,
[0150]
(v)[pd-1-vh]-[重链恒定区]-[连接子]-[能够特异性结合vegf的第二抗原结合域];
[0151]
(iv)[pd-1-vl]-[轻链恒定区];
[0152]
其中所述式(v)和式(iv)是从n端到c端排列的。
[0153]
在一些实施方案中,所述的双特异性抗原结合分子具有式(vi)所示结构的第一链和式(iv)所示结构的第二链,
[0154]
(vi)[能够特异性结合vegf的第二抗原结合域]-[连接子]-[重链可变区pd-1-vh]-[重链恒定区];
[0155]
(iv)[轻链可变区pd-1-vl]-[轻链恒定区];
[0156]
其中所述式(vi)和式(iv)是从n端到c端排列的。
[0157]
在一些实施方案中,前述的双特异性抗原结合分子,其中所述连接子是肽连接子。在一些实施方案中,所述连接子是柔性肽连接子。在一些实施方案中,所述连接子各自独立
的具有l
1-(ggggs)
n-l2的结构,其中,l1是键、a、gs、ggs或gggs,n是1、2、3、4、5、6、7、8、9或10,l2是键、g、gg、ggg或gggg。在一些实施方案中,所述连接子具有1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30的氨基酸残基。在一些实施方案中,所述连接子具有8至24或10至19的氨基酸残基。
[0158]
在一些实施方案中,前述的双特异性抗原结合分子,其中所述连接子各自独立的具有选自由seq id no:127至seq id no:134组成的组的氨基酸序列。序列如下:
[0159]
gsggggsg(seq id no:127),
[0160]
ggggsggggs(seq id no:128),
[0161]
ggggsggggsggggsgggg(seq id no:129),
[0162]
ggggsggggsgggg(seq id no:130),
[0163]
aggggsggggsggggsggggsg(seq id no:131),
[0164]
ggggsggggsggggsggggsgggg(seq id no:132),
[0165]
ggsggggsggggs(seq id no:133),或
[0166]
ggggsggggsggggsggggs(seq id no:134)。
[0167]
在一些实施方案中,前述的双特异性抗原结合分子,其中的连接子可以是相同或不同的。
[0168]
在一些实施方案中,前述的双特异性抗原结合分子,其中所述的双特异性抗原结合分子具有:
[0169]
(a)包含选自由seq id no:105、seq id no:107、seq id no:109、seq id no:111、seq id no:112和seq id no:114组成的组的氨基酸序列的第一链和包含选自由seq id no:106、seq id no:108、seq id no:110和seq id no:113组成的组的氨基酸序列的第二链;或
[0170]
(b)包含选自由seq id no:115至seq id no:126、seq id no:138和seq id no:140组成的组的氨基酸序列的第一链和包含seq id no:75的氨基酸序列的第二链。
[0171]
在一些实施方案中,前述的双特异性抗原结合分子,其中所述的双特异性抗原结合分子具有:
[0172]
包含seq id no:105的氨基酸序列的第一链,和包含seq id no:106的氨基酸序列的第二链;或
[0173]
包含seq id no:107的氨基酸序列的第一链,和包含seq id no:108的氨基酸序列的第二链;或
[0174]
包含seq id no:109的氨基酸序列的第一链,和包含seq id no:110的氨基酸序列的第二链;或
[0175]
包含seq id no:111的氨基酸序列的第一链,和包含seq id no:110的氨基酸序列的第二链;或
[0176]
包含seq id no:112的氨基酸序列的第一链,和包含seq id no:110的氨基酸序列的第二链;或
[0177]
包含seq id no:109的氨基酸序列的第一链,和包含seq id no:113的氨基酸序列的第二链;或
[0178]
包含seq id no:114的氨基酸序列的第一链,和包含seq id no:113的氨基酸序列
的第二链;或
[0179]
包含seq id no:115的氨基酸序列的第一链,和包含seq id no:75的氨基酸序列的第二链;或
[0180]
包含seq id no:116的氨基酸序列的第一链,和包含seq id no:75的氨基酸序列的第二链;或
[0181]
包含seq id no:117的氨基酸序列的第一链,和包含seq id no:75的氨基酸序列的第二链;或
[0182]
包含seq id no:118的氨基酸序列的第一链,和包含seq id no:75的氨基酸序列的第二链;或
[0183]
包含seq id no:119的氨基酸序列的第一链,和包含seq id no:75的氨基酸序列的第二链;或
[0184]
包含seq id no:120的氨基酸序列的第一链,和包含seq id no:75的氨基酸序列的第二链;或
[0185]
包含seq id no:121的氨基酸序列的第一链,和包含seq id no:75的氨基酸序列的第二链;或
[0186]
包含seq id no:122的氨基酸序列的第一链,和包含seq id no:75的氨基酸序列的第二链;或
[0187]
包含seq id no:123的氨基酸序列的第一链,和包含seq id no:75的氨基酸序列的第二链;或
[0188]
包含seq id no:124的氨基酸序列的第一链,和包含seq id no:75的氨基酸序列的第二链;或
[0189]
包含seq id no:125的氨基酸序列的第一链,和包含seq id no:75的氨基酸序列的第二链;或
[0190]
包含seq id no:126的氨基酸序列的第一链,和包含seq id no:75的氨基酸序列的第二链;或
[0191]
包含seq id no:138的氨基酸序列的第一链,和包含seq id no:75的氨基酸序列的第二链;或
[0192]
包含seq id no:140的氨基酸序列的第一链,和包含seq id no:75的氨基酸序列的第二链。
[0193]
在一些实施方案中,前述的双特异性抗原结合分子,其中所述的双特异性抗原结合分子具有:
[0194]
包含seq id no:112的氨基酸序列的第一链,和包含seq id no:110的氨基酸序列的第二链;或
[0195]
包含seq id no:125的氨基酸序列的第一链,和包含seq id no:75的氨基酸序列的第二链;或
[0196]
包含seq id no:138的氨基酸序列的第一链,和包含seq id no:75的氨基酸序列的第二链;或
[0197]
包含seq id no:140的氨基酸序列的第一链,和包含seq id no:75的氨基酸序列的第二链。
[0198]
在一些实施方案中,前述的双特异性抗原结合分子,其中所述的双特异性抗原结合分子具有:
[0199]
包含seq id no:137的氨基酸序列的第一链,和包含seq id no:78的氨基酸序列的第二链;或
[0200]
包含seq id no:139的氨基酸序列的第一链,和包含seq id no:78的氨基酸序列的第二链。
[0201]
在一些实施方案中,前述的双特异性抗原结合分子,其包含两条第一链和两条第二链。在一些实施方案中,前述的双特异性抗原结合分子,其包含两条相同的第一链和两条相同的第二链。
[0202]
在一些实施方案中,还提供双特异性抗原结合分子,所述的双特异性抗原结合分子与前述任一项所述的双特异性抗原结合分子段竞争性结合人pd-1和人vegf。
[0203]
在一些实施方案中,本披露还提供一种药物组合物,其含有治疗有效量的前述任一项的双特异性抗原结合分子,以及一种或更多种药学上可接受的载体、稀释剂、缓冲剂或赋形剂。在一些实施方案中,所述治疗有效量为单位剂量的组合物中含有0.1-3000mg的如前所述的双特异性抗原结合分子。
[0204]
在一些实施方案中,本披露还提供一种核酸分子,其编码前述任一项所述的双特异性抗原结合分子。
[0205]
在一些实施方案中,本披露还提供一种宿主细胞,其包含前述的核酸分子。
[0206]
在一些实施方案中,本披露还提供一种用于免疫检测或测定pd-1的方法,所述方法包括使用前述任一项所述的双特异性抗原结合分子与受试者或来自受试者的样品接触的步骤。
[0207]
在一些实施方案中,本披露还提供一种试剂盒,其包含前述的双特异性抗原结合分子。
[0208]
在一些实施方案中,还提供前述双特异性抗原结合分子在制备与pd-1相关的疾病的诊断剂中的应用。
[0209]
在一些实施方案中,本披露还提供一种治疗疾病的方法,所述方法包括向受试者施用治疗有效量的前面任一项所述的双特异性抗原结合分子,或前述的药物组合物,或前述的核酸分子。
[0210]
在一些实施方案中,所述疾病为肿瘤。
[0211]
在另一些实施方案中,所述疾病选自:头和颈鳞状细胞癌、头和颈癌、脑癌、神经胶质瘤、多形性成胶质细胞瘤、神经母细胞瘤、中枢神经系统癌、神经内分泌肿瘤、咽喉癌、鼻咽癌、食管癌、甲状腺癌、恶性胸膜间皮瘤、肺癌、乳腺癌、肝癌、肝细胞瘤、肝胆癌、胰腺癌、胃癌、胃肠道癌、肠癌、结肠癌、结肠直肠癌、肾癌、透明细胞肾细胞癌、卵巢癌、子宫内膜癌、子宫颈癌、膀胱癌、前列腺癌、睾丸癌、皮肤癌、黑色素瘤、白血病、淋巴瘤、骨癌、软骨肉瘤、骨髓瘤、多发性骨髓瘤、骨髓异常增生综合征、骨髓增生性肿瘤、鳞状细胞癌、尤因氏肉瘤、全身性轻链淀粉样变性和梅克尔细胞癌;在其中一些实施方案中,所述淋巴瘤选自:霍奇金淋巴瘤、非霍奇金淋巴瘤、弥漫性大b-细胞淋巴瘤、滤泡性淋巴瘤、原发性纵隔大b-细胞淋巴瘤、套细胞淋巴瘤、小淋巴细胞性淋巴瘤、富含t-细胞/组织细胞的大b-细胞淋巴瘤和淋巴浆细胞性淋巴瘤,所述肺癌选自:非小细胞肺癌和小细胞肺癌,所述白血病选自:慢性髓
细胞样白血病、急性髓细胞样白血病、淋巴细胞白血病、成淋巴细胞性白血病、急性成淋巴细胞性白血病、慢性淋巴细胞性白血病和髓样细胞白血病;在另一些实施方案中,所述疾病选自:pd-l1阳性的黑色素瘤、肺癌、非小细胞肺癌、乳腺癌、胃癌、肾癌、膀胱癌、肠癌和结肠癌。
[0212]
在一些实施方案中,本披露还提供前述的双特异性抗原结合分子,或前述的药物组合物,或前述的核酸分子在制备治疗或预防疾病的药物中的用途。
[0213]
在一些实施方案中,所述疾病为肿瘤。
[0214]
在另一些实施方案中,所述疾病选自:头和颈鳞状细胞癌、头和颈癌、脑癌、神经胶质瘤、多形性成胶质细胞瘤、神经母细胞瘤、中枢神经系统癌、神经内分泌肿瘤、咽喉癌、鼻咽癌、食管癌、甲状腺癌、恶性胸膜间皮瘤、肺癌、乳腺癌、肝癌、肝细胞瘤、肝胆癌、胰腺癌、胃癌、胃肠道癌、肠癌、结肠癌、结肠直肠癌、肾癌、透明细胞肾细胞癌、卵巢癌、子宫内膜癌、子宫颈癌、膀胱癌、前列腺癌、睾丸癌、皮肤癌、黑色素瘤、白血病、淋巴瘤、骨癌、软骨肉瘤、骨髓瘤、多发性骨髓瘤、骨髓异常增生综合征、骨髓增生性肿瘤、鳞状细胞癌、尤因氏肉瘤、全身性轻链淀粉样变性和梅克尔细胞癌;在其中一些实施方案中,所述淋巴瘤选自:霍奇金淋巴瘤、非霍奇金淋巴瘤、弥漫性大b-细胞淋巴瘤、滤泡性淋巴瘤、原发性纵隔大b-细胞淋巴瘤、套细胞淋巴瘤、小淋巴细胞性淋巴瘤、富含t-细胞/组织细胞的大b-细胞淋巴瘤和淋巴浆细胞性淋巴瘤,所述肺癌选自:非小细胞肺癌和小细胞肺癌,所述白血病选自:慢性髓细胞样白血病、急性髓细胞样白血病、淋巴细胞白血病、成淋巴细胞性白血病、急性成淋巴细胞性白血病、慢性淋巴细胞性白血病和髓样细胞白血病;在另一些实施方案中,所述疾病选自:pd-l1阳性的黑色素瘤、肺癌、非小细胞肺癌、乳腺癌、胃癌、肾癌、膀胱癌、肠癌和结肠癌。
[0215]
在一些实施方案中,本披露还提供用作药物的前面任一项所述的双特异性抗原结合分子,或前述的核酸分子、或前述的药物组合物。
[0216]
在一些实施方案中,所述药物用于治疗或预防与pd-1相关的疾病。
[0217]
在一些实施方案中,所述疾病为肿瘤。
[0218]
在另一些实施方案中,所述疾病选自:头和颈鳞状细胞癌、头和颈癌、脑癌、神经胶质瘤、多形性成胶质细胞瘤、神经母细胞瘤、中枢神经系统癌、神经内分泌肿瘤、咽喉癌、鼻咽癌、食管癌、甲状腺癌、恶性胸膜间皮瘤、肺癌、乳腺癌、肝癌、肝细胞瘤、肝胆癌、胰腺癌、胃癌、胃肠道癌、肠癌、结肠癌、结肠直肠癌、肾癌、透明细胞肾细胞癌、卵巢癌、子宫内膜癌、子宫颈癌、膀胱癌、前列腺癌、睾丸癌、皮肤癌、黑色素瘤、白血病、淋巴瘤、骨癌、软骨肉瘤、骨髓瘤、多发性骨髓瘤、骨髓异常增生综合征、骨髓增生性肿瘤、鳞状细胞癌、尤因氏肉瘤、全身性轻链淀粉样变性和梅克尔细胞癌;在其中一些实施方案中,所述淋巴瘤选自:霍奇金淋巴瘤、非霍奇金淋巴瘤、弥漫性大b-细胞淋巴瘤、滤泡性淋巴瘤、原发性纵隔大b-细胞淋巴瘤、套细胞淋巴瘤、小淋巴细胞性淋巴瘤、富含t-细胞/组织细胞的大b-细胞淋巴瘤和淋巴浆细胞性淋巴瘤,所述肺癌选自:非小细胞肺癌和小细胞肺癌,所述白血病选自:慢性髓细胞样白血病、急性髓细胞样白血病、淋巴细胞白血病、成淋巴细胞性白血病、急性成淋巴细胞性白血病、慢性淋巴细胞性白血病和髓样细胞白血病;在另一些实施方案中,所述疾病选自:pd-l1阳性的黑色素瘤、肺癌、非小细胞肺癌、乳腺癌、胃癌、肾癌、膀胱癌、肠癌和结肠癌。
[0219]
本披露提供的双特异性抗原结合分子,具有治疗活性、安全性、药物代谢动力学特性和成药性(如稳定性)好的特点。
附图说明
[0220]
图1:抗pd-1抗体阻断pd-1与其配体的结合测试结果;
[0221]
图2:抗pd-1抗体对pbmc细胞分泌ifnγ的影响;
[0222]
图3:抗pd-1抗体对小鼠结肠癌mc38移植瘤的疗效;
[0223]
图4:抗pd-1抗体对小鼠结肠癌mc38肿瘤体积的影响;
[0224]
图5:双特异性抗体和抗体融合蛋白对pd-1/pd-l1配体阻断;
[0225]
图6:图6a:双特异性抗体和抗体融合蛋白对pbmc细胞分泌ifnγ的影响(供体1);图6b:双特异性抗体和抗体融合蛋白对pbmc细胞分泌ifnγ的影响(供体2);图6c:双特异性抗体和抗体融合蛋白对pbmc细胞分泌ifnγ的影响(供体3);图6d:双特异性抗体和抗体融合蛋白对pbmc细胞分泌ifnγ的影响(供体4);
[0226]
图7:图7a至图7f:双特异性抗体和抗体融合蛋白抑制vegfa诱导的huvec细胞磷酸化;
[0227]
图8:图8a:融合蛋白在人pbmc重建的小鼠mda-mb-231模型中的抗肿瘤疗效;图8b:融合蛋白在人pbmc重建的小鼠mda-mb-231模型中的抗肿瘤疗效;
[0228]
图9:图9a:dvd-gs8、dvd-gs10、dvd-h19l14、dvd-h21l14、dvd-gs14、dvd-gs19、dvd-h24l19、4-4-dvd的结构示意图;图9b:igg-gs10-scfv、igg-gs13-scfv、igg-gs19-scfv的结构示意图;图9c:hu23-2te、hu23-3st、hu23-5lk、3-6、3-12、6-37、hu33-v6、hu23-v6、hu33-wt和hu23-wt的结构示意图;图9d:#2、#3、#5的结构示意图。
具体实施方式
[0229]
术语
[0230]
为了更容易理解本披露,以下具体定义了某些技术和科学术语。除非在本文中另有明确定义,本文使用的所有其它技术和科学术语都具有本披露所属领域的一般技术人员通常理解的含义。
[0231]
术语“程序性死亡1”、“细胞程序性死亡1”、“蛋白pd-1”、“pd-1”、“pdcd1”和“hpd-1”可互换使用,且包括人pd-1的变体、同种型、物种同源物、以及与pd-1具有至少一个共同表位的类似物。完整的pd-1序列见genbank登录号u64863。
[0232]
术语“程序性死亡配体-1(pd-l1)”是pd-1的两种细胞表面糖蛋白配体之一(另一种为pd-l2),它在与pd-1结合时下调t细胞活化和细胞因子分泌。如本文中使用的术语“pd-l1”包括人pd-l1(hpd-l1),hpd-l1的变体、同种型、和种间同源物,以及5种与hpd-l1具有至少一个共同表位的类似物。完整的hpd-l1序列见genbank登录号q9nzq7。
[0233]
术语“血管内皮生长因子”或“vegf”可互换使用,还包括已知的异构体,物种同源物,截断形式,突变体等。在本文中,vegf可以指vegfa。
[0234]
本披露所用氨基酸三字母代码和单字母代码如j.biol.chem,243,p3558(1968)中所述。
[0235]
本披露所述的“抗原结合分子”在本文中以最广意义指特异性结合抗原的分子,抗
原结合分子的例子是抗体、抗体片段、抗体融合蛋白或融合蛋白。示例性的,本文中的双特异性抗原结合分子包含双特异性抗体和抗体融合蛋白。示例性的,本文的双特异性抗体和抗体融合蛋白可以包含第一链与第二链。所述第一链可以是第一多肽链,所述第二链可以是第二多肽链。所述第一多肽链可以是抗体的重链或包含抗体重链的多肽,所述第二多肽链可以是抗体的轻链或包含抗体轻链的多肽。示例性的,本文的双特异性抗体或抗体融合蛋白具有全长抗体的基本结构。示例性的,本文的双特异性抗体或抗体融合蛋白是由两条第一多肽链和两条第二多肽链通过链间二硫键连接而成的四肽链结构。
[0236]
本披露所述的“能够特异性结合pd-1的第一抗原结合域”或“能够特异性结合vegf的第二抗原结合域”指抗原结合分子中包含与pd-1或vegf的全部或部分特异性结合的区域。例如,所述抗原结合域可以包含一个或多个抗体可变区或蛋白。特别的,能够特异性结合抗原的抗原结合域包含抗体轻链可变区和抗体重链可变区,其可以形成scfv、fab等构型;或者,能够特异性结合抗原的抗原结合域包含一种能够与抗原特异性结合的蛋白,如vegftrap或其变体。
[0237]
本披露所述的“抗体”在本文中以最广意义使用,并且包括不同的抗体结构,包括,但不限于,单克隆抗体,多克隆抗体,鼠源抗体、嵌合抗体、人源化抗体、多特异性抗体(例如,双特异性抗体)和抗体片段,只要它们显示所需的抗原结合活性和特异性即可。
[0238]
术语“抗体片段”是指不同于完整抗体的分子,其包含完整抗体的部分,所述部分与完整抗体特异性结合的抗原特异性结合。抗体片段的实例包括但不限于fv,fab,fab',fab
’‑
sh,f(ab')2,双抗体,线性抗体,单链抗体分子(例如scfv或scfab),单域抗体(dabs),和由抗体片段形成的多特异性抗体。
[0239]“双特异性抗体”指能够对两个不同抗原或同一抗原的两个不同抗原表位特异性结合的抗体(包括抗体或其抗原结合片段,如单链抗体)。现有技术已公开了各种结构的双特异性抗体,根据igg分子的完整性可分为igg样双特异性抗体和抗体片段型双特异性抗体,根据抗原结合区域的数量可分为二价、三价、四价或更多价的双特异性抗体,根据结构左右是否对称可分为对称结构双特异性抗体和不对称结构双特异性抗体。其中,基于抗体片段的双特异性抗体,例如缺乏fc片段的fab片段,其通过将2个或多个fab片段结合在一个分子中形成双特异性抗体,其具有较低的免疫原性,且分子量小,具有较高的肿瘤组织渗透性,该类型的典型的抗体结构如f(ab)2、scfv-fab、(scfv)2-fab等双特异性抗体;igg样双特异性抗体(例如具有fc片段),这类抗体相对分子量较大,fc片段有助于抗体后期的纯化,并提高其溶解性、稳定性,fc部分还可能会与受体fcrn结合,增加抗体血清半衰期,典型的双特异性抗体结构模型如kih、crossmab、triomab quadroma、fcδadp、art-ig、bimab、biclonics、beat、duobody、azymetric、xmab、2:1tcbs、1fab-igg tdb、fynomab、two-in-one/daf、scfv-fab-igg、dart-fc、lp-dart、codv-fab-tl、hle-bite、f(ab)2-crossmab、igg-(scfv)2、bs4ab、dvd-ig、tetravalent-dart-fc、(scfv)4-fc、codv-ig、mab2、f(ab)4-crossmab等双特异性抗体(参见aran f.labrijn等,nature reviews drug discovery volume 18,pages585
–
608(2019);chen s1等,j immunol res.2019feb 11;2019:4516041)。
[0240]
术语“一价”、“二价”、“三价”或“多价”是指抗体或多肽复合物中存在指定数量的抗原结合位点。例如“一价抗体”表示抗体中存在一个抗原结合位点,“一价多肽复合物”表
示多肽复合物中存在一个抗原结合位点;“二价抗体”表示抗体中存在两个抗原结合位点,“二价多肽复合物”表示多肽复合物中存在两个抗原结合位点;“三价抗体”表示抗体中存在三个抗原结合位点,“三价多肽复合物”表示多肽复合物中存在三个抗原结合位点;“多价抗体”表示抗体中存在多个(三个或以上)抗原结合位点,“多价多肽复合物”表示多肽复合物中存在多个(两个或以上)抗原结合位点。
[0241]
术语“抗体融合蛋白”是指将目的蛋白质(多肽)与抗体连接形成的具有生物活性的融合蛋白,所述的融合蛋白具有所连接的蛋白质的生物学活性以及免疫球蛋白活性。
[0242]
本披露所述的“嵌合抗体(chimeric antibody)”,是将鼠源性抗体的可变区与人抗体的恒定区融合而成的抗体,可以减轻鼠源性抗体诱发的免疫应答反应。
[0243]
本披露所述的“人源化抗体(humanized antibody)”,也称为cdr移植抗体(cdr-grafted antibody),是指将鼠的cdr序列移植到人的抗体可变区框架,即不同类型的人种系抗体框架序列中产生的抗体。可以克服嵌合抗体由于携带大量鼠蛋白成分,从而诱导的异源性反应。为避免免疫原性下降的同时,引起的活性下降,可对所述的人抗体可变区框架序列进行最少反向突变或回复突变,以保持或增强活性。本披露的人源化抗体也包括进一步由酵母菌展示对cdr进行亲和力成熟突变后的人源化抗体。
[0244]
本披露中“人抗体”(humab)、“人源抗体”、“全人抗体”、“完全人抗体”可以互换使用,其氨基酸序列对应于由人或人细胞产生的抗体的氨基酸序列、或衍生自利用人抗体组库或其它人抗体编码序列的非人来源的氨基酸序列。该人抗体的定义明确排除了包含非人抗原结合残基的人源化抗体。
[0245]
本披露所述的“抗体片段”是指不同于完整抗体的分子,其包含完整抗体的部分,所述部分与完整抗体特异性结合的抗原特异性结合。抗体片段的实例包括但不限于fv,fab,fab',fab
’‑
sh,f(ab')2,双抗体,线性抗体,单链抗体分子(例如scfv或scfab),单域抗体(dabs),和由抗体片段形成的多特异性抗体。本披露的“抗体”包含“完整抗体”及其“抗体片段”。相应的,本披露所述的抗体的重链或抗体的轻链包含完整的重链或完整的轻链,也包含抗体片段中的重链片段或轻链片段。
[0246]
术语“可变区”指抗体重链和轻链中牵涉抗原结合的域。天然抗体中,重链可变区与轻链可变区共同构成抗原结合域。本文中,重链可变区pd-1-vh指抗pd-1抗体的重链可变区,轻链可变区pd-1-vl指抗pd-1抗体的轻链可变区,重链可变区vegf-vh指抗vegf抗体的重链可变区,轻链可变区vegf-vl指抗vegf抗体的轻链可变区。
[0247]
术语“互补决定区”、“cdr”或“高变区”是指抗体的可变区内主要促成抗原结合的6个高变区之一。通常,每个重链可变区中存在三个cdr(hcdr1、hcdr2、hcdr3),每个轻链可变区中存在三个cdr(lcdr1、lcdr2、lcdr3)。可以使用各种公知方案中的任何一种来确定cdr的氨基酸序列边界,包括“kabat”编号规则(参见kabat等(1991),“sequences of proteins of immunological interest”,第5版,public health service,national institutes of health,bethesda,md)、“chothia”编号规则(参见al-lazikani等人,(1997)jmb 273:927-948)和immunogentics(imgt)编号规则(lefranc m.p.,immunologist,7,132-136(1999);lefranc,m.p.等,dev.comp.immunol.,27,55-77(2003)等。例如,对于经典格式,遵循kabat规则,所述重链可变区(vh)中的cdr氨基酸残基编号为31-35(hcdr1)、50-65(hcdr2)和95-102(hcdr3);轻链可变区(vl)中的cdr氨基酸残基编号为24-34(lcdr1)、50-56(lcdr2)和
89-97(lcdr3)。遵循chothia规则,vh中的cdr氨基酸编号为26-32(hcdr1)、52-56(hcdr2)和95-102(hcdr3);并且vl中的氨基酸残基编号为26-32(lcdr1)、50-52(lcdr2)和91-96(lcdr3)。通过组合kabat和chothia两者的cdr定义,cdr由人vh中的氨基酸残基26-35(hcdr1)、50-65(hcdr2)和95-102(hcdr3)和人vl中的氨基酸残基24-34(lcdr1)、50-56(lcdr2)和89-97(lcdr3)构成。遵循imgt规则,vh中的cdr氨基酸残基编号大致为26-35(cdr1)、51-57(cdr2)和93-102(cdr3),vl中的cdr氨基酸残基编号大致为27-32(cdr1)、50-52(cdr2)和89-97(cdr3)。遵循imgt规则,抗体的cdr区可以使用程序imgt/domaingap align确定。除非另有说明,本披露实施例涉及的抗体可变区和cdr序列均适用“kabat”编号规则。本文中,pd-1-hcdr1、pd-1-hcdr2、pd-1-hcdr3、pd-1-lcdr1、pd-1-lcdr2pd-1-lcdr3指抗pd-1抗体的cdr组合;vegf-hcdr1、vegf-hcdr2、vegf-hcdr3、vegf-lcdr1、vegf-lcdr2 vegf-lcdr3指抗vegf抗体的cdr组合。
[0248]
术语“框架”或“fr”指除了互补决定区(cdr)残基以外的可变区残基。可变区的fr一般由四个fr域组成:fr1、fr2、fr3和fr4。因而,cdr和fr序列一般以下面的次序在vh(或vl)中出现:
[0249]
fr1-hcdr1(lcdr1)-fr2-hcdr2(lcdr2)-fr3-hcdr3(lcdr3)-fr4
[0250]
本披露的“恒定区”包括人源或鼠源κ、λ链或其变体的轻链恒定区,或人源或鼠源igg1、igg2、igg3、igg4或其变体的重链恒定区。本披露的恒定区还包括所述人抗体重链恒定区和人抗体轻链恒定区的“常规变体”,其指现有技术已公开的来源于人的不改变抗体可变区结构和功能的重链恒定区或轻链恒定区的变体,示例性变体包括对重链恒定区进行定点改造和氨基酸替换的igg1、igg2、igg3或igg4重链恒定区变体,具体替换如现有技术已知的yte突变,l234a和/或l235a突变,s228p突变,和/或获得knob-into-hole结构的突变(使得抗体重链具有knob-fc和hole-fc组合),这些突变已被证实使得抗体具有新的性能,但不改变抗体可变区的功能。在一个实施方式中,恒定区包含人源igg1、igg2或igg4重链恒定区,或者使用氨基酸突变(例如l234a和/或l235a突变、和/或s228p突变)的igg1、igg2或igg4变体。
[0251]
术语“特异性结合”、“选择性结合”、“选择性地结合”和“特异性地结合”是指抗体对预先确定的抗原上的表位的结合。通常,抗体以大约小于10-8
m,例如大约小于10-9
m、10-10
m、10-11
m、10-12
m或更小的亲和力(kd)结合。
[0252]
术语“kd”是指特定抗体-抗原相互作用的解离平衡常数。通常,本披露的抗体以小于大约10-7
m,例如小于大约10-8
m、10-9
m、10-10
m、10-11
m、10-12
m的解离平衡常数(kd)结合抗原,例如,如使用表面等离子体共振(spr)技术在biacore仪中测定的。
[0253]
术语“氨基酸差异”或“氨基酸突变”是指相较于原蛋白质或多肽,变体蛋白质或多肽存在氨基酸的改变或突变,包括在原蛋白质或多肽的基础上发生1个、2个、3个或更多个氨基酸的插入、缺失或替换。
[0254]
术语“连接子”指连接两个多肽片段的连接单元。在本文中,同一结构中出现的连接子可以是相同或不同的。连接子可以是肽连接子,其包含一个或多个氨基酸,典型的约1-30个、2-24个或8-24个氨基酸。应用于本文的连接子可以是相同或不同的。
[0255]
当术语“键”出现在结构单元,如l1或l2中时,其表示该单元没有氨基酸,单元两侧的单元直接连接。
[0256]
当术语“竞争”用于竞争相同表位的抗原结合蛋白(例如中和抗原结合蛋白或中和抗体)的情况中时,意指在抗原结合蛋白之间竞争,其通过以下测定法来测定:在所述测定法中,待检测的抗原结合蛋白(例如抗体或其免疫学功能片段)防止或抑制(例如降低)参考抗原结合蛋白(例如配体或参考抗体)与共同抗原(例如pd-1抗原或其片段或vegf抗原或其片段)的特异性结合。众多类型的竞争性结合测定可用于确定一种抗原结合蛋白是否与另一种竞争,这些测定例如:固相直接或间接放射免疫测定(ria)、固相直接或间接酶免疫测定(eia)、夹心竞争测定(参见例如stahli等,1983,methodsin enzymology 9:242-253);固相直接生物素-亲和素eia(参见例如kirkland等,1986,j.immunol.137:3614-3619)、固相直接标记测定、固相直接标记夹心测定(参见例如harlow和lane,1988,antibodies,a laboratory manual(抗体,实验室手册),cold spring harbor press);用i-125标记物的固相直接标记ria(参见例如morel等,1988,molec.immunol.25:7-15);固相直接生物素-亲和素eia(参见例如cheung,等,1990,virology176:546-552);和直接标记的ria(moldenhauer等,1990,scand.j.immunol.32:77-82)。通常所述测定法涉及使用结合荷有未标记的检测抗原结合蛋白及标记的参考抗原结合蛋白任一种的固态表面或细胞的纯化的抗原。通过测量在所测抗原结合蛋白存在下结合固态表面或细胞的标记的量来测量竞争性抑制。通常所测抗原结合蛋白过量存在。由竞争性测定(竞争抗原结合蛋白)鉴定的抗原结合蛋白包括:结合与参考抗原结合蛋白同一表位的抗原结合蛋白;和结合充分接近参考抗原结合蛋白的结合表位的邻近表位的抗原结合蛋白,所述两个表位在空间上互相妨碍发生结合。在本文实施例中提供关于用于测定竞争性结合的方法的其它详细资料。通常当竞争的抗原结合蛋白过量存在时,其将抑制(例如降低)至少40-45%、45-50%、50-55%、55-60%、60-65%、65-70%、70-75%或75%或更多参考抗原结合蛋白与共同抗原的特异性结合。在某些情况下,结合被抑制至少80-85%、85-90%、90-95%、95-97%或97%或更多。
[0257]
本文中使用的术语“核酸分子”是指dna分子和rna分子。核酸分子可以是单链或双链的,优选是双链dna或单链mrna或修饰的mrna。当将核酸与另一个核酸序列置于功能关系中时,核酸是“有效连接的”。例如,如果启动子或增强子影响编码序列的转录,那么启动子或增强子有效地连接至所述编码序列。
[0258]
术语“载体”是指能够运输已与其连接的另一个核酸的核酸分子。在一个实施方案中,载体是“质粒”,其是指可将另外的dna区段连接至其中的环状双链dna环。在另一个实施方案中,载体是病毒载体,其中可将另外的dna区段连接至病毒基因组中。本文中公开的载体能够在已引入它们的宿主细胞中自主复制(例如,具有细菌的复制起点的细菌载体和附加型哺乳动物载体)或可在引入宿主细胞后整合入宿主细胞的基因组,从而随宿主基因组一起复制(例如,非附加型哺乳动物载体)。
[0259]
现有技术中熟知生产和纯化抗体和抗原结合片段的方法,如冷泉港的抗体实验技术指南,5-8章和15章。例如,鼠可以用人pd-1或其片段免疫,所得到的抗体能被复性、纯化,并且可以用常规的方法进行氨基酸测序。抗原结合片段同样可以用常规方法制备。发明所述的抗体或抗原结合片段用基因工程方法在非人源的cdr区加上一个或更多个人源fr区。人fr种系序列可以通过比对imgt人类抗体可变区种系基因数据库和moe(molecular operation environment)软件,从immunogenetics(imgt)的网站http://imgt.cines.fr得到,或者从免疫球蛋白杂志,2001isbn012441351上获得。
[0260]
术语“宿主细胞”是指已向其中引入了表达载体的细胞。宿主细胞可包括细菌、微生物、植物或动物细胞。易于转化的细菌包括肠杆菌科(enterobacteriaceae)的成员,例如大肠杆菌(escherichia coli)或沙门氏菌(salmonella)的菌株;芽孢杆菌科(bacillaceae)例如枯草芽孢杆菌(bacillus subtilis);肺炎球菌(pneumococcus);链球菌(streptococcus)和流感嗜血菌(haemophilus influenzae)。适当的微生物包括酿酒酵母(saccharomyces cerevisiae)和毕赤酵母(pichia pastoris)。适当的动物宿主细胞系包括cho(中国仓鼠卵巢细胞系)和ns0细胞。
[0261]
本披露工程化的抗体或抗原结合片段或双特异性抗体或抗体融合蛋白可用常规方法制备和纯化。比如,编码重链和轻链的cdna序列,可以克隆并重组至gs表达载体。重组的免疫球蛋白表达载体可以稳定地转染cho细胞。作为一种更推荐的现有技术,哺乳动物类表达系统会导致抗体的糖基化,特别是在fc区的高度保守n端位点。所述方式可包括:得到稳定的克隆,阳性的克隆在生物反应器的无血清培养基中扩大培养以生产抗体。分泌了抗体的培养液可以用常规技术纯化。比如,用含调整过的缓冲液的a或g sepharose ff柱进行纯化。洗去非特异性结合的组分。再用ph梯度法洗脱结合的抗体,用sds-page检测抗体片段,收集。抗体可用常规方法进行过滤浓缩。可溶的混合物和多聚体,也可以用常规方法去除,比如分子筛、离子交换。得到的产物需立即冷冻,如-70℃,或者冻干。
[0262]“施用”、“给予”和“处理”当应用于动物、人、实验受试者、细胞、组织、器官或生物流体时,是指外源性药物、治疗剂、诊断剂或组合物与动物、人、受试者、细胞、组织、器官或生物流体的接触。“施用”、“给予”和“处理”可以指例如治疗、药物代谢动力学、诊断、研究和实验方法。细胞的处理包括试剂与细胞的接触,以及试剂与流体的接触,其中所述流体与细胞接触。“施用”、“给予”和“处理”还意指通过试剂、诊断、结合组合物或通过另一种细胞体外和离体处理例如细胞。“处理”当应用于人、兽医学或研究受试者时,是指治疗处理、预防或预防性措施,研究和诊断应用。
[0263]“治疗”意指给予患者内用或外用治疗剂,例如包含本披露的任一种结合化合物的组合物,所述患者具有一种或多种疾病症状,而已知所述治疗剂对这些症状具有治疗作用。通常,在受治疗患者或群体中以有效缓解一种或多种疾病症状的量给予治疗剂,以诱导这类症状退化或抑制这类症状发展到任何临床右测量的程度。有效缓解任何具体疾病症状的治疗剂的量(也称作“治疗有效量”)可根据多种因素变化,例如患者的疾病状态、年龄和体重,以及药物在患者产生需要疗效的能力。通过医生或其它专业卫生保健人士通常用于评价该症状的严重性或进展状况的任何临床检测方法,可评价疾病症状是否已被减轻。尽管本披露的实施方案(例如治疗方法或制品)在缓解每个目标疾病症状方面可能无效,但是根据本领域已知的任何统计学检验方法如student t检验、卡方检验、依据mann和whitney的u检验、kruskal-wallis检验(h检验)、jonckheere-terpstra检验和wilcoxon检验确定,其在统计学显著数目的患者中应当减轻目标疾病症状。
[0264]“保守修饰”或“保守置换或取代”是指具有类似特征(例如电荷、侧链大小、疏水性/亲水性、主链构象和刚性等)的其它氨基酸置换蛋白中的氨基酸,使得可频繁进行改变而不改变蛋白的生物学活性。本领域技术人员知晓,一般而言,多肽的非必需区域中的单个氨基酸置换基本上不改变生物学活性(参见例如watson等(1987)molecular biology of the gene,the benjamin/cummings pub.co.,第224页,(第4版))。另外,结构或功能类似的
氨基酸的置换不大可能破环生物学活性。示例性保守取代于下表“示例性氨基酸保守取代”中陈述。
[0265]
表3.示例性氨基酸保守取代
[0266]
原始残基保守取代ala(a)gly;serarg(r)lys;hisasn(n)gln;his;aspasp(d)glu;asncys(c)ser;ala;valgln(q)asn;gluglu(e)asp;glngly(g)alahis(h)asn;glnile(i)leu;valleu(l)ile;vallys(k)arg;hismet(m)leu;ile;tyrphe(f)tyr;met;leupro(p)alaser(s)thrthr(t)sertrp(w)tyr;phetyr(y)trp;pheval(v)ile;leu
[0267]“有效量”或“有效剂量”指获得任一种或多种有益的或所需的治疗结果所必需的药物、化合物或药物组合物的量。对于预防用途,有益的或所需的结果包括消除或降低风险、减轻严重性或延迟病症的发作,包括病症、其并发症和在病症的发展过程中呈现的中间病理表型的生物化学、组织学和/或行为症状。对于治疗应用,有益的或所需的结果包括临床结果,诸如减少各种本披露靶抗原相关病症的发病率或改善所述病症的一个或更多个症状,减少治疗病症所需的其它药剂的剂量,增强另一种药剂的疗效,和/或延缓患者的本披露靶抗原相关病症的进展。
[0268]“外源性”指根据情况在生物、细胞或人体外产生的物质。“内源性”指根据情况在细胞、生物或人体内产生的物质。
[0269]“同源性”是指两个多核苷酸序列之间或两个多肽之间的序列相似性。当两个比较序列中的位置均被相同碱基或氨基酸单体亚基占据时,例如如果两个dna分子的每一个位置都被腺嘌呤占据时,那么所述分子在该位置是同源的。两个序列之间的同源性百分率是两个序列共有的匹配或同源位置数除以比较的位置数
×
100的函数。例如,在序列最佳比对时,如果两个序列中的10个位置有6个匹配或同源,那么两个序列为60%同源;如果两个序列中的100个位置有95个匹配或同源,那么两个序列为95%同源。通常,当比对两个序列时
进行比较以给出最大百分比同源性。例如,可以通过blast算法执行比较,其中选择算法的参数以在各个参考序列的整个长度上给出各个序列之间的最大匹配。以下参考文献涉及经常用于序列分析的blast算法:blast算法(blast algorithms):altschul,s.f.等人,(1990)j.mol.biol.215:403-410;gish,w.等人,(1993)nature genet.3:266-272;madden,t.l.等人,(1996)meth.enzymol.266:131-141;altschul,s.f.等人,(1997)nucleic acids res.25:3389-3402;zhang,j.等人,(1997)genome res.7:649-656。其他如ncbi blast提供的常规blast算法也为本领域技术人员所熟知。
[0270]
本文使用的表述“细胞”、“细胞系”和“细胞培养物”可互换使用,并且所有这类名称都包括后代。因此,单词“转化体”和“转化细胞”包括原代受试细胞和由其衍生的培养物,而不考虑转移数目。还应当理解的是,由于故意或非有意的突变,所有后代在dna含量方面不可能精确相同。包括具有与最初转化细胞中筛选的相同的功能或生物学活性的突变后代。在意指不同名称的情况下,其由上下文清楚可见。
[0271]
本文使用的“聚合酶链式反应”或“pcr”是指其中微量的特定部分的核酸、rna和/或dna如在例如美国专利号4,683,195中所述扩增的程序或技术。一般来说,需要获得来自目标区域末端或之外的序列信息,使得可以设计寡核苷酸引物;这些引物在序列方面与待扩增模板的对应链相同或相似。2个引物的5’末端核苷酸可以与待扩增材料的末端一致。pcr可用于扩增特定的rna序列、来自总基因组dna的特定dna序列和由总细胞rna转录的cdna、噬菌体或质粒序列等。一般参见mullis等(1987)cold spring harbor symp.ouant.biol.51:263;erlich编辑,(1989)pcr technology(stockton press,n.y.)。本文使用的pcr被视为用于扩增核酸测试样品的核酸聚合酶反应法的一个实例,但不是唯一的实例,所述方法包括使用作为引物的已知核酸和核酸聚合酶,以扩增或产生核酸的特定部分。
[0272]“分离的”指纯化状态,并且在这种情况下意味着在指定的分子基本上不含其他生物分子,例如核酸、蛋白质、脂质、碳水化合物或其他材料,例如细胞碎片和生长培养基。通常,术语“分离的”并不意图指完全不存在这些材料或不存在水、缓冲液或盐,除非它们以显著干扰如本文所述的化合物的实验或治疗用途的量存在。
[0273]“任选”或“任选地”意味着随后所描述地事件或环境可以但不必发生,该说明包括该事件或环境发生或不发生的场合。例如,“任选包含1-3个抗体重链可变区”意味着特定序列的抗体重链可变区可以但不必须存在。
[0274]“药物组合物”表示含有一种或多种本文所述化合物或其生理学上/可药用的盐或前体药物与其他化学组分的混合物,所述化合物可以是抗原结合分子,所述其他组分例如生理学/可药用的载体和赋形剂。药物组合物的目的是促进对生物体的给药,利于活性成分的吸收进而发挥生物活性。
[0275]
术语“药学上可接受的载体”指适合用于制剂中用于递送抗体或抗原结合片段的任何无活性物质。载体可以是抗粘附剂、粘合剂、包衣、崩解剂、充填剂或稀释剂、防腐剂(如抗氧化剂、抗菌剂或抗真菌剂)、增甜剂、吸收延迟剂、润湿剂、乳化剂、缓冲剂等。合适的药学上可接受的载体的示例包括水、乙醇、多元醇(例如甘油、丙二醇、聚乙二醇等)右旋糖、植物油(例如橄榄油)、盐水、缓冲液、缓冲的盐水和等渗剂,例如糖、多元醇、山梨糖醇和氯化钠。
[0276]
此外,本披露包括用于治疗与目标抗原(例如pd-1)阳性细胞相关的疾病的药剂,所述药剂包含本披露的抗pd-1抗体或其抗原结合片段作为活性成分。
[0277]
本披露中与pd-1或vegf相关的疾病没有限制,只要它是与pd-1或vegf相关的疾病即可,例如利用本披露的分子诱导的治疗反应可通过结合人类pd-1,然后阻遏pd-1与其配体pd-l1、pd-l2的结合,或杀伤过表达pd-1的肿瘤细胞。因此,当处于适于治疗应用的制备物和制剂中时,本披露的分子对这样一些人是非常有用的,他们患有肿瘤或癌症,优选黑色素瘤、结肠癌、乳腺癌、肺癌、胃癌、肠癌、肾癌、非小细胞肺癌、膀胱癌等。
[0278]
此外,本披露涉及用于免疫检测或测定目标抗原(例如pd-1或vegf)的方法、用于免疫检测或测定目标抗原(例如pd-1或vegf)的试剂、用于免疫检测或测定表达目标抗原(例如pd-1或vegf)的细胞的方法和用于诊断与目标抗原(例如pd-1或vegf)阳性细胞相关的疾病的诊断剂,其包含本披露的特异性识别目标抗原(例如人pd-1或vegf)并与胞外区的氨基酸序列或其三维结构结合的抗体或抗体片段作为活性成分。
[0279]
在本披露中,用于检测或测定目标抗原(例如pd-1或vegf)的量的方法可以是任何已知方法。例如,它包括免疫检测或测定方法。
[0280]
免疫检测或测定方法是使用标记的抗原或抗体检测或测定抗体量或抗原量的方法。免疫检测或测定方法的实例包括放射性物质标记的免疫抗体方法(ria)、酶免疫测定法(eia或elisa)、荧光免疫测定法(fia)、发光免疫测定法、蛋白质免疫印迹法、物理化学方法等。
[0281]
为了检测表达多肽的细胞,可以使用已知的免疫检测方法,并优选使用免疫沉淀法、荧光细胞染色法、免疫组织染色法等。此外,可以使用利用fmat8100hts系统(applied biosystem)的荧光抗体染色法等。
[0282]
在本披露中,对用于检测或测定目标抗原(例如pd-1或vegf)的活体样品没有特别限制,只要它具有包含表达目标抗原(例如pd-1或vegf)的细胞的可能性即可,例如组织细胞、血液、血浆、血清、胰液、尿液、粪便、组织液或培养液。
[0283]
根据所需的诊断方法,含有本披露的单克隆抗体或其抗体片段的诊断剂还可以含有用于执行抗原-抗体反应的试剂或用于检测反应的试剂。用于执行抗原-抗体反应的试剂包括缓冲剂、盐等。用于检测的试剂包括通常用于免疫检测或测定方法的试剂,例如识别所述单克隆抗体、其抗体片段或其结合物的标记的第二抗体和与所述标记对应的底物等。
[0284]
pd-1抗原的制备
[0285]
1.抗原构建:
[0286]
设计并合成人pd-1-igg1fc融合蛋白,n端为人pd-1胞外区150个氨基酸,c端为人igg1的fc段(higg1fc)。经protein a的亲和柱纯化,可获得高纯度的重组pd-1-fc蛋白,用于检测抗pd-1抗体与抗原的结合。
[0287]
人pd-1-igg1fc(seq id no:1):
[0288][0289]
注释:下划线部分为信号肽,正体部分为人pd-1胞外区,斜体部分为higg1fc(信号肽+胞外区+higg1fc)。
[0290]
人pd-1-his(seq id no:2):
[0291]
mefglswlflvailkgvqcpgwfldspdrpwnpptfspallvvtegdnatftcsfsntsesfvlnwyrmspsnqtdklaafpedrsqpgqdcrfrvtqlpngrdfhmsvvrarrndsgtylcgaislapkaqikeslraelrvterraevptahpspsprpagqfqtlvgssdykddddkhhhhhh。
[0292]
转染细胞的pd-1核酸编码的pd-1抗原(seq id no:3):
[0293]
mqipqapwpvvwavlqlgwrpgwfldspdrpwnpptfspallvvtegdnatftcsfsntsesfvlnwyrmspsnqtdklaafpedrsqpgqdcrfrvtqlpngrdfhmsvvrarrndsgtylcgaislapkaqikeslraelrvterraevptahpspsprpagqfqtlvvgvvggllgslvllvwvlavicsraargtigarrtgqplkedpsavpvfsvdygeldfqwrektpeppvpcvpeqteyativfpsgmgtssparrgsadgprsaqplrpedghcswpl。
[0294]
pd-1抗体的制备
[0295]
抗人pd-1抗体可通过免疫小鼠产生,也可通过抗人pd-1噬菌体小鼠免疫文库获得。
[0296]
通过免疫小鼠制备抗人pd-1抗体的方法如下:
[0297]
1.免疫:实验用sjl白小鼠,雌性,6-8周龄和balb/c白小鼠,雌性,6-8周龄。饲养环境:spf级。小鼠购进后,实验室环境饲养1周,12/12小时光/暗周期调节,温度20-25℃;湿度40-60%。将已适应环境的小鼠按不同方案免疫,每组6-10只。免疫抗原可以是纯化的重组蛋白pd-1-igg1fc(见seq id no:1)、pd-1-his(见seq id no:2)、或pd-1作为抗原(见seq id no:3)转染的jurkat/cho-pd-1细胞,可以使用单独一种抗原配合不同的免疫佐剂或者不同类型免疫原交叉免疫。免疫部位可以是腹腔或者背部皮下,或者两种位置交替免疫。免疫佐剂gold adjuvant(以下简称titermax,购自sigma货号t2684)与imject alum adjuvant(以下简称alum,购自pierce货号77161)交叉免疫。抗原与佐剂(titermax)比例为1:1,抗原与佐剂(alum)比例为3:1,25-50μg/只(首免),50μg/只(加强免疫),或是1
×
107个jurkat/cho-pd-1细胞/只。第0天腹膜内注射25-50μg/只的乳化后抗原,首次免疫后每周一次或是每两周一次,titermax和alum交替使用,共5-8次。
[0298]
2.细胞融合:选择血清中抗体滴度高的小鼠进行脾细胞融合,将冲刺免疫72小时后的小鼠眼球放血,拉颈处死,放入75%乙醇中消毒。采用优化的peg介导的融合步骤将脾淋巴细胞与骨髓瘤细胞sp2/0细胞(中国科学院)进行融合得到杂交瘤细胞。融合好的杂交瘤细胞用hat完全培养基(含20%fbs、1
×
hat和1
×
opi的rpmi-1640培养基)重悬,分装于96孔细胞培养板中(1
×
105/150μl/孔),37℃,5%co2孵育,种板10-30块左右。融合后的第5天
加入hat完全培养基,50μl/孔,37℃,5%co2孵育。融合后第7天至8天,根据细胞生长密度,全换液,200μl/孔,37℃,5%co2孵育。
[0299]
3.杂交瘤细胞筛选:融合后第7-9天,根据细胞生长密度,进行抗体与pd-1结合的elisa检测,并将检测的阳性孔细胞进行pd-1/pdl1结合的阻断elisa检测,阳性孔换液,并根据细胞密度及时扩大至24孔板中。移入24孔板的细胞株经过复测后进行保种和第一次亚克隆。第一次亚克隆筛选为阳性的进行保种,并进行第二次或第三次亚克隆,直至获得单细胞克隆。多次融合获得有阻断pd-1与pdl1结合效果的杂交瘤细胞。
[0300]
通过抗人pd-1噬菌体小鼠免疫文库获得抗人pd-1抗体的方法如下:
[0301]
1.构建抗人pd-1噬菌体小鼠免疫文库:选择血清中抗体滴度高的小鼠的脾脏,用trizol(invitrogen cat no.15596-018)提取组织总rna。使用primescript
tm
ii 1st strand cdna synthesis kit试剂盒(takara cat no.6210a)进行反转录获得cdna。根据imgt数据库设计并合成构建文库的引物。通过三轮pcr反应,获得单链抗体片段。将单链抗体片段和经过改造的建库载体pcantab5e(amersham biosciences/ge cat no.27-9400-01)用sfi1(neb cat no.#r0123l)进行酶切,电泳后用gel extraction kit(omega cat no.d2500-02)进行纯化回收。然后用t4 dna连接酶(neb cat no.#m0202l)16℃连接16-18小时,再用上述试剂盒进行纯化回收,最后用去离子水洗脱。取1μg连接产物与1支电转化感受态tg1(lucigen cat no.60502-2)混合,电转化仪(bio rad micropulser)参数设至2.5kv,200ω,25μf,进行电转化。重复转化10次,涂平板,37℃倒置培养16-18小时。将所有菌落刮洗下来混和在一起,加入终浓度为15%的甘油,-80℃保存备用。
[0302]
2.抗人pd-1噬菌体小鼠免疫文库的筛选:将包装好的抗人pd-1噬菌体免疫文库(1
×
10
12-1
×
10
13
)与100μl链菌素微珠(mi1envi biotec,auburn,ca)加入1m1含2%脱脂牛奶-磷酸盐缓冲液(缩写mpbs)中于室温下孵育1小时,放置在磁力架上,取上清。上清加入10μg/ml生物素化的人pd-1-ecd-his蛋白(购自sino biological)中于室温下孵育1小时,再加入100μl链霉亲和素包被的磁珠(1ml mpbs预孵育)于室温下孵育1小时。并使其负载于磁力架系统上用于分选,吸去上清。加入1ml pbst(含0.1%tween-20的磷酸盐缓冲液),翻转多次,吸尽后再加入新鲜洗液,重复11次,以去除未结合的抗体片段,加入0.5ml洗脱液(50μl 10mg/ml trypsin stock solution(存储液)加入450μl pbs中)。室温下摇晃15min。放置在磁力架上,吸出上清至一新ep管中。tg1接入2yt培养基中扩增至培养细菌密度od600=0.4时。每管加入1.75ml tg1(od600=0.4),并加入250μl洗脱后phage(噬菌体),37℃水浴中静置孵育30min,梯度稀释涂板,用于测试滴度。其余tg1溶液离心,涂板,37℃过夜孵育。
[0303]
噬菌体小鼠免疫文库利用生物素化的人pd-1-ecd-his抗原,经过2-3轮macs筛选(链霉素磁珠,invitrogen),最终获得具有结合pd-1和阻断pd-1与pd-l1结合的单克隆,测序验证,得到抗体的可变区序列。
[0304]
重组抗原蛋白/抗体的纯化
[0305]
1.杂交瘤上清分离纯化/proteing亲和层析:
[0306]
对于小鼠杂交瘤上清纯化首选proteing进行亲和层析,将培养所得杂交瘤离心取上清,根据上清体积加入10-15%体积的1m tris-hcl(ph8.0-8.5)调节上清ph。proteing柱利用6m盐酸胍洗3-5倍柱体积,然后利用纯水清洗3-5倍柱体积;利用如1
×
pbs(ph7.4)缓冲体系作为平衡缓冲液对层析柱平衡3-5倍柱体积;细胞上清利用低流速上样结合,控制流速
使保留时间约1min或更长时间;利用1
×
pbs(ph7.4)洗涤层析柱3-5倍柱体积至紫外吸收回落至基线;利用0.1m醋酸/醋酸钠(ph3.0)缓冲液进行样品洗脱,根据紫外检测收集洗脱峰,洗脱产物利用1mtris-hcl(ph8.0)快速调节ph至5-6暂存。对于洗脱产物可以利用本领域技术人员熟知的方法进行溶液置换,如利用超滤管进行超滤浓缩及溶液置换至所需的缓冲体系,或者利用分子排阻如g-25脱盐替换成所需的缓冲体系,或者利用如superdex 200等高分辨率分子排阻柱去除洗脱产物中的聚体成分以提高样品纯度。
[0307]
2.protein a亲和层析纯化蛋白或抗体:
[0308]
首先将表达抗原蛋白或者抗体的细胞培养上清进行高速离心收取上清。protein a亲和柱利用6m盐酸胍洗3-5倍柱体积,然后利用纯水清洗3-5倍柱体积。利用如1
×
pbs(ph7.4)缓冲体系作为平衡缓冲液对层析柱平衡3-5倍柱体积。细胞上清利用低流速上样结合,控制流速使保留时间约1min或更长时间,结合完毕后利用1
×
pbs(ph7.4)洗涤层析柱3-5倍柱体积至紫外吸收回落至基线。利用0.1m醋酸/醋酸钠(ph3.0-3.5)缓冲液进行样品洗脱,根据紫外检测收集洗脱峰,洗脱产物利用1m tris-hcl(ph8.0)快速调节ph至5-6暂存。对于洗脱产物可以利用本领域技术人员熟知的方法进行溶液置换,如利用超滤管进行超滤浓缩及溶液置换至所需的缓冲体系,或者利用分子排阻如g-25脱盐替换成所需的缓冲体系,或者利用如superdex 200等高分辨率分子排阻柱去除洗脱产物中的聚体成分以提高样品纯度。
[0309]
本披露所采用的对照抗体或融合蛋白的序列
[0310]
lucentis:
[0311]
lucentis的重链氨基酸序列(seq id no:83):
[0312][0313]
lucentis的轻链氨基酸序列(seq id no:84):
[0314][0315]
上述lucentis抗体可变区序列中,斜体表示恒定区,下划线斜体表示cdr序列,序列顺序依次为fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4。
[0316]
vegftrap-fc(seq id no:93):
[0317]
sdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhq
hkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhekdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg
[0318]
vp101
[0319]
vp101的重链氨基酸序列(seq id no:101):
[0320]
evqlvesggglvqpggslrlscaasgytftnygmnwvrqapgkglewvgwintytgeptyaadfkrrftfsldtskstaylqmnslraedtavyycakyphyygsshwyfdvwgqgtlvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgggggsggggsggggsggggsevqlvesggglvqpggslrlscaasgfafssydmswvrqapgkgldwvatisgggrytyypdsvkgrftisrdnsknnlylqmnslraedtalyycanrygeawfaywgqgtlvtvssggggsggggsggggsggggsdiqmtqspssmsasvgdrvtftcrasqdintylswfqqkpgkspktliyranrlvsgvpsrfsgsgsgqdytltisslqpedmatyyclqydefpltfgagtklelk
[0321]
vp101的轻链氨基酸序列(seq id no:102):
[0322]
diqmtqspsslsasvgdrvtitcsasqdisnylnwyqqkpgkapkvliyftsslhsgvpsrfsgsgsgtdftltisslqpedfatyycqqystvpwtfgqgtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgecby24.3
[0323]
by24.3的重链氨基酸序列(seq id no:103):
[0324]
qvqlvesgggvvqpgrslrldckasgitfsnsgmhwvrqapgkglewvaviwydgskryyadsvkgrftisrdnskntlflqmnslraedtavyycatnddywgqgtlvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslggggsggggsggggsasdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhek
[0325]
by24.3的轻链氨基酸序列(seq id no:104):
[0326]
eivltqspatlslspgeratlscrasqsvssylawyqqkpgqaprlliydasnratgiparfsgsgsgtdftltisslepedfavyycqqssnwprtfgqgtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec实施例
[0327]
以下结合实施例进一步描述本披露,但这些实施例并非限制着本披露的范围。本披露实施例中未注明具体条件的实验方法,通常按照常规条件,如冷泉港的抗体技术实验手册,分子克隆手册;或按照原料或商品制造厂商所建议的条件。未注明具体来源的试剂,为市场购买的常规试剂。
[0328]
实施例1
[0329]
实施例1-1.抗人pd-1鼠源抗体获得
[0330]
将经前述方法获得的抗人pd-1鼠源抗体进行抗原结合实验,筛选得到多株活性良好的抗体:其中包括m23、m32和m33,将单细胞克隆扩培养,提取rna,利用mouse-ig的简并引物进行反转录扩增(rt-pcr),得到抗体的可变区序列。将该鼠抗体可变区序列与人抗体恒定区序列连接,克隆并重组表达出该鼠单克隆抗体的嵌合抗体,进行体外活性实验,确认所得到的单克隆抗体可变区序列正确。
[0331]
测得鼠源抗体m23、m32和m33的可变区序列如下:
[0332]
鼠源抗体m23的重链可变区(seq id no:4):
[0333]
qvqlqqsgaelvrpgasvtlsckasgytftdyemhwvkqtpihglewiglidpetggtvynqkfkdktiltadkssstaymefrsltsedsavyhctrerfsyygstsdwyfdvwgtgttvtvss。
[0334]
鼠源抗体m23的轻链可变区(seq id no:5):
[0335]
dglmtqtplslpvslgdhasiscrssqslvhsngntylewylqkpgqspklliykvsnrfsgvpdrfsgsgsgtdftlkisrveaedlgiyycfqgshvpytfgggtkleik。
[0336]
鼠源抗体m32的重链可变区(seq id no:6):
[0337]
qvqlqqsgaelvrpgasvtlsckasdftftdyeihwvkqtpvhglewiglfdpetggivynqkfkgkailtadkssntaymefrsltsedsavyyctregynrdwyfdvwgtgttvtvss。
[0338]
鼠源抗体m32的轻链可变区(seq id no:7):
[0339]
dvlmtqtplslpvslgdqasiscrssqsivhsngntylewylqkpgqspklliykvsnrfsgvpdrfsgsgsgtdftlkisrveaedlgiyycfqgshvpyafgggtkleik。
[0340]
鼠源抗体m33的重链可变区:(seq id no:19)
[0341]
kvmlvesggglvkpggslklscaasgftfssyamswvrqtpekrlewvatisgggvdtyyqdnvqgrftisrdnakntlylqmsslrsedtalyycaspyghgyfdvwgtgttvtvss。
[0342]
鼠源抗体m33的轻链可变区:(seq id no:20)
[0343]
diqmtqttsslsaslgdrvtiscrasqdinnflnwyqqkpdgtvklliyytsslhsgvpsrfsgsgsgtdysltisnleqediatyfcqqgntlpwtfgggtkleik。
[0344]
备注:上述抗体的重链可变区和轻链可变区序列中,下划线为kabat编号系统确定的cdr序列,依次为fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4。
[0345]
表4.鼠源抗体m23、m32和m33重链及轻链cdr区序列
[0346][0347]
备注:表中的抗体cdr序列是根据kabat编号系统确定。
[0348]
实施例1-2.抗人pd-1单克隆抗体的人源化
[0349]
通过比对imgt人类抗体重轻链可变区种系基因数据库和moe软件分析,分别挑选与m23,m32,m33的轻重链序列同一性高的人种系重轻链可变区种系基因作为模板,将这3个鼠源抗体的cdr分别移植到相应的人源抗体模板中,分别构建其对应的人源化抗体。
[0350]
1.鼠源抗体m23人源化
[0351]
1.1鼠源抗体m23人源化构架选择
[0352]
鼠源抗体m23的人源化轻链模板为igkv2-40*01和igkj4*01,人源化重链模板为ighv1-69*02和ighj6*01,人源化改造后可变区序列如下(下划线为cdr序列):
[0353]
hu23vh-cdr嫁接:(seq id no:27)
[0354]
evqlvqsgaevkkpgssvkvsckasggtfsdyemhwvrqapgqglewmglidpetggtvynqkfkdrvtitadkststaymelsslrsedtavyycarerfsyygstsdwyfdvwgqgttvtvss
[0355]
hu23vl-cdr嫁接:(seq id no:28)
[0356]
divmtqtplslpvtpgepasiscrssqslvhsngntylewylqkpgqspqlliykvsnrfsgvpdrfsgsgsgtdftlkisrveaedvgvyycfqgshvpytfgggtkveik
[0357]
1.2鼠源抗体m23的人源化模板选择和回复突变设计
[0358]
表5.鼠源抗体m23人源化抗体的回复突变
[0359]
[0360]
注:嫁接(grafted)代表鼠抗体cdr植入人种系fr区序列,氨基酸残基由kabat编号系统确定并注释,如i2g表示依照kabat编号系统,将kabat编号的第2位i突变回g。
[0361]
m23的人源化抗体轻/重链可变区序列如下:
[0362]
》hu23vl1(同hu23vl-cdr嫁接):(seq id no:28)
[0363]
divmtqtplslpvtpgepasiscrssqslvhsngntylewylqkpgqspqlliykvsnrfsgvpdrfsgsgsgtdftlkisrveaedvgvyycfqgshvpytfgggtkveik
[0364]
》hu23vl2(seq id no:29)
[0365]
dgvmtqtplslpvtpgepasiscrssqslvhsngntylewylqkpgqspqlliykvsnrfsgvpdrfsgsgsgtdftlkisrveaedvgvyycfqgshvpytfgggtkveik
[0366]
》hu23vh1(同hu23vh-cdr嫁接):(seq id no:27)
[0367]
evqlvqsgaevkkpgssvkvsckasggtfsdyemhwvrqapgqglewmglidpetggtvynqkfkdrvtitadkststaymelsslrsedtavyycarerfsyygstsdwyfdvwgqgttvtvss
[0368]
》hu23vh2(seq id no:30)
[0369]
evqlvqsgaevkkpgssvkvsckasgytfsdyemhwvrqapgqglewmglidpetggtvynqkfkdrvtltadkststaymelsslrsedtavyycarerfsyygstsdwyfdvwgqgttvtvss
[0370]
》hu23vh3(seq id no:31)
[0371]
evqlvqsgaevkkpgssvkvsckasgytfsdyemhwvrqapgqglewiglidpetggtvynqkfkdrttltadkststaymefsslrsedtavyycarerfsyygstsdwyfdvwgqgttvtvss
[0372]
》hu23vh4(seq id no:32)
[0373]
evqlvqsgaevkkpgssvkvsckasgytfsdyemhwvrqapgqglewiglidpetggtvynqkfkdrttltadkststaymefsslrsedtavyyctrerfsyygstsdwyfdvwgqgttvtvss
[0374]
1.3鼠源抗体m23的人源化序列组合
[0375]
鼠源抗体m23的人源化后获得的抗体及其可变区组合见下表。
[0376]
表6.人源化hu23抗体可变区组合
[0377][0378]
备注:“hu23-1”指代抗体轻链可变区为hu23vl1且重链可变区为hu23vh1的抗体,其它依此类推。
[0379]
上表中所指代的抗体轻/重链可变区组合(例如hu23-1)可以分别与抗体轻/重链恒定区连接形成全长抗体;在本披露中如无明确说明时,形成全长抗体时轻链可变区与seq id no:73所示的kappa链恒定区连接形成抗体轻链,重链可变区与seq id no:72所示的igg4-aa重链恒定区或seq id no:79所示的igg4-p重链恒定区连接形成抗体重链,并以表中指代抗体轻/重链可变区组合的名称(例如hu23-1)加后缀“.igg4aa”表示与igg4-aa重链恒定区连接形成的全长抗体,加后缀“.igg4p”表示与igg4-p重链恒定区连接形成的全长抗体,例如,“hu23-1.igg4aa”表示由hu23vh1重链可变区和如seq id no:72所示的igg4-aa重
链恒定区连接而成的重链,与由hu23vl1轻链可变区和如seq id no:73所示的kappa链恒定区连接而成的轻链形成的全长抗体。“hu23-1.igg4p”表示由hu23vh1重链可变区和如seq id no:79所示的igg4-p重链恒定区连接而成的重链,与由hu23vl1轻链可变区和如seq id no:73所示的kappa链恒定区连接而成的轻链形成的全长抗体。
[0380]
2.鼠源抗体m32人源化
[0381]
2.1鼠源抗体m32人源化构架选择
[0382]
鼠源抗体m32的人源化轻链模板为igkv2-40*01和igkj4*01,人源化重链模板为ighv1-69*02和ighj6*01,人源化可变区序列如下(下划线为cdr序列):
[0383]
hu32vh-cdr嫁接:(seq id no:33)ighv1-69*02和ighj6*01
[0384]
evqlvqsgaevkkpgssvkvsckasggtfsdyeihwvrqapgqglewmglfdpetggivynqkfkgrvtitadkststaymelsslrsedtavyycaregynrdwyfdvwgqgttvtvss
[0385]
hu32vl-cdr嫁接:(seq id no:34)
[0386]
divmtqtplslpvtpgepasiscrssqsivhsngntylewylqkpgqspqlliykvsnrfsgvpdrfsgsgsgtdftlkisrveaedvgvyycfqgshvpyafgggtkveik
[0387]
2.2鼠源抗体m32的人源化模板选择和回复突变设计
[0388]
表7.鼠源抗体m32的人源化抗体的回复突变
[0389][0390]
注:嫁接(grafted)代表鼠抗体cdr植入人种系fr区序列。氨基酸残基由kabat编号系统确定并注释,如i2v表示依照kabat编号系统,将kabat编号的第2位i突变回v。
[0391]
鼠源抗体m32的人源化抗体轻重链可变区序列如下:
[0392]
》hu32vl1(同hu32vl-cdr嫁接):(seq id no:34)
[0393]
divmtqtplslpvtpgepasiscrssqsivhsngntylewylqkpgqspqlliykvsnrfsgvpdrfsgsgsgtdftlkisrveaedvgvyycfqgshvpyafgggtkveik
[0394]
》hu32vl2(seq id no:35)
[0395]
dvvmtqtplslpvtpgepasiscrssqsivhsngntylewylqkpgqspqlliykvsnrfsgvpdrfsgsgsgtdftlkisrveaedvgvyycfqgshvpyafgggtkveik
[0396]
》hu32vh1(同hu32vh-cdr嫁接):(seq id no:33)
[0397]
evqlvqsgaevkkpgssvkvsckasggtfsdyeihwvrqapgqglewmglfdpetggivynqkfkgrvt
no:73所示的kappa链恒定区连接而成的轻链形成的全长抗体。
[0414]
3.鼠源抗体m33人源化
[0415]
3.1鼠源抗体m33人源化构架选择
[0416]
鼠源抗体m33的人源化轻链模板为igkv1-39*01和igkj4*01,人源化重链模板为ighv3-7*01和ighj6*01,人源化可变区序列如下:
[0417]
hu33vh-cdr嫁接(seq id no:41):
[0418]
evqlvesggglvqpggslrlscaasgftfssyamswvrqapgkglewvatisgggvdtyyqdnvqgrftisrdnaknslylqmnslraedtavyycarpyghgyfdvwgqgttvtvss
[0419]
hu33vl-cdr嫁接(seq id no:42):
[0420]
diqmtqspsslsasvgdrvtitcrasqdinnflnwyqqkpgkapklliyytsslhsgvpsrfsgsgsgtdftltisslqpedfatyycqqgntlpwtfgggtkveik
[0421]
3.2鼠源抗体m33的人源化模板选择和回复突变设计
[0422]
表9.鼠源抗体m33人源化抗体的回复突变
[0423][0424]
注:嫁接(grafted)代表鼠抗体cdr植入人种系fr区序列。氨基酸残基由kabat编号系统确定并注释,如f71y表示依照kabat编号系统,将kabat编号的第71位f突变回y。
[0425]
鼠源抗体m33的人源化抗体轻链可变区和重链可变区序列如下:
[0426]
》hu33vl1(同hu33vl-cdr嫁接):(seq id no:42)
[0427]
diqmtqspsslsasvgdrvtitcrasqdinnflnwyqqkpgkapklliyytsslhsgvpsrfsgsgsgtdftltisslqpedfatyycqqgntlpwtfgggtkveik
[0428]
》hu33vl2(seq id no:43)
[0429]
diqmtqspsslsasvgdrvtitcrasqdinnflnwyqqkpgkapklliyytsslhsgvpsrfsgsgsgtdytltisslqpedfatyycqqgntlpwtfgggtkveik
[0430]
》hu33vl3(seq id no:44)
[0431]
diqmtqspsslsasvgdrvtitcrasqdinnflnwyqqkpggavklliyytsslhsgvpsrfsgsgsgtdytltisslqpedfatyycqqgntlpwtfgggtkveik
[0432]
》hu33vh1(同hu33vh-cdr嫁接):(seq id no:41)
[0433]
evqlvesggglvqpggslrlscaasgftfssyamswvrqapgkglewvatisgggvdtyyqdnvqgrftisrdnaknslylqmnslraedtavyycarpyghgyfdvwgqgttvtvss
[0434]
》hu33vh2(seq id no:45)
[0435]
evqlvesggglvqpggslrlscaasgftfssyamswvrqapgkglewvatisgggvdtyyqdnvqgrftisrdnaknslylqmnslraedtavyycaspyghgyfdvwgqgttvtvss
[0436]
》hu33vh3(seq id no:46)
[0437]
kvqlvesggglvqpggslrlscaasgftfssyamswvrqapgkglewvatisgggvdtyyqdnvqgrft
isrdnaknslylqmnslraedtavyycaspyghgyfdvwgqgttvtvss
[0438]
3.3鼠源抗体m33的人源化序列组合
[0439]
表10.人源化抗体hu33轻重链可变区组合
[0440][0441]
备注:表中例如“hu33-6”指代抗体轻链可变区为hu33vl2且重链可变区为hu33vh3的抗体轻/重链可变区组合,其它依此类推。
[0442]
上表中所指代的抗体轻/重链可变区组合(例如hu33-6)可以分别与抗体轻/重链恒定区连接形成全长抗体;在本披露中如无明确说明时,形成全长抗体时轻链可变区与seq id no:73所示的kappa链恒定区连接形成抗体轻链,重链可变区与seq id no:72所示的igg4-aa重链恒定区或seq id no:79所示的igg4-p重链恒定区连接形成抗体重链,并以表中指代抗体轻/重链可变区组合的名称(例如hu33-6)加后缀“.igg4aa”表示与igg4-aa重链恒定区连接形成的全长抗体,加后缀“.igg4p”表示与igg4-p重链恒定区连接形成的全长抗体,例如,“hu33-6.igg4aa”,表示由hu33vh3重链可变区和如seq id no:72所示的igg4-aa重链恒定区连接而成的重链,与由hu33vl2轻链可变区和如seq id no:73所示的kappa链恒定区连接而成的轻链形成的全长抗体。“hu33-6.igg4p”,表示由hu33vh3重链可变区和如seq id no:79所示的igg4-p重链恒定区连接而成的重链,与由hu33vl2轻链可变区和如seq id no:73所示的kappa链恒定区连接而成的轻链形成的全长抗体。
[0443]
4.人源化抗体的突变体
[0444]
4.1hu23人源化抗体的突变抗体
[0445]
通过计算机模拟,对hu23人源化抗体的轻链lcdr1(seq id no:11)的特定位点氨基酸进行定点突变,具体突变见表11:
[0446]
表11.hu23轻链lcdr1的突变序列
[0447][0448][0449]
注:hu23lcdr1(n28q)表示对hu23人源化抗体轻链可变区hu23vl1或hu23vl2的kabat编号规则第28位n突变为q的lcdr1突变序列,hu23lcdr1(g29a)表示对hu23人源化抗体轻链可变区hu23vl1或hu23vl2的kabat编号规则第29位g突变为a的lcdr1突变序列(由kabat编号系统确定cdr)。
[0450]
lcdr1突变后的hu23人源化抗体轻链可变区序列如下:
[0451]
》hu23vl1(n28q)
[0452]
divmtqtplslpvtpgepasiscrssqslvhsqgntylewylqkpgqspqlliykvsnrfsgvpdrfsgsgsgtdftlkisrveaedvgvyycfqgshvpytfgggtkveik(seq id no:53)
[0453]
》hu23vl1(n28l)
[0454]
divmtqtplslpvtpgepasiscrssqslvhslgntylewylqkpgqspqlliykvsnrfsgvpdrfsgsgsgtdftlkisrveaedvgvyycfqgshvpytfgggtkveik(seq id no:54)
[0455]
》hu23vl1(n28t)
[0456]
divmtqtplslpvtpgepasiscrssqslvhstgntylewylqkpgqspqlliykvsnrfsgvpdrfsgsgsgtdftlkisrveaedvgvyycfqgshvpytfgggtkveik(seq id no:55)
[0457]
》hu23vl1(n28d)
[0458]
divmtqtplslpvtpgepasiscrssqslvhsdgntylewylqkpgqspqlliykvsnrfsgvpdrfsgsgsgtdftlkisrveaedvgvyycfqgshvpytfgggtkveik(seq id no:56)
[0459]
》hu23vl1(g29a)
[0460]
divmtqtplslpvtpgepasiscrssqslvhsnantylewylqkpgqspqlliykvsnrfsgvpdrfsgsgsgtdftlkisrveaedvgvyycfqgshvpytfgggtkveik(seq id no:57)
[0461]
》hu23vl1(g29v)
[0462]
divmtqtplslpvtpgepasiscrssqslvhsnvntylewylqkpgqspqlliykvsnrfsgvpdrfsgsgsgtdftlkisrveaedvgvyycfqgshvpytfgggtkveik(seq id no:58)
[0463]
》hu23vl2(n28q)
[0464]
dgvmtqtplslpvtpgepasiscrssqslvhsqgntylewylqkpgqspqlliykvsnrfsgvpdrfsgsgsgtdftlkisrveaedvgvyycfqgshvpytfgggtkveik(seq id no:59)
[0465]
》hu23vl2(n28l)
[0466]
dgvmtqtplslpvtpgepasiscrssqslvhslgntylewylqkpgqspqlliykvsnrfsgvpdrfsgsgsgtdftlkisrveaedvgvyycfqgshvpytfgggtkveik(seq id no:60)
[0467]
》hu23vl2(n28t)
[0468]
dgvmtqtplslpvtpgepasiscrssqslvhstgntylewylqkpgqspqlliykvsnrfsgvpdrfsgsgsgtdftlkisrveaedvgvyycfqgshvpytfgggtkveik(seq id no:61)
[0469]
》hu23vl2(n28d)
[0470]
dgvmtqtplslpvtpgepasiscrssqslvhsdgntylewylqkpgqspqlliykvsnrfsgvpdrfsgsgsgtdftlkisrveaedvgvyycfqgshvpytfgggtkveik(seq id no:62)
[0471]
》hu23vl2(g29a)
[0472]
dgvmtqtplslpvtpgepasiscrssqslvhsnantylewylqkpgqspqlliykvsnrfsgvpdrfsgsgsgtdftlkisrveaedvgvyycfqgshvpytfgggtkveik(seq id no:63)
[0473]
》hu23vl2(g29v)
[0474]
dgvmtqtplslpvtpgepasiscrssqslvhsnvntylewylqkpgqspqlliykvsnrfsgvpdrfsgsgsgtdftlkisrveaedvgvyycfqgshvpytfgggtkveik(seq id no:64)
[0475]
表12.hu23人源化抗体轻/重链可变区组合
[0476][0477]
备注:表中例如“hu23-11”指代抗体轻链可变区为hu23vl1(n28t)且重链可变区为hu23vh1的抗体轻/重链可变区组合,其它依此类推。
[0478]
上表中所指代的抗体轻/重链可变区组合(例如hu23-11)可以分别与抗体轻/重链恒定区连接形成全长抗体;在本披露中如无明确说明时,形成全长抗体时轻链可变区与seq id no:73所示的kappa链恒定区连接形成抗体轻链,重链可变区与seq id no:72所示的igg4-aa重链恒定区或seq id no:79所示的igg4-p重链恒定区连接形成抗体重链,并以表中指代抗体轻/重链可变区组合的名称(例如hu23-11)加后缀“.igg4aa”表示与igg4-aa重链恒定区连接形成的全长抗体,加后缀“.igg4p”表示与igg4-p重链恒定区连接形成的全长抗体,例如,“hu23-11.igg4aa”,表示由hu23vh1重链可变区和如seq id no:72所示的igg4-aa重链恒定区连接而成的重链,与由hu23vl1(n28t)轻链可变区和如seq id no:73所示的kappa链恒定区连接而成的轻链形成的全长抗体。“hu23-11.igg4p”,表示由hu23vh1重链可变区和如seq id no:79所示的igg4-p重链恒定区连接而成的重链,与由hu23vl1(n28t)轻链可变区和如seq id no:73所示的kappa链恒定区连接而成的轻链形成的全长抗体。
[0479]
实验结果显示,hu23lcdr1(n28q)、hu23lcdr1(n28l)、hu23lcdr1(n28t)、hu23lcdr1(n28d)、hu23lcdr1(g29a)、hu23lcdr1(g29v)位点突变后的人源化抗体均保持与pd-1的结合能力(表16)。
[0480]
4.2hu32人源化抗体的突变抗体
[0481]
经序列分析,m23来源的系列人源化抗体hu23和m32来源的系列人源化抗体hu32的序列同一性较高,将hu23轻链可变区和hu32的重链可变区组合成新的轻重链可变区组合。实验结果显示,包含新组合轻重链可变区的人源化抗体均保持与pd-1抗原的结合能力(表16)。
[0482]
表13.hu32和hu23抗体cdr通式
[0483][0484]
表14.hu32重链可变区与hu23轻链可变区的组合
[0485][0486][0487]
备注:表中例如“hu32a-85”指代抗体轻链可变区为hu23vl1(n28t)且重链可变区为hu32vh6的抗体轻/重链可变区组合,其它依此类推。
[0488]
上表中所指代的抗体轻/重链可变区组合(例如hu32a-85)可以分别与抗体轻/重链恒定区连接形成全长抗体;在本披露中如无明确说明时,形成全长抗体时轻链可变区与seq id no:73所示的kappa链恒定区连接形成抗体轻链,重链可变区与seq id no:72所示的igg4-aa重链恒定区或seq id no:79所示的igg4-p重链恒定区连接形成抗体重链,并以表中指代抗体轻/重链可变区组合的名称(例如hu32a-85)加后缀“.igg4aa”表示与igg4-aa
重链恒定区连接形成的全长抗体,加后缀“.igg4p”表示与igg4-p重链恒定区连接形成的全长抗体,例如,“hu32a-85.igg4aa”,表示由hu32vh6重链可变区和如seq id no:72所示的igg4-aa重链恒定区连接而成的重链,与由hu23vl1(n28t)轻链可变区和如seq id no:73所示的kappa链恒定区连接而成的轻链形成的全长抗体。“hu32a-85.igg4p”,表示由hu32vh6重链可变区和如seq id no:79所示的igg4-p重链恒定区连接而成的重链,与由hu23vl1(n28t)轻链可变区和如seq id no:73所示的kappa链恒定区连接而成的轻链形成的全长抗体。
[0489]
表15.hu23重链可变区与hu32轻链可变区的组合
[0490][0491]
备注:表中例如“hu23a-57”指代抗体轻链可变区为hu32vl1且重链可变区为hu23vh1的抗体轻/重链可变区组合,其它依此类推。
[0492]
上表中所指代的抗体轻/重链可变区组合(例如hu23a-57)可以分别与抗体轻/重链恒定区连接形成全长抗体;在本披露中如无明确说明时,形成全长抗体时轻链可变区与seq id no:73所示的kappa链恒定区连接形成抗体轻链,重链可变区与seq id no:72所示的igg4-aa重链恒定区或seq id no:79所示的igg4-p重链恒定区连接形成抗体重链,并以表中指代抗体轻/重链可变区组合的名称(例如hu32a-85)加后缀“.igg4aa”表示与igg4-aa重链恒定区连接形成的全长抗体,加后缀“.igg4p”表示与igg4-p重链恒定区连接形成的全长抗体,例如,“hu23a-57.igg4aa”,表示由hu23vh1重链可变区和如seq id no:72所示的igg4-aa重链恒定区连接而成的重链,与由hu32vl1轻链可变区和如seq id no:73所示的kappa链恒定区连接而成的轻链形成的全长抗体。“hu23a-57.igg4p”,表示由hu23vh1重链可变区和如seq id no:79所示的igg4-p重链恒定区连接而成的重链,与由hu32vl1轻链可变区和如seq id no:73所示的kappa链恒定区连接而成的轻链形成的全长抗体。
[0493]
5.人源化抗体的筛选
[0494]
通过biacore进行不同人源化抗体的亲和力检测(方法参见测试例3),结果见表16,结果显示不同的人源化抗体保持了对于pd-1的结合能力,部分人源化抗体的亲和力甚至和其鼠源抗体基本接近。
[0495]
表16.hu23人源化抗体与人pd-1的亲和力
[0496][0497][0498]
实施例1-3.构建和表达pd-1人源化抗体
[0499]
设计引物pcr搭建各人源化抗体vh/vk基因片段,再与表达载体phr(带信号肽及恒定区基因(ch1-fc/cl)片段)进行同源重组,构建抗体全长表达载体vh-ch1-fc-phr/vk-cl-phr。igg4-p代表s228p(对应于序列seq id no:72或seq id no:79的第108位)突变,igg4-aa代表f234a(对应于序列seq id no:72或seq id no:79的第114位)、l235a(对应于序列
seq id no:72或seq id no:79的第115位)和s228p(对应于序列seq id no:72或seq id no:79的第108位)突变,igg4-aa和igg4-p抗体形式可以通过igg4抗体形式简单点突变获得。
[0500]
igg4-aa重链恒定区序列如下(seq id no:72):
[0501]
astkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeaaggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk
[0502]
抗体的轻链(kappa链)恒定区序列如下(seq id no:73):
[0503]
rtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
[0504]
构建的igg4aa形式全长抗体序列示例性列举如下:
[0505]
hu23-11.igg4aa抗体重链(seq id no:74):
[0506]
evqlvqsgaevkkpgssvkvsckasggtfsdyemhwvrqapgqglewmglidpetggtvynqkfkdrvtitadkststaymelsslrsedtavyycarerfsyygstsdwyfdvwgqgttvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeaaggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk
[0507]
hu23-11.igg4aa轻链(seq id no:75):
[0508]
divmtqtplslpvtpgepasiscrssqslvhstgntylewylqkpgqspqlliykvsnrfsgvpdrfsgsgsgtdftlkisrveaedvgvyycfqgshvpytfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
[0509]
hu32a-85.igg4aa重链(seq id no:76):
[0510]
evqlvqsgaevkkpgssvkvsckasdftftdyeihwvkqapghglewiglfdpetggivynqkfkgkatltadkststaymefsslrsedtavyyctregynrdwyfdvwgqgttvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeaaggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk。
[0511]
hu32a-85.igg4aa的轻链(同hu23-11.igg4aa的轻链,seq id no:75):
[0512]
hu33-6.igg4aa重链(seq id no:77):
[0513]
kvqlvesggglvqpggslrlscaasgftfssyamswvrqapgkglewvatisgggvdtyyqdnvqgrftisrdnaknslylqmnslraedtavyycaspyghgyfdvwgqgttvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeaaggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk
[0514]
hu33-6.igg4aa轻链(seq id no:78):
[0515]
diqmtqspsslsasvgdrvtitcrasqdinnflnwyqqkpgkapklliyytsslhsgvpsrfsgsgsgtdytltisslqpedfatyycqqgntlpwtfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
[0516]
igg4-p的重链恒定区序列如下(seq id no:79):
[0517][0518][0519]
构建的igg4-p形式全长抗体序列示例性列举如下:
[0520]
hu23-11.igg4p抗体重链(seq id no:80):
[0521]
evqlvqsgaevkkpgssvkvsckasggtfsdyemhwvrqapgqglewmglidpetggtvynqkfkdrvtitadkststaymelsslrsedtavyycarerfsyygstsdwyfdvwgqgttvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk
[0522]
hu23-11.igg4p轻链(同hu23-11.igg4aa的轻链,seq id no:75):
[0523]
hu32a-85.igg4p重链(seq id no:81):
[0524]
evqlvqsgaevkkpgssvkvsckasdftftdyeihwvkqapghglewiglfdpetggivynqkfkgkatltadkststaymefsslrsedtavyyctregynrdwyfdvwgqgttvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk
[0525]
hu32a-85.igg4p的轻链(同hu23-11.igg4aa的轻链,seq id no:75):
[0526]
hu33-6.igg4p重链(seq id no:82):
[0527]
kvqlvesggglvqpggslrlscaasgftfssyamswvrqapgkglewvatisgggvdtyyqdnvqgrftisrdnaknslylqmnslraedtavyycaspyghgyfdvwgqgttvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk
[0528]
hu33-6.igg4p轻链(同hu33-6.igg4aa轻链,seq id no:78):
[0529]
diqmtqspsslsasvgdrvtitcrasqdinnflnwyqqkpgkapklliyytsslhsgvpsrfsgsgsgtdytltisslqpedfatyycqqgntlpwtfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakv
qwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
[0530]
测试例1
[0531]
测试例1-1.抗pd-1抗体体外pd-1配体结合和结合阻断elisa实验
[0532]
肿瘤细胞表面的pd-l1通过和t细胞表面的pd-1的结合,从而对t细胞的增殖起到抑制的效果。pd-1的抗体能通过和pd-1的结合,而阻断pd-l1/pd-1的信号通路,进而刺激t细胞的增殖。pd-1/pd-l1的结合阻断实验用于检测抗pd-1抗体对于信号通路的阻断活性。
[0533]
本实验中,将pd-1-his蛋白(cat.#10377h08h,sino biological)包被96孔板后,分别加入待测的抗pd-1抗体(包括抗体:hu23-11.igg4aa、hu32a-85.igg4aa和hu33-6.igg4aa,阳性对照抗体:h005-1(参见wo2015085847中h005-1抗体),进行孵育反应;稍后再加入hrp标记的goat anti-human igg(h+l)抗体(cat.#109-035-003,jackson immunoresearch),孵育反应。洗板后,检测hrp标记的goat anti-human igg(h+l)结合量,计算得到抗pd-1抗体对配体pd-1结合的ec
50
值。
[0534]
本实验中,将胞外区与fc融合的pd-1蛋白(pd-1-fc,序列见seq id no:1)包被96孔板后,分别加入待测的抗pd-1抗体(包括抗体:hu23-11.igg4aa、hu32a-85.igg4aa和hu33-6.igg4aa,阳性对照抗体:h005-1(参见wo2015085847中h005-1抗体),进行孵育反应;稍后再加入生物素标记的pd-l1/pd-l2,孵育反应。洗板后,检测生物素标记的pd-l1/pd-l2结合量,计算得到抗pd-1抗体对配体pd-l1/pd-l2结合阻断的ic
50
值。
[0535]
用ph 9.6cb缓冲液(1.59g na2co3和2.93g nahco3溶于1l蒸馏水)将pd-1-fc稀释至1μg/ml,以100μl/孔的体积加于96孔板中,于4℃放置16h-20h。将96孔板中pbs缓冲液吸掉,用pbst(ph7.4 pbs含0.05%tween20)缓冲液洗板1次后,加入120μl/孔pbst/1%milk,室温孵育1h进行封闭。移去封闭液,用pbst缓冲液洗板1次后,加入90μl用样品稀释液(ph7.4 pbs含5%bsa,0.05%tween20)稀释至合适浓度的待测抗pd-1抗体,置4℃预孵育1h。以10μl/孔的体积加入10
×
浓度的生物素标记pd-l1/pd-l2(北京义翘神州生物技术有限公司)(10μg/ml),在振荡器上振荡、混匀后,置37℃孵育1h。移去反应体系,用pbst洗板6次后,加入100μl/孔用pbst缓冲液1:400稀释的streptavidin
–
peroxidase polymer(链霉亲和素-过氧化物酶聚合物),室温振荡孵育50分钟。用pbst洗板6次后,加入100μl/孔tmb,于室温孵育5-10min。加入100μl/孔1m h2so4终止反应。用酶标仪在450nm处读取吸收值,计算抗pd-1抗体对配体pd-l1/pd-l2结合阻断的ic
50
值。数据详见下表17。
[0536]
表17.本披露的抗pd-1抗体和pd-1结合及对配体pd-l1/pd-l2结合阻断elisa
[0537][0538]
本披露示例性抗pd-1抗体hu23-11.igg4aa、hu32a-85.igg4aa和hu33-6.igg4aa都能够有效阻断pd-1与pd-l1/pd-l2的结合,其阻断活性与阳性对照抗体相似。
[0539]
测试例1-2.示例性抗体的配体阻断试验
[0540]
研究抗体对pd-1与pd-l1结合的阻断作用。实验过程简单描述如下:
[0541]
消化chok1/pd-l1细胞(promega),按照100μl/孔加入到96孔板中,放置于37℃,5%co2培养箱培养24小时。使用pbs稀释对照品和样品至所需浓度。计数jurkat/pd-1细胞(稳转pd-1的jurkat细胞),按一定比例种chok1/pd-l1细胞的细胞培养板中(90μl/孔)同时加入10μl/孔加入稀释后的抗体(抗体:hu23-11.igg4aa、hu32a-85.igg4aa和hu33-6.igg4aa,阳性对照抗体:h005-1),阴性对照igg4蛋白,抗体梯度稀释浓度为0.3mg/ml、3mg/ml、30mg/ml),置于37℃,5%co2培养箱培养5小时。取出细胞培养板,置于室温放置5分钟,然后每孔加入50μl bio-glotmreagent,室温孵育5分钟,读板。实验结果见附图1。
[0542]
结果表明,本披露中示例性的抗pd-1抗体hu23-11.igg4aa、hu32a-85.igg4aa和hu33-6.igg4aa能够有效阻断pd-1与pd-l1的结合。
[0543]
测试例1-3.示例性抗体的biacore抗体亲和力实验
[0544]
用protein a生物传感芯片(cat.#29127556,ge)亲和捕获igg,human pd-1抗原(cat.#10377h08h,sino biological)、cyno pd-1抗原(购自sino biological)流过芯片表面,biacore t200仪器实时检测pd-1抗体和抗原pd-1反应信号获得结合和解离曲线。在每个实验循环解离完成后,用10mm glycine-hcl ph1.5的缓冲液将生物传感芯片洗净再生。实验缓冲体系为1
×
hbs-ep缓冲溶液(cat#br-1001-88,ge)。实验结束后用ge biacore t200 evaluation version 3.0软件以(1:1)langmuir模型拟合数据,得出亲和力数值,结果见表18。
[0545]
表18.抗pd-1抗体与人pd-1和猴pd-1的亲和力
[0546][0547][0548]
结果显示,本披露示例性的抗pd-1抗体hu23-11.igg4aa、hu32a-85.igg4aa和hu33-6.igg4aa均能够与人pd-1和猴pd-1结合。
[0549]
测试例1-4.抗体在pbmc-t淋巴细胞激活实验中对细胞ifnγ的分泌作用
[0550]
为了研究抗pd-1抗体对人原代t淋巴细胞功能的影响,收集和纯化人外周血单核细胞(pbmc),采用结核菌素(tb)体外刺激5天后,检测细胞因子ifnγ分泌水平。实验过程简单描述如下:
[0551]
新鲜血液利用ficoll-hypaque(17-5442-02,ge),密度梯度离心(stem cell technologies)得到pbmc,于rpmi 1640(sh30809.01,ge)培养基中培养,该培养基中添加10%(v/v)fbs(10099-141,gibco),37℃,5%co2条件下培养。
[0552]
新鲜分离纯化的pbmc以rpmi 1640培养基调整密度为2
×
106个/ml,20ml细胞悬液中加入40μl结核菌素(97-8800,synbiotics),37℃,5%co2培养箱培养5天。第5天,收集上述培养的细胞离心,重悬至新鲜的rpmi 1640培养基中,调整密度为1.1
×
106个/ml,接种至
96孔细胞培养板,每孔90μl。同时加入梯度稀释的抗体样品(包括本披露的抗体:hu23-11.igg4aa、hu32a-85.igg4aa和hu33-6.igg4aa,阳性对照抗体h005-1,和阴性对照igg4蛋白,抗体梯度稀释浓度为0.3mg/ml、3mg/ml、30mg/ml),用pbs(b320,上海源培生物科技股份有限公司)稀释,每孔10μl。细胞培养板置于37℃,5%co2培养箱孵育3天。取出细胞培养板,离心(4000rpm,10min)收集细胞培养上清,采用elisa的方法(人ifn-γ检测试剂盒(ehc102g.96,欣博盛),检测ifn-γ的水平。具体操作参考试剂说明书。
[0553]
试验结果见图2,结果表明本披露的抗pd-1抗体hu23-11.igg4aa、hu32a-85.igg4aa、和hu33-6.igg4aa均能有效激活ifn-γ的分泌。
[0554]
测试例1-5.抗pd-1抗体在转基因pd-1小鼠结肠癌模型mc38中的作用
[0555]
将mc38细胞5
×
10*5细胞/小鼠/100μl接种于90只hpd-1tg小鼠(百奥赛图)右肋部皮下,10天后去除肿瘤体积过大过小的动物,按平均肿瘤体积约120mm^3将小鼠随机分为:空白对照vehicle(pbs)、阳性对照h005-1 3mpk、hu32a-85.igg4aa 1mpk、hu32a-85.igg4aa 3mpk、hu23-11.igg4aa 1mpk、hu23-11.igg4aa 3mpk、hu33-6.igg4aa 3mpk共7组,每组8只。day0(第0天)起每周三次腹腔注射各组抗体,第一周给药结束后发现肿瘤被明显抑制,第二、三周调整给药频率为每周一次,共给药5次。每周2次监测肿瘤体积、动物重量并记录数据。当肿瘤体积超过2000mm3或多数肿瘤出现破溃或体重下降20%时,将荷瘤动物进行安乐死作为实验终点。
[0556]
肿瘤体积(tv)=1/2
×
l
长
×
l
短2
[0557]
肿瘤增殖率(t/c%)=(t-t0)/(c-c0)
×
100%
[0558]
抑瘤率(tgi%)=1-t/c%
[0559]
其中,t、t0分别表示抗体给药组试验结束和试验开始时的肿瘤体积,c、c0分别表示空白对照组试验结束和试验开始时的肿瘤体积。
[0560]
试验结果见表19和附图3,试验结果表明,与空白对照相比,本披露的抗体均能显著抑制小鼠结肠癌mc38移植瘤的生长,其中抑瘤率最高的是hu32a-85.igg4aa-3mpk组,末次测量时抑瘤率为77.64%。当给药频率为一周三次给药3次,在第七天检测时,结果显示本披露的抗体的抑瘤率均明显优于阳性对照抗体h005-1;其后给药频率降为一周一次,给药2次后(day21),本披露的抗体间药效逐渐拉开差距,且表现出剂量依赖性,其中hu32a-85.igg4aa明显优于同等剂量的h005-1(p<0.05)。而且荷瘤小鼠对抗pd-1抗体均能很好耐受,在整个给药过程中体重平稳上升,无明显药物致体重减轻等症状发生。
[0561]
表19.抗pd-1抗体对小鼠结肠癌mc38的抑瘤率影响(mm3)
[0562][0563]
测试例1-6.抗pd-1抗体在转基因pd-1小鼠结肠癌模型mc38中的作用
[0564]
转基因pd-1小鼠来源于购买的转基因pd-1小鼠(isis innovation limited,university offices,wellington square,oxford ox1 2jd,england)在cephrim biosciences,inc.培育的第五代小鼠。将mc38细胞以5
×
105个/100μl/只接种到hpd-1转基因小鼠(雌雄各半)右肋后部皮下,待小鼠平均肿瘤体积达到80-100mm3之间时,去除体重、肿瘤过大和过小的动物,按照肿瘤体积大小将荷瘤小鼠随机分为5组(每组8只):阴性对照
higg control 30mpk、h005-1 10mpk、h005-1 30mpk、hu33-6.igg4aa 10mpk、hu33-6.igg4aa 30mpk。分组给药日期设定为day 0。分组后腹腔给予各药物,给药周期22天,每两天给药一次,共11次。每周测2次瘤体积,称体重,记录数据。各组动物体重、肿瘤体积均用平均值
±
标准差(mean
±
sem)表示,并用graphpad prism 5和excel软件作图,使用student t test统计分析。
[0565]
肿瘤体积(tv)=0.5236
×
l
长
×
l
短2
[0566]
肿瘤增殖率t/c%=(t-t0)/(c-c0)
×
100%
[0567]
抑瘤率%tgi=1-t/c%
[0568]
其中,t、t0分别表示抗体给药组试验结束和试验开始时的肿瘤体积,c、c0分别表示空白对照组试验结束和试验开始时的肿瘤体积。
[0569]
试验结果见表20和附图4所示,试验结果表明,与对照组相比,本披露的抗体能显著抑制小鼠结肠癌mc38移植瘤的生长,其中抑瘤率最高的是hu33-6.igg4aa 30mpk组,第20天测量时抑瘤率为80.4%。在低剂量组(10mpk),hu33-6.igg4aa-10mpk的药效好于阳性对照h005-1-10mpk。
[0570]
表20.抗pd-1抗体对小鼠结肠癌mc38肿瘤体积影响
[0571][0572]
备注:表中各组肿瘤平均体积的单位为:mm3。
[0573]
实施例2
[0574]
实施例2-1.构建和表达pd-1-vegf双特异性抗体
[0575]
双特异性抗体的构建基于hu23-11和lucentis的序列,通过不同的连接子长度构建不同形式的双特异性抗体。基于以下的序列合成不同的重链和轻链的基因片段,将重链基因和轻链基因分别克隆到真核生物表达载体上形成重链质粒和轻链质粒。然后将所述表达载体导入到真核生物中以表达所述具有两条相同重链和两条相同轻链的双特异性抗体,将培养后的上清用mabselect sure亲和柱进行纯化,获得表达产物。本披露中的双特异性抗体的重链和轻链的氨基酸序列如下:
[0576]
dvd-gs8
[0577]
》dvd-gs8的重链氨基酸序列(seq id no:105):
[0578][0579]
》dvd-gs8的轻链氨基酸序列(seq id no:106):
[0580][0581][0582]
dvd-gs10
[0583]
》dvd-gs10的重链氨基酸序列(seq id no:107):
[0584][0585]
》dvd-gs10的轻链氨基酸序列(seq id no:108):
[0586][0587]
dvd-h19l14
[0588]
》dvd-h19l14的重链氨基酸序列(seq id no:109):
[0589][0590]
》dvd-h19l14的轻链氨基酸序列(seq id no:110):
[0591][0592][0593]
dvd-h21l14
[0594]
》dvd-h21l14的重链氨基酸序列(seq id no:111):
[0595][0596]
》dvd-h21l14的轻链氨基酸序列(seq id no:110):
[0597]
[0598]
dvd-gs14
[0599]
》dvd-gs14的重链氨基酸序列(seq id no:112):
[0600][0601]
》dvd-gs14的轻链氨基酸序列(seq id no:110):
[0602][0603][0604]
dvd-gs19
[0605]
》dvd-gs19的重链氨基酸序列(seq id no:109):
[0606][0607]
》dvd-gs19的轻链氨基酸序列(seq id no:113):
[0608][0609]
dvd-h24l19
[0610]
》dvd-h24l19的重链氨基酸序列(seq id no:114):
[0611][0612]
》dvd-h24l19的轻链氨基酸序列(seq id no:113):
[0613][0614][0615]
igg-gs10-scfv
[0616]
》igg-gs10-scfv的重链氨基酸序列(seq id no:115):
[0617][0618]
》igg-gs10-scfv的轻链氨基酸序列(seq id no:75):igg-gs13-scfv
[0619]
》igg-gs13-scfv的重链氨基酸序列(seq id no:116):
[0620][0621]
》igg-gs13-scfv的轻链氨基酸序列(seq id no:75):igg-gs19-scfv
[0622]
》igg-gs19-scfv的重链氨基酸序列(seq id no:117):
[0623]
[0624][0625]
》igg-gs19-scfv的轻链氨基酸序列(seq id no:75):
[0626]
4-4-dvd
[0627]
》4-4-dvd的重链氨基酸序列(seq id no:135):
[0628][0629]
》4-4-dvd的轻链氨基酸序列(seq id no:136):
[0630][0631]
(备注:单下划线表示可变区,斜体表示连接部分(linker))
[0632]
其中,dvd-gs8、dvd-gs10、dvd-h19l14、dvd-h21l14、dvd-gs14、dvd-gs19、dvd-h24l19、4-4-dvd的结构如图9a所示;igg-gs10-scfv、igg-gs13-scfv、igg-gs19-scfv的结构如图9b所示。
[0633]
实施例2-2.构建和表达pd-1-vegftrap抗体融合蛋白
[0634]
抗体融合蛋白的构建基于hu23-11和vegftrap突变体的序列,通过不同的连接子长度构建不同形式的抗体融合蛋白。基于以下的序列合成不同的重链和轻链的基因片段,将重链基因和轻链基因分别克隆到真核生物表达载体上形成重链质粒和轻链质粒。然后将所述表达载体导入到真核生物中以表达所述具有两条相同重链和两条相同轻链的抗体融合蛋白,将培养后的上清用mabselect sure亲和柱进行纯化,获得表达产物。本披露中的抗体融合蛋白的重链和轻链的氨基酸序列如下:
[0635]
hu23-2te
[0636]
》hu23-2te的重链氨基酸序列(seq id no:118):
[0637]
》hu23-2te的轻链氨基酸序列(seq id no:75)
[0638]
hu23-3st
[0639]
》hu23-3st的重链氨基酸序列(seq id no:119):
[0640]
》hu23-3st的轻链氨基酸序列(seq id no:75)
[0641]
hu23-5lk
[0642]
》hu23-5lk的重链氨基酸序列(seq id no:120):
[0643]
[0644][0645]
》hu23-5lk的轻链氨基酸序列(seq id no:75)3-6
[0646]
》3-6的重链氨基酸序列(seq id no:121):
[0647][0648]
》3-6的轻链氨基酸序列(seq id no:75)
[0649]
3-12
[0650]
》3-12的重链氨基酸序列(seq id no:122):
[0651][0652]
》3-12的轻链氨基酸序列(seq id no:75)
[0653]
6-37
[0654]
》6-37的重链氨基酸序列(seq id no:123):
[0655]
[0656][0657]
》6-37的轻链氨基酸序列(seq id no:75)#2
[0658]
》#2的重链氨基酸序列(seq id no:124):
[0659][0660]
》#2的轻链氨基酸序列(seq id no:75)
[0661]
#3
[0662]
》#3的重链氨基酸序列(seq id no:125):
[0663][0664]
》#3的轻链氨基酸序列(seq id no:75)
[0665]
#5
[0666]
》#5的重链氨基酸序列(seq id no:126):
[0667][0668]
》#5的轻链氨基酸序列(seq id no:75)
[0669]
hu33-v6
[0670]
》hu33-v6的重链氨基酸序列(seq id no:137):
[0671][0672]
》hu33-v6的轻链氨基酸序列(seq id no:78)hu23-v6
[0673]
》hu23-v6的重链氨基酸序列(seq id no:138):
[0674]
[0675]
》hu23-v6的轻链氨基酸序列(seq id no:75)
[0676]
hu33-wt
[0677]
》hu33-wt的重链氨基酸序列(seq id no:139):
[0678][0679]
》hu33-wt的轻链氨基酸序列(seq id no:78)
[0680]
hu23-wt
[0681]
》hu23-wt的重链氨基酸序列(seq id no:140):
[0682][0683]
》hu23-wt的轻链氨基酸序列(seq id no:75)
[0684]
(备注:单下划线表示可变区,斜体表示连接部分(linker),双下划线表示vegftrap)
[0685]
其中,hu23-2te、hu23-3st、hu23-5lk、3-6、3-12、6-37、hu33-v6、hu23-v6、hu33-wt和hu23-wt的结构如图9c所示;#2、#3、#5的结构如图9d所示。
[0686]
测试例2
[0687]
测试例2-1.双特异性抗体和抗体融合蛋白的配体阻断试验
[0688]
表21实验试剂与材料
[0689]
试剂或材料名称货号生产商pd-1/pd-l1 blockade bioassayj1250promega
rpmi medium164022400-089gibcof-12nutrient mixture(ham)11765-054gibcohygromycin b10687-010invitrogenantibiotic g-418sulfate solutionv8091promegabio-glotm luciferase assay systemg7940或g7941promegafbs 10099-14110099-141gibcogloresponsetm nfat-luc2/pd1 jurkatcs187102promegapd-l1+cho-k1cs187108promega
[0690]
消化cho-k1/pd-l1细胞,最后使用f-12nutrient mixture(ham)完全培养基重悬细胞,根据细胞计数结果使用完全培养基调整细胞密度至4
×
105个/ml,将细胞悬液转移至加样槽中,使用多道移液器按照100μl/孔加入到96孔板(corning#3903)中,放置于37℃,5%co2培养箱培养20~24h。同时根据对照品和样品的浓度,使用pbs稀释至300μg/ml,10倍梯度稀释,共3个浓度点,每个浓度设置2复孔,同时设置只加分析培养基的空白孔。1000rpm离心5mins,收集jurkat/pd1细胞悬液,根据细胞计数结果使用分析培养基重悬细胞,并调整细胞密度至5.5
×
105个/ml或者1.25
×
106个/ml。将加入cho-k1/pd-l1细胞的细胞培养板从培养箱中取出,使用多道移液器每孔取出95μl培养液,将jurkat/pd1细胞悬液(5.5
×
105个/ml)转移至加样槽中,以90μl/孔加入到细胞培养板中,然后按照10μl/孔加入稀释后的对照品和样品,置于37℃,5%co2培养箱培养5~6h。将bio-glotmreagent取出使其温度恢复至室温,每孔加入50μl bio-glotmreagent,,5~10min后用victor3读板。用graphpad软件处理数据。
[0691]
结果见图5。配体阻断实验证明,双特异性抗体dvd-h19l14、dvd-h24l19、dvd-h21l14、dvd-gs14、dvd-gs19和抗体融合蛋白3-6、6-37、#2、#3、#5都能够阻断pd-1与pd-l1的结合,其阻断活性与对照抗体hu23-11.igg4aa相似。
[0692]
测试例2-2.双特异性抗体和抗体融合蛋白的biacore抗体亲和力实验
[0693]
用protein a生物传感芯片(cat.#29127556,ge)亲和捕获igg,然后于芯片表面流经抗原。试验在hbs-ep+10x缓冲溶液(cat#br-1001-88,ge)中进行,用biacore t200仪器实时检测双特异性抗体和抗体融合蛋白和抗原反应信号获得结合和解离曲线。在每个实验循环解离完成后,用10mm glycine-hcl(ph1.5)将生物传感芯片洗净再生。数据拟合模型采用1:1模型。
[0694]
抗原分子样品来源如下:
[0695]
human vegfa165(19.2kda,cat#11066-hnah,lot.#lc11de0604,s.b)
[0696]
mouse vegfa164(19.4kda,cat#5109-mnab,lot.#lc12oc2306,s.b)
[0697]
human vegfb(20.3kda,cat.#ve6-h5225,lot.#675-78af1-jx,acro)
[0698]
human pd1(17.4kda,cat.#10377-h08h,lot.#lc13au2111,s.b)
[0699]
cyno pd1(17.4kda,cat.#pd1-c5223,lot.#643-7ctf1-us,s.b)
[0700]
human pigf(14.9kda,cat#10274-hnae1,lot.#lc13se0205,s.b)
[0701]
mouse pigf(16.6kda,cat#50125-ncch,lot.#lc08ma2905,s.b)
[0702]
表22:双特异性抗原结合分子与pd-1蛋白结合的亲和力
[0703][0704]
表23-1:双特异性抗原结合分子与人vegfa165和鼠vegf164蛋白结合的反应亲和力
[0705][0706]
表23-2:双特异性抗原结合分子与人vegfa165,人vegfb和鼠的vegf164蛋白结合的反应亲和力
[0707]
分子hvegfa165 kd(m)hvegfb kd(m)mvegf164 kd(m)hu23-v62.48e-114.00e-111.25e-11hu23-wt8.43e-123.40e-117.10e-12hu33-v61.11e-112.01e-113.05e-12hu33-wt7.28e-122.96e-111.46e-12
[0708]
所有的双特异性抗体和抗体融合蛋白都能够结合人pd-1和猴pd-1,亲和力和pd-1对照抗体hu23-11.igg4aa相当,高于对照双特异性抗体vp101和对照抗体融合蛋白by24.3。
所有的双特异性抗体和融合蛋白都能够结合人的vegfa165,亲和力和对照抗体lucentis,对照双特异性抗体vp101相当。抗体融合蛋白都能够结合人的vegfab和鼠vegfa164,其中hu23-3st和hu23-5lk和人的vegfa165的亲和力略高于对照抗体融合蛋白by24.3。其中抗体融合蛋白(3-12,#3)和鼠vegfa164的亲和力和对照抗体融合蛋白by24.3相当。
[0709]
测试例2-3.双特异性抗体和抗体融合蛋白在pbmc-t淋巴细胞激活实验中对细胞ifnγ的分泌作用
[0710]
为了研究双特异性抗体和抗体融合蛋白对人原代t淋巴细胞功能的影响,收集和纯化人外周血单核细胞(pbmc,4个供体),采用结核菌素(tb)体外刺激5天后,检测细胞因子ifnγ分泌水平。实验过程描述如下:
[0711]
新鲜血液利用ficoll-hypaque(17-5442-02,ge),密度梯度离心(stem cell technologies)得到pbmc,于rpmi 1640(sh30809.01,ge)培养基中培养,该培养基中添加10%(v/v)fbs(10099-141,gibco),37℃,5%co2条件下培养。
[0712]
新鲜分离纯化的pbmc以rpmi 1640培养基调整密度为2
×
106个/ml,20ml细胞悬液中加入40μl结核菌素(97-8800,synbiotics),37℃,5%co2培养箱培养5天。第5天,收集上述培养的细胞离心,重悬至新鲜的rpmi 1640培养基中,调整密度为1.1
×
106个/ml,接种至96孔细胞培养板,每孔90μl。同时加入梯度稀释的抗体样品,用pbs(b320,上海源培生物科技股份有限公司)稀释,每孔10μl。细胞培养板置于37℃,5%co2培养箱孵育3天。取出细胞培养板,离心(4000rpm,10min)收集细胞培养上清,采用elisa的方法(人ifn-γ检测试剂盒(ehc102g.96,欣博盛)),检测ifn-γ的水平。具体操作参考试剂说明书。
[0713]
结果(见图6)显示,在4个供体的实验中,所有双特异性抗体和抗体融合蛋白都可以激活pbmc分泌ifn-γ。在供体2中(如图6b),dvd-gs14激活pbmc分泌ifn-γ的活性高于对照抗体hu23-11.igg4aa。
[0714]
测试例2-4.双特异性抗体和抗体融合蛋白抑制vegfa诱导的huvec细胞磷酸化实验
[0715]
表24实验仪器与材料
[0716][0717]
huvec细胞培养在huvec完全的培养基(huvec基础培养基+添加剂+10%fbs)中,一周传代2~3次,传代比例1:3或1:6。传代时,吸掉培养基,用5ml0.25%的胰酶冲洗细胞层,然后吸掉胰酶,将细胞放在培养箱中消化3~5分钟,终止消化,离心1500rpm,5min,弃上清,加入新鲜培养基重悬细胞。
[0718]
用细胞计数仪计数后,将细胞悬液调整密度为1.2
×
105细胞/ml,1ml/孔铺于12孔板,每孔细胞数为120000个。将培养板在培养箱培养24小时(37℃,5%co2)。取细胞培养板,弃去培养基,用pbs洗一遍,更换成含0.5%bsa的huvec基础培养基900μl/孔,在室温孵育25min。用pbs稀释待测样品至2000nm(20
×
浓度),10倍稀释3个浓度,分别为2000nm、200nm和20nm。取60μl样品加入60μl的vegf165(20nm)1:1混合成10
×
样品浓度。每孔100μl加入到细胞培养板中。将细胞培养板在室温孵育15min。弃去培养液,用4℃预冷的pbs洗一遍。配制1
×
的lysis buffer:用预冷至4℃的双蒸水将phospho-total protein lysis buffer稀释4倍,然后加入1/100体积的blocking reagent,混匀。加入1
×
的lysis buffer,120μl/孔,室温孵育30分钟。每孔取100μl细胞裂解液加入elisa孔中4℃孵育过夜,根据phospho-vegfr-2(tyr1175)sandwich elisa kit说明书进行实验。
[0719]
结果(见图7,其中的igg4表示对照分子c25-igg4)显示,所有双特异性抗体和抗体融合蛋白都可以抑制vegfa诱导的huvec细胞磷酸化,并且成剂量相关性。其中抗体融合蛋白(hu23-5lk)在低浓度下的抑制活性好于对照融合蛋白vegftrap-fc(图7e)。dvd-gs14在高浓度下的抑制活性好于dvd-gs8,dvd-gs10和dvd-gs19(图7f)。
[0720]
测试例2-5.人pbmc重建的小鼠mda-mb-231模型的药效实验
[0721]
本测试例利用人pbmc重建的nod-scid小鼠(北京维通利华实验动物有限公司)mda-mb-231模型来评价本披露测试pd1-vegftrap融合蛋白在小鼠体内的抗肿瘤疗效。
[0722]
(a)将mda-mb-231细胞(3
×
106个细胞/只/200μl,含100μl matrigel)接种于雌性nod-scid小鼠右肋部皮下,当荷瘤小鼠肿瘤体积达到240mm3左右时将小鼠随机分组,每组7只,将分组当天定义为该实验day0,并于当天将用hcd3抗体刺激4天的pbmcs以5
×
105细胞/100μl/只进行小鼠瘤内注射,剩余pbmcs停止刺激并继续培养一周后,按5
×
106细胞/100μl/只进行小鼠腹腔注射,此为第一轮注射。再一周后如此进行第二轮注射。分组当日开始腹腔注射各抗体,每周3次,共给药3周,每周2次监测肿瘤体积、动物重量并记录数据。
[0723]
结果(见图8a)显示pd-1抗体hu23-11.igg4aa-10mpk和vegftrap-fc-6.4mpk在day22时相同摩尔剂量下的抑瘤率分别为19.58%和27.80%(p《0.05)。
[0724]
融合蛋白6-37-13mpk和#3-12.9mpk在day22时的抑瘤率分别为38.87%(p《0.01)和37.21%(p《0.01),均优于同等摩尔剂量的pd-1对照抗体和vegftrap-fc对照融合蛋白。
[0725]
(b)本实验(b)在荷瘤小鼠肿瘤体积达到150mm3左右时进行随机分组,其余步骤与实验(a)相同。
[0726]
结果(见图8b)显示pd-1抗体hu23-11.igg4aa-10mpk和vegftrap-fc-7mpk在day28时相同摩尔剂量下的抑瘤率分别为12.59%和14.00%,与溶剂对照组相比没有显著性差异。
[0727]
抗体融合蛋白hu23-5lk体内抑瘤效果呈现剂量依赖效应,在day28时13.2mpk和4mpk剂量下的抑瘤率分别为44.43%(p《0.001)和35.65%(p《0.05),均优于相同摩尔剂量下pd-1对照抗体和vegftrap-fc对照融合蛋白。
[0728]
抗体融合蛋白hu23-5lk-13.2mpk,hu23-3st-13.2mpk和3-12-13.2mpk在day28时的抑瘤率分别为44.43%(p《0.01),38.93%(p《0.01)和28.81%(p《0.05),均优于同等摩尔剂量的pd-1对照抗体和vegftrap-fc对照融合蛋白。
[0729]
测试例2-6.人pbmc重建的小鼠mda-mb-231模型的药效实验
[0730]
本测试例利用人pbmc重建的nod-scid小鼠(北京维通利华实验动物有限公司)mda-mb-231模型来评价本发明测试pd1-vegf双特异性抗体在小鼠体内的抗肿瘤疗效。
[0731]
将处于对数生长期的mda-231细胞3
×
106个细胞/只/200μl(含100μl matrigel)接种于80只雌性nod-scid小鼠右肋部皮下,当荷瘤小鼠肿瘤体积达到190mm3左右时,去除肿瘤体积过大、过小或体重<18g的,随机分组:pbs、dvd-gs14 4/13mpk、dvd-gs19 13mpk、dvd-gs24 13mpk、vp-101 13mpk、hu23-11.igg4aa 10mpk。将分组当天定义为该实验day0,day0时将经cd3抗体刺激3天的两名志愿者的pbmcs以1:1比例混合,以5
×
105个细胞/100μl/只注射到小鼠肿瘤组织中,剩余的pbmcs停止刺激并继续培养,1周后以5
×
106个细胞/100μl/只腹腔注射到荷瘤鼠体内,视为第1轮注射,至实验结束共注射两轮pbmcs。day0开始每周二次腹腔注射各抗体,共给药9次(表1)。每周2次监测肿瘤体积、动物重量并记录数据。当肿瘤体积超过1000mm3或多数肿瘤出现破溃或体重下降20%时,将荷瘤动物进行安乐死作为实验终点。
[0732]
实验结果见表25,本次实验pd1-vegf双特异性抗体dvd-gs14、dvd-gs19、dvd-gs24均能明显抑制人乳腺癌mda-mb-231小鼠皮下移植瘤的生长,3个抗体的药效基本相当,在实验终点时的抑瘤率分别为70.60%(dvd-gs24-13mpk)、67.90%(dvd-gs19-13mpk)、67.08%(dvd-gs14-13mpk)和57.98%(dvd-gs14-4mpk),且都与等摩尔剂量的pd-1单抗对照hu23-11.igg4aa(10mpk,tgi=13.18%)存在极显著性差异,较优于同剂量的阳性抗体vp-101
(13mpk,tgi=63.12%)。
[0733]
表25.双特异性抗原结合分子对人乳腺癌细胞mda-mb-231移植瘤的疗效
[0734][0735]
***p<0.001
[0736]
测试例2-7pd1-vegf抗体对u87mg+pbmc移植瘤裸鼠体内疗效实验
[0737]
向nod-scid鼠右肋部皮下接种u87mg细胞(1.5
×
106个/只),当天注射pbmc,腹腔注射,4
×
106个/只。6月19日,第二次腹腔注射pbmc,4
×
106个/只。8天后分组,7只/组,共9组。分组当天平均每组肿瘤体积为79.26mm3。day0开始每周二次腹腔注射各抗体,共给药9次。每周2次监测肿瘤体积、动物重量并记录数据。
[0738]
实验结果见表26,本次实验腹腔注射给药8次,观察至day29。同摩尔剂量相比较,本披露的三个双功能分子在肿瘤生长抑制上均优于对照分子vp-101(3mpk)。给药过程中各组动物体重均无明显下降,提示受试药物无明显毒副作用。
[0739]
表26.双特异性抗原结合分子对u87mg+pbmc移植瘤的疗效
[0740][0741][0742]
虽然为了清楚的理解,已经借助于附图和实例详细描述了上述发明,但是描述和实例不应当解释为限制本披露的范围。本文中引用的所有专利和科学文献的公开内容通过引用完整地清楚结合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1