巴氏杆菌噬菌体培养基及培养方法与流程
1.本发明涉及噬菌体培养技术领域,尤其涉及巴氏杆菌噬菌体培养基及培养方法。
背景技术:
2.巴氏杆菌病(pasteurellosis):由多杀性巴氏杆菌引起的以出血性败血症或传染性肺炎为主要症状的人或动物传染病;人巴氏杆菌病通常呈现皮肤和软组织感染,引起人的急性或慢性呼吸道疾病。动物巴氏杆菌病常以败血症和出血性炎症为主要特征,生猪养殖场巴氏杆菌常引起肺炎或萎缩性鼻炎,造成重大经济损失。
3.目前,巴氏杆菌感染的防治仍主要依赖于抗生素,例如头孢类、青霉素类抗生素,链霉素、四环素和磺胺类药物也有一定的疗效。但随着抗生素的大规模使用,巴氏杆菌对抗生素的耐药性越来越明显。在全球限抗、禁抗的大背景下,对巴氏杆菌感染引起疾病的防治,仍亟待研发新的方法。
4.近年来,研究表明巴氏杆菌噬菌体可以特异性裂解巴氏杆菌,从而起到消灭病原阻断巴氏杆菌相关疾病传播的作用。但若要将巴氏杆菌噬菌体应用于巴氏杆菌感染导致疾病的治疗中,则需要大量的巴氏杆菌噬菌体。而噬菌体属于病毒,其培养宿主为细菌,且不同噬菌体的生长特性差异较大,很难针对不同噬菌体采用同一方法进行高密度培养。
5.目前,对巴氏杆菌噬菌体,特别是多杀性巴氏杆菌噬菌体的培养技术仍存在缺陷,无法实现巴氏杆菌噬菌体的高密度培养。
技术实现要素:
6.有鉴于此,本发明要解决的技术问题在于提供巴氏杆菌噬菌体培养基及巴氏杆菌噬菌体的高密度培养方法。
7.本发明提供的培养基包括水和:胰蛋白胨10~15g/l,酵母浸粉10~20g/l,氯化钠3~7g/l,磷酸氢二钾0.1~0.3g/l,硫酸镁0.01~0.1g/l。
8.一些具体实施例中,所述培养基包括水和:胰蛋白胨12g/l,酵母浸粉15g/l,氯化钠5g/l,磷酸氢二钾0.25g/l,硫酸镁0.05g/l。
9.一些实施例中,所述巴氏杆菌为多杀性巴氏杆菌。具体的,所述巴氏杆菌为为分离自猪的多杀性巴氏杆菌。
10.本发明所述的培养基在巴氏杆菌噬菌体和/或巴氏杆菌培养中的应用。
11.本发明中,所述巴氏杆菌噬菌体为分离自猪的多杀性巴氏杆菌噬菌体。
12.本发明提供了一种巴氏杆菌噬菌体的培养方法,其将巴氏杆菌和巴氏杆菌噬菌体接种于本发明所述的培养基,然后进行培养。
13.本发明提供的培养方法中,先接入巴氏杆菌,待培养至od值为1.5~2.0接入巴氏杆菌噬菌体。所述巴氏杆菌的接种密度为4
×
10
10
cfu。
14.接入巴氏杆菌噬菌体时,所述巴氏杆菌和巴氏杆菌噬菌体的数量比为1:10000。
15.所述培养的条件包括:接入噬菌体后,静置30min,然后在37℃、ph7.2条件下培养7
~10h。
16.本发明中,所述巴氏杆菌为分离自猪的多杀性巴氏杆菌;
17.所述巴氏杆菌噬菌体为分离自猪的多杀性巴氏杆菌噬菌体。
18.本发明所述培养方法培养获得的巴氏杆菌噬菌体培养液。
19.本发明还提供了一种治疗巴氏杆菌病的药物,其由所述的巴氏杆菌噬菌体培养液制得。
20.所述治疗巴氏杆菌病的药物的制备方法包括:将培养获得的巴氏噬菌体菌液,经过0.45微米和0.22微米两级微滤得到高密度巴氏杆菌噬菌体制剂。
21.本发明还提供了一种治疗巴氏杆菌病的方法,其为给予本发明所述的药物。
22.本发明提供的培养基包括水和:胰蛋白胨,酵母浸粉,氯化钠,磷酸氢二钾,硫酸镁。该培养基能够实现对巴氏杆菌噬菌体的大规模、高密度培养。实验表明,相对于其他组分组成的培养基,本发明提供的培养基能够更有效的培养巴氏杆菌噬菌体,获得更高的放罐效价。
具体实施方式
23.本发明提供了巴氏杆菌噬菌体培养基及培养方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
24.本发明采用的试材皆为普通市售品,皆可于市场购得。其中,巴氏杆菌噬菌体和巴氏杆菌皆来自牧原公司兽医部研发中心。所述酵母浸粉为安琪酵母浸粉。下面结合实施例,进一步阐述本发明:
25.实施例1
26.1、种子液制备:
27.巴氏杆菌种子液制备:将巴氏杆菌菌株划线接种于tsa(胰蛋白胨大豆琼脂)固体平板,37℃培养24h,然后挑单菌落转接入tsb(tryptone soya broth)培养基摇瓶中于37℃、140rpm摇床振荡培养12h得到纯培养种子菌液。
28.巴氏杆菌噬菌体种子制备:将10微升巴氏杆菌噬菌体液体均匀涂布于tsa双层平板于37℃培养24h,待平板表面出现噬菌斑后将噬菌斑刮下,用无菌tsb洗下,采用0.22微米滤膜过滤除菌。
29.噬双层平板制备过程及噬菌体效价检测方法:
30.①
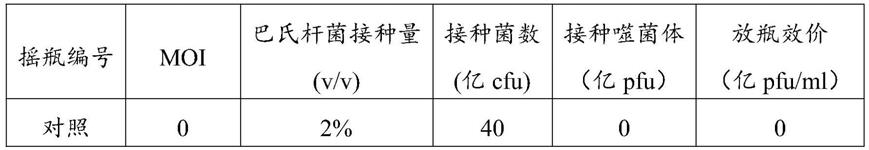
底层平板制备:在无菌操作台内,待tsa培养基冷却至40
‑
50℃左右,以不烫手为宜,将灭菌过的培养皿放在火焰旁的桌面上,右手拿装有培养基的蜀牛瓶,左手旋出瓶盖。右手拿蜀牛瓶,使瓶口迅速通过火焰2
‑
3次;在酒精灯火焰旁,用左手将培养皿打开一条稍大于瓶口的缝隙,右手将蜀牛瓶中的培养基(约15~20ml)倒入培养皿,左手立即盖上培养皿的皿盖,正置放于无菌操作台内;手不经过培养皿上方将皿盖打开,等待平板冷却凝固(10
‑
15min)后,旋转平板,使皿盖在下,皿底在上,放于冰箱4℃保存。
31.②
上层平板制备:取一系列试管,分别添加8ml培养基(含有0.9%琼脂的tsb培养
基,温度在50℃左右为宜,禁止凝固);各试管中500ul的菌液与马血清(温度把控40℃左右防止凝固,以不烫手为宜,忌温度过高影响血清效果、烫死细菌)摇匀试管内液体,均匀涂布于配置好的tsa平板培养基上(边倒入边摇动平板使其迅速铺展表面);待平板晾干后,划分区域并标记。
32.③
编号:取制备好的双层平皿4套,用记号笔标明样品信息及做样日期,另取8支无菌1.5ml离心管排列于试管架上,加入0.9ml生理盐水并标明梯度
33.④
稀释:准备好标准样品及需要检测的样品(如果为未除菌的的则需要用0.22um针头滤器进行过滤),将待测噬菌体样品及标准样品以10倍比例稀释8个梯度。取一系列1.5ml离心管(标注梯度),分别加入0.9ml无菌生理盐水于离心管中,将待测样品放在振荡器上振荡1min,确保样品完全混匀,10
‑
1离心管中加入过的待检测噬菌体原液0.1ml,注意加液时枪头不要接触液面,确保枪头内壁无菌液残留。震荡混匀1min,另取枪头,在液面下吸入菌液,吸时深入管底,吹时离开液面,在离心管壁上缓缓打出,吹打完保证枪头上无过多液体残留(慢吸慢打),进行一次润洗后,在液面下准确吸取0.1ml10
‑1样品加入10
‑2离心管中,涡旋震荡30s,步骤同第一步操作,10
‑2—10
‑8稀释步骤相同。取最低浓度离心管涡旋震荡30s,移液器抽取10ul小心滴于平板培养基内相应区域,尽量一次性打完,避免分散;由低浓度至高浓度,依次摇匀、抽取、涂布平板
34.④
涂布:晾干15
‑
20min后,倒置平板,37℃温箱过夜培养。
35.⑤
计数:观察计数:(以最终出现噬菌斑的最大稀释倍数分区计算;噬菌斑数量与前面梯度相对应为宜)。
36.噬菌体效价(pfu/ml)=噬菌斑数
×
稀释倍数
×
100
37.计数标准:据样品估计稀释梯度,控制噬菌斑数在10~100pfu为宜。
38.3、试验方案
39.(1)巴氏杆菌噬菌体摇瓶moi实验
40.实验方案:将巴氏杆菌噬菌体按照效价采用tsb培养基稀释至1亿pfu/ml。采用tsb培养基进行摇瓶种子制备(500ml摇瓶装量150ml),37℃、140rpm摇床培养12h。采用tsb培养基为巴氏杆菌噬菌体培养用培养基,设置6组摇瓶试验(500ml摇瓶装量150ml),按照2%接种量和moi=0对照、moi1:10、moi1:100、moi1:1000、moi1:10000、moi1:20000、moi1:100000为实验组接入摇瓶后37℃140rpm条件下振荡培养10h。检测噬菌体效价。
41.实验数据及结果见下表。按照2%接种量接种巴氏杆菌、同时按照moi1:10000比例接种噬菌体可以获得较高的噬菌体效价。
42.[0043][0044]
(2)巴氏杆菌噬菌体50l反应器培养基优化
[0045]
实验方案:分别采用tsb培养基、安琪巴氏杆菌专用培养基、脑
‑
心浸萃液态培养基、lb培养基、自制1号培养基(胰蛋白胨12g/l,安琪酵母浸粉15g/l,氯化钠5g/l,磷酸氢二钾0.25g/l,硫酸镁0.05g/l)、自制2号培养基(胰蛋白胨12g/l,安琪酵母浸粉25g/l,氯化钠5g/l,磷酸氢二钾0.25g/l,硫酸镁0.05g/l)进行反应器培养。培养基采用121℃灭菌20min,降温至37℃后按照2%接种量,同时按照接种菌数:接种噬菌体量=1:10000接入噬菌体。接入混合均匀后静置30min,然后在37℃、ph7.2条件下培养7
‑
10h,待菌体od上升又下降至平稳后结束发酵,对菌液取样采用0.22μm滤器过滤后检测噬菌体效价。
[0046]
实验结果:实验数据见下表。巴氏杆菌采用自制1号培养基在反应器上生长情况较好,效价较高。脑
‑
心精粹液态培养基与自制2号培养基可能营养过于充分,菌体生长过快,噬菌体未明显裂解细菌,噬菌体产量较低。
[0047]
培养基放罐噬菌体效价(亿pfu/ml)tsb培养基21安琪巴氏杆菌专用培养基36脑
‑
心浸萃液态培养基0.6lb培养基17自制1号培养基108自制2号培养基0.7
[0048]
(3)巴氏杆菌噬菌体50l发酵罐噬菌体接入时机优化。
[0049]
实验方案:采用自制1号培养基,50l反应器配置20l培养液,121℃灭菌20min。按照2%接种量接种巴氏杆菌菌液,7个批次分别在0h(od0.2)、od0.5、od1.0、od1.5、od2.0、od2.5、od3.0按照moi1:10000接入相应数量的噬菌体,接入混合均匀后静置30min,然后在37℃、ph7.2条件下继续培养5
‑
10h,待发酵罐od下降平稳后结束发酵,取发酵菌液采用0.22微米过滤器过滤除菌后检测噬菌体效价。
[0050]
试验结果:见下表。按照上述工艺培养7个批次。发酵液在od1.5
‑
2.0时按照1:10000比例接入噬菌体可以获得较高的噬菌体效价。
[0051]
试验编号噬菌体加入时机放罐噬菌体效价(亿pfu/ml)
①
0h(od0.2)87
②
od0.5111
③
od1.0237
④
od1.5503
⑤
od2.0675
⑥
od2.5206
⑦
od3.02.6
[0052]
结论:巴氏杆菌噬菌体采用优化筛选的1号自制培养基(胰蛋白胨12g/l,安琪酵母浸粉15g/l,氯化钠5g/l,磷酸氢二钾0.25g/l,硫酸镁0.05g/l)为较好的噬菌体高密度培养用培养基。经过摇瓶moi试验,确定较合适的噬菌体接种比例为moi1:10000。经过反应器噬菌体接入时机试验确定od1.5
‑
2.0为较好的噬菌体高密度培养噬菌体接入时机。接入噬菌体后,先静置培养30分钟,再37℃、100rpm条件下培养5
‑
10h,待菌体裂解后600nm处吸光度降至最低至平稳后结束培养,巴氏杆菌噬菌体效价可以达到500
‑
1000亿pfu/ml。反应器采用筛选的自制培养基可以实现噬菌体的高密度培养,效价相当于摇瓶效价的10倍以上。
[0053]
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1