一种活性肽的制备方法和应用
中nahco3的浓度为0.1mol/l。
19.在一种优选的实施方式中,采用如下方法来模拟胃消化和肠消化过程:向步骤(3) 得到的蛋白酶解液中加入唾液溶液,蛋白酶解液与唾液溶液的体积比为1:3,将混合物 置于37℃的水浴中震荡5-15min,随后用3-7mol/l的盐酸调整ph到1.2,然后加入 模拟胃液15ml,其中,模拟胃液与蛋白酶解液的体积比为1:3,模拟胃液的ph为1.2, 胃液中nacl的含量为0.03mol/l,胃液中胃蛋白酶的含量为0.32wt%,37℃震荡孵育4 h后,加入0.1mol/l的nahco3调整ph至6,停止胃消化;随后加入模拟肠消化液15 ml,肠液溶液的体积比与蛋白酶解液为1:3,肠液中含有0.33%胰蛋白酶,2%的胆汁 提取物,胆汁提取物购买自上海源叶生物科技有限公司,肠液中nahco3的浓度为 0.1mol/l,然后加入2.5ml 120mmol/l的nacl和2.5ml 5mmol/l kcl,混合物在 37℃下摇动4-8h,于100℃条件下灭酶5-25min,最后得到的混合物在4℃5000g下离 心5-15min,得到的上清液待超滤分离。
20.步骤(5)中,用截留分子量为10kda的超滤膜纯化系统进行过滤时,操作温度 为20-40℃,操作压力为0.1-0.3mpa。
21.本发明进一步提出了一种活性肽,所述活性肽由上述制备方法制备得到。
22.优选地,活性肽分子量小于10kda。优选地,活性肽分子量小于3kda。
23.本发明进一步提出了上述活性肽在清除羟基自由基、清除超氧阴离子、还原铁离 子、抑制血管紧张素转换酶上的应用。
24.有益效果:本发明以酸枣仁和枸杞子为原料,采用碱性蛋白酶酶解,模拟胃肠道 消化等可控酶解技术及超滤技术,获得目标肽段,探讨酸枣仁和枸杞子多肽分子量的 分布与抗氧化、降血压的关系。实验结果显示,目标肽段中,分子量越小其抗氧化能 力、降血压能力越强。
附图说明
25.图1为酸枣仁蛋白、酸枣仁蛋白酶解物、酸枣仁蛋白酶解物消化道产物的分子量分 布;
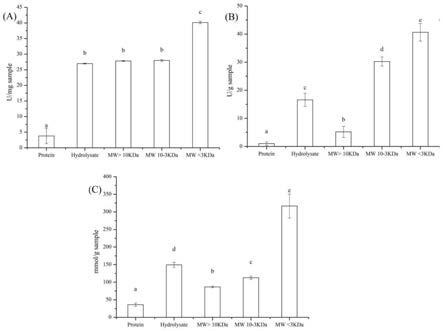
26.图2为酸枣仁多肽抗氧化结果,其中,a:羟基自由基清除能力,b:超氧阴离子 清除能力,c:铁离子还原能力,protein:酸枣仁蛋白,hydrolysate:酸枣仁蛋白消化 产物,mw:不同分子量的酸枣仁蛋白消化产物;
27.图3显示了不同分子量段酸枣仁多肽对ace的抑制作用,其中,protein:酸枣仁蛋 白,hydrolysate:酸枣仁蛋白消化产物,mw:不同分子量的酸枣仁蛋白消化产物;
28.图4为酸枣仁多肽降血糖结果,其中,a:α-葡萄糖苷酶抑制活性,b:α-淀粉酶抑 制活性,c:dpp
‑ⅳ
抑制活性,protein:酸枣仁蛋白,hydrolysate:酸枣仁蛋白消化产 物,mw:不同分子量的酸枣仁蛋白消化产物;
29.图5为不同蛋白酶对枸杞蛋白水解度的影响;
30.图6为枸杞子蛋白、枸杞子蛋白碱性蛋白酶酶解物、枸杞子蛋白酶解物消化道产物 的分子量分布;
31.图7为不同分子量段枸杞子多肽对羟基自由基、超氧阴离子清除能力以及铁离子还 原能力的影响,其中,a:羟基自由基清除能力;b:超氧阴离子清除能力;c:铁离 子还原能力;其中,protein:枸杞子蛋白,hydrolysate:枸杞子蛋白消化产物,mw: 不同分子量的
枸杞子蛋白消化产物;
32.图8为枸杞子多肽降血压活性研究,其中,protein:枸杞子蛋白,hydrolysate:枸 杞子蛋白消化产物,mw:不同分子量的枸杞子蛋白消化产物;
33.图9为枸杞子多肽降血糖结果,其中,a:α-葡萄糖苷酶抑制活性,b:α-淀粉酶抑 制活性,c:dpp
‑ⅳ
抑制活性;protein:枸杞子蛋白,hydrolysate:枸杞子蛋白消化产 物,mw:不同分子量的枸杞子蛋白消化产物。
具体实施方式
34.下面结合具体实施例对本发明做进一步详细说明,实施例将有助于理解本发明, 但是本发明的保护范围不限于下述的实施例。其中,唾液来自于市售的人工唾液,厂 家为上海源叶生物科技有限公司;肠液中含有0.33%胰蛋白酶,2%的胆汁提取物,胆 汁提取物购买自上海源叶生物科技有限公司,肠液中nahco3的浓度为0.1mol/l;胃液 的ph为1.2,胃液中nacl的含量为0.03mol/l,胃液中胃蛋白酶的含量为0.32wt%。
35.实施例1酸枣仁活性肽的制备。
36.(1)酸枣仁分离蛋白的制备。
37.酸枣仁经低温烘干,粉碎机粉碎,过40目筛后收集备用。过筛后的枸杞子粉用纱 布分装成小包后加入索氏提取器,溶剂是石油醚,料液比1:20,120℃提取5h,取出待石 油醚挥发干净,得到脱脂后的酸枣仁粉,其中石油醚采用旋转蒸发仪回收。将称量好 的酸枣仁脱脂粉中加入去离子水溶解,以1:15固液比,用1m氢氧化钠将ph值调节到 9.0,室温下,机械搅拌1小时后(该过程中使用1m的naoh使酸枣仁溶液的ph保持在 9.0),于3000rmp/min离心机中离心20min,弃沉淀。使用1m的hcl将ph值调至4.5,室 温静置5分钟之后,在4000rmp/min离心机中离心20分钟,倒掉上清液。用蒸馏水将分 离出的酸性条件下的酸枣仁蛋白沉淀洗涤2-3次,使其在纯水中形成蛋白分散液,再 用1m naoh调ph值至7.0,将所得碱提酸沉酸枣仁蛋白分散液经冷冻干燥后即为酸 枣仁分离蛋白。
38.(2)酸枣仁蛋白酶解物的制备.
39.用去离子水配置酸枣仁分离蛋白溶液,浓度为5%,超声处理变性,超声波条件: 400w,20min,25℃,然后在50℃水浴条件下,调节ph至8.5,加入碱性蛋白酶酶解, 酶的添加量为蛋白质0.5wt%,酶解过程中用盐酸和氢氧化钠溶液维持ph恒定,酶解结 束后,100℃水浴15min灭酶,冷却到25℃,用1mol/l盐酸调节溶液ph至7.0,得到酸枣 仁蛋白酶解液备用。
40.(3)酸枣仁蛋白酶解物消化产物的制备.
41.取5ml酸枣仁蛋白酶解液,加入15ml人工唾液溶液(厂家为上海源叶生物科技 有限公司)。混合物置于37℃的水浴中震荡10min,随后用5mol/l的盐酸调整ph到1.2, 然后加入模拟胃液15ml(胃液的ph为1.2,胃液中nacl的含量为0.03mol/l,胃液中胃 蛋白酶的含量为0.32wt%),37℃震荡孵育4h后,加入0.1mol/l的nahco3调整ph至 6,停止胃消化。随后加入肠消化液15ml(肠液中含有0.33%胰蛋白酶,2%的胆汁提 取物,胆汁提取物购买自上海源叶生物科技有限公司,肠液中nahco3的浓度为0.1mol/l, 然后加入2.5ml 120mmol/l的nacl和2.5ml 5mmol/l kcl,混合物在37℃下摇动6h。 于100℃条件下灭酶15min,最后得到的混合物在4℃5000g下离心10min,得到的上清 液待超滤分离,其中,上清液为酸枣仁多
肽消化道产物,沉淀为未能水解的蛋白质。
42.(4)模拟消化产物的超滤分离。
43.将步骤(3)得到的酸枣仁蛋白酶解物消化道产物用0.45μm微滤膜过滤,然后将 微滤膜透过液分别经过截留分子量为10kda的超滤膜纯化系统进行过滤,操作温度为 30℃,操作压力为0.2mpa,得超滤膜截留液和透过液。超滤膜截留液是指超滤膜纯化 系统截留的液体;超滤膜透过液是指能通过超滤膜纯化系统的液体。
44.其中,截留分子量为10kda的超滤膜纯化系统是指其可以截留分子量大于10kda的 分子,使分子量不大于10kda的分子通过。再将透过液经过截留分子量为3kda的超滤膜 纯化系统进行过滤,操作温度为30℃,压力为0.4mpa,得到超滤膜截留液和透过液, 分别将不同分子量段的枸杞子多肽液真空冷冻干燥或喷雾干燥,备用。
45.酸枣仁蛋白、酸枣仁蛋白酶解物、酸枣仁蛋白酶解物消化道产物的分子量分布采 用凝胶色谱法。仪器:waters e2695高效液相色谱仪(四元泵,柱温箱,自动进样器, pda-w2998检测器photodiode array detector:waters 2998;美国waters公司,empower 处理软件);色谱条件:谱柱tskgelg3000pwxl(300nm
×
7.8nm);流动相:乙腈:纯水: 三氟乙酸的体积比为30:69.9:0.1;流速:0.5ml/min,柱温25℃;样品浓度2mg/ml, 进样体积20μl,检测波长220nm。标准品牛血清白蛋白、细胞色素c,维生素b12,谷 胱甘肽和赖氨酸。
46.结果如图1所示,酸枣仁蛋白经过碱性蛋白酶酶解后,主要形成的多肽分子量分布 在3.2kda,1.6kda和0.6kda。该酶解物通过模拟消化道后,多肽分子量分布没有显著变 化。因此,酸枣仁蛋白多肽在模拟消化道中具有较高的稳定性。
47.实施例2不同分子量段的酸枣仁多肽抗氧化实验。
48.羟基自由基的清除能力使用南京建成生物工程研究所的羟自由基测定试剂盒进行 测定。清除超氧阴离子的能力使用南京建成生物工程研究所的抗超氧阴离子自由基及 产生超氧阴离子自由基测试盒测定。铁离子还原能力的测定使用南京建成生物工程研 究所的总抗氧化能力(t-aoc)测试盒进行测定。
49.羟基自由基的清除能力:使用羟基自由基测试盒进行测定,配制好的所有应用液 在37℃水浴中预热3分钟,以下所有操作均在37℃恒温中进行。干燥箱中取出准备好 的试管,先取0.4ml试剂三应用液(以1:1比例混合的甲液应用液与乙液)分别加入 所有试管中,将滴入0.4ml的双蒸水作为对照组,将加入0.2ml的0.03%h2o2应用液 以及0.2ml双蒸水的试管作为标准组,将滴入0.2ml双蒸水和底物应用液的试管作为 对照组,分别加入0.2ml配制酸枣仁多肽样品(浓度为1mg/ml)和底物应用液的试 管设为测定管。将其混匀,静置1分钟(准确至秒),之后通过滴入新配制的显色剂 终止反应。将混合液置于常温状态下静置20分钟后,在波长为550nm下,针对各个试 管的吸光值进行测定。显色剂为试剂四应用液(试剂四加双蒸水稀释至100ml)与试 剂五、试剂六、冰乙酸体积比8:3:3:2配制。
50.超氧阴离子的清除能力:用双蒸水配置多肽样品浓度为1mg/ml,利用涡旋仪振荡 使其充分溶解。使用抗超氧阴离子自由基及产生超氧阴离子自由基测试盒进行测定, 首先准备对照管,标准管,测定管,在各个管中加入试剂。三组管中均加入试剂一应 用液1ml、试剂二、试剂三和试剂四应用液0.1ml。标准管中加入0.15mg/mlvc 0.05ml, 对照管加入蒸馏水0.05ml,测定管中分别加入酸枣仁待测样品0.05ml。充分混匀后, 在37℃水浴锅中加热40分钟后每个试管中均加入2ml的显色剂。10分钟后,在波长 550nm情况下测定其吸光值。
51.铁离子还原能力:使用总抗氧化能力试剂盒进行测定配制好的样品。在96孔板盖 上做好标记,待测孔每个都滴180μl frap工作液(试剂一:试剂二:试剂三=10:1:1的 混合溶液),滴入5μl的双蒸水作为空白,再滴5μl的不同浓度的的标准品溶液至其 他孔中,测定孔中滴入5μl的多肽样品(1mg/ml)溶液,在37℃的条件下静置5分钟, 并在波长593nm下,测定每个孔中的吸光值。
52.图2显示了不同分子量段酸枣仁多肽对羟基自由基、超氧阴离子清除能力以及铁离 子还原能力的影响。由图3可知,不同分子量段的酸枣仁多肽对羟基自由基、超氧阴离 子清除以及铁离子还原均表现出不同程度的能力,与酸枣仁蛋白比较,酸枣仁多肽的 抑制作用均有所提高,分子量段小于3kda抗氧化效果最好。
53.实施例3不同分子量段的酸枣仁多肽降血压活性。
54.血管紧张素转换酶(ace)抑制活性的测定:
55.在2ml的离心管中混合50μl消化产物(2mg/ml)和200μl0.005 mol/l马尿酰 组氨酸亮氨酸(hhl,hhl溶液用含有0.3mol/l氯化钠的0.1mol/l、ph8.3的硼酸缓冲 液配制)。在37℃恒温水浴预热5min,然后加入50μl0.4 u/ml ace启动反应,37℃恒 温保持30min,加入0.2ml1mol/l的盐酸终止反应。加入1.2ml冰冷的乙酸乙酯,用 力震荡混合,离心机3000r/min离心5min后,取出0.8ml酯层移入试管中,在85℃烘 箱中烘干(约1h),再加入2ml的去离子水震荡2min溶解马尿酸,溶液在228nm测 定吸光值(od);对照组除不加入消化产物外,其余操作与反应管完全相同。抑制率 计算方法如下所示:
[0056][0057]
式中:oda:对照组的吸光值;odb:样品组的吸光值。
[0058]
体外α-葡萄糖苷酶抑制率的测定:
[0059]
用ph6.9的0.1m磷酸盐缓冲液配制0.1u/ml α-葡萄糖苷酶溶液和2.5mmol/l的 pnpg溶液。将0.1ml磷酸缓冲液、0.1ml样品溶液(2mg/ml制得的酸枣仁多肽液)及0.1ml的α-葡萄糖苷酶溶液置于试管中,在37℃水浴锅中恒温水浴10min,加入0.1ml 2.5mmol/l的pnpg溶液,37℃反应40min,加入0.6ml 0.2mol/l的na2co3溶液终 止反应,于405nm处测定吸光值。反应体系中用0.1ml蒸馏水代替0.1ml样品溶液作 为空白实验。抑制率计算方法如下所示:
[0060][0061]
式中:oda:空白组的吸光值;odb:样品组的吸光值。
[0062]
体外α-淀粉酶抑制率的测定:
[0063]
取0.2ml用ph6.9的0.1m磷酸盐缓冲液配制0.2u/mlα-淀粉酶溶液与等体积的 2mg/ml样品(制得的酸枣仁多肽液)溶液共培养30min后,加入0.4ml 1%的可溶性淀 粉溶液,37℃水浴继续处理10min后,加入0.2ml的dns溶液终止反应,迅速经沸水 浴处理10min后,用流水冷却,加适量的水定容到一定的体积,540nm下测定吸光值。 反应体系中用0.1ml蒸馏水代替0.1ml样品溶液作为空白实验。抑制率计算方法如下 所示:
[0064][0065]
式中:oda:空白组的吸光值;odb:样品组的吸光值。
[0066]
体外dpp-iv抑制率的测定:
[0067]
取40μl用ph8.2的0.1m tris-hcl配制2.5mu/ml dpp-iv溶液、60μl p h8.2 的tris-hcl溶液、40μl 2mg/ml样品(制得的酸枣仁多肽液)溶液共培养10min后,加 入40μl0.25mm gly-pro-p na于37℃水浴60min,于405nm下测定吸光值。用等体 积的去离子水代替样品作为空白对照。抑制率计算方法如下所示:
[0068][0069]
式中:oda:空白组的吸光值;odb:样品组的吸光值。
[0070]
图3显示了不同分子量段酸枣仁多肽对ace的抑制作用。由图3可知,不同分子 量段的酸枣仁多肽对ace均表现出不同程度的抑制作用,与酸枣仁蛋白比较,酸枣仁 多肽的抑制作用均有所提高,分子量段小于3kda抑制效果最好。
[0071]
图4显示了不同分子量段酸枣仁多肽对α-葡萄糖苷酶、α-淀粉酶以及dpp
‑ⅳ
抑 制活性的影响。由图4可知,不同分子量段的酸枣仁多肽对α-葡萄糖苷酶、α-淀粉酶 以及dpp
‑ⅳ
均表现出不同程度的抑制活性,与酸枣仁蛋白比较,酸枣仁多肽的抑制作 用均有所提高,分子量段小于3kda抑制效果最好。
[0072]
实施例5枸杞子活性肽的制备。
[0073]
本实施先考察了不同的蛋白酶酶解的效果实验,分别采用碱性蛋白酶、胰蛋白酶、 木瓜蛋白酶、中性蛋白酶对枸杞子蛋白质进行水解,水解条件如下:
[0074]
碱性蛋白酶:酶的添加量为蛋白质的0.05%,ph8.5,温度50℃,反应时间5h。
[0075]
胰蛋白酶:酶的添加量为蛋白质的0.05%,ph8.0,温度43℃,反应时间5h。
[0076]
木瓜蛋白酶:酶的添加量为蛋白质的0.05%,ph6.5,温度55℃,反应时间5h。
[0077]
中性蛋白酶:酶的添加量为蛋白质的0.05%,ph7.0,温度50℃,反应时间5h。
[0078]
水解度的测定:利用游离氨基的增加量来表征水解度。游离氨基的测定采用三硝 基苯磺酸法。
[0079]
实验结果:如图5所示,碱性蛋白酶具有较高的水解度,因此,下述实施例中均采 用碱性蛋白酶来制备枸杞多肽。
[0080]
(1)枸杞子分离蛋白的制备。
[0081]
枸杞子经低温烘干,粉碎机粉碎,过40目筛后收集备用。过筛后的枸杞子粉用纱 布分装成小包后加入索氏提取器,以石油醚为溶剂,料液比为1:20进行提取,120℃提 取五小时,取出待石油醚挥发干净,收集枸杞子粉备用,其中石油醚采用旋转蒸发仪 回收。称取一定量的脱脂后的枸杞籽粉,以去离子水为溶剂,在料液质量比1:12条件 下采用1mol/l的氢氧化钠调节ph值8.0-8.5,恒温40℃搅拌提取60min,将提取液在 3500r/min条件下离心30min,得到枸杞子蛋白提取液。再用1mol/l的盐酸调节枸杞子蛋 白提取液的ph值至4.5,使其在等电点处沉淀,3500r/min条件下离心20min得到枸杞子 分离蛋白,水洗采用1mol/l的氢氧化钠来调节为中性后真空冷冻干燥,于干燥皿中保 存备用。
[0082]
(2)枸杞子蛋白酶解物的制备。
[0083]
用去离子水配置枸杞子分离蛋白溶液,浓度为5%,超声处理变性,超声波条件: 400w,20min,25℃,然后在50℃水浴条件下,调节ph至8.5,加入碱性蛋白酶酶解, 酶的添加量为蛋白质0.5%,酶解过程中用盐酸和氢氧化钠溶液维持ph恒定,酶解结束 后,100℃水
浴15min灭酶,冷却到25℃,用1mol/l盐酸调节溶液ph至7.0,得到枸杞子 蛋白酶解液备用。
[0084]
(3)枸杞子蛋白酶解物消化产物的制备。
[0085]
取5ml枸杞子蛋白酶解液,加入15ml人工唾液溶液(厂家为上海源叶生物科技 有限公司),混合物置于37℃的水浴中震荡10min,随后用5mol/l的盐酸调整ph到1.2, 然后加入模拟胃液15ml(胃液的ph为1.2,胃液中nacl的含量为0.03mol/l,胃液中胃 蛋白酶的含量为0.32wt%),37℃震荡孵育4h后,加入0.1mol/l的nahco3调整ph至 6,停止胃消化。随后加入肠消化液15ml(肠液中含有0.33%胰蛋白酶,2%的胆汁提 取物,胆汁提取物购买自上海源叶生物科技有限公司,肠液中nahco3的浓度为 0.1mol/l),然后加入2.5ml 120mmol/l的nacl和2.5ml 5mmol/l kcl,混合物在37℃ 下摇动6h。于100℃条件下灭酶15min,最后得到的混合物在4℃5000g下离心10min, 得到的上清液待超滤分离,其中上清液为枸杞多肽消化道产物,沉淀为未能水解的蛋 白质。
[0086]
(4)模拟消化产物的超滤分离。
[0087]
将步骤(3)得到的枸杞子多肽消化道产物用微滤膜(0.45μm)过滤,然后将微滤 膜透过液分别经过截留分子量为10kda的超滤膜纯化系统进行过滤,操作温度为30℃, 操作压力为0.2mpa,得超滤膜截留液和透过液。超滤膜截留液是指超滤膜纯化系统截 留的液体;超滤膜透过液是指能通过超滤膜纯化系统的液体。截留分子量为:截留分 子量为10kda的超滤膜纯化系统是指其可以截留分子量大于10kda的分子,使分子量不 大于10kda的分子通过。再将透过液经过截留分子量为3kda的超滤膜纯化系统进行过滤, 操作温度为30℃,压力为0.4mpa,得到超滤膜截留液和透过液,分别将不同分子量段 的枸杞子多肽液真空冷冻干燥或喷雾干燥,备用。
[0088]
枸杞子蛋白、枸杞子蛋白碱性蛋白酶酶解物、枸杞子蛋白酶解物消化道产物的分 子量分布采用凝胶色谱法。仪器:waters e2695高效液相色谱仪(四元泵,柱温箱,自 动进样器,pda-w2998检测器photodiode array detector:waters 2998;美国waters 公司,empower处理软件);色谱条件:谱柱tskgelg3000pwxl(300nm
×
7.8nm);流动 相:乙腈:纯水:三氟乙酸的体积比为30:69.9:0.1;流速:0.5ml/min,柱温25℃; 样品浓度2mg/ml,进样体积20μl,检测波长220nm。标准品牛血清白蛋白、细胞色素c, 维生素b12,谷胱甘肽和赖氨酸。
[0089]
结果如图6所示,枸杞子蛋白经过碱性蛋白酶酶解后,主要形成的多肽分子量分 布在11.8kda和3.2kda。该酶解物通过模拟消化道后,分子量在11.8kda的多肽被水 解,从而在1.7kda,1.2kda和0.7kda附近形成新的多肽。此外,分子量在3.2kda 附近的多肽未能受到模拟消化道的影响。因此,该分子量的多肽在模拟消化道中具有 较高的稳定性。
[0090]
实施例6不同分子量段的枸杞子多肽抗氧化实验。
[0091]
羟基自由基的清除能力使用南京建成生物工程研究所的羟自由基测定试剂盒进行 测定。清除超氧阴离子的能力使用南京建成生物工程研究所的抗超氧阴离子自由基及 产生超氧阴离子自由基测试盒测定。铁离子还原能力的测定使用南京建成生物工程研 究所的总抗氧化能力(t-aoc)测试盒进行测定。测试方法同实施例2。
[0092]
图7显示了不同分子量段枸杞子多肽对羟基自由基、超氧阴离子清除能力以及铁离 子还原能力的影响。由图7可知,不同分子量段的枸杞子多肽对羟基自由基、超氧阴离 子清除以及铁离子还原均表现出不同程度的能力,与枸杞子蛋白比较,枸杞子多肽的 抑制
作用均有所提高,分子量段小于3kda抗氧化效果最好。
[0093]
实施例7不同分子量段的枸杞子多肽降血压活性。
[0094]
血管紧张素转换酶(ace)抑制活性的测定、体外α-葡萄糖苷酶抑制率的测定、 体外α-淀粉酶抑制率的测定、体外dpp-iv抑制率的测定方法同实施例3。
[0095]
图8显示了不同分子量段枸杞子多肽对ace的抑制作用。由图8可知,不同分子量 段的枸杞子多肽对ace均表现出不同程度的抑制作用,与枸杞子蛋白比较,枸杞子多 肽的抑制作用均有所提高,分子量段小于3kda抑制效果最好。
[0096]
图9显示了不同分子量段枸杞子多肽对α-葡萄糖苷酶、α-淀粉酶以及dpp
‑ⅳ
抑 制活性的影响。由图9可知,不同分子量段的枸杞子多肽对α-葡萄糖苷酶、α-淀粉酶 以及dpp
‑ⅳ
均表现出不同程度的抑制活性,与枸杞子蛋白比较,枸杞子多肽的抑制作 用均有所提高,分子量段小于3kda的多糖抑制效果最好。
[0097]
本发明提供了一种酸枣仁多肽的思路及方法,具体实现该技术方案的方法和途径 很多,以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术 人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和 润饰也应视为本发明的保护范围。本实施例中未明确的各组成部分均可用现有技术加 以实现。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1