使用不对称氢化合成S-氟丁酰草胺的方法与流程
使用不对称氢化合成s-氟丁酰草胺的方法
技术领域
1.本发明涉及一种用于制备氟丁酰草胺的s-对映异构体的方法。
背景技术:
2.美国专利号4,929,273披露了作为除草化合物的具有式1的n-苄基-2-(4-氟-3-三氟甲基苯氧基)-丁酰胺。该化合物在酰胺部分的2-碳上具有单个不对称中心,并且因此可以是手性分子。
[0003][0004]
该呈外消旋形式的化合物已经以常用名氟丁酰草胺在商业上销售,作为土壤除草剂用于谷物中双子叶杂草的出苗前和出苗后控制。该化合物抑制了类胡萝卜素的生物合成中涉及的酶八氢番茄红素脱氢酶。类胡萝卜素的消耗导致易感杂草的叶绿素的光氧化和白化/褪绿。
[0005]
美国专利号4,929,273还披露了(-)-光学异构体比外消旋混合物更具除草活性。更有活性的对映异构体已确认为具有如化合物s-1所示的s-构型(environ.sci.technol.[环境科学与技术]2013,47,6806-6811和environ.sci.technol.[环境科学与技术]2013,47,6812-6818)。
[0006][0007]
虽然前面的参考文献中披露的方法可以提供所期望的化合物s-1,但仍寻求持续改进,特别是在开发以商业规模提供材料的方法方面。因此,持续需要更低成本、更高效、更灵活或更方便操作的新方法。
技术实现要素:
[0008]
实施例a.本发明提供了一种用于由化合物s-5制备化合物s-1的方法
[0009][0010]
其中化合物s-5通过以下方式制备:将化合物2
[0011][0012]
在手性络合物的存在下用叔胺和氢源进行处理。
[0013]
实施例b.本发明还提供了一种用于制备化合物s-1的方法
[0014][0015]
该方法包括:
[0016]
将化合物2
[0017][0018]
在手性络合物的存在下用叔胺和氢源进行处理以制备化合物s-5
[0019][0020]
以及将化合物s-5转化为化合物s-1。
[0021]
实施例c.本发明还提供了一种用于制备化合物s-1的方法
[0022][0023]
该方法包括:
[0024]
将具有式6的化合物
[0025][0026]
其中r1是c
1-c6烷基;
[0027]
用化合物7(即4-氟-3-(三氟甲基)苯酚)
[0028][0029]
在碱的存在下进行处理,以提供具有式8的化合物
[0030][0031]
其中r1是c
1-c6烷基;
[0032]
水解该具有式8的化合物以提供化合物2
[0033][0034]
将化合物2在手性络合物的存在下用叔胺和氢源进行处理以制备化合物s-5
[0035][0036]
以及将化合物s-5转化为具有式s-1的化合物。
[0037]
实施例d.
[0038]
本发明还提供了一种用于制备化合物s-5的方法
[0039][0040]
该方法包括:
[0041]
将化合物2
[0042][0043]
在手性络合物的存在下用叔胺和氢源进行处理。
[0044]
实施例e.
[0045]
本发明还提供了一种具有式16的化合物
[0046][0047]
其中g是oh、c
1-c6烷氧基或o-m
+
;并且
[0048]m+
是碱金属阳离子或叔铵阳离子。
具体实施方式
[0049]
如本文所使用的,术语“包含(comprises)”、“包含(comprising)”、“包括(includes)”、“包括(including)”、“具有(has)”、“具有(having)”、“含有(contains)”、“含有(containing)”、“特征为(characterized by)”或其任何其他变体,旨在涵盖非排他性包括,受到明确指出的任何限制。例如,包含一系列要素的组合物、混合物、工艺或方法不一定仅限于那些要素,而是可以包括未明确列出的其他要素或此类组合物、混合物、工艺或方法固有的其他要素。
[0050]
连接短语“由
……
组成”排除任何未指出的要素、步骤或成分。如果在权利要求中,则此短语将使权利要求为封闭式,不包括除所述那些外的材料,但与其通常相关的杂质除外。当短语“由
……
组成”出现在权利要求主体的子句中而非紧接前序部分时,该短语仅仅限制该子句中阐述的要素;整体上,该权利要求并不排除其他要素。
[0051]
连接词“基本上由
……
组成”用于定义组合物、工艺或方法,其包括除字面上所披露的那些之外的材料、步骤、特征、组分或要素,前提是这些另外的材料、步骤、特征、组分或要素不会实质性地影响所要求保护的发明的一个或多个基本和新颖特征。术语“基本上由
……
组成”居于“包含”和“由
……
组成”中间。
[0052]
当申请人已经用开放式术语如“包含”定义了本发明或其一部分时,则应易于理解(除非另外指明),说明书应被解释为还使用术语“基本上由
……
组成”或“由
……
组成”描述本发明。
[0053]
此外,除非明确相反地指出,否则“或”是指包含性的或而非排他性的或。例如,条件a或b由以下中任一个满足:a为真(或存在)且b为假(或不存在)、a为假(或不存在)且b为真(或存在)以及a和b皆为真(或存在)。
[0054]
另外,在本发明的要素或组分之前的不定冠词“一个/一种(a和an)”旨在关于该要素或组分的实例(即,出现)数量是非限制性的。因此,“一个/一种(a或an)”应被理解为包括一个/一种或至少一个/一种,并且要素或组分的单数单词形式也包括复数,除非数字显然意指单数。
[0055]
如本文所使用的,术语“合适的”指示如此描述的实体或条件适用于所表示的情况或环境。如本文所使用的,术语“处理(treatment)”或“处理(treating)”表示使用化学品或化学工艺改变其他材料、化学品或化合物的现存条件。术语“转化(converting)”是指使实体如化合物在结构、形式、特性或功能方面改变。例如,通过涉及一种或多种如上所定义的处理的化学工艺将具有第一式或结构的化合物转化为具有第二式或结构的化合物。
[0056]
在上述中,术语“烷基”,单独使用或在复合词如“烷硫基”或“卤代烷基”中使用,包括直链或支链的烷基,如甲基、乙基、正丙基、异丙基、或不同的丁基、戊基、或己基异构体。
[0057]“烷氧基”包括例如甲氧基、乙氧基、正丙氧基、异丙氧基和不同的丁氧基、戊氧基和己氧基异构体。
[0058]
如本文所使用的,“碱金属”是指周期表第1族的元素,包括锂、钠、钾和铯,优选钠或钾,或其阳离子,如当与阴离子抗衡离子结合使用以定义化合物时。“碱土金属”是指周期表第2族的元素,包括镁、钙或其阳离子,如当与阴离子抗衡离子结合使用以定义化合物时。
[0059]
术语“叔铵阳离子”是指质子化的叔胺物质,例如,三乙铵阳离子、(乙基)3nh
+
。
[0060]
术语“卤素”,单独地或在复合词如“卤代烷基”中,或者当在描述如“卤化”中使用时,包括氟、氯、溴或碘。
[0061]
在取代基中的碳原子的总数用“c
i-c
j”前缀指示,其中i和j是从1至6的数。
[0062]
术语“任选地”当在本文中使用时意指任选的条件可以存在或可以不存在。例如,当反应任选地在溶剂的存在下进行时,该溶剂可以存在或可以不存在。
[0063]
如本文所使用的,术语“水解(hydrolysis)”、“水解(hydrolyzing)”和相关术语是指将化合物用水处理来破坏一个或多个键以将该化合物转化为另一种化合物。例如,可以将酯、酰胺、酰氯、或羧酸盐用水处理(水解)以获得对应的羧酸。取决于所期望的转化,水解反应可以在中性、酸性或碱性条件下进行。
[0064]
本发明包括与外消旋混合物相比对映异构体地富集的化合物;例如,化合物s-1或本文描述的用于制备化合物s-1的方法中的任何中间体的对映异构体。还包括了化合物s-1或本文描述的用于制备化合物s-1的方法中的任何中间体的基本上纯的对映异构体。本发明的基本和新颖特征包括如本文描述的通过在手性络合物的存在下将化合物2用叔胺和氢源进行处理来制备化合物s-1和s-5。除字面上披露的那些以外,基本和新颖特征还包括可以根据本文的描述用于由化合物2来制备化合物s-1和s-5的任何化合物、材料、步骤、特征、组分、或元素。本发明的基本和新颖特征还包括如本文描述的可用于制备化合物2的任何化合物、材料、步骤、特征、组分、或元素。本发明的基本和新颖特征还包括如本文描述的具有式16的任何化合物,包括含有具有式16的化合物的任何组合物,以及与制造或使用具有式16的化合物的方法相关的任何材料、步骤、特征、组分、或元素。
[0065]
当对映异构体地富集时,一种对映异构体以比另一种更大的量存在,并且富集程度可以通过定义为(f
maj-f
min
)
·
100%的对映异构体过量(“ee”)的表达来定义,其中f
maj
是混合物中主要对映异构体的摩尔分数并且f
min
是混合物中较少对映异构体的摩尔分数(例如,20%的ee对应于对映异构体的60:40比率)。
[0066]
如本文所使用的,取决于在不对称中心处的主要构型,具有至少80%对映异构体过量、优选至少90%对映异构体过量、更优选至少94%对映异构体过量、至少96%对映异构体过量、或至少98%对映异构体过量的特定异构体的化合物被称为r-或s-。应注意的是更主要的对映异构体的基本上对映异构体纯的实施例(》99%ee)。如本文所使用的,具有少于80%对映异构体过量的化合物被命名为非外消旋的(scalemic)。
[0067]
本文绘制的分子描述通常依照用于描绘立体化学的标准惯例。为了指明立体构型,从绘图平面伸出并且朝向观察者的键以实心楔形表示,其中该楔形的宽端连接至从绘图平面伸出朝向观察者的原子上,如以下所示出的,其中基团b从绘图平面上伸出。除非特
别指明,否则通常不示出附接到不对称中心的氢原子。
[0068][0069]
伸向绘图平面下方并且远离观察者的键由虚线楔形表示,其中该楔形的宽端连接到进一步远离观察者的原子上,即基团b’在绘图平面下方。
[0070][0071]
等宽线指示相对于用实心或虚线楔形示出的键具有相对或中立方向的键;等宽线还可描绘其中不旨在指明立体构型的分子或分子部分中的键。值得注意的是,如本文所使用的,附接到不对称中心的等宽线还表示其中在该中心处的r-和s-构型的量相等时的情况;例如,具有单个不对称中心的化合物是外消旋的。
[0072][0073]
波浪线指示其中不旨在指明特定立体构型的分子或分子部分中的键。如本文所使用的,附接到烯基碳的波浪线代表其中在该碳处e-和z-构型的量未定义的情况;例如,在该碳处的构型可以是e-和z-构型的混合物。
[0074][0075]
本发明的实施例包括以下。
[0076]
实施例a1.如实施例a所述的方法,其中该手性络合物包含与手性双膦络合的钌。
[0077]
实施例a2.如实施例a1所述的方法,其中该手性络合物包含具有手性双膦的二氯钌络合物。
[0078]
实施例a3.如实施例a3所述的方法,其中该手性络合物包含具有不对称阻旋异构双膦的二氯钌络合物。
[0079]
实施例a4.如实施例a、a1、a2或a3中任一项所述的方法,其中该双膦配体选自由(s)-synphos、(s)-p-phos、(s)-cl-meo-biphep、(-)-tmbtp和(s)-binap组成的组。
[0080]
实施例a5.如实施例a4所述的方法,其中该手性络合物是氯[(s)-(-)-2,2
’‑
双(二苯基膦基)-1,1
’‑
联萘基](对伞花烃)氯化钌(ii),即(s)-binap。
[0081]
实施例a6.如实施例a至a5中任一项所述的方法,其中该叔胺包含三乙胺、二异丙基乙胺、n,n,n’,n
’‑
四甲基乙二胺、n-甲基哌啶、n-苯基哌啶或n-甲基吗啉。
[0082]
实施例a7.如实施例a6所述的方法,其中该叔胺包含三乙胺。
[0083]
实施例a8.如实施例a至a7中任一项所述的方法,其中化合物s-5通过包括以下的
方法来制备:将化合物2用三乙胺进行处理以提供三乙胺盐3
[0084][0085]
在手性络合物的存在下将该三乙胺盐3用氢源进行处理以提供三乙胺盐s-4
[0086][0087]
以及将该具有式s-4的三乙胺盐用酸进行处理。
[0088]
实施例a9.如实施例a至a8中任一项所述的方法,其中化合物2通过以下方式制备:将具有式6的化合物
[0089][0090]
其中r1是c
1-c6烷基;
[0091]
用化合物7
[0092][0093]
在碱的存在下进行处理,以提供具有式8的化合物
[0094][0095]
其中r1是c
1-c6烷基;以及
[0096]
水解该具有式8的化合物。
[0097]
实施例a10.如实施例a9所述的方法,其中r1是ch3。
[0098]
实施例a11.如实施例a10所述的方法,其中该碱是碱金属或碱土金属的氢化物、醇盐、氢氧化物、碳酸盐、碳酸氢盐,或酰胺碱,或叔胺。
[0099]
实施例a12.如实施例a11所述的方法,其中该碱是氢氧化钠、氢氧化钾、碳酸氢钠、碳酸氢钾、碳酸钠或碳酸钾。
[0100]
实施例a13.如实施例a12所述的方法,其中该碱在水溶液中。
[0101]
实施例a14.如实施例a12或a13所述的方法,其中该碱是碳酸钾。
[0102]
实施例a15.如实施例a至a14中任一项所述的方法,其中由化合物s-5制备化合物s-1包括:
[0103]
将化合物s-5用氯化剂进行处理以制备化合物s-9
[0104][0105]
以及任选地在额外的碱的存在下将化合物s-9用化合物10(即苄胺)进行处理
[0106][0107]
实施例a16.如实施例a15所述的方法,其中该氯化剂是pocl3、socl2、(cocl)2或cocl2。
[0108]
实施例a17.如实施例a16所述的方法,其中该氯化剂是亚硫酰氯,即socl2。
[0109]
实施例a18.如实施例a14至a17中任一项所述的方法,其中该额外的碱包含碱金属或碱土金属的氢化物、醇盐、氢氧化物、碳酸盐、碳酸氢盐;或酰胺碱;或叔胺。
[0110]
实施例a19.如实施例a18所述的方法,其中该额外的碱包含三乙胺、氢氧化钠、氢氧化钾、碳酸氢钠、碳酸氢钾、碳酸钠或碳酸钾。
[0111]
实施例a20.如实施例a19所述的方法,其中该额外的碱包含三乙胺。
[0112]
实施例b1.如实施例b所述的方法,其中该手性络合物包含与手性双膦络合的钌。
[0113]
实施例b2.如实施例b1所述的方法,其中该手性络合物包含具有手性双膦的二氯钌络合物。
[0114]
实施例b3.如实施例b2所述的方法,其中该手性络合物包含具有不对称阻旋异构双膦的二氯钌络合物。
[0115]
实施例b4.如实施例b至b3中任一项所述的方法,其中该双膦配体选自由(s)-synphos、(s)-p-phos、(s)-cl-meo-biphep、(-)-tmbtp和(s)-binap组成的组。
[0116]
实施例b5.如实施例b至b4中任一项所述的方法,其中该手性络合物是氯[(s)-(-)-2,2
’‑
双(二苯基膦基)-1,1
’‑
联萘基](对伞花烃)氯化钌(ii),即(s)-binap。
[0117]
实施例b6.如实施例b至b5中任一项所述的方法,其中该叔胺包含三乙胺、二异丙基乙胺、n,n,n’,n
’‑
四甲基乙二胺、n-甲基哌啶、n-苯基哌啶或n-甲基吗啉。
[0118]
实施例b7.如实施例b6所述的方法,其中该叔胺包含三乙胺。
[0119]
实施例b8.如实施例b至b7中任一项所述的方法,该方法包括将化合物2用三乙胺进行处理以提供具有式3的三乙胺盐
[0120][0121]
在手性络合物的存在下将该具有式3的三乙胺盐用氢源进行处理以提供三乙胺盐s-4
[0122][0123]
以及将三乙胺盐s-4用酸进行处理以提供化合物s-5。
[0124]
实施例b9.如实施例b至b8中任一项所述的方法,其中具有式2的化合物通过以下方式制备:将具有式6的化合物
[0125][0126]
其中r1是c
1-c6烷基;
[0127]
用化合物7
[0128][0129]
在碱的存在下进行处理,以提供具有式8的化合物
[0130][0131]
其中r1是c
1-c6烷基;以及
[0132]
水解该具有式8的化合物。
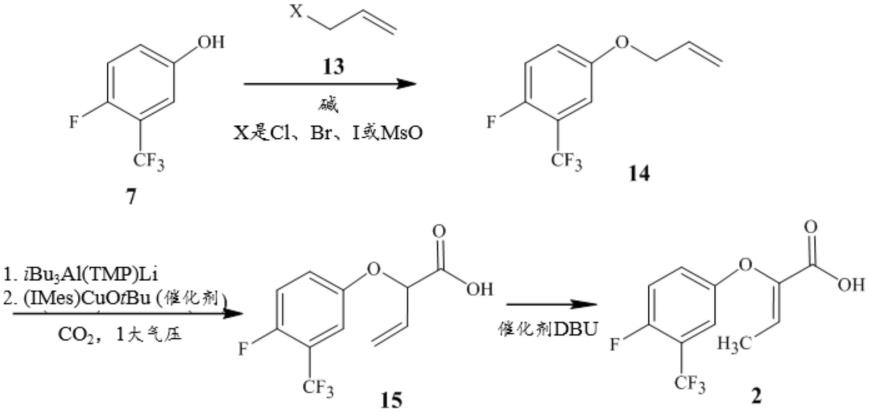
[0133]
实施例b10.如实施例b9所述的方法,其中r1是ch3。
[0134]
实施例b11.如实施例b10所述的方法,其中该碱是碱金属或碱土金属的氢化物、醇盐、氢氧化物、碳酸盐、碳酸氢盐;或酰胺碱;或叔胺。
[0135]
实施例b12.如实施例b11所述的方法,其中该碱是氢氧化钠、氢氧化钾、碳酸氢钠、碳酸氢钾、碳酸钠或碳酸钾。
[0136]
实施例b13.如实施例b12所述的方法,其中该碱在水溶液中。
[0137]
实施例b14.如实施例b12或b13所述的方法,其中该碱是碳酸钾。
[0138]
实施例b15.如实施例b至b14中任一项所述的方法,其中将化合物s-5转化为化合物s-1包括:
[0139]
将化合物s-5用氯化剂进行处理以制备化合物s-9
[0140][0141]
以及任选地在额外的碱的存在下将化合物s-9用化合物10进行处理
[0142][0143]
实施例b16.如实施例b15所述的方法,其中该氯化剂是pocl3、socl2、(cocl)2或cocl2。
[0144]
实施例b17.如实施例b16所述的方法,其中该氯化剂是亚硫酰氯,即socl2。
[0145]
实施例b18.如实施例b15至b17中任一项所述的方法,其中该额外的碱包含碱金属或碱土金属的氢化物、醇盐、氢氧化物、碳酸盐、碳酸氢盐;或酰胺碱;或叔胺。
[0146]
实施例b19.如实施例b18所述的方法,其中该额外的碱包含三乙胺、氢氧化钠、氢氧化钾、碳酸氢钠、碳酸氢钾、碳酸钠或碳酸钾。
[0147]
实施例b20.如实施例b19所述的方法,其中该额外的碱包含三乙胺。
[0148]
实施例c1.如实施例c所述的方法,其中r1是ch3。
[0149]
实施例c2.如实施例c或c1所述的方法,其中该碱是碱金属或碱土金属的氢化物、醇盐、氢氧化物、碳酸盐、碳酸氢盐,或酰胺碱,或叔胺。
[0150]
实施例c3.如实施例c2所述的方法,其中该碱是氢氧化钠、氢氧化钾、碳酸氢钠、碳酸氢钾、碳酸钠或碳酸钾。
[0151]
实施例c4.如实施例c3所述的方法,其中该碱在水溶液中。
[0152]
实施例c5.如实施例c3或c4所述的方法,其中该碱是碳酸钾。
[0153]
实施例c6.如实施例c至c5中任一项所述的方法,其中该手性络合物包含与手性双膦络合的钌。
[0154]
实施例c7.如实施例c6所述的方法,其中该手性络合物包含具有手性双膦的二氯钌络合物。
[0155]
实施例c8.如实施例c7所述的方法,其中该手性络合物包含具有不对称阻旋异构双膦的二氯钌络合物。
[0156]
实施例c9.如实施例c6至c8中任一项所述的方法,其中该双膦配体选自由(s)-synphos、(s)-p-phos、(s)-cl-meo-biphep、(-)-tmbtp和(s)-binap组成的组。
[0157]
实施例c10.如实施例所述的方法,2
’‑
双(二苯基膦基)-1,1
’‑
联萘基](对伞花烃)氯化钌(ii),即(s)-binap。
[0158]
实施例c11.如实施例c至c10中任一项所述的方法,其中该叔胺包含三乙胺、二异丙基乙胺、n,n,n’,n
’‑
四甲基乙二胺、n-甲基哌啶、n-苯基哌啶或n-甲基吗啉。
[0159]
实施例c12.如实施例c11所述的方法,其中该叔胺包含三乙胺。
[0160]
实施例c13.如实施例c至c12中任一项所述的方法,该方法包括将化合物2用三乙胺进行处理以提供具有式3的三乙胺盐
[0161][0162]
在手性络合物的存在下将该具有式3的三乙胺盐用氢源进行处理以提供具有式s-4的三乙胺盐
[0163][0164]
以及将该具有式s-4的三乙胺盐用酸进行处理以提供化合物s-5。
[0165]
实施例c14.如实施例c至c13中任一项所述的方法,其中将化合物s-5转化为化合
物s-1包括:
[0166]
将化合物s-5用氯化剂进行处理以制备化合物s-9
[0167][0168]
以及任选地在额外的碱的存在下将化合物s-9用化合物10进行处理
[0169][0170]
实施例c15.如实施例c14所述的方法,其中该氯化剂是pocl3、socl2、(cocl)2或cocl2。
[0171]
实施例c16.如实施例c15所述的方法,其中该氯化剂是亚硫酰氯,即socl2。
[0172]
实施例c17.如实施例c14至c16中任一项所述的方法,其中该额外的碱包含碱金属或碱土金属的氢化物、醇盐、氢氧化物、碳酸盐、碳酸氢盐;或酰胺碱;或叔胺。
[0173]
实施例c18.如实施例c17所述的方法,其中该额外的碱包含三乙胺、氢氧化钠、氢氧化钾、碳酸氢钠、碳酸氢钾、碳酸钠或碳酸钾。
[0174]
实施例c19.如实施例c18所述的方法,其中该额外的碱包含三乙胺。
[0175]
实施例d1.如实施例d所述的方法,其中该手性络合物包含与手性双膦络合的钌。
[0176]
实施例d2.如实施例d1所述的方法,其中该手性络合物包含具有手性双膦的二氯钌络合物。
[0177]
实施例d3.如实施例d2所述的方法,其中该手性络合物包含具有不对称阻旋异构双膦的二氯钌络合物。
[0178]
实施例d4.如实施例d至d2中任一项所述的方法,其中该双膦配体选自由(s)-synphos、(s)-p-phos、(s)-cl-meo-biphep、(-)-tmbtp和(s)-binap组成的组。
[0179]
实施例d5.如实施例d4所述的方法,其中该手性络合物是氯[(s)-(-)-2,2
’‑
双(二苯基膦基)-1,1
’‑
联萘基](对伞花烃)氯化钌(ii),即(s)-binap。
[0180]
实施例d6.如实施例d至d5中任一项所述的方法,其中该叔胺包含三乙胺、二异丙基乙胺、n,n,n’,n
’‑
四甲基乙二胺、n-甲基哌啶、n-苯基哌啶或n-甲基吗啉。
[0181]
实施例d7.如实施例d6所述的方法,其中该叔胺包含三乙胺。
[0182]
实施例d8.如实施例d至d7中任一项所述的方法,该方法包括将化合物2用三乙胺进行处理以提供具有式3的三乙胺盐
[0183][0184]
在手性络合物的存在下将该具有式3的三乙胺盐用氢源进行处理以提供三乙胺盐s-4
[0185][0186]
以及将该三乙胺盐s-4用酸进行处理以提供化合物s-5。
[0187]
实施例d9.如实施例d至d8中任一项所述的方法,其中化合物2通过以下方式制备:将具有式6的化合物
[0188][0189]
其中r1是c
1-c6烷基;
[0190]
用化合物7
[0191][0192]
在碱的存在下进行处理,以提供具有式8的化合物
[0193][0194]
其中r1是c
1-c6烷基;以及
[0195]
水解该具有式8的化合物。
[0196]
实施例d10.如实施例d9所述的方法,其中r1是ch3。
[0197]
实施例e1.如实施例e所述的化合物,其中g是oh[即,(z)-2-(4-氟-3-(三氟甲基)苯氧基)丁-2-烯酸)]。
[0198]
实施例e2.如实施例e所述的化合物,其中g是och3[即,(z)-2-(4-氟-3-(三氟甲基)苯氧基)丁-2-烯酸甲酯)]。
[0199]
实施例e3.如实施例e所述的化合物,其中g是o-(乙基)3nh
+
。
[0200]
本发明的实施例,包括上述实施例a1至a20、b1至b20、c1至c19、d1至d10、和e1至e3以及本文描述的任何其他实施例(包括实施例p1至p11),可以以任何方式组合,并且实施例中变量的描述不仅涉及化合物s-1、s-5和具有式16的化合物以及它们的制备方法,还涉及对于制备化合物s-1有用的起始化合物和中间体化合物s-5和2,以及具有式6、8、11和12的化合物。
[0201]
优选的实施例包括以下。
[0202]
实施例p1.如实施例a、b、c或d中任一项所述的方法,其中该手性络合物包含与手性双膦络合的钌。
[0203]
实施例p2.如实施例a、b、c或d中任一项所述的方法,其中该手性络合物是氯[(s)-(-)-2,2
’‑
双(二苯基膦基)-1,1
’‑
联萘基](对伞花烃)氯化钌(ii),即(s)-binap。
[0204]
实施例p3.如实施例a、b、c或d中任一项所述的方法,其中该叔胺包含三乙胺。
[0205]
实施例p4.如实施例a、b、c或d中任一项所述的方法,其中化合物s-5通过包括以下的方法来制备:将化合物2
[0206][0207]
用三乙胺进行处理以提供具有式3的三乙胺盐
[0208][0209]
在手性络合物的存在下将该具有式3的三乙胺盐用氢源进行处理以提供具有式s-4的三乙胺盐
[0210]
以及
[0211]
将该具有式s-4的三乙胺盐用酸进行处理。
[0212]
实施例p5.如实施例a、b、c或d中任一项所述的方法,其中具有式2的化合物通过以下方式制备:将具有式6的化合物
[0213][0214]
其中r1是c
1-c6烷基;
[0215]
用化合物7
[0216][0217]
在碱的存在下进行处理,以提供具有式8的化合物
[0218][0219]
其中r1是c
1-c6烷基;以及
[0220]
水解该具有式8的化合物。
[0221]
实施例p6.如实施例p5所述的方法,其中r1是ch3。
[0222]
实施例p7.如实施例a、b或c中任一项所述的方法,其中将化合物s-5转化为化合物s-1包括:
[0223]
将化合物s-5用氯化剂进行处理以制备化合物s-9
[0224][0225]
以及任选地在额外的碱的存在下将化合物s-9用化合物10进行处理
[0226][0227]
实施例p8.如实施例p7所述的方法,其中该氯化剂是亚硫酰氯,即socl2。
[0228]
实施例p9.如实施例p7或p8所述的方法,其中该额外的碱包含三乙胺。
[0229]
实施例p10.如实施例e所述的化合物,其中g是oh或och3。
[0230]
实施例p11.如实施例e所述的化合物,其中g是o-(乙基)3nh
+
。
[0231]
优选的实施例包括以下。
[0232]
在以下方案中,除非另外指明,否则以下具有式6、8、11和12的化合物中的r1的定义是如以上在发明内容和实施例的描述中所定义的。本文描述的方法提供了化合物s-1的高效且稳健的合成。
[0233]
具有高对映异构体纯度的有机酸的获得可以以数种方式完成,包括催化不对称合成、色谱拆分、萃取拆分、膜拆分、酶促拆分和非对映异构体盐拆分。各种拆分技术取决于酸的外消旋混合物的分离,将它们的效率限制在最大50%的产率,除非可以配合拆分使不期望的对映异构体外消旋化或差向异构化。相反,由于前体前手性烯烃在期望的不对称中心是非手性的,因此可以使用催化不对称合成将整个前体转化为期望的对映异构体是可能的。但是,催化不对称合成取决于底物与手性络合物之间良好的配位以实现高对映异构体过量,这可能是难以实现的。
[0234]
如方案1中总结的,化合物s-1可以由化合物s-5(即,(s)-2-(4-氟-3-(三氟甲基)苯氧基)丁酸)制备,其中,如依据方案2和3更详尽描述的,该具有式s-5的化合物通过不对称氢化化合物2(即,(z)-2-(4-氟-3-(三氟甲基)苯氧基)丁-2-烯酸)获得。对化合物2的催化不对称氢化可以通过在手性络合物的存在下用氢源处理来实现,如其中该手性络合物包含与手性双膦络合的钌,包括具有手性双膦的二氯钌络合物。“氢源”可以是提供氢的等价物(二氢或h2)的任何部分。“氢源”包括氢气或氢转移剂。转移氢化从除气态h2以外的来源向分子添加氢。氢转移剂包括甲酸铵,其在合适的条件下分解为氨、co2和h2。另一种氢转移剂是异丙醇,其通过在合适的条件下转化为丙酮来提供氢。将化合物s-5转化为化合物s-1可以通过本文随后描述的数种反应序列中的任一种来实现。
[0235]
方案1
[0236][0237]
使用具有阻旋异构双膦的钌络合物可以高效地实现对化合物2的催化不对称氢化以提供化合物s-5。优选的双膦配体包括(s)-synphos、(s)-p-phos、(-)-tmbtp、(s)-cl-meo-biphep和(s)-binap,更优选(s)-binap,即(s)-(2,2
’‑
双(二苯基膦基)-1,1
’‑
联萘(方案2中所示出)。为了该反应在可接受的速率下进行,添加叔胺的约一种等价物如三乙胺、二异丙基乙胺、n,n,n’,n
’‑
四甲基乙二胺、n-甲基哌啶、n-苯基哌啶或n-甲基吗啉,优选三乙胺。可替代地,可以使用聚合物结合胺。合适的溶剂包括醇(任选地与水混合)如甲醇、乙醇和异丙醇,极性非质子溶剂如乙腈和乙酸乙酯,及其混合物。优选使用甲醇。对于类似的不对称氢化,见org.letters[有机化学通讯],2004,6,3147-3150和org.proc.res.&dev.[有机加工研究与开发]2009,13,525-534。
[0238]
方案2
[0239][0240]
优选实施例示出于方案3中。在甲醇中处理化合物2提供了三乙胺盐3。使用具有(s)-binap的ru络合物的不对称氢化提供了三乙胺盐s-4。用碱、然后酸依序处理提供化合物s-5。
[0241]
方案3
[0242][0243]
可以理解的是,如果需要,若使用阻转双膦的r-对映异构体,可以使用总结于方案2和3中的程序以相同效率获得化合物r-5。
[0244][0245]
如方案5中所示出的,可以在碱的存在下将具有式6的化合物用化合物7(即,4-氟-3-(三氟甲基)苯酚)处理,以提供具有式8的化合物。该具有式6的化合物可以是e-和z-异构体的混合物。典型地将具有式8的化合物分离为z-异构体,尽管该具有式6的化合物是异构体的混合物。在具有式6和8的化合物中,r1是c
1-c6烷基,优选c
1-c4烷基,更优选c
1-c2烷基,甚至更优选ch3(即,具有式8的化合物是(z)-2-(4-氟-3-(三氟甲基)苯氧基)丁-2-烯酸甲酯)。合适的溶剂包括乙腈、二氯乙烷、甲苯、异丙醇、四氢呋喃、二甲基亚砜或n,n-二甲基甲酰胺。优选的溶剂包括二氯乙烷、甲苯、乙腈或n,n-二甲基甲酰胺,更优选乙腈。用于反应合适的碱包括碱金属或碱土金属的氢化物、醇盐、氢氧化物、碳酸盐、碳酸氢盐,或酰胺碱,或叔胺。此类碱包括碱金属氢化物,如氢化钠;或碱金属醇盐,如异丙醇钠和叔丁醇钾;或碱金属氢氧化物,如氢氧化钾和氢氧化钠;或碱金属碳酸盐和碳酸氢盐如碳酸氢钠、碳酸氢钾、碳酸钠、碳酸钾和碳酸铯;或酰胺碱如双(三甲基甲硅烷基)氨基锂、双(三甲基甲硅烷基)氨基钠和二异丙基氨基锂;或叔胺,如三乙胺和二异丙基乙胺。优选的碱包括氢氧化钠、氢氧化钾、碳酸氢钠、碳酸氢钾、碳酸钠或碳酸钾,任选地其中该碱在水溶液中。更优选地是碳酸钾。
[0246]
可以通过用水性碱处理随后酸化将具有式8的化合物水解成化合物2。优选的碱包括氢氧化钠、氢氧化钾、碳酸氢钠、碳酸氢钾、碳酸钠或碳酸钾,作为水溶液。更优选的是氢氧化钾溶液。用于酸化的优选的酸包括盐酸、氢溴酸或硫酸;更优选的是盐酸。
[0247]
方案5
[0248][0249]
如方案6中所示出的,具有式6的化合物可以由具有式11的巴豆酸酯制备,通过溴化以提供具有式12的化合物,随后脱溴化氢。在具有式11和12的化合物中,r1是c
1-c6烷基,优选c
1-c4烷基,更优选c
1-c2烷基,甚至更优选ch3。优选地,溴化在没有溶剂的情况下进行。可以通过用碱(任选地在合适的溶剂中)处理来对具有式12的粗产物进行脱溴化氢。优选的碱包括氢氧化钠、氢氧化钾、碳酸氢钠、碳酸氢钾、碳酸钠或碳酸钾。更优选地是碳酸钾。合适的溶剂包括乙腈、四氢呋喃、二甲基亚砜或n,n-二甲基甲酰胺,优选乙腈。具有式6的化合物的e-和z-异构体的混合物可以在脱溴化氢中形成。
[0250]
方案6
[0251][0252]
在一些实施例中,具有式12的化合物的脱溴化氢和具有式6的化合物与化合物7的反应可以依序地在相同碱/溶剂体系中、在不分离具有式6的化合物的情况下进行,以提供具有式8的化合物。用于这样的实施例的值得注意的碱/溶剂体系是固体碳酸钾在乙腈中的浆料。
[0253]
可替代地,可以如方案7中所示出的由化合物7来制备化合物2。将化合物7用具有式13的化合物(其中x是离去基团如cl、br、i或甲磺酸酯(甲磺酸盐))进行烯丙基化提供化合物14。合适的溶剂包括乙腈、二氯甲烷、二氯乙烷、甲苯、四氢呋喃、二甲基亚砜或n,n-二甲基甲酰胺。优选的溶剂包括二氯甲烷、二氯乙烷、甲苯、乙腈或n,n-二甲基甲酰胺。用于反应的合适的碱包括碱金属氢化物,如氢化钠;或碱金属醇盐,如异丙醇钠和叔丁醇钾;或碱金属氢氧化物,如氢氧化钾和氢氧化钠;或碱金属碳酸盐和碳酸氢盐如碳酸氢钠、碳酸氢钾、碳酸钠、碳酸钾和碳酸铯;或酰胺碱如双(三甲基甲硅烷基)氨基锂、双(三甲基甲硅烷基)氨基钠和二异丙基氨基锂;或叔胺,如三乙胺和二异丙基乙胺。优选的碱包括氢氧化钠、氢氧化钾、碳酸氢钠、碳酸氢钾、碳酸钠或碳酸钾,任选地其中该碱在水溶液中。更优选地是
碳酸钾。
[0254]
可以通过用铝酸盐化合物如ibu3al(tmp)li去质子化铝化,随后nhc-铜-催化羧化得到的芳氧基烯丙基铝物质来将化合物14转化为化合物2。具有式15的化合物的区域-和立体-选择性异构化可以通过用催化量的受阻碱如dbu处理来实现。对于此类型的转化见org.&biomol.chem.[有机和生物分子化学]2017,15,2370-2375。
[0255]
方案7
[0256][0257]
如方案8中所示出的,化合物s-5(如方案5中所制备)可以通过用氯化剂处理以制备化合物s-9,随后用化合物10(即苄胺)处理被转化为化合物s-1。合适的氯化剂包括pocl3、socl2、(cocl)2或cocl2。亚硫酰氯(socl2)为优选的氯化剂。合适的溶剂包括乙腈、二氯乙烷、甲苯、四氢呋喃、二甲基亚砜或n,n-二甲基甲酰胺。优选的溶剂包括n,n-二甲基甲酰胺、二氯乙烷、甲苯或乙腈,更优选甲苯。
[0258]
可以任选地在额外的碱的存在下,将化合物s-9用化合物10处理以提供化合物s-1。合适的溶剂包括乙腈、二氯甲烷、二氯乙烷、甲苯、四氢呋喃、二甲基亚砜或n,n-二甲基甲酰胺。优选的溶剂包括二氯甲烷、二氯乙烷、甲苯或乙腈,更优选二氯甲烷或甲苯,最优选二氯甲烷。用于反应的合适的额外的碱包括碱金属氢化物,如氢化钠;或碱金属醇盐,如异丙醇钠和叔丁醇钾;或碱金属氢氧化物,如氢氧化钾和氢氧化钠;或碱金属碳酸盐和碳酸氢盐如碳酸氢钠、碳酸氢钾、碳酸钠、碳酸钾和碳酸铯;或碱,如双(三甲基甲硅烷基)氨基锂、双(三甲基甲硅烷基)氨基钠和二异丙基氨基锂;或叔胺,如三乙胺和二异丙基乙胺。优选的额外的碱包括三乙胺、氢氧化钠、氢氧化钾、碳酸氢钠、碳酸氢钾、碳酸钠或碳酸钾,更优选三乙胺。
[0259]
方案8
[0260][0261]
可替代地,如方案9中所示出的,可以将化合物s-5用化合物10处理以制备化合物s-1。优选地,该处理包括在约100℃至125℃(如约110℃至120℃)下将化合物s-5与约2至5摩尔当量的化合物10(如约三当量)一起加热。任选地,可以使用溶剂如甲苯。去除过量的苄胺后获得的粗材料可以从异丙醇和水的混合物重结晶,以提供化合物s-1。
[0262]
方案9
[0263][0264]
在一些实施例中,具有式6、8、11和12的化合物或化合物2、3、s-4、s-5、s-9、14和15中的每一种可以在制备后并且在进入下一个步骤之前分离。可替代地,从化合物7、10、11至化合物s-1的步骤中的两个或更多个可以在不分离各自的中间体化合物的情况下合并。例如,可以在不分离中间体胺盐3和s-4的情况下将化合物2转化为化合物s-5。
[0265]
应认识到,上述对于制备化合物所描述的某些试剂和反应条件可能不与中间体中存在的某些官能团相容。在这些情况下,将保护/去保护序列或官能团相互转化结合到合成中将有助于获得所期望的产物。保护基团的使用和选择对于化学合成领域的技术人员来说将是显而易见的(参见,例如greene,t.w.;wuts,p.g.m.protective groups in organic synthesis[有机合成中的保护基团],第2版;wiley[威利出版社]:纽约,1991)。本领域的技术人员将认识到,在一些情况下,在按照任何单独方案中描绘的引入给定试剂后,可能必需进行没有详细描述的额外常规合成步骤以完成化合物的合成。本领域的技术人员还将认识到,可能必需以与制备化合物所呈现的具体顺序所暗含的不同的顺序来进行以上方案中示出的步骤的组合。本领域的技术人员还将认识到,本文所描述的化合物和中间体可经受各
种亲电反应、亲核反应、自由基反应、有机金属反应、氧化反应和还原反应以添加取代基或改性现有的取代基。
[0266]
无需进一步详细阐述,据信本领域技术人员使用先前描述可以最大程度地利用本发明。因此,以下实例应被解释为仅是说明性的,并且无论如何不以任何方式限制本披露。以下实例中的步骤示出了在整体合成转化中每个步骤的程序,并且用于每个步骤的起始材料并不必须由其程序描述于其他实例或步骤中的具体制备试验来制备。百分比是按重量计。缩写“h”代表“小时(hour)”或“小时(hours)”。缩写“gc”代表“气相色谱法”或“气相色谱的”。气相色谱分析使用通常已知的选择来提供对感兴趣的化合物从其他化合物的足够的拆分的程序来确定其纯度和识别,任选地使用已知标准品进行比较。缩写“mp”代表熔点。
[0267]
合成实例1
[0268]
(s)-2-(4-氟-3-(三氟甲基)苯氧基)丁酸的制备
[0269]
步骤1 2-溴巴豆酸甲酯的制备。
[0270]
向配备有机械搅拌器、冷凝器和温度计袋的夹套式反应器中装入巴豆酸甲酯(58.8g,582mmol),并且将温度调节至约25℃。在约2h的时间段内添加溴(98.7g,612mol),以便将温度维持在约25℃至35℃下。在添加的期间,反应混合物从透明无色溶液变为随时间加深的透明红色溶液。观察到溴烟。通过取100ul等分试样监测反应进程,将等分试样在乙酸乙酯(2ml)和水性hcl(2ml)之间分离。通过gc分析有机相。继续反应直至巴豆酸甲酯按gc面积计少于0.3%。将粗2,3-二溴丁酸甲酯从反应器去除。向夹套式反应器中装入乙腈(157g)和碳酸钾(179g,1280mmol),并且使温度达到约70℃。在4-h时间段内在剧烈搅拌下将粗2,3-二溴丁酸甲酯添加到反应器中。浆料从深红色变为黄-橙色。在约70℃下搅拌反应混合物直至gc分析示出2,3-二溴丁酸甲酯按gc面积计少于0.3%。不对该反应进行后处理,但是将其作为得到的浆料用于步骤2中。如果通过过滤、用乙腈洗涤滤饼并且蒸发挥发物来进行后处理,则可以作为油状物获得粗2-溴巴豆酸甲酯。预期产率大于97%,具有约95%的纯度。
[0271]
步骤2:(z)-2-(4-氟-3-(三氟甲基)苯氧基)丁-2-烯酸甲酯的制备。
[0272]
在约2h内剧烈搅拌下在70℃下,向含有来自步骤1的浆料的夹套式反应器中装入4-氟-3-(三氟甲基)苯酚(91.5g,503mmol)。继续搅拌直至4-氟-3-(三氟甲基)苯酚按gc面积计少于0.2%。完成需要总计约8h。将浆料冷却至约25℃并且然后过滤。用额外的乙腈(1
×
60g,任选地额外的洗涤)洗涤滤饼。将合并的滤液在反应器中加热至约70℃至75℃并且使压力达到约100毫巴,以蒸馏出乙腈来获得作为油状物的标题化合物。相对高的夹套温度避免了产物凝固,该产物具有55℃-56℃的mp。添加甲基叔丁基醚(mtbe)(164g)并且使夹套温度达到约25℃。产物的溶解是吸热的,从而冷却溶液。通过gc分析的纯度为约97%-98%。在不进一步纯化或表征的情况下,使标题化合物在mtbe中的溶液进入下一个步骤中。如果需要,可以通过去除mtbe以提供可以从乙腈重结晶的固体来将产物分离。
[0273]
步骤3:(z)-2-(4-氟-3-(三氟甲基)苯氧基)丁-2-烯酸的制备。
[0274]
向配备有机械搅拌器、冷凝器和温度计袋的夹套式反应器中装入50%氢氧化钾(67.5g,601mmol),并且将温度调节至约50℃。在1-h时间段内将步骤2的标题化合物在mtbe中的溶液添加至反应器中。在添加完成后,搅拌反应物质直至起始酯按gc面积计少于0.5%,约30min。检查ph为至少9然后继续进行。将水(67.5g)添加到反应器中,随后在1-h时
间段内添加37%hcl(71g)。将相分离并且将有机相称重以确定浓度,假设仅有的组分是标题化合物和mtbe。将己烷(164g)添加到反应器中,以提供mtbe和己烷的30%w/w混合物,并且用由之前制备的标题化合物的晶体(2g)对该混合物种晶。在12-h时间段内,将该混合物从50℃线性冷却至-10℃。将得到的浆料过滤,并将滤饼空气干燥以提供80%至85%产率的标题产物(103g)。未洗涤该滤饼,以避免再溶解标题产物中的一些。通过gc分析的纯度为约99%。在不进一步纯化或表征的情况下,使粗固体进入下一个步骤中。
[0275]
步骤4:(s)-2-(4-氟-3-(三氟甲基)苯氧基)丁酸三乙铵的制备。
[0276]
向配备有机械搅拌器、温度计和滴液漏斗的夹套式反应器中装入甲醇(约150g)和步骤3的标题产物(103g,385mmol)。将反应物质的温度调节至约20℃并且在30-min时间段内添加三乙胺(56.4g,557mmol),同时将温度维持在约20℃。在添加完成后,将混合物过滤以去除微小的黑色颗粒。将过滤的溶液装入配备有空心轴搅拌器的氢化反应器中,以高效地将氢气分散到液相中。将(s)-rucl[对伞花烃(binap)]cl(644mg,0.69mmol)在甲醇(约14g)中的溶液装入反应器中。将反应器密封并且开始搅拌。将反应器通过加压至4巴的氮气、保持两分钟并通氮气吹扫三次。将反应器通过加压至4巴的氢气、保持两分钟并将氢气通入氮气流中吹扫三次。将反应物质调节至55℃,并且在剧烈搅拌下将氢气压力增加至9巴。将混合物维持在氢气压力下直至停止氢气的吸收(约2h),并且将氢气通入氮气流中。可以使用适当的氢气流量计来在线监测转化。可替代地,可以使用采样和1h-nmr分析。将温度调节至环境温度,并且将得到的溶液与由步骤4获得的溶液装入配备有机械搅拌器、具有接收器的冷凝器、温度计和滴液漏斗的夹套式反应器中。将温度调节至约55℃并且将压力降低至约10毫巴,以蒸馏出挥发物来获得作为棕色油状物的标题化合物的粗产物,其具有约95:5的(s):(r)比率的对映异构体比率,约90%的ee。
[0277]
步骤5:(s)-2-(4-氟-3-(三氟甲基)苯氧基)丁酸的制备。
[0278]
使含有步骤4的标题化合物的粗产物的反应器达到约25℃,并且装入二氯甲烷(177g)。在10分钟内添加盐酸(61.4g,522mmol),将温度维持在约25℃。检查ph以确保其为约0至1,并且添加水(41.4g)。将相分离以去除水相。将反应器中的压力降低至约110毫巴并且将二氯甲烷蒸馏至接收器中。使夹套温度达到约50℃,同时维持温和地将二氯甲烷冷凝至接收器中。将压力调节至10毫巴以确保二氯甲烷完全去除。去除二氯甲烷后,使反应器达到环境温度和压力,以提供标题化合物,在进入下一个步骤中之前不对其进一步纯化或表征。
[0279]
合成实例2
[0280]
(s)-n-苄基-2-(4-氟-3-三氟甲基苯氧基)-丁酰胺的制备
[0281]
步骤1:(s)-2-(4-氟-3-(三氟甲基)苯氧基)丁酰氯的制备。
[0282]
向含有(s)-2-(4-氟-3-(三氟甲基)苯氧基)丁酸(约385mmol)(即,来自合成实例1步骤5的标题材料)的反应器添加二氯甲烷(177g)。移除接收器并将冷凝器配置成表现为回流冷凝器。连接碱洗涤器并且添加吡啶(0.9g,11mmol)。在约10分钟内添加亚硫酰氯(52.1g,438mmol),产生白色烟雾。将反应器夹套调节至约50℃-55℃,以便使反应物质在约40℃下回流。使二氧化硫和氯化氢废气通过碱洗涤器排出。继续回流约3至5h,直至通过对等分试样的gc分析起始酸的量少于约0.5%。将反应器中的压力降低至约110毫巴并且将挥发物蒸馏出。将压力调节至10毫巴以确保所有挥发物完全去除。使反应器在氮气下达到环
境温度和压力,并且反应器配备有装满氯化钙的干燥管以提供作为油状物的标题化合物。在不进一步纯化或表征的情况下,将粗材料直接在下一个步骤中使用。
[0283]
步骤2:(s)-n-苄基-2-(4-氟-3-三氟甲基苯氧基)-丁酰胺的制备。
[0284]
向含有(s)-2-(4-氟-3-(三氟甲基)苯氧基)丁酰氯(约385mmol)(即,来自步骤1的标题材料)的反应器添加二氯甲烷(177g)。将溶液装入配备有机械搅拌器、温度计和滴液漏斗的夹套式反应器中,并且将反应混合物冷却至约5℃。在约1h的时间段内通过滴液漏斗添加苄胺(43.2g,438mmol)和三乙胺(44.3,438mmol)的混合物,同时维持温度低于10℃。在添加期间反应是高度放热的。在添加完成后,搅拌反应混合物约30分钟,直至通过对等分试样的gc分析起始酰氯的量少于约0.5%。将温度调节至约5℃并且添加水(131.8)。10分钟后,将相分离,并且去除水层。挥发物(主要是二氯甲烷)通过将压力降低至约100毫巴并且然后将反应物质温度逐渐增加至70℃来去除。添加异丙醇(200g)并且将得到的混合物冷却至约40℃且搅拌约15分钟。添加水(90.1g)以提供相当于在7:3的异丙醇:水混合物中的标题化合物的溶液(约30%w/w)的混合物。用来自之前运行的(s)-n-苄基-2-(4-氟-3-三氟甲基苯氧基)-丁酰胺(2g,2%种晶量)对溶液种晶,并且然后使用以下冷却模式冷却
[0285][0286]
将所得浆料在5℃下过滤并且使用冷滤液来洗涤反应器和滤饼。不再进一步洗涤滤饼,以避免再溶解产物。将滤饼在过滤器上在抽吸下干燥并且进一步空气干燥,以提供作为灰白色固体的标题化合物,其具有约95%的纯度以及约75%至80%来自(s)-2-(4-氟-3-(三氟甲基)苯氧基)丁酸的分离产率。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1