用于HER2的嵌合抗原受体和其使用方法与流程
用于her2的嵌合抗原受体和其使用方法
1.相关申请的交叉引用
2.本技术要求于2020年1月23日提交的美国临时申请第62/964,947号的权益。本技术通过全文引用的方式并入本文中。
3.序列表
4.本技术在此以引用的方式并入有与此同时提交的电子序列表材料。电子序列表中的材料以2021年1月22日创建的标题为“f1_005_wo_01_sequence_listing.txt”的文本(.txt)文档形式提交,其文件大小是354kb并且以全文引用的方式并入本文中。
5.联合研究协议
6.f1 oncology公司(现被称为埃秀马生物科技公司(exuma biotech corp.))和百奥生物有限责任公司(bioatla,llc)是与本文所公开的主题相关的联合研究协议的当事方。
技术领域
7.本公开涉及嵌合抗原受体和所述嵌合抗原受体在诊断和治疗方法中的用途。
背景技术:
8.在基于细胞的过继性免疫疗法中,从患者分离的免疫细胞可以被修饰为表达合成蛋白,所述合成蛋白使细胞在随后被转移回到患者中之后能够执行新的治疗功能。此类合成蛋白的实例是嵌合抗原受体(car)。目前使用的car的实例是胞外识别结构域(例如,抗原特异性靶向区域或astr)、跨膜结构域和一个或多个细胞内信号传导结构域的融合。在抗原接合时,car的细胞内信号传导部分可以在免疫细胞中启动激活相关的应答,如释放溶细胞分子以诱导肿瘤细胞死亡等。尽管car和car-t疗法对某些类型的血癌非常有效,但仍然需要针对实体瘤的car和car-t疗法,迄今为止已证明所述疗法更加难以捉摸。
9.虽然car-t疗法代表了一种用于治疗各种疾病,尤其是血癌的有前景的方法,但car-t疗法的安全性最近因临床试验期间的不良事件而受到质疑。一种用于减少这些不良事件的方法是减少astr的中靶脱瘤结合。由于被称为瓦博格效应(warburg effect)的癌细胞代谢改变,肿瘤微环境(tme)比正常生理环境酸性更大。具有条件活性astr的car仅在某些条件下与抗原结合(即条件活性生物car(cab car),如存在于tme中的那些,并且提供减少中靶脱瘤结合,使得car不会在正常生理条件下结合抗原。因此,这些car的副作用减少,并且治疗可以更安全地进行。尽管开发了此类cab car的某些实例,但仍然需要高效但安全的cab car。此外,仍然需要有效和安全的治疗方法,如针对实体瘤的新型cab car,因为虽然car-t疗法已被证明对治疗某些血癌非常有效,但开发针对实体瘤的有效car-t疗法已经更具挑战性。
10.受体酪氨酸激酶(rtk)是通过配体控制的酪氨酸激酶活性调节一系列正常细胞过程的细胞表面受体家族。在过去的20年中,对rtk的放松管制已被证明在癌症发展和进展中发挥关键作用。rtk现在被认为是预后分子生物标志物和肿瘤治疗剂的靶标。肿瘤学中的重
要的rtk是her2(erbb2)。her2受体是在许多组织中表达的1255个氨基酸、185kd跨膜糖蛋白rtk(iqbal和iqbal,《国际细胞与分子生物学评论(mol biol int.)》第2014卷,2014:852748)。her2过表达发生在许多实体癌中,包含例如乳腺癌、胃癌、食道癌、卵巢癌、子宫内膜癌、肺癌和膀胱尿路上皮癌(同前)。尽管her2的几种抗体和小分子抑制剂被批准用于治疗某些癌症,尤其是转移性乳腺癌,但这些治疗剂通常延长生存期,但不是治愈性的(同前)。例如,相当一部分用批准的靶向her2的单克隆抗体治疗的患有her2+乳腺癌的患者最终会复发或发展为进行性疾病。因此,仍然需要开发靶向her2癌症的有效治疗剂。此外,尽管已经制备了识别her2的car,以尝试提供更有效的抗her2疗法,但此类car会导致安全问题,并且甚至导致患者死亡,这被认为是由于与正常肺细胞的脱靶结合触发了细胞因子风暴(morgan等人,《分子疗法(mol.ther.)》2010;18(4)843-851)。
11.仍然需要一种有效的治疗方法,所述治疗方法利用免疫系统的力量来对抗癌症,但已经减少或消除了中靶脱瘤以及脱靶效应。尽管针对her2的单克隆抗体是可商购获得的,但仍需要包含靶向her2的抗体片段的car,所述抗体片段具有条件活性,仅在某些环境如癌症微环境中有效靶向表达her2的细胞。创建此类有条件活性的car提出了许多挑战。例如,必须创建和鉴定抗体片段,不仅当所述抗体片段作为car的一部分在t细胞或nk细胞的表面上表达时结合her2,而且另外具有识别暴露在癌细胞上的表位的能力。此外,与正常生理ph值相比,此类car理想地以条件活性的方式与其靶标结合,尤其是在肿瘤的酸性ph下。另外地,当此类候选car与其靶标结合时,必须激活表达car的t细胞或nk细胞以表达细胞毒性功能。因此,对含有此类抗体片段的car有很多要求,以帮助解决当前car-t方法带来的问题。此外,由于her2在许多实体瘤上表达,针对her2的此类条件活性car有望用于使用car-t疗法治疗实体癌,从而克服当前car-t疗法的主要限制。
技术实现要素:
12.本公开提供了与her2结合的嵌合抗原受体(car)和包括编码所述car的核苷酸序列的核酸以及与her2结合的条件活性生物(cab)car。本公开提供了经基因修饰以产生所述car的细胞、包括这些含cab car的细胞(尤其是cab cart细胞和nk细胞)群体的递送悬浮液以及用于制备此类细胞的方法。本公开的所述car可以用于也被提供的各种方法,所述方法包含用于在某些条件如tme的ph下激活免疫细胞的方法,以及用于执行如car疗法等过继性细胞疗法,所述car疗法例如针对癌症的car疗法。在本文所公开的概念验证实验中,使用表达本文所提供的此类cab car的t细胞和/或nk细胞的说明性实例显示,此类cab car t细胞和/或nk细胞是可以克服与中靶脱瘤效应相关的尤其是针对抗her2 car的问题的有效生物制剂。
13.在本公开全文中提供了本文所提供的各方面和实施例的细节。为了清楚起见,本发明内容部分不旨在且不应被解释为限制本文所提供的本公开的范围。
附图说明
14.图1a和1b示出了如通过elisa测量的各种抗体在不同ph值下与人her2蛋白的结合活性。条件活性抗体与her2基准抗体(bm)一起示出。
15.图2示出了荧光素酶杀伤测定中cho-s-her2靶细胞的裂解百分比。cho-s-her2细
胞和car-t效应细胞在低ph和高ph下共培养持续至多6小时。示出了基准car、x4-04和5个cab-car的数据,它们各自与x4-04的不同之处在于包括astr的scfv的重链或轻链中的5种不同的单个氨基酸取代。
16.图3示出了荧光素酶杀伤测定中cho-s-her2靶细胞的裂解百分比。cho-s-her2细胞和car-t效应细胞在低ph和高ph下共培养持续至多6小时。示出了与在每个定向上包括vh-1和vl-3的并通过连接子a(图3a)或连接子b(图3b)连接的cab car相比,在每个定向上包括vh-1和vl-1的基准car的数据。
17.图4示出了如在实时杀伤测定中在30小时内测量的car x4-03和x4-16在低ph和高ph下对cho-s-her2靶细胞的特异性裂解百分比。
18.图5示出了如通过流式细胞术测量的在低ph和高ph下与mcf7靶标共培养持续1天之后的cd3+etag+car-t细胞上的cd69的mfi的图。
19.图6示出了如通过流式细胞术测量的在低ph和高ph下与mcf7靶标共培养持续1天之后细胞内ifnγ染色阳性的cd3+etag+car-t细胞的百分比的图。
20.图7示出了如通过流式细胞术测量的在低ph和高ph下与mcf7靶标共培养持续5小时之后是cd107a+的cd3+etag+car-t细胞的百分比的图。
21.图8示出了如通过活cd3+门控细胞的流式细胞术测量的在低ph和高ph下与mcf7靶标共培养持续5天之后的wt1和候选2car-t细胞中的celltrace violet的量的直方图。
22.图9示出了用dpbs、cab-car细胞或wt car细胞处理后小鼠的平均sk-ov-3肿瘤体积。
23.图10a和10b示出了通过ivis对小鼠进行体内成像以观察在用cab-car细胞、wt car细胞或dpb处理后具有人her2-荧光素酶的强制肝脏表达和携带sk-ov-3肿瘤的小鼠的肝脏的生物发光的结果。图10a示出了小鼠的图像。图10b示出了平均总通量。
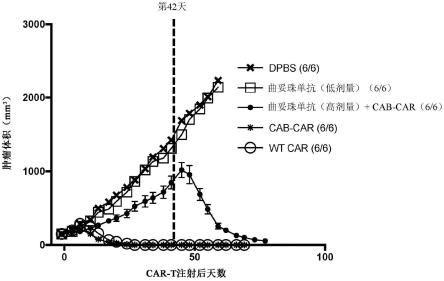
24.图11示出了用dpbs、曲妥珠单抗(低剂量)、曲妥珠单抗(高剂量),随后在第42天给药的cab-car细胞、cab-car细胞或wt car细胞处理后小鼠的平均nci-87肿瘤体积。
25.定义
26.如本文所用,术语“嵌合抗原受体”或“car”或“car”是指将抗原特异性移植到细胞例如t细胞、nk细胞、巨噬细胞和干细胞上的工程化受体。本发明的car包含至少一个抗原特异性靶向区(astr)、跨膜结构域(tm)和细胞内激活结构域(iad),并且可以包含茎结构域和一个或多个共刺激结构域(csd)。在另一个实施例中,car是对两种不同抗原或表位具有特异性的双特异性car。在astr与靶抗原特异性结合之后,iad激活细胞内信号传导。例如,iad可以利用抗体的抗原结合特性,以非mhc限制性方式将t细胞特异性和反应性重定向到选定的靶标。非mhc限制性抗原识别使表达car的t细胞能够识别独立于抗原处理的抗原,从而绕开了肿瘤逃逸的主要机制。此外,当在t细胞中表达时,有利地,car不会与内源性t细胞受体(tcr)α和β链发生二聚。
27.如本文所用,术语“组成型t细胞或nk细胞启动子”是指当与编码或指定基因产物的多核苷酸可操作地连接时,使基因产物在细胞的大部分或所有生理条件下在细胞中产生的启动子。
28.如本文所用,术语“诱导型启动子”或“可激活启动子”是指当与编码或指定基因产物的多核苷酸可操作地连接时,使基因产物基本上仅在启动子特异性诱导剂存在于细胞中
时在细胞中产生的启动子。诱导型启动子没有基础转录活性或具有低水平的基础转录活性,但在存在诱导信号的情况下转录活性有时会大大增加。
29.如本文所用,术语“微环境”意指组织或身体的与组织的其它区或身体的其它区具有恒定的或暂时的、物理的或化学的差异的任何部分或区。例如,如本文所用,术语“肿瘤微环境”(tme)是指肿瘤存在的环境,所述环境是肿瘤内的非细胞区域和正好在肿瘤组织外部但不属于癌细胞本身的细胞内区室的区域。tme可以指肿瘤环境的任何和所有条件,包含为恶性过程创建结构和/或功能环境以生存和/或扩大和/或扩散的条件。例如,tme可以包含条件的改变,如但不限于压力、温度、ph、离子强度、渗透压力、渗透压、氧化应激、一种或多种溶质浓度、电解质浓度、葡萄糖浓度、透明质酸浓度、乳酸或乳酸盐浓度、白蛋白浓度、腺苷水平、r-2-羟基戊二酸水平、丙酮酸浓度、氧浓度和/或氧化剂、还原剂或辅因子的存在以及熟练的技术人员将理解的其它条件。就ph而言,认为tme比正常生理ph具有酸性更大的ph。
30.如本文可互换使用的,术语“多核苷酸”和“核酸”是指任何长度的核苷酸的聚合形式,核糖核苷酸或脱氧核糖核苷酸。因此,此术语包含但不限于单链、双链或多链dna或rna、基因组dna、cdna、dna-rna杂交体或包括嘌呤和嘧啶碱基或其它天然的、经化学或生化修饰的、非天然的或衍生的核苷酸碱基的聚合物。
31.如本文所用,术语“抗体”包含多克隆抗体和单克隆抗体,包含保留与抗原特异性结合的完整抗体和抗体片段。抗体片段可以是但不限于片段抗原结合(fab)片段、fab
′
片段、f(ab
′
)2片段、fv片段、fab
′‑
sh片段、(fab
′
)2fv片段、fd片段、重组igg(rigg)片段、单链抗体片段,包含单链可变片段(scfv)、二价scfv、三价scfv和单结构域抗体片段(例如,sdab、sdfv、纳米抗体)。所述术语包含基因工程化和/或以其它方式修饰的免疫球蛋白形式,如胞内抗体、肽体、嵌合抗体、单链抗体、完全人抗体、人源化抗体、包含抗体的抗原特异性靶向区和非抗体蛋白的融合蛋白以及异缀合抗体、多特异性(例如,双特异性)抗体、双功能抗体、三功能抗体和四功能抗体、串联双scfv和串联三scfv
′
。除非另有说明,否则术语“抗体”应理解为包含其功能抗体片段。所述术语还包含完整或全长抗体,包含任何类别或亚类的抗体,包含igg以及其亚类、igm、ige、iga和igd。
32.如本文所用,术语“抗体片段”包含完整抗体的一部分,例如完整抗体的抗原结合或可变区。抗体片段的实例包含:fab片段、fab
′
片段、f(ab
′
)2片段和fv片段;双功能抗体;线性抗体(zapata等人,《蛋白质工程化(protein eng.)》8(10):1057-1062(1995));单链抗体分子;以及由抗体片段形成的多特异性抗体。木瓜蛋白酶消化抗体产生了:两个相同的抗原结合片段,被称为“fab”片段,每个抗原结合片段具有单个抗原结合位点;以及残留的“fe”片段,这一名称反映了容易结晶的能力。胃蛋白酶处理得到具有两个抗原组合位点并且仍然能够交联抗原的f(ab
′
)2片段。
33.如本文可互换使用的,术语“单链fv”、“scfv”或“sfv”抗体片段包含抗体的vh结构域和v
l
结构域,其中这些结构域存在于单个多肽链中。在一些实施例中,fv多肽进一步包含位于vh结构域与v
l
结构域之间的多肽连接子或间隔子,所述多肽连接子或间隔子使sfv能够形成用于抗原结合的期望的结构。关于sfv的综述,参见pluckthun,《单克隆抗体药理学(the pharmacology of monoclonal antibodies)》,第113卷,rosenburg和moore编,施普林格出版社(springer verlag),纽约,第269-315页(1994)。
34.如本文所用,“天然存在的”vh结构域和vl结构域是指当在特定条件下以scfv形式产生时已经从宿主分离而没有进一步进行分子进化来改变其亲和力的vh结构域和vl结构域。
35.如本文所用,术语“亲和力”是指两种药剂的可逆结合的平衡常数,并且被表示为解离常数(kd)。亲和力可以比抗体对无关氨基酸序列的亲和力大至少1倍、大至少2倍、大至少3倍、大至少4倍、大至少5倍、大至少6倍、大至少7倍、大至少8倍、大至少9倍、大至少10倍、大至少20倍、大至少30倍、大至少40倍、大至少50倍、大至少60倍、大至少70倍、大至少80倍、大至少90倍、大至少100倍或大至少1000倍或更多。抗体对靶蛋白的亲和力可以为例如约100纳摩尔(nm)到约0.1nm、约100nm到约1皮摩尔(pm)或约100nm到约1飞摩尔(fm)或更多。或如本文所用,术语“亲合力”是指两种或更多种药剂的复合物在稀释之后对解离的抗性。关于抗体和/或抗原结合片段,术语“免疫反应性”和“优先结合”在本文中可互换使用。
36.如本文所用,术语“结合”是指由于例如共价、静电、疏水和离子和/或氢键相互作用(包含如盐桥和水桥等相互作用)而产生的两个分子之间的直接缔合。非特异性结合将是指以小于约10-7
m的亲和力结合,例如以10-6
m、10-5
m、10-4
m等的亲和力结合。
37.如本文所用,提及“细胞表面表达系统”或“细胞表面展示系统”是指蛋白质或其部分在细胞的表面上的展示或表达。通常,产生的细胞表达与细胞表面蛋白融合的所关注蛋白质。例如,蛋白质表达为具有跨膜结构域的融合蛋白。
38.如本文所用,术语“元件”包含多肽,包含多肽的融合物、多肽的区、多核苷酸和其功能性突变体或片段。
39.如本文所用,术语“区”是多肽或多核苷酸的任何区段。
40.如本文所用,“结构域”是多肽或多核苷酸的具有功能和/或结构特性的区。
41.如本文所用,术语“茎”或“茎结构域”是指为侧接多肽区提供结构柔性和间隔的柔性多肽连接区,并且可以由天然或合成多肽组成。茎可以源自免疫球蛋白(例如,igg1)的通常被定义为从人igg1的glu216延伸至pro230的铰链或铰链区(burton(1985)《分子免疫学(molec.immunol.)》,22:161-206)。通过将形成重链间二硫键(s-s)键的第一个半胱氨酸残基和最后一个半胱氨酸残基放置在相同位置中,可以将其它igg同型(isotype)的铰链区与igg1序列比对。茎可以是天然发生的或非天然发生的,包含但不限于改变的铰链区。茎可以包含源自任何类别或亚类的抗体的完整铰链区。茎还可以包含源自cd8、cd28或其它受体的区,所述受体在为侧接区域提供柔性和间隔方面提供类似功能。
42.如本文所用,术语“分离的”意指将材料从其原始环境(例如,如果其天然存在的话,自然环境)中去除。例如,存在于活动物中的天然存在的多核苷酸或多肽不是分离的,但是从天然系统中的一些或全部共存材料分离的相同的多核苷酸或多肽是分离的。此类多核苷酸可以是载体的一部分和/或此类多核苷酸或多肽可以是组合物的一部分,并且仍然是分离的,因为此类载体或组合物不是其天然环境的一部分。
43.如本文所用,“多肽”是通过肽键连接的单链氨基酸残基。多肽不折叠成固定结构,也不具有任何翻译后修饰。“蛋白质”是折叠成固定结构的多肽。“多肽”和“蛋白质”在本文中可互换使用。
44.如本文所用,可以“纯化”多肽以去除多肽自然环境中的污染物组分,例如,干扰多肽的诊断或治疗用途的物质,如例如酶、激素和其它蛋白质或非蛋白质溶质。多肽可以被纯
化以达到如通过lowry方法确定的(1)大于90重量%、大于95重量%或大于98重量%的抗体,例如大于99重量%,(2)以足以通过使用旋转杯测序仪获得n端的至少15个残基或内部氨基酸序列,或(3)以使用考马斯蓝或银染色在还原或非还原条件下通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sds-page)进行均质化。
45.如本文所用,术语“免疫细胞”通常包含源自骨髓中产生的造血干细胞(hsc)的白血细胞(白细胞)。“免疫细胞”包含例如淋巴细胞(t细胞、b细胞、自然杀伤(nk)细胞)和骨髓源性细胞(嗜中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、单核细胞、巨噬细胞、树突状细胞)。
46.如本文所用,“t细胞”包含表达cd3的所有类型的免疫细胞,包含t-辅助细胞(cd4
+
细胞)、细胞毒性t细胞(cd8+细胞)、t-调节细胞(treg)和γ-δt细胞。nkt细胞是表达cd3的t细胞子集,并且通常共表达αβt细胞受体,但也表达通常与nk细胞相关的各种分子标志物(如nk1.1或cd56)。
47.如本文所用,“细胞毒性细胞”包含cd8
+
t细胞、自然杀伤(nk)细胞、nk-t细胞、γδ t细胞、cd4
+
细胞亚群以及嗜中性粒细胞,所述细胞是能够介导细胞毒性应答的细胞。
48.如本文所用,术语“干细胞”通常包含多能或专能干细胞。“干细胞”包含例如胚胎干细胞(es);间质干细胞(msc);诱导性多能干细胞(ips);以及定型祖细胞(造血干细胞(hsc);骨髓源性细胞等)。
49.如本文所用,术语“治疗(treatment、treating)”等是指获得期望药理学和/或生理学效果。就完全或部分预防疾病或其症状而言,所述效果可以是预防性的,和/或就部分或完全治愈疾病和/或可归因于疾病的副作用而言可以是治疗性的。如本文所用,“治疗”涵盖对哺乳动物例如人的疾病的任何治疗,并且包含:(a)预防疾病在可能易患疾病但尚未诊断患有所述疾病的受试者体内发生;(b)抑制疾病,即,遏制其发展;以及(c)缓解疾病,即,使疾病消退。
50.如本文可互换使用的,术语“个体”、“受试者”、“宿主”和“患者”是指哺乳动物,包含但不限于人类、鼠类(例如,大鼠、小鼠)、兔类动物(例如,兔)、非人灵长类动物、犬科动物、猫科动物、有蹄类动物(例如,马、牛、绵羊、猪、山羊)等。
51.如本文所用,术语“治疗有效量”或“有效量”是指当施用于哺乳动物或其它受试者以治疗疾病时足以影响疾病的此类治疗的一种药剂的量或两种药剂的组合量。治疗有效量将根据药剂、疾病及其严重性以及待治疗的受试者的年龄、体重等而变化。
52.如本文所用,术语“进化(evolution或evolving)”是指使用一种或多种诱变方法产生编码不同多肽的不同多核苷酸,所述不同多核苷酸本身是改进的生物分子和/或有助于产生另一种改进的生物分子。“生理”或“正常”或“正常生理”条件是如但不限于以下的条件:压力、温度、ph、离子强度、渗透压力、渗透压、氧化应激、一种或多种溶质浓度、电解质浓度、葡萄糖浓度、透明质酸浓度、乳酸或乳酸盐浓度、白蛋白浓度、腺苷水平、r-2-羟基戊二酸水平、丙酮酸浓度、氧浓度和/或氧化剂、还原剂或辅因子的存在以及将被视为在施用位点或作用位点的组织或器官处对受试者是正常范围内的其它条件。
53.如本文所用,“转导细胞”或“稳定转染细胞”是含有整合到细胞的基因组中的外源性核酸的细胞。如本文所用,“经基因修饰的细胞”是含有外源性核酸的细胞,无论外源性核酸是否整合到细胞的基因组中,并且无论用于将外源性核酸引入到细胞中的方法。细胞内
的未整合到细胞的基因组中的外源性核酸在本文中可以被称为“染色体外的”。如本文所用,“经修饰的细胞”是与在说明性实施例中是无复制能力的重组逆转录病毒颗粒的重组核酸载体相关的含有外源性核酸的细胞,或已经被外源性核酸基因修饰的细胞。通常,在包含无复制能力的重组逆转录病毒颗粒的组合物和方法中,经修饰的细胞通过细胞的表面上的蛋白质与无复制能力的重组逆转录病毒颗粒的表面上的蛋白质之间的相互作用与无复制能力的重组逆转录病毒颗粒缔合,包含假型化元件和/或t细胞激活元件。在包含将核酸转染到基于脂质的试剂如脂质体试剂内的组合物和方法中,作为一种重组核酸载体的含有核酸的基于脂质的试剂在融合或被经修饰的细胞内化之前与经修饰的细胞的脂质双层缔合。类似地,在包含基于化学的核酸转染如基于聚乙烯亚胺(pei)或磷酸钙的转染的组合物和方法中,核酸通常与带正电荷的转染试剂缔合以形成重组核酸载体,所述重组核酸载体在复合物被经修饰的细胞内化之前与经修饰的细胞的带负电荷的膜缔合。稳定转染或基因修饰细胞的其它手段或方法包含电穿孔、弹道递送和显微注射。如本文所用,“多肽”可以包含部分或整个蛋白质分子以及任何翻译后或其它修饰。
54.如本文所用的假型化元件可以包含鉴定和结合靶宿主细胞的包含一种或多种多肽,通常是糖蛋白的“结合多肽”和一种或多种介导逆转录病毒和靶宿主细胞膜的融合由此允许逆转录病毒基因组进入到靶宿主细胞中的“融合多肽”。如本文所用,“结合多肽”也可以被称为“t细胞和/或nk细胞结合多肽”或“靶接合元件”,并且“融合多肽”也可以被称为“融合元件”。
[0055]“静息”淋巴细胞,如例如静息t细胞,是处于细胞周期的g0阶段的不表达激活标志物如ki-67的淋巴细胞。静息淋巴细胞可以包含从未遇到特异性抗原的原初t细胞和因先前遇到抗原而改变的记忆t细胞。“静息”淋巴细胞也可以被称为“静态”淋巴细胞。
[0056]
如本文所用,“淋巴细胞清除”涉及减少受试者的淋巴细胞数量的方法,例如通过施用淋巴细胞清除剂。淋巴细胞清除也可以通过局部或全身分段放射疗法来实现。淋巴细胞清除剂可以是当施用于哺乳动物时能够减少哺乳动物的功能性淋巴细胞数量的化合物或组合物。此类药剂的一个实例是一种或多种化学治疗剂。此类药剂和剂量是已知的,并且可以由治疗医师根据要治疗的受试者来选择。淋巴细胞清除剂的实例包含但不限于氟达拉滨(fludarabine)、环磷酰胺(cyclophosphamide)、克拉屈滨(cladribine)、地尼白介素(denileukin diftitox)、阿仑单抗(alemtizumab)或其组合。
[0057]
如本文所用,“重组逆转录病毒”是指不可复制的或“无复制能力的”逆转录病毒,除非明确指出它是可复制的逆转录病毒。术语“重组逆转录病毒”和“重组逆转录病毒颗粒”在本文中可互换使用。此类逆转录病毒/逆转录病毒颗粒可以是任何类型的逆转录病毒颗粒,包含例如γ逆转录病毒,并且在说明性实施例中,慢病毒。如已知的,此类逆转录病毒颗粒,例如慢病毒颗粒,通常通过用质粒转染包装细胞在包装细胞中形成,所述质粒包含包装组分如gag、pol和rev、编码假型化元件的包膜或假型化质粒以及转移、基因组或逆转录病毒(例如,慢病毒)表达载体,所述表达载体通常是基因或其它所关注编码序列在其上编码的质粒。因此,逆转录病毒(例如,慢病毒)表达载体包含在转染到细胞中之后促进表达和包装的序列(例如,5
′
ltr和3
′
ltr侧翼,例如psi包装元件和靶异源编码序列)。术语“慢病毒”和“慢病毒颗粒”在本文中可互换使用。
[0058]
如本文所用,术语“构建体”是指分离的多肽或编码多肽的分离的多核苷酸。技术
人员将根据上下文理解构建体是指分离的多核苷酸还是分离的多肽。
[0059]
如本文所用,“moi”是指感染复数比率,其中moi等于每细胞数量用于感染的病毒颗粒数量的比率。作为非限制性实例,可以使用facs和报告基因表达对病毒颗粒数量进行功能滴定。
[0060]“外周血单核细胞”(pbmc)包含具有圆形细胞核的外周血细胞并且包含淋巴细胞(例如,t细胞、nk细胞和b细胞)和单核细胞。一些不是pbmc的血细胞类型包含红细胞、血小板和粒细胞(即,中性粒细胞、嗜酸性粒细胞和嗜碱性粒细胞)。
[0061]
应当理解,本公开以及本文所提供的各方面和实施例不限于所公开的特定实例,因为这样当然可以变化。还应理解的是,本文使用的术语仅是为了公开特定实例和实施例的目的,而并不旨在是限制性的,因为本公开的范围将仅由所附权利要求书限定。
[0062]
在提供了值范围的情况下,应当理解的是,介于所述范围的上限与下限之间的每个中间值(到下限的单位的十分之一,除非另外明确说明)以及所述范围中的任何其它所陈述或中间值均涵盖于本公开内。这些较小范围的上限和下限可以独立地包含在更小的范围中,并且也涵盖在本发明内,这受制于所陈述的范围中的任何明确排除的限值。在所陈述的范围包含限值中的一个或两个限值的情况下,排除那些被包含在内的限值中的任一个或两个限值的范围也包含在本发明内。当对于重叠的范围给出多个低值和多个高值时,所属领域的技术人员应认识到,所选择的范围将包含小于高值的低值。本说明书中的所有标题均是为了方便阅读起见且不是限制性的。
[0063]
除非另外定义,否则本文所使用的所有技术术语和科学术语均具有与本发明所属领域普通技术人员通常所理解的含义相同的含义。虽然类似或等效于本文所描述的那些方法和材料的任何方法和材料也可以用于本发明的实践或测试,但现在描述优选的方法和材料。在此提及的所有公开是通过引用结合在此,以结合所引用的这些公开来公开和描述这些方法和/或材料。
[0064]
必须注意,除非上下文另外明确指示,否则如在本文和所附权利要求中所使用的,单数形式“一个”、“一种”和“所述”包含复数指代物。因此,例如,提及“嵌合抗原受体”包含本领域技术人员已知的多个此类嵌合抗原受体和其等效物,等等。另外注意,权利要求可以撰写为排除任何任选的要素。因此,所述陈述旨在用作前置基础,用于结合权利要求要素的叙述使用如“单独地”、“仅”等排他性术语或使用“负面”限制。
[0065]
应当理解,为了清楚起见,在单独实施例的背景下描述的本发明的某些特征还可以以组合形式提供在单个实施例中。相反地,为了简便起见,在单个实施例的背景下描述的本发明的不同特征也可以单独地或以任何适合的子组合提供。本发明具体涵盖与本发明有关的实施例的所有组合,并且在本文中公开,就好像每个和每个组合被单独和明确地公开一样。此外,本发明还具体涵盖了各种实施例及其元件的所有子组合,并且在本文中公开,就好像每个子组合和每个这种子组合在本文中单独和明确地公开一样。本文所使用的任何章节标题仅仅是出于组织的目的并且不应被解释为以任何方式限制所描述的主题。
具体实施方式
[0066]
本文所公开的各方面和实施例通过在某些方面提供用于结合her2的新型嵌合抗原受体(car)来克服当前癌症疗法,并且具体地是靶向her2的癌症疗法,的中靶脱瘤效应的
问题。在说明性实施例中,本文所提供的用于结合her2的car是用于产生本文所提供的cab car-t细胞和nk细胞的在肿瘤环境中具有活性但在正常生理组织/器官中活性较低或不具有活性的条件活性生物car(即,抗her2 cab car)。此类cab car,并且尤其是表达此类cab car的t细胞和nk细胞,以及本文所提供的包含此类cab car t细胞和nk细胞的递送悬浮液,有望用于疗法,并用于制造治疗剂,尤其是用于治疗实体瘤,尤其是表达her2和/或归类为her2+肿瘤的实体瘤。在本文所公开的概念验证实验中显示,使用表达此类cab car的此类t细胞和/或nk细胞,与正常生理ph相比,本文所提供的示例性cab car t细胞和/或nk细胞可以更有效地杀死在较低ph(例如,tme的ph)下表达her2的靶细胞。此外,本文在此类概念验证实验中显示,本文所提供的表达抗her2 cab car的car-t细胞的说明性实例可以在体内小鼠模型中杀死表达her2的肿瘤细胞,而保留在tme外表达her2的细胞。
[0067]
除了结合her2的car的各个实施例之外,本文所提供的核酸实施例包含编码本文所提供的任何car或编码可以用于此类car的抗原特异性靶向区(astr)的核苷酸序列。此外,用于表达此类car的表达载体,如用于表达所述car中的任何car的病毒构建体和逆转录病毒颗粒。本公开的car可以用于多种方法,所述方法也与用编码本公开的car的表达载体如重组病毒载体感染t细胞和其它细胞毒性细胞的方法一起提供。
[0068]
条件活性生物抗her2 car(抗her2 cab-car)
[0069]
本公开提供了嵌合抗原受体,为简单起见,所述嵌合抗原受体在本文中被称为“car”。在说明性实施例中,本公开的car是与her2结合的多肽,并且在进一步说明性实施例中,car以条件活性方式与her2结合。本文所提供的说明性抗her2 car通常包含与her2结合的抗原特异性靶向区(astr),所述her2与其它car结构域连接,并且在说明性实施例中,与其它car结构域共价连接。这些其它car结构域通常包含将抗her2 astr连接到跨膜结构域的茎结构域,所述跨膜结构域连接到细胞内信号传导结构域。这些其它car结构域可以进一步包含一个或多个调节结构域以及本领域已知的任何car结构域,其中一些在本文中明确提供。astr通常包含分开的重链可变区和轻链可变区,在说明性实施例中,所述重链可变区和轻链可变区位于由连接子分开的相同多肽链上。
[0070]
一方面,本文提供了一种car,其包含:a)与ph为7.4相比,在ph为6.7时,表现出与her2的结合增加的至少一个条件活性抗原特异性靶向区(astr);b)跨膜结构域;以及c)细胞内激活结构域。在说明性实施例中,car的抗原特异性靶向区是抗her2抗体的条件活性scfv部分。此外,在说明性实施例中,与正常生理环境相比,astr在肿瘤环境中表现出活性增加。
[0071]
本公开的car在说明性实施例中是条件活性的。这种特性通常是car的抗her2astr结构域的条件活性性质的结果,表现为与正常组织中的生理ph相比,在较低ph下与her2的结合增加,在说明性实施例中,相对于ph为7.4,在ph为6.7下结合增加。不受理论限制,本文所提供的抗her2 astr的这种条件结合可以赋予包含此类条件活性抗her2 astr的car条件抗her2 car活性。在某些实施例中,本文所提供的car的条件抗her2活性是在将表达car的细胞暴露于her2表达性靶细胞时,与ph为7.4相比,在ph为6.5到6.9(说明性实施例6.7)下增加的car活性。在一些实施例中,此抗her2 car活性是在与her2表达性靶细胞一起温育时对t细胞的激活。在一些实施例中,对t细胞的激活是通过分析t细胞对t细胞激活生物标志物表达增加、t细胞进行的细胞因子产生、t细胞进行的增殖和t细胞进行的靶细胞杀伤中的
一种或多种来确定的。如本文更详细地讨论和本文实例所展示的,抗her2 car活性可以在体外测定中测量,其中在检测和/或测量t细胞的激活之前,表达her2的靶细胞和用编码被测car的核酸转导的被测car-t细胞在测定培养基中一起温育持续一定有效时间。
[0072]
在某些说明性实施例中,本公开的cab-car在tme中的条件下比在非tme中的条件下对her2具有更高的结合亲和力。在一些实施例中,tme中的条件和非tme中的条件均是ph。因此,cab-car可以以条件活性方式选择性地与her2结合,通常是因为与ph为约7.2到7.8(在正常生理环境中遇到的ph)相比,它们在ph为约6.0到6.8(在tme中遇到的ph)下对her2具有更高的结合亲和力。例如,本文所提供的说明性cab-car在ph 6.7下对her2的结合亲和力比在ph 7.4下更高。另外地或可替代地,本文所提供的说明性cab-car在ph 6.0下对her2的结合亲和力比在ph 7.4下更高。可以在体外肿瘤替代测定中测试此类条件,例如,在体内肿瘤环境中发现的一种或多种条件下测试抗原结合和/或car活性(例如,细胞裂解),如下文更详细地阐述,这与正常生理组织中的对应条件不同。例如,与生理ph(7.2-7.8)相比,体外肿瘤替代测定条件可以是低ph(例如,6.0-6.8)。在说明性实例中,肿瘤替代测定条件是ph为6.7,而对应生理ph为7.4。
[0073]
靶向her2的条件活性astr
[0074]
如本文所讨论的,本文所提供的说明性car的条件抗her2 car活性被认为是与在正常生理ph下的结合相比,在低于正常生理ph的ph下这些car的astr与her2的结合增加的结果。因此,本文所提供的各个方面中的任何方面的说明性实施例包含具有条件活性astr的car,与ph为7.4相比,所述条件活性astr在ph为5.0到6.8、或ph为6.5到6.8或ph为6.7下与her2蛋白的结合增加。此类astr和含有此类astr的car的实例在本文中的实例中提供。不受理论的限制,值得注意的是,发明人相信可以用本文所公开的包含重链可变区和/或轻链可变区的任何astr制备car,所述重链可变区和/或轻链可变区当存在于抗体中时赋予所述抗体在ph 6.7下相对于7.4增加的结合,所述car将具有抗her2 cab-car活性,其中与7.4相比,在ph 6.7下活性增加。尽管在本文实例中测试的每个car构建体(包含测试的此类car可变轻链和/或重链)中均未检测到抗her2 cab杀伤活性或甚至不受ph影响的杀伤活性,但相信进一步的测试将揭示这些car中的任何car的抗her2 cab-car性质,尤其是当与用cab抗体中未发现的重链可变区和轻链可变区制备的astr相比时。
[0075]
在一些实施例中,astr或其包括此类astr的重链和轻链的抗体或抗体片段在tme中的ph如ph为5.0到6.8或ph为6.0或ph为6.7下例如对her2蛋白的结合亲和力与在非tme中的不同ph如ph为7.4下对her2蛋白的结合亲和力的比率可以为至少约1.5∶1、至少约2∶1、至少约3∶1、至少约4∶1、至少约5∶1、至少约6∶1、至少约7∶1、至少约8∶1、至少约9∶1、至少约10∶1、至少约20∶1、至少约30∶1、至少约50∶1、至少约70∶1或至少约100∶1。
[0076]
在某些实施例中,astr与包含seq id no:119的重链和seq id no:122的轻链的抗体结合于her2的相同表位。在说明性实施例中,所述astr与包括通常由连接子分开的seq id no:119的抗体重链可变区和seq id no:122的抗体轻链可变区的单链可变抗体片段结合于her2的相同表位。在说明性实施例中,重链可变区可以是seq id no:123-125中的任一个,并且轻链可变区可以是seq id no:122。在说明性方面中,具有此类astr的car是条件活性抗her2 car(即,抗her2 cab car)。此类抗her2 cab car的非限制性实例在本文中的实例中提供。在一些实施例中,car或编码car的分离的核酸可以包含seq id no:153-236或
seq id no:157-236的astr中的任何astr,其在本文中的实例中测试并且相对于对照car显示出增加的杀伤活性。在一些实施例中,car或编码car的分离的核酸可以包含在本文中的实例中鉴定的astr中的任何astr,其与7.4相比,在存在her2表达性靶细胞的情况下在ph 6.7下显示cab活性。已发现包括这些astr和对应car的重链可变区和轻链可变区的抗体在ph 6.0下对her2的结合亲和力比在ph 7.4下更高(参见例如美国临时申请第62/964,747号的图4和8(以全文引用的方式并入本文中))。
[0077]
在说明性实施例中,轻链可变区可以是seq id no:126-130中的任一个,并且重链可变区可以是seq id no:119。这些重链可变区和轻链可变区组合在本文中的实例中显示出cab-car活性。在至少一位发明人进行的实验中已经发现包括这些重链可变区和轻链可变区的抗体在ph 6.0下比在ph 7.4下对her2具有更高的结合亲和力(参见例如图4和8和美国临时申请第62/964,747号(以全文引用的方式并入本文中))。
[0078]
seq id no:119和122的重链可变区和轻链可变区的组合在本文中分别被称为基准。基准的cdr是:与seq id no:119的氨基酸26到35相对应的hcdr1 gfnikdtyih(seq id no:131);与seq id no:119的氨基酸50到66相对应的hcdr2 riyptngytryadsvkg(seq id no:132);与seq id no:119的氨基酸99到109相对应的hcdr3 wggdgfyamdy(seq id no:133);与seq id no:122的氨基酸24到34相对应的lcdr1 rasqdvntava(seq id no:134);与seq id no:122的氨基酸50到56相对应的lcdr2 sasflys(seq id no:135);以及与seq id no:122的氨基酸89到97相对应的lcdr3 qqhyttppt(seq id no:136)。这些cdr包含基于cdr的序列定义的氨基酸(kabat等人(1987)具有免疫学意义的蛋白质序列(sequences of proteins of immunological interest)马里兰州贝塞斯达美国国立卫生研究院(natl.inst.health,bethesda,md))和基于cdr的机构定义的氨基酸(chothia和lesk(1987)《分子生物学杂志(j.mol.biol.)》196:901-917)。本文提供的car的抗her2 astr的cdr类似地进行定义。包括由示例性连接子分开的基准重链和轻链的非限制性示例性astr在seq id no:153-156中提供。
[0079]
在本文中的说明性实施例中,相比于在ph为7.4时,本文所提供的抗her2 astr赋予含有它们的car在ph为6.7时增加的car活性。在说明性实施例中,这些car中的抗her2 astr与包括seq id no:119的抗体重链可变区和seq id no:122的抗体轻链可变区的抗体或单链可变抗体片段结合于her2的相同表位。在说明性实施例中,与7.4相比,本文所提供的此类抗her2 astr在ph为6.7下与her2的结合更大。
[0080]
在其中astr与her2结合的一些实施例中以及其中astr与包括seq id no:119的抗体重链可变区和seq id no:122的抗体轻链可变区的抗体或单链可变抗体片段结合于her2的相同表位的说明性实施例中,astr通常包含包括具有序列hcdr1、hcdr2和hcdr3的三个互补决定区(cdr)的重链可变区,其中:
[0081]
所述hcdr1序列是gfnikdtyih(seq id no:131);
[0082]
所述hcdr2序列是x1iyptngytx2yadsvkg(seq id no:137);并且
[0083]
所述hcdr3序列是wggdgfyamdy(seq id no:133);
[0084]
并且所述astr通常包含轻链可变区,所述轻链可变区包含具有序列lcdr1、lcdr2和lcdr3的三个cdr,其中:
[0085]
所述lcdr1序列是rasqdvntx3va(seq id no:142);
[0086]
所述lcdr2序列是sasflys(seq id no:135);并且
[0087]
所述lcdr3序列是qqx4yttppt(seq id no:143),
[0088]
其中x1是r或k,x2是r或e,x3是a或d,并且x4是h、d或e。
[0089]
在说明性实施例中,重链可变区和轻链可变区的组合不包括基准的重链和轻链cdr的组合。在说明性实施例中,astr在重链可变区与轻链可变区之间包括5到50(例如,10到40、15到30)个氨基酸连接子。在一些实施例中,astr具有各自分别与seq id no:119和seq id no:122至少70%、80%、85%、90%、95%、96%、97%、98%或99%相同的重链可变区序列和轻链可变区序列,并且包括作为k的x1、作为e的x2、作为d的x3或作为d或e的x4中的一者、两者、三者或所有四者。在一些实施例中,astr具有各自分别与seq id no:119和seq id no:122相同的重链可变区序列和轻链可变区序列,除了作为k的x1、作为e的x2、作为d的x3或作为d或e的x4中的一者、两者、三者或所有四者。包括由示例性连接子分开的包含基准cdr的基准重链和轻链的示例性astr提供于seq id no:153-156中。
[0090]
在一些实施例中,astr中的x1、x2、x3和x4分别是r、r、a和h。然而,在说明性实施例中,其中上述方面中的cdr不包含基准的重链可变区和轻链可变区的组合,astr中的x1、x2、x3和x4的组合不是分别为r、r、a和h。因此,例如,重链和轻链不是分别为seq id no:119和seq id no:122。在说明性实施例中,astr不包含seq id no:119和122的两个序列(即,组合)。在一些实施例中,astr不包含cdr的组合,其中x1是重链可变区中的r并且x2是r,并且x3是轻链可变区中的a并且x4是h。在说明性实施例中,astr的其余部分包括除cdr之外的seq id no:119的重链可变区(重链可变区的框架区),以及除cdr之外的seq id no:122的轻链可变区(轻链可变区的框架区)。
[0091]
在一些实施例中,重链可变区和轻链可变区的x1、x2、x3和x4可以分别是r、r、d和h(a032d);分别是r、r、a和d(h091d);分别是r、r、a和e(h091e);分别是k、r、a和h(r050k);或者分别是r、e、a和h(r059e)。来自基准的这些突变体中的每个突变体在抗体中被鉴定为在低于7.4的ph下提供增加的与her2的结合,如本文中的实例中所展示的。如本文中的实例所示,当包含在抗her2 car的astr中时,来自基准的这些重链可变区单突变体和轻链可变区单突变体中的每个单突变体都提供了cab-car活性。
[0092]
在实例2和3中,具有含有这些序列作为cdr的astr的car裂解了her2表达性细胞(表2-4)。在ph为6.7(典型的tme)与ph为7.4(典型的非tme)之间的活性比大于112(即,在较低的ph下显示出更高的活性)的car,被鉴定为cab(在表3中被归类为“cab”的构建体)。用另一个的astrn端的重链或轻链以及重链与轻链之间的连接子对car进行测试。在这些实施例中的任何实施例中,轻链可以是重链的n端,或者重链可以是轻链的n端。在说明性实施例中,car可以包含cdr以及在说明性实施例中,表3中的都具有如实例2所示的cab-car活性的f1-4-37、f1-4-26、f1-4-27、f1-4-28、f1-4-74、f1-4-75、f1-4-77、f1-4-81和f1-4-85中的任一个(seq id no:154、156、159-162、172-173、175-176、199或224)的astr。表3示出了cdr中的突变以及重链或轻链是否在另一个的n端。对于重链和轻链,car分别含有seq id no:119和122的fr。值得注意的是,虽然f1-4-31在实例2中被归类为野生型,因为其cab活性不大于基准的活性,但它的裂解百分比比率大于1,并且因此可以具有cab活性。
[0093]
在一些实施例中,本文所提供的任何car可以具有包含seq id no:119的重链和seq id no:126-128的任何轻链的astr。在一些实施例中,astr可以包含seq id no:123或
seq id no:124的重链和seq id no:122的轻链。
[0094]
在其中astr与her2结合的一些实施例中以及其中astr与包括seq id no:119的抗体重链可变区和seq id no:122的抗体轻链可变区的单链可变抗体片段结合于her2的相同表位的说明性实施例中,重链可变区可以包含具有序列hcdr1、hcdr2和hcdr3的三个互补决定区(cdr),其中:
[0095]
所述hcdr1序列是gfx1ikdtyih(seq id no:138);
[0096]
所述hcdr2序列是rix2ptx3x4yx5ryadsvkg(seq id no:139);并且
[0097]
所述hcdr3序列是wggdgfyx6mdy(seq id no:140);
[0098]
并且所述astr可包含轻链可变区,所述轻链可变区包含三个cdr,所述cdr具有序列lcdr1、lcdr2和lcdr3,其中:
[0099]
所述lcdr1序列是rasqdvntava(seq id no:134);
[0100]
所述lcdr2序列是sasflys(seq id no:135);并且
[0101]
所述lcdr3序列是qqhyttppt(seq id no:136),
[0102]
其中x1是n或w;x2是y、d或k;x3是n或a;x4是g或k;x5是t或d并且x6是a或e;
[0103]
并且其中重链可变区和轻链可变区的组合不包括基准的重链和轻链cdr的组合。
[0104]
由于上述方面中的cdr不包含基准的重链可变区和轻链可变区的组合,astr中的x1、x2、x3、x4、x5和x6的组合不是分别为n、y、n、g、t和a。因此,例如,重链和轻链不是分别为seq id no:119和seq id no:122。在说明性实施例中,astr不包括seq id no:119和122的两个序列(即,组合)。在说明性实施例中,astr的其余部分包括除cdr之外的seq id no:119的重链可变区(重链可变区的框架区),以及除cdr之外的seq id no:122的轻链可变区(轻链可变区的框架区)。
[0105]
在一些实施例中,重链可变区和轻链可变区的x1、x2、x3、x4、x5和x6可以分别是w、y、n、g、t和a(n028w);分别是n、d、n、g、t和a(y052d);分别是n、k、n、g、t和a(y052k);分别是n、y、a、g、t和a(n055a);分别是n、y、n、k、t和a(g056k);分别是n、y、n、g、d和a(t058d);或者分别是n、y、n、g、t和e(a106e)。在一些实施例中,重链可以包含突变s119e。当作为抗her2抗体测试时,这些突变显示具有cab活性(参见例如,实例1和美国临时申请第62/964,747号(通过引用并入本文))。
[0106]
在其中astr与her2结合的一些实施例中以及其中astr与包括seq id no:119的抗体重链可变区和seq id no:122的抗体轻链可变区的单链可变抗体片段结合于her2的相同表位的说明性实施例中,重链可变区可以包含具有序列hcdr1、hcdr2和hcdr3的三个互补决定区(cdr),其中:
[0107]
所述hcdr1序列是gfx1ikdtyih(seq id no:138);
[0108]
所述hcdr2序列是x2ix3ptx4x5yx6x7yadsvkg(seq id no:141);并且
[0109]
所述hcdr3序列是wggdgfyx8mdy(seq id no:140);
[0110]
并且所述astr可包含轻链可变区,所述轻链可变区包含三个cdr,所述cdr具有序列lcdr1、lcdr2和lcdr3,其中:
[0111]
所述lcdr1 rasqdvntx9va(seq id no:142);
[0112]
所述lcdr2序列是sasflys(seq id no:135);并且
[0113]
所述lcdr3序列是qqx
10
yttppt(seq id no:143),
[0114]
其中x1是n或w,x2是r或k,x3是y、d或k,x4是n或a,x5是g或k,x6是t或d,x7是r或e,x8是a或e,x9是a或d,并且x
10
是h、d或e;
[0115]
并且其中重链可变区和轻链可变区的组合不包括基准的重链和轻链cdr的组合。
[0116]
由于上述方面中的cdr不包含基准的重链可变区和轻链可变区的组合,在说明性实施例中,astr中的x1、x2、x3、x4、x5、x6、x7、x8、x9和x
10
的组合不是分别为n、r、y、n、g、t、r、a、a和h。因此,例如,重链和轻链不是分别为seq id no:119和seq id no:122。在说明性实施例中,astr不包括seq id no:119和122的两个序列(即,组合)。在说明性实施例中,astr的其余部分包括除cdr之外的seq id no:119的重链可变区(重链可变区的框架区),以及除cdr之外的seq id no:122的轻链可变区(轻链可变区的框架区)。
[0117]
在一些实施例中,重链可变区和轻链可变区的x1、x2、x3、x4、x5、x6、x7、x8、x9和x
10
可以分别是w、r、y、n、g、t、r、a、a和h(n028w);分别是n、k、y、n、g、t、r、a、a和h(r050k);分别是n、r、d、n、g、t、r、a、a和h(y052d);分别是n、r、k、n、g、t、r、a、a和h(y052k);分别是n、r、y、a、g、t、r、a、a和h(n055a);分别是n、r、y、n、k、t、r、a、a和h(g056k);分别是n、r、y、n、g、d、r、a、a和h(t058d);分别是n、r、y、n、g、t、e、a、a和h(r059e);分别是n、r、y、n、g、t、r、e、a和h(a106e);分别是n、r、y、n、g、t、r、r、d和h(a032d);分别是n、r、y、n、g、t、r、a、a和d(h091d);分别是n、r、y、n、g、t、r、a、a和e(h091e);分别是n、r、k、n、g、t、r、r、d和h(y052k/a032d);分别是n、r、y、n、k、t、r、r、d和h(g056k/a032d);分别是n、r、y、n、g、d、r、d、a和h(t058d/a032d);或者分别是n、r、y、n、g、t、r、e、d和h(a106e/a032d)。在一些实施例中,重链可以包含突变s119e。这些突变在由至少一位发明人进行的实验中显示,当作为抗her2抗体测试时具有cab活性(参见例如美国临时申请第62/964,747号的图4和8(通过引用并入本文中))。
[0118]
在本文所公开的实施例中的任何实施例中,所述astr可以是单链抗体、fab片段、fab
′
片段、(fab
′
)2片段、fv片段(例如,scfv片段)、二价单链抗体或双功能抗体。在说明性实施例中,结合her2的条件活性astr是包括重链和轻链的单链可变片段。
[0119]
与ph 7.4相比,在ph 6.7下与her2的结合增加的示例性条件活性car(cab-car)见于本文中的实例中。在说明性实施例中,所述car或astr可以与包括seq id no:119的抗体重链可变区和seq id no:122的抗体轻链可变区的抗体和/或单链可变抗体片段结合于her2的相同表位。在此类说明性实施例的另外的实施例中,抗her2 car或astr包括或是单链可变片段(scfv)。在另外的说明性实例中,抗her2 scfv包括位于轻链的n端的重链或位于重链的n端的轻链。在本文中的实施例中的包含car的任何实施例中和在说明性实施例中的与包含seq id no:119的抗体重链可变区和seq id no:122的抗体轻链可变区的抗体结合于her2的相同表位的任何实施例中,astr可以包含seq id no:119、122-124或126-28中的任一个,并且在说明性实施例中,包含1个重链和1个轻链并且不是seq id no:119和seq id no:122的组合。此外,本文中的实施例中的任何实施例的抗her2 car可以包含本文别处提供的任何car组分。在说明性实施例中,本文包含抗her2 car,尤其是抗her2 cab-car的car在非限制性说明性实施例中包含在表3-4中表现出条件细胞毒性活性(“cab”)的任何抗her2 cab-car。
[0120]
本文所公开的重链可变区多肽和轻链可变区多肽从亲本抗体重链可变区(seq id no:119)和亲本抗体轻链可变区(seq id no:122)中鉴定。
[0121]
car还可以包含作为可以与her2特异性结合的seq id no:119和122的序列的重链
可变区和轻链可变区的变体的astr,并且在说明性实施例中包含重链可变区的cdr(hcdr1-hcdr3)和轻链可变区(lcdr1-lcdr3)的cdr。这些重链可变区和轻链可变区的变体可以通过向编码重链可变区和轻链可变区的核苷酸序列中引入适当的修饰或通过肽合成来制备。此类修饰包含例如抗体或抗体片段的氨基酸序列内的残基的缺失和/或插入和/或取代。可以进行缺失、插入和取代的任何组合以得到最终构建体,条件是最终构建体具有所期望的特性中的至少一种特性,例如抗原结合。
[0122]
条件活性测试
[0123]
如所指出的,本文所提供的抗her2 car通常是与ph为7.4相比在ph介于5与6.7之间时具有增加的car活性的cab-car(即,条件性活性car)(例如,相对于7.4,在ph 6.7下的cab-car活性),此car活性可以通过在与her2表达性靶细胞一起温育之后激活表达本文所提供的car的t细胞来检测或测量。在一些实施例中,t细胞的激活通过分析以下中的一种或多种来确定:t细胞对t细胞激活生物标志物的表达增加、t细胞(细胞内或胞外)进行的细胞因子产生、t细胞进行的增殖和/或t细胞进行的靶细胞杀伤。如本文中的实例所展示的,car活性可以在体外测定中测量,其中表达her2的靶细胞和用编码被测car的核酸转导的被测car-t细胞在测定培养基中一起温育持续一定有效时间以进行测定。以下段落提供了关于此类测定的进一步公开。此外,本文中的实例证明了非限制性car活性和cab-car测定,如荧光素酶细胞杀伤测定和测量阻抗的实时细胞杀伤测定,以及许多体外表达测定和体内测定。应注意,使用在用一种靶细胞的初始筛选中不促进car杀伤或显示cab活性的被证明可结合her2的重抗体链和轻抗体链设计的car可以是具有不同结构域组合的cab-car,或者如果用其它her2表达性靶细胞测试。据信,由于本文中的示例性实施例中所公开的抗her2 car包含具有来自抗体的经实验确定在ph为5.0到6.7相对于7.4时与her2的结合增加的cdr的astr,因此本文中的示例性实施例的这些抗her2 car是cab-car,因为它们将至少在某些条件下展示cab-car活性,如通过使用本文公开的任何测试用于筛选cab-car活性的特定细胞系。
[0124]
通常,相对于7.4,在ph介于5.0与6.7之间下的cab-car活性是使用定量测定来确定的,其实例在本文中提供,包含但不限于在此部分中。在一些实施例中,特定的cab-car活性是基于统计上显著的结果。例如,此类测定可以涉及使用统计测试比较对照car的复制结果与被测car的复制结果,或相对于对ph为7.5,ph介于5.0与6.7之间的被测car的重复结果,其中所述活性基于统计显著性(例如,在6.7相对于7.4时,其被测复制的平均值为大至少1个标准偏差、2个标准偏差或3个标准偏差,或者相对于具有用不表现出cab活性的抗体结构域制备的对照car相同ph 6.7/7.4比率,其ph 6.7/7.4比率具有此类统计显著性;或者其中对照car和被测car的活性范围(平均值+/-1、2或3个标准偏差)不重叠),通常,相对于对照样品,被测样品的car活性显著增加。此类测定还可以涉及使用例如t测试比较来自对照car和被测car的结果。另外地,这些测试可以仅用被测car进行,并且比较较低ph值下与较高ph值下的被测car的结果,以确定被测car是否具有cab-car活性。
[0125]
本公开的car可以存在于真核细胞例如哺乳动物细胞的质膜中,其中合适的哺乳动物细胞包含但不限于细胞毒性细胞、t淋巴细胞、干细胞、干细胞的后代、祖细胞、祖细胞的后代、nk细胞、nk-t细胞和巨噬细胞。在说明性实施例中,car存在于一个或一群t细胞和/或nk细胞的质膜中。当存在于真核细胞的质膜中时,本公开的car在存在在某些条件下结合
astr的her2的情况下是有活性的。抗her2 astr是特异性结合对的第一成员,并且her2是特异性结合对的第二成员。特异性结合对的her2可以是可溶的(例如,不与细胞结合);但在说明性实施例中,存在于细胞如靶细胞的表面上;呈递在固体表面上;或存在于脂质双层中;等等。
[0126]
在一些情况下,本公开的car当存在于真核细胞的质膜中时并且当被her2激活时,增加细胞中的至少一种核酸的表达。例如,在一些情况下,与在不存在her2的情况下的核酸转录水平相比,本公开的car当存在于真核细胞的质膜中时并且当被her2激活时,将细胞中的至少一种核酸的表达增加至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约40%、至少约50%、至少约75%、至少约2倍、至少约2.5倍、至少约5倍、至少约10倍或超过10倍。
[0127]
作为实例,本公开的car可以包含含有基于免疫受体酪氨酸的激活基序(itam)的细胞内信号传导多肽;在此类情况下,本公开的car当存在于真核细胞的质膜中时并且当被her2激活时,增加激活t细胞(nfat)依赖性转录的核因子。nfat依赖性转录包含由nfat家族的任何成员诱导的转录,包含例如nfatel、nfatc2、nfatc3、nfatc4、nfat5;ap-1;spl;nkkb;等等。
[0128]
本公开的car当存在于通过car与her2的结合而被激活的真核细胞的质膜中时,在一些情况下,可以使由细胞产生的一种或多种细胞因子增加。例如,与在不存在her2的情况下由细胞产生的细胞因子的量相比,本公开的car当存在于真核细胞的质膜中时并且当被her2激活时,可以使由细胞产生的细胞因子如ifnγ或il-2或与激活相关的细胞表面标志物如cd107a和/或cd69增加至少10%、至少15%、至少20%、至少25%、至少30%、至少40%、至少50%、至少75%、至少2倍、至少2.5倍、至少5倍、至少10倍或超过10倍。在一些实施例中,与在不存在her2的情况下由细胞分泌的细胞因子的量相比,本公开的car当存在于真核细胞的膜中时并且当被her2激活时,可以使由细胞分泌的细胞因子增加至少10%、至少15%、至少20%、至少25%、至少30%、至少40%、至少50%、至少75%、至少2倍、至少2.5倍、至少5倍、至少10倍或超过10倍。产生可以增加的细胞因子包含但不限于干扰素γ(ifn-γ)、肿瘤坏死因子-α(tnf-α)、il-2、il-15、il-12、il-4、il-5、il-10;趋化因子;生长因子;等等。因此,如实例3所展示的,cab-car活性可以通过比较不同ph值例如ph 6.7相对于ph 7.4下cd69或cd107a的表达水平来证明。这些测定的通用方法如下:将her2表达性哺乳动物靶细胞接种在高和低ph下的组织培养板的孔中,并且在37℃和5%co2下温育过夜。第二天,将相应调整的ph的被测car效应细胞以特定的效应物与靶标(e:t)细胞比率添加到含有靶细胞的孔中,以形成共培养物。这些测定中使用的典型e∶t比率为10∶1、5∶1、3∶1、1∶1、1∶3、1∶5或1∶10。在说明性实施例中,e∶t比率为3∶1、1∶1或1∶3。根据所研究的标志物,共培养物在37℃和5%co2下温育持续不同的时间长度。在实例3中,将car效应物和mcf-7靶标的共培养物温育持续一天,然后收集细胞并用抗体染色,以通过流式细胞术分析cd69表面表达和细胞内ifng。对于ifng染色,细胞首先被透化。用于表达cd107a的通用方法是类似的,除了在刺激开始时添加布雷菲德菌素a和莫能菌素(例如,当靶细胞和效应细胞被放置成共培养时),并且在采集细胞并用针对cd107a的抗体染色之前,将共培养物温育持续大约五小时。为了特异性检测car-t细胞上的激活标志物的表面表达,细胞通常与针对cd3、cd4、cd8的抗体和针对car的抗体或细胞标签(如etag)共染色,并且例如带门控的流式细胞术用于研究
活cd3+etag+细胞的激活标志物表达。
[0129]
如实例3所展示的,cab-car活性也可以通过比较在不同ph值例如ph 6.7相对于ph 7.4下用靶细胞进行刺激之后的car-t细胞的增殖来评估。用于增殖测定的通用方法如下;靶细胞,如her2表达性靶细胞,用丝裂霉素c处理并在37℃和5%co2下温育持续大约3小时以抑制其进一步增殖。靶细胞在pbs中洗涤,并且在高和低ph下接种到组织培养板的孔中。采集受试car效应细胞,用一种或多种细胞示踪染料(例如,羧基荧光素二乙酸琥珀酰亚胺酯(cfse)和celltrace violet)进行标记,并且在对应的ph下以如上文所描述的定义的e:t比率添加到靶细胞中,并且在37℃和5%co2下温育。在共培养1到14天例如大约五天后之后,采集细胞并针对7aad、cd3、cd8和细胞标签如etag进行染色。随着效应细胞增殖,细胞示踪染料的量减少,并且在流式细胞仪直方图中可检测为不同的峰。门控可以用于专门研究活cd3+细胞标签+细胞的增殖。
[0130]
在一些情况下,本公开的car当存在于真核细胞的质膜中时并且当被her2激活时,可以使细胞中的核酸的转录的增加,细胞因子的产生增加以及由细胞分泌的细胞因子增加。
[0131]
在一些情况下,本公开的car当存在于真核细胞的质膜中时并且当被her2激活时,产生细胞对靶细胞的细胞毒性活性,所述靶细胞在其细胞表面上表达car的第一个多肽的抗原结合结构域结合的抗原。例如,在真核细胞是细胞毒性细胞(例如,nk细胞或细胞毒性t淋巴细胞(即细胞毒性t细胞))的情况下,本公开的car当存在于细胞的质膜中时并且当被her2激活时,增加细胞对在其细胞表面表达her2的靶细胞的细胞毒性活性。例如,在真核细胞是nk细胞或t淋巴细胞的情况下,与在不存在her2的情况下的细胞的细胞毒性活性相比,本公开的car当存在于真核细胞的质膜中时并且当被her2激活时,将细胞的细胞毒性活性增加至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约40%、至少约50%、至少约75%、至少约2倍、至少约2.5倍、至少约5倍、至少约10倍或超过10倍。
[0132]
在一些情况下,本公开的car当存在于真核细胞的质膜中时并且当被her2激活时,可以产生其它car激活相关事件,如增殖和扩增(由于细胞分裂增加或抗凋亡应答)。
[0133]
在一些情况下,本公开的car当存在于真核细胞的质膜中时并且当被her2激活时,可以产生其它car激活相关事件,如细胞内信号传导调节、细胞分化或细胞死亡。
[0134]
本公开的car可以存在于真核细胞膜中,其中car的第一多肽和第二多肽彼此不共价连接。本公开的car可以作为不与膜中的任何其它多肽共价连接的单一异二聚体存在于真核细胞膜中。可替代地,本公开的第一car可以作为与本公开的第二car共价或非共价连接的异二聚体存在于真核细胞膜中。在一些情况下,第一和第二car通过在第一car的第一多肽和第二car的第一多肽两者中存在的铰链区中存在的半胱氨酸之间形成的二硫键共价连接。
[0135]
在一些情况下,本公开的car可以存在于真核细胞膜中,其中car的第一多肽包含抗体片段并且car的第二多肽包含源自细胞因子受体的信号转导结构域,使得在二聚化时,car可以代表异二聚体信号体car,例如,由至少两个独立多肽构成的信号体。如本领域所知,“信号体”是由抗体片段和源自细胞因子受体的信号转导结构域构成的单一嵌合大分子。在某些情况下,本公开的异二聚体信号体car当存在于真核细胞的细胞膜中、被二聚体二聚化并被抗原例如寡聚化抗原激活时,可以诱导异二聚体信号体car的寡聚化。此类配体
诱导的异二聚体信号体car的寡聚化可以激活,例如,增加,或延续,例如,维持,信号转导,例如,配体诱导的异二聚体信号体car的寡聚化可以发射引发细胞应答的信号。在一些情况下,可以组合利用多个异二聚体信号体car以引发期望的细胞应答。
[0136]
进一步的astr结构考虑
[0137]
本公开的car包含特异性结合对的成员,所述特异性结合对包含通常是抗her2 astr的her2(即,至少在某些条件下能够结合her2)。适用于本公开的car中的抗her2 astr可以是任何抗原结合多肽,通常能够结合、有效结合或适于结合her2。在某些实施例中,astr是抗体,如单链抗体、fab片段、fab
′
片段、(fab
′
)2片段、fv片段(例如,scfv)、二价单链抗体或双功能抗体,或包括抗原结合可变区(vh或v
l
)以及轻链恒定结构域(cl)和重链恒定结构域ch1的抗体(已省略ch2和ch3的“全长”抗体)。在说明性实施例中,本文所提供的抗her2 astr包含两条抗体链,重链(vh)和轻链(vl)。vh和vl中的每一个通常包含三个可变区和四个框架区。如本文所用,术语“可变区”或“可变结构域”是指抗体与抗原结合所涉及的抗体重链或轻链的结构域。天然抗体的重链和轻链(分别为vh和vl)的可变结构域,以及本文中的说明性抗her2 astr,通常具有相似的结构,其中每个结构域包括四个保守框架区(fr)和三个高变互补决定区(cdr)(vh链中的hcdr1、hcdr2和hcdr3以及vl链中的lcdr1、lcdr2和lcdr3),参见例如kindt等人《kuby免疫学(kuby immunology)》,第6版,w.h.弗里曼公司(w.h.freeman and co.),第91页(2007)。单个vh或vl结构域可以足以赋予抗原结合特异性。此外,可以使用vh或vl结构域从结合抗原的抗体中分离出结合特定抗原的抗体,以分别筛选互补vl或vh结构域的文库,参见例如portolano等人,《免疫学杂志(j.immunol.)》,第150卷,第880-887页,1993;或clarkson等人,《自然(nature)》,第352卷,第624-628页,1991。如本文所用,术语“框架”或“框架区”或“fr”通常指除cdr中的残基之外的可变结构域残基(重链中的hcdr1-3和轻链中的lcdr1-3)。可变结构域的fr通常由四个fr结构域组成:fr1、fr2、fr3和fr4。因此,cdr和fr序列通常以下列序列出现在vh(或vl)中:fr1-hcdr1/lcdr1-fr2-hcdr2/lcdr2-fr3-hcdr3/lcdr3-fr4。fr和cdr的边界可以使用本领域已知的方法,例如通过kabat定义、chothia定义、abm定义和/或接触定义来精确地鉴定,所有所述定义均是本领域熟知的。(参见例如,kabat,e.a.等人(1991)《具有免疫学意义的蛋白质序列》,第五版,美国卫生与公众服务部(u.s.department ofhealth and human services),nih公开号91-3242;chothia等人,(1989)《自然》342:877;chothia,c.等人(1987)《分子生物学杂志》196:901-917,al-lazikani等人(1997)《分子生物学杂志》273:927-948;以及almagro,《分子识别杂志(j.mol.recognit.)》17:132-143(2004),所述文献以全文引用的方式并入本文中。
[0138]
在说明性实施例中,本文所提供的抗her2 astr是“人源化的”。术语“人源化抗体”或“人源化astr”通常分别指已将fr交换为在人抗体中发现的序列的非人抗体或astr。通常,在人源化抗体中,除cdr之外的整个抗体由人类来源的多核苷酸或分离的核酸编码或除了在其cdr内之外,与此抗体相同。在人源化astr中,astr由与人抗体的对应部分相同的多核苷酸或分离的核酸编码,除了在其cdr内。优选地,人源化抗体或astr对抗原具有与衍生其的非人源化小鼠抗体相同或基本上相同的亲和力。将cdr(所述cdr中的一些或全部是由源自非人生物体的核酸编码的)移植到人抗体可变区的β-片层框架中以产生抗体,所述抗体的特异性由移植的cdr确定。在说明性实施例中,本文中的car包括识别her2的人源化
astr,并且在另外的说明性实施例中,具有cab-car活性。在一些实施例中,本公开的astr中的重链可变区可以包含seq id no:119的fr,与本文所公开的hcdr1、hcdr2和hcdr3(例如,seq id no:131-133和137-141)中的任一个的组合。在一些实施例中,astr中的轻链可变区可以包含seq id no:122的fr,与本文所公开的lcdr1、lcdr2和lcdr3(例如,seq id no:134-136和142-143)中的任一个的组合。此类重链和轻链组合不是(即不包含)seq id no:119和seq id no:122的组合。
[0139]
用于修饰、人源化和重塑非人抗体的多种技术和方法是本领域熟知的(参见lu,rm.、hwang,yc.、liu,ij.等人“开发用于治疗疾病的治疗性抗体(development of therapeutic antibodies for the treatment of diseases)”,《生物医学科学杂志(j biomed sci)》27,1(2020)lu等人(以全文引用的方式并入本文中)。降低非人抗体可变区免疫原性的人源化或其它方法可以包含本领域已知的表面重修方法。在一个实施例中,亲本抗体已经是亲和力成熟的,如本领域已知的。如本领域已知的,可以利用基于结构的方法进行人源化和亲和力成熟。如本领域已知的,可以采用基于选择的方法来使抗体可变区人源化和/或亲和力成熟。如本领域已知的,其它人源化方法可以涉及移植仅部分cdr。
[0140]
可以用于使本文所提供的抗her2 astr人源化的人框架区包含但不限于:使用“最佳拟合”方法选择的框架区(参见例如,sims等人,《免疫学杂志》,第151卷,第2296页,1993);源自特定轻链可变区或重链可变区亚组的人抗体的共有序列例如在carter等人所公开的4d5-1、4d5-2、4d5-3、4d5-4、4d5-5、4d5-6、4d5-7或4d5-8中发现的任何序列的框架区可以与本文中的示例性实施例部分中公开的突变一起使用(参见例如,《美国国家科学院院刊(proc.natl.acad.sci.usa)》,第89卷,第4285页,1992;以及presta等人,《免疫学杂志》,第151卷,第2623页,1993);人成熟(体细胞突变的)框架区或人种系框架区(参见例如,almagro和fransson,《生物科学里程碑前沿(front.biosci.)》,第13卷,第1619-1633页,2008);源自筛选fr文库的框架区(参见例如,baca等人,《生物化学杂志(j.biol.chem.)》,第272卷,第10678-10684页,1997以及rosok等人,《《生物化学杂志》第271卷,第22611-22618页,1996)。按照本领域已知的方法可以对亲本非人抗体的vh和vl可变区进行三维分子建模分析。接下来,可以使用相同的分子建模分析来鉴定被预测对形成正确cdr结构具有重要性的框架氨基酸残基。平行地,使用亲本vh和vl序列作为搜索查询来从任何抗体基因数据库中鉴定具有与亲本非人抗体的氨基酸序列同源的氨基酸序列的人vh链和人vl链。然后选择人vh受体基因和人vl受体基因。
[0141]
在一些实施例中,本文所提供的抗her2 astr可以是人抗体或人源化抗体。在本文所提供的实施例中的任何实施例中,如示例性实施例中更详细公开的,astr可以具有本文所提供的针对抗her2astr的任何序列变化。例如,噬菌体显示屏鉴定了4d5-8背景中的在各种残基处的潜在突变,所述突变可以改善抗her2抗体与her2的结合(gerstner等人,2002,《分子生物学杂志》321(5):851-862)。在一些实施例中,本文所提供的任何car实施例可以包含不同的噬菌体展示屏突变。在本文中的示例性实施例部分中提供了更多实施例。在一些实施例中,本文所提供的抗her2 astr可以包含免疫球蛋白重链可变区,所述免疫球蛋白重链可变区包含与seq id no:119的整个可变区或框架区序列至少70%、75%、80%、85%、90%、95%、98%或99%相同的氨基酸序列。在一些实施例中,astr可以包含免疫球蛋白轻链可变区,所述免疫球蛋白轻链可变区包含与seq id no:122的整个可变区或框架区序列
至少70%、75%、80%、85%、90%、95%、98%或99%相同的氨基酸序列。在一些实施例中,将抗体的轻链可变区和重链可变区的cdr移植到人fr或共有人fr上。为了产生共有人fr,来自若干人重链或轻链氨基酸序列的fr被比对以鉴定共有氨基酸序列。cdr移植描述于例如美国专利第7,022,500号(queen)中并且是本领域已知的。在本文所提供的包含astr的各方面和实施例中的任何方面和实施例中,本文所提供的抗her2 astr可以包含免疫球蛋白重链可变区,所述免疫球蛋白重链可变区包含与seq id no:252-254的框架区序列至少70%、75%、80%、85%、90%、95%、98%或99%相同的氨基酸序列,所述免疫球蛋白重链可变区是针对各种抗原的重链可变区,其中框架区中的氨基酸被共有人氨基酸替代以形成人源化抗体。一些实施例中,astr可以包含免疫球蛋白轻链可变区,所述免疫球蛋白轻链可变区包含与seq id no:255-257的框架区序列至少70%、75%、80%、85%、90%、95%、98%或99%相同的氨基酸序列,所述免疫球蛋白轻链可变区是针对各种抗原的轻链可变区,其中框架区中的氨基酸被小鼠氨基酸或共有人氨基酸替代以形成人源化抗体。
[0142]
抗体重链和轻链的框架区(fr)可以用于本文所提供的具有本文所公开的任何突变的抗her2 astr。seq id no:119中的fr包含残基1-25、残基36-49、残基67-98和残基110-120。seq id no:122的fr包含残基1-23、残基35-49、残基57-88和残基98-107。熟练的技术人员将能够鉴定重链和轻链的fr。在一些实施例中,astr的重链可变区可以包含seq id no:119的fr。在一些实施例中,astr的轻链可变区可以包含seq id no:122中的fr。
[0143]
条件活性抗her2 astr(即靶向her2的astr)可以包含来自已知靶向her2的抗体和抗体片段的序列。例如,astr可以包含来自小鼠单克隆抗体mumab4d5的人源化版本的序列(carter等人《美国国家科学院院刊》89:4285-4289),其中astr保留结合her2的能力,并且是条件活性的,例如相对于ph为7.4在ph为6.7时具有更多结合。在一些说明性实施例中,astr的重链可变区可以包含seq id no:119。在一些实施例中,astr的轻链可变区可以包含seq id no:122。
[0144]
本文预期免疫球蛋白重链可变区序列和/或轻链可变区序列可以含有重链可变区和/或轻链可变区的框架区中的氨基酸改变(例如,至少1、2、3、4、5或10种氨基酸取代、缺失或添加)。在一些实施例中,提供了包含一种或多种氨基酸取代的astr。在本文所公开的实施例中的任何实施例中,基于seq id no:119中的编号,astr可以在重链的位置119处包含s到e突变。在说明性实施例中,基于seq id no:122中的编号,astr可以在轻链的位置32处包含a到d突变。当存在于抗her2抗体中时,此突变显示出cab活性。此突变位于fr中,并且含有此突变的抗体在用作抗体时显示出cab活性(结果未显示)。此fr突变可以与本文所公开的重链或轻链的cdr中的其它突变中的任何突变组合。
[0145]
在被称为“superhumanizationtm”的方法中,人cdr序列选自人种系基因,基于人cdr与要人源化的小鼠抗体的结构相似性,如本领域已知的。框架序列可以从公共dna数据库或已发表的参考文献中获得。
[0146]
用于降低免疫原性的其它方法包含“重塑”、“超嵌合”和“镶面/表面重修”。在本文所提供的一些实施例中,镶面/表面重修方法用于用在人抗体中相同位置处更常见的氨基酸残基替代本文中的astr中使用的小鼠抗her2抗体或其片段中的表面可接近的氨基酸残基。这些人源化抗体中的任何人源化抗体都可以用于制备人源化astr。
[0147]
在一些实施例中,本文所提供的抗her2 car的astr是单链fv(scfv)。在一些实施
例中,在本文所提供的抗her2 car的astr中,重链定位于本文所提供的car的astr中的轻链的n端。在其它实施例中,轻链定位于本文所提供的car的astr中的重链的n端。在所公开的实施例中的任何实施例中,如本文更详细地讨论的,重链和轻链可以通过连接子分开。在所公开的实施例中的任何实施例中,重链或轻链可以位于car的n端,并且通常是另一个结构域如信号序列或肽的c端。
[0148]
其它基于抗体的识别结构域(cab vhh(骆驼抗体可变结构域)和人源化版本、ignar vh(鲨鱼抗体可变结构域)和人源化版本、sdab vh(单结构域抗体可变结构域)和“骆驼化”抗体可变结构域)适于与car和使用本公开的car的方法一起使用。在一些情况下,基于t细胞受体(tcr)的识别结构域如单链tcr(sctv,含有vαvβ的单链双结构域tcr)也适于使用。
[0149]
本文中的任何方面或实施例的某些实施例包含car,包含具有被工程化为共同选择内源性tcr信号传导复合物和cd3z信号传导途径的胞外结构域的car。在一个实施例中,嵌合抗原受体astr与内源性tcr复合物链之一(例如,tcrα、cd3e等)融合,以促进并入到tcr复合物中并通过内源性cd3z链发出信号。在其它实施例中,car含有与tcr复合物结合的第一scfv或蛋白质和与靶抗原(例如,肿瘤抗原)结合的第二scfv或蛋白质。在另一个实施例中,tcr可以是单链tcr(sctv,含有vαvβ的单链双域tcr)。最后,还可以产生scfv以识别特定的mhc/肽复合物,由此充当替代tcr。此类肽/mhc scfv结合剂可以用于许多与car相似的配置。
[0150]
在本文所提供的包含astr的各方面中的任何方面的某些实施例中,astr可以针对将astr与在示例性分裂car构建体中的表达her-2的细胞上表达的her2连接的中间蛋白。中间多肽或蛋白质可以内源性表达或外源性引入,并且可以是天然的、工程化的或化学修饰的。在某些实施例中,astr可以是抗标签astr,使得至少一个标记的中间体,通常是抗体-标签缀合物,包含在由astr识别的标签与在her2表达性靶细胞上表达的靶分子,通常是her2蛋白靶标之间。因此,在此类实施例中,astr结合标签并且标签与本文所提供的针对靶细胞如癌细胞上的her2的cab抗体缀合。本文提供了其它分裂car构建体。标签的非限制性实例包含异硫氰酸荧光素(fitc)、链霉亲和素、生物素、组氨酸、二硝基苯酚、紫罗兰素叶绿素蛋白复合物、绿色荧光蛋白、藻红蛋白(pe)、辣根过氧化物酶、棕榈酰化、亚硝基化、碱性磷酸酶、葡萄糖氧化酶和麦芽糖结合蛋白。因此,astr包括结合标签的分子。
[0151]
取代变体、插入变体和缺失变体
[0152]
在一些实施例中,本文所公开的任何car的astr可以包含具有一种或多种氨基酸取代的变体。取代型诱变的所关注位点包含cdr和框架区(fr)。保守取代示出在表1中在标题“保守取代”下。在表1中在标题“示例性取代”下并且如以下参考氨基酸侧链类别进一步描述的,提供了更多改变。可以将氨基酸取代引入到所关注astr中,并且筛选产物的期望活性,例如,保留的/改进的抗原结合、条件活性和/或降低的免疫原性。
[0153]
表1:氨基酸取代
[0154][0155]
氨基酸可以根据共同的侧链性质进行分组:(1)疏水性:met、ala、val、leu、ile;(2)中性亲水的:cys、ser、thr、asn、gln;(3)酸性的:asp、glu;(4)碱性:his、lys、arg;(5)影响链定向的残基:gly、pro;以及(6)芳香族:trp、tyr、phe。非保守取代将需要将这些类别中的一个类别的成员交换为另一个类别。
[0156]
一种类型的取代型变体涉及取代亲本抗体(例如,人源化抗体或人抗体)的一或多个cdr残基。通常,选定的所得变体将相对于亲本抗体在某些生物性质(例如,增加的亲和力、改进的条件活性或选择性、降低的免疫原性)上具有修饰(例如,改进),和/或将基本上保留亲本抗体的某些生物性质。在说明性实施例中,所得变体将具有改进的条件活性。
[0157]
可以在cdr中进行变更(例如,取代),例如,以改进抗体亲和力。此类变更可以在cdr“热点”中进行,即由在体细胞成熟过程期间以高频经历突变的密码子编码的残基(参见例如,chowdhury,《分子生物学方法(methods mol.biol.),第207卷,第179-196页,2008),和/或在sdr(a-cdr)中进行,其中所得变体vh或vl针对结合亲和力进行测试。通过构建二级文库和从二级文库中重新选择来进行的亲和力成熟已经在例如hoogenboom等人,《分子生物学方法》,第178卷,第1-37页,2001中进行了描述。在亲和力成熟的一些实施例中,通过多种方法(例如,易错pcr、链改组或寡核苷酸定向诱变)中的任何方法将多样性引入到被选择用于成熟的可变基因中。然后产生二级文库。然后对文库进行筛选,以鉴别出具有期望的亲和力的任何抗体变体。用于引入多样性的另一种方法涉及cdr指导的方法,其中若干个cdr残基(例如,一次4-6个残基)被随机化。抗原结合所涉及的cdr残基可以例如使用丙氨酸扫描诱变或建模特异性地鉴别出来。cdr-hcdr3和cdr-lcdr3通常是靶向的。
[0158]
在一些实施例中,取代、插入或缺失可以发生在一或多个cdr中,只要此类变更不显著降低astr与her2抗原结合的能力即可。例如,在cdr中可以进行基本上不降低结合亲和
力的保守变更(例如,如本文所提供的保守取代)。此类变更可以在cdr“热点”或sdr之外。在以上所提供的变体vh和vl序列的某些实施例中,每个cdr不改变,或含有不超过一个、两个或三个氨基酸取代。
[0159]
考虑了本文所描述的astr的氨基酸序列修饰。例如,可能期望改善astr的结合亲和力和/或其它生物性质。已知当人源化抗体通过在人抗体的vh和vl的fr中简单地仅移植衍生自非人动物的抗体的vh和vl的cdr而产生时,与衍生自非人动物的原始抗体的抗原结合活性相比,抗原结合活性降低。据认为,不仅在cdr中,而且在fr中,非人抗体的vh和vl的若干个氨基酸残基与抗原结合活性直接或间接相关。因此,用衍生自人抗体的vh和vl的fr的不同氨基酸残基取代这些氨基酸残基将会降低结合活性。为了解决所述问题,在用人cdr移植的抗体中,必须作出尝试以在人抗体的vh和vl的fr的氨基酸序列中鉴别出和与抗体结合直接相关的氨基酸残基,或与cdr的氨基酸残基相互作用的氨基酸残基,或维持抗体的三维结构并与抗原结合直接相关的氨基酸残基。可以通过用衍生自非人动物的原始抗体的氨基酸残基置换鉴别出的氨基酸来增加降低的抗原结合活性。
[0160]
可以对本发明的抗体的结构和编码所述抗体的dna序列作出修饰和改变,并且仍然可以获得编码带有具有期望的特性的astr的car的功能分子。
[0161]
在对氨基酸序列作出改变时,可以考虑氨基酸的亲水指数。亲水氨基酸指数在向蛋白赋予相互作用生物功能方面的重要性在本领域中通常是被理解的。接受的是,氨基酸的相对亲水特性有助于所得蛋白的二级结构,所述二级结构进而定义蛋白与其它分子,例如酶、底物、受体、dna、抗体、抗原等的相互作用。根据氨基酸的疏水性和电荷特性,每种氨基酸都被指定了亲水指数,它们是:异亮氨酸(+4.5);缬氨酸(+4.2);亮氨酸(+3.8);苯丙氨酸(+2.8);半胱氨酸/胱氨酸(+2.5);甲硫氨酸(+1.9);丙氨酸(+1.8);甘氨酸(-0.4);苏氨酸(-0.7);丝氨酸(-0.8);色氨酸(-0.9);酪氨酸(-1.3);脯氨酸(-1.6);组氨酸(-3.2);谷氨酸盐(-3.5);谷氨酰胺(-3.5);天冬氨酸盐(-3.5);天冬酰胺(-3.5);赖氨酸(-3.9);以及精氨酸(-4.5)。
[0162]
本发明还涵盖本发明的抗体和抗体片段的功能保守变体。
[0163]
当大于80%,或大于85%,或优选地大于90%,或更优选地大于95%,或大于98%的氨基酸是相同的时,两个氨基酸序列是“基本上同源的”或“基本上相似的”。在一些实施例中,在整个序列长度上,至少90%或大于95%的氨基酸是相似的(功能相同)。优选地,类似序列或同源序列通过使用例如gcg(遗传学计算机集团(genetics computer group),gcg包程序手册(program manual for the gcg package),版本7,威斯康星州麦迪逊(madison,wis.))堆积程序或如blast、fasta等序列比较算法中的任何序列比较算法进行比对来鉴定。
[0164]
例如,某些氨基酸可以被蛋白结构中的其它氨基酸取代,而没有预期明显丧失活性(参见例如,上文表1)。由于蛋白的相互作用能力和性质限定了蛋白的生物功能活性,因此可以在蛋白序列中以及当然在其dna编码序列中进行某些氨基酸取代,然而同时获得具有相似性质的蛋白质。因此设想可以在本发明的抗体或抗体片段的序列或编码所述抗体或抗体片段的对应的dna序列中进行各种改变,而不会明显丧失其生物活性。
[0165]
本领域中已知某些氨基酸可以被具有类似亲水指数或得分的其它氨基酸取代并且仍产生具有类似生物活性的蛋白质,即仍获得生物功能等效蛋白。
[0166]
如上文所概述的,氨基酸取代可以基于氨基酸侧链取代基的相对相似性,例如其疏水性、亲水性、电荷、大小等。考虑到各种前述特性的示例性替代是本领域技术人员众所周知的并且包含使用以下对的替代:精氨酸和赖氨酸;谷氨酸和天冬氨酸;丝氨酸和苏氨酸;谷氨酰胺和天冬酰胺;以及缬氨酸、亮氨酸和异亮氨酸。
[0167]
糖基化变体
[0168]
在一些实施例中,本文所提供的astr被改变以增加或降低astr被糖基化的程度。针对抗体以及astr的对应scfv的糖基化位点的添加或缺失可以通过改变氨基酸序列使得一或多个糖基化位点得以产生或去除来方便地完成。
[0169]
茎
[0170]
在一些实施例中,car包含定位于细胞外的car的部分中并插入在astr与跨膜结构域之间的茎。在一些实施例中,茎与野生型cd8α茎区(tttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacd(seq id no:16))具有至少85、90、95、96、97、98、99或100%同一性,与野生型cd28茎区(fckievmypppyldneksngtiihvkgkhlcpsplfpgpskp(seq id no:3))具有至少85、90、95、96、97、98、99或100%同一性或者与野生型免疫球蛋白重链茎区具有至少85、90、95、96、97、98、99或100%同一性。在car中,所采用的茎允许抗原特异性靶向区,并且通常是整个car,保持与靶抗原的结合增加。
[0171]
茎区的长度可以为约4个氨基酸到约50个氨基酸,例如约4aa到约10aa、约10aa到约15aa、约15aa到约20aa、约20aa到约25aa、约25aa到约30aa、约30aa到约40aa或约40aa到约50aa。
[0172]
在一些实施例中,car的茎包含至少一个半胱氨酸。例如,在一些实施例中,茎可以包含序列cys-pro-pro-cys(seq id no:4)。如果存在,第一car的茎中的半胱氨酸可用于与第二car的茎形成二硫键。
[0173]
茎可以包含本领域已知的免疫球蛋白铰链区氨基酸序列;参见例如,tan等人(1990)《美国国家科学院院刊》87:162;以及huck等人(1986)《核酸研究(nucl.acids res.)》14:1779。作为非限制性实例,免疫球蛋白铰链区可以包含与以下氨基酸序列中任何氨基酸序列的至少10个、15个、20个或所有氨基酸的延伸段具有至少50、60、70、75、80、85、90、95、96、97、98、99或100%序列同一性的结构域:cppc(seq id no:4);dktht(seq id no:5);cpepkscdtpppcpr(seq id no:6)(参见例如,glaser等人(2005)《生物化学杂志》280:41494);elktplgdttht(seq id no:7);kscdkthtcp(seq id no:8);kccvdcp(seq id no:9);kygppcp(seq id no:10);epkscdkthtcppcp(seq id no:11)(人iggl铰链);erkccvecppcp(seq id no:12)(人igg2铰链);elktplgdtthtcprcp(seq id no:13)(人igg3铰链);spnmvphahhaq(seq id no:14)(人igg4铰链);等等。茎可以包含具有人igg1、igg2、igg3或igg4铰链区的氨基酸序列的铰链区。与野生型(天然存在的)铰链区相比,茎可以包含一种或多种氨基酸取代和/或插入和/或缺失。例如,人igg 1铰链的his229可以被tyr取代,使得茎包含序列epkscdktytcppcp(seq id no:15)(参见例如,yan等人(2012)《生物化学杂志》287:5891)。
[0174]
在一些实施例中,car包含一个或多个另外的胞外多肽结构域。此类另外的胞外多肽结构域包含但不限于亲和结构域、例如通过抗体测定或因为它是产生可检测信号的多肽而其存在或活性可以被检测到的多肽(可检测标志物)以及识别或消除结构域,每一个都在
本文的其它部分中更详细地描述。在一些实施例中,此类另外的胞外多肽结构域位于茎的n端。在一些实施例中,此类另外的胞外多肽结构域位于茎的c端。在一些实施例中,另外的胞外多肽结构与茎直接融合。在一些实施例中,多肽连接子将另外的细胞外多肽连接到茎。
[0175]
跨膜结构域
[0176]
本公开的car可以包含用于插入到真核细胞膜中的跨膜结构域。跨膜结构域可以插入在astr与共刺激结构域之间。跨膜结构域可以插入在茎与共刺激结构域之间,使得嵌合抗原受体包含,从氨基端(n端)到羧基端(c端):astr;茎;跨膜结构域;以及激活结构域。
[0177]
提供将多肽插入到真核(例如,哺乳动物)细胞的细胞膜中的任何跨膜(tm)结构域都适于本文所公开的各方面和实施例。
[0178]
在本文所提供的某些实施例中,本文所提供的包含car的任何方面的tm结构域是cd8αtm结构域、cd8βtm结构域、cd4 tm结构域、c3z tm结构域、c134 tm结构域、cd7 tm结构域、cd8 tm结构域、cd28 tm结构域、t细胞受体tm结构域的α链、t细胞受体cd3 tm结构域的β链、t细胞受体tm结构域的ζ链、cd3εtm结构域、cd45 tm结构域、cd5 tm结构域、cd9 tm结构域、cd16 tm结构域、cd22 tm结构域、cd33 tm结构域、cd37 tm结构域、cd64 tm结构域、cd80 tm结构域、cd86 tm结构域、cd137 tm结构域、cd154 tm结构域、kirds2 tm结构域、cd2 tm结构域、cd27 tm结构域、lfa-1(cd11a、cd18)tm结构域、icos(cd278)tm结构域、gitr tm结构域、cd40 tm结构域、baffr tm结构域、hvem(lightr)tm结构域、slamf7 tm结构域、nkp80(klrf1)tm结构域、cd160tm结构域、cd19tm结构域、il2rβtm结构域、il2rγtm结构域、il7ra tm结构域、vla1 tm结构域、cd49a tm结构域、itga1 tm结构域、itga4 tm结构域、itga6 tm结构域、itgad tm结构域、itgae tm结构域、itgal tm结构域、itgam tm结构域、itgaxtm结构域、itgb2 tm结构域、itgb7 tm结构域、ia4 tm结构域、cd49d tm结构域、vla-6tm结构域、cd49ftm结构域、cd11d tm结构域、cd103tm结构域、cd11atm结构域、cd11b tm结构域、cd11c tm结构域、itgb1、cd29tm结构域、cd18tm结构域、tnfr2 tm结构域、dnam1(cd226)tm结构域、slamf4(cd244、2b4)tm结构域、cd84tm结构域、cd96(tactile)tm结构域、tm结构域ceacam1 tm结构域、crtam tm结构域、ly9(cd229)tm结构域、cd160(by55)tm结构域、psgl1 tm结构域、cd100(sema4d)tm结构域、slamf6(ntb-a、ly108)tm结构域、slam(slamf1、cd150、ipo-3)tm结构域、blame(slamf8)tm结构域、selplg(cd162)tm结构域、ltbr tm结构域或pag/cbp tm结构域。本文所提供的car的说明性实施例包含cd8αtm结构域或cd28 tm结构域。适于本文所提供的各方面或实施例中的任何方面或实施例的tm结构域的非限制性实例包含与以下tm结构域或组合的茎和tm结构域中的任一个的至少10个、15个、20个或所有氨基酸的延伸段具有至少50、60、70、75、80、85、90、95、96、97、98、99或100%序列同一性的结构域:a)cd8αtm(seq id no:17);b)cd8βtm(seq id no:18);c)cd4 tm(seq id no:19);d)cd3z tm(seq id no:20);e)cd28 tm(seq id no:21);f)cd134(ox40)tm:(seq id no:22);g)cd7 tm(seq id no:23);h)cd8茎和tm(seq id no:24);以及i)cd28茎和tm(seq id no:25)。
[0179]
作为非限制性实例,本发明的方面的跨膜结构域与seq id no:17跨膜结构域可以具有至少80%、90%或95%或可以具有100%序列同一性,或者可以分别与以下基因的任何跨膜结构域具有100%序列同一性:cd8α跨膜结构域、cd8β跨膜结构域、cd4跨膜结构域、cd3ζ跨膜结构域、cd28跨膜结构域、cd134跨膜结构域或cd7跨膜结构域。
[0180]
细胞内激活结构域
[0181]
适于在本公开的car中使用的细胞内激活结构域在被激活时通常诱导一种或多种细胞因子的产生;增加细胞死亡;和/或增加cd8
+
t细胞、cd4
+
t细胞、nkt细胞、γ8t细胞和/或中性粒细胞的增殖。激活结构域(activating domain)在本文中也可以被称为激活结构域(activation domain)。激活结构域可以用于本文所提供的car。
[0182]
在一些实施例中,细胞内激活结构域包含如下文所描述的至少一个(例如,一个、两个、三个、四个、五个、六个等)itam基序。用于car的细胞内激活结构域可以包含若干类型的免疫信号传导受体的细胞内信号传导结构域,所述免疫信号传导受体包含t细胞信号传导蛋白,如cd3、b7家族共刺激和肿瘤坏死因子受体(tnfr)超家族受体;由如nkp30(b7-h6)、dap12、nkg2d、nkp44、nkp46、dap10和cd3z等nk和nkt细胞使用的信号传导结构域;以及含有如fcrγ(fcer1g)、fcrβ(fcer1b)、fcγri、fcγriia、fcγriic、fcγriiia和fcrl5等基于免疫受体酪氨酸的激活基序(itam)的人免疫球蛋白受体的信号传导结构域。因此,在本公开的各方面中的任何方面的car的某些实施例中,细胞内激活结构域是来自nkp30(b7-h6)、dap12、nkg2d、nkp44、nkp46、dap10、cd3z、fcγri、fcγriia、fcγriic、fcγriiia或fcrl5的信号传导结构域。这些在本文中分别被称为nkp30(b7-h6)激活结构域、dap12激活结构域、nkg2d激活结构域、nkp44激活结构域、nkp46激活结构域、dap10激活结构域、cd3z激活结构域、fcγri激活结构域、fcγriia激活结构域、fcγriic激活结构域、fcγriiia激活结构域或fcrl5激活结构域。在一些实施例中,细胞内激活结构域包含dap10/cd28型信号传导链。作为非限制性实例,本发明的包含car的任何方面的细胞内激活结构域可以是cd3z激活结构域、cd3d激活结构域、cd3e激活结构域、cd3g激活结构域、cd79a激活结构域、dap12激活结构域、fcer1g激活结构域、dap10/cd28激活结构域或zap70激活结构域。在一些实施例中,本发明的方面的细胞内激活结构域与如下文所描述的cd3z、cd3d、cd3e、cd3g、cd79a、cd79b、dap12、fcerlg、fcgr2a、fcgr2c、dap10/cd28或zap70结构域可以具有至少80%、90%或95%或可以具有100%序列同一性。
[0183]
适于本公开的car中使用的细胞内激活结构域包含含有基于免疫受体酪氨酸的激活基序(itam)的细胞内信号传导多肽。itam基序是yx1x2l/i,其中x1和x2独立地为任何氨基酸。在一些实施例中,car的细胞内激活结构域包含1、2、3、4或5个itam基序。在一些实施例中,itam基序在细胞内激活结构域中重复两次,其中itam基序的第一个实例和第二个实例由6到8个氨基酸例如(yx1x2l/i)(x3)n(yx1x2l/i)彼此分开,其中n是从6到8的整数,并且6到8个x3中的每一个可以是任何氨基酸。在一些实施例中,car的细胞内激活结构域包含3个itam基序。
[0184]
合适的细胞内激活结构域可以是源自含itam基序的多肽的含itam基序的部分。例如,合适的细胞内激活结构域可以是来自任何含itam基序的蛋白质的含itam基序的结构域。因此,合适的细胞内激活结构域不需要含有其源自的整个蛋白质的完整序列。合适的含itam基序的多肽的实例包含但不限于:cd3z(cd3ζ);cd3d(cd3δ);cd3e(cd3ε);cd3g(cd3γ);cd79a(抗原受体复合物相关蛋白α链);cd79b(抗原受体复合物相关蛋白β链)dap12;以及fcerlg(fcε受体iγ链)。
[0185]
在一些实施例中,细胞内激活结构域源自t细胞表面糖蛋白cd3ζ链(也被称为cd3z、t细胞受体t3ζ链、cd247、cd3-zeta、cd3h、cd3q、t3z、tcrz等)。例如,合适的细胞内激活结构域可以包含与以下序列的至少10个、15个、20个或所有氨基酸的延伸段或与以下氨
基酸序列(2个同种型(isoform))的任一个氨基酸序列的约100个氨基酸到约110个氨基酸(aa)、约110aa到约115aa、约115aa到约120aa、约120aa到约130aa、约130aa到约140aa、约140aa到约150aa或约150aa到约160aa的连续延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域:
[0186]
mkwkalftaailqaqlpiteaqsfglldpklcylldgilfiygviltalflrvkfsrsadapayqqgqnql[ynelnlgrreeydvl]dkrrgrdpemggkprrknpqegl[ynelqkdkmaeayseiigmkgerrrgkghdgl[yqglstatkdtydal]hmqalppr(seqid no:26)或mkwkalftaailqaqlpiteaqsfglldpklcylldgilfiygviltalflrvkfsrsadapayqqgqnql[ynelnlgrreeydvl]dkrrgrdpemggkpqrrknpqegl[ynelqkdkmaeaysei]gmkgerrrgkghdgl[yqglstatkdtydal]hmqalppr(seq id no:27),其中itam基序用括号括起来。
[0187]
同样,合适的细胞内激活结构域多肽可以包含有全长cd3ζ氨基酸序列的一部分的itam基序。因此,合适的细胞内激活结构域可以包含与以下序列的至少10个、15个、20个或所有氨基酸的延伸段或与以下氨基酸序列中的任一个氨基酸序列的约100个氨基酸到约110个氨基酸(aa)、约110aa到约115aa、约115aa到约120aa、约120aa到约130aa、约130aa到约140aa、约140aa到约150aa或约150aa到约160aa的连续延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域:
[0188]
rvkfsrsadapayqqgqnql[ynelnlgrreeydvl]dkrrgrdpemggkprrknpqegl[ynelqkdkmaeaysei]gmkgerrrgkghdgl[yqglstatkdtydal]hmqalppr(seq id no:28);rvkfsrsadapayqqgqnql[ynelnlgrreeydvl]dkrrgrdpemggkpqrrknpqegl[ynelqkdkmaeaysei]gmkgerrrgkghdgl[yqglstatkdtydal]hmqalppr(seq id no:29);nql[ynelnlgrreeydvl]dkr(seq id no:30);egl[ynelqkdkmaeaysei]gmk(seq id no:31);或dgl[yqglstatkdtydal]hmq(seq id no:32),其中itam基序在括号中列出。
[0189]
在一些实施例中,细胞内激活结构域源自t细胞表面糖蛋白cd3δ链(也被称为cd3d;cd3-delta;t3d;cd3抗原,δ亚基;cd3δ;cd3d抗原,δ多肽(tit3复合物);okt3,δ链;t细胞受体t3δ链;t细胞表面糖蛋白cd3δ链;等)。因此,合适的细胞内激活结构域可以包含与以下序列的至少10个、15个、20个或所有氨基酸的延伸段或与以下氨基酸序列中的任一个氨基酸序列的约100个氨基酸到约110个氨基酸(aa)、约110aa到约115aa、约115aa到约120aa、约120aa到约130aa、约130aa到约140aa、约140aa到约150aa或约150aa到约160aa的连续延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域:mehstflsglvlatllsqvspfkipieeledrvfvncntsitwvegtvgtllsditrldlgkrildprgiyrcngtdiykdkestvqvhyrmcqscveldpatvagiivtdviatlllalgvfcfaghetgrlsgaadtqallrndqv[yqplrdrddaqyshl]ggnwarnk(seq id no:33)或mehstflsglvlatllsqvspfkipieeledrvfvncntsitwvegtvgtllsditrldlgkrildprgiyrcngtdiykdkestvqvhyrtadtqallrndqv[yqplrdrddaqyshl]ggnwarnk(seq id no:34),其中itam基序在括号中列出。
[0190]
同样,合适的细胞内激活结构域多肽可以包括有全长cd3δ氨基酸序列的一部分的itam基序。因此,合适的细胞内激活结构域可以包含与以下序列中的至少10个、15个、20个或所有氨基酸的延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域:dqv[yqplrdrddaqyshl]ggn(seq id no:
35),其中itam基序在括号中列出。
[0191]
在一些实施例中,细胞内激活结构域源自t细胞表面糖蛋白cd3ε链(也被称为cd3e、t细胞表面抗原t3/leu-4ε链,t细胞表面糖蛋白cd3ε链,ai504783,cd3,cd3ε、t3e等)。因此,合适的细胞内激活结构域可以包含与以下序列的至少10个、15个、20个或所有氨基酸的延伸段或与以下氨基酸序列的约100个氨基酸到约110个氨基酸(aa)、约110aa到约115aa、约115aa到约120aa、约120aa到约130aa、约130aa到约140aa、约140aa到约150aa或约150aa到约160aa的连续延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域:mqsgthwrvlglcllsvgvwgqdgneemggitqtpykvsisgttviltcpqypgseilwqhndkniggdeddknigsdedhlslkefseleqsgyyvcyprgskpedanfylylrarvcencmemdmsvativivdicitggllllvyywsknrkakakpvtrgagaggrqrgqnkerpppvpnpd[yepirkgqrdlysgl]nqrri(seq id no:36),其中itam基序在括号中列出。
[0192]
同样,合适的细胞内激活结构域多肽可以包括有全长cd3ε氨基酸序列的一部分的itam基序。因此,合适的细胞内激活结构域可以包含与以下序列中的至少10个、15个、20个或所有氨基酸的延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域:npd[yepirkgqrdlysglinqr(seq id no:37),其中itam基序在括号中列出。
[0193]
在一些实施例中,细胞内激活结构域源自t细胞表面糖蛋白cd3γ链(也被称为cd3g、t细胞受体t3γ链、cd3-gamma、t3g、γ多肽(tit3复合物)等)。因此,合适的细胞内激活结构域可以包含与以下序列的至少10个、15个、20个或所有氨基酸的延伸段或与以下氨基酸序列的约100个氨基酸到约110个氨基酸(aa)、约110aa到约115aa、约115aa到约120aa、约120aa到约130aa、约130aa到约140aa、约140aa到约150aa或约150aa到约160aa的连续延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域:meqgkglavlilaiillqgtlaqsikgnhlvkvydyqedgsvlltcdaeaknitwfkdgkmigfltedkkkwnlgsnakdprgmyqckgsqnkskplqvyyrmcqncielnaatisgflfaeivsifvlavgvyfiagqdgvrqsrasdkqtllpndql[yqplkdreddqyshl]qgnqlrrn(seq id no:38),其中itam基序在括号中列出。
[0194]
同样,合适的细胞内激活结构域多肽可以包括有全长cd3γ氨基酸序列的一部分的itam基序。因此,合适的细胞内激活结构域可以包含与以下序列中的至少10个、15个、20个或所有氨基酸的延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域:dql[yqplkdreddqyshliqgn(seq id no:39),其中itam基序在括号中列出。
[0195]
在一些实施例中,细胞内激活结构域源自cd79a(也被称为b细胞抗原受体复合物相关蛋白α链;cd79a抗原(免疫球蛋白相关α);mb-1膜糖蛋白;ig-α;膜结合免疫球蛋白相关蛋白;表面igm相关蛋白;等)。因此,合适的细胞内激活结构域可以包含与以下序列的至少10个、15个、20个或所有氨基酸的延伸段或与以下氨基酸序列中的任一个氨基酸序列的约100个氨基酸到约110个氨基酸(aa)、约110aa到约115aa、约115aa到约120aa、约120aa到约130aa、约130aa到约140aa、约140aa到约150aa或约150aa到约160aa的连续延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域:mpggpgvlqalpatifllfllsavylgpgcqalwmhkvpaslmvslgedahfqcphnssnnanvtww
rvlhgnytwppeflgpgedpngtliiqnvnkshggiyvcrvqegnesyqqscgtylrvrqppprpfldmgegtknriitaegiillfcavvpgtlllfrkrwqneklgldagdeyedenl[yeglnlddcsmyedi]srglqgtyqdvgslnigdvqlekp(seq id no:40)或mpggpgvlqalpatifllfllsavylgpgcqalwmhkvpaslmvslgedahfqcphnssnnanvtwwrvlhgnytwppeflgpgedpneppprpfldmgegtknriitaegiillfcavvpgtlllfrkrwqneklgldagdeyedenl[yeglnlddcsmyedi]srglqgtyqdvgslnigdvqlekp(seq id no:41),其中itam基序在括号中列出。
[0196]
同样,合适的细胞内激活结构域多肽可以包括有全长cd79a氨基酸序列的一部分的itam基序。因此,合适的细胞内激活结构域可以包含与以下序列中的至少10个、15个、20个或所有氨基酸的延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域:enl[yeglnlddcsmyedi]srg(seq id no:42),其中itam基序在括号中列出。
[0197]
在一些实施例中,细胞内激活结构域源自dap12(也被称为tyrobp;tyro蛋白酪氨酸激酶结合蛋白;karap;plosl;dnax激活蛋白12;kar相关蛋白;tyro蛋白酪氨酸激酶结合蛋白;杀伤激活受体相关蛋白;杀伤激活受体相关蛋白;等)。例如,合适的细胞内激活结构域可以包含与以下序列的至少10个、15个、20个或所有氨基酸的延伸段或与以下氨基酸序列(4个同种型)的任一个氨基酸序列的约100个氨基酸到约110个氨基酸(aa)、约110aa到约115aa、约115aa到约120aa、约120aa到约130aa、约130aa到约140aa、约140aa到约150aa或约150aa到约160aa的连续延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域:mgglepcsrllllplllavsglrpvqaqaqsdcscstvspgvlagivmgdlvltvlialavyflgrlvprgrgaaeaatrkqritetesp[yqelqgqrsdvysdl]ntqrpyyk(seq id no:43),mgglepcsrllllplllavsglrpvqaqaqsdcscstvspgvlagivmgdlvltvlialavyflgrlvprgrgaaeatrkqritetesp[yqelqgqrsdvysdl]ntq(seq id no:44),mgglepcsrllllplllavsdcscstvspgvlagivmgdlvltvlialavyflgrlvprgrgaaeaatrkqritetesp[yqelqgqrsdvysdl]ntqrpyyk(seq id no:45)或mgglepcsrllllplllavsdcscstvspgvlagivmgdlvltvlialavyflgrlvprgrgaaeatrkqritetesp[yqelqgqrsdvysdl]ntqrpyyk(seq id no:46),其中itam基序在括号中列出。
[0198]
同样,合适的细胞内激活结构域多肽可以包括有全长dap12氨基酸序列的一部分的itam基序。因此,合适的细胞内激活结构域可以包含与以下序列中的至少10个、15个、20个或所有氨基酸的延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域:esp[yqelqgqrsdvysdlintq(seq id no:47),其中itam基序在括号中列出。
[0199]
在一些实施例中,细胞内激活结构域源自fcerlg(也被称为fcrg;fcε受体iγ链;fc受体γ链;fc-εri-γ;fcrγ;fceriγ;高亲和力免疫球蛋白ε受体亚基γ;免疫球蛋白e受体,高亲和力,γ链;等)。例如,合适的细胞内激活结构域可以包含与以下序列的至少10个、15个、20个或所有氨基酸的延伸段或与以下氨基酸序列的约50个氨基酸到约60个氨基酸(aa)、约60aa到约70aa、约70aa到约80aa或约80aa到约88aa的连续延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域:mipavvllllllveqaaalgepqlcyildailflygivltllycrlkiqvrkaaitsyeksdgv[ytglstrnqetyetl]khekppq(seq id no:48),其中itam基序在括号中列出。
[0200]
同样,合适的细胞内激活结构域多肽可以包括有全长fcer1g氨基酸序列的一部分的itam基序。因此,合适的细胞内激活结构域可以包含与以下序列中的至少10个、15个、20个或所有氨基酸的延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域:dgv[ytglstrnqetyetlikhe(seq id no:49),其中itam基序在括号中列出。
[0201]
适于本公开的car中使用的细胞内激活结构域包含dap10/cd28型信号传导链。dap10信号传导链的实例是氨基酸seq id no:50。在一些实施例中,合适的细胞内激活结构域包含与seq id no:50中的至少10个、15个、20个或所有氨基酸的延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域。
[0202]
cd28信号传导链的实例是氨基酸序列seq id no:51。在一些实施例中,合适的细胞内结构域包含与seq id no:51的至少10个、15个、20个或所有氨基酸的延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域。
[0203]
适于在本公开的car中使用的细胞内激活结构域zap70多肽,例如合适的细胞内激活结构域可以包含与以下序列的至少10个、15个、20个或所有氨基酸的延伸段或与seq id no:52的约300个氨基酸到约400个氨基酸、约400个氨基酸到约500个氨基酸或约500个氨基酸到619个氨基酸的连续延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域。
[0204]
分裂car
[0205]
在说明性实施例中,car被表达为包含astr(即配体结合结构域)、跨膜结构域和细胞内激活结构域的单个全长融合多肽。在其它实施例中,astr、跨膜结构域和激活结构域在分裂car设计中非共价连接。在一些实施例中,car被表达为两个非共价缔合的多肽。在一些实施例中,car被表达为3个或更多个非共价缔合的多肽。
[0206]
在一些分裂car实施例中,识别her2的astr不与跨膜结构域共价结合。在一些实施例中,识别her2的astr与多肽相互作用结构域融合,所述多肽相互作用结构域能够与包括跨膜结构域和细胞内激活结构域的融合多肽的胞外结构域中的同源相互作用结构域缔合。在一些实施例中,这些融合多肽之间的相互作用是直接的。在一些实施例中,所述相互作用是由亮氨酸拉链基序介导的。在一些实施例中,这两种多肽的相互作用是由第三种多肽或小分子介导的。
[0207]
在一些分裂car实施例中,第一多肽包括astr和跨膜结构域,并且第二多肽包括细胞内激活结构域。在一些实施例中,第一多肽包含缺乏共价连接的细胞内激活结构域的细胞内结构域。在一些实施例中,第二多肽是膜结合的。在一些实施例中,第二多肽在细胞质中扩散。在一些实施例中,第一多肽和第二多肽通过其跨膜结构域非共价缔合。在一些实施例中,第二多肽在细胞质中扩散并且与第一多肽的细胞内结构域缔合。
[0208]
调节结构域
[0209]
调节结构域可以改变car中的细胞内激活结构域的作用,包含增强或抑制激活结构域的下游效应或改变应答的性质。一个、两个、三个、四个或更多个不同的调节结构域,或相同调节结构域的一个、两个、三个、四个或更多个拷贝可以包含在本文所提供的car中。适
于在本公开的car中使用的调节结构域包含共刺激结构域,所述共刺激结构域是包含在本文所提供的某些示例性car实施例中的任选的car结构域。适于包含在car中的调节结构域的长度可以为约30个氨基酸到约70个氨基酸(aa),例如,调节结构域的长度可以为约30aa到约35aa、约35aa到约40aa、约40aa到约45aa、约45aa到约50aa、约50aa到约55aa、约55aa到约60aa、约60aa到约65aa或约65aa到约70aa。在其它情况下,调节结构域的长度可以为约70aa到约100aa、约100aa到约200aa或大于200aa。
[0210]
共刺激结构域通常增强和/或改变对激活结构域的应答的性质。适于在本公开的car中使用的共刺激结构域通常是源自受体的多肽。在一些实施例中,共刺激结构域同二聚化。主题共刺激结构域可以是跨膜蛋白的细胞内部分(即,共刺激结构域可以源自跨膜蛋白)。在一些实施例中,本文所提供的任何car可以包含共刺激结构域。在一些实施例中,共刺激结构域可以包含与至少10、15、20、25、30、35、40、45或50个氨基酸的延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域,或以下各项的共刺激结构域:4-1bb(cd137)、b7-hcdr3、cd2、cd7、cd27、cd28、因lck结合而缺失的cd28(icδ)、cd30、cd40、icos、ox40、btla、gitr、hvem、icam-1、lfa-1(cd11a/cd18)、light、nkg2c、b7-h3、与cd83特异性结合的配体、cds、baffr、slamf7、nkp80(klrf1)、cd4、cd8α、cd8β、il2rβ、il2rγ、il7rα、itga4、itga6、itgad、itgae、itgal、itgam、itgax、itgb1、itgb2、itgb7、ia4、vla1、vla-6、c49f、cd11a、cd11b、cd11c、cd11d、cd18、cd19、cd29、cd49a、cd49d、cd69、cd84、cd96(tactile)、cd103、cd160(by55)、crlf2、csf2rb、csf2ra、csf3r、epor、lfa-1、tnfr2、trance/rankl、dnam1(cd226)、fcgra2、ghr、slamf4(c244、2b4)、ceacam1、crtam、ly9(cd229)、pd-1、psgl1、c100(sema4d)、slamf6(ntb-a、ly108)、slam(slamf1、cd150、ipo-3)、blame(slamf8)、selplg(cd162)、itbr、lat、gads、pag/cbp、slp-76、tilr2、tilr4、tilr7、tilr9、fc受体γ链、fc受体ε链、ifnar1、ifnar2、ifngr1、ifngr2、ifnlr1、il1r1、il1rap、il1rl1、il1rl2、il2ra、il2rb、il2rg、il3ra、il4r、il5ra、il6r、il6st、il9r、il10ra、il10rb、il11ra、il12rb1、il12rb2、il13ra1、il13ra2、il15ra、il17ra、il17rb、il17rc、il17rd、il17re、il18r1、il18rap、il20ra、il20rb、il21r、il22ra1、il23r、il27ra、il31ra、lepr、lifr、lmp1、mpl、myd88、osmr或prlr或其功能突变体和/或片段。
[0211]
适于包含在car中的共刺激结构域的长度可以为约30个氨基酸到约70个氨基酸(aa),例如,共刺激结构域的长度可以为约30aa到约35aa、约35aa到约40aa、约40aa到约45aa、约45aa到约50aa、约50aa到约55aa、约55aa到约60aa、约60aa到约65aa或约65aa到约70aa。在其它情况下,共刺激结构域的长度可以为约70aa到约100aa、约100aa到约200aa或大于200aa。
[0212]
在一些实施例中,共刺激结构域源自跨膜蛋白cd137的细胞内部分(也被称为tnfrsf9;cd137;4-1bb;cdwlcdr37;ila;等)。例如,合适的共刺激结构域可以包含与seq id no:53中的至少10个、15个、20个或所有氨基酸的延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域。在这些实施例中的一些实施例中,共刺激结构域的长度为约30aa到约35aa、约35aa到约40aa、约40aa到约45aa、约45aa到约50aa、约50aa到约55aa、约55aa到约60aa、约60aa到约65aa或约65aa到约70aa。
[0213]
在一些实施例中,共刺激结构域源自跨膜蛋白cd28的细胞内部分(也被称为tp44)。例如,合适的共刺激结构域可以包含与seq id no:54中的至少10个、15个、20个或所有氨基酸的延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域。在这些实施例中的一些实施例中,共刺激结构域的长度为约30aa到约35aa、约35aa到约40aa、约40aa到约45aa、约45aa到约50aa、约50aa到约55aa、约55aa到约60aa、约60aa到约65aa或约65aa到约70aa。
[0214]
在一些实施例中,共刺激结构域源自因lck结合而缺失的跨膜蛋白cd28(icδ)的细胞内部分。例如,合适的共刺激结构域可以包含与seq id no:55中的至少10个、15个、20个或所有氨基酸的延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域。在这些实施例中的一些实施例中,共刺激结构域的长度为约30aa到约35aa、约35aa到约40aa、约40aa到约45aa、约45aa到约50aa、约50aa到约55aa、约55aa到约60aa、约60aa到约65aa或约65aa到约70aa。
[0215]
在一些实施例中,共刺激结构域源自跨膜蛋白icos的细胞内部分(也被称为ailim、cd278和cvidl)。例如,合适的共刺激结构域可以包含与seq id no:56中的至少10个、15个、20个或所有氨基酸的延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域。在这些实施例中的一些实施例中,共刺激结构域的长度为约30aa到约35aa、约35aa到约40aa、约40aa到约45aa、约45aa到约50aa、约50aa到约55aa、约55aa到约60aa、约60aa到约65aa或约65aa到约70aa。
[0216]
在一些实施例中,共刺激结构域源自跨膜蛋白ox40的细胞内部分(也被称为tnfrsf4、rp5-902p8.3、act35、cd134、ox-40、txgpll)。ox40在残基34-57处含有p85 pi3k结合基序,并且在残基76-102处含有traf结合基序,seq id no:84中的每一个。在一些实施例中,共刺激结构域可以包含ox40的p85 pi3k结合基序。在一些实施例中,共刺激结构域可以包含ox40的traf结合基序。对应于seq id no:84的氨基酸17和41的赖氨酸是用作泛素靶向基序的一部分的潜在的负调节位点。在一些实施例中,ox40的共刺激结构域中的这些赖氨酸中的一个或两个是突变的精氨酸或另一种氨基酸。在一些实施例中,合适的共刺激结构域可以包含与seq id no:57中的至少10个、15个、20个或所有氨基酸的延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域。在这些实施例中的一些实施例中,共刺激结构域的长度为约20aa到约25aa、约25aa到约30aa、30aa到约35aa、约35aa到约40aa、约40aa到约45aa或约45aa到约50aa。在说明性实施例中,共刺激结构域的长度为约20aa到约50aa,例如20aa到45aa或20aa到42aa。
[0217]
在一些实施例中,共刺激结构域源自跨膜蛋白cd27细胞内部分(也被称为s 152、t 14、tnfrsf7和tp55)。例如,合适的共刺激结构域可以包含与seq id no:58中的至少10个、15个、20个或所有氨基酸的延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域。在这些实施例中的一些实施例中,共刺激结构域的长度为约30aa到约35aa、约35aa到约40aa、约40aa到约45aa或约45aa到约50aa。
[0218]
在一些实施例中,共刺激结构域源自跨膜蛋白btla的细胞内部分(也被称为btla1和cd272)。例如,合适的共刺激结构域可以包含与seq id no:59中的至少10个、15个、20个或所有氨基酸的延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、
97%、98%、99%或100%序列同一性的结构域。
[0219]
在一些实施例中,共刺激结构域源自跨膜蛋白cd30细胞内部分(也被称为tnfrsf8、d1s166e和ki-1)。例如,合适的共刺激结构域可以包含与seq id no:60的约100个氨基酸到约110个氨基酸(aa)、约110aa到约115aa、约115aa到约120aa、约120aa到约130aa、约130aa到约140aa、约140aa到约150aa、约150aa到约160aa或约160aa到约185aa的延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域。
[0220]
在一些实施例中,共刺激结构域源自跨膜蛋白gitr的细胞内部分(也被称为tnfrsf18、rp5-902p8.2、aitr、cd357和gitr-d)。例如,合适的共刺激结构域可以包含与seq id no:61中的至少10个、15个、20个或所有氨基酸的延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域。在这些实施例中的一些实施例中,共刺激结构域的长度为约30aa到约35aa、约35aa到约40aa、约40aa到约45aa、约45aa到约50aa、约50aa到约55aa、约55aa到约60aa、约60aa到约65aa或约65aa到约70aa。
[0221]
在一些实施例中,共刺激结构域源自跨膜蛋白hvem的细胞内部分(也被称为tnfrsf14、rp3-395m20.6、atar、cd270、hvea、hvem、lightr和tr2)。例如,合适的共刺激结构域可以包含与seq id no:62中的至少10个、15个、20个或所有氨基酸的延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域。在这些实施例中的一些实施例中,第一多肽和第二多肽两者的共刺激结构域的长度为约30aa到约35aa、约35aa到约40aa、约40aa到约45aa、约45aa到约50aa、约50aa到约55aa、约55aa到约60aa、约60aa到约65aa或约65aa到约70aa。
[0222]
连接子
[0223]
在一些实施例中,car包含任何两个相邻结构域之间的连接子。例如,连接子可以介于跨膜结构域与第一共刺激结构域之间。作为另一个实例,astr可以是抗体并且连接子可以介于重链与轻链之间。作为另一个实例,连接子可以介于astr与跨膜结构域和共刺激结构域之间。作为另一个实例,连接子可以介于第二多肽的共刺激结构域与细胞内激活结构域之间。作为另一个实例,连接子可以介于astr与细胞内信号传导结构域之间。
[0224]
连接肽可以具有多个氨基酸序列中的任一个。蛋白质可以通过通常具有柔性性质的间隔肽连接,但不排除其它化学键。连接子可以是长度介于约1个与约100个氨基酸之间,或介于约1个与约25个氨基酸之间的肽。这些连接子可以通过使用合成的、编码连接子的寡核苷酸来偶联蛋白质而产生。可以使用具有一定柔性的肽连接子。连接肽实际上可以具有任何氨基酸序列,记住:合适的连接子将具有产生一般柔性肽的序列。使用如甘氨酸和丙氨酸等小型氨基酸在产生柔性肽方面是有用的。这种序列的产生对于本领域技术人员来说是常规的。
[0225]
合适的连接子可以容易地选择,并且可以是具有如1个氨基酸(例如,gly)到50个氨基酸、2个氨基酸到35个氨基酸、5个氨基酸到30个氨基酸、15个氨基酸到30个氨基酸、2个氨基酸到15个氨基酸、3个氨基酸到12个氨基酸,包含4个氨基酸到10个氨基酸、5个氨基酸到9个氨基酸、6个氨基酸到8个氨基酸或7个氨基酸到8个氨基酸等不同长度的合适的连接子中的任一个,并且可以是1个氨基酸、2个氨基酸、3个氨基酸、4个氨基酸、5个氨基酸、6个
氨基酸或7个氨基酸。
[0226]
示例性柔性连接子包含甘氨酸聚合物(g)n、甘氨酸-丝氨酸聚合物(包含例如(gs)n、(ggs)n、(gsggs)n、(gggs)n和(ggggs)n,其中n是为至少一的整数)、甘氨酸-丙氨酸聚合物、丙氨酸-丝氨酸聚合物和本领域已知的其它柔性连接子。甘氨酸和甘氨酸-丝氨酸聚合物是所关注的,因为这些氨基酸中的两个氨基酸都是相对非结构化的,并且因此可以充当组分之间的中性系链。甘氨酸聚合物特别受关注,因为甘氨酸比甚至丙氨酸获得显著更多的phi-psi空间,并且比具有较长侧链的残基的限制要少得多(参见scheraga,《计算化学综述(rev.computational chem.)》11173-142(1992))。示例性柔性连接子包含但不限于gstsgsgkpgsgegs(seq id no:1)、rtgstsgsgkpgsgegs(seq id no:249)、gstsgsgkpgsgegstkg(seq id no:144)、ggggsggggsggggs(seq id no:63)、ggggsggggsggggsggggsggggsggggs(seq id no:64)、ggggsgggsggggs(seq id no:65)、ggsg(seq id no:66)、ggsgg(seq id no:67)、gsgsg(seq id no:68)、gsggg(seq id no:69)、gggsg(seq id no:70)、gsssg(seq id no:71)、gs、ggggsggggsggggsggggs(seq id no:152)等。在某些说明性实施例中,astr的重链可变区与轻抗体链可变区之间的连接子介于5个与50个、5个与30个、5个与20个、10个与20个、10个与30个、15个与30个或5个与15个氨基酸之间并且包含gggs的重复。普通技术人员将认识到,与上文描述的任何要素缀合的肽的设计可以包含完全或部分柔性的连接子,使得所述连接子可以包含柔性连接子以及赋予较少柔性结构的一个或多个部分。
[0227]
核酸
[0228]
本文公开了核酸用于各种方法。此外,编码本文所公开的任何car的分离的核酸是本文所提供的单独的方面和实施例。例如,一方面,本文提供了一种编码用于结合her2的嵌合抗原受体(car)的分离的核酸,所述car包括:
[0229]
a)抗原特异性靶向区(astr),所述astr与her2蛋白特异性结合;
[0230]
b)跨膜结构域;以及
[0231]
c)细胞内激活结构域,其中所述跨膜结构域定位于所述astr与所述细胞内激活结构域之间,并且其中所述astr包括重链可变区,所述重链可变区包括具有序列hcdr1、hcdr2和hcdr3的三个互补决定区(cdr),其中:所述hcdr1序列是gfnikdtyih(seq id no:131);所述hcdr2序列是x1iyptngytx2yadsvkg(seq id no:137);并且所述hcdr3序列是wggdgfyamdy(seq id no:133);并且所述astr包括轻链可变区,所述轻链可变区包含具有序列lcdr1、lcdr2和lcdr3的三个cdr,其中:所述lcdr1序列是rasqdvntx3va(seq id no:142);所述lcdr2序列是sasflys(seq id no:135);并且所述lcdr3序列是qqx4yttppt(seq id no:143),其中x1是r或k,x2是r或e,x3是a或d,并且x4是h、d或e。
[0232]
考虑了编码本文所提供的任何car的许多其它核酸方面和实施例。例如,在本文中的示例性实施例部分中提供了另外的非限制性实例。技术人员理解,可以使用基因密码设计编码本文所提供的任何car多肽的核酸。
[0233]
在本文所公开的实施例中的任何实施例中,编码car的核酸,包含但不限于此类car的astr,可以通过对核酸序列的修饰(包含密码子优化和对剪接供体和受体位点的去除)来优化以在人细胞中表达。在本文中的说明性实施例中,基准抗体重链可变区(seq id no:119)由核酸序列seq id no:145编码,其中hcdr1由核苷酸76到105编码,hcdr2由核苷酸
148到198编码,并且hcdr3由核苷酸295到327编码。在本文中的说明性实施例中,抗体重链可变区是突变体r050k(seq id no:124)并且由核酸序列seq id no:146编码。在本文中的说明性实施例中,抗体重链可变区是突变体r059e(seq id no:123)并且由核酸序列seq id no:147编码。在本文中的说明性实施例中,抗体重链可变区具有突变体r050k/r059e(seq id no:125)。在本文中的说明性实施例中,基准抗体轻链可变区(seq id no:122)由核酸序列seq id no:148编码,其中lcdr1由核苷酸70到102编码,lcdr2由核苷酸148到168编码,并且lcdr3由核苷酸265到291编码。在本文中的说明性实施例中,抗体轻链可变区是突变体a032d(seq id no:128)并且由核酸序列seq id no:149编码。在本文中的说明性实施例中,抗体轻链可变区是突变体h091d(seq id no:127)并且由核酸序列seq id no:150编码。在本文中的说明性实施例中,抗体轻链可变区是突变体h091e(seq id no:126)并且由核酸序列seq id no:151编码。在本文中的说明性实施例中,抗体重链可变区具有突变体a032/h091d(seq id no:129)。在本文中的说明性实施例中,抗体重链可变区具有突变体a032/h091e(seq id no:130)。在说明性实施例中,对于上文提供的编码重链可变区突变体的核酸,轻链可变区是seq id no:148。在说明性实施例中,对于上文提供的编码轻链可变区突变体的核酸,重链可变区是seq id no:145。
[0234]
核酸在一些实施例中是dna,包含例如编码任何抗her2 car的重组表达载体,并且在说明性实施例中,本文所提供的cab-car,例如呈分离形式或作为t细胞或nk细胞的基因组的全部或部分。核酸在一些实施例中是dna编码任何抗her2 car的rna,并且在说明性实施例中,本文所提供的cab-car,例如呈分离形式或作为包装细胞系、t细胞或nk内的逆转录病毒基因组或表达的转录物。在一些实施例中,核酸可以是分离的。如本文所用,术语“分离的”意指将材料从其原始环境(例如,如果其天然存在的话,自然环境)中去除。例如,存在于活动物中的天然存在的多核苷酸或在其它实施例中多肽不是分离的,但是从天然系统中的一些或全部共存材料分离的相同的多核苷酸或多肽是分离的。此类多核苷酸可以是载体的一部分和/或此类多核苷酸或多肽可以是组合物的一部分,并且仍然是分离的,因为此类载体或组合物不是其天然环境的一部分。例如,分离的核酸可以是表达载体的一部分,在说明性实施例中,所述表达载体可以是无复制能力的重组逆转录病毒颗粒。
[0235]
编码多肽(例如,本公开的car)的核苷酸序列可以与转录控制元件,例如启动子和增强子等可操作地连接。在此类构建体中,转录控制元件指导和/或调节可操作连接的多肽(例如,car)的表达。为了在真核细胞中表达,如例如用于制备重组逆转录病毒颗粒的包装细胞系,合适的启动子包含但不限于轻链和/或重链免疫球蛋白基因启动子和增强子元件;巨细胞病毒立即早期启动子;单纯疱疹病毒胸苷激酶启动子;早期和晚期sv40启动子;存在于逆转录病毒的长末端重复序列中的启动子;小鼠金属硫蛋白-i启动子;以及各种本领域已知的组织特异性启动子。在一些实施例中,启动子是cd8细胞特异性启动子、cd4细胞特异性启动子、嗜中性粒细胞特异性启动子或nk特异性启动子。启动子在靶细胞中可以是组成型活性的或可诱导的。例如,可以使用cd4基因启动子;参见例如,salmon等人(1993)《美国国家科学院院刊》90:7739;以及marodon等人(2003)《血液(blood)》101:3416。作为另一个实例,可以使用cd8基因启动子。例如,对于在t细胞中的表达,启动子可以是ef1α启动子或小鼠干细胞病毒(mscv)启动子(jones等人,《人基因疗法(human gene therapy)》(2009)20:630-40)。在说明性实施例中,所述启动子是t细胞特异性cd3ζ启动子。nk细胞特异性表
达可以通过使用neri(p46)启动子来实现;参见例如,eckelhart等人(2011)《血液》117:1565。合适的可逆启动子,包含可逆诱导型启动子是本领域已知的。此类可逆启动子可以分离自和源自许多生物体例如真核生物和原核生物中。对源自第一生物体的可逆启动子进行修饰以用于第二生物,例如第一原核生物和第二真核生物、第一真核生物和第二原核生物等,在本领域中是众所周知的。此类可逆启动子和基于此类可逆启动子但还包括另外的控制蛋白的系统包含但不限于醇调节的启动子(例如,醇脱氢酶i(alca)基因启动子、对醇反式激活蛋白(alcr)具有应答性的启动子等)、四环素调节启动子(例如,包含tetactivators、teton、tetoff等的启动子系统)、类固醇调节启动子(例如,大鼠糖皮质激素受体启动子系统、人雌激素受体启动子系统、类视黄醇启动子系统、甲状腺启动子系统、蜕皮激素启动子系统、米非司酮启动子系统等)、金属调节启动子(例如,金属硫蛋白启动子系统等)、发病机制相关的调节启动子(例如,水杨酸调节启动子、乙烯调节启动子、苯并噻二唑调控启动子等)、温度调节启动子(例如,热休克诱导型启动子(例如,hsp-70、hsp-90、大豆热休克启动子等)、光调节启动子、合成诱导型启动子等。本文提供了对用于各种方法和作为单独方面的合适启动子的进一步讨论。
[0236]
编码本公开的car的分离的核苷酸序列可以存在于真核表达载体中。表达载体可以包含选择标志物、复制起点和提供对载体的复制和/或维持以及转基因表达的其它特征。例如,表达载体通常包含与转基因可操作地连接的启动子。合适的表达载体是本领域已知的并且包含例如质粒和病毒载体。在一些实施例中,表达载体是重组逆转录病毒颗粒,如本文详细公开的。
[0237]
包含多核苷酸、核酸序列和/或转录单元和/或包含它们的载体的各个方面和实施例进一步包含kozak型序列(在本文中也被称为kozak相关序列)、土拨鼠肝炎病毒转录后调节元件(wpre)和双重终止密码子或三重终止密码子中的一种或多种,其中所述双重终止密码子或所述三重终止密码子中的一个或多个终止密码子定义对一个或多个转录单元中的至少一个转录单元的读取的终止。在某些实施例中,多核苷酸、核酸序列和/或转录单位和/或包含它们的载体,进一步包含在一个或多个转录单元中的至少一个转录单元的起始密码子上游10个核苷酸内具有5
′
核苷酸的kozak型序列。kozak确定699个脊椎动物mrna的kozak共有序列(gcc)gccrccatg(seq id no:107),其中r是嘌呤(a或g)(kozak.《核酸研究》1987年10月26日;15(20):8125-48)。在一个实施例中,kozak型序列是或包含ccaccat/ug(g)(seq id no:108)、ccgccat/ug(g)(seq id no:109)、gccgccgccat/ug(g)(seq id no:110)或gccgccaccat/ug(g)(seq id no:111)(其中括号中的核苷酸表示任选的核苷酸,并且由斜线分隔的核苷酸指示所述位置处不同可能的核苷酸,例如取决于核酸是dna还是rna)。在包含au/tg起始密码子的这些实施例中,a可以被视为是位置0。在某些说明性实施例中,-3和+4处的核苷酸是相同的,例如-3和+4核苷酸可以是g。在另一个实施例中,kozak型序列在atg上游的第3位置包含a或g,其中atg是起始密码子。在另一个实施例中,kozak型序列在aug上游的第3位置包含a或g,其中aug是起始密码子。在说明性实施例中,kozak序列是(gcc)gccrccatg(seq id no:107),其中r是嘌呤(a或g)。在说明性实施例中,kozak型序列是gccgccaccaug(seq id no:112)。在可以与包含kozak型序列的前述实施例和/或包含三重终止密码子的以下实施例组合的另一个实施例中,多核苷酸包含wpre元件。wpre已在本领域中表征(参见例如(higashimoto等人,《基因疗法(gene ther.)》2007;14:1298))并且
如在wo2019/055946中所展示的)。在一些实施例中,wpre元件定位于一个或多个转录单元的终止密码子的3
′
和多核苷酸的3
′
ltr的5
′
。在可以与前述实施例中的一个或两个实施例组合的另一个实施例中(即其中多核苷酸包含kozak型序列的实施例和/或其中多核苷酸包含wpre的实施例),一个或多个转录单元以双重终止密码子或三重终止密码子中的一个或多个终止密码子终止,其中双重终止密码子包含第一阅读框中的第一终止密码子和第二阅读框中的第二终止密码子,或框中的第一终止密码子与第二终止密码子,并且其中所述三重终止密码子包含第一阅读框中的第一终止密码子、第二阅读框中的第二终止密码子和第三阅读框中的第三重终止密码子,或框中的第一终止密码子与第二终止密码子和第三终止密码子。
[0238]
本文中的三重终止密码子包含三个终止密码子,每个阅读框中一个,彼此相距10个核苷酸,并且优选地具有重叠序列,或者在同一阅读框中包含三个终止密码子,优选地在连续密码子处。双重终止密码子意指两个终止密码子,各自在不同的阅读框中,彼此相距10个核苷酸,并且优选地具有重叠序列,或相同阅读框中的两个终止密码子,优选地在连续密码子处。
[0239]
在本文所公开的方法和组合物中的一些方法和组合物中,将dna引入到pbmc、b细胞、t细胞和/或nk细胞中并且任选地将dna并入到宿主细胞基因组中,是使用不利用无复制能力的重组逆转录病毒颗粒的方法进行的。例如,可以使用其它病毒载体,如源自腺病毒、腺相关病毒或单纯疱疹病毒-1的那些,作为非限制性实例。
[0240]
在一些实施例中,本文所提供的方法可以包含用非病毒载体转染靶细胞。在本文所公开的实施例中的任何实施例中,可以利用非病毒载体转染靶细胞,可以使用包含以下的方法将包含裸dna的非病毒载体引入到靶细胞,如例如pbmc、b细胞、t细胞和/或nk细胞中:电穿孔、核转染、脂质体调配、脂质、树状物、如聚(乙烯亚胺)(pei)和聚(l-赖氨酸)(pll)等阳离子聚合物、纳米颗粒、细胞穿透肽、显微注射和/或非整合慢病毒载体。在一些实施例中,dna可以以与脂质体和鱼精蛋白的复合物形式引入到靶细胞如pbmc、b细胞、t细胞和/或nk细胞中。可以用于本文所提供的方法的实施例中的用于离体转染t细胞和/或nk细胞的其它方法是本领域已知的(参见例如,morgan和boyerinas,《生物医学(biomedicines.)》2016年4月20日;4(2).pii:e9,所述文献以全文引用的方式并入本文中)。
[0241]
在本文所提供的方法的一些实施例中,可以使用基于转座子的载体系统通过将靶dna作为质粒共转染、共核转染或共电穿孔而将dna整合到基因组中,所述质粒含有所关注基因5
′
端和3
′
端中的转座子itr片段和作为dna或mrna或蛋白质或位点特异性丝氨酸重组酶如phic31的将所关注基因整合到人基因组中的伪attp位点的转座酶载体系统,在此情况下,dna载体含有34到40bp attb位点(bhaskar thyagarajan等人由噬菌体整合酶介导的哺乳动物细胞中的位点特异性基因组整合(site-specific genomic integration in mammalian cells mediated by phageintegrase),《分子细胞生物学(mol cell biol.)》2001年6月;21(12):3926-3934),所述位点是重组酶的识别序列并且用重组酶共转染。对于t细胞和/或nk细胞,可以用于本文所提供的某些方法的基于转座子的系统利用呈dna、mrna或蛋白质形式的睡美人dna载体系统(参见例如,美国专利第6,489,458号和美国专利申请第15/434,595号,所述文献以全文引用的方式并入本文中),piggybac dna载体系
统(参见例如,manuri等人,《人基因疗法》2010年4月;21(4):427-37,所述文献以全文引用的方式并入本文中)或tolcdr2转座子系统(参见例如,tsukahara等人,《基因疗法》2015年2月;22(2):209-215,所述文献以全文引用的方式并入本文中)。在一些实施例中,基于转座子的载体系统的转座子和/或转座酶可以在引入到t细胞和/或nk细胞中之前作为小环dna载体产生(参见例如,hudecek等人,《癌症研究的最新成果(recent results cancer res.)》2016;209:37-50以及monjezi等人,《白血病(leukemia.)》2017年1月;31(1):186-194,所述文献以全文引用的方式并入本文中)。然而,在一些情况下,基于转座酶的载体系统不是引入外源性核酸的优选方法。因此,在一些实施例中,本文所公开的各方面或实施例中的任何方面或实施例的多核苷酸不包含转座子itr片段。在一些实施例中,本文所公开的各方面或实施例中的任何方面或实施例的经修饰的、经基因修饰的和/或经转导的细胞不包含作为dna或mrna或蛋白质的转座酶载体系统。car还可以使用crispr或talen介导的整合,通过添加与靶位点的整合5
′
和3
′
同源的50-1000bp同源臂来整合到基因组中的定义的和特异性位点(jae seong lee等人《科学报告5(scientific reports 5)》,文章编号:8572(2015),由crispr/cas9和同源定向dna修复途径介导的cho细胞中的位点特异性整合(site-specific integration in cho cells mediated by crispr/cas9 and homology-directed dna repair pathway))。crispr或talen提供特异性和基因组靶向切割,并且构建体将通过同源介导的末端接合进行整合(yao x等人《细胞学研究(cell res.)》2017年6月;27(6):801-814.doi:10.1038/cr.2017.76.epub 2017年5月19日)。crispr或talen可以与靶标质粒作为dna、mrna或蛋白质共转染。
[0242]
在一些实施例中,本文中的分离的核酸是合成rna,如编码一种或多种car的合成mrna。car可以是本文所公开的任何car组合物。
[0243]
重组逆转录病毒颗粒
[0244]
本文所提供的方法和组合物中公开了重组逆转录病毒颗粒,例如,用于转导t细胞和/或nk细胞以制备经基因修饰的t细胞和/或nk细胞以及作为分离的表达载体。重组逆转录病毒颗粒本身就是本发明的方面。通常,本文所提供的方面中包含的重组逆转录病毒颗粒是无复制能力的,这意味着重组逆转录病毒颗粒一旦离开包装细胞就不能复制。在说明性实施例中,重组逆转录病毒颗粒是慢病毒颗粒。
[0245]
在一些方面,本文提供了用于转导细胞,通常是淋巴细胞和说明性实施例t细胞和/或nk细胞的无复制能力的重组逆转录病毒颗粒。无复制能力的重组逆转录病毒颗粒可以包含本文别处讨论的任何假型化元件。一方面,本文提供了一种无复制能力的重组逆转录病毒颗粒,其包含多核苷酸,所述多核苷酸包含:a.一个或多个转录单元,所述一个或多个转录单元与在t细胞和/或nk细胞中具有活性的启动子可操作地连接,其中所述一个或多个转录单元编码嵌合抗原受体(car);以及b.假型化元件。另一方面,本文提供了一种无复制能力的重组逆转录病毒颗粒,其包含多核苷酸,所述多核苷酸包含与在t细胞和/或nk细胞中具有活性的启动子可操作地连接的一个或多个转录单元,其中所述一个或多个转录单元编码包含嵌合抗原受体(car)的第一多肽以及第二多肽。
[0246]
本文在一些方面提供了一种重组逆转录病毒颗粒,其包含(i)能够与t细胞和/或nk细胞结合并促进所述重组逆转录病毒颗粒与其膜融合的假型化元件;以及(ii)具有与在t细胞和/或nk细胞中具有活性的启动子可操作地连接的一个或多个转录单元的多核苷酸,
其中所述一个或多个转录单位编码具有嵌合抗原受体的第一多肽,所述嵌合抗原受体包含抗原特异性靶向区、跨膜结构域和细胞内激活结构域。在一些实施例中,在t细胞和/或nk细胞中具有活性的启动子在包装细胞系中不具有活性或仅在包装细胞系中以可诱导的方式具有活性。
[0247]
在本公开全文中提供了包含在无复制能力的重组逆转录病毒颗粒中的各种元件和元件的组合,如例如假型化元件,以及包含在无复制能力的重组逆转录病毒颗粒的基因组中的核酸序列,如但不限于编码car的核酸;编码控制元件的核酸;以及启动子,尤其是在t细胞和/或nk细胞中具有组成型活性或可诱导的启动子。此外,本文提供的各个方面,如制备重组逆转录病毒颗粒的方法、用于进行过继性细胞疗法的方法以及用于转导t细胞的方法,产生和/或包含无复制能力的重组逆转录病毒颗粒。产生和/或包含在此类方法中的无复制能力的重组逆转录病毒本身形成本发明的单独方面,作为无复制能力的重组逆转录病毒颗粒组合物,其可以呈分离的形式。此类组合物可以呈干燥的(例如,冻干的)形式,或者可以呈本领域已知的用于储存和使用逆转录病毒颗粒的合适溶液或介质形式。
[0248]
重组逆转录病毒载体如慢病毒载体的必要元件是本领域已知的。这些元件包含在包装细胞系部分中,并且详细地用于制备实例中提供的无复制能力的重组逆转录病毒颗粒。例如,慢病毒颗粒通常包含:包装元件rev、gag和pol,所述包装元件可以通过一种或多种包装质粒递送到包装细胞系;假型化元件;本文所提供的各个实例,其可以通过假型化质粒递送到包装细胞系;以及基因组,所述基因组由通过转移质粒递送到宿主细胞的多核苷酸产生。此多核苷酸通常包含病毒ltr和psi包装信号。5
′
ltr可以是与异源启动子融合的嵌合5
′
ltr,其包含不依赖于tat反式激活的5
′
ltr。转移质粒可以自失活,例如,通过去除3
′
ltr的u3区。
[0249]
包含在本发明的各个方面的逆转录病毒颗粒(例如,慢病毒颗粒)在说明性实施例中是无复制能力的,尤其是出于安全原因,对于包含将用此类逆转录病毒颗粒转导的细胞引入到受试者中的实施例而言。当无复制能力的逆转录病毒颗粒用于转导细胞时,逆转录病毒颗粒不由经转导的细胞产生。本领域已知对逆转录病毒基因组的修饰以确保包含所述基因组的逆转录病毒颗粒是无复制能力的。然而,应当理解,在本文所提供的各方面中的任何方面的一些实施例中,可以使用具有复制能力的重组逆转录病毒颗粒。
[0250]
本领域技术人员将认识到本文所讨论的功能元件可以使用不同类型的载体,如表达载体,递送到包装细胞和/或t细胞。本发明的说明性方面利用逆转录病毒载体,并且在一些特别说明性的实施例中利用慢病毒载体。其它合适的表达载体可以用于实现本文中的某些实施例。此类表达载体包含但不限于病毒载体(例如,基于牛痘病毒的病毒载体;脊髓灰质炎病毒;腺病毒(参见例如,li等人,《眼科学和视觉科学研究(invest opthalmol vis sci)》35:25432549,1994;borras等人,《基因疗法》6:515524,1999;li和davidson,《美国国家科学院院刊(pnas)》92:77007704,1995;sakamoto等人,《人基因疗法》5:10881097,1999;wo 94/12649、wo 93/03769;wo 93/19191;wo 94/28938;wo 95/11984和wo 95/00655);腺相关病毒(参见例如,ali等人,《人基因疗法》9:8186,1998,flannery等人,《美国国家科学院院刊》94:69166921,1997;bennett等人,《眼科学和视觉科学研究》38:28572863,1997;jomary等人,《基因疗法》4:683690,1997,rolling等人,《人基因疗法》10:641648,1999;ali等人,《人分子基因学(hum mol genet)》5:591594,1996;srivastava的wo 93/09239,
samulski等人,《病毒学杂志(j.vir.)》(1989)63:3822-3828;mendelson等人,《病毒学(virol.)》(1988)166:154-165;以及flotte等人,《美国国家科学院院刊》(1993)90:10613-10617);sv40;单纯性疱疹病毒;或者逆转录病毒载体(例如,小鼠白血病病毒、脾坏死病毒,以及源自如劳斯肉瘤病毒、哈维肉瘤病毒、禽白血病病毒、人类免疫缺陷病毒、骨髓增殖性肉瘤病毒和乳腺肿瘤病毒等逆转录病毒的载体),例如γ逆转录病毒;或者人类免疫缺陷病毒(参见例如,miyoshi等人,《美国国家科学院院刊》94:1031923,1997;takahashi等人,《病毒学杂志》73:78127816,1999);等等。
[0251]
如本文所公开的,无复制能力的重组逆转录病毒颗粒是用于基因递送的常用工具(miller,《自然》(1992)357:455-460)。无复制能力的重组逆转录病毒颗粒将未重排的核酸序列递送到广泛的啮齿动物、灵长类动物和人类体细胞中的能力使得无复制能力的重组逆转录病毒颗粒非常适合将基因转移到细胞中。在一些实施例中,无复制能力的重组逆转录病毒颗粒可以源自α逆转录病毒属、β逆转录病毒属、γ逆转录病毒属、δ逆转录病毒属、ε逆转录病毒属、慢病毒属或泡沫病毒属。存在许多逆转录病毒适于在本文所公开的方法中使用。例如,可以使用小鼠白血病病毒(mlv)、人类免疫缺陷病毒(hiv)、马传染性贫血病毒(eiav)、小鼠乳腺肿瘤病毒(mmtv)、劳斯肉瘤病毒(rsv)、弗吉纳米肿瘤病毒(fusv)、莫洛尼鼠白血病病毒(mo-mlv)、fbr鼠骨肉瘤病毒(fbr msv)、莫洛尼鼠肉瘤病毒(mo-msv)、艾贝尔森鼠白血病病毒(a-mlv)、禽骨髓细胞瘤病毒29(mc29)和禽成红细胞病毒(aev)。逆转录病毒的详细列表可以在coffin等人中找到(“逆转录病毒”1997冷泉港实验室出版社(cold spring harbor laboratory press)编辑:j m coffin、s m hughes、h e varmus第758-763页)。一些逆转录病毒的基因组结构的细节可以在本领域中找到。通过举例的方式,可以从ncbi genbank中找到有关hiv的详情(即基因组登录号af033819)。
[0252]
在说明性实施例中,无复制能力的重组逆转录病毒颗粒可以源自慢病毒属。在一些实施例中,无复制能力的重组逆转录病毒颗粒可以源自hiv、siv或fiv。在另外的说明性实施例中,无复制能力的重组逆转录病毒颗粒可以源自慢病毒属中的人类免疫缺陷病毒(hiv)。慢病毒是复杂的逆转录病毒,除了常见的逆转录病毒基因gag、pol和env外,还含有具有调节或结构功能的其它基因。较高的复杂性使慢病毒能够调节其生命周期,就像在潜伏感染过程中一样。典型的慢病毒是人类免疫缺陷病毒(hiv),aids的病原体。在体内,hiv可以感染很少分裂的终末分化细胞,如淋巴细胞和巨噬细胞。
[0253]
在一些实施例中,利用含dna的病毒颗粒代替重组逆转录病毒颗粒。此类病毒颗粒可以是腺病毒、腺相关病毒、疱疹病毒、巨细胞病毒、痘病毒、禽痘病毒、流感病毒、水疱性口炎病毒(vsv)或辛德毕斯病毒。技术人员将理解如何修改本文公开的方法以用于不同的病毒和逆转录病毒或逆转录病毒颗粒。在使用包含dna基因组的病毒颗粒的情况下,熟练的技术人员将理解,功能单元可以包含在此类基因组中,以诱导病毒颗粒的全部或部分dna基因组整合到用此类病毒转导的t细胞的基因组中。
[0254]
在一些实施例中,hiv rre和编码hiv rev的多核苷酸区可以被n端rgg盒rna结合基序和编码icp27的多核苷酸区替代。在一些实施例中,编码hiv rev的多核苷酸区可以被一个或多个编码腺病毒e1b 55-kda和e4 orf6的多核苷酸区替代。
[0255]
一方面,本文提供了一种容器,如商业容器或包装,或包括所述商业容器或包装的试剂盒,所述容器包括根据本文所提供的任何无复制能力的重组逆转录病毒颗粒方面的分
离的无复制能力的重组逆转录病毒颗粒。此外,另一方面,本文提供了一种容器,如商业容器或包装,或包括所述商业容器或包装的试剂盒,所述容器包括分离的包装细胞,在说明性实施例中,根据本文所提供的任何包装细胞和/或包装细胞系方面的包装细胞系的分离的包装细胞。在一些实施例中,所述试剂盒包含另外的容器,所述另外的容器包含另外的试剂,如本文所提供的方法中使用的缓冲液或试剂。此外,本文在某些方面提供了本文在任何方面提供的任何无复制能力的重组逆转录病毒颗粒在制造根据本文所提供的任何方面的用于基因修饰t细胞或nk细胞的试剂盒中的用途。此外,本文在某些方面提供了本文在任何方面提供的任何包装细胞或包装细胞系在制备用于产生根据本文所提供的任何方面的无复制能力的重组逆转录病毒颗粒的试剂盒中的用途。
[0256]
一方面,本文提供了一种商业容器,其含有无复制能力的重组逆转录病毒颗粒和用于使用其治疗受试者的肿瘤生长的说明书,其中所述无复制能力的重组逆转录病毒颗粒具有编码本文所提供的任何抗her2 car的基因组。因此,重组逆转录病毒颗粒可以在其基因组中包括多核苷酸,所述多核苷酸包括编码本文所提供的抗her2 car的与在t细胞和/或nk细胞中具有活性的启动子可操作地连接的一个或多个核酸序列。通常,一个或多个核酸序列中的核酸序列编码本文所提供的抗her2嵌合抗原受体(car),所述抗her2 car包括能够结合her2的抗原特异性靶向区(astr)、跨膜结构域和细胞内激活结构域。
[0257]
含有重组逆转录病毒颗粒的容器可以是管、小瓶、板的孔或用于储存重组逆转录病毒颗粒的其它容器。所述试剂盒可以包含两个或更多个容器,其中第二容器或其它容器可以包含例如用于转导t细胞和/或nk细胞的溶液或培养基,和/或第二容器或其它容器可以包含调节ph的药理学药剂。这些容器中的任一个容器都可以具有工业强度和等级。
[0258]
另一方面,本文提供了一种用于治疗或预防癌症或肿瘤生长的药物组合物,所述药物组合物包括无复制能力的重组逆转录病毒颗粒作为活性成分。另一方面,本文提供了一种用于治疗或预防癌症或肿瘤生长的输注组合物或其它递送溶液,所述输注组合物或其它递送溶液包括无复制能力的重组逆转录病毒颗粒。药物组合物或输注组合物的无复制能力的重组逆转录病毒颗粒可以包含上文或本文别处所讨论的任何方面、实施例或子实施例。
[0259]
一方面,本文提供了一种容器,如商业容器或包装,或包括所述商业容器或包装的试剂盒,所述容器包括分离的核酸,在说明性实施例中,根据本文所提供的任何无复制能力的重组逆转录病毒颗粒方面和实施例的逆转录病毒颗粒。逆转录病毒颗粒可以在其基因组中包括多核苷酸,所述多核苷酸包括与在t细胞和/或nk细胞中具有活性的启动子可操作地连接的一个或多个核酸序列。在一些实施例中,一个或多个核酸序列中的核酸序列可以编码本文所提供的抗her2 cab car,所述抗her2 cab car包括抗原特异性靶向区(astr)、跨膜结构域和细胞内激活结构域。
[0260]
含有分离的核酸,在说明性实施例中,在任何方面或实施例中的重组逆转录病毒颗粒的容器,包含商业容器,所述商业容器可以是试剂盒的组件,可以是管、小瓶、板的孔或用于用于储存核酸,如但不限于逆转录病毒颗粒的其它容器。事实上,本文所提供的一些方面包括包含逆转录病毒颗粒的容器,其中此类逆转录病毒颗粒包含本文所公开的任何核酸或其它组分。说明性实施例中的此类容器包含基本上纯的无复制能力的重组逆转录病毒颗粒,在本文中有时被简称为基本上纯的逆转录病毒颗粒。通常,根据标准方案,基本上纯的
逆转录病毒颗粒的制剂和/或容器是无菌的,并且对于支原体、相同类型的具有复制能力的逆转录病毒和外来病毒是阴性的(参见例如,“病毒载体表征:分析工具概览(viral vector characterization:a look atanalytical tools)”;2018年10月10日(可在https://cellculturedish.com/viral-vector-characterization-analytical-tools/处获得))。用于产生基本上纯的逆转录病毒颗粒的示例性方法可以通过深度过滤、tff、苯甲酶处理、渗滤和调配中的一种或多种或全部的组合来纯化。此类示例性方法可以用于产生不含非人动物蛋白的基本上纯的病毒颗粒。在某些说明性实施例中,基于质量控制测试结果,基本上纯的逆转录病毒颗粒满足以下所有特性:
[0261]
a.对于支原体是阴性的;
[0262]
b.内毒素低于25eu/ml,并且在某些另外的说明性实施例中,低于10eu/ml;
[0263]
c.没有在容器中检测到与故意在容器中检测到的具有复制能力的逆转录病毒(例如,慢病毒)相同的类型;
[0264]
d.没有检测到外来病毒;
[0265]
e.小于1pg宿主细胞dna/病毒tu,并且在某些另外的说明性实施例中,小于0.3pg/tu;
[0266]
f.小于100个残留质粒拷贝/病毒tu,并且在某些另外的说明性实施例中,小于10个拷贝/病毒tu的用于制备重组逆转录病毒颗粒的任何质粒。
[0267]
g.小于1ng hek蛋白/tu,并且在某些另外的说明性实施例中,小于50pg hek蛋白/tu。
[0268]
h.大于100tu/ng p24蛋白,并且在某些另外的说明性实施例中,大于10,000tu/ng p24蛋白。
[0269]
逆转录病毒颗粒在发布给客户之前,通常会根据包含上文所提供的部分或全部内容的发布规范进行测试。每个颗粒的效力可以基于通过elisa确定的p24病毒衣壳蛋白,通过q-rt pcr确定的病毒rna基因组拷贝,通过基于qpcr的产物增强rt(pert)测定测量逆转录酶活性来定义,但都可以通过在生物测定中测量功能性基因转移转导单位(tu)而转换为感染滴度。
[0270]
通过生物测定和qpcr确定纯化的散装逆转录病毒材料和成品的感染滴度是用于确定逆转录病毒的感染滴度的示例性分析测试方法。指示细胞库(如f1xt)可以在例如无血清培养基中生长,以每孔150,000个细胞接种,然后暴露于逆转录病毒产品的系列稀释液。在指示细胞上稀释纯化的逆转录病毒颗粒,例如从1∶200到1∶1,600。可以添加参考标准病毒用于系统适用性。与逆转录病毒一起温育4天后,采集细胞,进行dna提取和纯化。使用人类基因组和独特的逆转录病毒基因组序列质粒pdna扩增子的标准曲线,例如100-10,000,000个拷贝/孔,然后添加暴露于逆转录病毒颗粒的细胞样品的基因组dna。对于每个pcr反应,逆转录病毒扩增子和内源性对照(如hrnasep)两者的cq值都外推回到每个反应的拷贝数。从这些值计算整合基因组拷贝数。在一些情况下,指示细胞如293t已被表征为三倍体,因此在计算中应利用每个细胞的单拷贝基因的3个拷贝。使用每孔的初始活细胞计数,可以确定添加到细胞中的逆转录病毒的体积和基因组拷贝数比率,即每ml逆转录病毒颗粒的转导单位(tu)。
[0271]
效力测试可以包含针对具有纯度和特异性活性的释放规格的效力测试。例如,最
终产品的效力释放测试可以包含测量与病毒颗粒量相比的转导单位(tu)的数量(例如,通过针对病毒蛋白进行elisa,例如针对慢病毒,通过执行p24衣壳蛋白elisa,其中截止值为至少100、1,000、2,000或2,500tu/ng p24)和car功能,例如通过测量由暴露于经基因修饰的细胞的报告细胞系释放的干扰素
γ
。
[0272]
在本文中的包含此类逆转录病毒颗粒的容器的任何试剂盒或分离的无复制能力的重组逆转录病毒颗粒方面中,容器中存在足够的重组逆转录病毒颗粒以在使用逆转录病毒颗粒制备的反应混合物中实现moi(每个细胞应用的转导单位或tu的数量)为介于0.1与50之间、0.5与50之间、0.5与20之间、0.5与10之间、1与25之间、1与15之间、1与10之间、1与5之间、2与15之间、2与10之间、2与7之间、2与3之间、3与10之间、3与15之间或5与15之间或至少0.1、0.5、1、2、2.5、3、5、10或15或实现moi为至少0.1、0.5、1、2、2.5、3、5、10或15。试剂盒中提供的病毒颗粒的转导单位应能够使用防止在单独细胞中产生过多整合体的moi,平均每个细胞基因组少于3个慢基因组拷贝,并且更优选地每个细胞1个拷贝。对于试剂盒和分离的逆转录病毒颗粒实施例,此类moi可以基于1、2.5、5、10、20、25、50、100、250、500或1,000ml的反应混合物,假设1
×
106个靶细胞/ml,例如在全血的情况下,假设1
×
106个pbmc/ml的血液。因此,逆转录病毒颗粒的容器可以包含1
×
105到1
×
109个、1
×
105到1
×
108个、1
×
105到5
×
107个、1
×
105到1
×
107个、1
×
105到1
×
106个;5
×
105到1
×
109个;5
×
105到1
×
108个、5
×
105到5
×
107个、5
×
105到1
×
107个、5
×
105到1
×
106个或1
×
107到1
×
109个、1
×
107到5
×
107个、1
×
106到1
×
107个和1
×
106到5
×
106个tu。在某些说明性实施例中,容器可以含有1
×
107到1
×
109个、5
×
106到1
×
108个、1
×
106到5
×
107个、1
×
106到5
×
106个或5
×
107到1
×
108个逆转录病毒转导单位。不受理论限制,此类数量的颗粒将支持1到100ml的moi为介于1与10之间的血液。
[0273]
含有逆转录病毒颗粒的每个容器的体积可以例如介于0.05ml与5ml之间、介于0.05ml与1ml之间、介于0.05ml与0.5ml之间、介于0.1ml与5ml之间、介于0.1ml与1ml之间、介于0.1ml与0.5ml之间、介于0.1与10ml之间、介于0.5与10ml之间、介于0.5ml与5ml之间、介于0.5ml与1ml之间、介于1.0ml与10.0ml之间、介于1.0ml与5.0ml之间、介于10ml与100ml之间、介于1ml与20ml之间、介于1ml与10ml之间、介于1ml与5ml之间、介于1ml与2ml之间、介于2ml与20ml之间、介于2ml与10ml之间、介于2ml与5ml之间、0.25ml到10ml、0.25到5ml或0.25到2ml。
[0274]
在某些实施例中,容器中的逆转录病毒颗粒是gmp级或cgmp级逆转录病毒颗粒(即,根据监管机构的gmp或当前gmp要求产生),或使用gmp系统执行的逆转录病毒制造过程的产品。此类逆转录病毒颗粒通常是使用美国fda(即,美国gmp或美国cgmp)、ema(即,ema gmp或ema cgmp)或中国国家药品监督管理局(nmpa)(即,中国fda)(即,nmpagmp或nmpa cgmp)良好生产规范(gmp),例如使用gmp质量系统和gmp程序控制制备的。这些产品通常在满足gmp或cgmp要求的设施中产生。此类产品通常在基于gmp或cgmp规定的严格质量管理体系下制造。gmp级逆转录病毒颗粒通常是无菌的。这可以例如通过用0.45um或0.22um过滤器过滤逆转录病毒颗粒,例如基本上纯的逆转录病毒颗粒来实现。gmp级逆转录病毒颗粒通常基本上是纯的,并且按照效力、质量和安全性的控制制造测试规范进行制备。
[0275]
在一些实施例中,容器中包括逆转录病毒颗粒的溶液不含可检测的牛蛋白,其可以被称为“不含牛的”。例如,此类逆转录病毒颗粒溶液可以是不含牛的,因为牛蛋白,如牛
血清蛋白,在逆转录病毒产生期间不用于培养包装细胞。在一些实施例中,逆转录病毒颗粒溶液为gmp级,并且是不含牛的。基本上纯的核酸溶液通常是不含牛的,并且在不含牛的肉汤中产生。
[0276]
在一些方面,本文提供了一种用于修饰nk细胞和/或在说明性实施例中t细胞的试剂盒。在某些实施例中,此类试剂盒包含一个或多个容器,所述一个或多个容器含有多核苷酸,通常是包括与在t细胞和/或nk细胞中具有活性的启动子可操作地连接的一个或多个第一转录单元的基本上纯的多核苷酸,其中所述一个或多个第一转录单元编码包括第一嵌合抗原受体(car)(有时被称为第一car)的第一多肽;以及附件组分(在本文中也被称为附件试剂盒组分)的一个或多个容器。多核苷酸(例如,逆转录病毒颗粒)可以冷冻储存,例如在-70℃或更低(例如,-80℃)下。
[0277]
逆转录病毒基因组大小
[0278]
在本文所提供的方法和组合物中,重组逆转录病毒基因组,在非限制性说明性实例中,慢病毒基因组,对可以包装到病毒颗粒中的多核苷酸的数量有限制。在本文所提供的一些实施例中,由多核苷酸编码区编码的多肽可以是保留功能活性的截短或其它缺失,使得多核苷酸编码区由比野生型多肽的多核苷酸编码区更少的核苷酸编码。在一些实施例中,由多核苷酸编码区编码的多肽可以是可以从一个启动子表达的融合多肽。在一些实施例中,融合多肽可以具有用于从一种融合多肽和一种启动子产生两种或更多种功能性多肽的切割信号。此外,初始离体转导之后不需要的一些功能不包含在逆转录病毒基因组中,而是通过包装细胞膜存在于无复制能力的重组逆转录病毒颗粒的表面上。这些不同的策略在本文中用于最大化包装在无复制能力的重组逆转录病毒颗粒内的功能元件。
[0279]
在一些实施例中,要包装的重组逆转录病毒基因组可以在范围的低端为1,000、2,000、3,000、4,000、5,000、6,000、7,000到8,000个核苷酸,并且在范围的高端为2,000、3,000、4,000、5,000、6,000、7,000、8,000、9,000、10,000到11,000个核苷酸。要包装的逆转录病毒基因组包含一个或多个编码如本文详细公开的第一多肽和第二多肽的多核苷酸区。在一些实施例中,要包装的重组逆转录病毒基因组可以少于5,000、6,000、7,000、8,000、9,000、10,000或11,000个核苷酸。本文别处所讨论的可以包装的功能包含逆转录病毒组装和包装所需的逆转录病毒序列,如逆转录病毒rev、gag和pol编码区,以及5
′
ltr和3
′
ltr,或其活性截短片段,编码逆转录病毒顺式作用rna包装元件和cppt/cts元件的核酸序列。
[0280]
组合
[0281]
在一些实施例中,由无复制能力的重组逆转录病毒颗粒提供的多核苷酸具有编码一个或多个car的某些组合的一个或多个转录单元。在本文所提供的一些方法和组合物中,经基因修饰的t细胞包含在t细胞通过无复制能力的重组逆转录病毒颗粒转导之后的一个或多个car的组合。应当理解,提及第一多肽、第二多肽、第三多肽等是为了方便,并且“第一多肽”上的元件和“第二多肽”上的元件意指元件位于不同的多肽上,所述多肽被称为第一或第二仅用于参考和惯例,通常在所述特定多肽的另外的元件或步骤中。
[0282]
在一个实施例中,一个或多个car在t细胞特异性启动子或同一转录物下的通用启动子下表达,其中在转录物中,编码car的核酸被编码一个或多个内部核糖体进入位点(ire)或一种或多种蛋白酶切割肽的核酸分开。
[0283]
在某些实施例中,所述多核苷酸编码两个car,其中第一car包含能够与第一抗原
结合的第一胞外抗原结合结构域和第一细胞内信号结构域(例如,cd3ζ信号结构域)但不包含共刺激结构域(例如,cd27、cd28、ox40、icos和4-1bb),并且第二多肽包含第二胞外抗原结合结构域和第二细胞内信号传导结构域,如例如共刺激分子的信号传导结构域。在某个实施例中,第一或第二抗原是her2并且其它抗原是psca、psma、bcma、vegf。在某个实施例中,第一、第二或两个胞外抗原结合结构域包括抗体或其片段(例如,scfv),例如与psca、psma或bcma具有特异性的抗体或其片段。在某个实施例中,第一或第二胞外抗原结合结构域是受体,例如vegf的受体,即vegfr。
[0284]
另外的序列
[0285]
car可以进一步包含一个或多个另外的多肽结构域,其中此类结构域包含但不限于信号序列;表位标签;亲和结构域;以及可以检测到其存在或活性的多肽(可检测标志物),例如通过抗体测定或因为它是产生可检测信号的多肽。用于本文所提供的任何方面或实施例的另外的结构域的非限制性实例包含与如下文所描述的以下序列中的任何序列具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域:产生可检测信号的信号序列、表位标签、亲和结构域或多肽。
[0286]
适用于主题car的信号序列,例如,在主题car的第一多肽中,包含任何真核信号序列,包含天然存在的信号序列、合成的(例如,人造的)信号序列等。在一些实施例中,例如信号序列可以是cd8信号序列(seq id no:72)。
[0287]
合适的表位标签包含但不限于血凝素(ha;例如ypydvpdya;seq id no:73);flag(例如,dykddddk;seq id no:74);c-myc(例如,eqkliseedl;seq id no:75)等。
[0288]
亲和结构域包含可以与可用于鉴定或纯化的结合配偶体(例如,如固定在固体支持物上的结合配偶体)相互作用的肽序列。当与表达的蛋白质融合时,编码多个连续单氨基酸(如组氨酸)的dna序列可以用于通过与树脂柱(如镍琼脂糖凝胶)的高亲和力结合来一步纯化重组蛋白。示例性亲和结构域包含his5(hhhhh;seq id no:76)、hisx6(hhhhhh;seq id no:77)、c-myc(eqkliseedl;seq id no:75)、flag(dykddddk;seq id no:74)、strep标签(wshpqfek;seq id no:78)、血凝素例如ha标签(ypydvpdya;seq id no:73)、gst、硫氧还蛋白、纤维素结合结构域、ryirs(seq id no:79)、phe-his-his-thr(seq id no:80)、甲壳素结合结构域、s肽、t7肽、shcdr2结构域、c端rna标签、weaaareaccreccara(seq id no:81)、金属结合结构域,例如锌结合结构域或钙结合结构域,如来自钙结合蛋白的那些,例如钙调蛋白、肌钙蛋白c、钙调神经磷酸酶b、肌球蛋白轻链、恢复素、s-调节蛋白、视锥蛋白、vilip、神经钙素、海马钙素、聚集蛋白、钙蛋白、钙蛋白酶大亚基、s100蛋白、小白蛋白、钙结合蛋白d9k、钙结合蛋白d28k和钙调蛋白、内含肽、生物素、链霉亲和素、myod、id、亮氨酸拉链序列和麦芽糖结合蛋白。
[0289]
合适的可检测信号产生蛋白包含例如荧光蛋白;催化产生可检测信号作为产物的反应的酶;等等。
[0290]
合适的荧光蛋白包含但不限于绿色荧光蛋白(gfp)或其变体、gfp的蓝色荧光变体(bfp)、gfp的青色荧光变体(cfp)、gfp的黄色荧光变体(yfp)、增强的gfp(egfp)、增强型cfp(ecfp)、增强型yfp(eyfp)、gfps65t、祖母绿、黄玉(tyfp)、venus、柠檬黄、mcitrine、gfpuv、去稳定化egfp(degfp)、去稳定化ecfp(decfp)、去稳定化eyfp(deyfp)、mcfpm、天蓝色、t-天蓝色、cypet、ypet、mko、hcred、t-hcred、dsred、dsred2、dsred-单体、j-red、二聚体2、t-二
聚体2(12)、mrfpl、pocilloporin、海肾gfp、怪物gfp、pagfp、kaede蛋白和点燃蛋白、藻胆蛋白和藻胆蛋白结合物,包含b-藻红蛋白、r-藻红蛋白和别藻蓝蛋白。荧光蛋白的其它实例包含mhoneydew、mbanana、morange、dtomato、tdtomato、mtangerine、mstrawberry、mcherry、mgrapel、mraspberry、mgrape2、mplum(shaner等人(2005)《自然方法(nat.methods)》2:905-909)等。来自珊瑚虫物种的各种荧光蛋白和有色蛋白中的任一种,如例如matz等人(1999)《自然生物技术(nature biotechnol.)》17:969-973中所描述的,适于使用。
[0291]
合适的酶包含但不限于辣根过氧化物酶(hrp)、碱性磷酸酶(ap)、β-半乳糖苷酶(gal)、葡萄糖-6-磷酸脱氢酶、β-n-乙酰氨基葡萄糖苷酶、β-葡糖苷酸酶、转化酶、黄嘌呤氧化酶、萤火虫萤光素酶、葡萄糖氧化酶(go)等。
[0292]
识别和/或消除结构域
[0293]
本文所提供的任何无复制能力的重组逆转录病毒颗粒可以包含编码识别或消除结构域的核酸,作为编码本文所提供的任何car的核酸的一部分或与其分开。因此,本文所提供的任何car可以包含识别或消除结构域。识别或消除结构域在t细胞和/或nk细胞上表达,但在无复制能力的重组逆转录病毒颗粒上不表达。
[0294]
在一些实施例中,识别或消除结构域可以源自单纯疱疹病毒衍生的酶胸苷激酶(hsv-tk)或诱导型胱天蛋白酶-9。在一些实施例中,识别或消除结构域可以包含经修饰的内源性细胞表面分子,例如美国专利8,802,374中所公开的。经修饰的内源性细胞表面分子可以是被修饰的任何细胞表面相关受体、配体、糖蛋白、细胞粘附分子、抗原、整合素或分化簇(cd)。在一些实施例中,经修饰的内源性细胞表面分子是截短的酪氨酸激酶受体。一方面,截短的酪氨酸激酶受体是表皮生长因子受体(egfr)家族的成员(例如,erbb1、erbb2、erbb3和erbb4)。在一些实施例中,识别结构域可以是被识别egfr成员的胞外结构域的抗体识别的多肽。在一些实施例中,识别结构域可以是egfr家族成员的至少20个连续氨基酸,或例如,egfr家族成员的20到50个连续氨基酸。例如,seq id no:82是被识别egfr成员的胞外结构域的抗体识别并在适当条件下被抗体结合的示例性多肽。此类胞外egfr表位在本文中有时被称为etag。在说明性实施例中,此类表位被可商购获得的抗egfr单克隆抗体识别。
[0295]
表皮生长因子受体,也被称为egfr、erbb1和her1,是胞外配体的表皮生长因子家族的成员的细胞表面受体。egfr活性的变更与某些癌症有关。在一些实施例中,编码包含人表皮生长因子受体(egfr)的egfr多肽的基因是通过去除编码包含膜远侧egf结合结构域和细胞质信号传导尾部的多肽的核酸序列而构建的,但保留了由抗egfr抗体识别的胞外膜近侧表位。优选地,抗体是已知的、可商购获得的抗egfr单克隆抗体,如西妥昔单抗(cetuximab)、马妥珠单抗(matuzumab)、耐昔妥珠单抗(necitumumab)或帕尼单抗(panitumumab)。
[0296]
其它已经表明,将生物素化西妥昔单抗与抗生物素微珠组合应用于免疫磁性选择,成功地将已经用含egfrt的构建体进行慢病毒转导的t细胞从低至2%的群体中富集到大于90%的纯度,而没有观察到对细胞制剂的毒性。此外,其它已经表明,这种惰性egfr分子的组成型表达不会影响t细胞表型或效应功能,如协同表达的嵌合抗原受体(car)cd19r所指示的那样。另外,其它已经表明,通过流式细胞术分析,egfr被成功地用作小鼠的t细胞植入的体内跟踪标志物。此外,通过介导的抗体依赖性细胞毒性(adcc)途径,egfr被证明具有自杀基因潜力。本公开的发明人已经使用慢病毒载体成功地在pbmc中表达
etag,并且发现通过暴露于西妥昔单抗的pbmc在体外表达etag,为pbmc提供了有效的消除机制。因此,egfr可以用作具有免疫治疗潜力的经转导的t细胞的非免疫原性选择工具、跟踪标志物和自杀基因。egfr核酸也可以通过本领域熟知的方法检测。
[0297]
在本文所提供的一些实施例中,egfr被表达为单个多肽的一部分,所述多肽也包含car。在一些实施例中,编码egfr识别结构域的氨基酸序列可以通过切割信号和/或核糖体跳跃序列与编码嵌合抗原受体的氨基酸序列分开。核糖体跳跃和/或切割信号可以是本领域已知的任何核糖体跳跃和/或切割信号。不受理论限制,核糖体跳跃序列可以是例如t2a(本文中也被称为2a-1)(seq id no:83)。不受理论限制,切割信号和核糖体跳跃序列的其它实例包含fmdv 2a(f2a);马鼻炎a病毒2a(缩写e2a);猪捷申病毒-12a(p2a);以及褐翅蛾病毒2a(t2a)。在一些实施例中,编码识别结构域的多核苷酸序列可以与car在同一转录物上,但通过内部核糖体进入位点与编码car的多核苷酸序列分开。
[0298]
在如本文经验例示的其它实施例中,识别结构域可以表达为融合多肽的一部分。与单独的多肽相比,此类构建体提供了在rna基因组上占据更少基因组空间的优势,尤其是与本文所提供的其它“节省空间”元件组合。
[0299]
序列重组
[0300]
在某些情况下,可以通过使用位点特异性重组技术在细胞中重排或缺失car的多肽序列,例如car结构域。在某些实施例中,对特定car的细胞激活相关应答可以通过位点特异性重组来改变,例如,引发第一次激活相关应答的car的第一细胞内激活结构域可以交换为引发第二激活相关应答的第二细胞内激活结构域。如本领域技术人员将清楚的,位点特异性重组可以用于细胞中以将car的任何结构域或序列与如本文所公开的任何其它结构域或序列交换。如本领域技术人员也将清楚的,位点特异性重组可以用于细胞中以缺失car的任何结构域或序列。此类序列和结构域的交换和切除是本领域已知的,参见例如,如以下中所描述的信号体中的结构域切换:tone等人(2013)《生物技术与生物工程(biotechnology and bioengineering)》,3219-3226,所述文献的公开内容通过引用并入本文中。在体内进行位点特异性重组的机制和要求也是本领域众所周知的,参见例如,grindley等人(2006)《生物化学年度评论(annual review of biochemistry)》,567-605和tropp(2012)《分子生物学(molecular biology)》(马萨诸塞州萨德伯里琼斯和巴特利特出版社(jones&bartlett publishers,sudbury,ma)),所述文献的公开内容通过引用并入本文中。
[0301]
car是通过将上文所讨论的所有不同结构域融合在一起形成融合蛋白而产生的嵌合蛋白。car通常由包括编码如本文所讨论的car的不同结构域的多核苷酸序列的表达载体产生。本发明的用于识别靶细胞上的抗原和与所述抗原结合的astr是条件活性的。具体地,与对应的野生型蛋白质的astr相比,astr在正常生理条件下与靶抗原结合的活性小或无活性,并且在肿瘤条件下有活性。
[0302]
肿瘤微环境
[0303]
实体瘤中的癌细胞能够在其周围形成肿瘤微环境(tme),以支持癌细胞的生长和转移。tme是肿瘤存在的细胞环境,包含周围的血管、免疫细胞、成纤维细胞、其它细胞、可溶性因子、信号传导分子、胞外基质以及可以促进肿瘤转化、支持肿瘤生长和侵袭、保护肿瘤免于宿主免疫、培养治疗抵抗力并且为休眠的转移瘤提供繁衍生态位的机械线索。肿瘤和其周围微环境是密切相关的并不断相互作用。肿瘤可以通过释放细胞外信号、促进肿瘤血
管生成以及诱导外周免疫耐性来影响其微环境,而微环境中的免疫细胞可以影响癌细胞的生长和进化。参见swarts等人“肿瘤微环境复杂性:癌症疗法中的新兴角色(tumor microenvironment complexity:emerging roles in cancer therapy)”,《癌症研究(cancer res)》,第72卷,第2473-2480页,2012。
[0304]
tme经常缺氧。随着肿瘤质量增加,肿瘤内部会越来越远离现有的血液供应,这导致难以向tme充分供应氧气。与血浆中的氧分压为约40mm hg相比,在超过50%的局部晚期实体瘤中,肿瘤环境中的氧分压低于5mm hg。相比之下,身体其它部位不缺氧。缺氧环境通过下调核苷酸切除修复和错配修复途径导致基因不稳定性,这与癌症进展相关。缺氧还会使缺氧诱导因子iα(hif1-α)上调,从而诱导血管生成,并且与较差的预后和与转移相关的基因的激活相关。参见weber等人,“肿瘤微环境”,《外科肿瘤学(surgical oncology)》,第21卷,第172-177页,2012和blagosklonny,“抗血管生成治疗和肿瘤进展(antiangiogenic therapy and tumor progression)”,《癌细胞(cancer cell)》,第5卷,第13-17页,2004。
[0305]
另外,肿瘤细胞倾向于依赖乳酸发酵产生的能量,所述乳酸发酵不需要氧气。因此,肿瘤细胞不太可能使用需要氧气的正常有氧呼吸。使用乳酸发酵的结果是tme是酸性的(ph 6.5-6.9),而身体的其它部位通常是中性或微碱性的。例如,人血浆的ph为约7.4。参见estrella等人,“由肿瘤微环境产生的酸度驱动局部侵入(acidity generated by the tumor microenvironment drives local invasion)”,《癌症研究(cancer research)》,第73卷,第1524-1535页,2013。与定位于身体其它部位的细胞相比,由于增殖的癌细胞对营养的需求相对较高,tme中的营养可用性也很低。
[0306]
进一步地,tme还含有许多在身体其它部位不常见的不同细胞类型。这些细胞类型包含内皮细胞和其前体、周细胞、平滑肌细胞、成纤维细胞、癌相关成纤维细胞、肌成纤维细胞、中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、肥大细胞、t淋巴细胞和b淋巴细胞、自然杀伤细胞和抗原呈递细胞(apc),如巨噬细胞和树突状细胞(lorusso等人,“肿瘤微环境和其对肿瘤向转移进化的贡献(the tumor microenvironment and its contribution to tumor evolution toward metastasis)”,《组织化学:细胞生物学(histochem cell biol)》,第130卷,第1091-1103页,2008)。
[0307]
因此,tme具有至少若干种不同于身体其它部位的生理条件,如血浆中的生理条件。tme的ph(酸性)低于身体其它部位,尤其是血浆(ph 7.4)。tme的氧气浓度低于身体其它部位,如血浆。此外,tme的营养可用性低于身体其它部位,尤其是血浆。tme还具有一些在身体其它部位尤其是血浆中不常见的独特细胞类型。
[0308]
在说明性实施例中,本发明的car包含从野生型生物(即天然)蛋白质产生的条件活性astr,如从哺乳动物生物体(例如小鼠或人)分离的例如可以是用于肿瘤治疗的候选物的野生型或天然抗体。在此类说明性实施例中,条件活性astr在至少一种生理条件下在tme以外的身体部位(如血浆)中具有比天然或野生型生物蛋白质低的活性,而在tme中的至少一种生理条件下,它比天然或野生型生物蛋白具有更高的活性。此类条件活性的天然或生物蛋白质可以优先作用于tme中的癌细胞以治疗肿瘤,并且因此不太可能引起副作用。在其中天然或生物蛋白质是针对其中抗原暴露于tme的肿瘤细胞的表面上的抗原的抗体的实施例中,条件活性抗体对抗原的亲和力低于身体其它部位例如非tme中的天然或野生型抗体,而它对抗原的亲和力高于tme中的天然或野生型抗体。此类条件活性抗体可以与身体其它
部位中的抗原结合较弱或完全不结合,但与tme中的抗原结合更强,或与抗原强而紧密地结合。
[0309]
假型化元件
[0310]
本文提供的许多方法和组合物包含假型元件。具有异源包膜糖蛋白的无复制能力的重组逆转录病毒颗粒的假型化通常会改变病毒的嗜性并且促进宿主细胞的转导。如本文所用的假型化元件可以包含鉴定和结合靶宿主细胞的包含一种或多种多肽,通常是糖蛋白的“结合多肽”和一种或多种介导逆转录病毒和靶宿主细胞膜的融合由此允许逆转录病毒基因组进入到靶宿主细胞中的“融合多肽”。在本文所提供的一些实施例中,假型化元件以多肽/蛋白质的形式或以编码多肽/蛋白质的核酸序列的形式提供。
[0311]
在一些实施例中,假型化元件是猫内源性病毒(rd114)包膜蛋白、癌病毒性两性包膜蛋白、癌病毒性嗜性包膜蛋白、水疱性口炎病毒包膜蛋白(vsv-g)(seq id no:85)、狒狒逆转录病毒包膜糖蛋白(baev)(seq id no:86)、鼠白血病包膜蛋白(mulv)(seq id no:87)、流感糖蛋白ha表面糖蛋白(ha)、流感糖蛋白神经氨酸酶(na)、副粘病毒麻疹包膜蛋白h,副粘病毒麻疹包膜蛋白f和/或这些包膜蛋白中的任何包膜蛋白的功能变体或片段。
[0312]
包装细胞系/制备重组逆转录病毒颗粒的方法
[0313]
本公开提供了哺乳动物包装细胞和包装细胞系,所述包装细胞系产生无复制能力的重组逆转录病毒颗粒。产生无复制能力的重组逆转录病毒颗粒的细胞系在本文中也被称为包装细胞系。
[0314]
本文提供了用于制备逆转录病毒颗粒的示例性方法,例如本文的实例部分。此类方法包含,例如,4质粒包装系统。在说明性实施例中,4质粒包装系统包含编码(i)gag/pol,(ii)rev和(iii)假型化元件(如vsv-g)的3种包装质粒。4质粒包装的第4个质粒是基因组质粒。在另外的说明性实施例中,基因组质粒是第三代慢病毒表达载体,其3
′
ltr缺失导致自失活。
[0315]
包装细胞系的细胞可以是贴壁细胞或悬浮细胞。下文提供了示例性细胞类型。在说明性实施例中,包装细胞系可以是悬浮细胞系,即在生长期间不粘附于表面的细胞系。细胞可以在化学定义的培养基和/或无血清培养基中生长。在一些实施例中,包装细胞系可以是源自贴壁细胞系的悬浮细胞系,例如,可以根据本领域已知的方法使hek293细胞系在产生悬浮适应的hek293细胞系的条件下生长。包装细胞系通常在化学定义的培养基中生长。在一些实施例中,包装细胞系培养基可以包含血清。在一些实施例中,如本领域已知的,包装细胞系培养基可以包含血清替代物。在说明性实施例中,包装细胞系培养基可以是无血清培养基。此类培养基可以是按照美国食品和药物管理局(fda)的现行良好生产规范(cgmp)规定制造的化学定义的无血清调配物。包装细胞系培养基可以是无异源的且完整的。在一些实施例中,包装细胞系培养基已被监管机构批准用于离体细胞处理,如fda 510(k)批准的装置。
[0316]
因此,一方面,本文提供了一种制备无复制能力的重组逆转录病毒颗粒的方法,所述方法包含:a.在无血清培养基中悬浮培养包装细胞,其中所述包装细胞包括编码所述无复制能力的逆转录病毒颗粒的可包装rna基因组、rev蛋白、gag多肽、pol多肽和假型化元件的核酸序列;以及b.从无血清培养基中采集所述无复制能力的重组逆转录病毒颗粒。
[0317]
在一些实施例中,多肽可以包含car,并且所述核酸序列可以编码本文所提供的任
何car实施例。例如,多肽可以包含第一抗原特异性靶向区、第一跨膜结构域和第一细胞内激活结构域。抗原特异性靶向区、跨膜结构域和细胞内激活结构域的实例在本文别处公开。在一些实施例中,可包装rna基因组可以进一步包含编码第二多肽的核酸序列。在其中靶细胞是t细胞或nk细胞的一些实施例中,在靶细胞中具有活性的启动子在t细胞或nk细胞中具有活性,如本文别处所公开的。
[0318]
本公开的一些方面包含细胞或者是细胞,在说明性实例中,哺乳动物细胞,所述哺乳动物细胞被用作包装细胞以制备用于t细胞和/或nk细胞转导的无复制能力的重组逆转录病毒颗粒,如慢病毒。
[0319]
本公开的一些方面包含细胞或者是细胞,在说明性实例中,哺乳动物细胞,所述哺乳动物细胞被用作包装细胞以制备用于t细胞和/或nk细胞转导的病毒,如慢病毒。根据本发明,可以选择多种细胞中的任一种用于体外产生病毒或病毒颗粒,如假型化重组逆转录病毒颗粒。通常使用真核细胞,特别是哺乳动物细胞,包含人、猿、犬、猫、马和啮齿动物细胞。在说明性实例中,细胞是人细胞。在另外的说明性实施例中,细胞无限繁殖,并且因此是永生的。可以有利地用于本发明的细胞的实例包含nih 3t3细胞、cos细胞、马丁-达比犬肾细胞(madin-darby canine kidney cell)、人胚胎293t细胞和源自此类细胞的任何细胞,如源自293t细胞的gpnlslacz细胞。可以使用高度可转染的细胞,如人胚肾293t细胞。“高度可转染”意指至少约50%、更优选地至少约70%和最优选地至少约80%的细胞可以表达引入的dna的基因。
[0320]
合适的哺乳动物细胞包含原代细胞和永生化细胞系。合适的哺乳动物细胞系包含人细胞系、非人灵长类动物细胞系、啮齿动物(例如,小鼠、大鼠)细胞系等。合适的哺乳动物细胞系包含但不限于hela细胞(例如,美国典型培养物保藏中心(atcc)编号ccl-2)、cho细胞(例如,atcc编号crl9618、ccl61、crl9096)、293细胞(例如,atcc编号crl-1573)、vero细胞、nih 3t3细胞(例如,atcc编号crl-1658)、huh-7细胞、bhk细胞(例如,atcc编号ccllo)、pc12细胞(atcc编号crlcdr1721)、cos细胞、cos-7细胞(atcc编号crlcdr1651)、ratl细胞、小鼠l细胞(atcc编号ccli.3)、人胚胎肾(hek)细胞(atcc编号crlcdr1573)、hlhepg2细胞、hut-78、jurkat、hl-60、nk细胞系(例如,nkl、nk92和yts)等。
[0321]
经基因修饰的t细胞和nk细胞
[0322]
在本文中的方法和组合物的实施例中,产生了经基因修饰的淋巴细胞,其本身是本发明的单独方面。此类经基因修饰的淋巴细胞可以是经基因修饰和/或转导的淋巴细胞。一方面,本文提供的经基因修饰的t细胞或nk细胞是使用根据本文所提供的任何方面的用于基因修饰血液或其组分中的t细胞和/或nk细胞的方法制备的。例如,在一些实施例中,t细胞或nk细胞已被基因修饰以表达第一多肽。在说明性实施例中,第一多肽可以是包含与her2蛋白特异性结合的抗原特异性靶向区(astr)、跨膜结构域和细胞内激活结构域的car。在一些实施例中,t细胞或nk细胞可以进一步包含可以是car的第二多肽。在一些实施例中,t细胞或nk细胞可以进一步包含表面上的假型化元件。经基因修饰的t细胞或nk细胞的car和假型化元件可以包含本文所公开的任何方面、实施例或子实施例。
[0323]
在一些实施例中,经基因修饰的淋巴细胞是已被基因修饰以表达包括嵌合抗原受体的第一多肽的淋巴细胞,如t细胞或nk细胞,所述嵌合抗原受体包含与her2蛋白特异性结合的抗原特异性靶向区(astr)、跨膜结构域和细胞内激活结构域。在本文中的任何方面的
一些实施例中,nk细胞是nkt细胞。nkt细胞是表达cd3的t细胞子集,并且通常共表达αβt细胞受体,但也表达通常与nk细胞相关的各种分子标志物(如nk1.1或cd56)。
[0324]
本公开的经修饰的淋巴细胞具有异源核酸序列,所述异源核酸序列已通过重组dna方法引入到淋巴细胞中,所述方法通常是编码本文所提供的抗her2 car的核酸。例如,说明性实施例中的异源序列在本文所提供的用于转导淋巴细胞的方法期间被插入到淋巴细胞中。异源核酸存在于淋巴细胞内并且在一些实施例中整合到或不整合到经修饰淋巴细胞的基因组中。
[0325]
在说明性实施例中,异源核酸整合到经基因修饰的淋巴细胞的基因组中。在说明性实施例中,使用本文所提供的用于转导淋巴细胞的方法产生此类淋巴细胞,所述方法利用重组逆转录病毒颗粒。此类重组逆转录病毒颗粒可以包含编码嵌合抗原受体的多核苷酸,所述嵌合抗原受体通常至少包含抗原特异性靶向区(astr)、跨膜结构域和细胞内激活结构域。本文在本公开的其它部分中提供了无复制能力的重组逆转录病毒颗粒和在无复制能力的逆转录病毒颗粒的基因组中编码的多核苷酸的各个实施例,所述实施例可以用于产生本身形成本公开的另一方面的经基因修饰的淋巴细胞。
[0326]
例如,本公开的包含本文所提供的编码用于结合her2的car的核酸中的任何核酸的经基因修饰的淋巴细胞可以在体外分离。例如,此类淋巴细胞可以存在于如本文所提供的用于离体转导的培养基和其它溶液中。淋巴细胞可以以未经基因修饰的形式存在于通过本文所提供的方法从受试者中收集的血液中,并且然后在转导方法期间进行基因修饰。
[0327]
在一些方面,本文提供了递送悬浮液、细胞疗法悬浮液、输注悬浮液、细胞分散体或细胞悬浮液,其包括由悬浮在溶液如输注溶液中的经基因修饰的t细胞和/或nk细胞构成的群体,在说明性实施例中,冷冻保存的递送溶液或其它递送溶液,其中所述经基因修饰的t细胞和/或nk细胞包括编码用于结合本文所提供的her2的嵌合抗原受体(car)的核酸。在说明性实施例中,此类组合物包括用于将经基因修饰的t细胞和/或nk细胞递送到哺乳动物(例如,人)受试者的药物或生物级递送溶液,用于细胞疗法,通常是car-t疗法。在一些实施例中,递送悬浮液、细胞疗法悬浮液、输注悬浮液、细胞悬浮液或细胞分散体位于包括适于细胞递送的赋形剂的溶液中,并且在说明性实施例中是冷冻保存的。在一些实施例中,所述赋形剂包括以下中的一种或多种全部:葡萄糖、氯化钠、人白蛋白溶液、注射用葡聚糖40、二甲亚砜、葡萄糖酸钠、乙酸钠、氯化钾、氯化镁、n-乙酰色氨酸钠、辛酸钠、铝或已知浓度的用于细胞疗法悬浮液或分散体的水。在此类细胞悬浮液或相关组合物中使用的溶液通常包含基础培养基,如盐水或csb,以及任选地如本文所公开的冷冻保存剂。在一些实施例中,所述组合物可以包含如本文别处所公开的冷冻保存溶液。在说明性实施例中,冷冻保存溶液是作为冷冻保存剂的冷冻保存的输注溶液,其中细胞可以被冷冻,并且然后在解冻时输注到受试者中。例如,冷冻保存的输注溶液可以包括20-40%葡萄糖、0.5-2%葡聚糖、20-60%人血清白蛋白、5-15%dmso、无热原iv晶体溶液,例如具有血浆-裂解物a(百特国际公司(baxter international))、葡萄糖和氯化钠的组合物。每1000ml的血浆-裂解物a含有用于本文中的冷冻保存的输注溶液的基础培养基,并且因此所述基础培养基可以具有括号中的范围,分别为5.26g(4-6g)氯化钠、370mg(350-450mg)氯化钾、300mg(200-400mg)氯化镁、3.68(3-4)g和5.02g(4.5-5.5g)乙酸钠和葡萄糖酸钠;这分别相当于140mmol/l钠、5mmol/l钾、1.5mmol/l镁、98mmol/l氯化物以及27mmol/l和23mmol/l乙酸盐和葡萄糖酸盐。在一些
实施例中,冷冻保存的输液溶液是cryostor冷冻培养基。其它示例性冷冻保存的输注溶液,其中可以冷冻保存car-t细胞以解冻和任选地递送到受试者,包含cryostor cs5;31.25%血浆-裂解物a、31.25%葡萄糖、0.45%nacl、7.5%dmso、1%葡聚糖40和5%hsa;31.25%血浆-裂解物a、31.25%葡萄糖、0.45%nacl、7.5%dmso、1%葡聚糖40和5%hsa;50%hsa、40%血浆裂解物和10%dmso;以及血浆-裂解物a、5%hsa和10%dmso。
[0328]
在一些实施例中,细胞疗法悬浮液、输液悬浮液、细胞分散体或细胞悬浮液位于无菌容器中,锁死无菌容器被配置成或适用于容纳细胞,特别是用于冷冻和解冻细胞(即,低温容器),如细胞冷冻保存袋(例如,康宁公司(corning inc.)(亚利桑那州格兰岱尔(glendale,az))、crymacs
tm
(加利福尼亚州圣地亚哥美天旎生物技术公司(miltenyl biotec,san diego,ca))、crystore
tm
冷冻袋(德克萨斯州奥斯汀傲锐东源公司(origen,austin,tx))、kryosure
tm
冷冻保存袋(马里兰州盖瑟斯堡圣戈班(saint gobain,gaithersburg,md))),当细胞未冷冻时(例如,细胞解冻之后),其也可以充当输液袋。在说明性实施例中,容器,例如输液袋包含用于鉴定受试者的信息,如患者鉴定信息。在一些实施例中,所述袋是乙烯醋酸乙烯酯(eva)输液袋。在一些实施例中,容器(例如,袋)包含递送溶液(如冷冻保存的输注溶液)中的一定体积的经基因修饰的细胞。在所述范围的低端,此类体积可以介于1、2、3、4、5、6、7、8、9、10、15、20与25ml之间,并且在所述范围的高端,介于5、6、7、8、9、10、15、20、25、30、35、40、45、50、75与100ml之间,例如,介于5ml与100ml之间、10ml与50ml之间、10ml与30ml之间、30ml与50ml之间或10ml与25ml之间。在一些实施例中,容器(例如,袋)含有介于1
×
104与1
×
10
10
之间、或介于1
×
104与1
×
109之间、或介于1
×
104与1
×
108之间、或介于1
×
104与1
×
10
10
之间、或介于1
×
104与1
×
109之间或介于1
×
104与1
×
108之间个细胞。经基因修饰的淋巴细胞可以在它们被引入或在已被基因修饰之后重新引入到受试者中之后在受试者体内发现。本文提供了关于施用经基因修饰的细胞的进一步细节。
[0329]
一方面,本文提供了经转导和/或经基因修饰的t细胞或nk细胞,其包括重组多核苷酸,所述重组多核苷酸在其基因组中包括与在t细胞和/或nk细胞中具有活性的启动子可操作地连接的一个或多个转录单元。转录单元可以编码任何分离的编码本文所提供的car的核酸。
[0330]
在本文所公开的方法和组合物中,多肽的表达可以由控制元件调节。
[0331]
产生可条件激活的细胞的方法
[0332]
本公开提供了一种产生可条件激活的细胞的方法。所述方法通常涉及用包含编码本公开的条件活性car的核苷酸序列的表达载体(例如,质粒或病毒)或rna(例如,体外转录的rna)基因修饰哺乳动物细胞。经基因修饰的细胞在存在her2的情况下是可条件激活的。基因修饰可以在体内、体外或离体进行。细胞通常是免疫细胞(例如,t淋巴细胞、t辅助细胞或nk细胞)、干细胞、祖细胞等。在说明性实施例中,所述细胞是t细胞。
[0333]
在一些情况下,基因修饰是离体进行的。例如,从个体中获得t淋巴细胞、干细胞、t辅助细胞或nk细胞;并且从个体中获得的细胞被基因修饰以表达本公开的car。经基因修饰的细胞在存在her2的情况下是可条件激活的。在一些情况下,经基因修饰的细胞在体外被激活。在其它情况下,将经基因修饰的细胞引入到个体(例如,从其中获得细胞的个体)中;并且经基因修饰的细胞在体内被激活。例如,在her2存在于个体中的细胞的表面上的情况
下,不需施用抗原。经基因修饰的细胞与个体中的细胞的表面上存在的抗原接触并且所述经基因修饰的细胞被激活。例如,在经基因修饰的细胞是t细胞的情况下,所述经基因修饰的细胞可以对在其结合car的表面上表达her2的细胞表现出细胞毒性。
[0334]
一方面,本文提供了用于制备可条件激活的t细胞和/或nk细胞的离体方法,所述方法包括用于条件结合her2的嵌合抗原受体(car),其中所述方法包括:
[0335]
a)富集外周血单核细胞(pbmc),以从分离的血液中分离包括t细胞和/或nk细胞的pbmc;
[0336]
b)在有效条件下激活富集的pbmc的t细胞和/或nk细胞;
[0337]
c)在有效条件下用无复制能力的重组逆转录病毒颗粒转导激活的t细胞和/或nk细胞,由此产生经基因修饰的t细胞和/或nk细胞,其中所述无复制能力的重组逆转录病毒颗粒各自包括逆转录病毒基因组,所述逆转录病毒基因组包括与在t细胞和/或nk细胞中具有活性的启动子可操作地连接的一个或多个核酸序列,其中所述一个或多个核酸序列的第一核酸序列编码根据本文所提供的任何实施例的cab-car;以及
[0338]
d)扩增所述经基因修饰的t细胞和/或nk细胞,由此制备所述可条件激活的t细胞和/或nk细胞。
[0339]
在上述方面的一些实施例中,所述方法进一步包含采集扩增的经基因修饰的t细胞和/或nk细胞。在上述方面的一些实施例中,所述方法进一步包含在富集pbmc之前,从受试者中收集血液。在另外的实施例中,所述方法进一步包含将采集的扩增的经基因修饰的t细胞和/或nk细胞引入到所述受试者中。在另外的实施例中,所述经基因修饰的t细胞和/或nk细胞在被引入到受试者中之后1、2、3、4、5、6、7或14天存在于所述受试者中。
[0340]
另一方面,本文提供了用于制备可条件激活的t细胞和/或nk细胞的离体方法,所述方法包括用于条件结合her2的嵌合抗原受体(car),其中所述方法包括:
[0341]
a)富集外周血单核细胞(pbmc),以从分离的血液中分离包括t细胞和/或nk细胞的pbmc;
[0342]
b)用合成rna转染t细胞和/或nk细胞,由此产生经基因修饰的t细胞和/或nk细胞,其中所述合成rna包括与在t细胞和/或nk细胞中具有活性的启动子可操作地连接的一个或多个核酸序列,其中所述一个或多个核酸序列的第一核酸序列编码根据本文所提供的任何实施例的cab-car;以及
[0343]
c)扩增所述经基因修饰的t细胞和/或nk细胞,由此制备所述可条件激活的t细胞和/或nk细胞。
[0344]
血液收集
[0345]
可以通过本领域已知的任何合适方法从受试者中收集或获得含有pbmc的血液。例如,可以通过静脉穿刺或收集血液和/或pbmc样品的任何其它血液收集方法来收集血液。在一些实施例中,pbmc可以通过如下文所讨论的单采术获得。
[0346]
对pbmc的富集
[0347]
在用于制备可条件激活的t细胞和/或nk细胞的离体方法中,包含t细胞和/或nk细胞的外周血单核细胞(pbmc)在富集步骤中与血液样品的其它组分分离。可以使用本领域已知的任何方法,例如使用单采术和/或密度梯度离心法,从其它血液组分和血细胞中富集pbmc。在一些实施例中,可以使用ficoll-paque(通用电气医疗集团(ge healthcare))。在
一些实施例中,使用自动单采分离器,所述自动单采分离器从受试者中采集血液,使血液通过分拣出特定细胞类型(如例如,pbmc)的设备,并且将剩余部分返回到受试者中。单采术之后可以进行密度梯度离心。在一些实施例中,可以使用白细胞减少过滤装置富集和分离pbmc。在一些实施例中,然后根据细胞表型(即阳性选择),使用磁珠激活的细胞分选从pbmc中纯化特定细胞群体,如例如t细胞和/或nk细胞。在一些实施例中,可以使用本领域已知的方法从pbmc中去除单核细胞和/或巨噬细胞。关于要治疗的受试者,细胞可以是同种异体的和/或自体的。在pbmc富集过程期间,可以如本领域已知的那样进行一次或多次洗涤,然后分离富集的pbmc并且然后激活。洗涤溶液可以是任何适于洗涤血液和/或pbmc的溶液。根据本领域已知的方法,可以将分离的pbmc重悬于用于培养t细胞和/或nk细胞的任何合适的基础培养基中。在一些实施例中,培养基可以补充有hsa、人ab+血清、源自受试者的血清和/或血清替代物。
[0348]
对pbmc的激活
[0349]
本文提供的用于制备可条件激活的t细胞和/或nk细胞的离体方法通常包含用一种或多种激活剂激活或刺激分离的pbmc以产生激活的t细胞和/或nk细胞的步骤。可以对新鲜分离的pbmc或先前冷冻保存的pbmc进行激活。在使用冷冻保存的细胞的情况下,可以在使用前使用开发的方案解冻细胞。
[0350]
在激活期间通常存在培养基,如本领域已知的用于离体过程的那些(作为非限制性实例,x-vivo 15(龙沙公司(lonza))或cts培养基(赛默飞世尔公司(thermo fisher)))。在一些实施例中,培养基可以补充有hsa、人ab+血清、源自受试者的血清和/或血清替代物。在说明性实施例中,培养基可以补充有血清替代物,如cts血清替代物(赛默飞世尔公司)。在一些实施例中,培养基可以补充有hsa、人ab+血清、源自受试者的血清和/或血清替代物。
[0351]
可以将一种或多种激活剂的任何组合添加到培养基中以产生激活的t细胞和/或nk细胞。通常形成反应混合物以进行激活。在一些实施例中,可以通过将一种或多种激活剂添加到培养基中来形成反应混合物。在本文所公开的实施例中的任何实施例中,一种或多种激活剂以有效量使用,使得产生激活的t细胞和/或nk细胞。
[0352]
在一些实施例中,激活剂可以是多肽或抗体(例如,抗cd2、抗cd3和/或抗cd28)或其靶向或结合t细胞刺激或共刺激分子、t细胞因子或任何其它合适的有丝分裂原(例如,十四烷酰佛波醇乙酸酯(tpa)、植物血凝素(pha)、刀豆球蛋白a(cona)、脂多糖(lps)、商陆有丝分裂原(pwm))的功能片段、t细胞刺激或共刺激分子的天然配体、磷酸抗原或氨基双膦酸盐,如唑来膦酸盐。本领域已知多种抗体及其功能片段可激活或刺激t细胞和/或nk细胞。在一些实施例中,一种或多种抗体或其功能片段可以固定在固体表面,如珠粒上。
[0353]
对t细胞和/或nk细胞的转导
[0354]
本文提供的用于制备可条件激活的t细胞和/或nk细胞的离体方法通常包含转化或转导激活的t细胞和/或nk细胞的步骤。在此类方法的一些实施例中,t细胞和/或nk细胞离体与表达载体如无复制能力的重组逆转录病毒颗粒接触,以基因修饰t细胞和/或nk细胞。不受理论限制,在接触期期间,无复制能力的重组逆转录病毒颗粒与t细胞和/或nk细胞结合,此时逆转录病毒和宿主细胞膜开始融合。然后,通过转导过程,来自无复制能力的重组逆转录病毒颗粒的遗传物质进入t细胞和/或nk细胞,并且通常并入宿主细胞dna中。因此,此类方法包含通过转导对t细胞和/或nk细胞进行基因修饰。本领域已知用于用无复制
能力的重组逆转录病毒颗粒(如无复制能力的重组慢病毒颗粒)离体转导t细胞和/或nk细胞的方法。示例性方法描述于以下中:例如wang等人(2012)《免疫疗法杂志(j.immunother.)》35(9):689-701;cooper等人(2003)《血液》101:1637-1644;verhoeyen等人(2009)《分子生物学方法》506:97-114;以及cavalieri等人(2003)《血液》102(2):497-505。在一些实施例中,t细胞和/或nk细胞可以与无复制能力的重组逆转录病毒颗粒接触。在说明性实施例中,t细胞和/或nk细胞可以与无复制能力的重组慢病毒颗粒接触。
[0355]
扩增经转导的t细胞和/或nk细胞
[0356]
在本文所提供的用于制备可条件激活的t细胞和/或nk细胞的离体方法的说明性实施例中,经转导的t细胞和/或nk细胞在采集之前被扩增。在本文所公开的实施例中的任何实施例中,存在用于激活和转导的培养基,并且转导之后可以进一步添加或更换,以进行扩增。在一些实施例中,可以将培养基添加到激活期间形成的反应混合物中。用于扩增的培养基通常包含用于激活和转导的相同基础培养基,如本领域已知的用于离体过程,尤其是用于t细胞和/或nk细胞的那些(作为非限制性实例,x-vivo 15(龙沙公司)或optimizer cts培养基(赛默飞世尔公司))。在一些实施例中,培养基可以补充有hsa、人ab+血清、源自受试者的血清和/或血清替代物,如cts血清替代物(赛默飞世尔公司)。细胞因子,如il-2、il-7或il-15,或在hsa中发现的那些可以在激活、转导和扩增之前、期间和/或之后添加到培养基中。细胞扩增可以进行一定天数。在一些实施例中,扩增可以进行4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或21天。在一些实施例中,扩增可以进行在所述范围的低端的4、5、6、7或8天到在所述范围的高端的9、10、11、12、13、14、15、16、17、18、19、20或21天。在某些说明性实施例中,扩增进行6到12天或8到10天。
[0357]
细胞采集
[0358]
本文所提供的用于制备可条件激活的t细胞和/或nk细胞的离体方法通常包含在扩增之后采集经基因修饰的t细胞和/或nk细胞。在一些实施例中,可以使用本领域已知的方法在采集期间浓缩或收集经转导的t细胞和/或nk细胞。在一些实施例中,t细胞和/或nk细胞可以在采集期间使用本领域已知的任何合适的洗涤溶液洗涤一次或多次。在采集结束时,t细胞和/或nk细胞可以重新悬浮在本领域已知的任何合适的培养基中。在本文所公开的实施例中的任何实施例中,对扩增的t细胞和/或nk细胞的采集可以基于扩增完成标准进行。在一些实施例中,扩增完成标准可以是乳酸浓度、细胞密度或扩增天数。
[0359]
在一些实施例中,可以将采集的细胞引入,返回引入,重新引入,输注或重新输注到受试者中。在一些实施例中,在重新引入到受试者中之前,可以如下文所描述的将采集的细胞冷冻保存。在说明性实施例中,在不首先冷冻保存细胞的情况下,将采集的细胞引入,返回引入,重新引入,输注或重新输注到受试者中。受试者通常是采集血液的同一受试者。
[0360]
在整个本公开中,经转导的t细胞和/或nk细胞包含在离体转导期间保留并入到细胞中的核酸中的至少一种核酸的经转导的细胞的后代。在本文列举“重新引入”经转导的细胞的方法中,应当理解,当从受试者的血液中收集此类细胞时,所述细胞通常不处于转导状态。
[0361]
细胞引入/重新引入
[0362]
在本文所公开的用于制备可条件激活的t细胞和/或nk细胞的离体方法的某些实施例中,可以将采集的t细胞和/或nk细胞引入、返回引入、重新引入、输注或重新输注到受
试者中用于治疗效果。要重新引入的t细胞和/或nk细胞的数量可以是预定剂量,所述预定剂量可以是治疗有效剂量。在一些实施例中,预定剂量可以取决于在细胞上表达的car(例如,在经转导的t细胞和/或nk细胞上表达的抗原特异性靶向区的亲和力和密度)、靶细胞的类型、正在治疗的疾病或病理病状的性质或组合。在一些实施例中,采集的细胞的预定剂量可以基于受试者的质量,例如,每千克受试者的细胞数(细胞/kg)。在本文中提供了要施用的药物组合物中的经修饰的t细胞和/或nk细胞的进一步细节,包含在本文中提供的剂量范围和施用途径。
[0363]
细胞冷冻保存
[0364]
在本文所提供的用于制备可条件激活的t细胞和/或nk细胞的离体方法中,通过本文所描述的方法产生的采集的细胞可以以预定剂量冷冻保存在低温容器如冷冻保存袋(即,冷冻袋)中供以后使用,如本文进一步详细讨论的。用于冷冻保存细胞的方法和试剂在本领域中是众所周知的。冷冻保存可以包含一次或多次洗涤和/或浓缩本文中的实施例中提供的任何t细胞和/或nk细胞的步骤。所述方法还可以包含形成冷冻保存混合物或悬浮液的步骤,所述冷冻保存混合物或悬浮液包含稀释溶液中的t细胞和/或nk细胞,所述稀释溶液可以是递送溶液和合适的冷冻保存溶液。在一些实施例中,所述方法可以包含如本领域已知的冷冻所述冷冻保存混合物的步骤。
[0365]
作为非限制性具体实例,一旦细胞被调配为在一个或多个冻存袋中冷冻,就将袋密封,放入如cryomed 7455(赛默飞世尔公司)等冷冻装置中,并且然后将袋以37℃到4℃,并且然后逐步下降到-80℃的逐渐温度下降斜坡冷冻。然后可以在例如12-36小时之后将细胞转移到液氮中。
[0366]
在一些实施例中,合适的冷冻保存溶液可以包含一种或多种非电解质,包含低分子分子,如糖、甘油(海藻糖和蔗糖)和二甲基亚砜(dmso),以及大聚合物分子(例如,聚乙烯吡咯烷酮和羟乙基淀粉)。本文提供了关于冷冻保存溶液的进一步细节。
[0367]
解冻冷冻保存的t细胞和/或nk细胞的方法是本领域已知的。对于自体细胞引入/输注,这通常涉及在重新引入(即输注)之前使用在低温容器(例如,冷冻袋)上提供的个人鉴定信息确认受试者的身份。然后可以通过确定体重、剂量和car阳性t细胞和/或nk细胞密度(细胞/ml)来计算输注体积。然后将低温容器(例如,冷冻袋)中的细胞解冻,例如在37℃水浴中。低温容器中存在的任何细胞团块都可以通过搅拌去除。然后可以例如以本文所提供的任何速率静脉内递送细胞悬浮液,例如用注射器或注射泵以0.25到5毫升/分钟或0.75到1.25毫升/分钟。
[0368]
表征和商业产生方法
[0369]
本公开提供了可以在科学实验和商业生产中用作研究试剂的各种方法和组合物。此类科学实验可以包含用于表征淋巴细胞如nk细胞并且在说明性实施例中使用用于基因修饰例如转导本文所提供的淋巴细胞的方法的t细胞的方法。例如,此类方法可以用于研究淋巴细胞的激活以及激活使此类细胞可转导的详细分子机制。此外,本文提供了经基因修饰的淋巴细胞,所述经基因修饰的淋巴细胞将具有效用,例如,作为研究工具以更好地了解影响t细胞增殖和存活的因素。此类经基因修饰的淋巴细胞,如nk细胞和在说明性实施例中的t细胞,还可以用于商业生产,例如用于生产某些因子,如生长因子和免疫调节剂,所述因子可以被采集和测试或用于商业产品的生产。
[0370]
淋巴细胞的科学实验和/或表征可以包含本文所提供的用于分析或比较淋巴细胞的任何方面、实施例或子实施例。在一些实施例中,t细胞和/或nk细胞可以用本文所提供的包含多核苷酸的无复制能力的重组逆转录病毒颗粒转导。在一些实施例中,对t细胞和/或nk细胞的转导可以包含多核苷酸,所述多核苷酸包含编码本公开的多肽例如car的多核苷酸。
[0371]
激活免疫细胞的方法
[0372]
本公开提供了在体外、体内或离体激活免疫细胞的方法。所述方法通常涉及使免疫细胞(体外、体内或离体)与her2接触,其中所述免疫细胞已被基因修饰为产生(即表达)本公开的条件活性car。在存在her2的情况下,条件激活的car激活免疫细胞,由此产生激活的免疫细胞。免疫细胞包含例如细胞毒性t淋巴细胞、nk细胞、cd4
+
t细胞、t调节(treg)细胞、γδ-t细胞、nk-t细胞、嗜中性粒细胞等。在说明性实施例中,免疫细胞是t细胞或nk细胞,在具体地说明性实施例中,免疫细胞是包含nk-t细胞的t细胞。在此类说明性实施例中,激活通常是激活t细胞或nk细胞的细胞毒性活性。此类方法可以使用多种免疫细胞(例如,t细胞或nk细胞)进行。在另外的说明性实施例中,所述接触涉及使表达her2的靶哺乳动物细胞与免疫细胞接触。用于激活t细胞或nk细胞的此类方法可以通过检测以下而检测:t细胞或nk细胞对细胞因子的释放如ifn-γ或il-2的释放、t细胞和/或nk细胞对表达her2的细胞的细胞毒性活性的增加、t细胞或nk细胞中的ifnγ和/或il-2的细胞内表达增加、通过荧光激活细胞分选(facs)分析测量的t细胞或nk细胞的cd107a和/或cd69表达增加以及t细胞或nk细胞的增殖增加。本文中的实例提供了检测t细胞和/或nk细胞激活的这些方法中的一些方法的细节。
[0373]
本文所提供的另外的方面包含用于将免疫细胞(例如,t细胞或nk细胞)与靶哺乳动物细胞结合的方法,所述方法包含在体外、体内或离体使靶哺乳动物细胞与免疫细胞接触,其中所述靶哺乳动物细胞表达her2,并且所述免疫细胞表达本文所提供的与her2结合的任何car。此类结合可以激活免疫细胞。此类方法可以使用多种免疫细胞(例如,t细胞或nk细胞)进行。如通过检测由释放细胞因子和细胞毒性活性增加引起的t细胞或nk细胞的激活来检测的此类结合方法在本文中的实例中提供。
[0374]
在本文中的说明性实施例中,用于结合或激活免疫细胞的方法中的接触涉及在小于7.4的ph下接触微环境中的免疫细胞(例如,t细胞或nk细胞)。例如,ph可以小于5.8、5.9、6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8或6.9或者在5.8到7.0的范围内,在说明性实施例中在6.0到6.8的范围内、在6.1到6.9的范围内、在6.2到6.8的范围内,或者介于所述范围的低端的6.0、6.1、6.2、6.3、6.4和6.5与所述范围的高端的6.6、6.7、6.8和6.9之间。在此类说明性实施例中,car是本文所公开的识别本文所提供的her2的任何cab-car。
[0375]
与在不存在her2的情况下由免疫细胞产生的细胞因子的量相比,使经基因修饰的免疫细胞(例如,t淋巴细胞、nk细胞)与her2接触可以使由免疫细胞产生的细胞因子增加至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约40%、至少约50%、至少约75%、至少约2倍、至少约2.5倍、至少约5倍、至少约10倍或超过10倍。与在不存在her2的情况下由免疫细胞分泌的细胞因子的量相比,使经基因修饰的免疫细胞(例如,t淋巴细胞或nk细胞)与her2接触可以使由免疫细胞分泌的细胞因子增加至少10%、至少15%、至少20%、至少25%、至少30%、至少40%、至少50%、至少75%、至少2倍、至少2.5倍、至少5倍、
至少10倍或超过10倍。可以增加产量的细胞因子包含但不限于il-2和ifn-γ。
[0376]
与在不存在her2的情况下细胞毒性细胞的细胞毒性活性相比,使经基因修饰的细胞毒性细胞(例如,细胞毒性t淋巴细胞)与her2接触可以使细胞毒性细胞的细胞毒性活性增加至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约40%、至少约50%、至少约75%、至少约2倍、至少约2.5倍、至少约5倍、至少约10倍或超过10倍。
[0377]
与在不存在her2的情况下免疫细胞的cd107a和/或cd69的表达相比,使经基因修饰的免疫细胞(例如,t淋巴细胞、nk细胞)与her2接触可以使细胞的cd107a和/或cd69的表达增加至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约40%、至少约50%、至少约75%、至少约2倍、至少约2.5倍、至少约5倍、至少约10倍或超过10倍。
[0378]
在其它实施例中,例如,取决于宿主免疫细胞,使经基因修饰的宿主细胞与抗原接触可以增加或减少细胞增殖、细胞存活、细胞死亡等。
[0379]
治疗方法
[0380]
本公开提供了用于治疗包含本文所提供的抗her2 cab-car的病症的多种方法。在一些实施例中,所述方法利用了以下事实:本公开的cab-car当存在于t淋巴细胞或nk细胞中并由其表达时可以介导对靶细胞的细胞毒性。对于向其引入/施用具有本文所提供的cab-car t细胞和/或nk细胞的群体的受试者,细胞可以是同种异体的或自体的。本公开的cab-car在某些靶标条件下与靶细胞上存在的抗原结合,由此介导被基因修饰为产生cab-car的t淋巴细胞或nk细胞对靶细胞的杀伤。cab-car的astr通常与靶细胞的表面上存在的抗原结合。因此,在另外的方面,本公开提供了编码本文所提供的任何cab-car的核酸在制造或制备药物中的用途。
[0381]
靶细胞包含但不限于癌细胞。因此,本公开提供了杀死靶癌细胞或抑制靶癌细胞生长的方法,所述方法涉及接触被基因修饰为产生主题car的细胞毒性免疫效应细胞(例如,细胞毒性t细胞或nk细胞),使得t淋巴细胞或nk细胞识别存在于靶癌细胞的表面上的抗原,并且介导对靶细胞的杀伤。此类方法的说明性方面提供了用于治疗癌症的方法。cab-car不限于用于治疗癌症或靶向肿瘤或癌细胞的用途,而是适用于一种或多种适应症,包含治疗循环系统病症、关节炎、多发性硬化症、自身免疫性病症、皮肤病症、病毒性疾病和病症,并且以各种诊断形式使用。在本文中的某些说明性实施例中,将表达或能够表达本文所提供的抗her2 car的t细胞和/或nk细胞递送到患有与her2蛋白表达或过表达相关的癌症的受试者。此类癌症包含但不一定限于乳腺癌、卵巢癌、膀胱癌、胆囊癌、肺癌、宫颈癌、肠癌、肝外或肝内胆管癌、唾液管癌、胃癌,包含食道癌、食道胃结合部癌和胃腺癌和胃肠道间质瘤、结肠癌、肺癌,包含非小细胞和小细胞小细胞肺癌、胰腺癌如胰腺腺癌、阴茎癌、垂体癌、前列腺癌、肉瘤,包含软组织肉瘤、腹膜肉瘤和腹膜后肉瘤、孤立性纤维瘤、胸腺癌、甲状腺癌、宫颈癌、子宫癌、睾丸癌、子宫内膜癌、胶质母细胞瘤如多形性胶质母细胞瘤、胶质瘤、少突胶质细胞瘤、头颈癌、肝细胞癌、小肠恶性肿瘤、黑色素瘤、神经内分泌肿瘤或其它her2蛋白表达或过度表达的癌症。her2通常在上皮来源的恶性肿瘤和源自间充质、神经内分泌组织、中枢神经系统和肾脏的癌症中过表达,并且因此本发明的抗体或抗体片段可以用于治疗这些类型的癌症。有关癌症中的各种形式的her2表达的信息可以在例如以下中找到:“her2在多种癌症中的表达状态:回顾来自37,992名患者的结果(her2expression status in diverse cancers:review ofresults from 37,992patients)”,yan,min等人,《癌症和
转移综述(cancer metastasis rev.)》,(2015)34:157-164。与her2表达或过表达相关的疾病包含外阴佩吉特氏病(vulvar paget
′
s disease)。在一些实施例中,本公开的方法可以包含用于抑制血管生成、抑制细胞增殖、抑制免疫功能、抑制炎性细胞因子分泌(例如,来自肿瘤相关巨噬细胞)、抑制肿瘤脉管系统(例如,瘤内脉管系统或肿瘤相关脉管系统)和/或抑制肿瘤基质功能的抗her2 astr和/或car。在一些实施例中,治疗这些病状的方法可以包含抗her2 astr和/或car。在说明性实施例中,将抗her2 cab car t细胞和/或nk细胞递送到患有her2阳性癌症的哺乳动物(例如人)受试者,以为受试者增加生存持续时间、启动客观缓解、控制癌症或抑制癌症进展。
[0382]
在某些方面,本公开提供了一种治疗患有癌症的受试者的癌症的方法。因此,本公开提供了用于针对癌症,尤其是表达her2的癌症的过继性细胞疗法的方法,所述方法使用本文所提供的抗her2 cab-car。因此,一方面,所述方法包含以下:a.将被配置为表达编码如本文所提供的针对her2的cab-car的多核苷酸序列的表达载体引入到从受试者中获得的外周血细胞中以产生基因工程化的细胞毒性细胞(如t细胞或nk细胞);以及b.将所述基因工程化的细胞毒性细胞施用于所述受试者。本文提供了用于处理t细胞以激活、转导和通常扩增此类细胞的详细方法,所述方法提供上述步骤a的说明性实施例。
[0383]
治疗方法包含本文中的示例性实施例部分中提供的方法:在哺乳动物中提供抗肿瘤免疫,治疗患有与her2表达升高相关的疾病、病症或病状的哺乳动物,治疗患有癌症(例如,乳腺癌、胃癌、食道癌、卵巢癌、子宫内膜癌、肺癌或膀胱尿路上皮癌)的人,在哺乳动物中产生由经基因修饰的t细胞构成的持久群体,扩增人的由经基因修饰的t细胞构成的群体,并且刺激对哺乳动物(例如,人)的靶细胞群体或组织的t细胞介导的免疫应答。
[0384]
在本文所提供的包含受试者、哺乳动物和/或人的实施例的任何方面的某些实施例中,哺乳动物(例如,人)受试者接受了先前的曲妥珠单抗疗法作为新辅助或辅助疗法。在一些实施例中,在某些说明性实施例中,哺乳动物(例如,人)受试者患有复发性癌症(例如,复发性乳腺癌),所述复发性癌症在哺乳动物受试者用曲妥珠单抗疗法(即赫赛汀疗法)或其生物类似物治疗之后复发。
[0385]
在本文所提供的包含受试者、哺乳动物和/或人以及任选地用于将细胞施用于受试者的步骤的实施例的任何方面的某些实施例中,在说明性实施例中,哺乳动物患有her2阳性癌症。在一些实施例中,her2阳性癌症是由过度表达her2的细胞引起的癌症。在一些实施例中,相对于未癌变的相似细胞,过表达可以是1.5、2、2.5、3、3.5、4、4.5或5倍过表达。在一实施例中,her2阳性癌症包含具有her2基因扩增的细胞。在一些实施例中,哺乳动物受试者(例如,人)患有肿瘤,其中所分析的所有肿瘤细胞中的至少50%为her2阳性。用于检测和测量肿瘤的her2表达的方法是本领域已知的。在一些实施例中,her2阳性由细胞表面上的her2的表达(例如,免疫组织化学(ihc))、基因扩增(例如,fish或pcr)或her2 mrna的表达(例如,qpcr)确定。在一些实施例中,her2是如由her2确定的阳性,例如赫赛汀,伴随诊断。在一些实施例中,her2伴随诊断是foundationone cdx(基础医学公司(foundation medicine,inc.))、pathvysion her-2dna探针试剂盒(雅培分子公司(abbott molecular inc.))、insite her-2/neu kit(拜尔基因实验室公司(biogenex laboratories,inc.))、inform her-2/neu(文塔纳医疗系统公司(ventana medical systems,inc.))、pathway抗her2/neu(4b5)兔单克隆初级抗体(文塔纳医疗系统公司)、inform her2双ish dna探针混
合物(文塔纳医疗系统公司)、ventanaher2双ish dna探针混合物(文塔纳医疗系统公司)、spot-light her2 cish试剂盒(生命技术公司(life technologies corp.))、bond oracle her2 ihc系统(莱卡生物系统公司(leica biosystems))、her2 cish pharmdx试剂盒(丹麦丹科公司a/s(dako denmarka/s))、herceptest(丹麦丹科公司a/s)或her2 fish pharmdx试剂盒(丹麦丹科公司a/s)。在非限制性具体实例中,her2表达使用罗氏her2抗体(4b5)对肿瘤组织进行标准染色来分析,并且根据“乳腺癌her2检测指南(2019版)”和“胃癌her2检测指南(2016版)”进行解释。在某些实施例中,肿瘤细胞占所有肿瘤细胞的≥50%。对于除胃癌和乳腺癌以外的her23+实体瘤,在说明性实施例中进行fish以确认her2的表达;对于在her2靶向疗法之后复发的患者,在说明性实施例中,再次进行活检和ihc以检测her2表达;
[0386]
在一些实施例中,人受试者具有大多数或在说明性实施例中,所有以下血液参数:血红蛋白(hgb)≥90g/l,两周内不进行输血;白细胞(wbc)≥2.5
×
109/l;中性粒细胞绝对计数(anc)≤1.5
×
109/l;血小板计数(plt)≥80
×
109/l;-总胆红素(tbil)≤3.0ng/dl或≤1.5uln;天冬氨酸转氨酶(ast)和丙氨酸转氨酶(alt)≤2.5
×
uln;如果肝功能异常是由肝细胞癌或肿瘤肝转移引起的,则ast和alt≤5
×
uln;并且血清肌酸酐(cr)≤1.5
×
uln;或者肌酸酐清除率(crcl)≥50毫升/分钟。
[0387]
car可以是识别本文所公开的her2的任何cab-car,尤其是对表达这些抗原的癌细胞具有细胞毒性的那些。通过用载体转导包含t细胞和/或nk细胞的外周血白细胞,可以将编码抗her2 cab-car的表达载体引入到外周血细胞中。在某些说明性实施例中,载体是重组病毒,如重组逆转录病毒,所述重组病毒在一些实施例中是重组慢病毒。在一些实施例中,癌症是表达her2的软组织肉瘤或间皮瘤,受试者(例如,软组织肉瘤患者或间皮瘤患者)的t细胞和/或nk细胞用本文所公开的抗her2 car,例如抗her2 cab-car转导。
[0388]
用于治疗本文所提供的病症的方法通常包含向受试者施用表达本文所提供的抗her2 cab-car的经基因修饰的t细胞或nk细胞。在一些实施例中,经基因修饰的细胞存在于递送溶液中,例如如本文所讨论的冷冻保存的递送溶液。在一些实施例中,递送溶液位于袋中,如输液袋,如本文别处所公开的。在一些实施例中,施用可以是静脉内施用、皮下施用或肿瘤内施用。在一些实施例中,静脉内施用可以包含的输注速率为介于所述范围的低端的0.25、0.5、0.75、1、2、3、4、5、6、7、8、9、10、15和20毫升/分钟与所述范围的高端的5、6、7、8、9、10、15、20、25、30和35毫升/分钟之间,例如介于5毫升/分钟与30毫升/分钟之间、10毫升/分钟与25毫升/分钟之间或10毫升/分钟与20毫升/分钟之间。在一些实施例中,施用可以在1次施用中发生。在一些实施例中,施用可以在2次或更多次,例如3次或更多次、4次或更多次、或5次或更多次单独施用中发生。在一些实施例中,一次施用可以包含使用多于1个袋,例如2、3、4、5、6、7、8、9或10个袋。在一些实施例中,经基因修饰的细胞被冷冻,例如在冷冻保存的递送溶液中,并且必须在施用之前解冻。在一些实施例中,经基因修饰的细胞处于细胞分散体中。在静脉内施用经基因修饰的t细胞和/或nk细胞的方法中,通常1
×
104个细胞/kg到1
×
10
10
个细胞/kg体重,例如1
×
104到1
×
109,例如1
×
105到1
×
107个car阳性t和/或nk细胞/kg体重,在适合肠胃外施用的缓冲液中递送。在一些实施例中,对体重为50kg或以下的受试者的施用可以含有每kg体重0.2
×
106到5.0x108个或0.2
×
106到5.0
×
106个表达本文所提供的抗her2 cab-car的car阳性t和/或nk细胞。在一些实施例中,对体重高于50kg的
30、30-35、35-40、40-45或45-50mg/m2)的剂量例如静脉内施用。在一些实施例中,环磷酰胺以约200-300mg/m2(例如,约200-225、225-250、250-275或275-300mg/m2)的剂量例如静脉内施用。在一些实施例中,苯达莫司汀以50-150mg/m2(70-130、75-125、75-115、80-100、85-95或90mg/m2)例如静脉内施用。
[0393]
氟达拉滨可以施用例如2-6、2-4、3-5、3-4、4-5、3天或4天,通常连续若干天。环磷酰胺可以递送1-4天、2-4天、2-3天或3天,通常是连续若干天,例如与氟达拉滨一起施用时与氟达拉滨在同一天开始。例如,苯达莫司汀可以递送1-4、2-4、2-3或3天。可以在淋巴细胞清除方案施用完成之后1到21、2到14、2到10、2到7或2到5天将经基因修饰的t细胞和/或nk细胞施用于受试者。例如,可以连续1天、2天、3天、4天或5天,说明性地连续3天,在1到30、2到15、2到11、2到7、3到5或2到4天之前向受试者施用淋巴细胞清除化学疗法。在一些实施例中,测量受试者的白细胞计数以确保其超过某个临界值(例如,1
×
109),或者在施用经基因修饰的t细胞和/或nk细胞之前未执行淋巴细胞清除方案。在一些实施例中,施用之前、伴随施用和/或施用之后施用白介素或其经修饰版本。例如,本文所提供的一些实施例包含共施用il-2,或具有持续释放和/或与偏向激活增殖和/或杀伤t细胞的活性的某些il-2受体结合的il-2的经修饰版本。例如,经修饰的il-2在某些实施例中是peg化il-2并且可以是nktr-214(加利福尼亚州旧金山内克塔治疗公司((nektar therapeutics,san francisco,ca))。在其它实施例中,经修饰的il-2是alks4230(奥克美思公司(alkermes,inc.))。
[0394]
可以适于通过本文所公开的方法进行疗法的癌包含但不限于食道癌、肝细胞癌、基底细胞癌(一种皮肤癌)、鳞状细胞癌(各种组织)、膀胱癌,包含移行细胞癌(膀胱恶性肿瘤)、支气管癌、结肠癌、结直肠癌、胃癌、肺癌,包含小细胞癌和非小细胞肺癌、肾上腺皮质癌、甲状腺癌、胰腺癌、乳腺癌、卵巢癌、前列腺癌、腺癌、汗腺癌、皮脂腺癌、乳头状癌、乳头状腺癌、囊腺癌、髓样癌、肾细胞癌、导管原位癌或胆管癌、绒毛膜癌、精原细胞瘤、胚胎癌、肾母细胞瘤、宫颈癌、子宫癌、睾丸癌、成骨细胞癌、上皮癌和鼻咽癌。
[0395]
可以适于通过本文所公开的方法进行疗法的肉瘤包含但不限于纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、脊索瘤、成骨肉瘤、骨肉瘤、血管肉瘤、内皮肉瘤、淋巴管肉瘤、淋巴管内皮瘤、滑膜瘤、间皮瘤、尤文氏肉瘤、平滑肌肉瘤、横纹肌肉瘤和其它软组织肉瘤。
[0396]
可以适于通过本文所公开的方法进行疗法的其它实体瘤包含但不限于胶质瘤、星形细胞瘤、髓母细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、血管母细胞瘤、听神经瘤、少突胶质细胞瘤、血管瘤、黑色素瘤、神经母细胞瘤和视网膜母细胞瘤。
[0397]
可以适于根据本文所公开的方法进行治疗的其它癌症包含非典型脑膜瘤(脑)、胰岛细胞癌(胰腺)、髓质癌(甲状腺)、间质瘤(肠)、肝细胞癌(肝)、肝母细胞瘤(肝)、透明细胞癌(肾)和纵隔神经纤维瘤。
[0398]
在一些实施例中,适于根据本文所公开的方法进行治疗的癌症包含her2阳性肿瘤或癌症。在一些实施例中,适于根据本文所公开的方法进行治疗的癌症包含乳腺癌、胃癌、食道癌、卵巢癌、子宫内膜癌、肺癌或尿路上皮膀胱癌。在一些实施例中,受试者的癌症是复发性或难治性her2阳性实体瘤。肿瘤可以是经组织学或细胞学证实未通过标准治疗的晚期实体瘤,其中tnm分期为iv期(根据ajcc第八版)。在某些实施例中,根据recist 1.1标准,存在至少一个可测量病变,即根据ct横截面图像或磁共振成像(mri),非淋巴结病变的长直径为≥10mm,或者淋巴结病变的短直径为≥15mm;在一些实施例中,受试者可以具有0-1的东
部合作肿瘤小组(ecog ps)。
[0399]
增强宿主的免疫功能以对抗肿瘤可以与本发明的方法结合使用。常规方法包含(i)apc增强,如(a)将编码外源mhc同种抗原的dna注入肿瘤,或(b)用增加免疫抗原识别的可能性的基因(例如,免疫刺激性细胞因子gm-csf、共刺激分子b7.1、b7.2)来转染活检肿瘤细胞,(iii)过继性细胞免疫疗法或用活化的肿瘤特异性t细胞治疗。过继性细胞免疫疗法包含分离肿瘤浸润性宿主t淋巴细胞、在体外扩增群体,如通过il-2或肿瘤或两者的刺激。另外,功能障碍的分离的t细胞还可以通过体外应用抗pd-lcdr1抗体来活化。然后,如此激活的t细胞可以重新施用于宿主。这些方法中的一种或多种方法可以与本文所提供的car-t方法组合使用。
[0400]
组合疗法
[0401]
在一些实施例中,本文所提供的任何方面和实施例的抗her2 car细胞(例如,t细胞和/或nk细胞)与标准癌症疗法组合施用,在对标准癌症疗法难治的癌症/患者中施用,或作为标准癌症疗法的辅助疗法。在说明性实施例中,本文中的方法中的哺乳动物(例如,人类)受试者对抗her2抗体疗法(如曲妥珠单抗疗法)是难治的或患有her2阳性的复发性实体瘤。这些方法将任何方法或组合物组合在一种方法中,所述方法包含施用本文所提供的任何抗her2 car细胞或编码本文所提供的抗her2 car的rna,以及施用标准癌症疗法的步骤。标准癌症疗法包含外科手术(例如,对癌组织进行外科手术去除)、放射疗法(例如,放射疗法、x射线疗法、辐照)或使用电离辐射来杀死癌细胞并缩小肿瘤。放射疗法可以通过外部光束放射疗法(ebrt)外部地或通过近距离放射疗法内部地施用;骨髓移植;化学治疗,或应用通常影响快速分裂的细胞的细胞毒性药物;靶向疗法,或特异性地影响癌细胞的失调蛋白的药剂(例如,酪氨酸激酶抑制剂伊马替尼(imatinib)、吉非替尼(gefitinib);单克隆抗体、光动力学疗法);生物应答调节剂治疗;免疫疗法,或增强宿主的免疫应答(例如,疫苗);激素疗法,或阻断激素(例如,当肿瘤对激素敏感时),血管生成抑制剂,或阻断血管形成和生长,以及姑息照护,或旨在改善照护质量以减少疼痛、恶心、呕吐、腹泻和出血的治疗。如吗啡(morphine)和羟考酮(oxycodone)等止痛药、如昂丹司琼(ondansetron)和阿瑞匹坦(aprepitant)等止吐药可以允许更积极的治疗方案和上述的某些组合。
[0402]
放射疗法包含但不限于从外部应用源(如束)或通过植入小放射源递送的x射线或γ射线。
[0403]
用于癌症治疗的合适抗体(基于抗癌抗体的生物制剂)包含但不限于裸抗体,例如曲妥珠单抗(赫赛汀)(抗her2))、贝伐单抗(avastin
tm
)、西妥昔单抗(erbitux
tm
)、帕尼单抗(vectibix
tm
)、伊匹单抗(yervoy
tm
)、利妥昔单抗(瑞图宣(rituxan))、阿仑单抗(lemtrada
tm
)、奥法木单抗(arzerra
tm
)、奥戈伏单抗(ovarex
tm
)、兰博利珠单抗(mk-3475)、帕妥珠单抗(perjeta
tm
)、兰尼单抗(lucentis
tm
)等,以及缀合抗体,例如吉妥单抗(mylortarg
tm
)、本妥昔单抗
90
y-标记的替伊莫单抗(zevalin
tm
)、
131
i-标记的托西莫单抗(adcetris
tm
)、(bexxar
tm
)等。用于癌症治疗的合适抗体包含但不限于针对肿瘤相关抗原的抗体。此类抗原包含但不限于cd20、cd30、cd33、cd52、epcam、cea、gpa33、粘蛋白、tag-72、caix、psma、叶酸结合蛋白、神经节苷脂(例如,gd2、gd3、gm2等)、ley、vegf、vegfr、整合素α-v-β-3、整合素α-5-β-1、egfr、erbb2、erbb3、met、igf1r、epha3、trailr1、trailr2、rankl、pap、腱生蛋白等。
406042)、软海绵素b(nsc 609395)、秋水仙碱(nsc 757)、秋水仙碱衍生物(例如,nsc 33410)、尾海兔素(dolstatin)10(nsc 376128)、美登素(nsc 153858)、根瘤素(nsc 332598)、紫杉醇紫杉醇衍生物、多西他赛硫秋水仙碱(nsc 361792)、三苯甲基半胱氨酸、硫酸长春花碱、硫酸长春新碱、天然和合成埃博霉素,包含但不限于埃博霉素a、埃博霉素b、圆皮海绵内酯;雌莫司汀(estramustine)、诺考达唑(nocodazole)等。
[0412]
适于使用的激素调节剂和类固醇(包含合成类似物)包含但不限于肾上腺皮质类固醇,例如泼尼松(prednisone)、地塞米松(dexamethasone)等;雌激素和孕激素,例如己酸羟孕酮、醋酸甲羟孕酮、醋酸甲地孕酮、雌二醇、克罗米芬、他莫昔芬;等;以及肾上腺皮质抑制剂,例如氨基谷氨酰胺;1 7a-炔雌醇;己烯雌酚、睾酮、氟甲睾酮、丙酸屈莫司酮、睾酮内酯、甲基强的松龙、甲基睾酮、强的松龙、曲安西龙、氯三茴香烯、羟孕酮、氨基谷氨酰胺、雌莫司汀、醋酸甲羟孕酮、亮丙瑞林、氟他胺(屈洛尼尔(drogenil))、托瑞米芬(法乐通(fareston))和雌激素刺激增殖和分化,因此与雌激素受体结合的化合物用于阻断这种活性。皮质类固醇可以抑制t细胞增殖。
[0413]
其它化学治疗剂包含金属络合物,例如顺铂(cis-ddp)、卡铂等;尿素,例如羟基脲;以及肼,例如n-甲基肼;鬼臼毒素;拓扑异构酶抑制剂;丙卡巴肼;米托蒽醌;亚叶酸;喃氟啶(tegafur);等等。其它所关注抗增殖剂包含免疫抑制剂,例如霉酚酸、沙利度胺、去氧精胍菌素、氮杂孢菌素、来氟米特、咪唑立滨、氮杂螺环素(skf 105685);(zd 1839,4-(3-氯-4-氟苯基氨基)-7-甲氧基-6-(3-(4-吗啉基)丙氧基)喹唑啉);等等。
[0414]“紫杉烷”包含紫杉醇,以及任何活性紫杉烷衍生物或前药。“紫杉醇”(本文应理解为包含类似物、调配物和衍生物,如例如多西他赛、taxol
tm
、taxotere
tm
(多西他赛的调配物)、紫杉醇的10-脱乙酰基类似物、紫杉醇的3
′
n-去苯甲酰基-3
′
n-叔丁氧羰基类似物可以利用本领域技术人员已知的技术容易地制备(还参见wo 94/07882、wo 94/07881、wo 94/07880、wo 94/07876、wo 93/23555、wo 93/10076;美国专利第5,294,637号;第5,283,253号;第5,279,949号;第5,274,137号;第5,202,448号;第5,200,534号;第5,229,529号;以及ep 590,267),或者从各种商业来源获得,包含例如,密苏里州圣路易斯西格马化学公司(sigma chemical co.,st.louis,mo.)(来自短叶红豆杉(taxus brevifolia)的t7402;或来自云南红豆杉(taxus yannanensis)的t-1912)。
[0415]
紫杉醇应理解为不仅指常见的化学可用形式的紫杉醇,还指类似物和衍生物(例如,taxotere
tm
多西他赛,如上所述)和紫杉醇缀合物(例如,紫杉醇-peg、紫杉醇-葡聚糖或紫杉醇-木糖)。
[0416]
术语“紫杉烷”还包含多种已知衍生物,包含亲水衍生物和疏水衍生物两者。紫杉烷衍生物包含但不限于国际专利申请第wo 99/18113号中描述的半乳糖和甘露糖衍生物;wo 99/14209中描述的哌嗪和其它衍生物;wo 99/09021、wo 98/22451和美国专利第5,869,680号中描述的紫杉烷衍生物;wo 98/28288中描述的6-硫代衍生物;美国专利第5,821,263号中描述的亚磺酰胺衍生物;以及美国专利第5,415,869号中描述的紫杉醇衍生物。它进一步包含紫杉醇的前药,包含但不限于在wo 98/58927;wo 98/13059;和美国专利第5,824,701号中描述的那些。
[0417]
示例性实施例
[0418]
本公开提供了与her2结合的嵌合抗原受体(car)和与her2结合的条件活性car以
及包括编码此类car的核苷酸序列的核酸。本公开提供了经基因修饰以产生所述car的细胞以及用于制备此类细胞的方法。本公开的所述car可以用于也被提供的各种方法,所述方法包含用于执行如car疗法等过继性细胞疗法,所述car疗法例如针对癌症的car疗法。
[0419]
在此部分中提供了一些非限制性示例性方面和实施例。一方面,本文提供了一种编码用于结合her2的嵌合抗原受体(car)的分离的核酸,所述car包括:
[0420]
a)抗原特异性靶向区(astr),所述astr与her2蛋白特异性结合;
[0421]
b)跨膜结构域;以及
[0422]
c)细胞内激活结构域,其中所述跨膜结构域定位于所述astr与所述细胞内激活结构域之间,并且其中所述astr包括重链可变区,所述重链可变区包括具有序列hcdr1、hcdr2和hcdr3的三个互补决定区(cdr),其中:所述hcdr1序列是gfnikdtyih(seq id no:131);所述hcdr2序列是x1iyptngytx2yadsvkg(seq id no:137);并且所述hcdr3序列是wggdgfyamdy(seq id no:133);并且所述astr包括轻链可变区,所述轻链可变区包含具有序列lcdr1、lcdr2和lcdr3的三个cdr,其中:所述lcdr1序列是rasqdvntx3va(seq id no:142);所述lcdr2序列是sasflys(seq id no:135);并且所述lcdr3序列是qqx4yttppt(seq id no:143),其中x1是r或k,x2是r或e,x3是a或d,并且x4是h、d或e;其中所述astr中的x1、x2、x3和x4的组合不是分别为r、r、a和h。
[0423]
在紧接上述方面和本文所提供的任何其它方面的一些实施例中,astr中的x1、x2、x3和x4分别是r、r、a和h。在紧接上述方面和本文所提供的任何其它方面的说明性实施例中,所述astr中的x1、x2、x3和x4不是分别为r、r、a和h。在一些实施例中,重链可变区和轻链可变区的x1、x2、x3和x4可以分别是r、r、d和h(vl-a032d);分别是r、r、a和d(vl-h091d);分别是r、r、a和e(vl-h091e);分别是k、r、a和h(vh-r050k);或者分别是r、e、a和h(vh-r059e)。在一些实施例中,所述astr的其余部分包括与seq id no:119的除cdr之外的重链可变区(重链可变区的框架区)至少80%、85%、90%、95%、96%、97%、98%、99%或相同的重链可变区以及与seq id no:122的除cdr之外的轻链可变区(轻链可变区的框架区)至少80%、85%、90%、95%、96%、97%、98%、99%或相同的轻链可变区。seq id no:119中的fr包含残基1-25、残基36-49、残基67-98和残基110-120。seq id no:122的fr包含残基1-23、残基35-49、残基57-88和残基98-107。
[0424]
另一方面,本文提供了一种用于结合her2的嵌合抗原受体(car),所述car包括:
[0425]
a)抗原特异性靶向区(astr),所述astr与her2蛋白特异性结合;
[0426]
b)跨膜结构域;以及
[0427]
c)细胞内激活结构域,其中所述跨膜结构域定位于所述astr与所述细胞内激活结构域之间,并且其中所述astr包括重链可变区,所述重链可变区包括具有序列hcdr1、hcdr2和hcdr3的三个互补决定区(cdr),其中:所述hcdr1序列是gfnikdtyih(seq id no:131);所述hcdr2序列是x1iyptngytx2yadsvkg(seq id no:137);并且所述hcdr3序列是wggdgfyamdy(seq id no:133);并且所述astr包括轻链可变区,所述轻链可变区包含具有序列lcdr1、lcdr2和lcdr3的三个cdr,其中:所述lcdr1序列是rasqdvntx3va(seq id no:142);所述lcdr2序列是sasflys(seq id no:135);并且所述lcdr3序列是qqx4yttppt(seq id no:143),其中x1是r或k,x2是r或e,x3是a或d,并且x4是h、d或e;其中所述astr中的x1、x2、x3和x4的组合不是分别为r、r、a和h。
[0428]
在紧接上述方面和本文所提供的任何其它方面的一些实施例中,astr中的x1、x2、x3和x4分别是r、r、a和h。在紧接上述方面和本文所提供的任何其它方面的说明性实施例中,所述astr中的,x1、x2、x3和x4不是分别为r、r、a和h。在一些实施例中,重链可变区和轻链可变区的x1、x2、x3和x4可以分别是r、r、d和h(vl-a032d);分别是r、r、a和d(vl-h091d);分别是r、r、a和e(vl-h091e);分别是k、r、a和h(vh-r050k);或者分别是r、e、a和h(vh-r059e)。在一些实施例中,所述astr的其余部分包括与seq id no:119的除cdr之外的重链可变区(重链可变区的框架区)至少80%、85%、90%、95%、96%、97%、98%、99%或相同的重链可变区以及与seq id no:122的除cdr之外的轻链可变区(轻链可变区的框架区)至少80%、85%、90%、95%、96%、97%、98%、99%或相同的轻链可变区。
[0429]
在说明性实施例中,上述段落中的各方面中提供的任何抗her2 car的astr在重链可变区与轻链可变区之间包括5到50(例如,10到40、15到30)个氨基酸连接子。在一些实施例中,本文中的任何方面或实施例的astr具有各自分别与seq id no:119和seq id no:122至少70%、80%、85%、90%、95%、96%、97%、98%或99%相同的重链可变区序列和轻链可变区序列,并且包括作为k的x1、作为e的x2、作为d的x3或作为d或e的x4中的一者、两者、三者或所有四者。在一些实施例中,astr具有各自分别与seq id no:119和seq id no:122相同的重链可变区序列和轻链可变区序列,除了作为k的x1、作为e的x2、作为d的x3或作为d或e的x4中的一者、两者、三者或所有四者。
[0430]
另一方面,本文提供了一种编码用于结合her2的嵌合抗原受体(car)的分离的核酸,所述car包括:
[0431]
a)抗原特异性靶向区(astr),所述astr与her2蛋白特异性结合;
[0432]
b)跨膜结构域;以及
[0433]
c)细胞内激活结构域,其中所述跨膜结构域定位于所述astr与所述细胞内激活结构域之间,并且其中所述astr包括重链可变区,所述重链可变区包括具有序列hcdr1、hcdr2和hcdr3的三个互补决定区(cdr),其中:所述hcdr1序列是gfx1ikdtyih(seq id no:138);所述hcdr2序列是rix2ptx3x4yx5ryadsvkg(seq id no:139);并且所述hcdr3序列是wggdgfyx6mdy(seq id no:140);并且所述astr可包含轻链可变区,所述轻链可变区包含三个cdr,所述cdr具有序列lcdr1、lcdr2和lcdr3,其中:所述lcdr1序列是rasqdvntx7va(seq id no:142);所述lcdr2序列是sasflys(seq id no:135);并且所述lcdr3序列是qqx8yttppt(seq id no:143),其中x1是n或w;x2是y、d或k;x3是n或a;x4是g或k;x5是t或d;x6是a或e;x7是a或d;并且x8是h、d或e;其中所述astr中的所述x1、x2、x3、x4、x5、x6、x7和x8的组合不是分别为n、y、n、g、t、a、a和h。在一些实施例中,所述astr的其余部分包括与seq id no:119的除cdr之外的重链可变区(重链可变区的框架区)至少80%、85%、90%、95%、96%、97%、98%、99%或相同的重链可变区以及与seq id no:122的除cdr之外的轻链可变区(轻链可变区的框架区)至少80%、85%、90%、95%、96%、97%、98%、99%或相同的轻链可变区。在一些实施例中,所述astr可以包含如seq id no:119中编号的重链可变区突变s119e。在一些实施例中,所述astr中的所述x1、x2、x3、x4、x5、x6、x7和x8的组合分别是n、y、n、g、t、a、a和h,并且所述astr包含如seq id no:119中编号的重链突变s119e。
[0434]
另一方面,本文提供了一种用于结合her2的嵌合抗原受体(car),所述car包括:
[0435]
a)抗原特异性靶向区(astr),所述astr与her2蛋白特异性结合;
是r或e,x8是a或e,x9是a或d并且x
10
是h、d或e;其中所述astr中的所述x1、x2、x3、x4、x5、x6、x7、x8、x9和x
10
的组合不是分别为n、r、y、n、g、t、r、a、a和h。在一些实施例中,所述astr的其余部分包括与seq id no:119的除cdr之外的重链可变区(重链可变区的框架区)至少80%、85%、90%、95%、96%、97%、98%、99%或相同的重链可变区以及与seq id no:122的除cdr之外的轻链可变区(轻链可变区的框架区)至少80%、85%、90%、95%、96%、97%、98%、99%或相同的轻链可变区。在一些实施例中,所述astr可以包含如seq id no:119中编号的重链突变s119e。在一些实施例中,所述astr中的所述x1、x2、x3、x4、x5、x6、x7、x8、x9和x
10
的组合分别是n、r、y、n、g、t、r、a、a和h,并且所述astr包含如seq id no:119中编号的重链突变s119e。
[0443]
另一方面,本文提供了一种用于结合her2的嵌合抗原受体(car),所述car包括:
[0444]
a)抗原特异性靶向区(astr),所述astr与her2蛋白特异性结合;
[0445]
b)跨膜结构域;以及
[0446]
c)细胞内激活结构域,其中所述跨膜结构域定位于所述astr与所述细胞内激活结构域之间,并且其中所述astr包括重链可变区,所述重链可变区包括具有序列hcdr1、hcdr2和hcdr3的三个互补决定区(cdr),其中:所述hcdr1序列是gfx1ikdtyih(seq id no:138);所述hcdr2序列是x2ix3ptx4x5yx6x7yadsvkg(seq id no:141);并且所述hcdr3序列是wggdgfyx8mdy(seq id no:140);并且所述astr可包含轻链可变区,所述轻链可变区包含三个cdr,所述cdr具有序列lcdr1、lcdr2和lcdr3,其中:所述lcdr1 rasqdvntx9va(seq id no:142);所述lcdr2序列是sasflys(seq id no:135);并且所述lcdr3序列是qqx10yttppt(seq id no:143),其中x1是n或w,x2是r或k,x3是y、d或k,x4是n或a,x5是g或k,x6是t或d,x7是r或e,x8是a或e,x9是a或d并且x
10
是h、d或e;其中所述astr中的所述x1、x2、x3、x4、x5、x6、x7、x8、x9和x
10
的组合不是分别为n、r、y、n、g、t、r、a、a和h。在一些实施例中,所述astr的其余部分包括与seq id no:119的除cdr之外的重链可变区(重链可变区的框架区)至少80%、85%、90%、95%、96%、97%、98%、99%或相同的重链可变区以及与seq id no:122的除cdr之外的轻链可变区(轻链可变区的框架区)至少80%、85%、90%、95%、96%、97%、98%、99%或相同的轻链可变区。在一些实施例中,所述astr可以包含如seq id no:119中编号的重链突变s119e。在一些实施例中,所述astr中的所述x1、x2、x3、x4、x5、x6、x7、x8、x9和x
10
的组合分别是n、r、y、n、g、t、r、a、a和h,并且所述astr包含如seq id no:119中编号的重链突变s119e。
[0447]
在说明性实施例中,上述段落中的各方面中提供的任何抗her2 car的astr在重链可变区与轻链可变区之间包括5到50(例如,10到40、15到30)个氨基酸连接子。在一些实施例中,本文中的任何方面或实施例的astr具有各自分别与seq id no:119和seq id no:122至少70%、80%、85%、90%、95%、96%、97%、98%或99%相同的重链可变区序列和轻链可变区序列,并且分别包括所述astr中的位置x1、x2、x3、x4、x5、x6、x7、x8、x9、x
10
处的n、r、y、n、g、t、r、a、a和h中的一者、两者、三者、四者、五者、六者、七者、八者、九者或十者,并且所述astr任选地包含如seq id no:119中编号的重链突变s119e。在一些实施例中,所述astr分别具有各自分别与seq id no:119和seq id no:122相同的重链可变区序列和轻链可变区序列,除了所述astr中的位置x1、x2、x3、x4、x5、x6、x7、x8、x9、x
10
处的n、r、y、n、g、t、r、a、a和h中的一者、两者、三者、四者、五者、六者、七者、八者、九者或十者。
[0448]
在本文所提供的包含或任选地包含car、递送悬浮液或编码car的分离的核酸的各方面和实施例中的任何方面和实施例中,所述astr可以包含vl-a032d、vl-h091d、vl-h091e、vh-r050k或vh-r059e以及通常由5到50个氨基酸连接子分开的重链可变区和轻链可变区,所述重链可变区和所述轻链可变区具有与以下中的任一者中的任选地在同一n到c定向上的重链可变区和轻链可变区的组合至少70%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的序列:
[0449]
a.实例2中的astr(seq id no:153-248)中的任一个,
[0450]
b.实例2中测试条件活性的astr(seq id no:157-248)中的任一个,
[0451]
c.实例2的表2中的astr(seq id no:153-236)中的任一个,
[0452]
d.实例2的表3中的astr(seq id no:154、156、159-162、172-173、175-176、199或224)中的任一个,或者
[0453]
e.实例2的表4中的astr(seq id no:157-178)中的任一个。
[0454]
在本文所提供的包含或任选地包含car、递送悬浮液或编码car的分离的核酸的各方面和实施例中的任何方面和实施例中,所述astr可以包含vl-a032d、vl-h091d、vl-h091e、vh-r050k或vh-r059e以及astr,所述astr具有与以下中的任一者中的整个astr序列至少70%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的序列:
[0455]
a.实例2中的astr(seq id no:153-248)中的任一个,
[0456]
b.实例2中测试条件活性的astr(seq id no:157-248)中的任一个,
[0457]
c.实例2的表2中的astr(seq id no:153-236)中的任一个,
[0458]
d.实例2的表3中的astr(seq id no:154、156、159-162、172-173、175-176、199或224)中的任一个,或者
[0459]
e.实例2的表4中的astr(seq id no:157-178)中的任一个。
[0460]
在一些实施例中,本文所提供的astr中的任一个包括保守取代。在一些实施例中,astr可以包含与seq id no:119至少70%、80%、85%、90%、95%、96%、97%、98%或99%相同的序列并且包含以下突变(相对于seq id no:119编号)中的一种或多种突变:y033w、r059k、r059v、r059l、r059i、w099f、w099y、d102e、d102k、d102r、d102h、d102g、d102s、d102t、d102n、d102q、d102a、d102v、d102l、d102i、d102m、d102p、d102f、d102w、d102y、g103s、g103t、g103a、g103l、y100t、y100f、t102e、t102k、t102r、t102g、t102s、t102c、t102q、t102a、t102v、t102l、t102i、t102m、t102w、t102y、f104r、f104v、f104l、f104i、f104m、f104p、f104w、f104y、y105t、y105f、y109e、y109k、y109r、y109g、y109s、y109t、y109c、y109q、y109a、y109v、y109l、y109i、y109m或y109w,所述突变中的每种突变在噬菌体筛选中鉴定(gerstner等人,2002,《分子生物学杂志》321(5):851-862)。在一些实施例中,astr可以包含与seq id no:119至少70%、80%、85%、90%、95%、96%、97%、98%或99%相同的序列并且包含以下突变(相对于seqid no:119编号的)中的一种或多种突变:a072r、t074d、a079l、s097a或y109v(carter等人,1992,《美国国家科学院院刊》89:4285-9)。在一些实施例中,astr可以包含与seq id no:119至少70%、80%、85%、90%、95%、96%、97%、98%或99%相同的以下氨基酸位于seq id no:119的残基72、74、79、97和109处的序列(这些氨基酸组合公开于carter等人(1992,《美国国家科学院院刊》89:4285-9)的相应4d5变体的重链中):分别为r、d、l、a和v(4d5-1);分别为a、d、l、a和v(4d5-2);分别为a、t、a、s和v
(4d5-3);分别为a、t、l、s和v(4d5-4);分别为a、t、a、s和v(4d5-5);分别为a、t、a、s和v(4d5-6);分别为a、t、a、s和y(4d5-7);或者分别为a、t、a、s和y(4d5-8)。
[0461]
在一些实施例中,astr可以包含与seq id no:122至少70%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的序列。在一些实施例中,astr可以包含与seq id no:122至少70%、80%、85%、90%、95%、96%、97%、98%或99%相同的序列并且包含以下突变(相对于seq id no:122编号的)中的一种或多种突变:n030g、n030s、n030l、n030i、y049d、y049e、y049s、y049t、y049c、y049q、y049a、y049v、y049l、y049i、y049m、y049f、y049w、y049y、f053k、f053r、f053g、f053s、f053t、f053a、f053v、f053l、f053i、f053m、f053w、f053y、y055d、y055r、y055h、y055s、y055t、y055a、y055v、y055l、y055f、y055w、h091n、h091i、h091f、h091w、h091y、y092g、y092s、y092n、y092m、y092f、y092w、t094s、t094n、t094l、t094m、t094f或t094w,所述突变中的每种突变在噬菌体筛选中鉴定(gerstner等人,2002,《分子生物学杂志》321(5):851-862)。在一些实施例中,astr可以包含与seq id no:122至少70%、80%、85%、90%、95%、96%、97%、98%或99%相同的序列并且包含以下突变(相对于seq id no:122编号的)中的一种或多种突变:y055e或r066g,并且在说明性实施例中y055e,如本文中的实例中所公开的(carter等人,1992,《美国国家科学院院刊》89:4285-9)。在说明性实施例中,astr可以是经修饰的astr并且包含与seq id no:122至少70%、80%、85%、90%、95%、96%、97%、98%或99%相同的具有seq id no:122的残基55和66处的以下氨基酸的序列(这些氨基酸组合公开于carter等人(1992,《美国国家科学院院刊》89:4285-9)的相应4d5变体的vl中):分别为e和g(4d5-1、4d5-2和4d5-3);分别为e和r(4d5-4、4d5-5和4d5-7);以及分别为y和r(4d5-6和4d5-8)。
[0462]
在一些实施例中,astr可以包含实例2中的任何一种astr的序列(seq id no:153-248)。在一些实施例中,astr可以包含在实例2中测试条件活性的任何一种astr的序列(seq id no:157-248)。在一些实施例中,astr可以包含实例2的表2中的任何一种astr的序列(seq id no:153-236)。在一些实施例中,astr可以包含实例2的表3中的任何一种astr的序列(seq id no:154、156、159-162、172-173、175-176、199或224)。在一些实施例中,astr可以包含实例2的表4中的任何一种astr的序列(seq id no:157-178)。
[0463]
在一些实施例中,astr可以包含vh(seq id no:119和123-125)和vl(seq id no:122和126-130)的组合中的具有另一条链的vh或vln端的任何组合,其中所述组合不是vh-1(seq id no:119)与vl-1(seq id no:122)的组合中的任何组合。在一些实施例中,astr可以包含表2中的vh(seq id no:119和123-125)和vl(seq id no:122和126-130)的组合中的具有如表2中所示的vh或vln端的任何组合,其中所述组合不是vh-1(seq id no:119)与vl-1(seq id no:122)的组合中的任何组合。在这些实施例中的任何实施例中,vh和vl可以与本文别处所提供的任何连接子连接。
[0464]
如本文中的car方面所提供的,car是包含astr、跨膜结构域和细胞内激活结构域的单一全长融合多肽。在其它替代性方面中,如本文所讨论的,此类car可以是包括两种或更多种多肽的分裂car。
[0465]
在本文所提供的包含或任选地包含car或编码car的分离的核酸的各方面和实施例中的任何方面和实施例中,car的astr在某些说明性实施例中不包含seq id no:119和122的两个序列。
[0466]
在本文所提供的包含或任选地包含car或编码car的分离的核酸的各方面和实施例中的任何方面和实施例中,car的astr可以与包括seq id no:119的抗体重链可变区和seq id no:122的抗体轻链可变区的单链可变抗体片段结合于her2的相同表位。
[0467]
在本文所提供的包含或任选地包含car或编码car的分离的核酸的各方面和实施例中的任何方面和实施例中,astr可以是单链抗体、fab片段、fab
′
片段、(fab
′
)2片段、fv片段和二价单链抗体或双功能抗体。在一些实施例中,astr可以是包括重链和轻链的单链可变片段。
[0468]
在本文所提供的包含或任选地包含具有包含重链和轻链的astr的car或编码car的分离的核酸的各方面和实施例中的任何方面和实施例中,所述重链和所述轻链可以由连接子分开。在一些实施例中,连接子的长度可以介于5个与100个氨基酸之间,例如长度介于5个与50个氨基酸之间、长度介于10个与40个氨基酸之间或长度介于10个与30个氨基酸之间。在一些实施例中,连接子可以是seq id no:1、63-71、144、152或249中的任一个。
[0469]
在本文所提供的包含或任选地包含具有包含重链和轻链的astr的car或编码car的分离的核酸的各方面和实施例中的任何方面和实施例中,所述重链可以在所述轻链的n端或所述轻链可以在所述重链的n端。
[0470]
在本文所提供的包含或任选地包含car或编码car的分离的核酸的各方面和实施例中的任何方面和实施例中,car从氨基端到羧基端可以包括astr、茎结构域、跨膜结构域、任选的共刺激结构域和细胞内激活结构域。在一些实施例中,编码car的分离的核酸可以包含识别结构域。在一些实施例中,识别结构域在细胞内激活结构域的c端。在一些实施例中,茎结构域和跨膜结构域是茎和跨膜结构域的组合。
[0471]
在本文所提供的包含或任选地包含car或在编码car的分离的核酸中编码的各方面和实施例中的任何方面和实施例中,与在非tme中出现的不同ph相比,具有astr的重链和轻链的抗体或其片段在tme中的ph下对her2蛋白具有更高的结合亲和力。此类car可以被称为条件活性的,并且在本文中也被称为cab-car。在一些实施例中,当car结合her2时,可以激活表达car的t细胞和/或nk细胞。
[0472]
在一些实施例中,本文所提供的car可以是与非tme中的ph例如ph 7.2、7.3、7.4或7.5相比在tme中的ph例如ph 6.5、6.6、6.7、6.8或6.9下抗her2 car活性增加的抗her2 cab-car。在一些实施例中,增加的抗her2 car活性可以在与her2表达性靶细胞一起温育时激活t细胞。在一些实施例中,对t细胞的激活可以通过分析以下中的一种或多种来确定:t细胞对t细胞激活生物标志物的表达增加、t细胞进行的细胞因子产生(细胞内或分泌)、t细胞进行的增殖和t细胞进行的靶细胞杀伤,其中所述car活性在测定中测量,其中her2表达性靶细胞和被基因修饰为表达本文所提供的任何car的细胞在测定培养基中一起温育持续用于进行测定的有效时间。在一些实施例中,激活是通过分析t细胞对t细胞激活生物标志物的表达增加、t细胞进行的细胞因子释放和t细胞进行的增殖中的一种或多种来确定的。在一些实施例中,t细胞激活标志物,如cd69和cd107a的表达增加,可以通过流式细胞术测定。在一些实施例中,可以使用本领域已知的方法测定由激活的t细胞产生的细胞因子,如ifnγ和il-2。透化细胞的流式细胞术可以用于检测细胞内细胞因子。elisa或测量样品中的多种分析物的免疫测定法,如r&d系统公司(r&d systems)提供的luminex测定法,可以用于检测分泌的细胞因子。用于测定t细胞激活标志物表达增加和细胞因子产生的代表性方
法在实例3中示出。在一些实施例中,可以使用本领域已知的方法,通过细胞示踪染料稀释监测不同代的增殖细胞来测定t细胞的增殖。在一些方法中,每一代细胞在流式细胞仪直方图上显示为不同的峰。在一些实施例中,celltrace violet试剂盒可以用于测定t细胞增殖,如实例3所示。在一些实施例中,t细胞对靶细胞的杀伤可以通过荧光素酶测定或体外实时杀伤测定进行分析,如实例2所示。在一些实施例中,如本文别处所提供的,可以使用统计测试来比较一个ph下的cab-car与另一个ph下的cab-car之间或cab-car与基准抗体之间的差异。在一些实施例中,可以使用体内测定检测和分析cab-car活性。例如,可以通过将经基因修饰的car-t和/或nk细胞施用于患有或将患有表达her-2的肿瘤的哺乳动物如小鼠并且分析在施用之后肿瘤随时间推移的大小来进行此类体内测定。在此类体内测定的另外的实施例中,可以分析定位于tme之外的her2表达性细胞的杀伤。与定位于tme之外(如肝脏中)的表达her2细胞相比,这些体内测定中的cab-car将优先杀死tme中的her2表达性细胞。i,例如各自在第一和第二ph下。
[0473]
上文所描述的体外和体内t细胞激活测定中使用的靶细胞可以天然表达her2,或者它们可以通过强制表达转基因来表达her2。天然表达her2并且可以用于这些测定的代表性细胞系包含mcf-7、sk-ov-3、bt474、nci-87、sk-br-3、katoiii、ags,snu-1、snu-5和hs 746t。在一些实施例中,靶细胞被转导为表达her2。在一些实施例中,被转导为表达her2的靶细胞表达全长人her2。在一些实施例中,被转导为表达her2的靶细胞表达截短的和/或融合蛋白,所述截短的和/或融合蛋白包括人her2的胞外结构域或其包括被astr识别的her2表位的片段。
[0474]
在一些实施例中,与在具有相似ph依赖性的非tme中出现的不同ph相比,本文所提供的t细胞和/或nk细胞在tme中的ph下激活更多。在一些实施例中,t细胞和/或nk细胞激活可以包含对表达her2的细胞杀伤增加、细胞因子分泌增加和/或增殖增加。在一些实施例中,tme中的ph可以在5.0到6.8的范围内,并且非tme的ph可以在7.0到7.6的范围内,例如tme中的ph可以在6.5到6.8的范围内并且非tme的ph可以在7.2到7.5的范围内。在一些实施例中,astr可以是具有相比于在ph为7.4时在ph为6.7时与her2的结合亲和力可以更高的astr的重链和轻链的抗体或其片段。在一些实施例中,具有astr的重链和轻链的抗体或抗体片段在tme中的ph下对her2蛋白的结合亲和力与在非tme中的不同ph下对her2蛋白的结合亲和力的比率为至少约1.5∶1、至少约2∶1、至少约3∶1、至少约4∶1、至少约5∶1、至少约6∶1、至少约7∶1、至少约8∶1、至少约9∶1、至少约10∶1、至少约20∶1、至少约30∶1、至少约50∶1、至少约70∶1或至少约100∶1。在一些实施例中,
[0475]
在本文所提供的包含或任选地包含car或编码car的分离的核酸的各方面和实施例中的任何方面和实施例中,car的astr可以是人抗体或人源化抗体。在一些实施例中,astr可以包含免疫球蛋白重链可变区,所述免疫球蛋白重链可变区包含与seq id no:119的整个可变区或框架区序列至少70%、75%、80%、85%、90%、95%、98%或99%相同的氨基酸序列。在一些实施例中,astr可以包含免疫球蛋白轻链可变区,所述免疫球蛋白轻链可变区包含与seq id no:122的整个可变区或框架区序列至少70%、75%、80%、85%、90%、95%、98%或99%相同的氨基酸序列。在本文所公开的实施例中的任何实施例中,基于seq id no:119中的编号,astr可以在重链的位置119处包含s到e突变。
[0476]
在本文所提供的包含或任选地包含car或编码car的分离的核酸的各方面和实施
例中的任何方面和实施例中,car可以包含信号肽,如本文别处所公开的。在一些实施例中,所述信号肽可以是seq id no:72。
[0477]
在本文所提供的包含或任选地包含car或编码car的分离的核酸的方面和实施例中的任何方面和实施例中,car可以包含茎结构域。在一些实施例中,茎结构域可以是seq id no:3-16中的任一个,如本文别处所公开的。在本文所提供的包含或任选地包含car或编码car的分离的核酸的各方面和实施例中的任何方面和实施例中,car可以包含跨膜结构域或组合的茎和跨膜结构域。在一些实施例中,跨膜结构域或组合的茎和跨膜结构域可以是cd8αtm(seq id no:17);b)cd8βtm(seq id no:18);c)cd4 tm(seq id no:19);d)cd3z tm(seq id no:20);e)cd28 tm(seq id no:21);f)cd134(ox40)tm:(seq id no:22);g)cd7 tm(seq id no:23);h)cd8茎和tm(seq id no:24);以及i)cd28茎和tm(seq id no:25),如本文别处所公开的。
[0478]
在本文所提供的包含或任选地包含car或编码car的分离的核酸的各方面和实施例中的任何方面和实施例中,细胞内激活结构域与如本文别处所公开的cd3z、cd3d、cd3e、cd3g、cd79a、cd79b、dap12、fcerlg、fcgr2a、fcgr2c、dap10/cd28或zap70可以具有至少80%、90%或95%或可以具有100%序列同一性。在一些实施例中,细胞内结构域与seq id no:26-52可以具有至少80%、90%或95%或可以具有100%序列同一性。
[0479]
在本文所提供的包含或任选地包含car或编码car的分离的核酸的各方面和实施例中的方面和实施例中,car可以包含共刺激结构域。在一些实施例中,共刺激结构域可以包含与至少10、15、20、25、30、35、40、45或50个氨基酸的延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域,或以下各项的共刺激结构域:4-1bb(cd137)、b7-hcdr3、cd2、cd7、cd27、cd28、因lck结合而缺失的cd28(icδ)、cd30、cd40、icos、ox40、btla、gitr、hvem、icam-1、lfa-1(cd11a/cd18)、light、nkg2c、b7-h3、与cd83特异性结合的配体、cds、baffr、slamf7、nkp80(klrf1)、cd4、cd8α、cd8β、il2rβ、il2rγ、il7rα、itga4、itga6、itgad、itgae、itgal、itgam、itgax、itgb1、itgb2、itgb7、ia4、vla1、vla-6、c49f、cd11a、cd11b、cd11c、cd11d、cd18、cd19、cd29、cd49a、cd49d、cd69、cd84、cd96(tactile)、cd103、cd160(by55)、crlf2、csf2rb、csf2ra、csf3r、epor、lfa-1、tnfr2、trance/rankl、dnam1(cd226)、fcgra2、ghr、slamf4(c244、2b4)、ceacam1、crtam、ly9(cd229)、pd-1、psgl1、c100(sema4d)、slamf6(ntb-a、ly108)、slam(slamf1、cd150、ipo-3)、blame(slamf8)、selplg(cd162)、ltbr、lat、gads、pag/cbp、slp-76、tilr2、tilr4、tilr7、tilr9、fc受体γ链、fc受体ε链、ifnar1、ifnar2、ifngr1、ifngr2、ifnlr1、il1r1、il1rap、il1rl1、il1rl2、il2ra、il2rb、il2rg、il3ra、il4r、il5ra、il6r、il6st、il9r、il10ra、il10rb、il11ra、il12rb1、il12rb2、il13ra1、il13ra2、il15ra、il17ra、il17rb、il17rc、il17rd、il17re、il18r1、il18rap、il20ra、il20rb、il21r、il22ra1、il23r、il27ra、il31ra、lepr、lifr、lmp1、mpl、myd88、osmr或prlr或其功能突变体和/或片段。在一些实施例中,共刺激结构域可以包含与seq id no:53-62或84中的至少10个、15个、20个、25个、30个、35个、40个、45个或50个氨基酸或所有氨基酸的延伸段具有至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的结构域。
[0480]
在本文所提供的包含或任选地包含car或编码car的分离的核酸的各方面和实施例中的任何方面和实施例中,核酸可以编码识别结构域,例如etag,并且编码识别结构域的
核酸可以通过核糖体跳跃序列与编码car的核酸分开,如本文别处所公开的。在一些实施例中,核糖体跳跃序列可以是t2a(2a-1)。
[0481]
在本文所提供的包含或任选地包含car或编码car的分离的核酸的各方面和实施例中的任何方面和实施例中,car可以进一步包含识别结构域。在一些实施例中,所述识别结构域可以由监管机构批准的抗体识别。在一些实施例中,所述识别结构域可以是egfr的至少20个连续氨基酸。
[0482]
在本文所提供的包含编码car的分离的核酸的各方面和实施例中的任何方面和实施例的说明性实施例中,核酸被密码子优化以表达人受试者。因此,在本文所提供的包含编码car的分离的核酸的各方面和实施例中的任何方面和实施例的某些实施例中,
[0483]
a.x1、x2、x3和x4的所述组合分别是r、r、d和h(a032d),重链可变区肽由核酸序列seq id no:145编码,并且所述轻链可变区由核酸序列seq id no:149编码;
[0484]
b.x1、x2、x3和x4的所述组合分别是r、r、a和d(h091d),重链可变区肽由核酸序列seq id no:145编码,并且所述轻链可变区由核酸序列seq id no:150编码;或者
[0485]
c.x1、x2、x3和x4的所述组合分别是r、r、a和e(h091e),重链可变区肽由核酸序列seq id no:145编码,并且所述轻链可变区由核酸序列seq id no:151编码。
[0486]
在本文所提供的包含编码car的分离的核酸的各方面和实施例中的任何方面和实施例的某些实施例中,
[0487]
a.所述x1、x2、x3和x4的组合分别是k、r、a和h(r050k),轻链可变区由seq id no:148编码并且抗体重链可变区由核酸序列seq id no:146编码;或者
[0488]
b.所述x1、x2、x3和x4的组合分别是r、e、a和h(r059e),轻链可变区由seq id no:148编码,并且抗体重链可变区由核酸序列seq id no:147编码。
[0489]
另一方面,本文提供了一种分离的重组t细胞或nk细胞,其包含基因组,所述基因组包含与在t细胞和/或nk细胞中具有活性的启动子可操作地连接的一个或多个核酸序列,其中所述一个或多个核酸序列包含编码上述实施例中的任何实施例的car的分离的核酸。在一些实施例中,car可以与启动子可操作地连接。在一些实施例中,所述编码所述car的核酸序列可以进一步编码识别结构域,其中编码所述识别结构域的核酸通过上文所公开的核糖体跳跃序列与编码所述car的核酸分开。
[0490]
另一方面,本文提供了一种用于激活t细胞或nk细胞的方法,所述方法包含使靶哺乳动物细胞与所述t细胞和/或nk细胞在ph小于7.0的微环境中接触,其中所述靶哺乳动物细胞表达her2,并且其中所述t细胞或nk细胞表达上述实施例中的任何实施例的car。根据权利要求28所述的方法,其中所述微环境的ph介于6.5与6.8之间。在一些实施例中,激活包含细胞因子的表达和/或产生和/或分泌增加和/或增殖增加。在一些实施例中,与接触之前t细胞或nk细胞表达的il-2或ifn-γ的表达相比,t细胞或nk细胞可以使il-2或ifn-γ的表达增加例如至少1.5倍、2倍、3倍、4倍、5倍或10倍。在一些实施例中,与接触之前t细胞或nk细胞的细胞毒性活性相比,t细胞或nk细胞的细胞毒性活性可以增加至少1.5倍、2倍、3倍、4倍、5倍或10倍。在一些实施例中,靶哺乳动物细胞可以在t细胞或nk细胞激活之后裂解。在一些实施例中,所述方法进一步包含在接触t细胞或nk细胞之前,用其基因组中的编码car的无复制能力的重组逆转录病毒颗粒转导所述t细胞或nk细胞,以基因修饰所述t细胞或nk细胞。在一些实施例中,所述转导可以离体执行。在一些实施例中,所述方法进一步包含将
微环境的ph增加到ph 7.0或以上,由此降低t细胞或nk细胞的激活。在一些实施例中,微环境可以是可以位于人受试者中的肿瘤。在一些实施例中,微环境可以在体外或离体。在一些实施例中,在所述方法中激活的细胞可以是t细胞。在其它实施例中,在所述方法中激活的细胞可以是nk细胞。
[0491]
另一方面,本文提供了一种在哺乳动物中提供抗肿瘤免疫的方法,所述方法包含向所述哺乳动物施用有效量的经基因修饰以表达本文所公开的实施例中的任何实施例的car的细胞,其中所述抗肿瘤免疫提供针对表达her2的肿瘤的抗肿瘤免疫,由此在所述哺乳动物中提供抗肿瘤免疫。在又另一方面,本文提供了一种在其基因组中编码本文所提供的任何car的任何无复制能力的重组逆转录病毒颗粒在制造用于在本文中的哺乳动物中提供抗肿瘤免疫的试剂盒中的用途。在说明性实施例中,哺乳动物是人。在说明性实施例中,哺乳动物患有her2阳性癌症。不受理论限制,由经car修饰的细胞引发的抗肿瘤免疫应答可以是主动或被动免疫应答。car介导的免疫应答可以是过继性免疫疗法方法的一部分,其中经car修饰的细胞诱导对car中的astr具有特异性的免疫应答。例如,表达本文所提供的具有抗her2 astr的car的细胞引发特异性针对表达her2的细胞的免疫应答。
[0492]
另一方面,本文提供了一种治疗患有与her2表达升高相关的疾病、病症或病状的哺乳动物的方法,所述方法包含向所述哺乳动物施用有效量的经遗传修饰以表达本文所公开的实施例中的任何实施例的car的细胞,由此治疗所述哺乳动物。在又另一方面,本文提供了一种在其基因组中编码本文所提供的任何car的任何无复制能力的重组逆转录病毒颗粒在制造用于治疗患有与her2表达升高相关的疾病、病症或病状的哺乳动物的试剂盒中的用途。在说明性实施例中,哺乳动物是人。在说明性实施例中,所述疾病是癌症并且所述哺乳动物患有her2阳性癌症。在一些实施例中,t细胞通过本文所提供的任何方法进行基因修饰。
[0493]
另一方面,本文提供了一种治疗患有癌症(例如,乳腺癌、胃癌、食道癌、卵巢癌、子宫内膜癌、肺癌或膀胱尿路上皮癌)的哺乳动物的方法,所述方法包含向所述哺乳动物施用经基因修饰以表达本文公开的实施例中的任何实施例的car的t细胞。在一些实施例中,所述方法包括治疗患有早期乳腺癌、转移性乳腺癌或胃癌的哺乳动物。在又另一方面,本文提供了一种在其基因组中编码本文所提供的任何car的任何无复制能力的重组逆转录病毒颗粒在制造用于治疗患有乳腺癌、胃癌、食道癌、卵巢癌、子宫内膜癌、肺癌或膀胱尿路上皮癌的哺乳动物的试剂盒中的用途。在说明性实施例中,哺乳动物是人。在说明性实施例中,哺乳动物(例如,人)受试者患有复发性癌症,包含her2+实体瘤,或患有对先前疗法是难治的癌症。在说明性实施例中,癌症是乳腺癌,例如早期乳腺癌。在一些实施例中,乳腺癌是尚未扩散到淋巴结的早期乳腺癌,即淋巴结阴性疾病。在一些实施例中,淋巴结阴性疾病必须是雌激素受体/孕激素受体(er/pr)阴性的或具有至少一项高风险特征,其中高风险特征是肿瘤大小为至少2cm,受试者35岁或以上或肿瘤等级为2或3。在说明性实施例中,所述癌症是her2阳性癌症。在一些实施例中,t细胞通过本文所提供的任何方法进行基因修饰。
[0494]
另一方面,本文提供了一种在哺乳动物,在说明性实施例中,人中产生由经基因修饰的t细胞构成的持久群体的方法,所述方法包含向哺乳动物(例如,人)施用经基因修饰以表达本文所公开的实施例中的任何实施例的car的t细胞,其中所述由经基因修饰的t细胞构成的持久群体在施用之后在所述哺乳动物中持续至少7、14、21或28天或1、2、3、4、5、6、7、
8、9、10、11或12个月或1、2、3、4或5年。在又另一实施例中,本文提供了一种在其基因组中编码本文所提供的任何car的任何无复制能力的重组逆转录病毒颗粒在制造用于在哺乳动物中产生由经基因修饰的t细胞构成的持久群体的试剂盒中的用途,其中所述由经基因修饰的t细胞构成的持久群体在施用之后在所述哺乳动物中持续至少7、14、21或28天或1、2、3、4、5、6、7、8、9、10、11或12个月或1、2、3、4或5年。在一些实施例中,所述由经基因修饰的t细胞构成的持久群体包括选自由以下组成的组的至少一个细胞:施用于哺乳动物的t细胞、施用于哺乳动物的t细胞的后代以及其组合。在一些实施例中,所述由经基因修饰的t细胞构成的持久群体包括记忆t细胞。在说明性实施例中,哺乳动物是人。在说明性实施例中,哺乳动物患有her2阳性癌症。在一些实施例中,t细胞通过本文所提供的任何方法进行基因修饰。
[0495]
另一方面,本文提供了一种在哺乳动物中扩增由经基因修饰的t细胞构成的群体的方法,所述方法包含向所述哺乳动物施用经基因修饰以表达本文所公开的实施例中的任何实施例的car的t细胞,其中所施用的经基因修饰的t细胞在所述哺乳动物中产生具有后代t细胞的群体。在又另一方面,本文提供了一种在其基因组中编码本文所提供的任何car的任何无复制能力的重组逆转录病毒颗粒在制造用于扩增哺乳动物中的由经修饰的t细胞构成的群体的试剂盒中的用途。在说明性实施例中,哺乳动物是人。在一些实施例中,哺乳动物中的后代t细胞包括记忆t细胞。在一些实施例中,t细胞是自体t细胞。在一些实施例中,所述具有后代t细胞的群体在施用之后在所述哺乳动物中持续至少7、14、21或28天或1、2、3、4、5、6、7、8、9、10、11或12个月或1、2、3、4或5年。在一些实施例中,t细胞通过本文所提供的任何方法进行基因修饰。
[0496]
另一方面,本文提供了一种用于刺激对哺乳动物(例如,人)中的靶细胞群体或组织的t细胞介导的免疫应答的方法,所述方法包含向所述哺乳动物施用有效量的经基因修饰以表达本文提供的任何car的细胞。在又另一方面,本文提供了一种在其基因组中编码本文所提供的任何car的任何无复制能力的重组逆转录病毒颗粒在制造用于刺激对哺乳动物中的靶细胞群体或组织的t细胞介导的免疫应答的试剂盒中的用途。在说明性实施例中,哺乳动物是人。在说明性实施例中,哺乳动物患有her2阳性癌症。
[0497]
在本文所提供的包含施用步骤的实施例的任何方面的某些实施例中,如本文中的治疗方法部分中所公开的,可以通过静脉内施用、皮下施用或肿瘤内施用进行施用。在一些实施例中,在施用之前,可以使用本文所公开的方法,例如,在用于产生可条件激活的细胞的方法部分中,产生经基因修饰的细胞。在一些实施例中,所述方法可以包含顶部富集的pbmc从分离的血液中分离t细胞和/或nk细胞,a)富集外周血单核细胞(pbmc),以从分离的血液中分离包括t细胞和/或nk细胞的pbmc;b)在有效条件下激活富集的pbmc的t细胞和/或nk细胞;c)在有效条件下用无复制能力的重组逆转录病毒颗粒转导激活的t细胞和/或nk细胞,由此产生经基因修饰的t细胞和/或nk细胞,其中所述无复制能力的重组逆转录病毒颗粒各自包括逆转录病毒基因组,所述逆转录病毒基因组包括与在t细胞和/或nk细胞中具有活性的启动子可操作地连接的一个或多个核酸序列,其中所述一个或多个核酸序列的第一核酸序列编码根据本文所提供的任何实施例的cab-car;以及d)扩增所述经基因修饰的t细胞和/或nk细胞,由此制备所述可条件激活的t细胞和/或nk细胞。
[0498]
在本文所提供的包含受试者、哺乳动物和/或人以及任选地用于将细胞施用于受
试者的步骤的实施例的任何方面的某些实施例中,在说明性实施例中,哺乳动物患有her2阳性癌症,在说明性实施例中,her2阳性实体瘤。在一些实施例中,此类癌症是复发性her2阳性癌症(例如,实体瘤)。在一些实施例中,her2阳性癌症是由过度表达her2的细胞引起的癌症。在一实施例中,her2阳性癌症包含具有her2基因扩增的细胞。在一些实施例中,her2阳性癌症通过监管机构批准的测试来鉴定,例如美国fda批准的测试、ema批准的测试或中国fda批准的测试,例如本文别处所公开的任何伴随诊断测试。在一些实施例中,哺乳动物受试者(例如,人)患有肿瘤,其中所分析的所有肿瘤细胞中的至少50%为her2阳性。在一些实施例中,施用是施用有效剂量以治疗her2+癌症,或减少哺乳动物(例如,人)受试者中的一个或多个her2+肿瘤的大小。
[0499]
在本文所提供的包含受试者、哺乳动物或人,任选地施用细胞,或针对细胞在某些实施例中nk细胞,并且在说明性实施例中t细胞的方面的各方面和实施例中的任何方面和实施例的某些实施例中,所述受试者、哺乳动物和/或人或t细胞和/或nk细胞的来源,是先前接受过或当前正在接受抗her2抗体生物疗法,如曲妥珠单抗疗法或其生物类似物的受试者,或对此类疗法是难治的受试者,或经历来自此类抗her2疗法的显著不良事件并且在一些实施例中对此类抗her2疗法过敏的受试者。在一些实施例中,哺乳动物(例如,人)受试者之前接受过曲妥珠单抗疗法作为新辅助或辅助疗法。在一些实施例中,在某些说明性实施例中,哺乳动物(例如,人)受试者患有复发性癌症(例如,复发性乳腺癌),所述复发性癌症在哺乳动物受试者用曲妥珠单抗疗法(即赫赛汀疗法)或其生物类似物治疗之后复发。
[0500]
在本文中的方法或用途中的方法或用途的一些实施例中,在将本文所提供的t细胞和/或nk细胞群体施用于受试者之前,哺乳动物(例如,人)受试者用淋巴细胞清除化学疗法治疗。例如,在施用本文所提供的t细胞和/或nk细胞群体之前,可以连续1天、2天、3天、4天或5天,说明性地连续3天,在1到30、2到15、2到11、2到7、3到5或2到4天向受试者施用淋巴细胞清除化学疗法。可以在施用本文所提供的t细胞和/或nk细胞之前15到120或30到60分钟施用受试者对乙酰氨基酚和/或苯海拉明或另一种h1-抗组胺剂。
[0501]
另一方面,本文提供了一种用于制备可条件激活的t细胞或nk细胞的方法,其中所述方法包含用表达载体基因修饰所述t细胞或nk细胞,所述表达载体包括与上述实施例的分离的核酸中的任何分离的核酸可操作地连接的启动子。
[0502]
另一方面,本文提供了一种用于制备可条件激活的t细胞和/或nk细胞的离体方法,其中所述方法包含:a)富集外周血单核细胞(pbmc)以从分离的血液中分离包含t细胞和/或nk细胞的pbmc;b)在有效条件下用无复制能力的重组逆转录病毒颗粒转导激活的t细胞和/或nk细胞,由此产生经基因修饰的t细胞和/或nk细胞,其中所述无复制能力的重组逆转录病毒颗粒各自包含逆转录病毒基因组,所述逆转录病毒基因组包括与在t细胞和/或nk细胞中具有活性的启动子可操作地连接的一个或多个核酸序列,其中所述一个或多个核酸序列包含上述实施例中的任何实施例的分离的核酸;以及d)任选地使所述经基因修饰的t细胞和/或nk细胞扩增,由此制备所述可条件激活的t细胞和/或nk细胞。在一些实施例中,所述方法进一步包含采集经基因修饰的t细胞和/或nk细胞。在一些实施例中,所述方法进一步包括将采集的经基因修饰的t细胞和/或nk细胞引入到受试者中。另一方面,本文提供了一种通过用于制备可条件激活的t细胞或nk细胞的任何方法产生的经修饰的t细胞或nk细胞。
[0503]
另一方面,本文提供了一种表达载体,所述表达载体包含上述实施例中的分离的核酸中的任何分离的核酸以及在t细胞和/或nk细胞中具有活性的启动子,所述启动子与所述编码所述car的核酸可操作地连接。在一些实施例中,所述表达载体可以是无复制能力的逆转录病毒颗粒。在某些说明性实施例中,所述表达载体是慢病毒载体。
[0504]
另一方面,本文提供了一种无复制能力的重组逆转录病毒颗粒,其包含上述实施例的分离的核酸中的任一种分离的核酸。在一些实施例中,无复制能力的重组逆转录病毒颗粒在说明性实施例中是慢病毒颗粒,通常是慢病毒颗粒表达载体。
[0505]
另一方面,本文提供了一种细胞悬浮液、可输注悬浮液或递送悬浮液,其包括由悬浮在递送溶液中的经基因修饰的t细胞和/或nk细胞在说明性实施例中为t细胞构成的群体,其中所述经基因修饰的t细胞和/或nk细胞包括本文所提供的任何编码用于结合her2的car的核酸。例如,此类核酸可以是本示例性实施例部分中提供的任何核酸。作为非限制性实例,在一个实施例中,所述核酸编码用于结合her2的嵌合抗原受体(car),所述car包括:
[0506]
a)抗原特异性靶向区(astr),所述astr与her2蛋白特异性结合;
[0507]
b)跨膜结构域;以及
[0508]
c)细胞内激活结构域,其中所述跨膜结构域定位于所述astr与所述细胞内激活结构域之间,并且其中所述astr包括重链可变区,所述重链可变区包括具有序列hcdr1、hcdr2和hcdr3的三个互补决定区(cdr),其中:
[0509]
所述hcdr1序列是gfnikdtyih(seq id no:131);
[0510]
所述hcdr2序列是x1iyptngytx2yadsvkg(seq id no:137);并且
[0511]
所述hcdr3序列是wggdgfyamdy(seq id no:133);
[0512]
并且所述astr包括轻链可变区,所述轻链可变区包含具有序列lcdr1、lcdr2和lcdr3的三个cdr,其中:
[0513]
所述lcdr1序列是rasqdvntx3va(seq id no:142);
[0514]
所述lcdr2序列是sasflys(seq id no:135);并且
[0515]
所述lcdr3序列是qqx4yttppt(seq id no:143),
[0516]
其中x1是r或k,x2是r或e,x3是a或d,并且x4是h、d或e;并且
[0517]
其中所述astr中的x1、x2、x3和x4的组合不是分别为r、r、a和h。
[0518]
递送溶液可以包含5到100ml或5到50、10到50、5到50或5到25ml的输注溶液,在说明性实施例中,冷冻保存的输注溶液。递送溶液被封闭在容器中,在说明性实施例中,所述容器是输注袋。递送悬浮液包括在递送冷冻保存的递送溶液中悬浮的1
×
104到1
×
10
10
,例如1
×
104到1
×
109个经基因修饰的t细胞和/或nk细胞。施用的细胞可以是同种异体细胞。在说明性实施例中,细胞是自体细胞。技术人员将认识到,当说明书提及“her2 cab”或“her2 cab-car”时,“her2”是指识别her2或其表位的astr。
[0519]
实例
[0520]
提出以下实例以便向本领域普通技术人员提供如何制备和使用本发明的完整公开和描述,并且不旨在限制诸位发明人看待其发明的范围,它们也不旨在表示以下实验是进行的全部或仅有的实验。已经做出努力来确保关于所使用的数字(例如,量、温度等)的准确性,但仍应考虑一些实验误差和偏差。除非另外指明,否则份数是重量份,分子量是重均分子量,温度是以摄氏度为单位,并且压力是在大气压下或接近大气压。可以使用标准缩
写,例如,bp:碱基对;kb:千碱基;pl:皮升;s或sec:秒;min:分钟;h或hr:小时;aa:氨基酸;kb:千碱基;bp:碱基对;nt,核苷酸;i.m.:肌内(地);i.p.:腹膜内(地);s.c.:皮下(地);i.v.,静脉内(地);等等。
[0521]
实例1:条件活性抗her2抗体与人her2蛋白的结合活性
[0522]
将her2基准抗体(bm)和潜在cab抗体的抗体重链和轻链表达为全长igg抗体,并且使用elisa进行测试,以测量在各种ph下与人her2蛋白的结合。在此实例中测试的cab抗体具有重链(vh)或轻链(vl)突变,并且另一条链为具有a032d突变的轻链,或者bm抗体的轻链或重链如下文所示。抗体在两组中进行测试(图1a和1b),并且包含以下重链和轻链组合:在图1a中-vh-wt/vl-wt(bm);vh-r050k/vl-wt;vh-r059e/vl-wt;vh-wt/vl-a032d;vh-wt/vl-h091d;vh-wt/vl-h091e;并且在图1b中-vh-wt/vl-wt(bm);vh-n028w/vl-a032d;vh-y052k/vl-a032d;vh-y052d/vl-a032d;vh-n055a/vl-a032d;vh-g056k/vl-a032d;vh-t058d/vl-a032d;vh-a1063/vl-a032d;以及vh-s119e/vl-a032d。
[0523]
ph范围elisa测定
[0524]
将碳酸盐-碳酸氢盐包被缓冲液中的100μl的1μg/ml重组人her2抗原移液到elisa板中。用密封薄膜覆盖板并在4℃下温育过夜。将板倒出并将残留的液体轻拍到一叠纸巾上。通过将200μl的各种ph温育缓冲液分配到孔中并完全抽出内容物来将孔洗涤两次。将200μl的各种ph温育缓冲液(ph 5.0、5.5、6.0、6.5、7.0和7.4)添加到孔中。用密封薄膜覆盖并在室温下将板放置在板振荡器上(设置为200rpm),持续60分钟。将板倒出并将残留的液体轻拍到一叠纸巾上。测试物质在ph温育缓冲液(ph 5.0、5.5、6.0、6.5、7.0和7.4)中连续稀释至100ng/ml。将100μl/孔的稀释测试物质添加到板中。用密封薄膜覆盖并在室温下将板放置在板振荡器上(设置为200rpm),持续60分钟。将板倒出并将残留的液体轻拍到一叠纸巾上。通过添加200μl的ph洗涤缓冲液(ph 5.0、5.5、6.0、6.5、7.0和7.4)并完全抽出,将孔洗涤三次。辣根过氧化物酶(hrp)次级抗体在ph温育缓冲液(ph 5.0、5.5、6.0、6.5、7.0和7.4)中以1∶2500稀释。将100μl稀释的hrp次级抗体添加到每个孔中。用密封薄膜覆盖并在室温下将板放置在板振荡器上(设置为200rpm),持续60分钟。将板倒出并将残留的液体轻拍到一叠纸巾上。通过添加200μl的ph洗涤缓冲液(ph 5.0、5.5、6.0、6.5、7.0和7.4)并完全抽出,将孔洗涤三次。将50μl的3,3
′
,5,5
′
四甲基联苯胺(tmb)底物溶液添加到每个孔中并在室温下温育3分钟。将每孔50μl的1n盐酸(hcl)添加到每个孔中。使用perkinelmer enspire 2300多标记读取器在450nm处读取板。
[0525]
结果
[0526]
对于每种条件活性抗体,重链和轻链如上所讨论的,在图1a和1b中所示的各种ph下结合。y轴示出了450nm处的光密度(od)。x轴示出了温育和洗涤缓冲液的ph(ph 5.0、5.5、6.0、6.5、7.0和7.4)。使用graphpad prism 5.03绘制每个ph的平均od值与缓冲液的ph。使用内置在软件中的4参数模型进行曲线拟合。将ph 6.0时的结合活性设为100%。结果在图1a和1b中示出。测试的突变示出了与her2的条件活性结合,这取决于环境中的ph,其中相对于7.4,在较低的ph下例如在ph为6.0或6.7时结合增加。
[0527]
图1b中的cab抗体的ph曲线的拐点(50%结合活性)如下表5所示。
[0528]
表5:重链突变的her2结合ph拐点
[0529]
重链突变/轻链突变或bmph拐点计算
vh-n028w/vl-a032d6.053vh-y052k/vl-a032d6.221vh-y052d/vl-a032d6.132vh-n055a/vl-a032d6.298vh-g056k/vl-a032d6.225vh-t058d/vl-a032d6.463vh-a106e/vl-a032d6.608vh-s119e/vl-a032d6.218bmn/a
[0530]
实例2:用于靶向her2的嵌合抗原受体的产生和通过体外杀伤测定对活性的分析
[0531]
此实例展示了用于制备本发明的某些实施例的car的方法,并且展示了表达这些car的car-t细胞的杀伤活性。此外,还提供了概念验证实验,证明了一些用说明性cab-car制备的car-t细胞的cab car活性。获得编码抗体重链和轻链的核酸,所述抗体重链和轻链构成实例1的与ph为7.4相比在ph为6.7时表现出与her2的结合增加的一些抗体,并且在重链和轻链的两个定向上克隆所述核酸以产生一组编码含有一组96个scfvastr的car的表达载体。用慢病毒颗粒表达载体转导t细胞,并在体外肿瘤替代测定中针对her2阳性靶细胞测试经转导的细胞杀死her2表达性靶细胞的能力,以及其与ph 7.4相比在ph 6.7时具有更强杀伤的条件性杀伤能力。
[0532]
通过瞬时转染产生重组慢病毒颗粒
[0533]
将命名为“f1xt细胞”的通过在freestyle
tm 293表达培养基(赛默飞世尔科技公司(thermofisher scientific))中连续生长而适应悬浮培养的293t细胞(lenti-x
tm 293t,clontech)用作包装细胞。
[0534]
使用典型的4载体包装系统并包含编码(i)gag/pol、(ii)rev和(iii)假型化元件vsv-g的3个包装质粒。此包装系统的第4个载体是基因组质粒,第三代慢病毒表达载体(其3
′
ltr缺失导致自失活),所述基因组质粒编码包含以下的car:cd8信号肽(seq id no:72)、来自一组识别人her2的scfv中的一个scfv、cd8茎和跨膜序列(seq id no:24)、cd137细胞内结构域(seq id no:53)和来自cd3z的细胞内激活结构域(seq id no:28),然后是均由ef1-a启动子驱动的t2a和etag(cd8sp:aher2:cd8:cd137:cd3z-t2a-etag)。编码gmcsf信号肽和由ef1-a启动子驱动的etag的慢病毒载体f1-0-01,但不是car,用作对照(gmcsfsp:etag)。
[0535]
对于每30ml的含有包装细胞的培养物,将质粒dna溶解在1.5ml gibco
tm opti-mem
tm
生长培养基中。聚乙烯亚胺(pei)(polysciences公司)(溶解在弱酸中)在1.5ml gibco
tm opti-mem
tm
中稀释到2μg/ml。通过将两种制备的试剂以2μg的pei:1μg的dna的比率组合来制备3ml的pei和dna混合物。在5分钟室温温育之后,将两种溶液彻底混合在一起,并且在室温下再温育20分钟。在125ml的爱伦美氏(erlenmeyer)烧瓶中,以1
×
106个细胞/ml将最终体积(3ml)添加到30ml的悬浮包装细胞中。然后将细胞在37℃下温育72小时,其中以125rpm进行旋转并且以8%co2进行转染。
[0536]
72小时之后,采集上清液并且通过以1,200g离心持续10分钟进行澄清。将澄清的上清液倒入到新试管中。通过聚乙二醇(peg)沉淀从澄清的上清液中纯化病毒。将1/4体积
的peg添加到澄清的上清液中,并且在4℃下温育过夜。然后将混合物以1600g离心持续1小时(对于50ml锥形管)或1800g离心持续1.5小时(对于500ml锥形管)。丢弃上清液,并且将慢病毒颗粒沉淀物重悬于含2%乳糖的pbs中的1∶100的初始体积的包装细胞培养物中。
[0537]
通过连续稀释和分析转基因表达、通过转导到293t和/或jurkat细胞中并使用lenti-x
tm qrt-pcr滴定试剂盒(#631235)或来自宝生物公司(takara)的p24测定elisa试剂盒(lenti-x
tm p24快速滴度试剂盒#632200)通过facs或qpcr分析慢病毒基因组的转基因表达来滴定慢病毒颗粒。
[0538]
t细胞转导和扩增
[0539]
根据制造商的说明书,先前使用rossettesep
tm
人t细胞富集混合物从人全血中分离的冷冻pan t细胞在第0天解冻并且在最终浓度为100iu/ml的补充有重组人il-2(r&d 202-il-010)的人t细胞培养基(x-vivo15(龙沙#04-418q)、5%人ab血清(valley生物医学公司(valley biomedical inc.),#hp1022)、1%n-乙酰l-半胱氨酸(西格玛奥德里奇#a9165))中培养。第1天,将原代人t细胞以500,000个细胞/孔接种到12孔板中,并且使用免疫磁珠人t活化剂cd3/cd28(thermo#11131d)以1:3的细胞:珠粒比率进行激活。在第2天,慢病毒颗粒以10的moi添加到孔中。经转导的t细胞在人t细胞培养基中维持在约106/ml下持续另外2天,然后转移到6孔g-rex板的孔中,其中30ml/孔的人t细胞培养基补充有il-2。每隔一天添加il-2培养细胞至少10天。在第11天,通过用西妥昔单抗、cd3、cd4和cd8染色细胞并使用novocyte流式细胞仪(acea)评估t细胞的etag表达来评估转导效率。
[0540]
杀伤测定
[0541]
基于荧光素酶的杀伤测定和实时杀伤测定均用于测量经转导的t细胞的细胞毒性活性。如上文所描述的,用针对her2的car(被测car-t细胞)转导的原代t细胞用作效应细胞。
[0542]
对于基于萤光素酶的杀伤测定,已被工程化为稳定地表达经修饰的人her2的cho-s细胞用作靶细胞,所述经修饰的人her2包括her2的胞外结构域和人pdgfr的跨膜和细胞内结构域的前5个残基以及萤火虫萤光素酶(cho-s-her2 ffluc)。将冷冻的效应细胞解冻并在含有100iu/ml的il-2的人t细胞培养基中静置2天。将靶细胞以每孔30,000个细胞接种在人t细胞培养基中的96孔平底板中,所述培养基含有一式三份调整到ph 6.7和ph 7.4并且允许在37℃和5%co2下粘附1小时的40mm hepes和pipes。将如通过etag表达测量的成功转导的效应细胞以9:1的效应物:靶标比率添加到培养物中,并且在37℃和5%co2下的标准加湿培养箱中培养。作为参考,每个板包含一式三份的ph 6.7和ph 7.4的靶细胞,其中未添加效应细胞。在2、4和6小时时间点或在4、5和6小时时间点处,将板旋转下来,去除上清液,并且根据制造商的说明书,使用one-glo
tm
萤光素酶测定系统(普洛麦格公司(promega))测定未裂解细胞中剩余的萤光素酶。剩余荧光计算为(测量的荧光)/(仅目标荧光的平均值)
×
100%。裂解计算为100%-剩余荧光。一些候选物被包含在不同日期运行的2个单独的测定中。
[0543]
对于实时杀伤测定,经转导的t细胞的细胞毒性活性通过xcelligence系统(acea)进行测量。已被工程化为稳定地表达经修饰的人her2的cho-s细胞用作靶细胞,所述经修饰的人her2包括her2的胞外结构域和人pdgfr的跨膜和细胞内结构域的前5个残基。将冷冻的效应细胞解冻并在含有100iu/ml的il-2的人t细胞培养基中静置2天。在用含有ph6.7和7.4
的40mm hepes和pipes的人t细胞培养基进行实验前一天,将靶细胞以20k细胞/孔接种到e板中。在测定当天,将静置的效应细胞以3∶1、1∶1和在某些情况下为0.3∶1的效应细胞/靶细胞比率(e/t)添加到实验孔中。在效应细胞添加之后大约30小时内每5分钟读取一次阻抗读段,并且将阻抗报告为细胞指数(ci)。特异性细胞溶解的百分比计算如下((ci靶标+经对照病毒转导的效应t细胞)-(ci靶标+用针对her2的car转导的效应t细胞))/(ci靶标+经对照病毒转导的效应t细胞)
×
100。
[0544]
结果
[0545]
制备了一组用于结合her2的候选嵌合抗原受体(car),其包含由从相对于7.4在ph为5.0到6.7时与her2结合增加的抗体中鉴定的抗体重链可变区和轻链可变区构建的astr(参见例如,实例1)。因此,这些car因此被认为与正常组织相比在降低的肿瘤环境ph下具有增加的活性(本文中有时被称为(cab-car))。car是通过将一组针对her2的此类astr与其它car结构域和etag结构域组装而成的。本文所描述的杀伤测定中使用的astr源自以不同的组合和定向排列成96个独特scfv的4个抗体重链、2个连接子和6个抗体轻链。这些astr中包含的重链是基准重链vh-1(seq id no:119),以及以下基于vh-1的重链;含有突变r059e(seq id no:123)的vh-2、含有突变r050k(seq id no:124)的vh-3和含有突变r050k和r059e(seq id no:125)两者的vh-4。15个氨基酸的连接子,连接子a(seq id no:63),或30个氨基酸的连接子,连接子b(seq id no:64)连接了重链和轻链。这些astr中的轻链是基准轻链vl-1(seq id no:122),以及以下基于vl-1的轻链;含有突变h091e(seq id no:126)的vl-2、含有突变h091d(seq id no:127)的vl-3、含有突变a032d(seq id no:128)的vl-4、含有突变a032d和h091d(seq id no:129)两者的vl-5和含有突变a032d和h091e(seq id no:130)两者的vl-6。在本发明实例中使用的car结构域是cd8茎和跨膜序列(seq id no:24)、cd137细胞内共刺激结构域(seq id no:53)以及来自cd3z的细胞内激活结构域(seq id no:28)。
[0546]
当以至少一种构型排列为scfv以形成如上文在此实例中描述的car的astr时,重链和轻链中的每一个,包含基准和突变体,都保留了形成功能性car的能力,如由在荧光素酶测定中用这些构建体转导的效应细胞在ph 6.7和/或ph 7.4时杀死cho-s-her2靶标的能力所确定的,优于用单独编码etag的构建体转导的效应细胞。表2示出了96种测试构型中的84种构型的car构建体、转导效率、n端链、连接子、c端链和scfv astr序列id,证明了在荧光素酶测定中识别和杀死cho-s-her2靶细胞的能力。
[0547]
表2:在萤光素酶测定中发现以scfv形式排列的抗体重链和轻链的身份和构型可杀死cho-s-her2靶标。
[0548]
[0549]
[0550][0551]
在此荧光素酶测定中,对于以下构建体,未观察到高于背景水平的cho-s-her2细胞的杀伤;x4-85(f1-4-06)(seq id no:237)、x4-86(f1-4-19)(seq id no:238)、x4-87(f1-4-24)(seq id no:239)、x4-88(f1-4-55)(seq id no:240)、x4-89(f1-4-58)(seq id no:241)、x4-90(f1-4-59)(seq id no:242)、x4-91(f1-4-62)(seq id no:243)、x4-92(f1-4-68)(seq id no:244)、x4-93(f1-4-70)(seq id no:245)、x4-94(f1-4-78)(seq id no:246)、x4-95(f1-4-87)(seq id no:247)和x4-96(f1-4-92)(seq id no:248)。这些构建体没有被进一步表征。然而,发明人相信,如果这些构建体被优化,这些astr中的一些或全部可能会促进对cho-s-her2细胞或其它her2表达性细胞的car杀伤,因为astr是使用被证明为结合her2的重抗体和轻抗体链设计的(参见例如,实例1)。
[0552]
使用上文所描述的荧光素酶测定,在ph为7.4(生理ph)和ph为6.7(替代肿瘤测定条件)时分析了在原代t和nk细胞上表达的候选car对cho-s-her2细胞的细胞毒性活性。示出了用指定car转导的效应细胞在4到6小时内对cho-s-her2靶标的裂解百分比的图在图2和图3中示出。图2中的car的astr均具有结构轻链-连接子a-重链rk;x4-20(r059e)、x4-21(r050k)、x4-23(h091d)、x4-24(a032d)和x4-72(h091e)。在图2中,x4-04的图示出了准构建体表现出杀伤活性,但裂解百分比在ph为7.4和6.7时相当,特别是在6小时时间点处,表明这是野生型car。对于图2中的其它car中的每一个,ph 6.7时的裂解百分比大于ph 7.4时的裂解百分比,表明x4-20、x4-21、x4-23、x4-24和x4-72各自是cab-car。
[0553]
图3中的数据示出了如与包括vh-1和其中引入突变h091d的基准抗体轻链(vl-3)的car相比,包括基准抗体重链(vh-1)和基准抗体轻链(vl-1)的car的杀伤活性。图3a示出了包括通过连接子a以任一定向连接的vl-1和vh-1的car不表现出cab活性,并且因此是野生型car。相比之下,包括通过连接子a以任一定向连接的vl-3和vh-1的car是cab car。类似地,图3b示出了包括通过连接子b以任一定向连接的vl-1和vh-1的car不表现出cab活性,并且因此是野生型car。相比之下,包括通过连接子b以任一定向连接的vl-3和vh-1的car是cab car。因此,可以改变抗体链的连接子和定向,并且这些包括vl-3的car维持cab活性。
[0554]
表3中的数据表明,当重链和轻链的定向反转时,保留cab-car活性的能力并不是vl-3的h091d突变所独有的。表3示出了代表性car构建体、转导效率、scfv中重抗体链和轻
抗体链的定向、如与基准序列相比每个car构建体中存在的突变、相对于7.4,ph 6.7时的裂解比率以及基于此裂解比率的构建体的类别。基于其ph 6.7相比于7.4裂解比率性能将候选物分组为三个类别之一;所有构建体在6小时时产生大于25%的裂解。那些在低到高ph下产生裂解%比率小于或等于1.12的候选car被归类为具有野生型活性(“wt”),并且那些在低到高ph下产生裂解%比率大于1.12的候选car被归类为具有具有cab活性(“cab”)。1.12截止值是基于基准在这些测定中的表现。对于每个测定中的样品,一式三份运行的样品的中位数用于裂解百分比。对于在2次单独测定中运行的样品,使用裂解百分比的平均值。
[0555]
表3在荧光素酶杀伤测定中,在cho-s-her2靶标上表达各种抗her2 car的t细胞的身份和cab活性。
[0556][0557]
包含具有重链或轻链突变体的astr的所有car构建体在抗体测定中被鉴定为负责cab活性(参见例如,实例1),除x4-47外,通过此荧光素酶杀伤测定具有cab-car活性然而,x4-47在基于实时阻抗的杀伤测定中以为3:1和1:1两者的效应物与靶标的比率确实表现出cab-car活性,表明x4-47是cab-car。
[0558]
图4示出了两个样品的实时杀伤测定的结果。图4a示出了表达基准car,x4-03的效应细胞对cho-s-her2靶细胞的杀伤。在ph 6.7和7.4时的特异性裂解百分比相当,表明x4-03不是cab-car。相比之下,图4b示出了在ph 6.7时比在ph 7.4时更大的特异性裂解百分比,表明x4-16是cab-car。x4-16(seq id no:168)的scfv包括r050k和r059e突变两者,证明可以组合负责cab活性的单独突变以产生cab car。
[0559]
22个car在荧光素酶测定中显示出杀伤力和强cab活性,其中在至少一种荧光素酶或使用cho-s-her2靶细胞的基于阻抗的实时杀伤测定初筛中,与高ph相比,在低ph时具有更大的杀伤力。表4提供了这22个cab car的astr的身份和序列。
[0560]
表4代表性cab car的身份和其相应scfv的seq id。
[0561]
[0562]
实例3:通过激活标志物的表达、细胞因子产生和增殖对代表性cab car的进一步体外测定
[0563]
在此实例中,通过研究car-t细胞在肿瘤微环境(tme)条件(ph 6.7)和正常生理条件(ph 7.4)下暴露于her2阳性靶细胞之后激活标志物的表达、细胞因子的产生和增殖,对her2 car候选物进行体外cab活性测试。
[0564]
如实例2所描述产生重组慢病毒颗粒。使用了若干种编码不同her2 car变体的基因组质粒。“wt1”是非cab car对照,包含igk信号肽(seq id no:250)、本身包含不显示cab活性并通过连接子c(seq id no:249)连接的抗体重链和轻链组合的scfv、cd8茎和跨膜序列(seq id no:24)、cd137细胞内结构域(seq id no:53)和来自cd3z的细胞内激活结构域(seq id no:28),然后是均由ef1-a启动子驱动的t2a和etag。此实例中研究的每个候选cab-cart 1-4包含在实例2中被鉴定为表现出cab car活性的相同的抗体重链(vh-a)和抗体轻链(vl-a)。此外,对于候选物1-4中的每个候选物,抗体链以相同的定向排列。候选物1-4的不同之处仅在于其信号肽、连接子的组合以及组氨酸标签(seq id no:251)是否存在于scfv与cd8茎之间的茎区。信号肽来自igk信号肽(seq id no:250)或cd8信号肽(seq id no:72)。连接子是连接子“a”(seq id no:249)、连接子“b”(seq id no:1)或连接子“c”(seq id no:64)。用这些慢病毒颗粒转导t细胞,如实例2所描述扩增并冷冻。
[0565]
当经被测转导的t细胞与已知表达her2的mcf-7细胞组合时,通过检查激活标志物和细胞因子的产生,使用以下方法评估car-t细胞激活。在第1天,将冷冻的转导t细胞解冻并在含有100iu/ml的il-2的x-vivo 15中在37℃和5%co2下温育2天,以用作效应细胞。第2天,在高和低ph下将mcf-7靶细胞以每孔30,000个细胞接种在100μl靶细胞培养基(含有10%热灭活fbs、1%pen/strep、1%mem neaa、1%丙酮酸钠并含有被调整到ph 6.7或ph 7.4的40mm hepes和pipes的dmem)中的96孔平底板中并且在37℃和5%co2下温育。在第3天,在高和低ph下将100μl效应细胞培养基(x-vivo15(龙沙#04-418q)、5%人ab血清(valley生物医学公司,#hp1022)、1%n-乙酰基-l-半胱氨酸(西格玛奥德里奇公司#a9165)、0.9%1n naoh并且含有被调整到ph 6.7或ph 7.4的40mm hepes和pipes)中的适当效应t细胞中的90,000个添加到铺板的靶细胞中并且在37℃和5%co2下温育。为了分析cd69表面表达,在第4天采集经刺激的细胞,并对cd69、etag、cd3、cd4和cd8进行染色。为了分析细胞内ifn γ,在第4天采集经刺激的细胞,并且在用bd perm/wash缓冲液(bd生物科学公司(bd biosciences)目录号554723)透化之后对etag、cd3、cd4、cd8和ifn γ进行染色。
[0566]
为了分析cd107a表面表达,在刺激开始时添加抗cd107a pe(e生物科学公司(ebioscience)目录号12-1079-42)、布雷非菌素a和莫能菌素。细胞在37℃和5%co2下温育5小时。刺激5小时之后,对细胞进行etag、cd3、cd4和cd8染色。使用bd cytofix固定染色的细胞,并在4℃下在facs缓冲液中过夜。用于这些测定的商业抗体是抗cd3(百进生物公司(biolegend)目录号317344)、抗cd4(百进生物公司目录号317412)、抗cd8(百进生物公司目录号301048)、抗cd69(百进生物公司目录号310932)、抗cd107a(e生物科学公司目录号12-1079-42)和抗ifnγ(bd pharmigen公司目录号557643或552887)。
[0567]
以下方法用于评估增殖作为car-t细胞激活的指标。在第1天,将冷冻的转导t细胞解冻并在含有5%ab血清、10mm nac和100iu/ml的il-2的x-vivo 15中在37℃和5%co2下温
育2天,以用作效应细胞。第3天,用最终浓度为10μg/ml的丝裂霉素c处理mcf-7靶细胞,在37℃和5%co2下温育3小时,并且在pbs中洗涤。然后将mcf7靶细胞以每孔100,000个细胞接种在500μl靶细胞培养基(含有10%热灭活fbs、1%pen/strep、1%mem neaa、1%丙酮酸钠并含有被调整到ph 6.7或ph 7.4的40mm hepes和pipes的dmem)中的48孔平底板中。根据制造商的方案(#c34557,赛默飞世尔公司)采集效应细胞并用celltrace violet标记。将ph 6.7或ph 7.4下的500μl的靶细胞培养基中的100,000个car+效应细胞添加到对应ph下的靶细胞中,以建立1∶1的效应物与靶标比率,并且在37℃和5%co2下温育。在第8天,收集细胞并进行cd3、cd8和7aad染色。随着效应细胞增殖,celltrace violet的量减少,并且可通过流式细胞仪检测。用于这些测定的商业抗体是抗cd3(百进生物公司目录号317306)、抗cd4(百进生物公司目录号317412)、抗cd8(百进生物公司目录号300914)和抗7aad(百进生物公司目录号420404)。
[0568]
如通过这些代表性体外测定测量的,在tme和正常生理条件下,已知表达her2的mcf7靶细胞对这些候选cab car-t效应细胞的t细胞激活的相对水平在图5-8中示出。
[0569]
图5示出了与mcf7靶标共培养1天之后cd3+etag+细胞上的cd69的mfi。与高ph相比,对照car,wt1在低ph下显示出cd69 mfi略有下降。相比之下,与低ph相比,候选物1到4在高ph下的cd69 mfi显著降低。在单独的测定(未示出)中,具有与候选物2相同的氨基酸序列但针对轻链中的突变y55e的第5个候选物,候选物5,如与当人乳腺癌细胞系bt-474被用作靶标时的低ph相比在高ph下显示cd69 mfi显著降低,表明候选物5也是cab car。
[0570]
图6示出了在与mcf7靶标共培养1天之后含有细胞内ifnγ的cd3+etag+细胞的百分比。在低和高ph下,表达ifnγ的wt1细胞的百分比是相等的。相比之下,在低ph条件下,并且与高ph相比,候选物1-4的大约两倍百分比表达细胞内ifnγ。
[0571]
图7示出了在与mcf7靶细胞共培养5小时之后表达cd107a的cd3+etag+细胞的百分比。与ifnγ的观察结果相似,在低ph和高ph下表达cd107a的wt1细胞的百分比是相等的,而在低ph条件下并且与高ph相比,表达cd107a的候选物1-4的百分比大约是两倍。
[0572]
图8示出了来自增殖测定的结果的实例。随着细胞增殖,每个细胞的celltrace violet的量会减少。这可以在活的cd3+门控细胞的直方图中作为多个不同的峰看到。wt1效应物与mcf7靶细胞在低和高ph两者下共培养5天,显示出多个表明增殖的峰。相比之下,在低ph但不是高ph下与mcf7靶细胞共培养5天的候选物2car效应物显示增殖(多个峰)。
[0573]
这些结果一起表明,如与正常生理环境相比,候选物1-4是在tme中的ph下具有更大活性的cab car。因此,对于以cab-car形式表现出cab活性的给定抗体重链和轻链组合,可以使用不同的信号肽、连接子和茎,并且car可以维持cab活性。此外,当候选物2中使用的轻链的位置55处的酪氨酸突变为谷氨酸时,cab-car活性被保留,这种突变也存在于4d5-7中(carter等人,1992,《美国国家科学院院刊》89:4285-9)。因此,据信本文所提供的候选cab-car可以在位置55处包含酪氨酸并保留其cab-car活性。最后,此实例展示了四种另外的体外测定,所述测定可以用于确定car是否为cab car,以及它在ph或6.7下是否具有更多或更少活性,如与正常的生理环境相比,这被认为与tme的ph相似。
[0574]
实例4:her2 cab-car在体内模型中表现出肿瘤杀伤以及减少的中靶脱瘤效应
[0575]
进行了一项混合肿瘤回归和安全性评估研究,以检查示例性cab-car的活性,以有条件地靶向和解决皮下her2表达性肿瘤,同时减少定位于tme之外的her2表达性肝细胞的
中靶脱瘤杀伤。
[0576]
如实例2所描述产生重组慢病毒颗粒。基因组质粒编码her2 car,然后是由ef1-a启动子驱动的t2a和etag。car是上述实例中鉴定的cab-car或非cab car(“wt car”)。通过深度过滤、tff、苯甲酶处理、渗滤和调配的组合纯化病毒上清液,以产生不含非人类动物蛋白的基本上纯的病毒颗粒。病毒颗粒用于以10的moi转导新鲜分离的pbmc,并且将细胞离体扩增12天。
[0577]
此研究选择了使用b-ndg小鼠的异种移植模型。b-ndg是缺乏成熟t细胞、nk细胞和b细胞的小鼠品系,并且是迄今为止描述的免疫缺陷最严重的小鼠品系之一。去除免疫系统的这些细胞组分通常是为了使人pbmc能够在宿主没有先天、体液或适应性免疫应答的情况下进行移植。由于缺乏鼠类胞外共同γ链,使过继性转移的人类细胞能够接受此类细胞因子,因此通常仅在人体放射或淋巴细胞清除化学疗法之后才存在稳态细胞因子的浓度。同时,这些动物也可以用于移植肿瘤异种移植靶标,以检查car杀死表达靶标的肿瘤的功效。虽然效应细胞产物中的异种反应性t细胞受体抗原的存在最终会导致移植物抗宿主病,但这些模型能够对动物药理学和急性耐受性进行短期评估。
[0578]
在第-42天,用pbs基质胶中的10m sk-ov-3卵巢肿瘤细胞皮下(sc)接种6-8周龄雌性b-ndg(biocytogen)小鼠。在第-14天,通过流体动力学基因递送将编码人全长her2和具有侧接转座子位点的萤火虫荧光素酶的pdna与转座酶pdna一起施用以诱导人her2抗原的肝脏表达。在第0天,给小鼠静脉注射(iv)单剂量的50
×
106cab-car细胞(4只小鼠)、50
×
106wt car细胞(6只小鼠)或dpbs对照(6只小鼠)。每周使用卡尺测量肿瘤2或3次,并且使用以下等式计算肿瘤体积:(最长直径*最短直径2)/2。ivis对小鼠的体内成像用于通过在异氟醚麻醉下进行荧光素底物注射后每周捕获图像来观察肝脏的生物发光。
[0579]
每组小鼠的平均肿瘤体积在图9中示出。cab-car和wt-car的施用使得sk-ov-3肿瘤从第7天开始出现类似的消退,其中到第27天通过卡尺测量无法检测到肿瘤。cab-car和wt-car也展示出相似的药代动力学血液膨胀,其在第14天达到峰值,并且在给药后4周收缩至低于检测限,如通过facs和qpcr方法测量的(未示出)。图10a中的小鼠的ivis图像显示人her2-荧光素酶在第-1天在所有小鼠的肝脏中以相似的水平表达。在第3天观察到用wt-car细胞给药的小鼠肝脏中的her2-荧光素酶减少,其中到第9天未检测到her2-荧光素酶。相比之下,用cab-car细胞给药的小鼠肝细胞中的her2-荧光素酶的表达仅适度下降。对此图像中的荧光素酶活性的定量在图10b中的lg(总通量)图中示出。因此,her2 cab-car细胞可以靶向和消退her2肿瘤,其中几乎不会对her2表达性细胞进行中靶脱瘤杀伤。
[0580]
这些数据证明,通过上文所公开的体外测定鉴定为cab-car的候选物是体内cab-car。因此,这些体外测定似乎可鉴定不仅是体外cab-car的,而且也是体内的car构建体。此外,这种混合肿瘤回归和安全模型可以用于鉴定和/或确认car是cab-car。这些结果支持cab-car可能有效治疗her2+癌症,其安全性高于不表现出条件活性的her2 car。
[0581]
实例5:her2 car可以在体内模型中杀死和解决曲妥珠单抗抗性肿瘤
[0582]
虽然曲妥珠单抗在治疗患有her2过表达肿瘤的患者中显示出功效,但大多数接受有效初始曲妥珠单抗疗法的患者在12个月内产生抗性。此研究的目的是测试和比较曲妥珠单抗和car疗法在小鼠模型中的功效。
[0583]
在此实例5中使用了实例4中产生的不含非人动物蛋白的基本上纯的病毒颗粒。在
第-14天,用pbs基质胶中的7
×
106nci-87胃上皮细胞sc接种6-8周龄雌性b-ndg(biocytogen)小鼠。在第0天,给小鼠iv注射单剂量的50
×
106个cab-car细胞(6只小鼠)、50
×
106个wt car细胞(6只小鼠)或dpbs对照(6只小鼠),并且以4mg/kg(低剂量)或30mg/kg(高剂量)的剂量腹膜内(ip)注射曲妥珠单抗,并且以2mg/kg(低剂量)或10mg/kg(高剂量)每周ip剂量维持在曲妥珠单抗上持续3周。在第42天,接受高剂量曲妥珠单抗的小鼠被iv注射单剂量的50
×
106个cab-car细胞。每周使用卡尺测量肿瘤2或3次,并且使用以下等式计算肿瘤体积:(最长直径*最短直径2)/2。
[0584]
这些小鼠的肿瘤体积在图11中示出。wt car和cab-car产品从注射后第7天开始高效地产生肿瘤消退,其中到第27天完全消退。用低剂量的曲妥珠单抗治疗的肿瘤以与dpbs对照相似的动力学进展。用高剂量的曲妥珠单抗治疗的肿瘤在第41天表现出50%的肿瘤生长抑制。在第42天用cab-car对这组小鼠进行进一步治疗引起对持续her2单克隆抗体给药难治的大型已建立肿瘤的完全消退。
[0585]
此处呈现的实例支持使用car,具体地是cab-car,以在曲妥珠单抗治疗肿瘤进展后治疗her2阳性肿瘤。
[0586]
所公开的实施例、实例和实验并不打算限制本公开的范围或并不打算表示以下实验是所执行的所有或仅有实验。已经努力确保关于所用数字(例如量、温度等)的准确性,但应当考虑到一些实验性误差和偏差。应理解,可以在不改变实验意图说明的基本方面的情况下,对所描述的方法进行改变。
[0587]
所属领域的技术人员可设计在本公开的范围和精神内的许多修改和其它实施例。实际上,在不改变本公开的基本方面的情况下,熟练的技术人员可对所描述材料、方法、图式、实验、实例和实施例进行变化。所公开的任一个实施例可与任何其它所公开的实施例组合使用。
[0588]
在一些情况下,已经参照具体实施例对所述方面进行了描述。然而,所属领域普通技术人员应理解,可以在不脱离以下权利要求书中阐述的本发明的范围的情况下作出各种修改和改变。因此,说明书和图式应该以说明性而不是限制性意义来看待,且所有这些修改意图包含在本发明范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1