基于光合绿藻的碳汇藻液生产设备、制备方法及应用与流程
1.本发明涉及碳汇藻液生产技术领域,特别涉及一种基于光合绿藻的碳汇藻液生产设备、制备方法及应用。
背景技术:
2.气候变化是人类共同面临的重大危机和严峻挑战,已经成为国际政治、外交、经济和生态领域的共同关切。应对气候变化应当减缓和适应并重,减缓气候变化是长期的艰巨任务,适应气候变化是更为现实的紧迫任务。林业是受气候变化影响最严重的领域之一,也是我国确定的适应气候变化的重点领域之一。做好林业适应气候变化工作对增强国家整体适应能力,维护生态安全、气候安全具有重大意义。
3.但是我国林业资源禀赋不足,我国森林覆盖率远低于全球31%的平均水平,人均森林面积仅为世界人均的1/4,人均森林蓄积只有世界人均的1/7;湿地率低于全球8.6%的平均水平,人均湿地面积仅为世界人均的1/5,湿地保护压力大、恢复难度大;雾霾天频现,沙尘暴多发,防沙治沙任务重;景观破碎化、物种濒危化加剧,生物多样性保护十分迫切。生态脆弱仍是我国的基本国情,生态产品短缺仍是突出短板,森林、湿地和荒漠生态系统对气候变化比较敏感,气候风险较大。同时,林业适应气候变化工作基础薄弱。林业领域适应气候变化的意识普遍不高、能力相对薄弱、工作体系不够健全、人才队伍比较紧缺,各项工作亟待加强。
4.森林是陆地生态系统中最大的碳库,扩大森林覆盖面积是未来30~50年经济可行、成本较低的减缓和应对气候变化的重要措施。森林具有巨大的汇集二氧化碳的功能,这个功能被称为“碳汇”。同时,毁林以及林地退化、森林火灾和病虫害等,又将其储存的二氧化碳释放到大气中,成为“碳源”。采取措施加强森林生态系统的碳储存和碳汇功能,减少来自森林的碳排放,已经成为应对气候变化的全球共识和行动,也成为中国两次承诺自主减排的目标之一。但是,现有碳汇产品,一般只用在森林中,且产生的碳汇强度不高。
技术实现要素:
5.基于此,本发明的目的是提供一种基于光合绿藻的碳汇藻液生产设备、制备方法及应用,以提高碳汇强度。
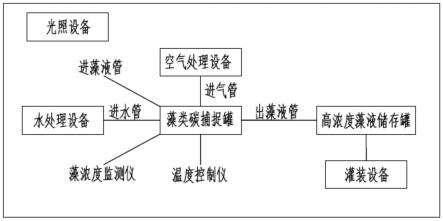
6.第一方面,本发明提供了一种基于光合绿藻的碳汇藻液生产设备,包括设备腔体,以及设于所述设备腔体中的藻类碳捕捉罐;
7.所述藻类碳捕捉罐通过进气管连接空气处理设备,通过进水管连接水处理设备,通过出藻液管连接高浓度藻液储存罐;
8.所述藻类碳捕捉罐上设有藻浓度监测仪、温度监测仪和进藻液管,所述进藻液管用于加入光合绿藻液;
9.所述设备腔体的顶部设有光照设备,所述高浓度藻液储存罐与灌装设备连接。
10.进一步地,所述藻类碳捕捉罐的体积不小于1m3。
11.第一方面,本发明提供了一种基于光合绿藻的碳汇藻液的制备方法,包括以下步骤:
12.步骤s10,将经空气处理设备处理后的净化空气送入藻类碳捕捉罐中,以及经水处理设备处理后的净化水送入藻类碳捕捉罐;
13.步骤s11,向藻类碳捕捉罐中加入光合绿藻液后,将柠檬酸、cacl2、mgso4·
7h2o、kh2po4、cuso4·
5h2o、edta-fe和净化水混合后,送入藻类碳捕捉罐中;
14.步骤s12,将经过多步纯化后的半夏凝集素蛋白质,与净化水混合后,送入藻类碳捕捉罐中;
15.步骤s13,通过光照设备设定预设光照强度并保持,温度监测仪设定预设温度并保持;
16.步骤s14,进行持续培养,并通过藻浓度监测仪每天坚持光合绿藻的细胞浓度,当细胞浓度达到预设峰值时,将藻类碳捕捉罐中的碳汇藻液排入高浓度藻液储存罐中;
17.步骤s15,将高浓度藻液储存罐中的碳汇藻液排入灌装设备中,进行灌装,以形成碳汇产品。
18.进一步地,所述步骤s12具体包括:
19.步骤s121,将克隆半夏凝集素基因克隆到带有his标签的高表达质粒中,并转化形成细菌培养物进行初步培养后,再用乳糖类似物iptg诱导以进行再次培养;
20.步骤s122,将再次培养的细菌培养物进行高速离心形成细胞沉淀后,采用tris、nacl和蛋白酶抑制剂混合物的裂解缓冲液对细胞沉淀进行裂解以形成细胞裂解液;
21.步骤s123,细胞裂解液依序经过镍亲和层析、离子交换层析柱和凝胶过滤柱纯化后以得到预设纯度的半夏凝集素蛋白质。
22.进一步地,所述步骤s123具体包括:
23.在细胞裂解液使用镍亲和层析纯化后,将蛋白质用500mm的咪唑洗脱形成初步洗脱液;
24.将初步洗脱液中的蛋白峰收集液注入离子交换层析柱中,基于表面离子电荷使用不同浓度的nacl进行梯度纯化形成再次洗脱液;
25.将再次洗脱液注入凝胶过滤柱中进行分离纯化以得到预设纯度的半夏凝集素蛋白质。
26.进一步地,在所述步骤11中,柠檬酸的浓度为20mg/l,cacl2的浓度为2g/l,mgso4·
7h2o的浓度为2g/l,kh2po4的浓度为2g/l,cuso4·
5h2o的浓度为2mg/l,edta-fe的浓度为20mg/l。
27.进一步地,在所述步骤13中,光照强度为2800lux,温度为28℃。
28.进一步地,在所述步骤14中,预设峰值为2000万/毫升,在达到预设峰值前,碳汇藻液的碳汇强度随着培养时间的增加而增强,达到预设峰值后,继续培养会降低碳汇藻液的碳汇强度,且最佳排出碳汇藻液并重复培养步骤的时间为90天。
29.第三方面,本发明中,上述的基于光合绿藻的碳汇藻液的制备方法制得的碳汇藻液的应用,将该碳汇藻液均匀喷洒在辽东栎的叶面上,该碳汇藻液的浓度越高,辽东栎的光合作用越强、碳汇量增加。
30.第四方面,本发明中,上述的基于光合绿藻的碳汇藻液的制备方法制得的碳汇藻
液的应用,将该碳汇藻液均匀喷洒在山楂树的叶面上,该碳汇藻液的浓度越高,山楂树的光合作用越强、碳汇量增加,成熟山楂的糖度提高、不饱和脂肪酸的含量增加。
31.相较现有技术,本发明具备以下优点:
32.第一,设备占地面积小,结构简单,成本低;
33.第二,灌装后的碳汇产品可适用于森林之外的空间,从而可以产生更大的碳汇强度;
34.第三,碳汇藻液捕捉的二氧化碳通过光合作用变成光合绿藻生命活动所需的营养,碳汇藻液中的高浓度光合绿藻又可以应用于各种树木的叶面上,使树木叶面的光合作用提升,从而提升整个森林的碳汇量。
附图说明
35.图1为本发明中基于光合绿藻的碳汇藻液生产设备的方框示意图。
36.如下具体实施方式将结合上述附图进一步说明本发明。
具体实施方式
37.为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。附图中给出了本发明的若干实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容更加透彻全面。
38.除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“及/或”包括一个或多个相关的所列项目的任意的和所有的组合。
39.请参阅图1,本发明一实施例中提供的一种基于光合绿藻的碳汇藻液生产设备,包括设备腔体,以及设于所述设备腔体中的藻类碳捕捉罐;
40.所述藻类碳捕捉罐通过进气管连接空气处理设备,通过进水管连接水处理设备,通过出藻液管连接高浓度藻液储存罐;
41.所述藻类碳捕捉罐上设有藻浓度监测仪、温度监测仪和进藻液管,所述进藻液管用于加入光合绿藻液;
42.所述设备腔体的顶部设有光照设备,所述高浓度藻液储存罐与灌装设备连接。
43.需要说明的是,本发明中,所述藻类碳捕捉罐的体积不小于1m3,便于操作,存放和运输。
44.本发明中,一种基于光合绿藻的碳汇藻液的制备方法,包括以下步骤:
45.(1),空气处理设备净化从设备间外吸入的空气,同时保持吸入二氧化碳浓度为33%,氮气50%,通气速率为200ml/min,空气的压强为0.6mpa;
46.(2),水处理设备净化水,水ph值控制在7.5,tds值在20,将净化后的水通过进水管加入藻类碳捕捉罐;
47.(3),将10l光合绿藻液通过进藻液管加入藻类碳捕捉罐;
48.(4),将20mg/l柠檬酸、2g/l cacl2、2g/l mgso4
·
7h2o、2g/l kh2po4、2mg/l cuso4
·
5h2o、20mg/l edta-fe混合入水处理设备净化后的水,通过进藻液管加入藻类碳捕
捉罐中,以作为光合绿藻生长需要的营养,各个分量均为5g;
49.(5),半夏凝集素纯化,以促进光合绿藻的细胞分裂,将半夏凝集素基因克隆到带有his标签的高表达质粒中。将转化了带有目的基因的质粒的细菌培养物在37℃培养至od 0.4,用0.2mm乳糖类似物iptg诱导,然后在24℃培养过夜。第二天,将细菌培养物高速离心,细胞沉淀用含有20mm tris-ph 7.5、150mm nacl和蛋白酶抑制剂混合物的裂解缓冲液裂解。细胞裂解液将首先使用镍亲和层析纯化,蛋白质将用500mm咪唑洗脱。然后将蛋白峰收集液注入离子交换层析柱,基于表面离子电荷进一步纯化蛋白质。在此步骤中,蛋白质将使用100mm至1m nacl梯度从柱中洗脱。最后,来自离子交换柱的洗脱液将被注入凝胶过滤柱,凝胶过滤柱将根据分子大小进一步分离纯化蛋白质。最终,通过这种三步纯化方案可获得高纯度的半夏凝集素蛋白质,将半夏凝集素蛋白质混合入水处理设备净化后的水,通过进藻液管加入藻类碳捕捉罐;
50.(6),光照设备保持光照强度为2800lux;
51.(7),温度监测仪保持温度为28℃;
52.(8),藻浓度检测仪每天检测光合绿藻细胞浓度;
53.(9),整个程持续20-100天,将藻液通过出藻液管排入高浓度藻液储存罐;
54.(10),将高浓度藻液储存罐中藻液排入灌装设备溶液罐,进行灌装操作,形成碳汇产品;
55.(11),重复步骤(1)至步骤(10);
56.(12),测算步骤(1)至步骤(11),光合绿藻最大固定二氧化碳速率为0.9-2g/(l.d)。
57.进一步需要明确的是,本发明是在更加狭小的空间,制造出类似森林碳汇一样更大碳汇量的设备,广泛的应用可以使我国增加一一个“平原森林”,同时捕捉的二氧化碳会通过光合作用变成藻类生命活动所需的营养,碳汇产物高浓度光合绿藻又可以用于森林中,使森林的叶面光合作用提升,从而提升森林碳汇量。
58.下面以具体的实施例来对发明进行详细说明。
59.实施例1:
60.整体流程步骤为:空气处理设备净化从设备间外吸入的空气,同时保持吸入二氧化碳浓度为33%,氮气为50%,通气速率为200ml/min,空气的压强为0.6mpa;水处理设备净化水,水ph值控制在7.5,tds值在20;将净化后的水通过进水管加入藻类碳捕捉罐;将10l光合绿藻液通过进藻液管加入藻类碳捕捉罐;将20mg/l柠檬酸、2g/l cacl2、2g/l mgso4
·
7h2o、2g/l kh2po4、2mg/l cuso4
·
5h2o、20mg/l edta-fe混合入水处理设备净化后的水,通过进藻液管加入藻类碳捕捉罐;半夏凝集素纯化,将半夏凝集素基因克隆到带有his标签的高表达质粒中。将转化了带有目的基因的质粒的细菌培养物在37℃培养至od 0.4,用0.2mm乳糖类似物iptg诱导,然后在24℃培养过夜。第二天,将细菌培养物高速离心,细胞沉淀用含有20mm tris-ph 7.5、150mm nacl和蛋白酶抑制剂混合物的裂解缓冲液裂解。细胞裂解液将首先使用镍亲和层析纯化,蛋白质将用500mm咪唑洗脱。然后将蛋白峰收集液注入离子交换层析柱,基于表面离子电荷进一步纯化蛋白质。在此步骤中,蛋白质将使用100mm至1m nacl梯度从柱中洗脱。最后,来自离子交换柱的洗脱液将被注入凝胶过滤柱,凝胶过滤柱将根据分子大小进一步分离纯化蛋白质。最终,通过这种三步纯化方案可获得高纯度
的半夏凝集素蛋白质,将半夏凝集素蛋白质混合入水处理设备净化后的水,通过进藻液管加入藻类碳捕捉罐;光照设备保持光照强度为2800lux;温度控制设备保持温度为28摄氏度;藻浓度检测仪每天检测光合绿藻细胞浓度;整个程持续20天,将藻液通过出藻液管排入高浓度藻液储存罐;将高浓度藻液储存罐中藻液排入灌装设备溶液罐,进行灌装操作,形成碳汇产品。
61.实施例2:
62.整体流程步骤为:空气处理设备净化从设备间外吸入的空气,同时保持吸入二氧化碳浓度为33%,氮气为50%,通气速率为200ml/min,空气的压强为0.6mpa;水处理设备净化水,水ph值控制在7.5,tds值在20;将净化后的水通过进水管加入藻类碳捕捉罐;将10l光合绿藻液通过进藻液管加入藻类碳捕捉罐;将20mg/l柠檬酸、2g/l cacl2、2g/l mgso4
·
7h2o、2g/l kh2po4、2mg/l cuso4
·
5h2o、20mg/l edta-fe混合入水处理设备净化后的水,通过进藻液管加入藻类碳捕捉罐;半夏凝集素纯化,将半夏凝集素基因克隆到带有his标签的高表达质粒中。将转化了带有目的基因的质粒的细菌培养物在37℃培养至od 0.4,用0.2mm乳糖类似物iptg诱导,然后在24℃培养过夜。第二天,将细菌培养物高速离心,细胞沉淀用含有20mm tris-ph 7.5、150mm nacl和蛋白酶抑制剂混合物的裂解缓冲液裂解。细胞裂解液将首先使用镍亲和层析纯化,蛋白质将用500mm咪唑洗脱。然后将蛋白峰收集液注入离子交换层析柱,基于表面离子电荷进一步纯化蛋白质。在此步骤中,蛋白质将使用100mm至1m nacl梯度从柱中洗脱。最后,来自离子交换柱的洗脱液将被注入凝胶过滤柱,凝胶过滤柱将根据分子大小进一步分离纯化蛋白质。最终,通过这种三步纯化方案可获得高纯度的半夏凝集素蛋白质,将半夏凝集素蛋白质混合入水处理设备净化后的水,通过进藻液管加入藻类碳捕捉罐;光照设备保持光照强度为2800lux;温度控制设备保持温度为28摄氏度;藻浓度检测仪每天检测光合绿藻细胞浓度;整个程持续30天,将藻液通过出藻液管排入高浓度藻液储存罐;将高浓度藻液储存罐中藻液排入灌装设备溶液罐,进行灌装操作,形成碳汇产品。
63.实施例3:
64.整体流程步骤为:空气处理设备净化从设备间外吸入的空气,同时保持吸入二氧化碳浓度为33%,氮气为50%,通气速率为200ml/min,空气的压强为0.6mpa;水处理设备净化水,水ph值控制在7.5,tds值在20;将净化后的水通过进水管加入藻类碳捕捉罐;将10l光合绿藻液通过进藻液管加入藻类碳捕捉罐;将20mg/l柠檬酸、2g/l cacl2、2g/l mgso4
·
7h2o、2g/l kh2po4、2mg/l cuso4
·
5h2o、20mg/l edta
ꢀ‑
fe混合入水处理设备净化后的水,通过进藻液管加入藻类碳捕捉罐;半夏凝集素纯化,将半夏凝集素基因克隆到带有his标签的高表达质粒中。将转化了带有目的基因的质粒的细菌培养物在37℃培养至od 0.4,用0.2mm乳糖类似物iptg诱导,然后在24℃培养过夜。第二天,将细菌培养物高速离心,细胞沉淀用含有20mm tris-ph 7.5、150mm nacl和蛋白酶抑制剂混合物的裂解缓冲液裂解。细胞裂解液将首先使用镍亲和层析纯化,蛋白质将用500mm咪唑洗脱。然后将蛋白峰收集液注入离子交换层析柱,基于表面离子电荷进一步纯化蛋白质。在此步骤中,蛋白质将使用100mm至1m nacl梯度从柱中洗脱。最后,来自离子交换柱的洗脱液将被注入凝胶过滤柱,凝胶过滤柱将根据分子大小进一步分离纯化蛋白质。最终,通过这种三步纯化方案可获得高纯度的半夏凝集素蛋白质,将半夏凝集素蛋白质混合入水处理设备净化后的水,通过进藻液管
加入藻类碳捕捉罐;光照设备保持光照强度为2800lux;温度控制设备保持温度为28摄氏度;藻浓度检测仪每天检测光合绿藻细胞浓度;整个程持续40天,将藻液通过出藻液管排入高浓度藻液储存罐;将高浓度藻液储存罐中藻液排入灌装设备溶液罐,进行灌装操作,形成碳汇产品。
65.实施例4:
66.基整体流程步骤为:空气处理设备净化从设备间外吸入的空气,同时保持吸入二氧化碳浓度为33%,氮气为50%,通气速率为200ml/min,空气的压强为0.6mpa;水处理设备净化水,水ph值控制在7.5,tds值在20;将净化后的水通过进水管加入藻类碳捕捉罐;将10l光合绿藻液通过进藻液管加入藻类碳捕捉罐;将20mg/l柠檬酸、2g/l cacl2、2g/l mgso4
·
7h2o、2g/l kh2po4、2mg/lcuso4
·
5h2o、20mg/l edta-fe混合入水处理设备净化后的水,通过进藻液管加入藻类碳捕捉罐;半夏凝集素纯化,将半夏凝集素基因克隆到带有his标签的高表达质粒中。将转化了带有目的基因的质粒的细菌培养物在37℃培养至od0.4,用0.2mm乳糖类似物iptg诱导,然后在24℃培养过夜。第二天,将细菌培养物高速离心,细胞沉淀用含有20mm tris-ph 7.5、150mm nacl和蛋白酶抑制剂混合物的裂解缓冲液裂解。细胞裂解液将首先使用镍亲和层析纯化,蛋白质将用500mm咪唑洗脱。然后将蛋白峰收集液注入离子交换层析柱,基于表面离子电荷进一步纯化蛋白质。在此步骤中,蛋白质将使用100mm至1m nacl梯度从柱中洗脱。最后,来自离子交换柱的洗脱液将被注入凝胶过滤柱,凝胶过滤柱将根据分子大小进一步分离纯化蛋白质。最终,通过这种三步纯化方案可获得高纯度的半夏凝集素蛋白质,将半夏凝集素蛋白质混合入水处理设备净化后的水,通过进藻液管加入藻类碳捕捉罐;光照设备保持光照强度为2800lux;温度控制设备保持温度为28摄氏度;藻浓度检测仪每天检测光合绿藻细胞浓度;整个程持续50天,将藻液通过出藻液管排入高浓度藻液储存罐;将高浓度藻液储存罐中藻液排入灌装设备溶液罐,进行灌装操作,形成碳汇产品。
67.实施例5:
68.整体流程步骤为:空气处理设备净化从设备间外吸入的空气,同时保持吸入二氧化碳浓度为33%,氮气为50%,通气速率为200ml/min,空气的压强为0.6mpa;水处理设备净化水,水ph值控制在7.5,tds值在20;将净化后的水通过进水管加入藻类碳捕捉罐;将10l光合绿藻液通过进藻液管加入藻类碳捕捉罐;将20mg/l柠檬酸、2g/l cacl2、2g/l mgso4
·
7h2o、2g/l kh2po4、2mg/l cuso4
·
5h2o、20mg/l edta-fe混合入水处理设备净化后的水,通过进藻液管加入藻类碳捕捉罐;半夏凝集素纯化,将半夏凝集素基因克隆到带有his标签的高表达质粒中。将转化了带有目的基因的质粒的细菌培养物在37℃培养至od 0.4,用0.2mm乳糖类似物iptg诱导,然后在24℃培养过夜。第二天,将细菌培养物高速离心,细胞沉淀用含有20mm tris-ph 7.5、150mm nacl和蛋白酶抑制剂混合物的裂解缓冲液裂解。细胞裂解液将首先使用镍亲和层析纯化,蛋白质将用500mm咪唑洗脱。然后将蛋白峰收集液注入离子交换层析柱,基于表面离子电荷进一步纯化蛋白质。在此步骤中,蛋白质将使用100mm至1m nacl梯度从柱中洗脱。最后,来自离子交换柱的洗脱液将被注入凝胶过滤柱,凝胶过滤柱将根据分子大小进一步分离纯化蛋白质。最终,通过这种三步纯化方案可获得高纯度的半夏凝集素蛋白质,将半夏凝集素蛋白质混合入水处理设备净化后的水,通过进藻液管加入藻类碳捕捉罐;光照设备保持光照强度为2800lux;温度控制设备保持温度为28摄氏
度;藻浓度检测仪每天检测光合绿藻细胞浓度;整个程持续60天,将藻液通过出藻液管排入高浓度藻液储存罐;将高浓度藻液储存罐中藻液排入灌装设备溶液罐,进行灌装操作,形成碳汇产品。
69.实施例6:
70.整体流程步骤为:空气处理设备净化从设备间外吸入的空气,同时保持吸入二氧化碳浓度为33%,氮气为50%,通气速率为200ml/min,空气的压强为0.6mpa;水处理设备净化水,水ph值控制在7.5,tds值在20;将净化后的水通过进水管加入藻类碳捕捉罐;将10l光合绿藻液通过进藻液管加入藻类碳捕捉罐;将20mg/l柠檬酸、2g/l cacl2、2g/l mgso4
·
7h2o、2g/l kh2po4、2mg/l cuso4
·
5h2o、20mg/l edta-fe混合入水处理设备净化后的水,通过进藻液管加入藻类碳捕捉罐;半夏凝集素纯化,将半夏凝集素基因克隆到带有his标签的高表达质粒中。将转化了带有目的基因的质粒的细菌培养物在37℃培养至od 0.4,用0.2mm乳糖类似物iptg诱导,然后在24℃培养过夜。第二天,将细菌培养物高速离心,细胞沉淀用含有20mm tris-ph 7.5、150mm nacl和蛋白酶抑制剂混合物的裂解缓冲液裂解。细胞裂解液将首先使用镍亲和层析纯化,蛋白质将用500mm咪唑洗脱。然后将蛋白峰收集液注入离子交换层析柱,基于表面离子电荷进一步纯化蛋白质。在此步骤中,蛋白质将使用100mm至1m nacl梯度从柱中洗脱。最后,来自离子交换柱的洗脱液将被注入凝胶过滤柱,凝胶过滤柱将根据分子大小进一步分离纯化蛋白质。最终,通过这种三步纯化方案可获得高纯度的半夏凝集素蛋白质,将半夏凝集素蛋白质混合入水处理设备净化后的水,通过进藻液管加入藻类碳捕捉罐;光照设备保持光照强度为2800lux;温度控制设备保持温度为28摄氏度;藻浓度检测仪每天检测光合绿藻细胞浓度;整个程持续70天,将藻液通过出藻液管排入高浓度藻液储存罐;将高浓度藻液储存罐中藻液排入灌装设备溶液罐,进行灌装操作,形成碳汇产品。
71.实施例7:
72.整体流程步骤为:空气处理设备净化从设备间外吸入的空气,同时保持吸入二氧化碳浓度为33%,氮气为50%,通气速率为200ml/min,空气的压强为0.6mpa;水处理设备净化水,水ph值控制在7.5,tds值在20;将净化后的水通过进水管加入藻类碳捕捉罐;将10l光合绿藻液通过进藻液管加入藻类碳捕捉罐;将20mg/l柠檬酸、2g/l cacl2、2g/l mgso4
·
7h2o、2g/l kh2po4、2mg/l cuso4
·
5h2o、20mg/l edta
ꢀ‑
fe混合入水处理设备净化后的水,通过进藻液管加入藻类碳捕捉罐;半夏凝集素纯化,将半夏凝集素基因克隆到带有his标签的高表达质粒中。将转化了带有目的基因的质粒的细菌培养物在37℃培养至od 0.4,用0.2mm乳糖类似物iptg诱导,然后在24℃培养过夜。第二天,将细菌培养物高速离心,细胞沉淀用含有20mm tris-ph 7.5、150mm nacl和蛋白酶抑制剂混合物的裂解缓冲液裂解。细胞裂解液将首先使用镍亲和层析纯化,蛋白质将用500mm咪唑洗脱。然后将蛋白峰收集液注入离子交换层析柱,基于表面离子电荷进一步纯化蛋白质。在此步骤中,蛋白质将使用100mm至1m nacl梯度从柱中洗脱。最后,来自离子交换柱的洗脱液将被注入凝胶过滤柱,凝胶过滤柱将根据分子大小进一步分离纯化蛋白质。最终,通过这种三步纯化方案可获得高纯度的半夏凝集素蛋白质,将半夏凝集素蛋白质混合入水处理设备净化后的水,通过进藻液管加入藻类碳捕捉罐;光照设备保持光照强度为2800lux;温度控制设备保持温度为28摄氏度;藻浓度检测仪每天检测光合绿藻细胞浓度;整个程持续80天,将藻液通过出藻液管排入
高浓度藻液储存罐;将高浓度藻液储存罐中藻液排入灌装设备溶液罐,进行灌装操作,形成碳汇产品。
73.实施例8:
74.整体流程步骤为:空气处理设备净化从设备间外吸入的空气,同时保持吸入二氧化碳浓度为33%,氮气为50%,通气速率为200ml/min,空气的压强为0.6mpa;水处理设备净化水,水ph值控制在7.5,tds值在20;将净化后的水通过进水管加入藻类碳捕捉罐;将10l光合绿藻液通过进藻液管加入藻类碳捕捉罐;将20mg/l柠檬酸、2g/l cacl2、2g/l mgso4
·
7h2o、2g/l kh2po4、2mg/l cuso4
·
5h2o、20mg/l edta
ꢀ‑
fe混合入水处理设备净化后的水,通过进藻液管加入藻类碳捕捉罐;半夏凝集素纯化,将半夏凝集素基因克隆到带有his标签的高表达质粒中。将转化了带有目的基因的质粒的细菌培养物在37℃培养至od 0.4,用0.2mm乳糖类似物iptg诱导,然后在24℃培养过夜。第二天,将细菌培养物高速离心,细胞沉淀用含有20mm tris-ph 7.5、150mm nacl和蛋白酶抑制剂混合物的裂解缓冲液裂解。细胞裂解液将首先使用镍亲和层析纯化,蛋白质将用500mm咪唑洗脱。然后将蛋白峰收集液注入离子交换层析柱,基于表面离子电荷进一步纯化蛋白质。在此步骤中,蛋白质将使用100mm至1m nacl梯度从柱中洗脱。最后,来自离子交换柱的洗脱液将被注入凝胶过滤柱,凝胶过滤柱将根据分子大小进一步分离纯化蛋白质。最终,通过这种三步纯化方案可获得高纯度的半夏凝集素蛋白质,将半夏凝集素蛋白质混合入水处理设备净化后的水,通过进藻液管加入藻类碳捕捉罐;光照设备保持光照强度为2800lux;温度控制设备保持温度为28摄氏度;藻浓度检测仪每天检测光合绿藻细胞浓度;整个程持续90天,将藻液通过出藻液管排入高浓度藻液储存罐;将高浓度藻液储存罐中藻液排入灌装设备溶液罐,进行灌装操作,形成碳汇产品。
75.实施例9:
76.整体流程步骤为:空气处理设备净化从设备间外吸入的空气,同时保持吸入二氧化碳浓度为33%,氮气为50%,通气速率为200ml/min,空气的压强为0.6mpa;水处理设备净化水,水ph值控制在7.5,tds值在20;将净化后的水通过进水管加入藻类碳捕捉罐;将10l光合绿藻液通过进藻液管加入藻类碳捕捉罐;将20mg/l柠檬酸、2g/l cacl2、2g/l mgso4
·
7h2o、2g/l kh2po4、2mg/l cuso4
·
5h2o、20mg/l edta-fe混合入水处理设备净化后的水,通过进藻液管加入藻类碳捕捉罐;半夏凝集素纯化,将半夏凝集素基因克隆到带有his标签的高表达质粒中。将转化了带有目的基因的质粒的细菌培养物在37℃培养至od 0.4,用0.2mm乳糖类似物iptg诱导,然后在24℃培养过夜。第二天,将细菌培养物高速离心,细胞沉淀用含有20mm tris-ph 7.5、150mm nacl和蛋白酶抑制剂混合物的裂解缓冲液裂解。细胞裂解液将首先使用镍亲和层析纯化,蛋白质将用500mm咪唑洗脱。然后将蛋白峰收集液注入离子交换层析柱,基于表面离子电荷进一步纯化蛋白质。在此步骤中,蛋白质将使用100mm至1m nacl梯度从柱中洗脱。最后,来自离子交换柱的洗脱液将被注入凝胶过滤柱,凝胶过滤柱将根据分子大小进一步分离纯化蛋白质。最终,通过这种三步纯化方案可获得高纯度的半夏凝集素蛋白质,将半夏凝集素蛋白质混合入水处理设备净化后的水,通过进藻液管加入藻类碳捕捉罐;光照设备保持光照强度为2800lux;温度控制设备保持温度为28摄氏度;藻浓度检测仪每天检测光合绿藻细胞浓度;整个程持续100天,将藻液通过出藻液管排入高浓度藻液储存罐;将高浓度藻液储存罐中藻液排入灌装设备溶液罐,进行灌装操作,形
成碳汇产品。
77.试验例1:
78.通过测算实施例1-实施例9的光合绿藻固碳,可得到如下数据:
[0079][0080]
由上表可以看出,由于碳汇藻类细胞本身的繁殖到达峰值浓度为2000万/毫升,在达到峰值前,藻类碳汇强度随着培养时间的增加而增强,到达峰值后,继续培养藻类会降低碳汇强度,最佳排除藻液并重复培养步骤时间为90天。
[0081]
试验例2:
[0082]
通过实施例1-实施例9得到的碳汇产品高浓度光合绿藻,分别应用于相同管理条件下的1亩辽东栎,均匀喷洒在叶面,每亩地施用1升,测算一年的碳汇量,可得到如下数据:
[0083][0084]
由上表可以看出,光合绿藻的浓度越高,可以更加增加树木的光合作用,使得树木的碳汇量增加。
[0085]
试验例3
[0086]
通过实施例1-实施例9得到的碳汇产品高浓度光合绿藻,应用于山楂。选取同一管理条件下的2个相同的区域,每个区域1亩,对其中一个区域采用正常施肥(对比例1),一个区域按常规用量施肥,叶面喷施碳汇产品高浓度光合绿藻1l,山楂成熟后,分别测定2个区域山楂中的含糖量和不饱和脂肪酸含量,计算出相对于对比例1的平均增加量,计算结果如下表所示:
[0087][0088]
由上表可以看出,光合绿藻的浓度越高,越能更加增加山楂的光合作用,使得山楂的糖度提高,同时增加不饱和脂肪酸效果更加明显。
[0089]
本说明书中,各个实施例采用递进的方式描述,每个实施例重点说明的都是与其它实施例的不同之处,各个实施例之间相同或相似部分互相参见即可。且以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1