一种酸的晶型及其制备方法与流程
1.本发明属于医药技术领域,涉及一种酸的晶型及其制备方法。
背景技术:
2.化合物德度司他(desidustat),其结构如下式所示,其是一种低氧诱导因子脯氨酰羟化酶抑制剂(hif-phi),目前处于用于治疗慢性肾病(ckd)引起的贫血的临床试验中。
[0003][0004]
在专利cn104903295b等文献中公开了德度司他的结构、制备方法,但未公开所得产物具体形态信息,美国专利申请us20190359574公开的德度司他的一种晶型,但未公开是否存在其他晶型及可能的晶型的相关性能信息。
[0005]
因药物的晶型形式对药物的制备、药物制剂的制备、储存、应用和溶出、生物利用度等存在重要影响,不同晶型可能在多方面存在差异,可能导致药物制剂的药效、安全性及应用存在明显差异或易不符合质量要求的问题,因此需要研究药物的晶型形式。发明人对德度司他的晶型进行了相关研究,发现了可以应用的新晶型。
技术实现要素:
[0006]
发明概述
[0007]
本发明主要涉及化合物德度司他的新晶型。本发明提供的部分新晶型具有稳定、有利于实施应用的特性。
[0008]
另一方面,本发明还提供了新晶型的制备方法和药物组合物等。
[0009]
术语定义
[0010]
本发明意图涵盖所有的替代、修改和等同技术方案,它们均包括在如权利要求定义的本发明范围内。本领域技术人员应认识到,许多与本文所述类似或等同的方法和材料能够用于实践本发明。本发明绝不限于本文所述的方法和材料。在所结合的文献、专利和类似材料的一篇或多篇与本技术不同或相矛盾的情况下(包括但不限于所定义的术语、术语应用、所描述的技术等等),以本技术为准。
[0011]
应进一步认识到,本发明的某些特征,为清楚可见,在多个独立的实施方案中进行了描述,但也可以在单个实施例中以组合形式提供。反之,本发明的各种特征,为简洁起见,在单个实施方案中进行了描述,但也可以单独或以任意合适的子组合提供。
[0012]
除非另外说明,本发明所使用的所有科技术语具有与本发明所属领域技术人员的通常理解相同的含义。本发明涉及的所有专利和公开出版物通过引用方式整体并入本发明。
[0013]
除非另外说明,应当应用本文所使用的下列定义。出于本发明的目的,化学元素与元素周期表cas版,和1994年第75版《化学和物理手册》一致。此外,有机化学一般原理可参考"organic chemistry",thomas sorrell,university science books,sausalito:1999,和"march's advanced organic chemistry”by michael b.smith and jerry march,john wiley&sons,new york:2007中的描述,其全部内容通过引用并入本文。
[0014]
术语“包含”或“包括”为开放式表达,即包括本发明所指明的内容,但并不排除其他方面的内容。
[0015]
术语“基本上如图所示”是指基本上纯净的某种“晶型”其x-射线粉末衍射图中至少50%,或至少60%,或至少70%,或至少80%,或至少90%,或至少95%,或至少99%的峰出现在所给出的x-射线粉末衍射图中。当样品中某种晶型的含量逐渐降低时,其x-射线粉末衍射图中的一些归属于该晶型的衍射峰可能会由于仪器的检测灵敏度的因素而变少。
[0016]
术语“相对强度”是指将归属于某一晶型的一组衍射峰中的第一强峰的强度定义为100%时,其它峰的强度与第一强峰的强度的比值。
[0017]
在本发明的上下文中,x-射线粉末衍射图中的2θ(又称2theta或衍射峰)值均以度(
°
)为单位。
[0018]
当提及图谱和/或图中数据,术语“衍射峰”是指本领域的技术人员不会归属于背景噪音的一个特征。
[0019]
所述晶体的x-射线粉末衍射峰,其x-射线粉末衍射图谱的2θ或衍射峰的量度有实验误差,在一台机器和另一台机器之间以及一个样品和另一个样品之间,x-射线粉末衍射图谱的2θ或衍射峰的量度可能会略有差别,所述2θ的误差为
±
0.2
°
,因此所述2θ或衍射峰的数值不能视为绝对的。
[0020]
所述晶体的差示扫描量热曲线(dsc)有实验误差,在一台机器和另一台机器之间以及一个样品和另一个样品之间,吸热峰的位置和峰值可能会略有差别,实验误差或差别的数值可能小于等于4℃,或小于等于3℃,或小于等于2℃,或小于等于1℃,因此所述dsc吸热峰的峰位置或峰值的数值不能视为绝对的。
[0021]
所述晶体的热重分析曲线(tga)有实验误差,在一台机器和另一台机器之间以及一个样品和另一个样品之间,吸热曲线或失重率可能会略有差别,实验误差或差别的数值可能小于等于0.004%或0.003%或0.002%或0.001%,因此所述热重分析曲线或其失重率不能视为绝对的。
[0022]
在本发明上下文中,无论是否使用“大约”或“约”等字眼,所有在此公开了的数字均为近似值,基于公开的数值,每一个数字的数值有可能会出现+/-1%,+/-2%,+/-3%,+/-4%,或+/-5%等差异。当大约用来形容x-射线粉末衍射峰的2θ(又称2theta或衍射峰)值时,大约表示所述2θ值可能有+/-0.2个单位或+/-0.1个单位或+/-0.05个单位差异。
[0023]“室温”是指温度在大约20℃-35℃或大约23℃-28℃或大约25℃。
[0024]
术语“良溶剂”可以是单一溶剂或混合溶剂,指样品在该单一溶剂或混合溶剂中的溶解度大于1g/l,或大于2g/l,或大于3g/l,或大于4g/l,或大于5g/l,或大于6g/l,或大于
7g/l,或大于8g/l,或大于9g/l,或大于10g/l,或大于15g/l,或大于20g/l,或大于30g/l,或大于40g/l,或大于50g/l,或大于60g/l,或大于70g/l,或大于80g/l,或大于100g/l。在一些实施例中,样品在良溶剂中的溶解度比反溶剂大;在一些实施例中,良溶剂和反溶剂对样品的溶解度之差大约为10%,20%,30%,40%,50%,60%,70%,80%或90%;在一些实施例中,良溶剂对样品的溶解度比反溶剂大,大于10%,20%,30%,40%,50%,60%,70%,80%或90%。
[0025]
本发明中,将美国专利申请us20190359574公开的德度司他的晶型称为晶型α,晶型α的xrpd具有2θ(单位:度,
°
)为8.0,8.9,10.6,11.3,16.1,25.5和26.4度的衍射峰。
[0026]
发明详述
[0027]
一方面,发明人通过研究开发了德度司他的新晶型,包括:晶型a,晶型b,晶型c,晶型d,晶型d-1,晶型e,晶型f,晶型g,晶型h和晶型i。
[0028]
一种德度司他的晶型,称为晶型a,其x-射线粉末衍射图谱具有2θ(单位:度,
°
,误差
±
0.2
°
)为10.31,11.25,14.74,17.53,19.02,21.28,21.70,22.57,27.05和28.23度的衍射峰。
[0029]
一些实施方式中,所述晶型a的x-射线粉末衍射图谱具有2θ为10.31,11.25,14.74,17.53,19.02,19.75,21.28,21.70,22.57,24.53,27.05,28.23,34.56和38.54度的衍射峰。
[0030]
一些实施方式中,所述晶型a的x-射线粉末衍射图谱在2θ为10.31,11.25,14.06,14.74,17.53,18.21,19.02,19.75,21.28,21.70,22.57,23.27,24.53,25.83,27.05,28.23,29.66,30.15,34.56和38.54度的位置有衍射峰。
[0031]
在一些实施方式中,晶型a的x-射线粉末衍射(xrpd)图如图1所示。
[0032]
所述晶型a还具有如下特性,其差示扫描量热曲线(dsc)中在208℃-218℃范围内具有吸热峰。在一些实施方式中,晶型a的差示扫描量热曲线(dsc)中在213℃-217℃具有吸热峰。在一些实施方式中,晶型a的差示扫描量热曲线(dsc)中在211℃-215℃具有吸热峰,峰顶值为216℃。在一些实施方式中,晶型a的差示扫描量热曲线(dsc)如图2所示。
[0033]
所述晶型a的热重分析曲线(tga)中,在低于200℃范围内无失重。根据晶型a的tga,认为所述晶型a为无水晶型,非溶剂化物。
[0034]
在一些实施方式中,晶型a的热重分析曲线(tga)如图3所示。
[0035]
根据影响因素稳定性试验研究,发现晶型a是一种稳定晶型,在高温、高湿或光照条件下稳定,不会发生晶型转变。根据晶型a的性能研究实验结果,认为晶型a是一种不易吸湿,相对已知晶型,更具有竞争性。
[0036]
另一方面,本发明提供了制备所述晶型a的方法。
[0037]
在一些实施方式中,一种制备所述德度司他晶型a的方法,包括:将德度司他溶于结晶溶剂中,然后降温析出晶体,过滤,去除溶剂,得到晶型a;所述结晶溶剂为异丁醇,乙酸乙酯和乙腈中的至少一种。德度司他与结晶溶剂的质量体积比可以为10mg:1ml-100mg:1ml。在一些实施方式中,在加热条件下,将德度司他溶于结晶溶剂中,温度可以为20℃-80℃。在一些实施方式中,将溶液降温至-10℃-25℃析出晶体。在一些实施方式中,将溶液降温至-10℃-15℃析出晶体。在一些实施方式中,将溶液降温至-5℃-10℃析出晶体。在一些实施方式中,将溶液降温至-10℃,-5℃,0℃,5℃或10℃,析出晶体。
[0038]
在一些实施方式中,一种制备德度司他晶型a的方法,包括:将德度司他溶于良溶剂中,溶清后与反溶剂混合,析出晶体,过滤,去除溶剂,得到晶型a;所述良溶剂为乙二醇二甲醚或n,n-二甲基乙酰胺或其组合;所述反溶剂为乙醇或异丙醇或其组合。德度司他与良溶剂的质量体积比为5mg:1ml-100mg:1ml。反溶剂与良溶剂的体积比可以为1:1-10:1,优选3:1-7:1。所述析出晶体的温度可以控制为-5℃-50℃,优选-5℃-25℃。在一些实施方式中,所述析出晶体的温度为-5℃-10℃或-5℃-5℃。在一些实施方式中,将反溶剂加入德度司他与良溶剂的溶液中。
[0039]
在一些实施方式中,一种制备德度司他晶型a的方法,包括:将德度司他与溶剂混合,在20℃-80℃混悬搅拌20小时或其以上,过滤,去除溶剂,得到晶型a;所述溶剂为水,甲醇,乙醇,异丙醇,正丁醇,丙酮,丁酮,甲基异丁基酮,甲酸乙酯,甲酸丁酯,乙酸乙酯,乙酸异丙酯,乙腈,异丙醚和甲基叔丁基醚中的至少一种。在一些实施方式中,在40℃-70℃混悬搅拌20小时-48小时。德度司他与溶剂的质量体积比可以为1mg:1ml-100mg:1ml。在一些实施方式中,一种制备德度司他晶型a的方法,包括:将德度司他与水,乙醇,或其组合溶剂混合,在40℃-70℃混悬搅拌20小时-48小时,过滤,去除溶剂,得到晶型a。
[0040]
在一些实施方式中,一种制备德度司他晶型a的方法,包括:将德度司他溶于溶剂中,在20℃-80℃条件下挥发除去溶剂,得到晶型a;所述溶剂为乙二醇二甲醚。德度司他与溶剂的质量体积比可以为10mg:1ml-200mg:1ml。
[0041]
另一方面,一种德度司他的新晶型,称为晶型b。
[0042]
德度司他的晶型b,其x-射线粉末衍射图谱具有2θ(单位:度,
°
,误差
±
0.2
°
)为7.81,10.20,11.09,16.19,18.47,22.45,23.67和26.95度的衍射峰。
[0043]
一些实施方式中,所述晶型b的x-射线粉末衍射图谱具有2θ为7.81,10.20,11.09,14.62,15.70,16.19,18.47,18.89,22.45,23.67和26.95度的衍射峰。
[0044]
一些实施方式中,所述晶型b的x-射线粉末衍射图谱具有2θ为7.81,10.20,11.09,13.11,14.62,15.70,16.19,18.47,18.89,19.74,21.14,22.06,22.45,23.67,26.95,27.83和28.11度的衍射峰。
[0045]
在一些实施方式中,所述晶型b的x-射线粉末衍射(xrpd)图如图4所示。
[0046]
所述晶型b的差示扫描量热曲线(dsc)在210℃-220℃范围内具有吸热峰,峰顶值为214℃。
[0047]
在一些实施方式中,所述晶型b的热重分析曲线(tga)在30℃-120℃范围内失重超过5%。在一些实施方式中,所述晶型b的热重分析曲线(tga)在30℃-120℃范围内失重约为8.18%。根据晶型b的tga结果,认为晶型b为溶剂化物。在一些实施方式中,所述晶型b为德度司他的1,4-二氧六环的溶剂化物,德度司他与1,4-二氧六环的摩尔比为1:0.5。
[0048]
一种制备晶型b的方法,包括:将德度司他与1,4-二氧六环混合,混悬搅拌,然后过滤,干燥,得到晶型b;或者包括:将德度司他与n,n-二甲基甲酰胺、n,n-二甲基乙酰胺中的至少一种及1,4-二氧六环混合,其中1,4-二氧六环与另一种溶剂的体积比为15:1-25:1,混悬搅拌,然后过滤,干燥,得到晶型b;或者包括:将德度司他与1,4-二氧六环混合,使固体溶解得到溶液,然后降温至-10℃~10℃,析晶,过滤,干燥,得到晶型b。制备晶型b的方法中,德度司他与溶剂的质量体积比可以为10mg:1ml-50mg:1ml。
[0049]
发明人经过研究,还开发了一种德度司他的新晶型,称为晶型c。晶型c的x-射线粉
末衍射图谱中,在2θ(单位:度,
°
,误差
±
0.2
°
)为6.49,9.25,10.55,11.22,16.19,16.35,17.63,18.61,19.62,19.87和24.19度的位置有衍射峰。
[0050]
在一些实施方式中,所述晶型c的x-射线粉末衍射图谱中,在2θ为6.49,7.60,9.25,10.55,11.22,16.19,16.35,17.63,18.61,19.62,19.87,21.58,22.59,23.02和24.19度的位置有衍射峰。
[0051]
在一些实施方式中,所述晶型c的x-射线粉末衍射图谱中,在2θ为6.49,7.60,9.25,10.55,11.22,12.60,15.27,16.19,16.35,17.63,18.61,19.62,19.87,21.58,22.59,23.02,23.63,24.19,26.27和26.92度的位置有衍射峰。
[0052]
在一些实施方式中,晶型c的x-射线粉末衍射(xrpd)图如图5所示。
[0053]
一种制备晶型c的方法包括:将德度司他溶于n,n-二甲基甲酰胺或溶于n,n-二甲基甲酰胺和丁酮或溶于n,n-二甲基甲酰胺和甲基异丁基酮的混合溶剂中,挥发除去溶剂,得到晶型c;德度司他与溶剂的体积比可以为10mg:1ml-100mg:1ml;挥发除去溶剂的温度可以为40℃~80℃。
[0054]
一种制备晶型c的方法包括:将德度司他与n,n-二甲基甲酰胺和乙酸异丙酯的混合溶剂在20℃~50℃混悬搅拌20小时-24小时,然后过滤,除去溶剂,得到晶型c;德度司他与使用的溶剂的体积比可以为10mg:1ml-50mg:1ml。
[0055]
一种制备晶型c的方法包括:将德度司他溶于n,n-二甲基甲酰胺中,然后与反溶剂混合,析晶,过滤,得到晶型c;所述反溶剂可以为甲基叔丁基醚,乙醇,异丙醇,丁酮,甲酸丁酯和乙酸异丙酯中的至少一种。所述反溶剂与n,n-二甲基甲酰胺的体积比可以为0.5:1-10:1,优选5:1-8:1。德度司他与n,n-二甲基甲酰胺的质量体积比可以为60mg:1ml-100mg:1ml。
[0056]
发明人经过研究,还开发了一种德度司他的新晶型,称为晶型d。晶型d的x-射线粉末衍射图谱中,在2θ(单位:度,
°
,误差
±
0.2
°
)为7.36,11.19,14.73和22.16度的位置有衍射峰。
[0057]
在一些实施方式中,所述晶型d的x-射线粉末衍射图谱中,在2θ为7.36,11.19,14.73,15.19,18.82和22.16度的位置有衍射峰。
[0058]
在一些实施方式中,所述晶型d的x-射线粉末衍射图谱中,在2θ为7.36,11.19,14.73,15.19,18.47,18.82,22.16和25.69度的位置有衍射峰。
[0059]
在一些实施方式中,晶型d的x-射线粉末衍射(xrpd)图如图6所示。
[0060]
在一些实施方式中,将德度司他溶于碳酸二甲酯中,降温至-10℃-15℃,析晶,得到晶型d;德度司他与碳酸二甲酯的质量体积比可以为1mg:1ml-100mg:1ml。
[0061]
发明人经过研究,还开发了一种德度司他的新晶型,称为晶型d-1。晶型d-1的x-射线粉末衍射图谱具有2θ(单位:度,
°
,误差
±
0.2
°
)为11.12,14.61,18.89,21.15,22.44,26.91和28.10度的衍射峰。
[0062]
一些实施方式中,所述晶型d-1,其x-射线粉末衍射图谱具有2θ为10.17,11.12,14.61,17.42,18.89,21.15,22.44,24.40,26.91和28.10度的衍射峰。
[0063]
一些实施方式中,所述晶型d-1,其x-射线粉末衍射图谱具有2θ为10.17,11.12,14.61,17.42,18.89,21.15,21.57,22.44,24.40,26.91,27.43,28.10,29.53,30.01,34.43和38.41度的衍射峰。
[0064]
一些实施方式中,所述晶型d-1的x-射线粉末衍射(xrpd)图如图7所示。
[0065]
所述晶型d-1还具有如下特性,其差示扫描量热曲线(dsc)中在210℃-218℃范围内具有吸热峰。在一些实施方式中,晶型d-1的差示扫描量热曲线(dsc)中在210℃-216℃具有吸热峰。在一些实施方式中,晶型d-1的差示扫描量热曲线(dsc)中在211℃-216℃具有吸热峰,峰顶值为215℃。在一些实施方式中,晶型d-1的差示扫描量热曲线(dsc)如图8所示。
[0066]
所述晶型d-1的热重分析曲线(tga)在低于200℃基本上无失重。根据晶型d-1的tga,认为所述晶型d-1为无水晶型,非溶剂化物。
[0067]
在一些实施方式中,晶型d-1的热重分析曲线(tga)如图9所示。
[0068]
一种制备晶型d-1的方法,包括:将前述的晶型d在40℃~80℃条件下真空干燥12小时-24小时,得到晶型d-1。
[0069]
发明人经过研究,还开发了一种德度司他的新晶型,称为晶型e。晶型e的x-射线粉末衍射图谱具有2θ(单位:度,
°
,误差
±
0.2
°
)为8.35,9.83,10.38,17.56,17.74,19.76,23.42,25.81,26.23和27.41度的衍射峰。
[0070]
一些实施方式中,所述晶型e,其x-射线粉末衍射图谱具有2θ为8.35,9.83,10.38,13.34,17.56,17.74,19.76,23.42,25.26,25.81,26.23,26.90,27.17,27.41和29.77度的衍射峰。
[0071]
一些实施方式中,所述晶型e,其x-射线粉末衍射图谱中,在2θ为8.35,9.83,10.38,13.34,16.76,17.56,17.74,18.01,19.76,20.87,22.51,22.98,23.42,25.26,25.81,26.23,26.90,27.17,27.41,28.97,29.77和34.56度的位置有衍射峰。
[0072]
在一些实施方式中,晶型e的x-射线粉末衍射(xrpd)图如图10所示。
[0073]
所述晶型e还具有如下特性,其差示扫描量热曲线(dsc)中在130℃-142℃具有吸热峰。在一些实施方式中,晶型e的差示扫描量热曲线(dsc)中在133℃-138℃具有吸热峰。在一些实施方式中,晶型e的差示扫描量热曲线(dsc)中具有吸热峰,峰顶值为135℃。
[0074]
所述晶型e的热重分析曲线(tga)在60℃-120℃有失重,失重量超过15%。
[0075]
在一些实施方式中,晶型e的热重分析曲线在60℃-120℃有失重,失重量为19.32%。根据晶型e的tga结果,认为晶型e为溶剂化物。在一些实施方式中,所述晶型e为德度司他的二甲基亚砜的溶剂化物,德度司他与二甲基亚砜的摩尔比为1:1。
[0076]
一种制备所述晶型e的方法,包括:将德度司他溶于二甲基亚砜,然后加入反溶剂,如水、乙醇、丙酮、乙酸乙酯或其组合,在10℃-30℃条件下析晶,过滤,干燥,得到晶型e。所述反溶剂与二甲基亚砜的体积比可以为0.5:1-10:1,优选2:1-6:1;德度司他与二甲基亚砜的质量体积比可以为10mg:1ml-80mg:1ml。
[0077]
在一些实施方式中,一种制备所述晶型e的方法,包括:将德度司他溶于二甲基亚砜,在20℃-80℃条件下挥发除去溶剂,得到晶型e;德度司他与二甲基亚砜的质量体积比为1mg:1ml-100mg:1ml。
[0078]
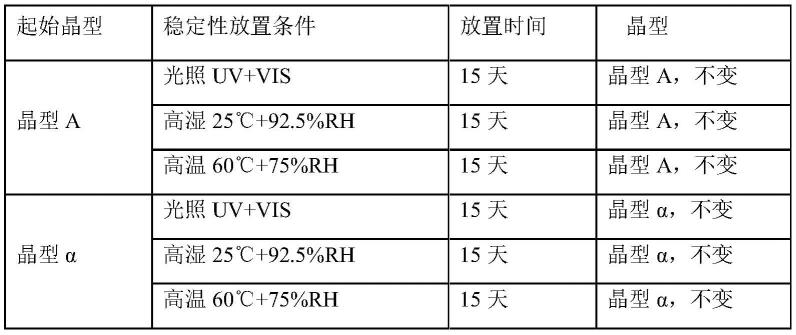
在一些实施方式中,一种制备所述晶型e的方法,包括:将德度司他与二甲基亚砜及乙酸乙酯、丙酮、甲基异丁基酮、乙醇和1,4-二氧六环中的至少一种混合,在20℃~80℃混悬搅拌24小时-48小时,过滤、干燥,得到晶型e;德度司他与溶剂的质量体积比为5mg:1ml-50mg:1ml。
[0079]
发明人经过研究,还开发了一种德度司他的新晶型,称为晶型f。
[0080]
根据本发明的一些实施例,晶型f,其x-射线粉末衍射图谱中,在2θ(单位:度,
°
,误差
±
0.2
°
)为8.27,8.90,9.43,16.47,17.06,18.93,24.73和26.51度的位置有衍射峰。
[0081]
根据本发明的一些实施例,晶型f,其x-射线粉末衍射图谱中,在2θ为8.27,8.90,9.43,14.36,15.47,16.47,17.06,18.93,21.73,23.73,24.73,26.51和27.01度的位置有衍射峰。
[0082]
在一些实施方式中,所述晶型f,其x-射线粉末衍射图谱中,在2θ为8.27,8.90,9.43,12.51,13.28,14.36,15.47,16.47,17.06,18.93,20.64,21.73,21.85,23.31,23.73,24.73,26.51,27.01,28.37,30.15和33.12度的位置有衍射峰。
[0083]
在一些实施方式中,晶型f的x-射线粉末衍射(xrpd)图如图11所示。
[0084]
所述晶型f还具有如下特性,其差示扫描量热曲线(dsc)在112℃-125℃范围内具有吸热峰。在一些实施方式中,所述晶型f的差示扫描量热曲线(dsc)具有吸热峰,峰顶值为120℃。
[0085]
所述晶型f还具有如下特性,其热重分析曲线(tga)在60℃-130℃间有失重,失重量超过20%。在一些实施方式中,晶型f的热重分析曲线(tga)在60℃-130℃间有失重,失重量为22.28%。根据晶型f的tga结果,认为晶型f为溶剂化物。
[0086]
一种制备所述晶型f的方法,包括:将德度司他溶于n-甲基吡咯烷酮或将德度司他溶于水、乙酸乙酯和丙酮中的至少一种和n-甲基吡咯烷酮的混合溶剂中,然后在20℃~80℃条件下挥发除去溶剂,得到晶型f;德度司他和所用溶剂的质量体积比可以为1mg:1ml-100mg:1ml。
[0087]
在一些实施方式中,一种制备所述晶型f的方法,包括:将乙酸乙酯和甲基叔丁基醚中的至少一种和n-甲基吡咯烷酮的混合溶剂与德度司他混合,在20℃~80℃混悬搅拌一段时间,过滤,得到晶型f。
[0088]
在一些实施方式中,一种制备所述晶型f的方法,包括:将德度司他溶于n-甲基吡咯烷酮,溶清后,加入反溶剂乙醇,异丙醚或其组合,在10℃~30℃条件下析晶,过滤,干燥,得到晶型f;所述反溶剂与n-甲基吡咯烷酮的体积比为0.5:1-10:1,优选2:1-6:1;德度司他和n-甲基吡咯烷酮的质量体积比可以为10mg:1ml-80mg:1ml。
[0089]
一种德度司他的新晶型,称为晶型g,其x-射线粉末衍射图谱中,在2θ(单位:度,
°
,误差
±
0.2
°
)为8.31,8.60,9.01,10.24,15.73,17.21,19.34和24.90度的位置有衍射峰。
[0090]
在一些实施方式中,所述晶型g,其x-射线粉末衍射图谱中,在2θ为8.31,8.60,9.01,9.60,10.24,15.73,16.63,17.21,19.34和24.90度的位置有衍射峰。
[0091]
在一些实施方式中,所述晶型g,其x-射线粉末衍射图谱中,在2θ为8.31,8.60,9.01,9.60,10.24,10.95,11.69,13.52,15.73,16.63,16.72,17.21,17.62,18.05,19.34,22.11,24.90,27.63和30.27度的位置有衍射峰。
[0092]
在一些实施方式中,晶型g的x-射线粉末衍射(xrpd)图如图12所示。
[0093]
一种制备所述晶型g的方法,包括:德度司他溶于n,n-二甲基乙酰胺和有机溶剂的混合溶剂中,然后在40℃~80℃条件下挥发除去溶剂,得到晶型g;所述有机溶剂为甲酸乙酯、甲酸丁酯、乙酸乙酯、乙酸异丙酯、乙腈、1,4-二氧六环和甲基叔丁基醚中的至少一种;德度司他与所用混合溶剂的质量体积比可以为1mg:1ml-50mg:1ml。
[0094]
一种德度司他的新晶型,称为晶型h,其x-射线粉末衍射的图谱中,在2θ(单位:
度,
°
,误差
±
0.2
°
)为4.88,7.63,8.21,8.37,8.72,9.21,10.73,12.09,12.55,14.57,14.76,15.82,16.26,17.49,18.50,19.38,22.77,23.09,23.65,26.83,27.56和28.49度的位置有衍射峰。
[0095]
在一些实施方式中,所述晶型h,其x-射线粉末衍射图谱中,在2θ为4.88,7.63,8.21,8.37,8.72,9.21,9.65,10.24,10.73,12.09,12.55,14.57,14.76,15.82,16.26,16.71,17.49,18.50,19.38,22.77,23.09,23.65,24.04,24.36,24.89,25.35,26.54,26.83,27.56和28.49度的位置有衍射峰。
[0096]
在一些实施方式中,所述晶型h,其x-射线粉末衍射图谱中,在2θ为4.88,7.63,8.21,8.37,8.72,9.21,9.65,10.24,10.73,11.77,12.09,12.55,13.53,14.57,14.76,15.82,16.26,16.71,17.49,18.50,18.95,19.38,19.75,20.66,21.26,22.01,22.41,22.77,23.09,23.65,24.04,24.36,24.89,25.35,26.54,26.83,27.56,28.49,29.37和31.69度的位置有衍射峰。
[0097]
在一些实施方式中,晶型h的x-射线粉末衍射(xrpd)图如图13所示。
[0098]
一种制备所述晶型h的方法,包括:将德度司他溶于n,n-二甲基乙酰胺和甲基异丁基酮的混合溶剂中,或者将德度司他溶于n,n-二甲基乙酰胺和碳酸二甲酯的混合溶剂中,然后在40℃~80℃条件下挥发除去溶剂,得到晶型h;所述德度司他与混合溶剂的质量体积比可以为1mg:1ml-50mg:1ml。所述n,n-二甲基乙酰胺与碳酸二甲酯或甲基异丁基酮的体积比可以为1:5-1:10。
[0099]
另一方面,本发明还提供了德度司他的一种晶型,称为晶型i。
[0100]
所述晶型i,其x-射线粉末衍射的图谱中,在2θ(单位:度,
°
,误差
±
0.2
°
)为8.15,8.51,8.78,10.26,16.45,18.03,22.56,24.52和24.69度的位置有衍射峰。
[0101]
在一些实施方式中,所述晶型i,其x-射线粉末衍射的图谱中,在2θ为8.15,8.51,8.78,10.26,11.19,16.45,17.07,17.50,18.03,19.32,22.56,24.52,24.69和25.05度的位置有衍射峰。
[0102]
在一些实施方式中,所述晶型i,其x-射线粉末衍射的图谱中,在2θ为8.15,8.51,8.78,9.63,10.26,11.19,12.44,16.45,17.07,17.50,18.03,18.92,19.32,20.55,20.83,22.56,23.71,24.52,24.69,25.05,25.58,27.87,28.38,29.00,29.81,32.96,33.28和36.59度的位置有衍射峰。
[0103]
在一些实施方式中,晶型i的x-射线粉末衍射(xrpd)图如图14所示。
[0104]
一种制备所述晶型i的方法,包括:将德度司他溶于乙二醇单甲醚和乙酸乙酯的混合溶剂,或溶于乙二醇单甲醚和异丙醚的混合溶剂中,然后在40℃-80℃挥发除去溶剂,得到晶型i;德度司他与混合溶剂的质量体积比可以为1mg:1ml-50mg:1ml。
[0105]
根据对前述的各种晶型的特性、性能研究,认为所述的晶型a和晶型d-1存在较好的稳定性,有利于储存、转移、生产工艺中操作,可与药学上可接受的载体制备成其药用组合物;而其它晶型则存在或多或少的不适于制备药物制剂的性质,如稳定性相对较低,或为溶剂化物,具有更高的不安全性等,或者溶解性较差,不利于制剂溶出等。
[0106]
所述的晶型a和晶型d-1还为具有良好外观和流动性的粉末,在溶出度、流动性等方面具有相对良好的性能,有利于储存、转移、生产工艺中操作,适于与药学上可接受的载体制备成其药用组合物。
[0107]
另一方面,本发明还提供一种组合物。
[0108]
一种组合物,其包括:选自前述的晶型a,晶型b,晶型c,晶型d,晶型d-1,晶型e,晶型f,晶型g,晶型h和晶型i中的至少一种和药学上可接受的辅料。
[0109]
在一些实施方式中,一种组合物,包括前述的晶型a和药学上可接受的辅料。在一些实施方式中,一种组合物,包括前述的晶型a和药学上可接受的辅料;还可以包括选自前述的晶型b,晶型c,晶型d,晶型d-1,晶型e,晶型f,晶型g,晶型h和晶型i中的至少一种。在一些实施方式中,一种组合物,包括前述的晶型a和药学上可接受的辅料;还可以包括前述的晶型d-1。
[0110]
在一些实施方式中,一种组合物,包括前述的晶型d-1和药学上可接受的辅料。在一些实施方式中,一种组合物,包括前述的晶型d-1和药学上可接受的辅料;还可以包括前述的晶型a,晶型b,晶型c,晶型d,晶型e,晶型f,晶型g,晶型h和晶型i中的至少一种和药学上可接受的辅料。
[0111]
在一些实施方式中,所述组合物中,按照质量比计算,所述晶型为德度司他的至少80%。在一些实施方式中,所述组合物中,按照质量比计算,所述晶型为德度司他的至少85%。在一些实施方式中,所述组合物中,按照质量比计算,所述晶型为德度司他的至少90%。在一些实施方式中,所述组合物中,按照质量比计算,所述晶型为德度司他的至少95%。在一些实施方式中,所述组合物中,按照质量比计算,所述晶型为德度司他的至少97%。在一些实施方式中,所述组合物中,按照质量比计算,所述晶型为德度司他的至少99%。
[0112]
在一些实施方式中,所述组合物中,按照质量比计算,所述晶型为德度司他的至少10%。在一些实施方式中,所述组合物中,按照质量比计算,所述晶型为德度司他的至少5%。在一些实施方式中,所述组合物中,按照质量比计算,所述晶型为德度司他的至少1%。在一些实施方式中,所述组合物中,按照质量比计算,所述晶型为德度司他的至少0.5%。在一些实施方式中,所述组合物中,按照质量比计算,所述晶型为德度司他的至少5%-10%。
[0113]
在一些实施方式中,所述组合物中,按照质量比计算,所述晶型不超过德度司他的10%。在一些实施方式中,所述组合物中,按照质量比计算,所述晶型不超过德度司他的6%。在一些实施方式中,所述组合物中,按照质量比计算,所述晶型不超过德度司他的5%。在一些实施方式中,所述组合物中,按照质量比计算,所述晶型不超过德度司他的3%。在一些实施方式中,所述组合物中,按照质量比计算,所述晶型不超过德度司他的1%。在一些实施方式中,所述组合物中,按照质量比计算,所述晶型不超过德度司他的0.5%。
[0114]
在一些实施方式中,所述组合物中,按照质量比计算,所述晶型为组合物总质量的至少0.05%-95%,0.1%-95%,1%-95%,5%-95%,或1%-50%。
[0115]
在一些实施方式中,一种组合物,包括前述的晶型a和药学上可接受的辅料;按照质量比计算,所述晶型a为德度司他的至少5%-10%。在一些实施方式中,一种组合物,包括前述的晶型a和药学上可接受的辅料;按照质量比计算,所述晶型a为组合物总重量的至少0.5%-5%。在一些实施方式中,一种组合物,包括前述的晶型a和药学上可接受的辅料;按照质量比计算,所述晶型a为德度司他的至少80%。在一些实施方式中,一种组合物,包括前述的晶型a和药学上可接受的辅料;按照质量比计算,所述晶型a为组合物总重量的至少90%,或至少95%,或至少99%。
[0116]
在一些实施方式中,一种组合物,包括前述的晶型d-1和药学上可接受的辅料;按照质量比计算,所述晶型d-1为德度司他的至少5%-10%。在一些实施方式中,一种组合物,包括前述的晶型d-1和药学上可接受的辅料;按照质量比计算,所述晶型d-1为组合物总重量的至少0.5%-5%。在一些实施方式中,一种组合物,包括前述的晶型d-1和药学上可接受的辅料;按照质量比计算,所述晶型d-1为德度司他的至少80%。在一些实施方式中,一种组合物,包括前述的晶型d-1和药学上可接受的辅料;按照质量比计算,所述晶型d-1为组合物总重量的至少90%,或至少95%,或至少99%。
[0117]
在一些实施方式中,所述的组合物,包括前述的晶型a或晶型d-1和药学上可接受的辅料,还可以包括晶型α。
[0118]
所述药学上可接受的辅料,包括稀释剂,崩解剂,粘合剂,或润滑剂等。
[0119]
所述的各种晶型,可以用于制备治疗慢性肾病引起的贫血的药物。
[0120]
所述的组合物,可以用于制备治疗慢性肾病(ckd)引起的贫血的药物。
附图说明
[0121]
图1示晶型a的x-射线粉末衍射图(xrpd);
[0122]
图2示晶型a的差示扫描量热曲线(dsc);
[0123]
图3示晶型a的热重分析曲线图(tga)。
[0124]
图4示晶型b的x-射线粉末衍射图(xrpd);
[0125]
图5示晶型c的x-射线粉末衍射图(xrpd)。
[0126]
图6示晶型d的x-射线粉末衍射图(xrpd)。
[0127]
图7示晶型d-1的x-射线粉末衍射图(xrpd);
[0128]
图8示晶型d-1的差示扫描量热曲线(dsc);
[0129]
图9示晶型d-1的热重分析曲线图(tga)。
[0130]
图10示晶型e的x-射线粉末衍射图(xrpd);
[0131]
图11示晶型f的x-射线粉末衍射图(xrpd);
[0132]
图12示晶型g的x-射线粉末衍射图(xrpd)。
[0133]
图13示晶型h的x-射线粉末衍射图(xrpd)。
[0134]
图14示晶型i的x-射线粉末衍射图(xrpd)。
[0135]
图15示晶型α的dvs图。
[0136]
图16示晶型a的dvs图。
[0137]
图17示晶型d-1的dvs图。
[0138]
图18示实施例24中各晶型在盐酸缓冲液中的浓度随时间变化曲线。
[0139]
以上附图中,2theta表示2θ,temperature(℃)表示温度(℃),heat flow(w/g)表示热流量(瓦/克),j/g表示焦耳/克,weight表示重量,target rh表示目标相对湿度,change in mass表示质量变化,cycle 1表示循环1。
具体实施方式
[0140]
为了使本领域的技术人员更好地理解本发明的技术方案,下面进一步披露一些非限制实施例对本发明作进一步的详细说明。
[0141]
本发明所使用的试剂均可以从市场上购得或者可以通过本发明所描述的方法制备而得。
[0142]
本发明中,mg或mg表示毫克,ml或ml表示毫升;nm表示纳米;rpm表示转/每分钟;涉及时间时,min表示分钟,h或h表示小时,d表示天;rh表示相对湿度;sds表示十二烷基硫酸钠;dmso表示二甲基亚砜。
[0143]
本发明中,除另有规定,室温指环境温度,在15℃-40℃,或者20℃-30℃,或者22℃-28℃。
[0144]
仪器参数
[0145]
除非参数中另行规定,以下所有分析都在室温下进行。
[0146]
x-射线粉末衍射(xrpd)研究
[0147]
在装配有自动化3*15零背景样品架的透射反射样品台的荷兰panalytical empyrean x-射线衍射仪上收集x-射线粉末衍射(xrpd)图案。所用辐射源为(cu,kα,kα1:1.540598;kα2:1.544426;kα2/kα1强度比例:0.50),其中电压设定在45kv,电流设定在40ma.x-射线的束发散度,即样品上x-射线约束的有效尺寸,为6.6mm.采用θ-θ连续扫描模式,得到3
°
~60
°
的有效2θ范围。取适量样品在环境条件(约18℃-32℃)下于零背景样品架圆形凹槽处,用洁净的载玻片轻压,得到一个平整的平面,并将零背景样品架固定。将样品以0.0167
°
的扫描步长在3~60
°
2θ
±
0.2
°
范围内产生传统的xrpd图案。用于数据收集的软件为data collector,数据用data viewer和highscore plus分析和展示。
[0148]
差示扫描量热法(dsc)
[0149]
dsc测量在ta instrumentstm型号q2000中用密封盘装置进行。将样品(约1~3mg)在铝盘中称量,用tzero压盖,精密记录到百分之一毫克,并将样品转移至仪器中进行测量。仪器用氮气以50ml/min吹扫。在30℃到300℃之间以10℃/min的加热速率收集数据。以吸热峰向下进行绘图,数据用ta universal analysis分析和展示。
[0150]
热重分析法(tga)
[0151]
在ta instruments q500上采集tga数据。使用认证的镍校准仪器的温度。通常将8-12mg样品加载到预称重的铂金坩埚上,并以10℃/min从30℃加热至300℃。在样品上方保持60ml/min的氮气清扫。在tga图中,横坐标表示温度(temperature,℃),纵坐标表示失重的百分含量(weight(%))。
[0152]
实施例1晶型a的制备
[0153]
5ml ep管(离心管)中分别加入30.0mg的德度司他和1.0ml的水,50.0℃条件下磁力搅拌,200rpm,搅拌混悬24h,然后过滤,室温干燥,得到约23.3mg产品,检测,为晶型a,x-射线粉末衍射,dsc,tga结果参见图1-图3。
[0154]
实施例2晶型a的制备
[0155]
5ml ep管中分别加入30.0mg的德度司他和1.0ml的乙醇,50.0℃条件下磁力搅拌,200rpm,搅拌混悬24h,然后过滤,室温干燥,得到约23.3mg产品,检测,为晶型a。
[0156]
实施例3晶型a的制备
[0157]
5ml ep管中分别加入30.0mg的德度司他和0.5ml的乙二醇单甲醚,70.0℃条件下磁力搅拌,200rpm,固体完全溶解形成溶液;滴加室温下的乙醇2.5ml,析出固体,加毕,搅拌24小时,过滤,得到约24.7mg固体,检测,为晶型a。
[0158]
实施例4晶型a的制备
[0159]
5ml ep管中加入30mg的德度司他和1ml乙二醇二甲醚,50.0℃条件下磁力搅拌,200rpm,固体完全溶解,溶清后缓慢挥发,析出固体,过滤,得到约22.7mg产品,检测,为晶型a。
[0160]
实施例5晶型a的制备
[0161]
5ml ep管中加入30mg的德度司他和2ml异丁醇,75.0℃条件下磁力搅拌,200rpm,固体完全溶解,溶清后缓慢降至0℃,析出固体,过滤,得到约23.8mg产品,检测,为晶型a。
[0162]
实施例6晶型b的制备
[0163]
5ml ep管中分别加入30.0mg的德度司他和1.0ml的1,4-二氧六环,约50.0℃和200rpm条件下磁力搅拌混悬24h,然后过滤,得到约21.5mg产品;检测x射线粉末衍射,dsc,tga,结果参见图4,为晶型b。
[0164]
实施例7晶型b的制备
[0165]
5ml ep管中加入30mg的德度司他和2ml1,4-二氧六环,75.0℃和200rpm条件下磁力搅拌,固体完全溶解,溶清后缓慢降至0℃,析出固体,过滤,得到约22.6mg产品,检测,为晶型b。
[0166]
实施例8晶型c的制备
[0167]
5ml ep管中加入30mg的德度司他和0.5ml n,n-二甲基甲酰胺,50.0℃和200rpm条件下磁力搅拌,固体完全溶解,溶清后缓慢挥发,析出固体,过滤,得到约22.4mg产品,检测,为晶型c,其xrpd参见图5。
[0168]
实施例9晶型c的制备
[0169]
5ml ep管中加入40mg的德度司他、0.1ml n,n-二甲基甲酰胺和1.5ml乙酸异丙酯的,50.0℃和200rpm条件下磁力搅拌混悬24h,过滤,得到约31.6mg产品,检测,确认为晶型c。
[0170]
实施例10晶型c的制备
[0171]
5ml ep管中加入30mg的德度司他和0.4ml n,n-二甲基甲酰胺,50.0℃、200rpm条件下磁力搅拌,固体完全溶解,溶清后缓慢滴加3ml甲基叔丁基醚(滴加方式可以是正滴也可以是反滴),析出固体,过滤,得到23.7mg产品,检测,为晶型c。
[0172]
实施例11晶型d的制备
[0173]
5ml ep管中加入30mg的德度司他和2ml碳酸二甲酯,75.0℃、200rpm条件下磁力搅拌,固体完全溶解,溶清后降至0℃,析出固体,过滤,得到约23.2mg产品,检测,为晶型d,其xrpd参见图6。
[0174]
实施例12晶型d-1的制备
[0175]
5ml ep管中加入20mg的德度司他晶型d样品,50.0℃真空干燥12h,得到约19.5mg产品,检测x-射线粉末衍射,dsc,tga,结果参见图7-图9,为晶型d-1。
[0176]
实施例13晶型e的制备
[0177]
5ml ep管中加入30mg的德度司他和1ml二甲基亚砜,50.0℃、200rpm条件下磁力搅拌,固体完全溶解,溶清后缓慢挥发,析出固体,过滤,得到约23.5mg产品,检测,其xrpd,dsc,tga;参见图10,为晶型e。
[0178]
实施例14晶型e的制备
[0179]
5ml ep管中加入40mg的德度司他、0.1ml二甲基亚砜和1.5ml乙酸乙酯,50.0℃、200rpm条件下磁力搅拌混悬24h,过滤,得到约33.5mg产品,检测,为晶型e。
[0180]
实施例15晶型e的制备
[0181]
5ml ep管中加入30mg的德度司他和0.5ml二甲基亚砜,50.0℃、200rpm条件下磁力搅拌,固体完全溶解,溶清后缓慢滴加2.5ml水,析出固体,过滤,得到约24.6mg产品,为晶型e。
[0182]
实施例16晶型f的制备
[0183]
5ml ep管中加入30mg的德度司他和0.5ml n-甲基吡咯烷酮,50.0℃、200rpm条件下磁力搅拌,固体完全溶解,溶清后缓慢挥发溶剂,析出固体,过滤,得到约24.3mg产品,检测,其xrpd,dsc,tga;参见图11,为晶型f。
[0184]
实施例17晶型f的制备
[0185]
5ml ep管中加入40mg的德度司他、0.1ml n-甲基吡咯烷酮和1.5ml乙酸乙酯,50.0℃、200rpm条件下磁力搅拌混悬24h,过滤,得到约23.1mg产品,检测,为晶型f。
[0186]
实施例18晶型f的制备
[0187]
5ml ep管中加入30mg的德度司他和0.5ml n-甲基吡咯烷酮,50.0℃、200rpm条件下磁力搅拌,固体完全溶解,溶清后缓慢滴加2.5ml乙醇,析出固体,过滤,得到约22.7mg产品,检测,为晶型f。
[0188]
实施例19晶型g的制备
[0189]
5ml ep管中加入20mg的德度司他、0.5ml n,n-二甲基乙酰胺和3ml乙酸乙酯,50.0℃、200rpm条件下磁力搅拌,固体完全溶解,溶清后缓慢挥溶剂,发析出固体,过滤,得到17.3mg产品,检测,其xrpd参见图12,为晶型g。
[0190]
实施例20晶型h的制备
[0191]
5ml ep管中加入20mg的德度司他、0.5ml n,n-二甲基乙酰胺和3ml甲基异丁基酮,50.0℃、200rpm条件下磁力搅拌,固体完全溶解,溶清后缓慢挥发溶剂,析出固体,过滤,得到16.7mg产品,检测,其xrpd参见图13,为晶型h。
[0192]
实施例21晶型i的制备
[0193]
5ml ep管中加入30mg的德度司他、0.5ml乙二醇单甲醚和2.5ml乙酸乙酯,50.0℃、200rpm条件下磁力搅拌,固体完全溶解,溶清后缓慢挥发溶剂,析出固体,过滤,得到约23.4mg产品,检测,其xrpd参见图14,为晶型i。
[0194]
实施例22稳定性测试
[0195]
1)预实验:将所得的德度司他的晶型a、b、c、d、e、f、g、h、i放置50.0℃真空干燥箱内干燥12h,然后取样检测xrpd,确认晶型情况,结果如下表1所示。
[0196]
表1:在50.0℃真空干燥的稳定性考察
[0197]
原料晶型处理方式产品晶型晶型a50.0℃真空干燥12h晶型a晶型b50.0℃真空干燥12h晶型b晶型c50.0℃真空干燥12h晶型α晶型d50.0℃真空干燥12h晶型d-1晶型e50.0℃真空干燥12h晶型e
晶型f50.0℃真空干燥12h晶型f晶型g50.0℃真空干燥12h晶型α晶型h50.0℃真空干燥12h晶型α晶型i50.0℃真空干燥12h晶型α
[0198]
由结果可知,在50.0℃条件下真空干燥12h后,晶型a、b、e、f晶型均未发生改变,而晶型c、g、h、i会向晶型α转晶,而晶型d转变为晶型d-1,说明晶型a、b、e、f在50℃下干燥12h能保持稳定,晶型d-1也具有相对高的稳定性。
[0199]
2)根据原料药稳定性试验指导原则,对样品进行影响因素实验,包括高温试验、高湿试验和强光照射试验,考察不同条件下各晶型的稳定性情况,具体实验条件如下:
[0200]
光照试验(光照uv+vis):分别取样品适量,平铺至称量瓶中,敞口,在可见光4500lux
±
500lux(vis)、紫外光1.7w*h/m2(uv)的恒温恒湿箱(25℃、rh 60%
±
5%)条件下放置,然后分别于0和15天取上述样品约10mg,采用x-射线粉末衍射(xrpd)测试晶型情况;
[0201]
高湿试验(高湿25℃+92.5%rh):分别取样品适量,平铺置称量瓶中,敞口,在25℃、rh 92.5
±
5%恒温恒湿箱中放置,然后分别于0和15天取样品约10mg,采用x-射线粉末衍射(xrpd)测试晶型情况;
[0202]
高温高湿试验(高温60℃+75%rh):分别取样品适量,平铺置称量瓶中,敞口,在60℃
±
5℃、rh 75%
±
5%的恒温恒湿箱中放置,然后分别于0和15天取样品约10mg,采用x-射线粉末衍射(xrpd)测试晶型情况。各样品的检测结果参见表2。
[0203]
表2:稳定性实验结果
[0204][0205]
根据结果可知:晶型a和晶型α在高温、高湿、光照条件下均能够保持晶型不变,晶型a和晶型α在影响因素条件下均较为稳定。
[0206]
3)将晶型a、晶型d-1和晶型α分别在水中37℃条件下搅拌混悬1天后,过滤、干燥,测试所得固体的晶型,结果如下表3所示。
[0207]
表3:晶型在水中的稳定性考察
[0208]
原料晶型温度搅拌时间产品晶型晶型α37℃1d晶型a晶型a37℃1d晶型a晶型α+晶型a37℃1d晶型a晶型a+晶型d-137℃1d晶型a
晶型α+晶型d-137℃1d晶型a晶型d-137℃1d晶型a
[0209]
由上述结果可知,德度司他的晶型α和晶型d-1在水中37℃条件下混悬一定时间后向晶型a转晶,晶型a在水中37℃混悬一定时间后未发生改变,而当把晶型a、晶型d-1和晶型α分别两两组合在水中37℃混悬一定时间后均得到晶型a,说明晶型a比晶型d-1和晶型α更稳定。综合上述结果,认为晶型a相对更稳定,而这种相对更优的稳定性,有利于制备过程中储层、转移和用于制剂制备中的晶型控制、杂质控制等。
[0210]
实施例23 dvs动态水分吸附测试
[0211]
25.0℃条件下随着相对湿度(0%-95.0%-0%)的变化,从0%相对湿度开始,以10%的相对湿度阶梯变化到达95%相对湿度,然后再以10%的相对湿度阶梯变化到达0%相对湿度;处于某一特定相对湿度条件下单位时间样品重量变化dm/dt的绝对值小于0.1%时认为达到平衡,则进入下一个相对湿度。检测desidustat各晶型样品在(0%-95.0%-0%)相对湿度循环条件下的引湿性变化情况,得到各晶型的dvs图。
[0212]
德度司他晶型α、晶型a和晶型d-1的dvs结果如图15-图17所示。晶型α在dvs曲线湿度大于80%后引湿性急剧上升,湿度为95%时引湿增重达到最大,约为2.72%。晶型a在dvs曲线湿度大于80%后引湿性急剧上升,湿度为95%时,引湿增重仅为0.78%,说明晶型a具有较低的引湿性。晶型d-1在dvs曲线湿度大于50%后引湿性缓慢上升,湿度为95%时,引湿增重仅为0.32%,说明晶型d-1也具有较低的引湿性。晶型a和晶型d-1的相对较低引湿性,对于药品的储层、转移和/或制剂的制备相对更有利。
[0213]
实施例24晶型盐酸缓冲液中的浓度变化测试
[0214]
将2mg德度司他(晶型α)溶于20ml的dmso与ph=1.2盐酸缓冲液的混合溶液(体积比1:1)中,配成浓度为0.1mg/ml的溶液,然后逐渐稀释成浓度为0.05mg/ml,0.025mg/ml,0.0125mg/ml
······
的溶液,分别在紫外光260nm-400nm下扫描,筛选出特征峰对应紫外光波长:293nm。
[0215]
其中稀释的稀释方法为:取0.1mg/ml的溶液1.5ml与1.5ml dmso与ph=1.2盐酸缓冲液的混合溶液(体积比1:1)混合均匀,配成浓度为0.05mg/ml的溶液,以此类推,逐步稀释。
[0216]
在波长260-400nm范围内进行扫描,记录不同浓度紫外吸收峰强度值,并绘制吸收强度-浓度标准曲线(特征峰对应紫外光波长:293nm)。
[0217]
将德度司他晶型α、晶型a和晶型d-1分别取30mg与50mlph=1.2的盐酸缓冲液在37℃混合,持续搅拌,并在5min、10min、20min、30min、45min、1h、2h、5h、8h、10h和24h的时间取样,过滤膜后,取1.5ml与1.5mldmso溶剂混合,然后于特征峰波长293nm下扫描得到一个吸收强度值,进而计算德度司他各晶型在37℃的ph=1.2的盐酸缓冲液中各个时刻的浓度,并绘制各晶型的浓度随时间变化曲线,结果参见图18,图中api指德度司他晶型α。
[0218]
根据图18可以看出,在ph=1.2的盐酸缓冲液中,在2h-5h内晶型α和晶型a具有相对高的浓度(即较好的溶解性),晶型d-1相对较低(即较差的溶解性);随时间延长,在8h-10h后,晶型a的浓度达到相对高值,且趋于平衡不变,而晶型α和晶型d-1相对较低(即较差的溶解性),且趋于降低(即进一步下降)。从这种浓度随时间变化结果可以得知,晶型a具有较高的且较稳定的溶解特性,将相对更有利于制备成药物制剂和有利于药物制剂的溶出。
[0219]
本发明的方法已经通过较佳实施例进行了描述,相关人员明显能在本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1