一种用于修饰蛋白质赖氨酸残基的探针及其制备方法和其修饰的生物传感器与流程
1.本发明属于生物传感和生物化学交叉领域,涉及一种探针和生物传感器,具体来说是一种用于修饰蛋白质赖氨酸残基的探针及其制备方法和其修饰的生物传感器。
背景技术:
2.高赖氨酸血症是一种罕见的遗传性氨基酸代谢病,分为i型和ⅱ型,确诊年龄集中在5-10岁。通常i型患者仅表现为血液中赖氨酸浓度偏高,而ⅱ型患者血液中赖氨酸和酵母氨酸浓度的同时增高,导致患者出现严重的神经损伤和发育迟缓。血液中赖氨酸含量的快速、实时、准确监测将为高赖氨酸血症患者的药物提前干预提供重要保障,同时为高赖氨酸血症的早发现、早预防、早治疗提供可能。然而目前临床上只能借助价格不菲的串联质谱等技术,才能准确鉴定血液中赖氨酸(lysine,lys)含量。
3.近年来,随着生物传感技术的快速发展,生物传感器如基于晶体管的生物传感器,有望为癌症/疾病的早期诊断提供快速、小型化、超灵敏和低成本的策略。碳纳米管(carbon nanotubes,cnt)由于其优异的电性能、较大的比表面积、以及良好的生物相容性,非常适用于基于晶体管的生物传感器的敏感材料。
4.然而,目前为止,还没有基于碳纳米管的晶体管生物传感器在赖氨酸检测中的研究,这可归因于器件上检测探针选择的局限性。目前常用的赖氨酸偶联策略是借助琥珀酰亚胺与赖氨酸上氨基的加成反应,该反应倾向于与赖氨酸主链上氨基的反应,但对侧链上氨基的响应率较低。
5.我们前期的研究发现含杂原子的含氮杂环酯类衍生物具有良好的胺酯交换反应活性。基于此开发出了名为kp2的生物探针,用于胞内含赖氨酸蛋白的高特异性标记。该类化合物相对传统的n羟基琥珀酰亚胺和五氟苯酚酯类衍生物具有更好的生物相容性、更低的生物毒性、更高的内吸性和更高的选择性,不仅解决了传统蛋白质氨基酸探针的对细胞高毒性的问题,同时为赖氨酸的准确定量提供了可能。
6.本发明中我们进一步探究了kp2在活体肿瘤细胞中富集赖氨酸蛋白的能力,并以此为出发点结合碳纳米管生物传感器的优势,开发一款用于赖氨酸检测的新型生物传感器,为血液中赖氨酸含量的测定提供一种实时、快速、低成本的检测策略。
技术实现要素:
7.针对现有技术中的上述技术问题,本发明提供了一种用于修饰蛋白质赖氨酸残基的探针及其制备方法和其修饰的生物传感器,所述的这种用于修饰蛋白质赖氨酸残基的探针及其制备方法和其修饰的生物传感器要解决现有技术中的蛋白质氨基酸探针对细胞高毒性的技术问题,同时对赖氨酸的定量不准确和捕获效果不佳的技术问题。
8.本发明提供了一种用于修饰蛋白质赖氨酸残基的探针(kp2),其结构式如下所示:
[0009][0010]
本发明还提供了上述的一种用于修饰蛋白质赖氨酸残基的探针的制备方法,包括如下步骤:
[0011]
1)将4-羟基吡啶,4-炔丙氧基苯甲酸和1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐溶解在二氯甲烷中,4-羟基吡啶、4-炔丙氧基苯甲酸和1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐的质量比为1~3:3~6:4~8;待反应完全后浓缩除去多余的溶剂,随后经硅胶层析纯化获得化合物
[0012][0013]
2)取步骤1)获得的化合物和三氟甲磺酸甲酯,步骤1)获得的化合物和三氟甲磺酸甲酯的物料比为1~2g:1~4ml,用二氯甲烷溶解后室温反应;待反应完全后加入等体积的乙醚沉淀产物,获得化合物
[0014][0015]
本发明还提供了上述的探针在制备用于富集活体肿瘤组织中含赖氨酸的蛋白中的用途。
[0016]
本发明还提供了一种改进的吡啶盐探针(pb-kp2),其结构式为:
[0017]
本发明还提供了上述的改进的吡啶盐探针的制备方法,包括如下步骤:
[0018]
(1)向含芘丁酸活性酯的二氯甲烷溶液中加入5~10倍当量的对羟基吡啶和5~10倍当量的三乙胺,室温反应过夜10-16h即可将吡啶基团引入到芘丁酸活性酯上;
[0019]
(2)随后向上述的探针中加入5~10倍当量的三氟甲(烷)磺酸甲酯(meotf),室温反应过夜10-16h,即可在吡啶环上引入甲基吡啶盐,获得所述的吡啶盐探针,其结构式如下所示:
[0020][0021]
本发明还提供了上述的改进的吡啶盐探针的制备方法,包括如下步骤:
[0022]
1)向含有芘丁酸的二氯甲烷溶液中加入5~10倍当量的对羟基吡啶,5~10倍当量的1-乙基-(3-二甲基氨基丙基)碳酰二亚胺和5~10倍当量的4-二甲氨基吡啶室温反应过夜10-16h;
[0023]
2)随后向上述的探针加入5~10倍当量的三氟甲(烷)磺酸甲酯(meotf),室温反应过夜10-16h,即可在吡啶环上引入甲基吡啶盐,获得所述的吡啶盐探针,其结构式如下所示:
[0024][0025]
本发明还提供了一种生物传感器,由上述的改进的吡啶盐探针修饰。
[0026]
本发明还提供了上述的改进的吡啶盐探针在制备生物传感器中的用途。
[0027]
本发明还提供了上述的生物传感器在制备检测赖氨酸的产品中的应用。
[0028]
本发明还提供了上述的生物传感器在制备捕获含赖氨酸的蛋白的产品中的用途。
[0029]
本发明提供了一种可应用于活体肿瘤组织中含赖氨酸蛋白富集的生物探针,并以此为基础开发新型的用于赖氨酸检测的生物传感器,所述的这种用于特异性修饰赖氨酸的探针及其制备方法解决了现有传统赖氨酸偶联策略效率低的问题,并为血液中赖氨酸的检测提供了一种基于生物传感器可行检测策略。
[0030]
本发明首次将kp2探针应用到活体肿瘤细胞中含赖氨酸残基蛋白的富集,确定了kp2赖氨酸特异性生物探针的安全性和高效性,为未来生物兼容性生物探针的开发和活体应用提供了保障。
[0031]
进一步的,本发明借助kp2探针的高特异性和碳纳米管生物传感器的高灵敏度,开发了用于检测赖氨酸的新型生物传感器。首先在原有探针的基础上,将吡啶盐引入到芘环上。随后借助芘环与碳纳米管的π-π堆积实现探针在器件上的固定。通过检测器件对赖氨酸的电信号响应情况确定基于赖氨酸探针的新型生物传感器可用于赖氨酸的高特异性、高灵敏度检测。未来有望将其直接拓展到血液中赖氨酸的实时定量检测中,并为高赖氨酸血症的早筛早检提供新型、快速、低成本的检测方案。
[0032]
本发明和已有技术相比,其技术效果是积极和明显的。本发明借助吡啶盐对赖氨酸残基选择性标记的特性,以及碳纳米管生物传感器的高灵敏度,构建新型的基于吡啶盐的生物探针,并将其修饰到单晶碳纳米管生物传感器上,用于赖氨酸的高特异性捕获。本发
明通过吡啶盐修饰提高了生物传感器对赖氨酸的检测灵敏度。该新型的生物传感器可为复杂生理环境中赖氨酸的高灵敏度分析提供一种可行策略,未来有望为临床上高赖氨酸血症的早筛、早检提供一种新型的低成本、便捷评估方案。
附图说明
[0033]
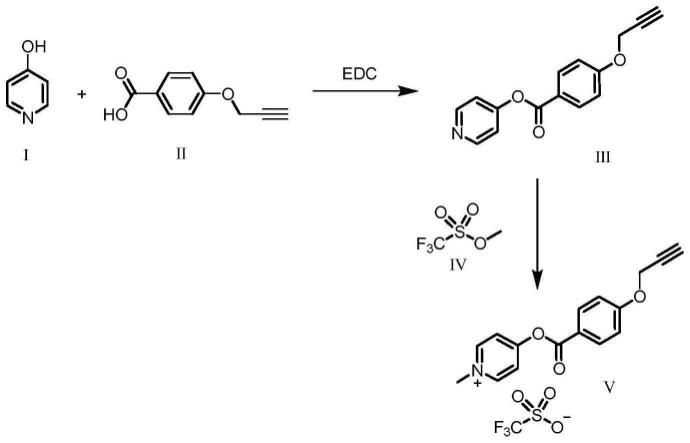
图1为kp2探针的合成步骤和示意图。
[0034]
图2为kp2探针的溶血结果。
[0035]
图3为kp2对mc-38肿瘤中蛋白的标记的质谱鉴定结果。
[0036]
图4为pb-kp2的合成步骤和示意图。(a)以芘丁酸活性酯为原料的pb-kp2的制备路线图。(b)以芘丁酸为原料的pb-kp2的制备路线图。
[0037]
图5为pb-kp2的ms鉴定结果。
[0038]
图6为单晶碳纳米管器件的表征结果。(a)器件的结构示意图。(b)器件的sem扫描图。(c)沟槽中单晶碳纳米管的sem扫描图。
[0039]
图7为生物传感器的修饰示意图。
[0040]
图8为pb-kp2修饰前后器件的拉曼光谱变化。
[0041]
图9为修饰了pb-kp2探针的生物传感器对赖氨酸的检测信号变化情况。
[0042]
实施例1:含吡啶盐探针的制备
[0043]
将2.4g的4-羟基吡啶i,4.4g的4-炔丙氧基苯甲酸和4.8g的1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐溶解在100ml的二氯甲烷中,薄层色谱分析法持续监测反应产物的情况,待反应完全后浓缩除去多余的溶剂,随后经200目硅胶层析纯化获得化合物iii。取1.3g化合物iii和1.5ml的三氟甲磺酸甲酯,用30ml的二氯甲烷溶解室温反应。薄层色谱分析法持续监测反应产物的情况,待反应完全后加入等体积的乙醚沉淀产物,获得化合物v。具体反应过程参考图1所示。
[0044]
利用核磁对产物进行鉴定,该产物的核磁结果如下:1h nmr(400mhz,meod)δ8.90(d,j=6.7hz,2h),8.37(d,j=6.8hz,2h),8.16
–
8.08(m,2h),7.27
–
7.20(m,2h),4.93(d,j=2.4hz,2h),4.44(s,3h),3.10(t,j=2.4hz,1h)。确定成功获得吡啶盐探针。
[0045]
实施例2:含吡啶盐探针的溶血实验
[0046]
为了鉴定探针的安全性,本发明采用小鼠溶血实验评估了kp2的溶血特性。具体步骤如下:眼眶静脉采血法获得新鲜的小鼠血液,并置于含有抗凝剂的ep管中,8600rpm/min快速离心10s,并用0.9%生理盐水洗涤至上清澄清。将得到的红细胞稀释至108/ml。将不同浓度的探针与红细胞混合,在37℃下共孵育1小时。随后8600rpm/min离心5min收取上清液,测定570nm处上清液的吸光值,评估血红素溶出情况。实验中以0.1%triton x-100为阳性对照组,以0.9%的生理盐水为阴性对照组。按照以下公式计算kp2的溶血率:溶血率(%)=[(od
实验组-od
0.9%生理盐水
)/(od
0.1%triton x-100
–
od
0.9%生理盐水
)]
×
100。
[0047]
图2的结果显示,在低于1.25mm给药浓度时,吡啶盐的溶血率低于20%,表明吡啶盐具有良好的生物安全性。这为该探针后续的生物学应用提供了重要保障。
[0048]
实施例3:吡啶盐探针用于活体肿瘤组织中含赖氨酸蛋白的富集
[0049]
为了进一步评估kp2在活体组织中靶向富集含赖氨酸蛋白的高效性和特异性,本发明构建了小鼠肿瘤模型,探究了kp2探针富集赖氨酸蛋白的能力。
[0050]
实验使用无特定病原体(spf)级的6-8周龄的近交系小鼠c57bl/6j并饲养在规定的屏障环境下。在第0天皮下接种1
×
106小鼠结直肠癌细胞mc-38。待肿瘤增长至200mm3,瘤内注射10mm的kp2活性探针(pbs溶液中)。给药4小时后,co2法处死小鼠,随后获取肿瘤组织,经切块、研磨、裂解步骤提取肿瘤组组织的全蛋白。并使用超高分辨液质联用仪上机检测,分析kp2探针在活体肿瘤中富集含赖氨酸蛋白的情况。
[0051]
图3结果显示本发明首次在活体动物水平富集到了含赖氨酸活性位点的蛋白质。这些被富集到的蛋白多分布在mrna相关信号通路上,推测此类蛋白在调控基因转录和表达过程中发挥重要的作用。
[0052]
以上结果表明,kp2探针可在复杂的生物环境中,高效富集含有赖氨酸残基的蛋白,这为后续基于吡啶盐的生物传感器在复杂检测环境中的应用提供了可能。
[0053]
实施例4:构建新型的吡啶盐探针用于器件修饰
[0054]
基于碳纳米管的生物传感器由于其表面平整的结构,难以直接标记检测探针,通常需要一个连接子将探针固定到器件上。常用的连接子有n-1-芘马来酰亚胺和芘丁酸活性酯。二者的基本原理类似,即借助分子一端的芘环与碳纳米管上的碳环之间形成强有效的π-π堆积,将连接子固定在碳纳米管上。随后分子上另外一端的马来酰亚胺/活性酯与探针上的巯基或者氨基共价偶联,实现探针在器件上的固定。
[0055]
本发明中为了将吡啶盐探针修饰在器件上,我们分别以芘丁酸活性酯和芘丁酸为原料,按照图4a和4b的路径制备获得吡啶盐连接的芘小分子。具体步骤如下:以芘丁酸活性酯为原料(图4a),加入5~10倍当量的对羟基吡啶和5~10倍当量的三乙胺(et3n)室温反应过夜(10-16h),将吡啶基团引入到pbase上。随后向共价偶联物中加入5~10倍当量的三氟甲(烷)磺酸甲酯(meotf),室温反应过夜(10-16h)后,即可在吡啶环上引入甲基吡啶盐。
[0056]
在以芘丁酸为原料的制备中(图4b),向含有芘丁酸的二氯甲烷溶液中加入5~10倍当量的对羟基吡啶,5~10倍当量的1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(edc)和5~10倍当量的4-二甲氨基吡啶(dmap)室温反应过夜(10-16h)。随后向共价偶联物中加入5~10倍当量的meotf,室温反应过夜(10-16h)后获得目标产物。
[0057]
用lc-ms鉴定分子量,图5的结果显示,实验检测到了380的产物,这与图4中的理论值一致,表明成功获得了pb-kp2分子。
[0058]
实施例5:单晶碳纳米管器件的制备
[0059]
将纯度为99.9%0.5mg的半导体碳纳米管粉末(semiconducting carbon nanotubes,s-cnt)和0.5mg的聚(亚苯-乙烯)衍生物(poly m-phenylenevinylene-co-2,5-dioctyloxy-p-phenylenevi-nylene,pmpv)分散在50ml 1,2-二氯乙烷中。
[0060]
在15℃控温条件下将上述溶液超声15h后获得均一的溶液。金属碳纳米管(metallic carbon nanotube,m-cnt)溶液的制备方法如下:将0.5%(w/w)的多臂m-cnt直接分散在水中,以便于后期均匀旋涂。所有cnt tft器件(图6a)以n型硅(si)晶片(电阻率:0.01
–
0.05ω
·
cm)作为背栅,利用原子层沉积技术(atomic layer deposition,ald)在硅衬底上沉积一层50nm厚的氧化铝(al2o3)高介电常数层。随后,将制备的m-cnt溶液均匀旋涂在介电层上并进行图案化处理,构建源极和漏极(s/d)电极。将制备的s-cnt旋涂在s/d电极中间作为通道。最后,通过光刻工艺和氧等离子体刻蚀确定s/d电极和通道。
[0061]
从图6b的sem扫描结果可以看出s/d电极和通道结构规整,且通道中的s-cnt呈网
络状均匀分布(图6c)。
[0062]
实施例6:吡啶盐对碳纳米管生物传感器的功能化修饰
[0063]
按照图7的方式对碳纳米管进行功能化修饰。将全cnt tft芯片浸泡在含有6mm pb-kp2的dmf溶液(n,n-二甲基甲酰胺)中,于室温50rpm摇床上孵育4小时。随后,依次用dmf、水、水、水清洗芯片。利用pb-kp2分子上的芘环与碳环形成π-π堆积,将pb-kp2分子固定到传感器上,制备获得吡啶盐功能化修饰的新型生物传感器。
[0064]
图8中的拉曼光谱显示,功能化修饰后,可检测到1612.5cm-1
处的一个新峰,这与已经报道的芘环的共振位置一致,表明pb-kp2分子被成功修饰到芯片上。而原始碳纳米管的主峰由原来的1590.9cm-1
偏移到1592.4cm-1
,这一微弱偏移可归因于pb-kp2和dmf对碳纳米管的掺杂效应。
[0065]
实施例7:吡啶盐修饰的生物传感器用于检测赖氨酸分子
[0066]
用半导体参数分析仪对修饰前、pb-kp2分子修饰后以及赖氨酸捕获后的器件的传输性能进行表征。
[0067]
图9的结果显示,初始全cnt tft器件(黑线)的传输曲线表现出典型的p型晶体管特性。与原始器件(黑线)相比,pb-kp2(红线)功能化修饰后,在-8v(v
gs
=-8v)的栅极电压下,开态电流显著减小,这可归因于pb-kp2和dmf的相反掺杂效应。
[0068]
此外,本发明以pbase修饰的生物传感器为对照,发现pbase修饰(蓝线)和pb-kp2修饰引起的器件的电流变化接近,也再次证实了本发明构建的新型生物探针被有效固定在碳纳米管表面。
[0069]
随后,将1μm的赖氨酸溶液滴加在上述功能化修饰的生物传感器,室温孵育30min后,i
on
表现出明显的增强(绿线),这可归因于附着于s-cnt通道表面的赖氨酸靶标的静电门控效应。电信号的显著变化也表明pb-kp2修饰的生物传感器可用于赖氨酸的精准捕获。
[0070]
鉴于本发明在肿瘤组织环境中吡啶盐对赖氨酸残基捕获的特异性,未来有望将本发明构建的基于吡啶盐修饰的传感器拓展到更复杂的血液环境中赖氨酸的实时、定量检测,为高赖氨酸血症的临床评估提供简便、低成本的快递检测方案。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1