一种加热促进的5-三氟甲基取代的1,2,4-三氮唑化合物的制备方法
1.本发明属于有机合成领域,尤其涉及一种无金属催化剂,氧化剂以及添加剂参与的合成5-三氟甲基取代的1,2,4-三氮唑化合物的方法。
背景技术:
2.三氟甲基取代1,2,4-三氮唑化合物是一类重要的含氮五元杂环分子骨架,普遍存在于多种生物活性和药物分子中(org.process res.dev.,2005,9,634)。很多生物活性分子中都含有三氟甲基取代的1,2,4-三氮唑结构,例如药物西他列汀,抗焦虑药物以及抑制剂等。在杂环分子中引入三氟甲基可以显著提高母体化合物的各种物理化学性质,三氟甲基取代的杂环化合物在药物设计合成领域具有重要的作用(science 2007,317,1881)。
[0003][0004]
脱羧环化反应是合成官能化杂环化合物的主要方法之一,其中羧基通常以二氧化碳的形式脱除。促进羧基脱除的手段通常为重金属促进,光催化促进,电催化促进等,其中加热促进也是一种常用方法,不过大部分都需要过渡金属催化剂协助脱羧。基于绿色化学和原子经济性的理念,发展简便绿色易操作的合成方法构建官能化杂环具有重要的研究意义和应用价值。
[0005]
基于此我们发展了一种以廉价易得的三氟乙基亚胺酰肼和酮酸为起始原料,无需任何金属催化剂,氧化剂以及添加剂的存在,仅需普通加热促进的简单高效的5-三氟甲基取代1,2,4-三氮唑的合成方法。
技术实现要素:
[0006]
本发明提供了一种5-三氟甲基取代的1,2,4-三氮唑化合物的制备方法,该制备方法步骤简便,起始原料廉价易得,反应条件极其简单,仅需加热即可,无需添加任何催化剂和添加剂,便于操作和后期应用。
[0007]
一种5-三氟甲基取代的1,2,4-三氮唑化合物的制备方法,包括如下步骤:将三氟
乙基亚胺酰肼以及酮酸加入到有机溶剂中,于120~140℃反应10~18小时,反应完全后,后处理得到所述的5-三氟甲基取代的1,2,4-三氮唑化合物;
[0008]
所述的三氟乙基亚胺酰肼的结构如式(ii)所示:
[0009][0010]
所述的酮酸的结构如式(iii)所示:
[0011][0012]
所述的5-三氟甲基取代的1,2,4-三氮唑化合物的结构如式(ⅰ)所示:
[0013][0014]
式(ⅰ)~(iii)中,r1和r2为烷基、取代或者未取代的苯基;
[0015]
在r1和r2中,所述的苯基上的取代基选自c1~c4烷基、c1~c4烷氧基、c1~c4烷硫基、卤素或三氟甲基。
[0016]
r1和r2上苯基的取代基位置可以为邻位、对位或者间位。
[0017]
反应式如下:
[0018][0019]
反应中可能先经历了三氟乙酰亚胺肼与酮酸的脱水缩合反应生成腙类中间体,然后发生分子内亲核加成反应得到不稳定的四面体型的不饱和五元杂环中间体,后者在加热和空气中氧气的共同促进作用下发生脱羧基和氧化芳构化过程得到最终的5-三氟甲基取代的1,2,4-三氮唑化合物,与此同时释放一分子二氧化碳。
[0020]
本发明中,可选用的后处理过程包括:过滤,硅胶拌样,最后经过柱层析纯化得到相应的5-三氟甲基取代的1,2,4-三氮唑化合物,采用柱层析纯化为本领域常用的技术手段。
[0021]
作为优选,r1和r2为烷基,取代或者未取代的苯基,所述苯基上的取代基选自甲基、甲氧基、甲硫基、氯、溴或三氟甲基,此时,所述的芳香胺以及三氟乙基亚胺酰肼容易得到,并且反应的产率较高。
[0022]
所述的酮酸价格较便宜,较为容易获得,相对于所述的对三氟乙基亚胺酰肼的用量为过量,作为优选,以摩尔量计,三氟乙基亚胺酰肼:酮酸=1:1~2;作为进一步的优选,以摩尔量计,三氟乙基亚胺酰肼:酮酸=1:1.5。
[0023]
本发明中,能将原料充分溶解的有机溶剂都能使反应发生,但反应效率差别较大,优选为非质子性溶剂,非质子性溶剂能够有效地促进反应的进行;作为优选,所述的有机溶剂为四氢呋喃,乙腈或者二甲基亚砜;作为进一步的优选,所述的有机溶剂为二甲基亚砜最
为合适,此时,各种原料都能以较高的转化率转化成产物,而且在脱羧反应中二甲基亚砜为最常用的有机溶剂之一。
[0024]
所述的有机溶剂的用量能将原料较好的溶解即可,1mmol的三氟乙基亚胺酰肼使用的有机溶剂的量约为5~10ml。
[0025]
作为优选,所述的反应条件仅为普通加热,只需要普通加热条件即可使得反应完全转化。
[0026]
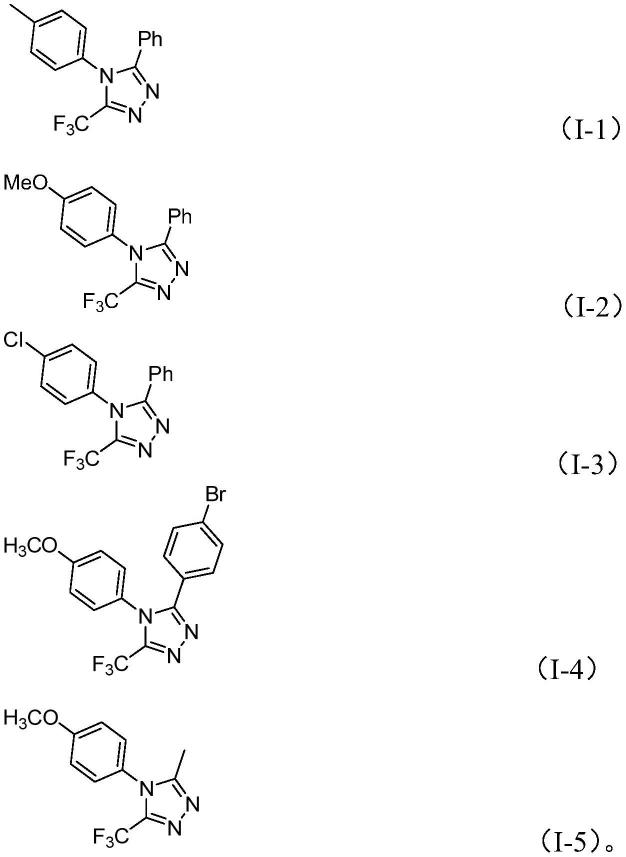
作为进一步的优选,所述的5-三氟甲基取代的1,2,4-三氮唑化合物为式(i-1)-式(i-5)所示化合物中的一种:
[0027][0028][0029]
上述制备方法中,所述的芳香胺和酮酸一般采用市售产品,都能从市场上方便地得到,所述的三氟乙基亚胺酰肼可由三氟乙基亚胺酰氯和水合肼以几乎定量的产率得到,而三氟乙基亚胺酰氯可由相应的芳香胺、三苯基膦、四氯化碳和三氟乙酸快速合成得到。
[0030]
同现有技术相比,本发明的有益效果体现在:该制备方法易于操作,后处理简便;反应起始原料廉价易得,且无需使用任何催化剂和添加剂,反应底物可设计性强,底物官能团容忍范围广,可根据实际需要设计合成出3,4位不同取代的同时带三氟甲基和各种芳基的1,2,4-三氮唑类化合物,实用性较强,符合绿色化学的理念。
具体实施方式
[0031]
下面结合具体实施例对本发明做进一步的描述。
[0032]
按照表1的原料配比在35ml的schlenk管中加入三氟乙基亚胺酰肼(ii)、酮酸(iii)和有机溶剂2ml,混合搅拌均匀,按照表2的反应条件反应10-18小时,过滤,硅胶拌样,经过柱层析纯化得到相应的5-三氟甲基取代的1,2,4-三氮唑化合物(ⅰ),反应过程如下式所示:
[0033][0034]
表1实施例1~15的原料加入量
[0035][0036]
表2
[0037][0038]
表1和表2中,t为反应温度,t为反应时间,ph为苯基,me为甲基,ome为甲氧基,sme为甲硫基,t-bu为叔丁基,cf3为三氟甲基,dmso为二甲基亚砜。
[0039]
实施例1~5制备得到化合物的结构确认数据:
[0040]
由实施例1制备得到的5-三氟甲基取代的1,2,4-三氮唑化合物(i-1)的核磁共振(1h nmr、
13
c nmr和
19
f nmr)检测数据为:
[0041][0042]1h nmr(400mhz,cdcl3)δ7.47-7.40(m,2h),7.38(t,j=7.4hz,1h),7.33-7.25(m,4h),7.15(d,j=8.3hz,2h),2.44(s,3h).
[0043]
13
c nmr(101mhz,cdcl3)δ156.7,145.8(c-f,q,2j
(c-f)
=38.6hz),141.0,130.5,130.3,128.6,128.6,127.0,125.3,118.1(c-f,q,1j
(c-f)
=271.2hz),21.3.
[0044]
19
f nmr(377mhz,cdcl3)δ-61.0.
[0045]
m.p.161-162℃.
[0046]
由实施例2制备得到的5-三氟甲基取代的1,2,4-三氮唑化合物(i-2)的核磁共振(1h nmr、
13
c nmr和
19
f nmr)检测数据为:
[0047][0048]1h nmr(400mhz,cdcl3)δ7.44(d,j=8.2hz,2h),7.37(t,j=7.4hz,1h),7.29(t,j
=7.8hz,2h),7.18(d,j=8.8hz,2h),6.97(d,j=8.8hz,2h),3.85(s,3h).
[0049]
13
c nmr(101mhz,cdcl3)δ160.9,156.8,145.9(c-f,q,2j
(c-f)
=38.7hz),130.5,128.6,128.5,125.3,125.2,118.1(c-f,q,1j
(c-f)
=271.3hz),115.0,55.5.
[0050]
19
f nmr(377mhz,cdcl3)δ-68.4.
[0051]
m.p.154-155℃.
[0052]
由实施例3制备得到的5-三氟甲基取代的1,2,4-三氮唑化合物(i-3)的核磁共振(1h nmr、
13
c nmr和
19
f nmr)检测数据为:
[0053][0054]1h nmr(400mhz,cdcl3)δ7.50(d,j=8.7hz,2h),7.45
–
7.38(m,3h),7.37
–
7.30(m,2h),7.25(d,j=8.6hz,2h).
[0055]
13
c nmr(101mhz,cdcl3)δ156.6,145.6(c-f,q,2j
(c-f)
=39.0hz),137.0,131.5,130.8,130.3,128.8,128.7,128.7,124.9,118.0(c-f,q,1j
(c-f)
=271.3hz).
[0056]
19
f nmr(377mhz,cdcl3)δ-68.1.
[0057]
m.p.182-184℃.
[0058]
由实施例4制备得到的5-三氟甲基取代的1,2,4-三氮唑化合物(i-4)的核磁共振(1h nmr、
13
c nmr和
19
f nmr)检测数据为:
[0059][0060]1h nmr(400mhz,cdcl3)δ7.44(d,j=8.6hz,2h),7.31(d,j=8.6hz,2h),7.19(d,j=8.9hz,2h),6.99(d,j=8.9hz,2h),3.87(s,3h).
[0061]
13
c nmr(101mhz,cdcl3)δ161.0,155.9,146.1(c-f,q,2j
(c-f)
=38.8hz),131.9,130.0,128.5,125.3,125.0,124.3,118.1(c-f,q,2j
(c-f)
=271.3hz),115.2,55.6.
[0062]
19
f nmr(377mhz,cdcl3)δ-61.6.
[0063]
hrms(esi):[m+h]
+
calcd.for c
16h12
brf3n3o
+
398.0110,found 398.0112.
[0064]
由实施例5制备得到的5-三氟甲基取代的1,2,4-三氮唑化合物(i-5)的核磁共振(1h nmr、
13
c nmr和
19
f nmr)检测数据为:
[0065][0066]1h nmr(400mhz,cdcl3)δ7.18(d,j=8.9hz,2h),7.03(d,j=8.9hz,2h),3.88(s,
3h),2.29(s,3h).
[0067]
13
c nmr(101mhz,cdcl3)δ161.1,155.4,145.2(q,j
(c-f)
=38.4hz),128.8,124.6,120.6(q,j
(c-f)
=278.2hz),115.1,55.6,10.7.
[0068]
19
f nmr(377mhz,cdcl3)δ-60.4.
[0069]
m.p.=152-154℃.
[0070]
hrms(esi):[m+h]
+
calcd.for c
11h10
f3n3o 258.0849,found 258.0857。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1