一种利用狐粪青霉菌发酵生产7-羟基丁苯酞的方法与流程
1.本发明涉及利用真菌代谢产物合成苯酞类结构类似物的方法,具体地说是利用狐粪青霉菌(penicillium vulpinum)发酵制备7-羟基丁苯酞的方法。
背景技术:
2.近年来随着人们物质生活水平的提高,心脑血管疾病逐渐成为威胁现代人类健康的主要疾病之一,脑卒中的高发病率和高死亡率更是位居前列。
3.3-丁苯酞作为治疗缺血性脑卒中的国内一类新药,表现出多靶点治疗途径,但是其总体疗效并不高,需要与阿司匹林等常规药物联用增强疗效。针对此类药物及其衍生物、结构类似物的深入研究成为该领域药物研发的热点。以3-丁苯酞为先导化合物进行结构改造,已获得闭环衍生物、开环衍生物以及类似物等。文献european journal of medicinal chemistry, 2010, 45(5): 1941-1946.进行了一系列卤素取代的苯肽环衍生物的合成及生物活性研究,其中化合物4i(6-溴-丁苯酞),4g(6-氟-丁苯酞)的血管舒张活性优于nbp;小鼠急性毒性实验显示,化合物4g(6-氟-丁苯酞) 的ld50 值为750.89 mg/kg,4i(6-溴-丁苯酞) 的ld50 值为1000 mg/kg,明显高于nbp 的 ld50 值(592.93 mg/kg)。文献journal of medicinal chemistry, 2013, 56(7): 3078-3089.报道了以2-(α-羟正戊基)苯甲酸为先导化合物,杂合异山梨醇,合成了一系列异山梨醇
ꢀ‑ꢀ
nbp 开环衍生物,其中化合物9a 的活性最佳。体外抗血小板聚集试验及体内抗血栓试验显示,化合物9a 的抑制活性较(s)-nbp及阿司匹林均显著增强。文献organic &biomolecular chemistry, 2011, 9(16): 5670-5681.以具有抗氧化、抗血小板作用的阿魏酸为连接基团,合成了no 供体型nbp 开环衍生物,其中新化合物zjm-289活性最佳。与nbp相比,化合物zjm-289 具有更好或相当的体内外抗血小板聚集、抗血栓和抗脑缺血活性。
4.cn 106214674 a公开了从一株狐粪青霉真菌菌株中分离得到三个丁苯酞结构类似物,体内外药效和毒性研究证明:7-羟基-丁苯酞、4-羟基-丁苯酞和7-甲氧基-丁苯酞均具有抗氧化、抗血栓和抗脑缺血等药效作用,其中的 7-羟基-丁苯酞与丁苯酞相比,具有更低的用药剂量、更显著、优良的抗血小板凝集、抗氧化应激和抗脑缺血活性等药效作用,而且具有更低的毒性,即具有更高的药物安全性。
5.7-羟基-丁苯酞为狐粪青霉菌(penicillium vulpinum)的培养代谢产物,其分子式为 c
12h1403 ,分子量为 206.0943 ,结构式如下:(参见heterocycles, vol. 48, no. 9,1998:1931-1941)。
6.来源自真菌狐粪青霉菌(penicillium vulpinum)的培养代谢产物的研究表现出
丰富的天然活性。natural product research. 2021 feb;35(3):421-427公开了利用越南槐植株内生真菌狐粪青霉菌(penicillium vulpinum)所产生得两种新的苯酞类化合物(即3-羧丙基-7-羟基苯酞和3-羧丙基-7-羟基苯酞甲酯),其抑菌活性实验结果显示该化合物对bacillus subtilis, shigella dysenteriae and enterobacter areogenes具有中等抑制作用。
7.目前,利用真菌代谢生成苯酞类结构类似物的研究比较活跃,尤其以短密青霉菌(penicillium brevicompactum)发酵合成具有苯酞环结构的霉酚酸较为深入。
8.cn104726347a公开了一种狐粪青霉菌(penicillium vulpinum)ncc3421(cgmcc no.9094)菌株及利用其制备左旋7-羟基丁苯酞的方法。该发明方法发酵制备的左旋7-羟基丁苯酞达到1600μg /ml,显示了其工业化开发前景,但其产量技术水平为50l罐1600μg /ml,距离工业化水平尚有一定距离。
技术实现要素:
9.本发明的目的在于提供一种利用狐粪青霉菌(penicillium vulpinum)发酵产生高浓度7-羟基丁苯酞的方法,以期进一步提高7-羟基丁苯酞的工业化生产效能。
10.本发明目的是通过以下方式实现的:本发明所提供的利用狐粪青霉菌(penicillium vulpinum)发酵产生高浓度7-羟基丁苯酞的方法,包括以下步骤:(a)制备狐粪青霉菌(penicillium vulpinum)摇瓶种子培养液:采用cn104726347a所公开得狐粪青霉菌(penicillium vulpinum)ncc3421(cgmcc no.9094)为发酵菌株(以下简称ncc3421菌株),将该菌株的斜面培养物接种于摇瓶种子培养基,于25℃培养,摇床转速220rpm,培养周期48~52h,获得摇瓶种子培养液;其中的培养基的成分配比及制备为:糊精10.0~20.0g/l、蔗糖20.0~30.0g/l、低温豆饼粉10.0~30.0g/l、蛋白胨5.0~15g/l、高磷有机氮源2~25.0g/l、硫酸铵2.5~10.0 g /l、氯化钠2.5~10.0g/l、碳酸钙2.0~4.0g/l,加水定容至1000ml,用氢氧化钠溶液调ph为6.4~6.8,121℃灭菌30min;其中所述的所述高磷有机氮源,可选用鱼粉、玉米浆、_麸质粉、花生饼粉中的一种或两种以上组合。优选鱼粉、玉米浆或二者组合。
11.本发明方法所述高磷有机氮源为优选鱼粉和玉米浆的组合物,其中鱼粉用量为5.0~10.0g/l、玉米浆用量为8.0~20.0g/l;组合物总量控制在10.0g~23.0g/l.更优选的用量为鱼粉8.0g/l、玉米浆用量为15.0g/l。
12.(b)制备狐粪青霉菌(penicillium vulpinum)一级罐种子液:将(a)所制备的摇瓶种子培养液以体积百分比0.3~0.5%的接种量接种于一级种子培养基上,于培养温度22~25℃,罐搅拌功率35~40hz,通气比1:0.8~1.5vvm,罐压0.05
±
0.01mpa,培养周期48~52h,获得一级罐种子液;其中所述一级种子罐培养基按以下方法制得:糊精10.0~20g/l、蔗糖20.0~30g/l、低温豆饼粉15.0~30g/l、玉米浆2.5~5.0g/l、蛋白胨10.0~20g/l、磷酸二氢钾3.0~6.0g/l、氯化钠2.5~5.0g/l、碳酸钙1g~2/l、消沫剂1~2 ml /l,加水定容至1000ml,用氢氧化钠溶液调ph至6.4~6.8,121℃灭菌30min。
13.(c)制备狐粪青霉菌(penicillium vulpinum)发酵液:将(b)步骤所制备的一级罐种子液以体积百分比3~5%的接种量接种于发酵培养基,发酵温度22~25℃,发酵培养转速为220~250rpm;罐搅拌功率35~40hz,通气比为1:0.8~1.5vvm,罐压0.05
±
0.01mpa,溶氧浓度(以下简称do)保持20~30%以上,发酵周期120-180h;其中所述的发酵培养基按以下方法制得:糊精0~40 g/l、蔗糖20.0~30.0g/l、低温黄豆饼粉30.0~45g/l、鱼粉10.0~20g/l、玉米浆16.0~32.0g/l、磷酸二氢钾3.0~6.0g/l、硫酸铵8.0~12.0 g /l、氯化钠2.5~5.0g/l、七水硫酸镁2.0~4.0g/l、前体物质a 0~8.0 g/l、前体物质b 0~8.0 g/l、玉米油15.0~30ml/l、碳酸钙2.0~4.0g/l、消沫剂0~1.0ml/l,加水定容至1000ml,用10%氢氧化钠调ph为6.4~6.8,121℃灭菌30min。
14.(d)将(c)所制备的发酵液,按照常规方法进行分离、收集,获得7-羟基丁苯酞溶液。
15.如将(c)所制备的发酵液3000rpm离心15min,弃上清液,留菌丝体;菌丝体中加入95%乙醇,搅拌浸泡25-30min,3000rpm离心15min,过滤,滤液中即富含获得7-羟基丁苯酞。
16.本发明方法中上述前体物质a为甲硫氨酸(前体物质a1)或乙硫氨酸(前体物质a2);所述的前体物质b是短链脂肪醇或短链脂肪酸;短链脂肪醇可选用乙醇、正丙醇、正丁醇;优选正丙醇、正丁醇。短链脂肪酸可选用乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸、正亮氨酸及其钠盐,其中优选正亮氨酸、正丁酸。
17.为进一步提增强菌种发酵产物的高效表达,本发明在上述(c)步骤的发酵过程中增加流加补料,其中所述的补料为葡萄糖300~450g/l或葡萄糖300~450g/l与甘油1~150g/l两种组分,两种组分的总质量控制在300~600g/l。
18.所述的发酵过程中流加补料的优选方案是:发酵过程中,发酵液ph回升至7.2~7.3时,开始流加补料,补料流速控制在2~4l/h;当发酵液还原糖在1.0%以下时,补料流速控制0.8~2l/h;补料完毕后继续发酵8~12h。
19.本发明方法所述摇瓶种子培养基的优选制备方法为:糊精10.0g/l、蔗糖20.0g/l、低温豆饼粉15.0g/l、蛋白胨10.0g/l、高磷有机氮源13~25.0g/l、硫酸铵5.0g/l、氯化钠5.0g/l、碳酸钙2.0g/l,加水定容1000ml,用10%氢氧化钠调ph为6.4~6.8,121℃灭菌30min。
20.本发明所述方法中前体物质a的加入量优选0.5~8.0g/l。
21.本发明所述方法中前体物质b的加入量优选0.5~8.0g/l。
22.本发明所述鱼粉可选用市售普通鱼粉,如市售的饲料级鱼粉。
23.本发明的有益效果主要体现在:本发明采用ncc3421菌株,对摇瓶种子培养液、一级罐种子液以及发酵培养基配方及工艺参数的进行特别设计,尤其是在摇瓶种子培养基中增加鱼粉、玉米浆等高磷有机氮源,缩短了孢子萌发时间,有效改善了种瓶菌丝繁殖活力,使菌种发酵水平得以高效表达,并且在后续的工业放大环节,采用合理的可操作接种量接种技术得以实现;在发酵培养基中添加生物合成前体物质(甲硫氨酸、正丁醇等),进一步促进了目的产物的合成;在发酵过程中增加了组合碳源流加补料工艺 ,进一步增强了菌种发酵产物的高效表达。
[0024] 本发明方法大大提高ncc3421菌株发酵合成7-羟基丁苯酞的产量,其生产水平可达到50l罐5000
ꢀ‑‑
10000μg /ml。
附图说明
[0025]
图1本发明实施例1(培养基iv)摇瓶种子培养液48h菌丝形态(
×
10)。
[0026]
图2为普通氮源摇瓶种子培养液48h菌丝形态(
×
10)。
[0027]
图3为本发明实施例2(培养基)2m3发酵罐48h菌丝形态(
×
40)。
[0028]
图4为本发明实施例6 所产生的7-羟基丁苯酞hplc色谱图。
具体实施方式
[0029]
以下结合具体实施例,对本发明作进一步说明。下列实施例中所用的实验材料如无特殊说明均为工业级原料;分析色谱柱inertsil ods-sp 5μm c18 4.6
×
250mm 购自日本岛津,色谱溶剂购自霍尼韦尔贸易(上海)有限公司。
[0030]
实施例1a、制备狐粪青霉菌(penicillium vulpinum)的摇瓶种子培养液:将菌株ncc3421的斜面培养物接种于分装有母瓶培养基的1000ml三角瓶中,于25℃培养,摇床转速220rpm,培养周期48~52h获得种子液。
[0031]
其中所述种子培养基按以下方法制得:糊精10.0g/l、蔗糖20.0g/l、低温豆饼粉15.0g/l、蛋白胨10.0g/l、高磷有机氮源0~23.0g/l、硫酸铵5.0g/l、氯化钠5.0g/l、碳酸钙2.0g/l,加水定容至1000ml,用10%氢氧化钠调ph为6.4~6.8,按照装量200ml分装三角瓶,121℃灭菌30min。
[0032]
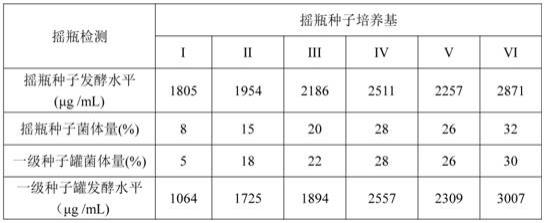
为了考察摇瓶种子培养基对菌丝萌发生长速度以及摇瓶种子质量对一级种子罐菌丝发育、发酵水平的影响,本实施例中给出六个不同摇瓶种子培养基,其分别为:培养基i(普通有机氮源):糊精10.0g/l、蔗糖20.0g/l、低温豆饼粉15.0g/l、蛋白胨10.0g/l、硫酸铵5.0g/l、氯化钠5.0g/l、碳酸钙2.0g/l,加水定容,用10%氢氧化钠调ph为6.4,121℃灭菌30min;培养基ii(有机氮源为低量玉米浆):糊精10.0g/l、蔗糖20.0g/l、低温豆饼粉15.0g/l、玉米浆8.0 g/l,蛋白胨10.0g/l、硫酸铵5.0g/l、氯化钠5.0g/l、碳酸钙2.0g/l,加水定容,用10%氢氧化钠调ph为6.6,121℃灭菌30min;培养基iii(有机氮源高量玉米浆):糊精10.0g/l、蔗糖20.0g/l、低温豆饼粉15.0g/l、玉米浆20.0 g/l、蛋白胨10.0g/l、硫酸铵5.0g/l、氯化钠5.0g/l、碳酸钙2.0g/l,加水定容,用10%氢氧化钠调ph为6.8,121℃灭菌30min;培养基iv(有机氮源为低量鱼粉/高量玉米浆组合):糊精10.0g/l、蔗糖20.0g/l、低温豆饼粉15.0g/l、玉米浆15.0 g/l、鱼粉3.0g/l、蛋白胨10.0g/l、硫酸铵5.0g/l、氯化钠5.0g/l、碳酸钙2.0g/l,加水定容,用10%氢氧化钠调ph为6.4,121℃灭菌30min;培养基v(有机氮源高量鱼粉/低量玉米浆组合):糊精10.0g/l、蔗糖20.0g/l、低温豆饼粉15.0g/l、玉米浆8.0 g/l,鱼粉10.0g/l、蛋白胨10.0g/l、硫酸铵5.0g/l、氯化钠5.0g/l、碳酸钙2.0g/l,加水定容,用10%氢氧化钠调ph为6.6,121℃灭菌30min;培养基vi(有机氮源中量鱼粉/高量玉米浆组合):糊精10.0g/l、蔗糖20.0g/l、低温豆饼粉15.0g/l、玉米浆15.0 g/l、鱼粉8.0g/l、蛋白胨10.0g/l、硫酸铵5.0g/l、氯化钠5.0g/l、碳酸钙2.0g/l,加水定容,用10%氢氧化钠调ph为6.8,121℃灭菌30min。
[0033]
b、制备狐粪青霉菌(penicillium vulpinum)一级罐种子液:
将步骤a所制备的摇瓶种子培养液以体积百分比0.3%的接种量接种于种子罐内,于培养温度25℃,罐搅拌功率40hz,通气比1:0.8~1.5vvm,罐压0.05
±
0.01mpa,培养周期48h~52h,获得一级罐种子液;其中种子罐培养基为:糊精10.0g/l、蔗糖10.0g/l、低温豆饼粉15.0g/l、玉米浆5.0g/l、蛋白胨10.0g/l、磷酸二氢钾3.0g/l、氯化钠5.0g/l、碳酸钙2.0g/l,消沫剂1.0ml/l,加水定容至1000ml,用40%氢氧化钠溶液调ph至6.4,121℃灭菌30min。
[0034]
c、制备狐粪青霉菌(penicillium vulpinum)合成7-羟基丁苯酞发酵液将上述种子液以体积百分比3%的接种量接种于发酵罐中的发酵培养基,发酵温度25℃,发酵周期120h~180h;发酵罐搅拌功率40hz,发酵培养转速为220~250rpm;通气比为1:0.8~1.5vvm,罐压0.05
±
0.01mpa,do保持20%以上。
[0035]
其中,发酵培养基按以下方法制得:糊精40 g/l、蔗糖20.0g/l、低温黄豆饼粉30.0g/l、鱼粉10.0g/l、玉米浆16.0g/l、磷酸二氢钾6.0g/l、硫酸铵8.0g/l、氯化钠5.0g/l、七水硫酸镁2.0g/l,玉米油15.0ml/l、碳酸钙4.0g/l,加水定容,用10%氢氧化钠调ph为6.4~6.8,于25℃,培养120h放瓶。
[0036]
发酵结束后,取发酵液10ml,3000rpm离心15min,弃上清,菌丝体加入95%乙醇10ml,搅拌浸泡30min,3000rpm离心15min,上清液经0.45μm滤膜过滤,滤液用岛津高效液相色谱仪lc2030c进行产物含量检测。
[0037]
左旋7-羟基丁苯酞的液相色谱检测条件:色谱柱:inertsil ods-sp 5μm c18 4.6
×
250mm流动相:乙腈/水=60/40,含0.05%磷酸;流速1ml/min;检测器:uv,210nm。
[0038]
上述条件下,左旋7-羟基丁苯酞的保留时间约为5.9min。
[0039]
检测结果如下表:由上述结果可见,本发明在进行摇瓶种子培养时所采用鱼粉+玉米浆作为复合高磷有机氮源,显著增强了种瓶菌丝发育,改善了低接种量进罐一级种子罐的培养质量,对于提升种瓶发酵水平具有突出的显著效果。尤其玉米浆15.0 g/l/鱼粉8.0g/l 组合效果更为显著,其摇瓶种瓶发酵水平达到2871μg /ml,一级种子罐发酵水平达到3007μg /ml。
[0040]
从图1、图2也可看出,本发明与普通氮源(对照工艺)菌丝相比较,本发明所制备的菌丝镜检形态,菌丝粗壮、美兰染色深,菌体量较大。
[0041]
实施例2将菌株ncc3421菌株斜面培养物接种于摇瓶种子培养基,于25℃,摇床转速220rpm培养52h获得摇瓶种子液。摇瓶种子以接种量5%接种于发酵摇瓶,于25℃,摇床转速220rpm
培养120h放瓶。
[0042]
其中摇瓶种子培养基为:糊精10.0g/l、蔗糖20.0g/l、低温豆饼粉15.0g/l、玉米浆15.0 g/l、鱼粉8g/l、蛋白胨10.0g/l、硫酸铵5.0g/l、氯化钠5.0g/l、碳酸钙2.0g/l,加水定容至1000ml,用10%氢氧化钠调ph为6.6,121℃灭菌30min。
[0043]
按照实施例1所述方法制备种子培养液,以体积百分比3%的接种量接种于发酵培养基中;发酵合成7-羟基丁苯酞发酵液。发酵温度25℃,发酵周期120h~180h;发酵罐搅拌功率40hz,发酵培养转速为220~250rpm;通气比为1:0.8~1.5vvm,罐压0.05
±
0.01mpa,do保持20%以上。
[0044]
其中本实施例制备了七种发酵培养基(以验证本发明所提出的前体物质a对产物7-羟基丁苯酞的影响),发酵瓶装液量为30ml/250ml,培养基组成分别为:培养基i(不含前体物质a):糊精40.0 g/l、蔗糖20.0g/l、低温黄豆饼粉30.0g/l、鱼粉10.0g/l、玉米浆16.0g/l、磷酸二氢钾6.0g/l、硫酸铵8.0g/l、氯化钠5.0g/l、七水硫酸镁2.0g/l、玉米油15.0ml/l、碳酸钙4.0g/l,加水定容,用10%氢氧化钠调ph为6.4,121℃灭菌30min。
[0045]
培养基ii(含低量前体物质a1):糊精40 g/l、蔗糖20.0g/l、低温黄豆饼粉30.0g/l、鱼粉10.0g/l、玉米浆16.0g/l、磷酸二氢钾6.0g/l、硫酸铵8.0g/l、甲硫氨酸2.0g/l、氯化钠5.0g/l、七水硫酸镁2.0g/l、玉米油15.0ml/l、碳酸钙4.0g/l,加水定容,用10%氢氧化钠调ph为6.6,121℃灭菌30min。
[0046]
培养基iii(含中量前体物质a1):糊精40 g/l、蔗糖20.0g/l、低温黄豆饼粉30.0g/l、鱼粉10.0g/l、玉米浆16.0g/l、磷酸二氢钾6.0g/l、硫酸铵8.0g/l、甲硫氨酸5.0g/l、氯化钠5.0g/l、七水硫酸镁2.0g/l、玉米油15.0ml/l、碳酸钙4.0g/l,加水定容,用10%氢氧化钠调ph为6.4,121℃灭菌30min。
[0047]
培养基iv(含高量前体物质a1):糊精40 g/l、蔗糖20.0g/l、低温黄豆饼粉30.0g/l、鱼粉10.0g/l、玉米浆16.0g/l、磷酸二氢钾6.0g/l、硫酸铵8.0g/l、甲硫氨酸8.0g/l、氯化钠5.0g/l、七水硫酸镁2.0g/l、玉米油15.0ml/l、碳酸钙4.0g/l,加水定容,用10%氢氧化钠调ph为6.3,121℃灭菌30min。
[0048]
培养基v:(含低量前体物质a2)糊精40 g/l、蔗糖20.0g/l、低温黄豆饼粉30.0g/l、鱼粉10.0g/l、玉米浆16.0g/l、磷酸二氢钾6.0g/l、硫酸铵8.0g/l、乙硫氨酸2.0g/l、氯化钠5.0g/l、七水硫酸镁2.0g/l、玉米油15.0ml/l、碳酸钙4.0g/l,加水定容,用10%氢氧化钠调ph为6.5,121℃灭菌30min。
[0049]
培养基vi(含中量前体物质a2):糊精40 g/l、蔗糖20.0g/l、低温黄豆饼粉30.0g/l、鱼粉10.0g/l、玉米浆16.0g/l、磷酸二氢钾6.0g/l、硫酸铵8.0g/l、乙硫氨酸5.0g/l、氯化钠5.0g/l、七水硫酸镁2.0g/l,玉米油15.0ml/l、碳酸钙4.0g/l,加水定容,用10%氢氧化钠调ph为6.8,121℃灭菌30min。
[0050]
培养基vii(含高量前体物质a2):糊精40 g/l、蔗糖20.0g/l、低温黄豆饼粉30.0g/l、鱼粉10.0g/l、玉米浆16.0g/l、磷酸二氢钾6.0g/l、硫酸铵8.0g/l、乙硫氨酸8.0g/l、氯化钠5.0g/l、七水硫酸镁2.0g/l,玉米油15.0ml/l、碳酸钙4.0g/l,加水定容,用10%氢氧化钠调ph为6.7,121℃灭菌30min。
[0051]
发酵结束后,取发酵液10ml,3000rpm离心15min,弃上清液,菌丝体加入95%乙醇
10ml,搅拌浸泡30min,3000rpm离心15min,上清液经0.45μm滤膜过滤,滤液用岛津高效液相色谱仪lc2030c进行产物含量检测。
[0052]
左旋7-羟基丁苯酞的液相色谱检测条件:色谱柱:inertsil ods-sp 5μm c18 4.6
×
250mm流动相:乙腈/水=60/40,含0.05%磷酸;流速1ml/min;检测器:uv,210nm。
[0053]
上述条件下,左旋7-羟基丁苯酞的保留时间约为5.9min。
[0054]
结果如下表:由上述结果可见,发酵培养中添加前体物质a进一步显著促进了7-羟基丁苯酞发酵产物的合成,尤其是添加中等计量的甲硫氨酸(5.0g/l),发酵水平达到5274μg /ml。
[0055]
从图3也可以看出,本发明实施例2(培养基)2m3发酵罐48h菌丝形态(
×
40),显示种子罐菌丝在移种至发酵罐后,菌丝发育迅速,代谢旺盛。
[0056]
实施例3将菌株ncc3421菌株斜面培养物接种于摇瓶种子培养基,于25℃,摇床转速220rpm培养52h获得摇瓶种子液。摇瓶种子以接种量3%接种于发酵摇瓶,于25℃,摇床转速220rpm培养120h放瓶。其中摇瓶种子培养基为:糊精10.0g/l、蔗糖20.0g/l、低温豆饼粉15.0g/l、玉米浆15.0 g/l、鱼粉8.0g/l、蛋白胨10.0g/l、硫酸铵5.0g/l、氯化钠5.0g/l、碳酸钙2.0g/l,加水定容,用10%氢氧化钠调ph为6.5,121℃灭菌30min。
[0057]
参照实施例1所述方法制备种子培养液,以体积百分比5%的接种量接种于发酵培养基中;发酵合成7-羟基丁苯酞发酵液。 发酵温度22℃,发酵周期120h~180h;发酵罐搅拌功率40hz,发酵培养转速为220~250rpm;通气比为1:0.8~1.5vvm,罐压0.05
±
0.01mpa,do保持30%。
[0058]
为了考察发酵培养基中前体物质b对产物7-羟基丁苯酞的影响,本实施例制备了六种发酵培养基,发酵瓶装液量为30ml/250ml。
[0059]
六种培养基分别为:培养基i(含低量前体物质b正丁醇):糊精40 g/l、蔗糖20.0g/l、低温黄豆饼粉30.0g/l、鱼粉10.0g/l、玉米浆16.0g/l、磷酸二氢钾6.0g/l、硫酸铵8.0g/l、甲硫氨酸5.0g/l、氯化钠5.0g/l、七水硫酸镁2.0g/l、玉米油15.0ml/l、碳酸钙4.0g/l,加水定容,用10%氢氧化钠调ph为6.5,121℃灭菌30min。消后加入正丁醇终浓度2.0g/l。
[0060]
培养基ii(含高量前体物质b正丁醇):糊精40 g/l、蔗糖20.0g/l、低温黄豆饼粉30.0g/l、鱼粉10.0g/l、玉米浆16.0g/l、磷酸二氢钾6.0g/l、硫酸铵8.0g/l、甲硫氨酸5.0g/l、氯化钠5.0g/l、七水硫酸镁2.0g/l、玉米油15.0ml/l、碳酸钙4.0g/l,加水定容至1000ml,用10%氢氧化钠调ph为6.4,121℃灭菌30min。消后加入正丁醇终浓度5.0g/l。
[0061]
培养基iii(含低量量前体物质b正亮氨酸):糊精40 g/l、蔗糖20.0g/l、低温黄豆饼粉30.0g/l、鱼粉10.0g/l、玉米浆16.0g/l、磷酸二氢钾6.0g/l、硫酸铵8.0g/l、甲硫氨酸
5.0g/l、正亮氨酸2.0g/l、氯化钠5.0g/l、七水硫酸镁2.0g/l、玉米油15.0ml/l、碳酸钙4.0g/l,加水定容,用10%氢氧化钠调ph为6.7,121℃灭菌30min。
[0062]
培养基iv(含高量前体物质b正亮氨酸):糊精40 g/l、蔗糖20.0g/l、低温黄豆饼粉30.0g/l、鱼粉10.0g/l、玉米浆16.0g/l、磷酸二氢钾6.0g/l、硫酸铵8.0g/l、甲硫氨酸5.0g/l、正亮氨酸5.0g/l、氯化钠5.0g/l、七水硫酸镁2.0g/l、玉米油15.0ml/l、碳酸钙4.0g/l,加水定容,用10%氢氧化钠调ph为6.8,121℃灭菌30min。
[0063]
培养基v(含低量前体物质b正丁酸钠):糊精40 g/l、蔗糖20.0g/l、低温黄豆饼粉30.0g/l、鱼粉10.0g/l、玉米浆16.0g/l、磷酸二氢钾6.0g/l、硫酸铵8.0g/l、甲硫氨酸5.0g/l、正丁酸钠2.0g/l、氯化钠5.0g/l、七水硫酸镁2.0g/l,玉米油15.0ml/l, 碳酸钙4.0g/l,加水定容,用10%氢氧化钠调ph为6.6,121℃灭菌30min。
[0064]
培养基vi(含高量前体物质b正丁酸钠):糊精40 g/l、蔗糖20.0g/l、低温黄豆饼粉30.0g/l、鱼粉10.0g/l、玉米浆16.0g/l、磷酸二氢钾6.0g/l、硫酸铵8.0g/l、甲硫氨酸5.0g/l、正丁酸钠5.0g/l、氯化钠5.0g/l、七水硫酸镁2.0g/l、玉米油15.0ml/l、碳酸钙4.0g/l,加水定容,用10%氢氧化钠调ph为6.4,121℃灭菌30min。
[0065]
发酵结束后,取发酵液10ml,3000rpm离心15min,弃上清,菌丝体加入95%乙醇10ml,搅拌浸泡30min,3000rpm离心15min,上清液经0.45μm滤膜过滤,滤液用岛津高效液相色谱仪lc2030c进行产物含量检测。
[0066]
左旋7-羟基丁苯酞的液相色谱检测条件:色谱柱:inertsil ods-sp 5μm c18 4.6
×
250mm流动相:乙腈/水=60/40,含0.05%磷酸;流速1ml/min;检测器:uv,210nm。
[0067]
上述条件下,左旋7-羟基丁苯酞的保留时间约为5.9min。
[0068]
结果如下表:由上述结果可见,本发明方法在添加高磷有机氮源以及前体物质a的基础上组合添加前体物质b进一步促进7-羟基丁苯酞发酵产物的合成,最优组甲硫氨酸5.0g/l,正丁醇2.0g/l,发酵水平达到6332μg /ml。
[0069]
实施例4将菌株ncc3421菌株斜面培养物接种于摇瓶种子培养基,于25℃,摇床转速220rpm培养48h获得摇瓶种子液,其中摇瓶种子培养基为:糊精10.0g/l、蔗糖20.0g/l、低温豆饼粉15.0g/l、玉米浆15.0 g/l,鱼粉8.0g/l、蛋白胨10.0g/l、硫酸铵5.0g/l、氯化钠5.0g/l、碳酸钙2.0g/l,加水定容,用10%氢氧化钠调ph为6.6,121℃灭菌30min。
[0070]
摇瓶种子液以接种量0.5%接种于一级种子罐(500l)内,接后体积300l,培养温度25℃,种子罐搅拌功率40hz,通气比为1:1.0vvm,罐压0.05
±
0.01mpa,培养48h获取一级种子。其中种子罐培养基为:糊精10.0g/l、蔗糖10.0g/l、低温豆饼粉15.0g/l、玉米浆5.0g/l、蛋白胨10.0g/l、磷酸二氢钾3.0g/l、氯化钠5.0g/l、碳酸钙2g/l,消沫剂1ml/l,加水定容,用40%氢氧化钠溶液调ph至6.8,121℃灭菌30min。
[0071]
将一级种子罐种子液以体积百分比5%的接种量接种于2m3发酵罐,接后体积1.2 m3,发酵温度25℃,发酵罐搅拌功率40hz,通气比为1:0.8~1.5vvm,罐压0.05
±
0.01mpa,do保持20%以上。其中发酵罐培养基为:蔗糖20.0g/l、低温黄豆饼粉30.0g/l、鱼粉10.0g/l、玉米浆16.0g/l、磷酸二氢钾6.0g/l、硫酸铵8.0g/l、甲硫氨酸5.0g/l、氯化钠5.0g/l、七水硫酸镁2.0g/l、玉米油15.0ml/l、 碳酸钙4.0g/l,加水定容,用10%氢氧化钠调ph为6.4,121℃灭菌30min。消后加入正丁醇终浓度为2.0g/l。
[0072]
发酵过程进行流加补料(补料为葡萄糖,添加总量为300g/l),流加方式为:当发酵液ph升至7.2时,启动补糖流速为2l/h,发酵中后期还原糖降至1.0%以下,下调补糖流速为0.8ml/h,放罐前12h停止补料,发酵周期168h。测得放罐发酵单位为8235μg /ml。
[0073]
实施例5将菌株ncc3421斜面培养物接种于摇瓶种子培养基,于25℃,摇床转速220rpm培养52h获得摇瓶种子液,其中摇瓶种子培养基为:糊精10.0g/l、蔗糖20.0g/l、低温豆饼粉15.0g/l、玉米浆15.0 g/l、鱼粉8.0g/l、蛋白胨10.0g/l、硫酸铵5.0g/l、氯化钠5.0g/l、碳酸钙2.0g/l,加水定容,用10%氢氧化钠调ph为6.8,121℃灭菌30min。
[0074]
摇瓶种子液以接种量0.3%接种于一级种子罐(500l)内,接后体积300l,培养温度25℃,种子罐搅拌功率40hz,通气比为1:1.5vvm,罐压0.05
±
0.01mpa,培养52h获取一级种子。其中种子罐培养基为:糊精10.0g/l、蔗糖10.0g/l、低温豆饼粉15.0g/l、玉米浆5.0g/l、蛋白胨10.0g/l、磷酸二氢钾3.0g/l、氯化钠5.0g/l、碳酸钙2g/l、消沫剂1.0ml/l,加水定容,用40%氢氧化钠溶液调ph至6.4,121℃灭菌30min。
[0075]
将一级种子罐种子液以体积百分比3%的接种量接种于2m3发酵罐,接后体积1.2 m3,发酵温度25℃,发酵罐搅拌功率40hz,通气比为1:0.8~1.5vvm,罐压0.05
±
0.01mpa,do保持20%以上。其中发酵罐培养基为:蔗糖20.0g/l、低温黄豆饼粉30.0g/l、鱼粉10.0g/l、玉米浆16.0g/l、磷酸二氢钾6.0g/l、硫酸铵8.0g/l、甲硫氨酸5.0g/l、氯化钠5.0g/l、七水硫酸镁2.0g/l、玉米油15.0ml/l、 碳酸钙4.0g/l,加水定容,用10%氢氧化钠调ph为6.8,121℃灭菌30min。消后加入正丁醇终浓度为2.0g/l。
[0076]
发酵过程进行流加补料(补料料液浓度为葡萄糖400g/l,甘油100g/l),当发酵液ph升至7.3时,启动补糖流速为3l/h,发酵中后期还原糖降至1.0%以下,下调补糖流速为1l/h,放罐前8h停止补料,发酵周期170h。测得放罐发酵单位为10168μg /ml。
[0077]
实施例6将菌株ncc3421斜面培养物接种于摇瓶种子培养基,于25℃,摇床转速220rpm培养50h获得摇瓶种子液,其中摇瓶种子培养基为:糊精10.0g/l、蔗糖20.0g/l、低温豆饼粉15.0g/l、玉米浆15.0 g/l,鱼粉8.0g/l,蛋白胨10.0g/l、硫酸铵5.0g/l、氯化钠5.0g/l、碳酸钙2.0g/l,加水定容,用10%氢氧化钠调ph为6.6,121℃灭菌30min。
[0078]
摇瓶种子液以接种量0.4%接种于一级种子罐(500l),接后体积300l,培养温度25℃,种子罐搅拌功率40hz,通气比为1:1.2vvm,罐压0.05
±
0.01mpa,培养52h获取一级种子。其中种子罐培养基为:糊精10.0g/l、蔗糖10.0g/l、低温豆饼粉15.0g/l、玉米浆5.0g/l、蛋白胨10.0g/l、磷酸二氢钾3.0g/l、氯化钠5.0g/l、碳酸钙2g/l、消沫剂1.0ml/l,加水定容,用40%氢氧化钠溶液调ph至6.4,121℃灭菌30min。
[0079]
将一级种子罐种子液以体积百分比5%的接种量接种于2m3发酵罐中进行发酵,接
后体积1.2 m3,发酵温度25℃,发酵罐搅拌功率40hz,通气比为1:0.8~1.5vvm,罐压0.05
±
0.01mpa,do保持20%以上。其中发酵罐培养基为:蔗糖20.0g/l、低温黄豆饼粉30.0g/l、鱼粉10.0g/l、玉米浆16.0g/l、磷酸二氢钾6.0g/l、硫酸铵8.0g/l、甲硫氨酸5.0g/l、氯化钠5.0g/l、七水硫酸镁2.0g/l、玉米油15.0ml/l、碳酸钙4.0g/l,加水定容,用10%氢氧化钠调ph为6.8,121℃灭菌30min。消后加入正丁醇终浓度为2.0g/l。
[0080]
发酵过程进行流加补料(补料料液浓度为葡萄糖450g/l,甘油150g/l),当发酵液ph升至7.3时,启动补糖流速为4l/h,发酵中后期还原糖降至1.0%以下,下调补糖流速为2l/h,放罐前12h停止补料,发酵周期180h。测得放罐发酵单位为10205μg /ml。其hplc色谱图详见图4。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1