酶催化合成嘌呤核苷的方法及组合物与流程
1.本发明涉及酶催化领域,具体而言,涉及一种酶催化合成嘌呤核苷的方法及组合物。
背景技术:
2.嘌呤核苷及其类似物可作为前体或者终产品广泛应用于医药领域,如抗病毒,抗肿瘤等药物。目前,嘌呤核苷及其类似物主要以化学法合成(wo2021186328a1、cn113173961a、cn111592542a、cn111253455a、cn110627729a、cn102127135a,wo2010113937a1,wo2009058800a2、cn101250210a、us2005171126a1、ep1108724a2),其合成工艺较为繁琐,需要严苛的反应条件,且化学法合成的产品纯化步骤复杂,与其异构体难以分离,会导致收率不高而引起成本较高等问题。此外,化学合成会用到毒性试剂,往往对环境造成较大的破坏。
3.此外,嘌呤核苷还可以微生物发酵法生产(cn112553135a、cn112574934a、cn113151238a、cn113278596a、cn112143751a、cn112126666a、cn113373100a、cn102171346、cn101120090a、cn1831115a、cn1270631a)。目前微生物发酵法生产嘌呤类核苷多限于天然核苷如腺苷,鸟苷和肌苷等的生产,且耗时长,产量较低,离工业化生产还有一定的距离。
4.近些年,嘌呤核苷的酶法合成由于步骤少,收率较高,光学纯度高,环境友好等优点,可以避免上述的问题而受到较多的关注。嘌呤核苷的酶法合成可经多种路线使用不同酶得以实现,如专利ep1457568a1公开了一种生物酶催化方法,可以利用n-脱氧核糖转移酶ii(nucleoside deoxyribosyl transferase ii)和核苷酶(nucleosidase)以胸苷和鸟嘌呤为底物反应32h合成31mm 2'-脱氧鸟苷。此外,该专利还以上述两种酶并结合腺苷脱氨酶(adenosine deaminase)用两步法反应约30h最终合成超过40mm 2'-脱氧鸟苷。此外,嘧啶核苷磷酸化酶(pyrimidine nucleoside phosphorylase)和嘌呤核苷磷酸化酶(purine nucleoside phosphorylase)也可以被用于合成嘌呤核苷。专利cn102770532a公开了一种可以利用嘧啶核苷磷酸化酶和嘌呤核苷磷酸化酶将嘧啶核苷和嘌呤碱基进行生物转化的方法,可以将尿苷或2'-脱氧尿苷和嘌呤碱基转化成2,6-二氨基嘌呤核苷和2,6-二氨基嘌呤-2'-脱氧核苷,转化率超过90%,但产量低于5mm。专利cn1207417a利用芽孢杆菌属脂肪嗜热杆菌(bacillus stearothermophilus jts859)来源的嘧啶核苷磷酸化酶和嘌呤核苷磷酸化酶以及节细菌属来源的尿嘧啶和胸腺嘧啶分解酶液,以胸苷和相应的嘌呤碱基为底物,反应110小时可生产14.9mm 2'-脱氧鸟苷,产率为75%,反应90小时可得到17.7mm的2'-脱氧腺苷,产率为88.5%。但上述公开的酶法合成,均具有转化率低、产量低或反应时间长等的问题。
技术实现要素:
5.本发明的主要目的在于提供一种酶催化合成嘌呤核苷的方法及组合物,以解决现有技术中的酶法合成嘌呤核苷产量低的问题。
6.为了实现上述目的,根据本发明的第一个方面,提供了一种酶催化合成嘌呤核苷的方法,该方法利用嘌呤核苷磷酸化酶以及如下任一种酶:嘧啶核苷磷酸化酶或胸苷磷酸化酶,催化底物合成嘌呤核苷;底物包括底物核苷和底物碱基;嘧啶核苷磷酸化酶包括pynp,pynp为seq id no:1所示的蛋白质;胸苷磷酸化酶包括tp,tp为seq id no:2所示的蛋白质;嘌呤核苷磷酸化酶包括pnp,pnp为seq id no:3所示的蛋白质。
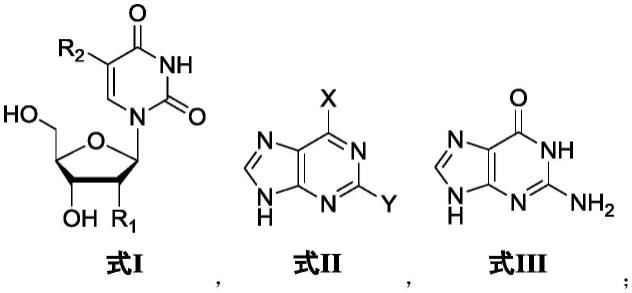
7.进一步地,底物核苷为式i所示的核苷,r1选自-h或-oh,r2选自-h或-ch3;优选地,底物核苷包括胸苷,尿苷或2'-脱氧尿苷。
[0008][0009]
进一步地,底物碱基为式ii或式iii所示的碱基,x选自-nh3或-och3,y选自-h或-nh2;优选地,底物碱基包括鸟嘌呤,腺嘌呤、2,6-二氨基嘌呤或6-甲氧基鸟嘌呤;
[0010][0011]
进一步地,pynp、tp、或pnp中的一种或多种为纯化蛋白、粗酶液或固定化酶。
[0012]
进一步地,上述方法中:底物核苷的浓度为2~400mm,底物碱基的浓度为1~200mm。
[0013]
进一步地,酶催化的催化时间为2~18h。
[0014]
进一步地,酶催化的催化温度为60~70℃。
[0015]
为了实现上述目的,根据本发明的第二个方面,提供了一种组合物,该组合物包括嘌呤核苷磷酸化酶以及如下任一种酶:嘧啶核苷磷酸化酶或胸苷磷酸化酶,其中,嘧啶核苷磷酸化酶为pynp,pynp为seq id no:1所示的蛋白质;胸苷磷酸化酶为tp,tp为seq id no:2所示的蛋白质;嘌呤核苷磷酸化酶为pnp,pnp为seq id no:3所示的蛋白质。
[0016]
进一步地,组合物包括pynp、tp或pnp中的一种或多种为纯化蛋白、粗酶液或固定化酶。
[0017]
进一步地,组合物还包括底物核苷和底物碱基;底物核苷为式i所示的核苷,r1选自-h或-oh,r2选自-h或-ch3;底物碱基为式ii或式iii所示的碱基,x选自-nh3或-och3,y选自-h或-nh2;优选地,底物核苷的浓度为2~400mm,底物碱基的浓度为1~200mm;
[0018][0019]
应用本发明的技术方案,利用pynp和pnp、或tp和pnp,共同进行酶催化,以底物核苷和底物碱基为原料,一步法催化生成多种嘌呤核苷,并能够实现放大生产,从而在较短的反应时间内高效合成,提高嘌呤核苷的产量。
附图说明
[0020]
构成本技术的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
[0021]
图1示出了根据本发明实施例5的2'-脱氧腺苷的标准曲线示意图。
[0022]
图2示出了根据本发明实施例7的2'-脱氧鸟苷的标准曲线示意图。
[0023]
图3示出了根据本发明实施例5的2'-脱氧腺苷的高效液相色谱图。
[0024]
图4示出了根据本发明实施例6的2'-脱氧腺苷的高效液相色谱图。
具体实施方式
[0025]
需要说明的是,在不冲突的情况下,本技术中的实施例及实施例中的特征可以相互组合。下面将结合实施例来详细说明本发明。
[0026]
如背景技术所提到的,现有技术中合成嘌呤核苷的方法,均具有成本高、耗时长、产量低等问题,不利于嘌呤核苷及其类似物的制备和后续利用。
[0027]
现有的酶法合成核苷磷酸化酶路线反应步骤多,操作繁琐,耗时较长,产量产率较低造成生产成本较高。如专利ep1457568a1涉及的酶法转化需要两步反应和三种酶,耗时30h,2'-脱氧鸟苷产量仅为40mm;cn1207417a公布的酶法转化耗时90小时以上,而且嘌呤核苷的产量较低,还需要额外制备具有尿嘧啶和胸腺嘧啶分解活性的酶液,增加了生产成本,如无添加则产量和产率显著降低,仅为添加时的13%~50%。专利cn102770532a公布的方法仅能得到低于5mm的2,6-二氨基嘌呤核苷和2,6-二氨基嘌呤-2'-脱氧核苷。而由于底物嘌呤碱基溶解度较低,酶不稳定和中间产物(核糖-1-磷酸或2
’‑
脱氧核糖-1-磷酸)易被破坏等问题,单纯的对反应进行放大或延长时间可能使反应平衡被破坏,酶失活等,最终得到的转化率和收率偏低,使得生产成本增加,因而难以被应用到实际的商业生产中。
[0028]
为改善上述现状,在本技术中,发明人尝试探究新的酶催化合成嘌呤核苷的方法,从大量具有潜在活性的相关蛋白中,发现了pynp(嘧啶核苷磷酸化酶,如seq id no:1所示的蛋白质)和pnp(嘌呤核苷磷酸化酶,如seq id no:3所示的蛋白质)及tp(胸苷磷酸化酶包括,如seq id no:2所示的蛋白质)和pnp组合作用的催化活性,发现利用pynp,tp和pnp的酶液能够一步法催化底物核苷和底物碱基,生成目标产物嘌呤核苷。该酶催化方法反应时间
短,合成效率高,因而得到的产品产量高。在此基础上,申请人提出了本技术的一系列保护方案。
[0029]
在本技术第一种典型的实施方式中,提供了一种酶催化合成嘌呤核苷的方法,该方法利用嘌呤核苷磷酸化酶以及如下任一种酶:嘧啶核苷磷酸化酶或胸苷磷酸化酶,,催化底物合成嘌呤核苷;底物包括底物核苷和底物碱基;嘧啶核苷磷酸化酶包括pynp,pynp为seq id no:1所示的蛋白质;胸苷磷酸化酶包括tp,tp为seq id no:2所示的蛋白质;嘌呤核苷磷酸化酶包括pnp,pnp为seq id no:3所示的蛋白质。上述嘧啶核苷磷酸化酶、胸苷磷酸化酶或嘌呤核苷磷酸化酶,均分别包括与pynp、tp或pnp具有80%、85%、90%、95%、98%、99%、99.5%或99.9%以上同源性且具有相同功能的蛋白质
[0030]
本技术中所使用嘧啶核苷磷酸化酶来源于嗜热栖热菌thermus thermophilus,为seq id no:1所示的蛋白质,将此嘧啶核苷磷酸化酶命名pynp;胸苷磷酸化酶来源于智人homo sapiens,为seq id no:2所示的蛋白质,将此胸苷磷酸化酶命名tp;嘌呤核苷磷酸化酶来源于嗜热脂肪地芽孢杆菌geobacillus stearothermophilus,为seq id no:3所示的蛋白质,将此嘌呤核苷磷酸化酶命名pnp。在上述酶催化方法中,利用两种不同来源的核苷磷酸酶,一步法高效合成嘌呤核苷,能够降低生产成本,并应用于大规模工业生产相关产品。上述底物包括底物核苷和底物碱基,可以为天然的核苷或碱基结构,也可以为人为改造的类似结构。
[0031][0032]
在该酶催化方法中,在pynp或tp的催化下进行上述a反应,将底物核苷的嘧啶基团和核糖基团间的c-n键断开,并在核苷基团上结合磷酸基团,形成磷酸核糖中间体。该磷酸核糖中间体在pnp的作用下,进行上述b反应,使核糖基团的c-1'原子与嘌呤类底物碱基的n-9原子形成c-n键,生成嘌呤核苷类化合物。在上述a和b反应中,不需要额外添加nadph等辅酶,仅利用底物和蛋白即可完成反应,反应简单,无需在活细胞中进行,大大降低反应成本和效率。此2种蛋白组合进行的该酶催化方法,能够在较短的催化时间内完成催化反应,且底物的转化率高,在放大反应中同样适用,能够大规模的进行工业生产。
[0033]
在一种优选的实施例中,底物核苷为式i所示的核苷,r1选自-h或-oh,r2选自-h或-ch3;优选地,底物核苷包括胸苷,尿苷或2'-脱氧尿苷;
[0034]
[0035]
在一种优选的实施例中,底物碱基为式ii或式iii所示的碱基,x选自-nh3或-och3,y选自-h或-nh2,优选地,底物碱基包括鸟嘌呤,腺嘌呤、2,6-二氨基嘌呤或6-甲氧基鸟嘌呤,
[0036][0037]
利用上述底物核苷和底物碱基,能够利用该酶催化方法,制备2'-脱氧腺苷,2'-脱氧鸟苷,2,6-二氨基嘌呤核苷,2,6-二氨基嘌呤-2'-脱氧核苷和6-o-甲基-鸟苷等嘌呤核苷。
[0038]
上述底物核苷和底物碱基中的r1、r2、x和y取代基均距离反应位点较远,因此可以利用pynp和pnp对不同的底物进行酶催化反应,制备多种嘌呤核苷。
[0039]
在一种优选的实施例中,pynp、tp或pnp中的一种或多种为纯化蛋白、粗酶液或固定化酶。
[0040]
利用pynp,tp和pnp催化反应,上述3种蛋白可以以纯化蛋白、粗酶液或固定化酶等多种形式存在,均能够催化合成嘌呤核苷。将表达pynp和/或tp和/或pnp的基因克隆在宿主细胞中,诱导蛋白表达后,破碎宿主细胞即能够获得含有目标蛋白的粗酶液。粗酶液的制备简单,且有良好的催化能力,且能够降低催化反应的生产成本。
[0041]
在一种优选的实施例中,在上述方法中,底物核苷的浓度为2~400mm,底物碱基的浓度为1~200mm。
[0042]
上述酶催化方法,能够进行放大反应,在反应体系中,底物核苷的浓度最大为400mm,底物碱基的浓度最大为200mm,从而进行大规模的嘌呤核苷的制备。
[0043]
在一种优选的实施例中,酶催化的催化时间为2~18h。
[0044]
在一种优选的实施例中,酶催化的催化温度为60~70℃。
[0045]
在上述适宜的催化温度和催化时间内,该酶催化反应即能够完成,且底物碱基的转化率,即反应收率较高。在反应中途也无需补加酶或其他试剂,一步法催化即能够完成反应,适宜在工业化放大生产上的应用。
[0046]
在本技术第二种典型的实施方式中,提供了一种组合物,该组合物包括嘌呤核苷磷酸化酶以及如下任一种酶:嘧啶核苷磷酸化酶或胸苷磷酸化酶,其中,嘧啶核苷磷酸化酶为pynp,pynp为seq id no:1所示的蛋白质;胸苷磷酸化酶为tp,tp为seq id no:2所示的蛋白质;嘌呤核苷酸磷酸化酶为pnp,pnp为seq id no:3所示的蛋白质。该组合物用于合成嘌呤核苷。
[0047]
在一种优选的实施例中,组合物包括纯化蛋白、粗酶液或固定化酶。
[0048]
在一种优选的实施例中,组合物还包括底物核苷和底物碱基反应,生成嘌呤核苷;底物核苷为式i所示的核苷,r1选自-h或-oh,r2选自-h或-ch3;底物碱基为式ii或式iii所示的碱基,x选自-nh3或-och3,y选自-h或-nh2;优选地,底物核苷的浓度为2~400mm,底物碱基的浓度为1~200mm;
[0049][0050]
pynp为来源于嗜热栖热菌thermus thermophilus的嘧啶核苷磷酸化酶,氨基酸序列如seq id no:1所示。tp为来源于智人homo sapiens的胸苷磷酸化酶,氨基酸序列如seq id no:2所示。pnp为来源于嗜热脂肪地芽孢杆菌geobacillus stearothermophilus的嘌呤核苷磷酸化酶,氨基酸序列如seq id no:3所示。组合物包括pynp和pnp、或tp和pnp,利用该组合物,能够催化胸苷、尿苷等核苷与鸟嘌呤、腺嘌呤等碱基完成反应,生产嘌呤核苷及其类似物。组合物中的蛋白,能够分别独立选自纯化蛋白、粗酶液或固定化酶等形式,均能够发挥催化作用。
[0051]
下面将结合具体的实施例来进一步详细解释本技术的有益效果。
[0052]
实施例1
[0053]
1.菌株构建
[0054]
本技术中所使用嘧啶核苷磷酸化酶来源于嗜热栖热菌thermus thermophilus,命名pynp,氨基酸序列如seq id no:1所示。胸苷磷酸化酶来源于智人homo sapiens,命名tp,氨基酸序列如seq id no:2所示。嘌呤核苷磷酸化酶来源于嗜热脂肪地芽孢杆菌geobacillus stearothermophilus,命名pnp,氨基酸序列如seq id no:3所示。
[0055]
密码子优化后获得编码两个酶的dna序列,编码pynp的dna序列为seq id no:4;编码tp的dna序列为seq id no:5;编码pnp的dna序列为seq id no:6。将其分别克隆到表达载体pet28a(+)上。将得到的质粒化转至大肠杆菌bl21(de3)宿主感受态中,获得单克隆菌株。
[0056]
seq id no:1:
[0057]
mnpvafirekregkkhrredleafllgylrdevpdyqvsawlmaaflrgldpeetlwltetmarsgkvldlsglphpvdkhssggvgdkvslvvgpilaasgctfakmsgrglahtggtidklesvpgwrgemteaeflerarrvglviaaqspdlapldgklyalrdvtatvesvpliassimskklaagarsivldvkvgrgafmktleearllaktmvaigqgagrrvralltsmeaplgravgnaievreaiealkgegpgdllevalalaeealrlegldpalarkaleggaalekfrafleaqggdpravedfsllplaeehplraeregvvrevdaykvglavlalgggrkrkgepidhgvgvyllkkpgdrvergealalvyhrrrgleealghlreayalgeeahpaplvleai。
[0058]
seq id no:2:
[0059]
maalmtpgtgappapgdfsgegsqglpdpspepkqlpelirmkrdggrlseadirgfvaavvngsaqgaqigamlmairlrgmdleetsvltqalaqsgqqlewpeawrqqlvdkhstggvgdkvslvlapalaacgckvpmisgrglghtggtldklesipgfnviqspeqmqvlldqagccivgqseqlvpaegilyaardvtatvdslplitasilskklveglsalvvdvkfggaavfpnqeqarelaktlvgvgaslglrvaaaltamdkplgrcvghaleveeallcmdgagppdlrdlvttlggallwlsghagtqaqgaarvaaalddgsalgrfermlaaqgvdpglaralcsgspaerrqllprareqeellapadgtvelvralplalvlhelgagrsrageplrlgvgaellvdvgqrlrrgtpwlrvhrdgpals
gpqsralqealvlsdrapfaapspfaelvlppqq。
[0060]
seq id no:3:
[0061]
msvhigakeheiadkillpgdplrakyiaetflegatcynqvrgmlgftgtykghrisvqgtgmgvpsisiyitelmqsynvqtlirvgtcgaiqkdvkvrdvilamtsstdsqmnrmtfggidyaptanfdllktayeigkekglqlkvgsvftadmfynenaqfeklarygvlavemettalytlaakfgrkalsvltvsdhiltgeettaeerqttfnemievaletairq。
[0062]
seq id no:4:
[0063]
atgaacccggtggcgtttattcgcgaaaaacgcgaaggcaagaaacatcgccgcgaggatctggaagcgtttctgctgggctatctgcgcgatgaagtgccggattatcaggtgagcgcgtggctgatggcggcgtttttacgcggcttagatccggaagaaaccctgtggctgaccgaaacgatggcccgcagcggtaaagtgctggatctgagcggtctgccgcatccggttgataaacatagcagcggcggcgtgggcgataaagtgagcttagtggtgggcccgattctggcggcgagcggttgtacctttgcgaaaatgtcgggccgcggcctggcgcataccggtggtaccattgataaactggaaagcgtgccgggctggcgcggcgaaatgaccgaagcagaatttctggaacgcgcccgtcgcgttggtctggttattgcggcgcaaagcccggatttagcgccgttagatggcaaactgtatgcgctgcgcgatgtgaccgcgaccgttgaatcagttccgctgattgcgagcagcattatgagcaagaaactggcggcgggcgcccgtagcattgtgttagatgttaaagtgggccgcggcgcgtttatgaaaaccctggaagaagcgcgtctgctggcgaaaacgatggtggcgattggccagggcgcgggccgtcgtgttcgtgcgttattaaccagcatggaagcgcctctgggtcgtgcggttggcaatgcgattgaagtgcgtgaagcgattgaagcgctgaaaggcgaaggcccgggcgatttattagaagtggcgctggcgttagcggaagaagcgctgcgtttagaaggcttagatccggcgctggcgcgtaaagcgttagaaggtggcgcggcgctggaaaaatttcgcgcgtttctggaagcgcagggcggcgatccgcgtgcagttgaagattttagcctgctgccgctggcggaagaacatccgttacgtgcggaacgcgaaggcgtggttcgcgaagttgatgcgtataaagtgggcctggcggtgctggcgttaggcggtggtcgtaaacgtaaaggtgaaccgattgatcatggcgtgggcgtgtatctgctgaagaaaccgggcgatcgcgtggaacgcggcgaagcgttagcgttagtgtatcatcgccgccgcggcttagaagaagcgctgggtcatttacgcgaagcgtatgcgctgggcgaagaagcgcatccggcgcctctggttttagaagcgatttaa。
[0064]
seq id no:5:
[0065]
atggcggcgttaatgacccctggcaccggtgcgcctcctgcgcctggtgattttagcggcgaaggcagccagggcctgccggaccctagccctgaacctaaacaactgccggaactgattcgcatgaaacgcgatggtggccgcctgagcgaagcggatattcgcggttttgtggcggcggtggtgaacggcagcgcacaaggtgcgcaaattggtgcgatgttaatggcgattcgcctgcgcggcatggatctggaagaaaccagcgtgctgacccaggcgctggcgcaaagcggtcagcaactggaatggcctgaagcgtggcgccagcagttagttgataaacatagcaccggcggcgtgggcgataaagtgagcttagttctggcgccggcgctggcggcgtgtggctgtaaagttcctatgattagcggccgtggcctgggccataccggtggtactttagataaactggaaagcattccgggctttaacgtgattcagagcccggaacagatgcaggtgctgctggatcaggcgggctgttgcattgtgggccagagcgaacagctggtgccggcggaagggattctgtatgcggcgcgtgatgtgaccgcgaccgttgatagcttaccgctgattaccgcgagcattctgagcaaaaagctggtggaaggcctgagcgccctggtggtggatgttaaatttggcggcgcggcggtgtttccgaaccaggaacaagcccgcgaactggcgaaaaccctggtgggcgttggcgcgagcctgggtttacgtgttgcggcggcgttaaccgcgatggataaaccgttaggccgctgcgttggccatgcgctggaagtggaagaagcgctgctgtgcatggatggcgcgggccctcctgatttacgcgatctggttacgaccctgggcggcgcgttactgtggttaagcggccatgcgggtacccaggcgcaaggcgcagcgcgtgttgcggcagcgctggatgatggtagcgcgttaggtcgttttgaacgcatgctggcggcgcagggtgtg
gaccctggtttggcgcgtgcgttatgtagcggcagccctgcggaacgtcgccagttattacctcgcgcccgtgaacaagaagaactgctggcgccggcggatggcaccgttgaattagtgcgtgcgctgccgttagcgctggtgttacatgaactgggcgcgggccgctcacgtgcgggtgaacctttacgtttaggcgttggtgcggaactgctggtggatgttggtcagcgcctgcgccgtggtaccccttggttacgtgttcatcgtgatggtccggcgctgagcggccctcaaagccgtgcgctgcaagaagcgttagttctgagcgatcgtgcgccgtttgcggcgccgagcccttttgcggaattggttttaccgcctcagcaataa。
[0066]
seq id no:6:
[0067]
atgagcgtgcatattggcgcgaaagaacatgaaattgcggataaaattctgctgccgggcgatccgttacgcgcgaaatatattgcggaaacctttctggaaggcgcgacctgctataaccaggtgcgcggcatgctgggctttaccggcacctataaaggccatcgcattagcgtgcagggcaccggcatgggcgttcctagcatttcaatttatattaccgaactgatgcagagctataacgtgcagaccctgattcgcgtgggcacctgcggtgcgattcaaaaagatgtgaaagtgcgcgatgtgattctggcgatgaccagcagcaccgatagccagatgaaccgcatgacctttggcggcattgattatgcgccgaccgcgaactttgatctgctgaaaaccgcgtatgaaattggcaaagaaaaaggcctgcagctgaaagtgggcagcgtgtttaccgcggatatgttttataacgaaaacgcgcagtttgagaaactggcccgctatggcgtgctggcggttgaaatggaaaccaccgcgctgtataccctggcggcgaaatttggccgcaaagcgctgagcgtgctgaccgtgagcgatcatattctgaccggcgaagaaaccaccgcggaagaacgccagaccacctttaacgaaatgattgaagtggcgctggaaaccgcgattcgccagtaa。
[0068]
2.蛋白表达
[0069]
将表达pynp、tp、和pnp的大肠杆菌菌株分别接种于试管,37℃培养16h后以1v/v%接种量,接种于含500ml lb液体培养基的2l摇瓶,37℃培养至od
600
为0.6时,加入终浓度为0.1m异丙基-β-d-硫代半乳糖苷诱导蛋白的表达,20℃培养18h。将培养结束的菌液7000rpm离心10min收集菌体,备用。
[0070]
3.酶液制备
[0071]
称取0.1g菌泥,添加1ml ph为7.5的磷酸钾缓冲液,震荡混匀后,用超声破碎仪,将菌体混悬液破碎,功率30%,时间5min。
[0072]
4.hplc检测方法
[0073]
色谱柱atlantis t3 column,4.6mm x 150mm,流动相为含有0.1v/v%三氟乙酸(tfa)的甲醇,流速为1ml/min,柱温40℃,uv检测器,检测波长254nm,检测时长为15min。
[0074]
实施例2嘌呤核苷及其类似物的酶催化
[0075]
在2mm磷酸缓冲液(ph 7.5)配制1ml反应体系,其中包括2mm胸苷或尿苷,以及1mm嘌呤或嘌呤类似物不同重量菌泥制备的pynp酶液和不同重量菌泥制备的pnp酶液,60℃反应18h。反应结束后,加入1ml dmso,送hplc检测,实验结果参见表1。结果显示,腺嘌呤和嘌呤类似物反应转化率均高于79%,其中在2,6-二氨基嘌呤核苷和2,6-二氨基嘌呤-2'-脱氧核苷的合成中,2,6-二氨基嘌呤的转化率可达96%。
[0076]
表1.嘌呤核苷及其类似物的酶催化
[0077][0078]
实施例3提高底物浓度对嘌呤核苷及其类似物酶催化的影响
[0079]
在2mm磷酸缓冲液(ph 7.5)配制1ml反应体系,其中包括4mm胸苷或尿苷,以及1mm嘌呤或嘌呤类似物,不同重量菌泥制备的pynp酶液和不同重量菌泥制备的pnp酶液,70℃反应2h。反应结束后,加入1ml dmso,送hplc检测,实验结果参见表2。结果显示,提高胸苷的底物浓度并缩短时间至2h,腺嘌呤和嘌呤类似物反应转化率仍有提高,均高于90%。
[0080]
表2.酶量对嘌呤核苷及其类似物酶催化的影响
[0081][0082]
实施例4 2'-脱氧腺苷合成反应酶量的优化
[0083]
在2mm磷酸缓冲液(ph 7.5)配制1ml反应体系,其中包括400mm胸苷,200mm腺嘌呤,9.7~48.4mg菌泥制备的pynp酶液和2.7~13.5mg菌泥制备的pnp酶液,60℃反应16h。反应结束后,加入1ml dmso,送hplc检测,实验结果参见表3。结果显示,当使用较低酶量时,嘌呤转化率仍可维持90%以上。例如,使用9.7mg菌泥制备的pynp酶液和2.7mg菌泥制备的pnp酶液时,转化率为93.17%。
[0084]
表3. 2'-脱氧腺苷合成反应酶量的优化
[0085][0086][0087]
实施例5 2'-脱氧腺苷合成的放大反应
[0088]
在2mm磷酸缓冲液(ph 7.5)配制50ml反应体系,其中包括400mm胸苷(thymidine),200mm腺嘌呤(adenine),484.0mg菌泥制备的pynp酶液和135.0mg菌泥制备的pnp酶液,60℃反应16h,生成胸腺嘧啶(thymine)和2'-脱氧腺苷(2'-deoxyadenosine)。反应结束后,取1ml反应液加入等体积的dmso溶解,稀释20倍后送hplc检测,如图3所示,胸苷转化率为39.20%,嘌呤转化率为94.72%,根据图1所示的标准曲线,计算2'-脱氧腺苷(2'-deoxyadenosine)产量为51.1g/l。
[0089]
实施例6补加酶量对2'-脱氧腺苷合成放大反应的影响
[0090]
在进行实施例5后,补加1.35g腺嘌呤和pnp菌泥135.0mg制备的酶液,继续反应24h。反应结束后,取1ml反应液加入等体积的dmso溶解,稀释20倍后送hplc检测,如图4所示,胸苷转化率为74.97%,嘌呤转化率为81.30%,根据图1所示的标准曲线,计算2'-脱氧腺苷产量为68.3g/l。
[0091]
实施例7 2'-脱氧鸟苷的酶催化反应
[0092]
1.配制浓度为1m的鸟嘌呤用naoh溶解,向1ml 2mm磷酸缓冲液(ph 7.5)的反应体系种加入含120mm的胸苷,40mm的鸟嘌呤,58mg菌泥制备的pynp酶液和120mg菌泥制备的pnp酶液,60℃反应16h后取样加入等体积的dmso溶解,稀释20倍,送hplc检测,胸苷转化率为37.77%,嘌呤转化率为86.42%,根据图2所示的标准曲线,计算2'-脱氧鸟苷最高产量为9.8g/l。
[0093]
2.配制浓度为1m的鸟嘌呤用naoh溶解,向1ml 2mm磷酸缓冲液(ph 7.5)的反应体
系种加入含240mm的胸苷,80mm的鸟嘌呤,58mg菌泥制备的pynp酶液和120mg菌泥制备的pnp酶液,60℃反应16h后取样加入等体积的dmso溶解,稀释20倍,送hplc检测,胸苷转化率为31.79%,嘌呤转化率为77.07%,根据图2所示的标准曲线,计算2'-脱氧鸟苷最高产量为17.5g/l。
[0094]
上述实验结果参见表4。
[0095]
表4. 2'-脱氧鸟苷的催化反应
[0096][0097][0098]
实施例8 2,6-二氨基嘌呤核苷合成的反应
[0099]
在2mm磷酸缓冲液(ph 7.5)配制10ml反应体系,其中包括320mm尿苷,200mm2,6-二氨基嘌呤,195.4mg菌泥制备的pynp酶液和150.1mg菌泥制备的pnp酶液,60℃反应16h。反应结束后,取1ml反应液加入等体积的dmso溶解,稀释20倍后送hplc检测,尿苷转化率为54.92%,嘌呤转化率为96.18%,2,6-二氨基嘌呤核苷产量为54.3g/l。
[0100]
实施例9 2,6-二氨基嘌呤-2'-脱氧核苷合成的反应
[0101]
在2mm磷酸缓冲液(ph 7.5)配制10ml反应体系,其中包括400mm 2'-脱氧尿苷,200mm 2,6-二氨基嘌呤,230.0mg菌泥制备的tp酶液和75.0mg菌泥制备的pnp酶液,50℃反应16h。反应结束后,取1ml反应液加入等体积的dmso溶解,稀释20倍后送hplc检测,2'-脱氧尿苷转化率为43.89%,嘌呤转化率为97.75%,2,6-二氨基嘌呤-2'-脱氧核苷产量为59.6g/l。
[0102]
实施例10 6-o-甲基-鸟苷合成的酶催化反应
[0103]
在2mm磷酸缓冲液(ph 7.5)配制10ml反应体系,其中包括320mm尿苷,200mm 6-o-甲基鸟嘌呤,195.4mg菌泥制备的pynp酶液和165.0mg菌泥制备的pnp酶液,60℃反应24h。反应结束后,取1ml反应液加入等体积的dmso溶解,稀释20倍后送hplc检测,尿苷转化率为51.27%,嘌呤转化率为98.67%,6-o-甲基鸟苷产量为58.6g/l。
[0104]
从以上的描述中,可以看出,本发明上述的实施例实现了如下技术效果:利用上述酶催化方法,能够在较短的催化时间内,以底物碱基和底物核苷为底物,合成嘌呤核苷类产物,并能够放大生产,在较短的反应时间内,高效合成2'-脱氧腺苷,2'-脱氧鸟苷,2,6-二氨基嘌呤核苷,2,6-二氨基嘌呤-2'-脱氧核苷和6-o-甲基-鸟苷,产量分别可达68.3g/l,17.5g/l,54.3g/l,59.6g/l和58.6g/l。
[0105]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1