一种用于检测抑制肝癌血管生成中的ETV4表达量的试剂盒
一种用于检测抑制肝癌血管生成中的etv4表达量的试剂盒
技术领域
1.本发明涉及医学诊断辅助治疗领域,具体是一种用于检测抑制肝癌血管生 成中的etv4表达量的试剂盒。
背景技术:
2.肝细胞癌(hepatocellular carcinoma,hcc)是我国高发恶性肿瘤之一, 发病率占全球近50%,70%~80%的患者首诊即是晚期,是我国第三大癌症死因。 肿瘤新生血管的生成是肝癌进展和预后不良的主要原因之一。监控新生血管生 成是防止肝癌进展和中晚期肝癌治疗的有效手段。尽管目前一些临床用药靶向 新生血管生成,但疗效并不理想,不能够辅助诊断肝癌和治疗抗血管生成,现 提出一种用于检测抑制肝癌血管生成中的etv4表达量的试剂盒。
技术实现要素:
3.本发明的目的在于提供一种用于检测抑制肝癌血管生成中的etv4表达量的 试剂盒,通过etv4基因在肝癌组织中呈现高表达,且抑制etv4基因表达能明 显抑制hcc的血管生成。hcc为富于血管的实体瘤,血管生成对肿瘤的生长、侵 袭和转移都有决定性的作用。因此,在hcc治疗中,抑制etv4有望减弱hcc的 血管生成,达到辅助治疗中晚期hcc的作用。
4.本发明的目的可以通过以下技术方案实现:
5.1、一种用于检测抑制肝癌血管生成中的etv4表达量的试剂盒,试剂盒包 括用于检测etv4表达量的qpcr试剂以及检测抑制肝癌血管生成的cd31抗体。
6.进一步的,所述qpcr试剂是etv4基因表达的引物(5
’ꢀ‑
ccctgagaaatttgaaggagac-3’,5
’‑
gtccaggcaatgaaatgggca-3’),即rna 提取及逆转录试剂,抑制etv4表达量的shrna序列(5
’ꢀ‑
gctccgatactattatgagaa-3’)。
7.进一步的,所述抑制etv4表达在实验中的应用包括:
8.(1)、采用慢病毒转染细胞的实验方法抑制etv4表达;
9.(2)、体内实验检测抑制etv4表达后对肿瘤微环境血管生成能力的影响;
10.(3)、体外实验检测抑制etv4表达后对肿瘤微环境血管生成能力的影响。 进一步的,所述抑制etv4表达在实验中的应用中(1)的实验步骤包括:
11.s1:取处于对数生长期的细胞接种到6孔板培养板里,细胞密度为5
×
104个/ml,37℃培养16-24h,至细胞汇合度为20-30%。
12.s2:根据病毒滴度,向6孔板的培养基中分别加入对应量的含敲低基因序 列及相应对照序列的慢病毒载体,并加入相应的感染增强液,混匀后于30-40℃ 培养箱静置培养。
13.s3:培养12-16h后更换为完全培养基,继续培养。
14.s4:慢病毒感染后30-50h,更换为含有嘌呤霉素(根据实验细胞选择对应 的浓度)的完全培养基筛选稳定细胞株,之后细胞每2d更换一次培养基,持续 10-20d。
15.s5:稳定转染10-20d后,提取稳定转染细胞株的总rna,检测目的基因的 表达水
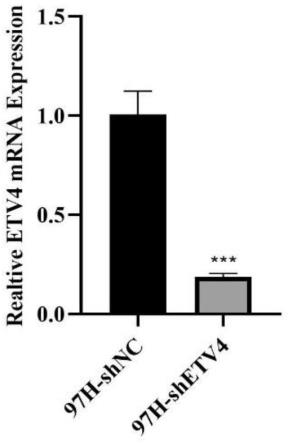
平,etv4shrna使肝癌细胞系mhcc-97h中etv4表达的表达水平下降至 20%,etv4shrna具有明显的抑制效果。
16.进一步的,所述抑制etv4表达在实验中的应用中(2)的实验步骤包括:
17.s1:选取2w龄的balb/c-nu实验品,在spf级动物房中继续饲养4w。
18.s2:将6w龄的实验品分为2组,经实验品静脉分别注射稳定转染的97h-shnc 和97h-shetv4细胞。
19.s3:30d后,使用实验品成像仪获取静脉注射后的肝转移瘤和肺转移瘤的荧 光图像,
20.s4:取出实验品内的转移性成瘤组织,制作石蜡切片,并进行免疫组化, 检测内皮细胞标记cd31表达,与对照组相比,etv4表达下降至20%后,血管内 皮细胞阳性标志分子cd31明显减少,肿瘤组织内形成的微血管数目和密度明显 降低,说明敲低etv4的表达对肿瘤微环境血管生成能力的影响。
21.进一步的,所述抑制etv4表达在实验中的应用中(3)的实验步骤包括:
22.s1:将稳定转染的shetv4细胞及其对应的shnc细胞培养至50%-60%汇合度 后,更换新鲜的完全培养基并培养48h。
23.s2:收集上清培养基,800-1500rpm离心5-15min,上清液经过0.22μm过 滤器过滤,获得条件培养基。
24.s3:将huvec细胞在条件培养基中培养12h。
25.s4:向预冷的96孔板中加入基质胶cd31抗体,50μl/孔,确保均匀,于 37℃培养箱中放置待凝固。
26.s5:将共培养后的huvec细胞以1-2
×
105个/ml浓度重新悬浮在对应的条件 培养基中,取100μl铺在基质胶cd31抗体表面,于37℃培养箱中培养。
27.s6:12h内观察huvec成管形态、成管数量及密度,用imagej软件分析, 统计细胞的成管长度、分支数及节点等数据,与对照组细胞(97h-shnc)相比, 敲低etv4表达的hcc细胞(97h-shetv4)与血管内皮细胞(huvec)细胞共培 养检测血管形成实验,etv4表达下降至20%后,内皮细胞的血管成管长度和数 量显著降低。
28.本发明的有益效果:
29.1、本发明etv4试剂盒通过利用shrna干扰方法敲低hcc细胞的etv4的表 达水平,提升hcc抗血管治疗的疗效;
30.2、本发明etv4试剂盒在hcc中,etv4高表达的患者预后不良,结合etv4 的高表达辅助预测肝癌预后,评估肝癌患者治疗过程中与血管抑制类药物联合 用药的方案,整个评估流程简便易行;
31.3、本发明etv4试剂盒etv4基因在肝癌组织中呈现高表达,且抑制etv4 基因表达能明显抑制hcc的血管生成,hcc为富于血管的实体瘤,血管生成对肿 瘤的生长、侵袭和转移都有决定性的作用。因此,在hcc治疗中,抑制etv4有 望减弱hcc的血管生成,达到辅助治疗中晚期hcc的作用。
附图说明
32.下面结合附图对本发明作进一步的说明。
33.图1是本发明shrna敲低etv4表达的效率的检测;
34.图2是本发明shrna敲低etv4表达瘤体内新生血管的形成数目和密度;
35.图3是本发明敲低etv4表达的与血管内皮细胞形成实验。
具体实施方式
36.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清 楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是 全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造 性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
37.一种用于检测抑制肝癌血管生成中的etv4表达量的试剂盒,etv4表达量的 检测试剂为qpcr试剂,qpcr试剂是etv4基因表达的引物(5
’ꢀ‑
ccctgagaaatttgaaggagac-3’,5
’‑
gtccaggcaatgaaatgggca-3’),即rna 提取及逆转录试剂,检测抑制肝癌血管生成的试剂为cd31抗体,抑制etv4表 达量的shrna序列(5
’‑
gctccgatactattatgagaa-3’)。
38.抑制etv4表达在实验中的应用:
39.1、采用慢病毒转染细胞的实验方法抑制etv4表达,实验步骤包括:
40.s1:取处于对数生长期的细胞接种到6孔板培养板里,细胞密度为5
×
104个/ml,37℃培养16-24h,至细胞汇合度为20-30%;
41.s2:根据病毒滴度,向6孔板的培养基中分别加入对应量的含敲低基因序 列及相应对照序列的慢病毒载体,并加入相应的感染增强液,混匀后于30-40℃ 培养箱静置培养;
42.s3:培养12-16h后更换为完全培养基,继续培养;
43.s4:慢病毒感染后30-50h,更换为含有嘌呤霉素(根据实验细胞选择对应 的浓度)的完全培养基筛选稳定细胞株,之后细胞每2d更换一次培养基,持续 10-20d;
44.s5:稳定转染10-20d后,提取稳定转染细胞株的总rna,检测目的基因的 表达水平,检测结果如图1所示,etv4shrna使肝癌细胞系mhcc-97h中etv4 表达的表达水平下降至20%,etv4shrna具有明显的抑制效果。
45.2、体内实验检测抑制etv4表达后对肿瘤微环境血管生成能力的影响,实 验步骤如下:
46.s1:选取2w龄的balb/c-nu裸鼠,在spf级动物房中继续饲养4w;
47.s2:将6w龄的裸鼠分为2组,经裸鼠的尾静脉分别注射稳定转染的97h-shnc 和97h-shetv4细胞,细胞接种量2
×
106个/200μl/只;
48.s3:30d后,使用活体动物成像仪获取尾静脉注射后的肝转移瘤和肺转移瘤 的荧光图像;
49.s4:对裸鼠安乐死,取出裸鼠体内转移性成瘤组织,制作石蜡切片,并进 行免疫组化,检测内皮细胞标记cd31表达,检测结果如图2所示,与对照组相 比,etv4表达下降至20%后,血管内皮细胞阳性标志分子cd31明显减少,肿瘤 组织内形成的微血管数目和密度明显降低,shrna敲低etv4表达的mhcc-97h细 胞97h-shnc和etv4shrna对照序列转染的mhcc-97h细胞97h-shetv4,接种 裸鼠成瘤后,应用组织切片免疫组化方法,以内皮细胞标记cd31表达评估瘤体 内新生血管的数目和密度,说明敲低etv4的表达对体内肿瘤微环境血管生成能 力的影响。
50.3、体外实验检测抑制etv4表达后对肿瘤微环境血管生成能力的影响,实 验步骤包括:
51.s1:将稳定转染的shetv4细胞及其对应的shnc细胞培养至50%-60%汇合度 后,更换新鲜的完全培养基并培养48h;
52.s2:收集上清培养基,800-1500rpm离心5-15min,上清液经过0.22μm过 滤器过滤,获得条件培养基;
53.s3:将huvec细胞在条件培养基中培养12h;
54.s4:向预冷的96孔板中加入基质胶cd31抗体,50μl/孔,确保均匀,于 37℃培养箱中放置待凝固;
55.s5:将共培养后的huvec细胞以1-2
×
105个/ml浓度重新悬浮在对应的条件 培养基中,取100μl铺在基质胶cd31抗体表面,于37℃培养箱中培养;
56.s6:12h内观察huvec成管形态、成管数量及密度,用imagej软件分析, 统计细胞的成管长度、分支数及节点等数据,检测结果如图3所示,与对照组 细胞(97h-shnc)相比,敲低etv4表达的hcc细胞(97h-shetv4)与血管内皮 细胞(huvec)细胞共培养检测血管形成实验,发现etv4表达下降至20%后,内 皮细胞的血管成管长度和数量显著降低。
57.通过抑制etv4表达在实验中的应用,能够发现用于敲低etv4表达的shrna 能够有效地降低hcc细胞中etv4的表达水平,而etv4的表达水平下降后,明 显降低了肝癌组织中新生血管的生成。因此,在hcc抗血管治疗中敲低etv4的 表达起到辅助疗效的作用。
58.在本说明书的描述中,参考术语“一个实施例”、“示例”、“具体示例
”ꢀ
等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含 于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表 述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或 者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
59.以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业 的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中 描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明 还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1