靶向人LILRB4的纳米抗体及其应用的制作方法
本发明属于抗体工程领域,具体涉及一种用于诊断或治疗肿瘤的治疗性单域抗体,特别是涉及一种靶向lilrb4的纳米抗体、其衍生蛋白以及用于制备药物的用途。
背景技术:
1、纳米抗体是目前最小的抗体分子,最初由比利时科学家hamers在骆驼血液中发现,它是工程化抗体产品中备受关注的一类。纳米抗体主要优点:一是体积是普通抗体的1/10,因为体积小,其在动物组织体内的穿透力强,如,可以通过人体的脑组织,可以达到高密度的肿瘤内部,而普通抗体却不能,这使得可以通过纳米抗体来治疗某些肿瘤或脑部疾病;二是抗原特异性好;三是易于基因改造,方便人工改造以获得对抗不同病原的抗体;四是稳定性高,如,纳米抗体在体内不被自然分解的时间比普通抗体长(意味着药效时间更持久),纳米抗体甚至能从人胃中通过而保持有效性。
2、lilrb4(又被称作ilt3,lir5,cd85k)是白细胞免疫球蛋白样受体(lilrs/lirs)的成员,是一种在抗原呈递细胞(apc)上发现的免疫调节性跨膜蛋白。lilrb4抑制apc活化并通过t抑制细胞诱导免疫耐受性。它已被证明通过诱导t细胞无反应性和cd8+t抑制细胞的分化来调节免疫反应,并且可能对癌症建立免疫耐受发挥作用。其主要在耐受性树突细胞(dc)、骨髓源性抑制细胞和m2巨噬细胞中表达,少量表达在浆细胞表面,并不在造血前体细胞或者干细胞表面表达。lilrb4是单核细胞急性髓系白血病(monocytic aml)的标志分子,其在monocytic aml细胞表面的高度表达。
3、目前有2款靶向lilrb4的抗体药物处于临床研究阶段,由ngmbiopharmaceuticals开发的ngm831目前处于临床一期,适应症为胰腺癌、乳腺癌、胃癌、非小细胞肺癌、子宫颈癌、宫颈内癌、头颈部鳞状细胞癌、膀胱尿路上皮癌、结直肠癌、食道癌、卵巢癌、肾细胞癌、前列腺癌、黑色素瘤、间皮瘤、胆管癌等;immune-onc therapeutics开发的io-202目前处于临床一期,适应症为急性骨髓性白血病、骨髓单核细胞白血病等。
技术实现思路
1、现有技术中的scfv、fab或全igg类抗lilrb4抗体分子,结构复杂、分子较大,虽然能将活性分子连接到lilrb4上,但影响活性分子的功能、方法复杂、负载效率也较低;纳米抗体分子较小、易于操作,但人源化程度低、亲和力不高,延长半衰期的性能有待进一步提高。
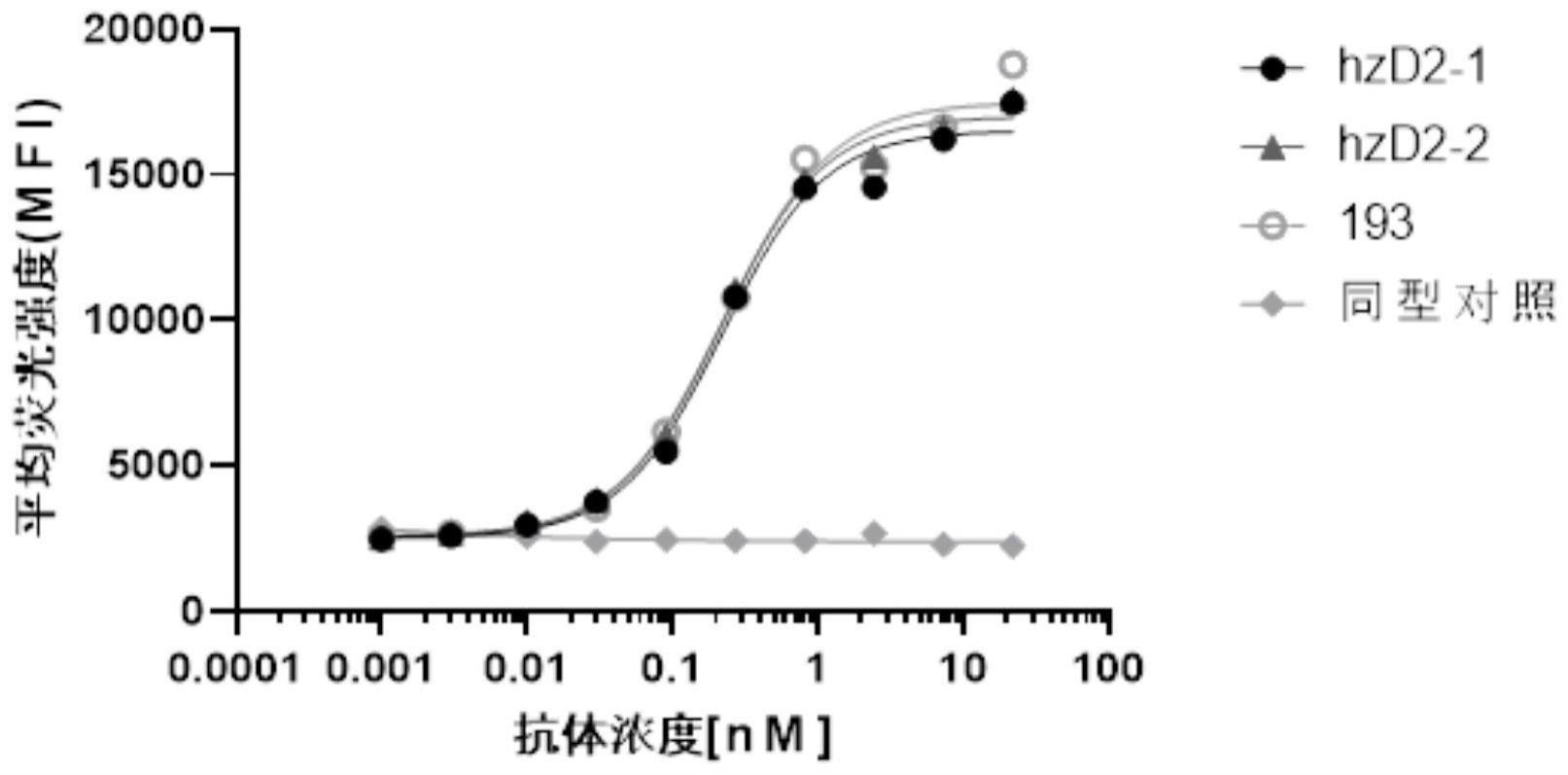
2、针对上述现有技术的不足,本发明提供一系列抗人lilrb4纳米抗体序列及制备方案。提供的抗lilrb4纳米抗体能高亲和力结合人lilrb4,并在细胞学模型上可以明确观察到对t细胞的激活作用,从而对肿瘤具有潜在的治疗价值。
3、第一方面,本发明提供一种抗lilrb4的纳米抗体,根据本发明的实施例,所述纳米抗体能够特异性结合lilrb4,且所述纳米抗体中的vhh链的互补决定区cdr为选自下组的一种或多种:
4、(1)seq id no:16所示的cdr1,seq id no:17所示的cdr2,和seq id no:18所示的cdr3;
5、(2)seq id no:19所示的cdr1,seq id no:20所示的cdr2,和seq id no:21所示的cdr3;
6、(3)seq id no:22所示的cdr1,seq id no:23所示的cdr2,和seq id no:24所示的cdr3;
7、(4)seq id no:25所示的cdr1,seq id no:26所示的cdr2,和seq id no:27所示的cdr3;
8、(5)seq id no:28所示的cdr1,seq id no:29所示的cdr2,和seq id no:30所示的cdr3;
9、(6)seq id no:25所示的cdr1,seq id no:26所示的cdr2,和seq id no:31所示的cdr3;
10、(7)seq id no:32所示的cdr1,seq id no:33所示的cdr2,和seq id no:34所示的cdr3;
11、(8)seq id no:35所示的cdr1,seq id no:36所示的cdr2,和seq id no:37所示的cdr3。
12、进一步,在本发明的一些实施方案中,上述纳米抗体是人源化的vhh或骆驼源化的vh。
13、进一步,在本发明的一些实施方案中,上述纳米抗体具有如seq id no:3、4、5、6、7、8、9、10、11、12、14、15任一项所示的氨基酸序列。
14、第二方面,本发明提供一种融合蛋白,根据本发明的实施例,其包括能够特异性结合lilrb4的功能结构域,所述功能结构域由上述任一项所述的抗lilrb4的纳米抗体构成。
15、本发明提供的纳米抗体可以与其他的任意蛋白或物质融合,以实现不同的目的,例如与荧光蛋白、酶或放射性元等结合以实现易于检测的目的,再如与治疗lilrb4介导相关疾病的药物分子融合以实现更佳的治疗目的。与该纳米抗体融合的蛋白类型,本领域技术人员可以根据实际需要或目的合理选择,无论融合何种类型的物质融合,其也在本发明的范围内。
16、第三方面,本发明提供一种抗lilrb4的抗体,根据本发明的实施例,所述抗体为传统抗体或其功能性片段,所述抗体的重链可变区由前述任一项所述的抗lilrb4的纳米抗体构成;
17、进一步,上述功能性片段为所述传统抗体的fab、fab’、(fab’)2、fv、scfv或sdfv结构。
18、传统抗体在结构上由两条相同的重链和两条相同的轻链组成,轻链具有轻链可变区(vl)和轻链恒定区(cl);重链具有重链可变区(vh)和重链恒定区(ch1,ch2,ch3和/或ch4)。在本发明公开了具有能够特异性结合lilrb4的纳米抗体的结构前提下,本领域技术人员容易想到利用本发明的纳米抗体对传统抗体以改造,例如将本发明纳米抗体的cdr区结构应用到传统抗体上,以获得可以特异性结合lilrb4的传统抗体,这类传统体也是属于本发明的保护范围;进一步地,基于传统抗体的结构,其部分结构例如fab、fab’、(fab’)2、fv、scfv或sdfv结构等也是具有lilrb4结合特异性的,这也是属于本发明的保护范围。
19、第四方面,本发明提供了一种治疗疾病的组合物,其包括如上任一项所述的抗lilrb4的纳米抗体、如上所述的融合蛋白或如上所述的抗体,以及药学上可接受的辅料。
20、上述药学上可接受的辅料是指药学领域的药用辅料,例如:稀释剂、填充剂、粘合剂、湿润剂、吸收促进剂、表面活性剂、崩解剂、吸附载体、润滑剂等。另外还可以加入其他辅料如香味剂、甜味剂等。即所述的辅料为稀释剂、填充剂、粘合剂、湿润剂、吸收促进剂、表面活性剂、崩解剂、吸附载体、润滑剂、香味剂、甜味剂中的一种或两种以上。
21、本发明所提供的药物的剂型并没有严格的限制,可根据药剂领域的现有方法制备成各种剂型,通过口服、鼻吸、直肠、肠胃外或经皮给药等方式施用于需要治疗的患者。
22、第五方面,本发明提供一种分离的核酸分子,其编码如上任一项所述的单域抗体。
23、基于本发明公开的内容,本领域技术人员通过本领域常规技术容易获得编码上述纳米抗体以及融合蛋白的多核苷酸分子,并基于密码子的简并性,该多核酸分子是多变的,其具体的碱基序列存在多种可能性,基于此,无论其多核酸分子如何变化,只要其能够编码本发明的单域抗体或融合蛋白即属于本发明的保护范围。
24、第六方面,本发明提供含有如上所述的核酸分子的载体。
25、第七方面,本发明提供含有如上所述的载体的重组细胞。
26、第八方面,本发明提供制备如上任一项所述的纳米抗体的方法,其包括:培养如上所述的重组细胞,从培养产物中分离纯化获得所述纳米抗体。
27、需要说明的是,制备本发明的纳米抗体、融合蛋白和抗体可以通过化学合成的方法,也可以是通过基因工程技术实现,或者是其他的方法,无论以何种方法制备本发明前述的纳米抗体、融合蛋白或抗体,其都是属于本发明的保护范围。
28、第九方面,本发明提供一种激活t细胞的方法,包括使t细胞与如上任一项所述的抗lilrb4纳米抗体、如上所述的融合蛋白、如上所述的抗体、如上所述的组合物、如上所述的核酸分子、如上所述的载体、或如上所述的重组细胞接触。
29、任选地,所述接触包括在癌细胞存在下。
30、lilrb4在单核细胞、巨噬细胞和树突细胞上表达,可以以细胞自主的方式抑制先天免疫,并通过间接机制抑制t细胞活化。lilrb4是单核细胞性急性髓细胞白血病(aml)的特异性标记,包括难治性和复发性疾病。已表明lilrb4支持肿瘤细胞浸润到组织中,并通过涉及aml细胞中apoe、lilrb4、shp-2、upar和arg1的信号通路抑制t细胞活性(deng m.etah,nature(2018)562:605-09)。
31、第十方面,提供了本发明如上任一项所述的抗lilrb4纳米抗体、如上所述的融合蛋白、如上所述的抗体、如上所述的组合物、如上所述的核酸分子、如上所述的载体、或如上所述的重组细胞的用途,用于在制备由人lilrb4蛋白介导的相关疾病的药物中的用途。
32、本发明的抗体可以用于治疗以lilrb4为靶点中和lilrb4进而实现预防、治疗和/或改善疾病的效果,该类疾病包括但不限于肿瘤。
33、为更好理解本发明,首先定义一些术语。其他定义则贯穿具体实施方式部分而列出。
34、一般,抗体的抗原结合特性可由位于重链可变区的3个特定的区域来描述,称为可变区域(cdr),将该段间隔成4个框架区域(fr),4个fr的氨基酸序列相对比较保守,不直接参与结合反应。这些cdr形成环状结构,通过其间的fr形成的β折叠在空间结构上相互靠近,重链上的cdr和相应轻链上的cdr构成了抗体的抗原结合位点。可以通过比较同类型的抗体的氨基酸序列来确定是哪些氨基酸构成了fr或cdr区域。
35、本发明不仅包括完整的抗体,还包括具有免疫活性的抗体的片段或抗体与其他序列形成的融合蛋白。因此,本发明还包括所述抗体的片段、衍生物和类似物。
36、“嵌合抗体”是指其中免疫球蛋白分子的氨基酸序列源于两个或更多个物种的抗体。通常,轻链与重链两者的可变区均对应于抗体的源于一个哺乳动物物种(例如小鼠、大鼠、兔等)的具有所需特异性、亲和力和能力的可变区,而恒定区与抗体中源于另一物种(通常是人)的序列同源以避免在那个物种中引发免疫应答。
37、“纳米抗体”通常如在wo 2008/020079或wo 2009/138519中所定义,且因而在一个具体的方面通常表示vhh、人源化的vhh或骆驼源化的vh(诸如骆驼源化的人vh),或通常表示序列优化的vhh(例如为了化学稳定性和/或溶解度、与已知人框架区的最大重叠和最大表达而优化)。“纳米抗体”用基因工程方法获得,主要有3类,第一类是从骆驼科动物hcab获得的重链可变区,为单一的折叠单元,保留了完整的抗原结合活性,是最小的天然抗体片段。第二类是从鲨鱼等软骨鱼ignar获得的重链可变区,用vnar表示。第三类是从人源或鼠源单抗获得的重链或轻链可变区,保留了抗原结合活性,但亲和性和可溶性大为下降。
38、“fc区”或“fc”是指免疫球蛋白重链的c端区,其含有铰链区的至少一部分、ch2结构域和ch3结构域,其介导免疫球蛋白与宿主组织或因子的结合,包括与位于免疫系统的各种细胞(例如,效应细胞)上的fc受体结合或与经典补体系统的第一组分(例如c1q)结合,包括天然序列fc区和变异fc区。通常,人igg重链fc区为自其cys226或pro230位置的氨基酸残基至羧基末端的区段,但其边界可能有变化。fc区的c-末端赖氨酸(残基447,依照eu编号系统)可以存在或可以不存在。fc还可以指隔离的这一区域,或在包含fc的蛋白多肽的情况下,例如“包含fc区的结合蛋白”,还称为“fc融合蛋白”(例如,抗体或免疫粘合素)。本发明的抗体中天然序列fc区包括人igg1,igg2(igg2a,igg2b),igg3和igg4。在igg、iga和igd抗体同种型中,fc区包含抗体的两条重链的每一条的ch2和ch3恒定结构域;igm和igefc区包含在每条多肽链中的三个重链恒定结构域(ch结构域2-4)。
39、“特异性结合”是指,两分子间的非随机的结合反应,如抗体和其所针对的抗原之间的反应。术语“免疫结合”是指发生在抗体分子和抗原(对于该抗原而言抗体为特异性的)之间的特异性结合反应。免疫结合相互作用的强度或亲和力可以相互作用的平衡解离常数(kd)表示,其中kd值越小,表示亲和力越高。两分子间的的免疫结合性质可使用本领域中公知的方法定量。一种方法涉及测量抗原结合位点/抗原复合物形成和解离的速度。指特定抗体-抗原相互作用的“结合速率常数”(ka或kon)和“解离速率常数”(kd或koff)两者都可通过浓度及缔合和解离的实际速率而计算得出,可用任何有效的方法测量kd、ka和kd值。在优选的实施方案中,用生物发光干涉测量法来测量解离常数。在其它优选的实施方案中,可用表面等离子共振技术(例如biacore)或kinexa来测量解离常数。
40、“载体”是指能够运输与其连接的另一种核酸的核酸分子。一种类型的载体是“质粒”,其是指其中可以连接另外的dna区段的环状双链dna环。另一种类型的载体是病毒载体,其中额外的dna区段可以连接到病毒基因组中。某些载体能够在它们被导入的宿主细胞中自主复制(例如,具有细菌复制起点和游离型哺乳动物载体的细菌载体)。其他载体(例如非附加型哺乳动物载体)可以在导入宿主细胞后整合到宿主细胞的基因组中,并由此与宿主基因组一起复制。此外,某些载体能够指导它们有效连接的基因的表达。
41、“核酸分子”旨在包括dna分子和rna分子。核酸分子可以是单链或双链的,并且可以是cdna。
42、本发明取得了以下有益的技术效果:
43、本发明的抗lilrb4纳米抗体能高亲和力结合人lilrb4,并在细胞学模型上可以明确观察到对t细胞的激活作用,从而对肿瘤具有潜在的治疗价值。
- 还没有人留言评论。精彩留言会获得点赞!