基于mNGS检测CAR-T细胞制品中病原微生物的方法建立及应用与流程
本发明涉及基因检测,具体涉及基于mngs技术检测car-t细胞制品中病原微生物的方法及应用。
背景技术:
1、近年来,car-t细胞疗法发展迅速,在肿瘤免疫治疗领域取得了突破性进展,为临床治疗带来了革命性的影响。目前,国内外已有8款针对血液肿瘤的car-t产品上市。同行业内公司目前使用的产品检测方法主要针对于生产car-t细胞用到的慢病毒或逆转录病毒中间制品进行检测,检测方法主要包括培养法和q-pcr法。获批放行的每批次慢病毒制品检测结果均为阴性,但存在检验周期长、检测范围单一等缺陷。
2、2017年,国家食药监总局(cfda)官网发布《细胞治疗产品研究与评价技术指导原则》,该原则指出:细胞治疗产品的检测机制建议采用中间样品的质量检验和终产品放行检验相结合的方法;产品放行检测的项目和标准可参考国外已上市品种。
3、2020年第四版《中国药典》在《药品微生物检验替代方法验证指导原则》一文指出:在控制药品微生物质量中,微生物实验室出于各种原因,如成本、生产量、快速简便及提高药品质量等需要而采用非药典规定的检验方法(即替代方法)时,应进行替代方法的验证,确认其应用效果优于或等同于药典的方法。
4、宏基因组测序,全称为宏基因组新一代测序技术(metagenomics next-generation sequencing,mngs),是综合分析样本内微生物和宿主的基因物质(dna和rna)的方法。由于其检测范围广、灵敏度高、特异性好等特点,mngs已广泛应用于食品、环保、工农业和医药等诸多领域。如今,mngs被频频用于临床微生物检测服务,应用于多种感染性疾病的诊断、微生物学分析、识别肿瘤相关病毒等多个方面。
5、目前,存在用mngs技术检测各种临床样本的大量报道,但尚无研究机构或企业将mngs技术用于car-t细胞制品的病原微生物检测或产品放行。
技术实现思路
1、本发明的目的在于提出基于mngs技术检测car-t细胞制品中病原微生物的方法及应用,具有快捷、便利、准确、高效的检测效果。
2、本发明的技术方案是这样实现的:
3、本发明提供一种基于mngs技术检测car-t细胞制品中病原微生物的方法,包括:
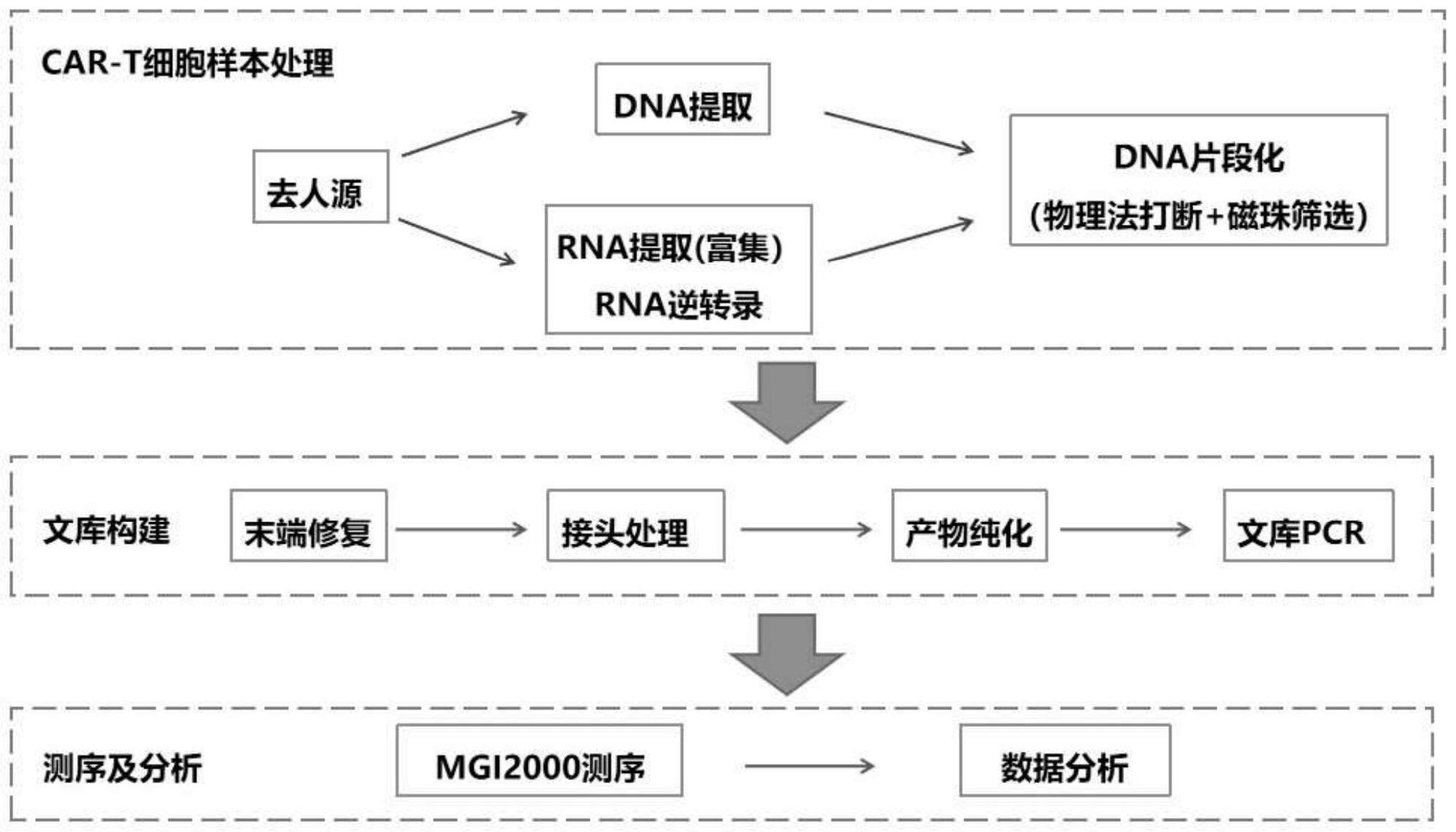
4、s1.基于mngs检测car-t细胞制品的核酸提取:
5、对供试品进行核酸提取,并采用去人源和非去人源样品前处理;
6、对样本分别进行dna和rna提取,将提取后的rna进行逆转录得到cdna;
7、s2.基于mngs检测car-t细胞制品的文库制备:
8、使用dna文库制备试剂盒对所提取的核酸分别建库,其中,核酸包括提取后的dna,以及rna经逆转后得到的cdna;
9、s3.基于mngs检测car-t细胞制品的测序:
10、对所述两种核酸文库进行高通量测序;
11、依据所述样本标签序列和文库标签序列对高通量测序数据进行拆分,得到对应于不同样本的测序读长数据;
12、s4.分析car-t细胞制品测序数据:
13、将测序数据与华大基因病原微生物数据库进行比对分析,得到每个样本的分析结果;
14、若mngs分析结果显示car-t细胞制品未检出病原微生物,且同批次的传统检测方法结果也未检出微生物,则判定该制品满足放行要求。
15、作为本发明的进一步改进,所述供试品包括新鲜car-t细胞制品、冻存car-t细胞制品,所述car-t细胞来源于健康供体或者患者体内的t细胞。
16、作为本发明的进一步改进,所述car-t细胞包括从健康供体或者患者体内获得的t细胞一直到体外培养、刺激、转导和扩增之后的成品car-t细胞。
17、作为本发明的进一步改进,所述car-t细胞包括以cd30为靶点的细胞制品,也包含其他所有靶点的car-t细胞制品。
18、作为本发明的进一步改进,步骤s4中所述比对分析包括:
19、s41.对所述测序数据进行过滤;
20、s42.将过滤后的测序数据与宿主基因组进行比对,去除比对到所述宿主基因组的序列;
21、s43.将未比对到所述宿主基因组的序列与病原微生物基因组进行比对;
22、s44.统计比对到所述病原微生物基因组的序列的检测参数,获得包括特异比对序列数、覆盖率、覆盖深度、背景微生物、相对丰度中的任一项或多项参数在内的检测结果;
23、s45.输出所述检测结果。
24、作为本发明的进一步改进,所述宿主基因组包括人类参考基因组序列和炎黄基因组序列。
25、作为本发明的进一步改进,步骤s43中所述与病原微生物基因组进行比对,基于下列中的至少之一确定所述测序数据中来自于所述病原微生物的测序数据:
26、(1)保留所述测序数据中比对长度占比大于90%的序列;
27、(2)保留所述测序数据中错配碱基数小于5%的序列;
28、(3)保留具有比对特异性的序列,其中所述具有比对特异性的序列为唯一比对序列或多比对结果中满足次优比对分值除以最优比对分值小于0.8的序列,其中所述唯一比对序列是唯一比对到所述病原微生物基因组一个位置上的序列。
29、本发明进一步保护一种上述的方法在病原微生物的检测中的应用。
30、本发明首次提出并应用华大基因mngs系统建立了快速检测car-t细胞制品的病原微生物方法,有利于为细胞治疗行业树立检测新标准。
31、本发明提供了mngs检测car-t细胞制品的相关原理、配套试剂盒、相关参数等等。
32、本发明比较了mngs对新鲜car-t细胞制品和冻存液处理后的冻存制品的检测结果,发现新鲜car-t细胞制品更适用于mngs检测。
33、本发明验证了“去人源处理”能显著提高mngs检测car-t细胞制品病原微生物的理论灵敏度。
34、本发明比较了新型mngs检测与传统检测方法,包括对支原体检测的常规培养法、dna荧光染色法,以及用于外源性病毒因子检测的细胞形态观察法、血吸附试验和红细胞凝集实验,对六个批次细胞制品的病原微生物风险因子的检测结果均显示,两种方法的检测结果均为阴性。
35、本发明建立了一种快速检测car-t细胞制品病原体微生物的高通量测序检测技术。
36、与传统检测方法相比,本发明具有如下有益效果:
37、(1)本发明可通过特殊处理car-t细胞制品提取核酸,通过去人源化处理提高病原微生物的检测灵敏度,以pcr技术进行文库制备,再到上机检测和分析,实现短期内对car-t制品病原微生物的快速检测;
38、(2)通过将mngs分析结果与传统微生物检测结果作对比,发现mngs能同时检测多个样本,能进一步提高检测通量并极大程度地缩短检测时间;此外,基于传统方法检测指标的有限性,mngs技术的检测范围极大,涵盖包括细菌、真菌、病毒、寄生虫在内的近2万种病原微生物。若出现某批次car-t制品质控不合格,通过mngs检测结果能快速判断是何种微生物污染,能对生产环节做出及时调整,而传统检测方法并不具备该特殊优势。
39、(3)本发明提出的mngs检测能有效提高car-t细胞制品的检测精度,能极大地缩短检测时间、提高检测效率,该方法能作为传统方法检测和放行car-t细胞制品的辅助或替代方法,这样不仅能为病人争取更多时间,也能为企业缩减成本。
- 还没有人留言评论。精彩留言会获得点赞!