一种用于保存分离猪胸膜肺炎放线杆菌病料的组方试剂及其应用的制作方法
1.本发明属于病料保存技术领域,涉及一种用于保存分离猪胸膜肺炎放线杆菌病料的组方试剂及其应用。
背景技术:
2.猪胸膜肺炎放线杆菌(app)现在已发现15个血清型,其中有的不具致病性,有的则会导致严重疾病。1、5、9、11和12型通常具有很强毒力,而3、6型较为温和,这种细菌寄生于扁桃体和上呼吸道。病原经飞沫或气雾在短距离内传播,在体外环境只能存活几天。
3.对于app的分离鉴定,目前主要是通过采集典型症状猪只的肺部组织送实验室进行分离。app营养要求高,不容易培养,分离培养过程如果处理不当、培养条件不适合、分离不及时都很难分离到该菌;所以对于实验室来说,送检的病料重复拿来分离app显得尤为重要;但是送检的病料一般都是放于4℃冷藏,12h内应及时进行分离,否则,即使病料中有app感染,也会因保存条件不当,存放时间太长,致使病料中app死亡,所以对于送检的病料保存显得尤为重要。
4.目前对于送检病料的组织保存主要是通过4℃冷藏,对于app分离条件要求较高,对于普通实验室来说首次分离的概率极低,所以很多时候需要对送检的病料进行保存,进行重复分离备用;但是对于app菌株放于4℃冷藏,12h内应及时进行分离,否则,即使病料中有app感染也会死亡,导致没办法分离到所需要的app菌株;本发明发明的组方试剂能有效的保存感染app的肺部组织病料,解决4℃冷藏条件下长期保存病料的同时还能分离到app菌株的问题,提高app的分离率,满足后续对于分离app菌株的相关研究,如药敏试验或者疫苗研究,对于猪场后续对该病的治疗起着至关重要的作用。
5.因此,实验室急需一种用于app送检肺部组织病料的保存方法,提高app的分离率,避免送检病料组织的浪费;满足后续对于分离app菌株的相关研究,如药敏试验或者疫苗研究,保障养猪产业的健康发展。
技术实现要素:
6.本发明的目的就是为了提供一种用于保存分离猪胸膜肺炎放线杆菌病料的组方试剂及其应用,以实现在4℃冰箱条件下保存的送检病料60h还能分离出猪胸膜肺炎放线杆菌,同时对分离出的猪胸膜肺炎放线杆菌的生物学特性和毒力没有影响。
7.本发明的目的可以通过以下技术方案来实现:
8.本发明的技术方案之一提供了一种用于保存分离猪胸膜肺炎放线杆菌病料的组方试剂,包括以下质量浓度的溶质成分:青霉素钠60-80mg/l,丙酸钙25-35mg/l,纳他霉素8-12mg/l,尼克酰胺腺嘌呤二核苷酸16-24mg/l。
9.进一步的,该组方试剂包括以下质量浓度的溶质成分:青霉素钠70mg/l,丙酸钙30mg/l,纳他霉素10mg/l,尼克酰胺腺嘌呤二核苷酸20mg/l。
0.25mpa)20min冷却待用。
30.试验分为对照组和试验组,对照组的组织病料在生物安全柜里用无菌镊子和剪刀,无菌操作取大小约为4cm
×
4cm
×
4cm的肺部组织块,置于100ml广口瓶,然后置于4℃冰箱保存;试验组的病料按照上述方法取组织块,置于100ml广口瓶,然后加入70ml上述配置的组方试剂,最后加入30ml甘油,置于4℃冰箱保存;对照组和试验组分别各设置3个重复。
31.对照组和试验组保藏的组织病料分别于保藏的6h、12h、24h、36h、48h和60h进行app菌株分离每个时间段各有3个肺部组织块,取完样之后组织块进行处理,不再放入4℃保存。
32.分离方法为:在生物安全柜中用无菌镊子从广口瓶中取出保存的肺部组织,用无菌剪刀剪个1cm的切口,用火焰灭菌的接种针在切口里面挑取病猪肺脏,划线接种于巧克力平板培养板,放置于37℃恒温箱中培养24-48h后,观察菌落形态并挑取可疑菌落进行革兰氏染色镜检。并将可疑单菌落接种于加有氨苄青霉素的tsa培养基进行纯化培养,直至菌落形态大小均一、色泽一致为止。并对纯化好的菌株进行16s rrna pcr扩增鉴定,并对分离到的app菌株进行生化试验、和动物试验;证明该病料组织保存试剂对分离到的菌株为app菌株,同时证明组织保存试剂对分离到的菌株为app菌株生物学特性和致病性作用没有影响。
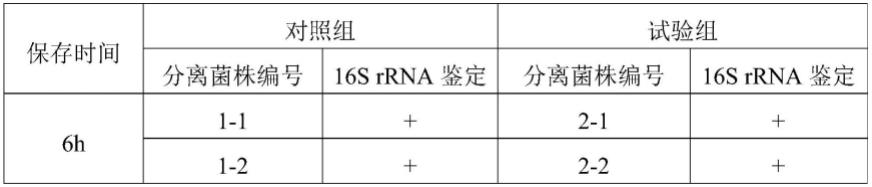
33.16s rrna pcr扩增鉴定根据genbank中胸膜肺炎放线杆菌的16s rrna序列设计1对特异性引物,提取分离纯化好的细菌dna进行pcr扩增,以出现目的扩增片段的确定为分离到的菌株为app菌株;通过对试验组和对照组6h、12h、24h、36h、48h和60h分离纯化到的菌株进行16s rrna扩增鉴定,结果见表1;在6h的时候保存的病料组织对照组分离到了4株,通过16s rrna鉴定有2株为app;试验组分离到了6株,鉴定有5株为app;12h的时候保存的病料组织对照组分离到了2株,通过16s rrna鉴定有1株为app;试验组分离到了4株,鉴定有3株为app;24h的时候保存的病料组织对照组分离到了2株,通过16s rrna鉴定有0株为app;试验组分离到了4株,鉴定有3株为app;48h的时候保存的病料组织对照组分离到了0株;试验组分离到了2株,鉴定有2株为app;60h的时候保存的病料组织对照组分离到了0株;试验组分离到了1株,鉴定有1株为app;说明试验组保存的病料分离app的菌株数量更多,同时保存60h的肺部组织病料还能分离出app菌株,试验组保存的肺部组织病料保存24h就没有分离app阳性菌株,说明试验组的肺部组织保存于本发明的病料组织保护液可以较长时间保存app阳性病料。
34.表1不同组别app菌株分离情况
35.[0036][0037]
注:“+”表示阳性;
“‑”
表示阴性。
[0038]
对试验组分离到的菌株进行生化试验,包括尿素酶接触试验、溶血性试验、过氧化氢试验、卫星现象等,糖发酵反应试验包括:木糖、甘露醇、棉子糖、阿拉伯糖、麦芽糖、蔗糖、果糖和葡萄糖等;试验组分离到的17株,其生化试验结果均一致,结果见表2,结果和app菌株生化实验结果相符,说明试验组保存的病料的组织保护液对app菌株的生化特性没有影响。
[0039]
表2试验组分离到的app菌株生化试验结果
[0040]
[0041][0042]
注:“+”表示阳性;
“‑”
表示阴性。
[0043]
试验组分离的app菌株致病性试验,试验组分离到17株app菌株进行纯培养,每一株菌株分别选取10只8周龄balb/c小鼠,分为对照组和注射组,对照组注射空白培养基,注射组进行腹腔注射aap菌液(浓度为1.5
×
108cfu/ml),攻毒后连续观察10d,计算小鼠死亡情况。结果发现分离到的17株app菌株注射小鼠后,均导致其死亡,死亡率100%
[0044]
以上结果证明本发明组织保护液能较长时间有效的保存app病料组织,使其在冷藏环境下较长时间存活,保存60h还能分离到app菌株,同时对app菌株的生物学特性和致病性没有影响,解决了实验室需要重新取病料进行分离app因为保存时间过长而分离不到的问题,为后期app药敏试验及疫苗的研究提供保障。
[0045]
对比例1:
[0046]
试验分为对照组和试验组,对照组按照实施例1所述配制的组织储存液按照实施例1所述方法储存肺部组织块;试验组取70mg青霉素钠、10mg纳他霉素粉末、20mg nad溶于950ml的纯净水,充分溶解后用磷酸氢二钠调节ph值为7.2,然后用纯净水定容至1l;120℃高压压力为0.2-0.25mpa 20min冷却后作为组织储存液按照实施例1所述方法储存肺部组织块。对照组和试验组分别各设置3个重复。分离方法参照实施例1所述。
[0047]
通过对试验组和对照组6h、12h、24h、36h、48h和60h分离纯化到的菌株进行16s rrna扩增鉴定,结果见表3;在6h的时候保存的病料组织对照组分离到了6株,通过16s rrna鉴定有2株为app;试验组分离到了4株,鉴定有2株为app;12h的时候保存的病料组织对照组分离到了4株,通过16s rrna鉴定有3株为app;试验组分离到了3株,鉴定有1株为app;24h的时候保存的病料组织对照组分离到了4株,通过16s rrna鉴定有3株为app;试验组分离到了2株,鉴定有0株为app;36h的时候对照组和试验组均分到了3株,对照组的3株均为app菌株,但是试验组的3株均不是app菌株;48h的时候对照组和试验组均分到了2株,对照组鉴定有2株为app,试验组为0株;试验组分离到了0株;60h的时候保存的病料组织对照组分离到了0株;试验组分离到了1株,鉴定有1株为app;保存60h的肺部组织病料对照组分离出1株app菌株,试验组保存的肺部组织病料虽然分离到了2株疑似菌株,但是鉴定均不是app菌。说明采用实施例1组方试剂的对照组的肺部组织保存的病料组织分离到的app菌株较多,没有加丙
酸钙的试验组分离的杂菌较多,说明该组织保护液保存的组织可以抑制杂菌的生长,属于必不可少的成分之一。
[0048]
同时对试验组分离出的9株app菌进行毒力验证试验,试验方法参见实施例1中的致病性试验,结果发现分离到的9株app菌株注射小鼠后,均不能导致注射小鼠死亡,死亡率为0%,说明了组分中的丙酸钙直接影响app菌株毒素的分泌。
[0049]
表3不同组别app菌株分离情况
[0050][0051][0052]
对比例2:
[0053]
试验分为对照组和试验组,对照组按照实施例1所述配制的组织储存液按照实施例1所述方法储存肺部组织块;试验组取70mg青霉素钠、30mg丙酸钙、10mg纳他霉素粉末溶于950ml的纯净水,充分溶解后用磷酸氢二钠调节ph值为7.2,然后用纯净水定容至1l;120
℃高压压力为0.2-0.25mpa 20min冷却后作为组织储存液按照实施例1所述方法储存肺部组织块。对照组和试验组分别各设置3个重复。分离方法参照实施例1所述。
[0054]
通过对试验组和对照组6h、12h、24h、36h、48h和60h分离纯化到的菌株进行16s rrna扩增鉴定,结果见表4;试验组于12h后就没有分离到目的菌株;对照组的组织保存60h后还有目的菌株分离说明发明的组织保护液添加nad对于app菌的生长起着重要作用,也证明了nad是本发明组分中必不可少的。
[0055]
表4不同组别app菌株分离情况
[0056][0057][0058]
对比例3:
[0059]
试验分为对照组和试验组,对照组按照实施例1所述配制的组织储存液按照实施例1所述方法储存肺部组织块;试验组取30mg丙酸钙、10mg纳他霉素粉末、20mg nad溶于
950ml的纯净水,充分溶解后用磷酸氢二钠调节ph值为7.2,然后用纯净水定容至1l;120℃高压压力为0.2-0.25mpa 20min冷却后作为组织储存液按照实施例1所述方法储存肺部组织块。对照组和试验组分别各设置3个重复。分离方法参照实施例1所述。
[0060]
通过对试验组和对照组6h、12h、24h、36h、48h和60h分离纯化到的菌株进行16s rrna扩增鉴定,结果见表5;对照组共分离到19株app菌株,试验组分离到26株疑似菌,但是经过鉴定为app菌的只有5株,其它菌株均为杂菌;且试验组分离的杂菌经革兰氏染色均为革兰氏阳性菌;该结果说明本发明组分中添加青霉素可以抑制杂菌生长,尤其是革兰氏阳性菌,是必不可少的组分。
[0061]
表5不同组别app菌株分离情况
[0062]
[0063][0064]
对比例4:
[0065]
试验分为对照组和试验组,对照组按照实施例1所述配制的组织储存液按照实施例1所述方法储存肺部组织块;试验组取30mg丙酸钙、70mg青霉素钠、20mg nad溶于950ml的纯净水,充分溶解后用磷酸氢二钠调节ph值为7.2,然后用纯净水定容至1l;120℃高压压力为0.2-0.25mpa 20min冷却后作为组织储存液按照实施例1所述方法储存肺部组织块。对照组和试验组分别各设置3个重复。分离方法参照实施例1所述。
[0066]
通过对试验组和对照组6h、12h、24h、36h、48h和60h分离纯化到的菌株进行16s rrna扩增鉴定,结果见表6;对照组共分离到19株app菌株,试验组分离到20株疑似菌,但是经过鉴定为app菌的只有5株,其它菌株均为杂菌;且经鉴定均为真菌;该结果说明本发明组分中添加纳他霉素可以抑制真菌生长,是本发明中必不可少的组分。
[0067]
表6不同组别app菌株分离情况
[0068]
[0069][0070]
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1