一种GPX4蛋白降解剂及其制备方法和应用、一种抗肿瘤细胞药物
一种gpx4蛋白降解剂及其制备方法和应用、一种抗肿瘤细胞药物
技术领域
1.本发明涉及药物应用技术领域,特别涉及一种gpx4蛋白降解剂及其制备方法和应用、一种抗肿瘤细胞药物。
背景技术:
2.铁死亡(ferroptosis)是一种细胞程序性死亡,最早可追溯至本世纪初。2012年,dixon课题组发现这种非凋亡形式的细胞死亡呈现铁离子依赖的方式,因此称其为“铁死亡”。
3.谷胱甘肽过氧化物酶4(gpx4)是与铁死亡最相关的过氧化物酶之一,gpx4利用谷胱甘肽(gsh)并将其转化为氧化形式(gssg),同时将脂质过氧化物(l-ooh)还原为醇形式(l-oh)。癌细胞内存在高表达的gpx4以对抗氧化应激反应,gpx4活性下降会引起脂质过氧化物大量蓄积,驱动铁死亡,因此,靶向抑制gpx4令其发生铁死亡已成为一项新的抗肿瘤策略。目前gpx4抑制剂主要为共价抑制剂。常见的gpx4蛋白抑制剂包括:(1s,3r)-rsl3、ml162、ml210和jke-1674等,但均存在靶向性不高,易于脱靶的问题。
4.
技术实现要素:
5.有鉴于此,本发明目的在于提供一种gpx4蛋白降解剂及其制备方法和应用、一种抗肿瘤细胞药物,本发明提供的gpx4蛋白降解剂具有蛋白降解靶向嵌合体(protac)分子结构,能够有效靶向并降解gpx4蛋白,从而诱导肿瘤细胞铁死亡。
6.为了实现上述发明目的,本发明提供以下技术方案:
7.本发明提供了一种gpx4蛋白降解剂,具有式i所示结构:
[0008][0009]
式i中,a1为
[0010]
a2为
[0011]
其中,m=1~20,n=1~20。
[0012]
优选的,具有式i-1~i-15任意一项所示结构:
[0013][0014]
式i-1~i-4中,m=1~20;
[0015][0016][0017]
式i-5~i-8中,n=1~20;
[0018]
[0019][0020]
本发明提供了上述gpx4蛋白降解剂的制备方法,包括以下步骤:
[0021]
①
当a1为时,所述gpx4蛋白降解剂的制备方法包括以下步骤:
[0022]
具有式a所示结构的化合物与具有nh
2-a2结构的化合物进行取代反应,得到具有式b所示结构的化合物;
[0023]
具有式b所示结构的化合物进行脱保护基反应,得到具有式c所示结构的化合物;
[0024]
所述具有式c所示结构的化合物与具有式d所示结构的化合物进行缩合反应,得到gpx4蛋白降解剂;
[0025][0026]
②
当a1为时,所述gpx4蛋白降解剂的制备方法包括以下步骤:
[0027]
具有式e所示结构的化合物与具有f-a2结构的化合物进行取代反应,得到具有式f所示结构的化合物;
[0028]
具有式f所示结构的化合物进行脱保护基反应,得到具有式g所示结构的化合物;
[0029]
具有式g所示结构的化合物与具有式d所示结构的化合物进行缩合反应,得到gpx4蛋白降解剂;
[0030][0031]
③
当a1为时,所述gpx4蛋白降解剂的制备方法包括以下步骤:
[0032]
具有式h所示结构的化合物与具有f-a2结构的化合物进行取代反应,得到具有式i所示结构的化合物;
[0033]
具有式i所示结构的化合物进行脱保护基反应,得到具有式j所示结构的化合物;
[0034]
具有式j所示结构的化合物与具有式k所示结构的化合物进行取代反应,得到具有式l所示结构的化合物;
[0035]
具有式l所示结构的化合物与具有式d所示结构的化合物进行缩合反应,得到gpx4蛋白降解剂;
[0036][0037]
④
当a1为时,所述gpx4蛋白降解剂的制备方法包括以下步骤:
[0038]
具有式m所示结构的化合物与具有f-a2结构的化合物进行取代反应,得到具有式n所示结构的化合物;
[0039][0040]
具有式n所示化合物与具有式d所示结构的化合物进行缩合反应和脱保护基反应,得到gpx4蛋白降解剂。
[0041]
优选的,所述具有式d所示结构化合物的制备方法,包括以下步骤:
[0042]
4-氯-4
’‑
羟基二苯甲酮与溴乙酸叔丁酯进行取代反应,得到具有式d-1所示结构的化合物;
[0043]
在还原剂的作用下,具有式d-1所示结构的化合物进行还原反应,得到具有式d-2所示结构的化合物;
[0044]
具有式d-2所示结构的化合物与草酰氯进行氯代反应,得到具有式d-3所示结构的化合物;
[0045]
具有式d-3所示结构的化合物与哌嗪进行取代反应,得到具有式d-4所示结构的化合物;
[0046]
6-甲基异恶唑-3-羧酸与硝酸钾进行硝化反应,得到具有式d-5所示结构的化合物;
[0047]
具有式d-4所示结构的化合物、具有式d-5所示结构的化合物和草酰氯进行偶联反应,得到具有式d-6所示结构的化合物;
[0048]
具有式d-6所示结构的化合物进行脱保护基反应,得到具有式d所示结构的化合物。
[0049][0050]
优选的,当a2为时,具有nh
2-a2结构的化合物的制备方法,包括以下步骤:
[0051]
具有式v1所示结构的化合物与4-甲基噻唑进行取代反应,得到具有式v2所示结构的化合物;
[0052]
具有式v2所示结构的化合物进行脱保护基反应,得到具有式v3所示结构的化合物;
[0053]
具有式v3所示结构的化合物与具有式w1所示结构的化合物进行缩合反应,得到具有式v4所示结构的化合物;
[0054]
具有式v4所示结构的化合物进行脱保护反应,得到具有式v5所示结构的化合物;
[0055]
具有式v5所示结构的化合物与具有式w2所示结构的化合物进行缩合反应,得到具有式v6所示结构的化合物;
[0056]
具有式v6所示结构的化合物进行脱保护反应,得到具有式v7所示结构的化合物;
[0057][0058]
优选的,所述具有式a所示结构的化合物的制备方法,包括以下步骤:
[0059]
具有式a-1所示结构的化合物与1-boc-哌嗪进行取代反应,得到具有式a-2所示结构的化合物;
[0060][0061]
具有式a-2所示结构的化合物与对甲苯磺酰氯进行取代反应,得到具有式a所示结
构的化合物。
[0062]
优选的,所述具有式e所示结构的化合物的制备方法,包括以下步骤:
[0063]
邻苯二甲酰亚胺与具有式e-1所示结构的化合物进行取代反应,得到具有式e-2所示结构的化合物;
[0064]
具有式e-2所示结构的化合物与1-boc哌嗪进行取代反应,得到具有式e-3所示结构的化合物;
[0065]
具有式e-3所示结构的化合物进行脱保护基反应,得到具有式e-4所示结构的化合物;
[0066]
具有式e-4所示结构的化合物与1-boc-4溴甲基哌啶进行取代反应,得到具有式e-5所示结构的化合物;
[0067]
在水合肼的作用下,具有式e-5所示结构的化合物进行脱酰亚胺基反应,得到具有式e所示结构的化合物;
[0068][0069]
优选的,具有式h所示结构的化合物的制备方法,包括以下步骤:
[0070]
具有式h-1所示结构的化合物与具有式h-2所示结构的化合物进行取代反应,得到具有式h-3所示结构的化合物;
[0071][0072]
具有式h-3所示结构的化合物进行脱cbz保护基反应,得到具有式h所示结构的化合物;
[0073]
所述具有式m所示结构的化合物的制备方法,包括以下步骤:
[0074]
具有式m-1所示结构的化合物与具有式m-2所示结构的化合物进行取代反应和脱保护反应,得到具有式m-3所示结构的化合物;
[0075][0076]
具有式m-3所示结构的化合物与具有式m-4所示结构的化合物进行取代反应,得到具有式m-5所示结构的化合物;
[0077]
[0078]
具有式m-5所示结构的化合物进行脱cbz保护基反应,得到具有式m所示结构的化合物。
[0079]
本发明提供了上述gpx4蛋白降解剂在制备抗肿瘤药物及抗耐药肿瘤药物中的应用。
[0080]
本发明提供了一种抗肿瘤药物,包括药物活性组分和药物辅料;所述药物活性组分为上述gpx4蛋白降解剂。
[0081]
本发明提供了一种gpx4蛋白降解剂,具有式i所示结构。蛋白降解靶向嵌合体(protacs)策略直接诱导靶蛋白降解,protacs具有独特的“事件驱动”作用模式、靶向不可成药蛋白的优势和高效持久的活性。本发明提供的降解剂具有蛋白降解靶向嵌合体(protacs)分子结构,以ml210单元为靶向单元,能够有效结合靶蛋白。a2取代基作为结合e3泛素连接酶复合物的小分子配体,a1取代基作为将两个配体连接起来连接基。因为protac与靶蛋白和e3连接酶需要在空间上形成构象稳定的三元复合物才能发挥降解活性,故protac策略具有可增强药物分子靶点选择性的优势,因此gpx4蛋白降解剂能够特异性识并靶向gpx4蛋白,并将gpx4蛋白有效泛素化,从而诱导肿瘤细胞铁死亡。实施例结果表明,本发明提供的gpx4蛋白降解剂表现出明显的降解活性和体内/外抗肿瘤活性。通过降解gpx4引发细胞内活性氧(ros)大量蓄积,最终导致细胞发生铁死亡。
附图说明
[0082]
图1为gpx4蛋白降解剂在ht1080细胞中作用后对gpx4蛋白的降解作用;
[0083]
图2为dc2的降解活性与浓度和时间的关系;
[0084]
图3为dc2对细胞增殖的抑制作用评估结果;
[0085]
图4为dc2对异种移植人纤维肉瘤(ht1080)组织中gpx4的降解作用与给药时间的关系;
[0086]
图5为多次给药后小鼠肿瘤体积和体重的变化。
具体实施方式
[0087]
本发明提供了一种gpx4蛋白降解剂,具有式i所示结构:
[0088][0089]
式i中,a1为为
[0090]
a2为
[0091]
其中,m=1~20,优选为7~14,更优选为8~12,进一步优选为10~11;
[0092]
n=1~20,优选为2~15,更优选为2~10,进一步优选为4~8。
[0093]
在本发明中,“*”表示连接位点。
[0094]
在本发明中,所述gpx4蛋白降解剂具有式i-1~i-15任意一项所示结构:
[0095][0096]
式i-1~i-4中,m=1~20;
[0097]
[0098][0099]
式i-5~i-8中,n=1~20;
[0100]
[0101][0102]
作为本发明的具体实施例,所述gpx4蛋白降解剂的结构式如表1所示。
[0103]
表1 gpx4蛋白降解剂的结构式
[0104]
[0105]
[0106][0107]
本发明提供了上述gpx4蛋白降解剂的制备方法,包括以下步骤:
[0108]
①
当a1为时,所述gpx4蛋白降解剂的制备方法包括以下步骤:
[0109]
具有式a所示结构的化合物与具有nh
2-a2结构的化合物进行取代反应,得到具有式b所示结构的化合物;
[0110]
具有式b所示结构的化合物进行脱保护基反应,得到具有式c所示结构的化合物;
[0111]
所述具有式c所示结构的化合物与具有式d所示结构的化合物进行缩合反应,得到gpx4蛋白降解剂;
[0112][0113]
在本发明中,所述具有式a所示结构的化合物与具有nh
2-a2结构的化合物进行取代反应,得到具有式b所示结构的化合物。在本发明中,所述具有式a所示结构的化合物的制备方法,包括以下步骤:
[0114]
具有式a-1所示结构的化合物与1-boc-哌嗪进行取代反应,得到具有式a-2所示结构的化合物;
[0115][0116]
在本发明中,所述具有式a-1所示结构的化合物与1-boc-哌嗪的摩尔比优选为1:1。在本发明中,所述取代反应所使用催化剂优选为k2co3和ki。在本发明中,所述取代反应使用的有机溶剂优选为乙腈;所述取代反应的温度优选为回流温度,时间优选为2h。
[0117]
具有式a-2所示结构的化合物与对甲苯磺酰氯进行取代反应,得到具有式a所示结构的化合物。
[0118]
在本发明中,所述具有式a-2所示结构的化合物与对甲苯磺酰氯的摩尔比优选为1:1。在本发明中,所述取代反应的催化剂优选为三乙胺。在本发明中,所述取代反应使用的有机溶剂优选为二氯甲烷;所述取代反应的温度优选为0℃~室温,时间优选为过夜。
[0119]
在本发明中,具有式a所示结构的化合物与具有nh
2-a2结构的化合物进行取代反应。在本发明中,所述具有式a所示结构的化合物与具有nh
2-a2结构的化合物的摩尔比优选为1:1。在本发明中,所述取代反应的催化剂优选为k2co3和ki。在本发明中,所述取代反应使用的有机溶剂优选为乙腈;所述取代反应的温度优选为回流温度,时间优选为2h。
[0120]
在本发明中,具有式b所示结构的化合物进行脱保护基反应,得到具有式c所示结构的化合物。在本发明中,所述脱保护基反应的催化剂优选为三氟乙酸。在本发明中,所述
脱保护基反应的有机溶剂优选为二氯甲烷;所述脱保护基反应的温度优选为室温,时间优选为30min。
[0121]
在本发明中,所述具有式c所示结构的化合物与具有式d所示结构的化合物进行缩合反应,得到gpx4蛋白降解剂。在本发明中,所述具有式d所示结构的化合物的制备方法,优选包括以下步骤:
[0122]
4-氯-4
’‑
羟基二苯甲酮与溴乙酸叔丁酯进行取代反应,得到具有式d-1所示结构的化合物;
[0123]
在还原剂的作用下,具有式d-1所示结构的化合物进行还原反应,得到具有式d-2所示结构的化合物;
[0124]
具有式d-2所示结构的化合物与草酰氯进行氯代反应,得到具有式d-3所示结构的化合物;
[0125]
具有式d-3所示结构的化合物与哌嗪进行取代反应,得到具有式d-4所示结构的化合物;
[0126]
6-甲基异恶唑-3-羧酸与硝酸钾进行硝化反应,得到具有式d-5所示结构的化合物;
[0127]
具有式d-4所示结构的化合物、具有式d-5所示结构的化合物和草酰氯进行偶联反应,得到具有式d-6所示结构的化合物;
[0128]
具有式d-6所示结构的化合物进行脱保护基反应,得到具有式d所示结构的化合物;
[0129][0130]
在本发明中,4-氯-4
’‑
羟基二苯甲酮与溴乙酸叔丁酯进行取代反应,得到具有式d-1所示结构的化合物。在本发明中,所述4-氯-4
’‑
羟基二苯甲酮与溴乙酸叔丁酯的摩尔比优选为1:1.5。在本发明中,所述取代反应的催化剂优选为k2co3。在本发明中,所述取代反应使用的有机溶剂优选为乙腈;所述取代反应的温度优选为85℃,时间优选为2h。
[0131]
本本发明中,在还原剂的作用下,具有式d-1所示结构的化合物进行还原反应,得到具有式d-2所示结构的化合物。在本发明中,所述还原剂优选为硼氢化钠。在本发明中,所述还原剂与具有式d-1所示结构的化合物的摩尔比优选为1:1。在本发明中,所述还原反应使用的有机溶剂优选为四氢呋喃和甲醇。在本发明中,所述还原反应的温度优选为0℃,时间优选为30min。
[0132]
在本发明中,具有式d-2所示结构的化合物与草酰氯进行氯代反应,得到具有式d-3所示结构的化合物。在本发明中,所述具有式d-2所示结构的化合物与草酰氯的摩尔比优选为1:2;在本发明中,所述氯代反应的有机溶剂优选为二氯甲烷和二甲基甲酰胺。在本发明中,所述氯代反应的温度优选为0℃,时间优选为8h。
[0133]
在本发明中,具有式d-3所示结构的化合物与哌嗪进行取代反应,得到具有式d-4
所示结构的化合物。在本发明中,所述具有式d-3所示结构的化合物与哌嗪的摩尔比优选为1:10;在本发明中,所述取代反应使用的有机溶剂优选为乙腈;所述取代反应的温度优选为85℃,更优选为90℃。
[0134]
在本发明中,6-甲基异恶唑-3-羧酸与硝酸钾进行硝化反应,得到具有式d-5所示结构的化合物。在本发明中,所述6-甲基异恶唑-3-羧酸与硝酸钾的摩尔比优选为1:1.5。
[0135]
在本发明中,所述硝化反应优选在硫酸环境下进行,所述硝化反应的温度优选为50℃,时间优选为4h。
[0136]
在本发明中,具有式d-4所示结构的化合物、具有式d-5所示结构的化合物与草酰氯进行偶联反应,得到具有式d-6所示结构的化合物。在本发明中,具有式d-4所示结构的化合物、具有式d-5所示结构的化合物和草酰氯的摩尔比优选为1:1.5。
[0137]
在本发明中,所述偶联反应的催化剂优选为三乙胺;所述偶联反应使用的有机溶剂优选为乙腈;所述偶联反应的温度优选为室温,时间优选为5h。
[0138]
在本发明中,具有式d-6所示结构的化合物进行脱保护基反应,得到具有式d所示结构的化合物。在本发明中,所述脱保护反应使用的脱保护试剂优选为三氟乙酸。在本发明中,所述脱保护反应使用的有机溶剂优选为二氯甲烷。在本发明中,所述脱保护基反应的温度优选为室温,时间优选为5h。
[0139]
在本发明中,所述具有式c所示结构的化合物与具有式d所示结构的化合物进行缩合反应,得到gpx4蛋白降解剂。在本发明中,所述具有式c所示结构的化合物与具有式d所示结构的化合物的摩尔比优选为1:1。
[0140]
在本发明中,所述缩合反应使用的缩合试剂优选为hatu和dipea。在本发明中,所述缩合反应使用的有机溶剂优选为二甲基甲酰胺。在本发明中,所述锁舌反应的温度优选为室温,时间优选为2h。
[0141]
在本发明中,所述具有nh
2-a2结构的化合物优选为结构的化合物优选为
[0142]
在本发明中,所述具有式v7所示结构的化合物的制备方法,优选包括以下步骤:
[0143]
具有式v1所示结构的化合物与4-甲基噻唑进行取代反应,得到具有式v2所示结构的化合物;
[0144][0145]
在本发明中,所述具有式v1所示结构的化合物与4-甲基噻唑的摩尔比优选为1:2。在本发明中,所述取代反应的催化剂优选为醋酸钯和乙酸钾。在本发明中,所述取代反应的溶剂优选为干二甲基甲酰胺;所述取代反应优选在ar气保护下进行,所述取代反应的温度优选为90℃,时间优选为2h。
[0146]
在本发明中,具有式v2所示结构的化合物进行脱保护基反应,得到具有式v3所示结构的化合物;
[0147][0148]
在本发明中,所述脱保护基反应使用的脱保护试剂优选为三氟乙酸;在本发明中,所述脱保护基反应使用的有机溶剂优选为二氯甲烷;所述脱保护基反应的温度优选为室温,时间优选为30min。
[0149]
在本发明中,具有式v3所示结构的化合物与具有式w1所示结构的化合物进行缩合反应,得到具有式v4所示结构的化合物;
[0150][0151]
在本发明中,所述具有式v3所示结构的化合物与具有式w1所示结构的化合物的摩尔比优选为1:1。在本发明中,所述缩合反应使用的缩合试剂优选为hatu和dipea。在本发明中,所述缩合反应使用的有机溶剂优选为二甲基甲酰胺;所述缩合反应的温度优选为室温,时间优选为过夜。
[0152]
在本发明中,具有式v4所示结构的化合物进行脱保护反应,得到具有式v5所示结构的化合物;
[0153][0154]
在本发明中,所述脱保护反应使用的脱保护试剂优选为三氟乙酸;所述脱保护反应使用的有机溶剂优选为二氯甲烷;所述脱保护反应的温度优选为室温,时间优选为30min。
[0155]
在本发明中,具有式v5所示结构的化合物与具有式w2所示结构的化合物进行缩合反应,得到具有式v6所示结构的化合物;
[0156][0157]
在本发明中,所述具有式v5所示结构的化合物与具有式w2所示结构的化合物的摩尔比优选为1:1。在本发明中,所述缩合反应使用的缩合试剂优选为hatu和dipea。在本发明中,所述缩合反应使用的有机溶剂优选为二甲基甲酰胺;所述缩合反应的温度优选为室温,时间优选为过夜。
[0158]
具有式v6所示结构的化合物进行脱保护反应,得到具有式v7所示结构的化合物。
[0159]
在本发明中,所述脱保护反应使用的脱保护试剂优选为三氟乙酸;所述脱保护反应使用的有机溶剂优选为二氯甲烷;所述脱保护反应的温度优选为室温,时间优选为30min。
[0160]
②
当a1为时,所述gpx4蛋白降解剂的制备方法包括以下步骤:
[0161]
具有式e所示结构的化合物与具有f-a2结构的化合物进行取代反应,得到具有式f所示结构的化合物;
[0162][0163]
具有式f所示结构的化合物进行脱保护基反应,得到具有式g所示结构的化合物;
[0164][0165]
具有式g所示结构的化合物与具有式d所示结构的化合物进行缩合反应,得到gpx4蛋白降解剂。
[0166]
在本发明中,具有式e所示结构的化合物与具有nh
2-a2结构的化合物进行取代反应,得到具有式f所示结构的化合物。在本发明中,所述具有式e所示结构的化合物的制备方法,优选包括以下步骤:
[0167]
邻苯二甲酰亚胺与具有式e-1所示结构的化合物进行取代反应,得到具有式e-2所示结构的化合物;
[0168][0169]
在本发明中,邻苯二甲酰亚胺与具有式e-1所示结构的化合物的摩尔比优选为1:1.2。在本发明中,所述取代反应的催化剂优选为四丁基溴化铵和k2co3。在本发明中,所述取代反应使用的有机溶剂优选为二甲基甲酰胺;所述取代反应的温度优选为室温,时间优选为3h。
[0170]
在本发明中,具有式e-2所示结构的化合物与1-boc哌嗪进行取代反应,得到具有式e-3所示结构的化合物;
[0171][0172]
在本发明中,所述取代反应的催化剂优选为三乙醇胺和k2co3。在本发明中,所述取代反应使用的有机溶剂优选为乙腈;所述取代反应的温度优选为回流温度,时间优选为过夜。
[0173]
在本发明中,具有式e-3所示结构的化合物进行脱保护基反应,得到具有式e-4所示结构的化合物;
[0174][0175]
在本发明中,所述脱保护基反应使用的脱保护试剂优选为三氟乙酸;所述脱保护基反应的有机溶剂优选为二氯乙烷;所述脱保护基反应的温度优选为室温,时间优选为3h。
[0176]
在本发明中,具有式e-4所示结构的化合物与1-boc-4溴甲基哌啶进行取代反应,得到具有式e-5所示结构的化合物;
[0177][0178]
在本发明中,所述具有式e-4所示结构的化合物与1-boc-4溴甲基哌啶的摩尔比优选为1:1.1。在本发明中,所述取代反应的催化剂优选为三乙醇胺和k2co3。在本发明中,所述取代反应使用的有机溶剂优选为乙腈;所述取代反应的温度优选为回流温度,时间优选为过夜。
[0179]
在水合肼的作用下,具有式e-5所示结构的化合物进行脱酰亚胺基反应,得到具有式e所示结构的化合物。在本发明中,所述具有式e-5所示结构的化合物与水合肼的摩尔比优选为1:2。在本发明中,所述脱酰亚胺基反应的溶剂优选为乙醇;所述脱酰亚胺基反应的温度优选为回流温度,时间优选为过夜。
[0180]
在本发明中,具有式e所示结构的化合物与具有f-a2结构的化合物进行取代反应,得到具有式f所示结构的化合物。在本发明中,所述具有f-a2结构的化合物优选为氟代沙利度胺或n-甲基氟代沙利度胺。
[0181][0182]
在本发明中,具有式e所示结构的化合物与具有f-a2结构的化合物的摩尔比优选为1:1。在本发明中,所述取代反应使用的缩合剂优选为dipea。在本发明中,所述取代反应使用的有机溶剂优先为二甲基亚砜。在本发明中,所述取代反应的温度优选为130℃,时间优选为0.5h。
[0183]
在本发明中,具有式f所示结构的化合物进行脱保护基反应,得到具有式g所示结构的化合物。在本发明中,所述脱保护基反应使用的脱保护基试剂优选为三氟乙酸。在本发明中,所述脱保护基反应使用的有机溶剂优选为二氯甲烷;所述脱保护基反应的温度优选为室温,时间优选为过夜。
[0184]
在本发明中,具有式g所示结构的化合物与具有式d所示结构的化合物进行缩合反应,得到gpx4蛋白降解剂。在本发明中,所述具有式g所示结构的化合物与具有式d所示结构的化合物的摩尔比优选为1:1;所述缩合反应使用的缩合剂优选为hatu和dipea。在本发明中,所述缩合反应使用的有机溶剂优选为二甲基甲酰胺;所述缩合反应的温度优选为室温,时间优选为过夜。
[0185]
③
当a1为时,所述gpx4蛋白降解剂的制备方法包括以下步骤:
[0186]
具有式h所示结构的化合物与具有f-a2结构的化合物进行取代反应,得到具有式i所示结构的化合物;
[0187]
具有式i所示结构的化合物进行脱保护基反应,得到具有式j所示结构的化合物;
[0188]
具有式j所示结构的化合物与具有式k所示结构的化合物进行取代反应,得到具有式l所示结构的化合物;
[0189]
具有式l所示结构的化合物与具有式d所示结构的化合物进行缩合反应,得到gpx4蛋白降解剂;
[0190][0191]
在本发明中,具有式h所示结构的化合物与具有f-a2结构的化合物进行取代反应,得到具有式i所示结构的化合物。在本发明中,具有式h所示结构的化合物的制备方法,优选包括以下步骤:
[0192]
具有式h-1所示结构的化合物与具有式h-2所示结构的化合物进行取代反应,得到具有式h-3所示结构的化合物;
[0193][0194]
在本发明中,所述具有式h-1所示结构的化合物与具有式h-2所示结构的化合物的摩尔比优选为1:1。在本发明中,所述取代反应的催化剂优选为k2co3和ki。在本发明中,所述取代反应使用的有机溶剂优选为乙腈;所述取代反应的温度优选为回流温度,时间优选为过夜。
[0195]
在本发明中,具有式h-3所示结构的化合物进行脱cbz保护基反应,得到具有式h所示结构的化合物。在本发明中,所述脱cbz保护基反应使用的脱保护试剂优选为三氟乙酸;所述脱cbz保护基反应使用的有机溶剂优选为二氯甲烷;所述脱cbz保护基反应的温度优选为室温,时间优选为3h。
[0196]
在本发明中,具有式h所示结构的化合物与具有f-a2结构的化合物进行取代反应,得到具有式i所示结构的化合物。在本发明中,所述具有f-a2结构的化合物优选为氟代沙利度胺。在本发明中,所述氟代沙利度胺的结构式为
[0197]
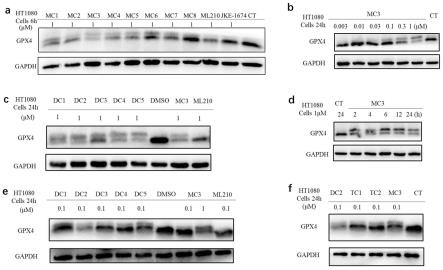
在本发明中,所述具有具有式h所示结构的化合物与具有f-a2结构的化合物的摩尔比优选为1:1。在本发明中,所述取代反应使用的缩合剂优选为dipea;所述取代反应使用的有机溶剂优选为二甲基亚砜。在本发明中,所述取代反应的温度优选为130℃,时间优选
为1h。
[0198]
在本发明中,具有式i所示结构的化合物进行脱保护基反应,得到具有式j所示结构的化合物。在本发明中,所述脱保护基反应使用的脱保护试剂优选为三氟乙胺;所述脱保护基反应使用的有机溶剂优选为二氯甲烷;所述脱保护基反应的温度优选为室温,时间优选为3h。
[0199]
在本发明中,具有式j所示结构的化合物与具有式k所示结构的化合物进行取代反应,得到具有式l所示结构的化合物。在本发明中,具有式j所示结构的化合物与具有式k所示结构的化合物的摩尔比优选为1:1.5。在本发明中,所述取代反应使用的催化剂优选为k2co3和ki。在本发明中,所述取代反应使用的有机溶剂优选为乙腈;所述取代反应的温度优选为回流温度,时间优选为过夜。
[0200]
在本发明中,具有式l所示结构的化合物与具有式d所示结构的化合物进行缩合反应,得到gpx4蛋白降解剂。在本发明中,所述具有式l所示结构的化合物优选先进行脱保护反应,所述脱保护反应使用的脱保护试剂优选为三氟乙酸。在本发明中,所述脱保护反应使用的有机溶剂优选为二氯甲烷;所述脱保护反应的温度优选为室温,时间优选为3h。
[0201]
在本发明中,所述缩合反应使用的缩合试剂优选为hatu和dipea。在本发明中,所述缩合反应使用的有机溶剂优选为二甲基甲酰胺;所述缩合反应的温度优选为室温,时间优选为过夜。
[0202]
④
当a1为时,所述gpx4蛋白降解剂的制备方法包括以下步骤:
[0203]
具有式m所示结构的化合物与具有f-a2结构的化合物进行取代反应,得到具有式n所示结构的化合物;
[0204][0205]
具有式n所示化合物与具有式d所示结构的化合物进行缩合反应和脱保护反应,得到gpx4蛋白降解剂。
[0206]
在本发明中,具有式m所示结构的化合物与具有f-a2结构的化合物进行取代反应,得到具有式n所示结构的化合物。在本发明中,所述具有式m所示结构的化合物的制备方法,包括以下步骤:
[0207]
具有式m-1所示结构的化合物与具有式m-2所示结构的化合物进行取代反应和脱保护反应,得到具有式m-3所示结构的化合物;
[0208][0209]
在本发明中,具有式m-1所示结构的化合物与具有式m-2所示结构的化合物的摩尔比优选为1:1。在本发明中,所述取代反应的催化剂优选为k2co3和ki。在本发明中,所述取代反应使用的有机溶剂优选为乙腈;所述取代反应的温度优选为回流温度,时间优选为过夜。
[0210]
在本发明中,具有式m-3所示结构的化合物与具有式m-4所示结构的化合物进行取
代反应,得到具有式m-5所示结构的化合物;
[0211][0212]
在本发明中,所述具有式m-3所示结构的化合物与具有式m-4所示结构的化合物的摩尔比优选为1:1,所述取代反应的催化剂优选为k2co3和ki。在本发明中,所述取代反应使用的有机溶剂优选为乙腈;所述取代反应的温度优选为回流温度,时间优选为过夜。
[0213]
在本发明中,具有式m-5所示结构的化合物进行脱cbz保护基反应,得到具有式m所示结构的化合物。在本发明中,所述脱cbz保护基反应使用的脱保护试剂优选为三氟乙酸;所述脱cbz保护基反应使用的有机溶剂优选为二氯甲烷;所述脱cbz保护基反应的温度优选为室温,时间优选为3h。
[0214]
在本发明中,具有式m所示结构的化合物与具有f-a2结构的化合物进行取代反应,得到具有式n所示结构的化合物。在本发明中,所述具有f-a2结构的化合物优选为氟代沙利度胺。在本发明中,所述取代反应使用的缩合剂优选为dipea。在本发明中,所述取代反应使用的有机溶剂优选为二甲基亚砜;所述取代反应的温度优选为130℃,时间优选为1h。
[0215]
在本发明中,具有式n所示化合物与具有式d所示结构的化合物进行缩合反应和脱保护反应,得到gpx4蛋白降解剂。在本发明中,所述具有式n所示化合物与具有式d所示结构的化合物的摩尔比优选为1:1;所述缩合反应使用的缩合试剂优选为hatu和dipea。在本发明中,所述缩合反应使用的有机溶剂优选为二甲基甲酰胺;所述缩合反应的温度优选为室温,时间优选为过夜。
[0216]
在本发明中,所述脱保护反应使用的脱保护试剂优选为三氟乙酸;所述脱保护反应使用的有机溶剂优选为二氯甲烷;所述脱保护反应的温度优选为室温,时间优选为3h。
[0217]
本发明提供了上述gpx4蛋白降解剂在制备抗肿瘤药物中的应用。在本发明中,所述抗肿瘤药物优选为抗纤维肉瘤、口腔鳞状细胞癌、胶质瘤、弥漫大b细胞淋巴瘤、肝癌、胰腺癌、前列腺癌、乳腺癌、神经母细胞瘤、卵巢癌、黑色素瘤、肾癌、胃癌、结直肠癌、甲状腺癌、肺癌、头颈癌、尿路上皮癌、宫颈癌或子宫内膜癌的药物。
[0218]
本发明提供了一种抗肿瘤细胞药物,包括药物活性组分和药物辅料;所述药物活性组分为上述gpx4蛋白降解剂;本发明对所述药物辅料没有特殊的要求,使用本领域技术人员熟知的药物辅料即可。在本发明中,所述药物活性成分在药物中的有效含量优选为1~50wt%,更优选为5~30wt%。
[0219]
下面结合实施例对本发明提供的一种gpx4蛋白降解剂及其制备方法和应用、一种抗肿瘤细胞药物进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
[0220]
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。下述实施例中部分中间体的结构式如表2所示。
[0221]
表2部分中间体的结构式
[0222][0223][0224]
实施例1 gpx4蛋白降解剂mc1的合成
[0225]
(1)中间体sm3的合成
[0226]
将5-甲基异恶唑-3-羧酸(10g,78.68mmol)逐分批次加入到kno3(11.93g,118.02mmol)和浓硫酸(30ml)混合液中,待全部溶解后,50℃加热反应4h。反应毕,冷却至室温,向体系中加入缓慢加入冷水,然后用乙酸乙酯萃取三次,合并有机相,依次用饱和nacl溶液洗涤和无水na2so4干燥。减压蒸馏除去溶剂,得到黄色固体(3.23g),不经纯化进行下一步反应。
[0227]
(2)中间体m1的合成
[0228]
将4-氯-4
’‑
羟基二苯甲酮(10g,42.98mmol)用150ml乙腈溶解,依次加入k2co3(8.95g,64.77mmol)和溴乙酸叔丁酯(10.06g,51.58mmol),85℃回流反应2h。反应毕,向体系中加入冷水淬灭反应液,用乙酸乙酯萃取三次,合并有机相,依次用饱和nacl溶液洗涤和无水na2so4干燥。柱分离(p/e=30/1-10/1)得白色固体(13.9g,94%)。
[0229]1h nmr(400mhz,dmso-d6)δ7.72(q,j=8.84,16.40hz,4h,ar-h),7.58(d,j=8.48hz,2h,ar-ha),7.06(d,j=8.84hz,2h,ar-hb),4.78(s,2h,ch2),1.43(s,3h,ch3×
3);
13
c nmr(100mhz,dmso-d6)δ193.59,167.73,161.94,137.50,136.75,132.48,131.56,130.03,128.99,114.89,82.10,81.90,65.50,29.00,28.11,27.87.
[0230]
(3)中间体m2的合成
[0231]
将m1(0.5g,1.44mmol)溶于thf/meoh(5/5ml)混合溶剂中,在冰浴条件下搅拌10min,然后向其中分批加入nabh4(49mg,1.44mmol),继续搅拌30min。反应毕,用饱和nh4cl溶液淬灭反应,用乙酸乙酯萃取三次,合并有机相,依次用饱和nacl溶液洗涤和无水na2so4干燥。柱分离(p/e=10/1-6/1)得无色透明液体(0.4g,80%)。
[0232]1h nmr(400mhz,cdcl3)δ7.29(brs,4h,ar-h),7.23(d,j=8.60hz,2h,ar-ha),6.84(d,j=8.76hz,2h,ar-hb);5.75(s,1h,oh),4.48(s,2h,ch2),1.48(s,3h,ch3×
3);
13
c nmr(100mhz,cdcl3)δ167.96,157.55,142.35,136.65,133.14,128.53,127.96,127.82,114.69,82.47,75.07,65.70,28.05.
[0233]
(4)中间体m3的合成
[0234]
将m2(385mg,1.10mmol)用5ml干燥二氯甲烷溶解,冰浴条件下搅拌10min,然后加入草酰氯(280mg,2.21mmol)和3滴dmf,室温搅拌过夜。反应毕,减压除去溶剂和多余的草酰氯,得到残留物,不经纯化,进行下一步反应。
[0235]
(5)中间体m4的合成
[0236]
将上步反应所得m3用乙腈溶解,然后向其中加入无水哌嗪,90℃回流过夜。反应毕,加入冷水淬灭反应,用乙酸乙酯萃取三次,合并有机相,依次用饱和nacl溶液洗涤和无水na2so4干燥。柱分离(d/m=30/1)得浅黄色固体m4(2.3g)。
[0237]1h nmr(400mhz,dmso-d6)δ7.40(d,j=8.52hz,2h,ar-h),7.32(d,j=8.48hz,2h,ar-h),7.27(d,j=8.72hz,2h,ar-h),6.81(d,j=8.72hz,2h,ar-h),4.58(s,2h,ch2),4.21(s,1h,nh),2.68(t,j=4.76hz,2h,ch2×
2),2.18(brs,4h,ch2×
2);1.40(s,3h,ch3×
3);
13
c nmr(100mhz,dmso-d6)δ168.29,157.07,142.68,135.24,131.56,129.78,129.15,128.84,114.95,81.78,74.47,65.44,53.24,46.18,28.13.
[0238]
(6)中间体m5的合成
[0239]
将sm3(0.50g,2.90mmol)用干燥二氯甲烷(20ml)溶解,冰浴条件下搅拌5min,加入草酰氯(0.76g,5.80mmol)和dmf(1滴),常温下搅拌过夜。减压蒸馏除去溶剂和多余的草酰
氯,残液用干燥的二氯甲烷溶解,冰浴条件下搅拌10min,然后向其中逐滴滴加m4(1.2g,2.90mmol)和三乙胺(0.61g,5.8mmol)的二氯甲烷(20ml)溶液,室温下搅拌5h。反应毕,加入冷水淬灭反应,用二氯甲烷萃取三次,合并有机相,依次用饱和nacl溶液洗涤和无水na2so4干燥。柱分离(p/e=30/1-3/1)得白色固体(1.42g,88%)。
[0240]1h nmr(400mhz,cdcl3)δ7.32(d,j=8.24hz,2h,ar-h),7.23-7.26(m,4h,ar-h),6.80(d,j=8.20hz,2h,ar-h),4.48(s,2h,ch2),4.21(s,1h,ch),3.81(brs,2h,ch2),3.34(t,j=5.12hz,2h,ch2),2.84(s,3h,ch3),2.50(t,j=5.12hz,2h,ch2),2.35(brs,2h,ch2),1.46(s,3h,ch3×
3);
13
c nmr(100mhz,cdcl3)δ171.71,167.92,157.37,156.50,153.05,128.99,128.88,114.95,82.41,74.30,65.73,53.45,51.56,51.00,46.99,42.36,28.04,13.46.
[0241]
(7)中间体m6的合成
[0242]
将m5(0.5g,0.88mmol)用二氯甲烷(30ml)溶解,加入三氟乙酸(1.00g,8.80mmol)室温搅拌5h。反应毕,减压蒸馏除去溶剂和多余的三氟乙酸,加入二氯甲烷溶解,用饱和nacl溶液洗涤和无水na2so4干燥。减压除去溶剂得白色固体(0.38g,84%)。不经纯化,直接进行下一步反应。
[0243]
(8)中间体c7-1的合成
[0244]
将7-溴-1-庚醇(4.00g,20.50mmol)用乙腈(80ml)溶解,依次加入k2co3(5.70g,41.00mmol)、ki(1.02g,6.15mmol)和1-boc-哌嗪(2.22g,20.50mmol),85℃回流3h。反应毕,加入冷水淬灭反应,用乙酸乙酯萃取三次,合并有机相,依次用饱和nacl溶液洗涤和无水na2so4干燥。柱层析分离(d/m=60/1)得淡黄色固体(5.04g,82%)。
[0245]1h nmr(400mhz,cdcl3)δ3.65(q,j=11.96,6.20hz,2h,ch2),3.50(t,j=5.32hz,4h,ch2×
2),2.46(brs,4h,ch2×
2),2.40(t,j=7.52hz,2h,ch2),1.53-1.61(m,4h,ch2×
2),1.48(s,9h,ch3×
3),1.32-1.43(m,7h,oh&ch2×
3);
13
c nmr(100mhz,cdcl3)δ154.67,79.74,62.92,58.65,58.64,52.93,32.68,29.23,28.42,27.39,26.36,25.64.hrms(esi
+
):m/z calculated for c
16h33
n2o3(m+h)
+
:301.2491;found 301.2491.
[0246]
(9)中间体c7-2的合成
[0247]
将c7-1(6.02g,20.50mmol)用二氯甲烷(40ml)溶解,加入三乙胺(5.7ml,41.00mmol),冰浴条件下搅拌10min。向其中逐滴加入对甲苯磺酰氯(7.82g,41.00mmol)的二氯甲烷(20ml)溶液,室温反应过夜。反应毕,加水淬灭反应,用乙酸乙酯萃取三次,合并有机相,依次用饱和nacl溶液洗涤和无水na2so4干燥。柱层析(d/m=80/1)得浅黄色透明液体(8.03g,86%)。
[0248]1h nmr(400mhz,cdcl3)δ7.80(d,j=8.32hz,2h,ar-h
×
2),7.36(d,j=8.00hz,2h,ar-h
×
2),4.03(t,j=6.48hz,2h,ch2),3.48(br,4h,ch2×
2),2.47(s,3h,ch3),2.35-2.43(m,6h,ch2×
2,ch2),1.54-1.69(m,2h,ch2),1.45-1.54(m,11h,ch3×
3,ch2),1.27-1.36(m,6h,ch2×
3);
13
c nmr(100mhz,cdcl3)δ154.67,144.63,133.22,129.79,127.86,79.72,70.57,58.55,58.55,52.93,28.78,28.76,28.42,27.19,36.36,25.27,21.64.hrms(esi
+
):m/z calculated for c
23h39
n2o5s(m+h)
+
:455.2580;found455.2576.
[0249]
(10)中间体c7-3的合成
[0250]
将来那度胺(570mg,2.20mmol)用乙腈(40ml)溶解,然后依次加入c7-2(1000mg,
0.98mmol)、k2co3(365mg,2.64mmol)、ki(109mg,0.66mmol),90℃回流2h。反应毕,加水淬灭反应,用乙酸乙酯萃取三次,合并有机相,依次用饱和nacl溶液洗涤和无水na2so4干燥。柱层析(d/m=60/1)得白色固体c7-3(515mg,42%)。
[0251]1h nmr(400mhz,cdcl3)δ7.29-7.36(m,2h,ar-h
×
2),6.87(dd,j=7.40,1.28hz,1h,ar-h),5.20(dd,j=13.44,5.16hz,1h,ch),4.26(q,j=52.32,15.40hz,2h,ch2),3.73-3.83(m,4h,ch2×
2),3.48(t,j=4.52hz,4h,ch2×
2),2.96-3.02(m,1h,ch
2-a
),2.81-2.91(m,1h,ch
2-b
),2.35-2.45(m,6h,ch2×
2,ch2),2.25-2.32(m,1h,ch
2-b
),2.15-2.21(m,1h,ch
2-a
),1.51-1.54(m,2h,ch2),1.47(s,9h,ch3×
3),1.29-1.35(m,6h,ch2×
3);
13
c nmr(100mhz,cdcl3)δ170.98,169.91,169.81,154.64,141.17,132.40,129.49,126.28,118.09,114.47,79.74,58.73,58.57,52.90,52.49,45.02,40.56,32.23,29.47,28.93,28.41,27.82,27.23,26.74,22.90.hrms(esi
+
):m/z calculated for c
29h44
n5o5(m+h)
+
:542.3342;found542.3343.
[0252]
(11)中间体c7-4的合成
[0253]
将c7-3(515mg,0.95mmol)用二氯甲烷(10ml)溶解,加入三氟乙酸(1083mg,9.50mmol),室温下搅拌2h。反应毕,减压除去溶剂及部分剩余的三氟乙酸,得到370mg黄色油状物,不经分离进行下一步反应。
[0254]
(12)gpx4蛋白降解剂的合成
[0255]
将m6(541mg,1.05mmol)溶于dmf(10ml)中,依次加入hatu(479mg,1.26mmol)、dipea(271mg,2.10mmol)和化合物c7-4(465mg,1.05mmol),室温反应2h。反应毕,向体系中加入冷水淬灭反应液,用乙酸乙酯萃取三次,合并有机相,依次用饱和nacl溶液洗涤和无水na2so4干燥。柱分离(d/m=50/1-30/1),得到黄色固体(120mg,15%)。
[0256]1h nmr(400mhz,cdcl3)δ7.29-7.31(m,2h,ar-h),7.20-7.26(m,6h,ar-h),6.79-6.82(m,3h,ar-h),5.11(dd,j=5.23,13.13hz,1h,ch),4.59(s,2h,ch2),4.11-4.25(m,3h,ch2&ch),3.83(s,2h,ch2),3.76-3.79(m,2h,ch2),3.68-3.73(m,2h,ch2),3.56-3.78(m,2h,ch2),3.48-3.50(m,2h,ch2),3.29-3.32(m,2h,ch2),2.87-2.94(m,1h,ch
2a
),2.74-3.83(m,1h,ch
2b
),2.79(s,3h,ch3),2.46(t,j=5.13hz,2h,ch2),2.31-2.38(m,4h,ch2×
2),2.25-2.28(m,2h,ch2),2.06-2.13(m,1h,ch
2a
),1.38-1.50(m,4h,ch2×
2),1.23-1.26(m,7h,ch
2b
&ch2×
3);
13
c nmr(100mhz,cdcl3)δ171.78,171.04,169.94,169.83,166.13,157.25,156.51,153.04,141.43,140.78,134.39,132.80,132.36,129.44,128.95,128.90,128.85,128.74,126.25,118.01,114.96,114.09,74.20,67.47,58.33,53.49,53.21,52.71,52.52,51.50,50.93,46.99,45.11,42.37,41.96,40.53,32.18,28.94,27.77,27.15,26.76,26.50,22.78,13.44.m.p.133-134℃.hrms(esi
+
):m/z calculated for c
48h56
cln9o9(m+h)
+
:938.3890;found 938.3988.
[0257]
实施例2~8gpx4蛋白降解剂mc2~mc8的合成
[0258]
实施例2~8与实施例1的区别在于,在制备中间体c7-1时的起始原料m值的不同。
[0259]
gpx4蛋白降解剂mc2的谱图数据:1h nmr(400mhz,cdcl3)δ7.24-7.34(m,8h,ar-h),6.83-6.87(m,3h,ar-h),6.24(s,1h,nh),5.16(dd,j=5.09,13.32hz,1h,ch),4.63(s,2h,ch2),4.15-4.30(m,3h,ch2&ch),3.72-3.83(m,6h,ch2×
3),3.61-3.64(m,2h,ch2),3.53-3.56(m,2h,ch2),3.33-3.36(m,1h,ch
2a
),2.92-2.99(m,1h,ch
2b
),2.79-2.88(m,2h,ch2),
×
2),2.11-2.18(m,1h,ch
2a
),1.43-1.53(m,4h,ch2×
2),1.24-1.29(m,15h,ch
2b
&ch2×
7);
13
c nmr(100mhz,cdcl3)δ171.72,171.01,169.91,169.81,166.14,157.25,156.58,156.50,153.06,141.30,140.76,134.42,132.85,132.39,129.46,128.94,128.91,128.87,128.77,128.59,126.27,118.04,114.96,114.28,74.24,67.69,67.54,60.37,58.48,53.26,52.70,52.50,51.52,50.95,47.00,45.13,45.01,42.38,41.94,40.66,32.20,29.41,29.14,27.92,27.35,26.92,26.58,22.86,13.45.m.p.112-113℃.hrms(esi
+
):m/z calculated for c
52h64
cln9o9(m+h)
+
:994.4516;found 994.4922.
[0263]
gpx4蛋白降解剂mc6的谱图数据:1h nmr(400mhz,cdcl3)δ7.25-7.35(m,9h,ar-h
×
8&nh),7.05-7.18(m,1h,ar-h),6.85-6.88(m,3h,ar-h),5.19(dd,j=5.37,13.50hz,1h,ch),4.64(s,2h,ch2),4.14-4.33(m,3h,ch2&ch),3.82-3.84(m,2h,ch2),3.76-3.78(m,3h,ch2&ch
2a
),3.58-3.65(m,4h,ch2×
2),3.36(t,j=5.01hz,2h,ch2),2.95-2.99(m,1h,ch
2b
),2.86(s,3h,ch3),2.51(t,j=5.11hz,2h,ch2),2.44(brs,4h,ch2×
2),2.34-2.37(m,4h,ch2×
2),2.14-2.20(m,1h,ch
2a
),1.48-1.56(m,4h,ch2×
2),1.26-1.30(m,17h,ch
2b
&ch2×
8);
13
c nmr(100mhz,cdcl3)δ171.70,171.00,169.90,169.80,166.15,157.24,156.50,153.06,141.26,140.75,134.45,132.87,132.41,129.47,128.94,128.92,128.87,128.77,126.27,118.06,114.95,114.35,74.25,67.57,58.46,53.22,52.66,52.50,51.52,50.96,47.00,44.99,42.38,40.67,32.21,29.46,29.42,29.17,27.93,27.34,26.93,22.87,13.45,-0.01.m.p.122-123℃.hrms(esi
+
):m/z calculated for c
53h66
cln9o9(m+h)
+
:1008.4672;found 1008.4780.
[0264]
gpx4蛋白降解剂mc7的谱图数据:1h nmr(400mhz,cdcl3)δ7.24-7.28(m,9h,ar-h
×
8&nh),6.33-6.81(m,1h,ar-h),6.85-6.88(m,3h,ar-h),5.17-5.21(m,1h,ch),4.58-4.64(m,2h,ch2),4.19-4.32(m,3h,ch2&ch),3.72-3.79(m,7h,ch2×
3&ch
2a
),3.62-3.63(m,2h,ch2),3.35(brs,2h,ch2),2.95-3.00(m,1h,ch
2b
),2.85-2.88(m,2h,ch2),2.36-2.49(m,10h,ch3&ch2×
3&ch
2a
),2.12-2.22(m,2h,ch
2b
),1.51-1.56(m,4h,ch2×
2),1.24-1.28(m,19h,)2.86(s,3h,ch3),2.51(t,j=5.11hz,2h,ch2),2.44(brs,4h,ch2×
2),2.34-2.37(m,4h,ch2×
2),2.14-2.20(m,1h,ch
2a
),1.48-1.56(m,4h,ch2×
2),1.26-1.30(m,19h,ch
2b
&ch2×
9);
13
c nmr(100mhz,cdcl3)δ172.50,172.09,169.63,167.52,166.48,158.60,155.96,148.87,145.93,139.98,135.11,134.71,131.40,129.51,129.33,129.06,127.31,126.25,123.47,117.07,116.56,115.80,74.06,66.01,56.30,55.80,52.57,51.92,46.82,45.85,45.43,44.08,30.81,29.43,29.32,29.23,29.20,29.17,29.13,29.09,29.02,27.56,27.48,27.25,25.99,13.78.m.p.111-112℃.hrms(esi
+
):m/z calculated for c
54h68
cln9o9(m+h)
+
:1022.4829;found1022.5059.
[0265]
gpx4蛋白降解剂mc8的谱图数据:1h nmr(400mhz,cdcl3)δ7.22-7.36(m,8h,ar-h
×
7&nh),7.07-7.18(m,2h,ar-h),6.85-6.90(m,3h,ar-h),5.20(dd,j=5.17,13.27hz,1h,ch),4.64-4.66(m,2h,ch2),4.20-4.33(m,3h,ch2&ch),3.73-3.85(m,5h,ch2×
2&ch
2a
),3.60-3.69(m,6h,ch2×
3),3.55-3.37(m,1h,ch
2b
),2.95-3.01(m,1h,ch
2a
),2.86(s,3h,ch3),2.47-2.53(m,5h,ch2×
2&ch
2b
),2.34-2.44(brs,4h,ch2×
2),2.27-2.32(m,1h,ch
2a
),2.14-2.21(m,1h,ch
2b
),1.48-1.56(m,4h,ch2×
2),1.26-1.31(m,21h,ch
2b
&ch2×
10);
13
c nmr(100mhz,cdcl3)δ172.50,172.09,169.63,167.52,166.48,158.60,155.96,148.87,
145.93,139.98,135.11,134.71,131.40,129.51,129.33,129.06,127.31,126.25,123.47,117.07,116.56,115.80,74.06,66.01,56.30,55.80,52.57,51.92,46.82,45.85,45.43,44.08,30.81,29.43,29.32,29.23,29.21,29.20,29.17,29.13,29.09,29.02,27.56,27.48,27.25,25.99,13.78.m.p.102-103℃.hrms(esi
+
):m/z calculated for c
55h70
cln9o9(m+h)
+
:1036.4985;found1036.5074.
[0266]
实施例9
[0267]
gpx4蛋白降解剂mc9的合成
[0268]
(1)中间体的合成c9-9的合成
[0269]
将叠氮基三甲基硅烷(0.92g,7.98mmol)用15ml dry dmf溶解,加入kf(0.47g,7.98mmol),室温搅拌30min,然后加入c9-2(1.28g,2.66mmol),60℃反应2h。反应结束后,用冷naoh溶液淬灭反应,乙酸乙酯提取三次,合并有机相,依次用饱和nacl溶液洗涤和无水na2so4干燥。减压浓缩得淡黄色液体c9-9(1.14g,89%),不经分离进行下一步反应。
[0270]
(2)中间体c9-10的合成
[0271]
将c9-9(1.14g,2.36mmol)用15ml甲醇溶解,加入5%pd/c(180mg),氢化反应2h。反应结束后,过滤除去钯碳,滤液浓缩得0.73g灰色固体,不经分离进行下一步反应。
[0272]
(3)中间体c9-11的合成
[0273]
将氟代沙利度胺(0.20g,0.72mmol)用5ml dry dmf溶解,依次加入c9-10(0.84g,1.44mmol)和dipea(0.19g,1.44mmol),90℃反应过夜。反应结束后,用水淬灭反应,乙酸乙酯提取三次,合并有机相,依次用饱和nacl溶液洗涤和无水na2so4干燥。柱色谱分离(d/m=60/1)得黄色固体c9-11(210mg,25%)。1h nmr(400mhz,cdcl3)δ8.70(s,1h,nh),7.48-7.52(m,1h,ar-h),7.10(d,j=7.04hz,1h,ar-h),6.89(d,j=8.52hz,1h,ar-h),6.24(t,j=5.40hz,nh),4.91-4.95(m,1h,ch),3.49(br,4h,ch2×
2),3.27(q,j=12.64,6.84hz,2h,ch2),2.70-2.92(m,3h,ch
2-a
×
2&ch
2-b
),2.35-2.51(m,6h,ch2×
2&ch2),2.11-2.17(m,1h,ch
2-b
),1.63-1.71(m,2h,ch2),1.50-1.58(m,2h,ch2),1.47(s,9h,ch3×
3),1.30-1.45(m,10h,ch2×
5);
13
c nmr(100mhz,cdcl3)δ171.13,169.50,168.46,167.64,154.69,147.03,136.07,132.49,116.62,111.32,109.83,79.73,58.63,52.85,52.85,48.89,42.61,31.48,29.47,29.44,29.36,29.17,28.42,27.46,26.81,26.45,22.84.hrms(esi+):m/z calculated for c31h46n5o6(m+h)+:583.3370;found 583.3752.
[0274]
(4)gpx4蛋白降解剂的合成
[0275]
将c9-11(0.10g,0.16mmol)用10ml dcm溶解,加入1ml tfa,室温搅拌30min。反应结束后,减压除去溶剂得浅黄色液体混合物c9-11,不经分离进行下一步反应。将m6(82mg,0.16mmol)溶于dmf(10ml)中,依次加入hatu(91mg,0.24mmol)、dipea(70mg,0.48mmol)和上步粗产物,室温反应2h。反应毕,向体系中加入冷水淬灭反应液,用乙酸乙酯萃取三次,合并有机相,依次用饱和nacl溶液洗涤和无水na2so4干燥。柱分离(d/m=50/1-30/1),得到黄色固体(47mg,30%)。1h nmr(400mhz,cdcl3)δ9.02(s,1h,nh),7.47(dd,j=7.39,8.34hz,1h,ar-h),7.33-7.30(m,2h,ar-h
×
2),7.27-7.22(m,4h,ar-h
×
4),7.07(d,j=7.13hz,1h,ar-h
×
1),6.87-6.82(m,3h,ar-h
×
3),6.23(t,j=5.52hz,1h,nh),5.29(s,1h,ch),4.62(s,2h,ch2),4.21(s,1h,ch),3.82-2.80(m,2h,ch2),3.60(d,j=24.50hz,4h,ch2×
2),3.35-3.32(m,2h,ch2),2.88-2.66(s,5h,ch3&ch2),2.51-2.44(m,6h,ch2×
3),2.36-2.31(m,2h,
ch2),2.25(q,j=6.57hz,2h,ch2),2.14-2.08(m,1h,ch
2a
)1.42-1.25(m,17h,ch2×
8&ch
2b
);
13
c nmr(100mhz,cdcl3)δ171.65,171.30,169.50,168.64,167.58,166.13,157.14,156.44,153.00,146.97,140.71,136.04,134.41,132.80,132.44,128.87,128.82,128.72,116.58,114.88,111.28,109.81,74.20,67.52,58.33,55.40,53.40,52.50,51.48,50.91,48.80,48.95,42.43,42.31,31.37,29.64,29.17,29.08,28.92,28.90,28.60,28.49,27.31,27.16,26.54,25.24,22.81,22.64,17.07,14.08,13.43.hrms(esi
+
):m/z calculated for c
50h58
cln9o
10
s(m+h)+:980.3995;found 980.4091.
[0276]
实施例10
[0277]
gpx4蛋白降解剂mc10的合成
[0278]
(1)中间体的合成c9-12的合成
[0279]
将氟代沙利度胺(200mg,0.72mmol)溶于无水dmf(5ml),依次加入化合物c9-2(347mg,0.72mmol)和dipea(186mg,1.44mmol),90℃反应1h。反应毕,冷却至室温,向体系中加入冷水淬灭反应,用乙酸乙酯萃取三次,合并有机相,依次用饱和nacl溶液洗涤和无水na2so4干燥。柱分离(p/e=10/1-6/1),得白色固体(163mg,30%)。
[0280]
(2)gpx4蛋白降解剂的合成
[0281]
将c9-12(0.12g,0.16mmol)用10ml dcm溶解,加入1ml tfa,室温搅拌30min。反应结束后,减压除去溶剂得浅黄色液体混合物c9-11,不经分离进行下一步反应。将m6(82mg,0.16mmol)溶于dmf(10ml)中,依次加入hatu(91mg,0.24mmol)、dipea(70mg,0.48mmol)和上步粗产物,室温反应2h。反应毕,向体系中加入冷水淬灭反应液,用乙酸乙酯萃取三次,合并有机相,依次用饱和nacl溶液洗涤和无水na2so4干燥。柱分离(d/m=50/1-30/1),得到淡黄色固体(36mg,30%)。1h nmr(400mhz,cdcl3)δ8.64(s,1h,ar-h),7.81(d,j=7.73hz,1h,nh),7.38-7.33(m,4h,ar-h
×
4),7.31-7.28(m,2h,ar-h
×
2),7.25-7.20(m,4h,ar-h
×
4),6.84-6.80(m,2h,ar-h
×
2),5.05-4.98(m,1h,ch),4.80(dd,j=5.31,8.31hz,1h,ch),4.50(s,2h,ch2),4.57-4.53(m,1h,ch),4.19(s,1h,ch),3.80-3.77(m,2h,ch2),3.51(t,j=4.98hz,2h,ch2),3.42(s,10h,ch2×
5),3.32(t,j=5.01hz,2h,ch2),3.09(s,1h,nh),2.81(s,3h,ch3),2.62-2.56(m,1h,ch
2a
),2.49-2.44(m,6h,ch3&ch2&ch
2a
),2.39-2.32(m,7h,ch2×
3&ch
2b
),1.93-1.86(m,1h,ch
2b
),2.27(t,j=7.62hz,2h,ch2),1.44-1.41(m,7h,ch2×
2&ch2),1.23(s,10h,ch2×
5),0.98(s,9h,ch3×
3);
13
c nmr(100mhz,cdcl3)δ175.90,171.66,169.71,166.16,157.09,156.47,153.91,150.31,148.26,143.17,140.62,134.35,132.75,131.59,130.64,129.45,128.82,128.77,128.65,126.34,114.84,74.14,69.75,67.39,58.41,58.15,55.54,53.18,52.95,52.58,51.41,50.83,50.43,48.86,48.81,46.91,45.04,43.17,42.29,41.86,35.13,35.06,30.13,29.29,29.27,29.25,27.23,27.08,26.68,26.48,22.19,15.90,13.35.hrms(esi
+
):m/z calculated for c
60h79
cln
10
o9s(m+h)+:1151.5441;found 1151.5447.
[0282]
实施例11gpx4蛋白降解剂dc1的合成
[0283]
(1)中间体t6-2的合成
[0284]
将购得的t5-2所示结构的化合物(114mg,0.30mmol)溶于dmso(10ml),依次加入氟代沙利度胺(83mg,0.30mmol)和tea(63μl,0.45),130℃反应0.5h。反应毕,向体系中加入冷水淬灭反应,用乙酸乙酯萃取三次,合并有机相,依次用饱和nacl溶液洗涤和无水na2so4干
燥。柱层析分离(d/m=50/1-20/1),得亮黄色固体(77mg,44%)。
[0285]1h nmr(400mhz,cdcl3)δ8.44(s,1h,nh),7.48(t,j=7.80hz,1h,nh),7.08(d,j=7.12hz,1h,ar-h),6.87(d,j=8.52hz,1h,ar-h),6.64(t,j=5.03hz,1h,ar-h),4.90-4.94(m,1h,ch),4.07(brs,2h,ch2),3.33(q,j=6.38,11.02hz,2h,ch2),2.48-2.90(m,16h,ch2×
8),2.19(d,j=6.32hz,2h,ch2),2.08-2.13(m,1h,ch),1.17(d,j=13.77hz,2h,ch2),1.44(s,9h,ch3×
3),1.02-1.11(m,2h,ch2);
13
c nmr(100mhz,cdcl3)δ171.13,171.11,169.10,168.41,167.67,154.89,146.67,136.03,132.54,116.78,111.38,110.16,79.20,64.38,56.22,53.51,52.90,48.82,39.37,33.53,31.43,30.72,28.44,22.74.
[0286]
(2)中间体t7-2的合成
[0287]
将化合物t6-2(72mg,0.13mmol)溶于dcm,加入过量tfa(0.5ml),室温搅拌2h。反应毕,减压除去溶剂和多余的tfa,得黄色油状物(72mg),不经纯化直接进行下一步反应。
[0288]
(3)降解剂dc1的合成
[0289]
将化合物m6(67mg,0.13mmol)溶于dmf(10ml)中,依次加入hatu(59mg,0.15mmol)、dipea(25mg,0.19mmol)和化合物t7-2(63mg,0.13mmol),室温反应2h。反应毕,向体系中加入水淬灭反应液,用乙酸乙酯萃取三次,合并有机相,依次用饱和nacl溶液洗涤和无水na2so4干燥。柱分离(d/m=50/1-30/1),得到黄色固体(25mg,19%)。
[0290]1h nmr(400mhz,cdcl3)δ8.63(s,1h,nh),7.47(t,j=8.30hz,1h,ar-h),7.32(d,j=7.75hz,2h,ar-h),7.20-7.26(m,4h,ar-h),7.06(d,j=7.75hz,2h,ar-h),6.84-6.87(m,3h,ar-h),6.61-6.64(m,1h,nh),4.89-4.93(m,1h,ch),4.62(s,2h,ch2),4.21(s,1h,ch),3.80-3.82(m,2h,ch2),2.98-3.04(m,1h,ch
2a
),2.78-2.88(m,4h,ch
2b
&ch3),2.64-2.67(m,4h,ch2×
2),2.48-2.53(m,9h,ch2×
4&ch
2a
),2.34-2.36(brs,3h,ch
2b
&ch2),2.16-2.18(m,2h,ch2),2.08-2.12(m,1h,ch
2a
),1.68-1.82(m,4h,ch2×
2),1.42(s,2h,ch2),1.23-1.27(m,2h,ch2),1.07-1.13(m,2h,ch2),0.82-0.93(m,1h,ch);
13
c nmr(100mhz,cdcl3)δ171.69,171.26,169.13,168.53,167.67,166.10,157.36,156.50,153.04,146.66,140.79,136.06,134.29,132.82,132.54,128.93,128.87,128.85,128.77,116.80,114.95,111.40,110.18,74.26,67.62,64.03,56.21,53.45,52.83,51.53,50.95,48.85,47.01,45.44,42.39,39.36,33.49,31.46,31.30,30.39,29.69,28.43,28.40,22.77,13.47.m.p.132-133℃.hrms(esi
+
):m/z calculated for c
49h55
cln
10o10
(m+h)
+
:979.3791;found 979.3864.
[0291]
实施例12gpx4蛋白降解剂dc2的合成
[0292]
(1)中间体t1-3的合成
[0293]
将邻苯二甲酰亚胺(3000mg,20.39mmol)、无水k2co3(8454mg,61.17mmol)、四丁基溴化铵(197mg,0.61mmol)依次加入dmf(40ml)中,混匀。加入1,3-二溴丙烷(4940mg,24.47mmol),室温反应3h。反应毕,向体系中加入水淬灭反应,用乙酸乙酯萃取三次,合并有机相,依次用饱和nacl溶液洗涤和无水na2so4干燥。柱层析分离(p/e=10/1-3/1),得白色固体(3827mg,70%)。
[0294]1h nmr(400mhz,cdcl3)δ7.76-7.80(m,2h,ar-h),7.65-7.69(m,2h,ar-h),3.77(t,j=6.96hz,2h,ch2),3.36(t,j=6.72hz,2h,ch2),2.20(quint,j=6.80hz,6.76hz,2h,ch2);
13
c nmr(100mhz cdcl3)δ168.15,134.03,131.94,123.26,36.68,31.62,29.93.
[0295]
(2)中间体t2-3的合成
[0296]
将t1-3(1000mg,3.73mmol)、1-boc哌嗪(834mg,4.48mmol)和k2co3(1289mg,9.32mmol)依次加入到乙腈(30ml)中,混匀,逐滴加入三乙胺(16μl,0.11mmol),85℃回流12h。反应毕,向体系中加入水淬灭反应,用乙酸乙酯萃取三次,合并有机相,依次用饱和nacl溶液洗涤和无水na2so4干燥。柱层析分离(p/e=10/1-3/1),得白色固体(1300mg,93%)。
[0297]1h nmr(400mhz,cdcl3)δ7.79-7.83(m,2h,ar-h),7.67-7.71(m,2h,ar-h),3.75(t,j=6.60hz,ch2),3.23(t,j=5.20hz,ch2),2.39(t,j=7.00hz,ch2),2.27-2.29(m,4h,ch2×
2),1.84(quint,j=6.80,6.76hz,2h,ch2),1.41(s,9h,ch3×
3);
13
c nmr(100mhz,cdcl3)δ177.57,157.34,143.56,131.41,118.45,83.95,56.07,51.66,34.53,29.89,22.14.
[0298]
(3)中间体t3-3的合成
[0299]
将化合物t2-3(3.60g,9.64mmol)溶于dcm(30ml),加入过量tfa(3ml),室温反应2h。反应毕,减压除去溶剂和剩余的tfa,向其中加入水并用ea萃取,弃去有机相,向水相中加入1n naoh溶液调节ph至碱性,用ea萃取三次,收集有机相并用无水na2so4干燥。减压除去溶剂,得淡黄色固体(2.64g,99%),不经纯化直接进行下一步反应。
[0300]
(4)中间体t4-3的合成
[0301]
将化合物t3-3(2.64g,9.64mmol)溶于乙腈(30ml),依次加入k2co3(3.33g,24.1mmol)、1-boc-4溴甲基哌啶(2.07g,10.60mmol)和ki(0.48g,2.89mmol),85℃回流过夜。反应毕,向体系中加入冷水淬灭反应,用乙酸乙酯萃取三次,合并有机相,依次用饱和nacl溶液洗涤和无水na2so4干燥。柱层析分离(p/e=10/1-3/1),得淡黄色固体(1.90g,42%)。
[0302]1h nmr(400mhz,cdcl3)δ7.81-7.85(m,2h,ar-h),7.69-7.73(m,2h,ar-h),4.06(brs,2h,ch2),3.75(t,j=6.92hz,ch2),2.65(t,j=13.04hz,ch2),2.26-2.42(m,8h,ch2×
4),2.04(d,j=7.08hz,2h,ch2),1.82-1.89(m,2h,ch2),1.67(d,j=13.16hz,2h,ch2),1.54-1.59(m,1h,ch),1.43-1.46(m,11h,ch3×
3&ch2),0.97-1.07(m,2h,ch2);
13
c nmr(100mhz,cdcl3)δ168.46,154.89,133.78,132.33,123.13,80.13,64.49,56.05,53.48,53.11,35.90,33.90,31.39,27.85,24.87.
[0303]
(5)中间体t5-3的合成
[0304]
将化合物t4-3(750mg,1.59mmol)溶于乙醇,加入80%水合肼(161mg,3.17mmol),80℃回流5h。反应毕,减压除去溶剂,得黄白色固体(250mg,46%),不经纯化直接进行下一步反应。
[0305]
(6)中间体t6-3的合成
[0306]
操作及处理同化合物t6-2,得亮黄色固体(210mg,48%)。
[0307]1h nmr(400mhz,cdcl3)δ8.75(s,1h,nh),7.46(t,j=8.08hz,1h,nh),7.06(d,j=7.04hz,1h,ar-h),6.91(d,j=8.53hz,1h,ar-h),6.41(t,j=5.82hz,1h,ar-h),4.88-4.92(m,1h,ch),4.06(brs,2h,ch2),3.32(q,j=6.09,12.70hz,2h,ch2),2.46-2.88(m,16h,ch2×
8),2.17(d,j=6.76hz,2h,ch2),1.78-1.85(m,2h,ch2),1.70(d,j=12.75hz,2h,ch2),1.59-1.65(m,1h,ch),1.44(s,9h,ch3×
3),1.00-1.10(m,2h,ch2);
13
c nmr(100mhz,cdcl3)δ171.27,169.35,168.56,167.64,154.91,146.97,136.03,132.54,116.72,111.37,109.94,79.21,64.47,55.75,53.39,53.18,48.86,41.04,33.53,31.45,30.76,28.47,26.29,
22.82.
[0308]
(7)中间体t7-3的合成
[0309]
操作及处理同化合物t7-2,得黄色油状物(158mg),不经纯化直接进行下一步反应。
[0310]
(8)gpx4蛋白降解剂dc2的合成
[0311]
操作及处理同化合物dc1,得黄色固体(92mg,29%)。
[0312]1h nmr(400mhz,cdcl3)δ8.40(s,1h,nh),7.47(t,j=7.90hz,1h,ar-h),7.32(d,j=8.46hz,2h,ar-h),7.23-7.25(m,4h,ar-h),7.07(d,j=7.00hz,2h,ar-h),6.92(d,j=7.31hz,1h,ar-h),6.92(d,j=8.80hz,2h,ar-h),6.61-6.64(m,1h,nh),4.88-4.92(m,1h,c h),4.62(s,2h,ch2),4.21(s,1h,ch),3.80-3.83(m,2h,ch2),2.98-3.04(m,1h,ch
2a
),2.80-2.89(m,4h,ch
2b
&ch3),2.70-2.77(m,2h,ch2),2.50-2.64(m,2h,ch2),2.44-2.51(m,11h,ch2×
5&ch
2a
),2.34-2.36(brs,3h,ch
2b
&ch2),2.09-2.23(m,4h,ch2×
2),1.76-1.86(m,6h,ch2×
3),1.42(s,2h,ch2),1.03-1.13(m,2h,ch2),0.86-0.89(m,1h,ch);
13
c nmr(100mh z,cdcl3)δ171.67,171.05,169.34,168.42,167.61,166.08,157.41,156.50,153.08,146.96,140.81,136.07,134.30,132.86,132.54,128.95,128.88,116.74,114.98,111.42,109.95,74.29,67.71,64.11,55.83,53.34,53.14,51.54,50.97,48.85,47.01,45.44,42.38,41.10,33.49,31.42,31.31,30.39,26.19,22.83,13.47.m.p.132-133℃;hrms(esi
+
):m/z calculated for c
50h57
cln
10o10
(m+h)
+
:993.3948;found 993.4053.
[0313]
实施例13~15gpx4蛋白降解剂dc3~dc5的合成
[0314]
实施例13~15与实施例12的区别在于,在制备中间体t1-3时的起始原料n值的不同。
[0315]
gpx4蛋白降解剂dc3的谱图数据:1h nmr(400mhz,cdcl3)δ7.86(s,1h,nh),7.58(t,j=8.04hz,1h,ar-h),7.42-7.45(m,1h,ar-h),7.27-7.37(d,j=8.46hz,2h,ar-h),7.12(d,j=8.72hz,1h,ar-h),7.03(d,j=7.05hz,1h,ar-h),6.79-6.86(m,2h,ar-h),6.58(s,1h,nh),5.03-5.07(m,1h,ch),4.73(s,2h,ch2),4.37(s,1h,ch),2.85-2.98(m,3h,ch2&ch
2a
),2.80-2.88(m,1h,ch
2b
),2.56-2.61(m,2h,ch2),2.49-2.51(m,17h,ch2×
8&ch
2a
),2.38-2.42(m,3h,ch
2b
&ch2),1.57-1.73(m,9h,ch2×
4&ch
2a
),1.17-1.23(m,2h,ch2),0.86-1.04(m,4h,ch
2b
&ch2&ch);
13
c nmr(100mhz,dmso-d6)δ172.50,172.08,169.62,168.47,166.70,166.53,158.60,155.96,148.87,144.74,139.98,135.11,134.71,132.37,132.23,129.51,129.33,129.06,123.47,120.58,120.37,115.80,114.07,74.06,66.47,63.73,56.53,53.27,52.42,51.92,51.34,45.85,43.87,32.95,29.89,28.94,27.29,24.96,24.67,13.78.m.p.125-126℃.hrms(esi
+
):m/z calculated for c
51h59
cln
10o10
(m+h)
+
:1007.4104;found 1007.4211.
[0316]
gpx4蛋白降解剂dc4的谱图数据:1h nmr(400mhz,cdcl3)δ8.40(s,1h,nh),7.47(t,j=7.90hz,1h,ar-h),7.32(d,j=8.15hz,2h,ar-h),7.21-7.28(m,4h,ar-h),7.11(d,j=7.20hz,2h,ar-h),6.82(d,j=7.31hz,1h,ar-h),6.77(d,j=8.80hz,2h,ar-h),6.62-6.69(m,1h,nh),4.63-4.92(m,1h,ch),4.62(s,2h,ch2),4.21(s,1h,ch),3.81-3.83(m,2h,ch2),2.98-3.04(m,1h,ch
2a
),2.80-2.89(m,4h,ch
2b
&ch3),2.70-2.77(m,2h,ch2),2.50-2.64(m,2h,ch2),2.44-2.51(m,15h,ch2×
7&ch
2a
),2.34-2.36(brs,3h,ch
2b
&ch2),2.09-2.23(m,4h,
ch2×
2),1.76-1.86(m,6h,ch2×
3),1.42(s,2h,ch2),1.03-1.15(m,2h,ch2),0.84-0.89(m,1h,ch);
13
c nmr(100mhz,cdcl3)δ172.58,172.44,169.63,168.47,166.70,166.56,158.60,155.98,148.87,144.74,139.97,135.11,134.71,132.37,132.29,129.51,129.33,129.06,123.77,120.58,120.37,115.80,114.07,74.06,66.47,63.73,55.82,53.27,52.42,51.92,51.34,45.85,44.05,43.87,32.95,29.88,29.04,28.94,26.68,25.44,24.67,13.78.m.p.135-136℃.hrms(esi
+
):m/z calculated for c
52h62
cln
10o10
(m+h)
+
:1021.4261;found 1021.4364.
[0317]
gpx4蛋白降解剂dc5的谱图数据:1h nmr(400mhz,cdcl3)δ7.50(t,j=7.90hz,1h,ar-h),7.35(d,j=8.51hz,2h,ar-h),7.23-7.28(m,4h,ar-h),7.07-7.11(m,2h,ar-h),6.85-6.91(m,3h,ar-h),6.21-6.24(m,1h,nh),4.90-4.94(m,1h,ch),4.64-4.68(m,2h,ch2),4.51-4.54(m,1h,ch),3.82-3.91(m,2h,ch2),3.25-3.30(m,2h,ch2),2.86(s,3h,ch3),2.64-2.78(m,4h,ch2×
2),2.51-2.67(m,8h,ch2×
4),2.12-2.25(m,2h,ch2),1.72-1.85(m,4h,ch2×
2),1.63-1.70(m,6h,ch2×
3),1.39-1.49(m,6h,ch2×
3),1.27(s,2h,ch2),1.04-1.12(m,2h,ch2),0.88-0.91(m,1h,ch);
13
c nmr(100mhz,cdcl3)δ171.75,171.35,169.62,168.83,167.56,166.18,157.36,156.54,153.06,146.98,140.82,136.23,134.40,132.84,132.47,129.53,129.22,128.95,128.87,128.79,128.43,116.77,115.03,114.70,111.47,109.87,74.25,63.60,52.71,52.09,51.53,50.95,48.84,48.01,47.00,42.39,31.35,29.69,28.73,26.42,25.90,22.89,18.08,13.46.m.p.131-132℃.hrms(esi
+
):m/z calculated for c
53h63
cln
10o10
(m+h)
+
:1035.4417;found 1035.4524.
[0318]
实施例14gpx4蛋白降解剂tc1的合成
[0319]
(1)中间体d1合成
[0320]
将1-boc哌嗪(200mg,1.07mmol)溶于ch3cn(15ml)中,依次加入n-boc溴甲基哌啶(300mg,1.07mmol)、k2co3(220mg,1.60mmol)、85℃回流过夜。反应毕,向体系中加入水淬灭反应,用乙酸乙酯萃取三次,合并有机相,依次用饱和nacl溶液洗涤和无水na2so4干燥。柱层析分离(p/e=10/1-3/1),得白色固体(224mg,56%)。
[0321]1h nmr(400mhz,cdcl3)δ7.34-7.37(m,4h,ar-h),7.26-7.30(m,1h,ar-h),5.17(s,2h,ch2),3.65-3.72(m,2h,ch2),3.24-3.41(m,6h,ch2×
3),2.36-2.60(m,6h,ch2×
3),1.72-1.85(m,5h,ch2×
2&ch),1.42(s,9h,ch3×
3);
13
c nmr(100mhz,cdcl3)δ
13
155.74,155.12,136.65,128.47,128.41,128.36,79.41,67.00,63.73,52.99,44.01,43.81,32.96,28.77,28.39.
[0322]
(2)中间体d2的合成
[0323]
将d3(100mg,0.24mmol)溶于meoh(5ml),加入催化剂量的pd/c(0.1eq),置于氢化仪中,通入高纯度氢气,室温搅拌3h。反应毕,经硅藻土过滤,收集滤液,减压蒸馏除去溶剂,得灰白色固体残渣,不经纯化,直接投下一步反应。
[0324]
(3)中间体d3的合成
[0325]
将d2(50mg,0.18mmol)溶于dmso(10ml),依次加入购得的氟代沙利度胺(52mg,0.18mmol)、tea(30mg,0.27mmol),90℃回流1h。反应毕,向其中加入水并用ea萃取,收集有机相,用饱和氯化钠溶液洗涤三次并用无水na2so4干燥。减压除去溶剂,经柱层析(d/m=50/1)得黄色固体(68mg,45%)。
[0326]1h nmr(400mhz,cdcl3)δ8.44(s,1h,nh),7.48(t,j=7.80hz,1h,nh),7.08(d,j=7.12hz,1h,ar-h),6.87(d,j=8.52hz,1h,ar-h),6.64(t,j=5.03hz,1h,ar-h),4.90-4.94(m,1h,ch),4.07(brs,2h,ch2),3.33(q,j=6.38,11.02hz,2h,ch2),2.48-2.94(m,12h,ch2×
6),2.19(d,j=6.32hz,2h,ch2),2.08-2.13(m,1h,ch),1.17(d,j=13.77hz,2h,ch2),1.44(s,9h,ch3×
3),1.02-1.11(m,2h,ch2);
13
c nmr(100mhz,cdcl3)δ172.08,169.61,167.63,166.37,155.12,143.07,133.39,133.24,123.22,122.08,117.03,79.41,63.73,53.12,51.03,50.39,44.01,32.96,29.89,28.77,28.39,24.67.
[0327]
(4)中间体d4的合成
[0328]
将d3(100mg,0.18mmol)溶于dcm,加入过量tfa(0.5ml),室温搅拌2h。反应毕,减压除去溶剂和多余的tfa,得黄色油状物(102mg),不经纯化直接进行下一步反应。
[0329]
(5)中间体d5的合成
[0330]
将d4(150mg,0.24mmol)溶于ch3cn(10ml),依次加入n-boc-溴甲基哌啶(66mg,0.24mmol),k2co3(50mg,0.36mmol),85℃回流过夜。反应毕,加入冷水淬灭反应,用乙酸乙酯萃取三次,合并有机相,依次用饱和nacl溶液洗涤和无水na2so4干燥。柱分离(d/m=30/1)得亮黄色固体(84mg,42%)。
[0331]1h nmr(400mhz,cdcl3)δ7.85-7.87(m,1h,ar-h),7.52(t,j=6.72hz,1h,ar-h),7.21(dd,j=1.05,7.48hz,1h,ar-h),5.49(t,j=3.60hz,1h,ch),3.65-3.72(m,2h,ch2),3.20-.330(m,6h,ch2×
3),2.48-2.71(m,14h,ch2×
7),2.16-2.22(m,1h,ch
2a
),1.46-1.85(m,11h,ch
×
2&ch
2b
&ch2×
4),1.42(s,9h,ch3×
3);
13
c nmr(100mhz,cdcl3)δ172.08,169.61,167.63,166.37,155.12,143.07,133.39,133.24,123.22,122.08,117.03,79.41,63.88,63.72,53.53,53.12,51.03,50.39,44.01,33.15,33.00,29.89,29.27,28.77,28.39,24.67.
[0332]
(6)gpx4蛋白降解剂tc1的合成
[0333]
将d5(80mg,0.13mmol)溶于dcm(5ml),加入过量tfa(0.5ml),室温搅拌2h。反应毕,减压除去溶剂和多余的tfa,得黄色油状物,不经纯化直接进行下一步反应。将上述油状物溶于dmf,依次加入m6(67mg,0.13mmol)、hatu(74mg,0.19mmol)和dipea(25mg,0.19mmol),室温搅拌过夜。反应毕,向体系中加入冷水淬灭反应液,用乙酸乙酯萃取三次,合并有机相,依次用饱和nacl溶液洗涤和无水na2so4干燥。柱分离(d/m=50/1-30/1),得到黄色固体(54mg,40%)。
[0334]1h nmr(400mhz,cdcl3)δ7.86(dd,j=1.28,7.12hz,1h,ar-h),7.52(t,j=7.36hz,1h,ar-h),7.39-7.41(m,2h,ar-h),7.30-7.33(m,2h,ar-h),7.21(dd,j=1.19,7.37hz,1h,ar-h),7.14-7.16(m,2h,ar-h),6.92-6.95(m,2h,ar-h),5.49(t,j=3.41hz,1h,ch),4.79(s,2h,ch2),4.34-4.35(m,2h,ch2),3.82-3.89(m,2h,ch2),3.69-3.75(m,2h,ch2),3.58-3.64(m,2h,ch2),3.36-3.43(m,4h,ch2×
2),3.26-3.28(m,2h,ch2),3.20-3.22(m,4h,ch2×
2),2.72(s,3h,ch3),2.49-2.69(m,13h,ch&ch2×
6),2.16-2.22(m,1h,ch
2a
),1.64-1.81(m,11h,c h
2b
&ch2×
5);
13
c nmr(100mhz,cdcl3)δ172.50,172.08,169.61,168.47,167.63,166.37,158.60,155.96,148.87,143.07,139.98,135.11,134.71,133.39,133.24,129.51,129.33,129.06,123.47,123.22,122.08,117.03,115.80,74.06,66.47,63.90,63.72,53.53,53.12,51.92,51.03,50.39,45.85,43.87,33.15,33.02,29.89,29.27,28.94,
24.67,13.78.
[0335]
实施例15gpx4蛋白降解剂tc2的合成
[0336]
将l4所示结构的化合物(120mg,0.23mmol)溶于dcm(5ml),加入过量tfa(0.5ml),室温搅拌2h。反应毕,减压除去溶剂和多余的tfa,得黄色油状物,不经纯化直接进行下一步反应。将上述油状物溶于dmf,依次加入m6(118mg,0.23mmol)、hatu(131mg,0.34mmol)和dipea(45mg,0.34mmol),室温搅拌过夜。反应毕,向体系中加入冷水淬灭反应液,用乙酸乙酯萃取三次,合并有机相,依次用饱和nacl溶液洗涤和无水na2so4干燥。柱分离(d/m=50/1-30/1),得到黄色固体(72mg,30%)。
[0337]1h nmr(400mhz,cdcl3)δ8.51(d,j=7.79hz,1h,nh)7.86(dd,j=1.28,7.12hz,1h,ar-h),7.52(t,j=7.36hz,1h,ar-h),7.39-7.41(m,2h,ar-h),7.30-7.33(m,2h,ar-h),7.21(dd,j=1.19,7.37hz,1h,ar-h),7.14-7.16(m,2h,ar-h),6.92-6.95(m,2h,ar-h),5.49(t,j=3.41hz,1h,ch),4.77(s,2h,ch2),4.34-4.36(m,2h,ch2),3.82-3.89(m,2h,ch2),3.69-3.75(m,2h,ch2),3.58-3.64(m,2h,ch2),3.36-3.45(m,4h,ch2×
2),3.26-3.28(m,2h,ch2),3.20-3.22(m,4h,ch2×
2),2.72(s,3h,ch3),2.49-2.69(m,13h,ch&ch2×
6),2.16-2.22(m,1h,ch
2a
),1.64-1.88(m,11h,ch
2b
&ch2×
5);
13
c nmr(100mhz,cdcl3)δ172.50,172.08,169.62,168.47,166.78,166.53,158.60,155.96,148.87,144.29,139.98,135.11,134.71,132.60,132.06,129.51,129.33,129.06,123.47,121.61,120.80,115.80,114.49,74.06,66.47,63.90,63.81,53.53,51.92,51.34,51.27,50.74,45.85,43.87,33.16,33.02,31.31,29.89,29.27,28.94,24.67,13.78.
[0338]
测试例生物活性评价
[0339]
(1)化合物降解作用评价
[0340]
通过wb方法,检测了不同浓度的化合物在ht1080细胞中作用6h及24h后对gpx4蛋白的降解作用,如图1所示。图1中,(a)为单环gpx4降解剂的降解活性;(b)(d)为mc3以浓度依赖和时间依赖的方式降解gpx4;(c)双环gpx4降解剂1μm浓度的降解活性;(e)双环gpx4降解剂0.1μm浓度的降解活性;(f)三环gpx4降解剂1μm浓度的降解活性。
[0341]
由图1可以看出,单环gpx4降解剂中mc3具有最优降解效果,且可以浓度依赖和时间依赖的方式降解gpx4,双环降解剂效果普遍优于单环及三环降解剂,且以dc2活性最优。
[0342]
(2)dc2的降解活性与浓度和时间的关系
[0343]
dc2的降解活性与浓度和时间的关系如图2所示,图2中,(a)(b)不同浓度的dc2在ht1080细胞中作用24h对gpx4蛋白水平的影响;(c)(d)0.1μm dc2在ht1080细胞中作用不同时间对gpx4的降解作用。
[0344]
在选定dc2后,研究其降解活性与浓度和时间的关系。我们梯度设置了6个给药浓度,给药24h后观察条带变化,所得结果如图2中的(a)、(c)所示。结果表明,dc2的降解作用具有浓度依赖性,在ht1080细胞中的dc
50
为0.03μm,浓度为0.3μm时对gpx4的降解较彻底。
[0345]
dc2的降解作用与时间的关系如图2中的(b)、(d)所示。在8个时间点(0.5、1、2、4、6、8、12、24h)分别给予相同浓度的dc2(0.1μm),然后观察条带变化。结果表明,随着时间的延长,gpx4水平逐渐降低,当给药时间为12h时,dc2能够降解超过80%的gpx4。基于上述实验结果可以肯定,dc2的降解作用具有浓度依赖和时间依赖的特点。
[0346]
(3)dc2对细胞增殖的抑制作用评估
[0347]
图3为dc2对细胞增殖的抑制作用评估结果,图3中(a)为dc2和ml210对hek293t细胞增殖的抑制作用;(b)为dc2和ml210对ht1080细胞增殖的抑制作用。
[0348]
选择hek293t(人胚肾细胞)来评估dc2对正常细胞的毒性作用,同时选择ml210作为阳性对照。通过mtt方法测定不同浓度的dc2和ml210对hek293t细胞增殖的抑制率,并利用graphpad prism 8计算出相应的ic
50
值,所得结果如图3中(a)所示。结果显示,dc2的ic
50
值为1.07μm,而ml210的ic50值为0.22μm,说明降解剂对hek293t的毒性作用较抑制剂毒性变小。
[0349]
随后评估dc2在肿瘤细胞中的抗增殖作用,选用的细胞系为ht1080(人纤维肉瘤细胞),dc2和ml210对ht1080细胞增殖的抑制作用如图3中(b)所示。可以看出,dc2的ic
50
值为0.3μm,与ml210(0.1μm)相当。
[0350]
(4)dc2在小鼠体内的药动学研究
[0351]
为了评估dc2在体内的药代动力学性质并探究后续药效学实验的给药方式和给药剂量,本发明选择icr小鼠进行了药动学实验。将小鼠按给药方式随机分成两个大组,一组采用口服给药(给药剂量为10mg/kg),另一组采用尾静脉注射给药(给药剂量为1mg/kg)。然后在7个时间点(5min,15min,30min,1h,2h,4h,6h,8h,24h)进行取血并检测dc2的浓度。结果如表1所示。
[0352]
表1dc2不同给药方式的体内药动学参数
[0353][0354]cmax
:达峰浓度;t
max
:达峰时间;t
1/2
:末端消除半衰期;auc:药时曲线下面积;vz:表观分布容积;cl:清除率;mrt:平均驻留时间;*:数据未检测;
[0355]
基于上述结果,选择尾静脉注射作为下一步药效学研究的给药方式。
[0356]
(5)dc2在异种移植肿瘤小鼠体内的药效学研究
[0357]
为了探究dc2在动物水平上的抗肿瘤效果,本发明构建异种移植人纤维肉瘤(ht1080)的小鼠模型。将dc2按照20mg/kg对荷瘤小鼠尾静脉注射,在指定时间点(3、6、12、24、48h)获取肿瘤组织,并提取蛋白进行western blotting实验,dc2对异种移植人纤维肉瘤(ht1080)组织中gpx4的降解作用与给药时间的关系如图4所示。结果显示,dc2给药6h已表现出对gpx4的降解作用,在给药12h后达到最大降解,降解活性可以维持至少48h。
[0358]
为探究dc2的安全性,本发明设置了三个给药浓度(5mg/kg、20mg/kg、40mg/kg),另
设阳性药组(ml210,3mg/kg)和空白对照组(生理盐水),尾静脉注射给药,每两天给药一次,同时测量小鼠体重。多次给药后小鼠体重的变化如图5所示。可以看出,尽管ml210有效抑制了肿瘤的生长,但导致小鼠体重明显下降,而dc2对体重几乎没有影响,表明dc2具有优于ml210的安全性。
[0359]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1