外泌体的生产及其用途的制作方法
本发明涉及一种大量生产外泌体的方法,其通过使用循环拉伸生物反应器来刺激细胞释放外泌体。此外,本发明涉及一种具有癌症特异性抗hla-g蛋白的外泌体。
背景技术:
1、近年来,各制药公司投入大量资源来开发新型药物载体,期望能够更高效、更精准地递送小分子或生物制剂。由于外泌体具有低免疫原性、良好的生物相容性、生物活性、对细胞的低排斥性、以及针对微环境的纳米尺寸,因此长久以来被视为药物载体的最佳候选者。除了上述优势以外,外泌体还拥有其他的显著特性,例如亲和力高、易被目标细胞吞噬、易于在细胞内降解和释放药物,并且能避免被免疫系统消耗等。
技术实现思路
1、本发明提供一种促进外泌体生产的方法,其包含:(a)提供循环拉伸生物反应器(cyclic tensile bioreactor),其中所述循环拉伸生物反应器包含培养槽(culturechamber)、具有拉胀结构(auxetic structure)的生物相容性聚合物材料(biocompatiblepolymeric material)和多个拉伸组件(tensile component),所述生物相容性聚合物材料和所述多个拉伸组件置于所述培养槽内,所述生物相容性聚合物材料包含生产外泌体的细胞,并且所述生物相容性聚合物材料的两端与所述多个拉伸组件连接;(b)所述多个拉伸组件重复拉伸所述生物相容性聚合物材料以施加循环拉伸力(cyclic tensile force);以及(c)收集因受所述多个拉伸组件施加的循环拉伸力而从所述生产外泌体的细胞所释放的外泌体。
2、本发明还提供一种外泌体,其包含融合蛋白,其中所述融合蛋白包含靶向蛋白和外泌体跨膜蛋白(exosomal transmembrane protein),以及所述靶向蛋白包含抗hla-g蛋白。本发明进一步提供一种治疗患有癌症的个体的方法,包含施用组合物至所述患有癌症的个体,其中所述组合物包括治疗性外泌体,且所述治疗性外泌体包含上述融合蛋白和抗癌剂。
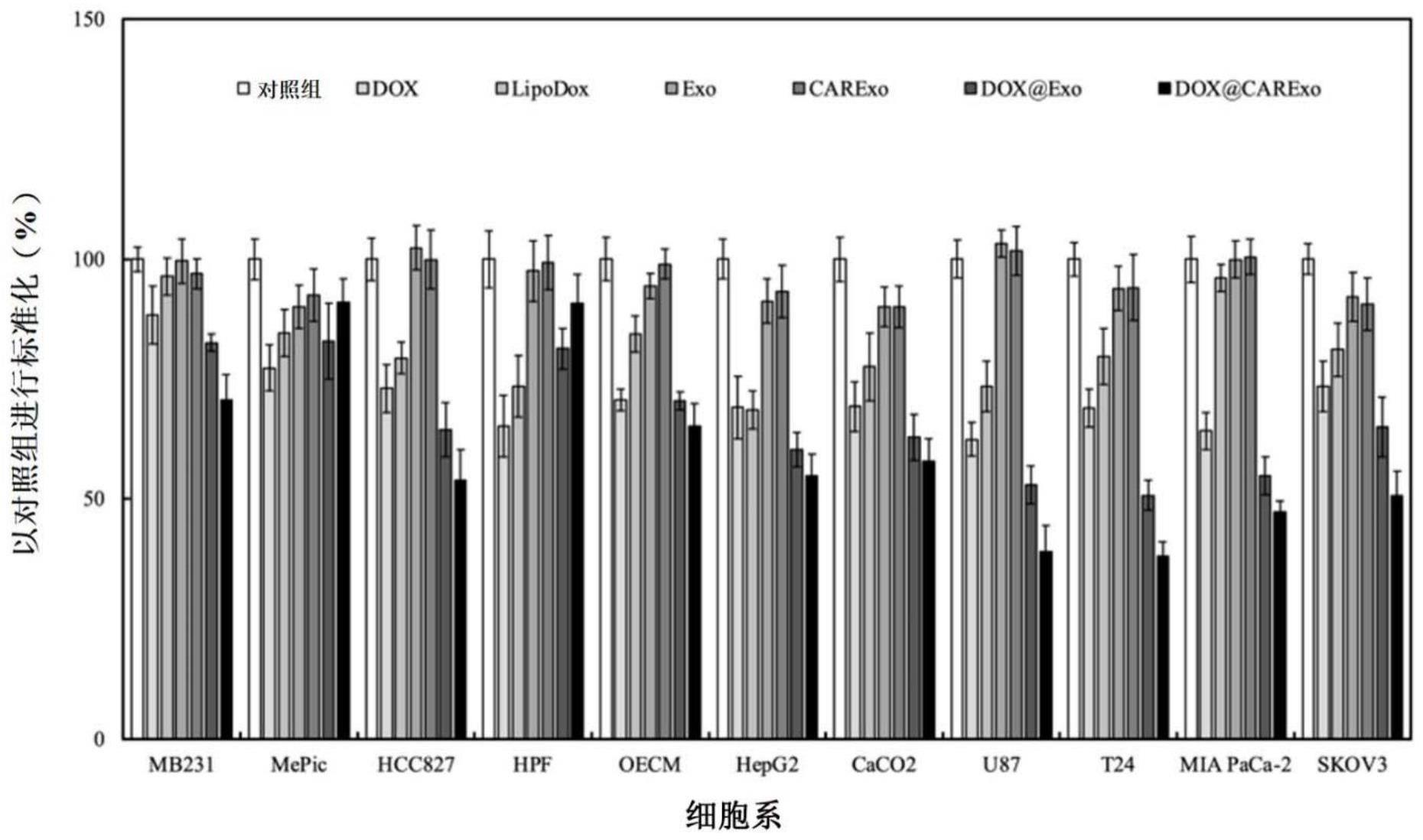
3、本发明通过调整亲代细胞培养参数,建立一个高质量、可量产、经工程化修饰的外泌体平台。经由3d动态刺激过程,亲代细胞(hek 293)能分泌大量高纯度外泌体的生物产物。在本发明中,构建了三个平台,包括靶向hla-g的基因修饰膜、外泌体量产系统以及载药设计的结合。本发明能够达到数项成果:(1)在动态培养环境下,hek293分泌的外泌体量可以产生45-300倍、高度表达cd63的外泌体,其可以为治疗方面提供高质量和高数量的外泌体;(2)由于化疗药物载量低,因此能高效率、无副作用的杀死癌细胞;(3)carexo携带抗hla-g蛋白以及mirna 34a,因此能够抑制肿瘤的恶化,和推迟肿瘤转移进程;以及(4)在动物模型中,carexo展现良好的肿瘤大小控制且无癌细胞转移。本发明认为carexo具有成为未来患者的有效抗癌武器的高潜力,并且有巨大的潜力和商机。
4、本文所用的术语“一”或“一个/一种”是用于描述本发明的要素和组件。此术语仅用于方便描述和提供本发明的基本构想。此描述应理解为包括一个或至少一个,除非明确另有说明,否则单数也包括复数。当在本技术中与单词“包含/包括/具有”合并使用时,术语“一种/一个”可以表示一种/一个或超过一种/一个。
5、在本技术中使用的术语“或”,表示“和/或”,除非明确指出仅表示其他选项,或除非其他选项彼此不兼容。
6、本发明提供一种促进外泌体生产的方法,其包含:(a)提供循环拉伸生物反应器,其中所述循环拉伸生物反应器包含培养槽、具有拉胀结构的生物相容性聚合物材料和多个拉伸组件,所述生物相容性聚合物材料与所述多个拉伸组件置于所述培养槽内,所述生物相容性聚合物材料包含生产外泌体的细胞,并且该所述生物相容性聚合物材料的两端与所述多个拉伸组件连接;(b)所述多个拉伸组件重复拉伸所述生物相容性聚合物材料以施加循环拉伸力;以及(c)收集因受所述多个拉伸组件施加的循环拉伸力而从所述生产外泌体的细胞所释放的外泌体。
7、在一个具体实施方案中,所述生物相容性聚合物材料包含基于甲基丙烯酰基的聚合物(methacryloyl-based polymer)。在一个优选的具体实施方案中,所述基于甲基丙烯酰基的聚合物包含甲基丙烯酰化明胶(gelatin methacryloyl,gelma)、甲基丙烯酰化胶原(collagen methacryloyl)、甲基丙烯酰化透明质酸(hyaluronic acid methacryloyl,hama)、甲基丙烯酰化硫酸软骨素(chondroitin sulfate methacryloyl)、甲基丙烯酰化壳聚糖(chitosan methacryloyl)、甲基丙烯酰化海藻酸盐(alginate methacryloyl)或具有甲基丙烯酰基的脱细胞胞外基质(decellularized extracellular matrix withmethacryloyl,decmma)。在一个更优选的具体实施方案中,所述甲基丙烯酰化明胶包含甲基丙烯酰化鱼明胶(fish gelatin methacryloyl,fgelma)或甲基丙烯酰化猪明胶(porcine gelatin methacryloyl,pgelma)。此外,所述甲基丙烯酰化明胶是由来自鱼或猪的明胶、甲基丙烯酸酐(methacrylic anhydride)和溶液(例如磷酸盐缓冲溶液)进行制备。因此,所述基于甲基丙烯酰基的聚合物是可生物降解的且具备生物相容性。
8、在本发明中,所述生物相容性聚合物材料的浓度会影响所述生物相容性聚合物材料的拉胀功能,而拉胀功能会进一步影响外泌体的生产。因此,本发明使用不同浓度的生物相容性聚合物材料来影响外泌体的产量。例如,gelma的浓度范围是5 wt%至30 wt%,甲基丙烯酰化海藻酸盐的浓度范围是1 wt%至10 wt%,甲基丙烯酰化胶原的浓度范围是0.5 wt%至10 wt%,hama的浓度范围是1 wt%至10 wt%,decmma的浓度范围是1 wt%至10 wt%。在一个具体的实施方案中,所述生物相容性聚合物材料的浓度范围为0.1 wt%至50 wt%。在一个优选的具体实施方案中,所述生物相容性聚合物材料的浓度范围为0.2 wt%至40 wt%。在一个更优选的具体实施方案中,所述生物相容性聚合物材料的浓度范围为0.5 wt%至30 wt%。
9、在本发明中,可以通过稀释来调节所述生物相容性聚合物材料的浓度。例如,如果所述生物兼容性聚合物材料是fgelma,可以混合20克的fgelma与80克的蒸馏水来制备出20wt%的fgelma。
10、此外,所述具有拉胀结构的生物相容性聚合物材料能够承受所述拉伸组件所施加的至少5%拉伸形变(tensile strain)而不被撕裂。在一个具体实施方案中,所述具有拉胀结构的生物相容性聚合物材料的机械强度可承受2.5-50%的拉伸形变。在一个优选的具体实施方案中,所述具有拉胀结构的生物相容性聚合物材料的机械强度可承受5-40%的拉伸形变。在一个更优选的具体实施方案中,所述具有拉胀结构的生物相容性聚合物材料的机械强度可承受10-30%的拉伸形变。
11、在一些方面,术语“拉伸形变”定义为因施加拉伸力或压力(stress)而导致固体变形或伸长。换句话说,当施加的力试图拉伸物体时,而造成物体的长度增加时,就产生拉伸形变。拉伸形变可以用以下的数学公式表示:ε=δl/l,其中ε=拉伸形变,δl=长度变化,l=原始长度。
12、在本发明中,所述生物相容性聚合物材料被设计成两端比身体宽的哑铃形状。因此,所述生物相容性聚合物材料可以分为两个部分:一个部分为具有拉胀结构的第一聚合物材料,另一个部分则包含两个具有刚性结构的第二聚合物材料。因此,每个所述具有刚性结构的第二聚合物材料的机械强度都高于所述具有拉胀结构的第一聚合物材料的机械强度。这两个第二聚合物材料会分别连接到所述第一聚合物材料的两端。细胞会被加载到所述第一聚合物材料的拉胀结构内。因此,所述第一聚合物材料是用来装载细胞,而所述第二聚合物材料则用于提供所述第一聚合物材料与多个拉伸组件之间的适当的连接。
13、在一个具体实施方案中,所述生物相容性聚合物材料包含第一聚合物材料以及两个第二聚合物材料。在一个优选的具体实施方案中,两个所述第二聚合物材料分别连接至所述第一聚合物材料的两端。在一个更优选的具体实施方案中,所述第一聚合物材料用于装载生产外泌体的细胞,以及所述第二聚合物材料是用于连接第一聚合物材料和多个拉伸组件。在另一个具体实施方案中,所述第一聚合物材料是fgelma,而所述第二聚合物材料是gelma。
14、所述生产外泌体的细胞可以通过已知的方法来加载到所述生物相容性聚合物材料或所述第一聚合物材料中。所述生产外泌体的细胞加载进入具有拉胀结构的生物相容性聚合物材料后,本发明就能获得装载细胞的拉胀支架。在本发明中,所述生物相容性聚合材料是装载细胞的fgelma,并且所述装载细胞的fgelma是通过将所述生产外泌体的细胞与fgelma进行混合后获得的。
15、所述生产外泌体的细胞可以以,例如,原代细胞(primary cells)、细胞系、存在于多细胞生物体内的细胞,或基本上任何其他类型的细胞源和生产外泌体细胞材料的形式存在。术语“生产外泌体的细胞(exosome-producing cell)”可以理解为涉及在合适的条件下能够生产外泌体的任何类型的细胞,例如在悬浮培养或在贴壁培养或是在任何其他类型的培养系统。所述生产外泌体的细胞还可以包括在体内产生外泌体的细胞。所述生产外泌体的细胞可以选自广泛范围的细胞和细胞系,其可以在悬浮培养基或贴壁培养基中生长或适于悬浮生长。所述生产外泌体的细胞可以选自:间质干细胞(mesenchymal stem cell)或基质细胞(stromal cells)(例如从骨髓、脂肪组织、华通氏胶(wharton’s jelly)、围产期组织(perinatal tissue)、胎盘、牙蕾(tooth buds)、脐带血、皮肤组织等获得)、纤维母细胞(fibroblasts)、羊膜细胞(amnion cell)(更具体的任选地表达各种早期标记物羊膜上皮细胞(amnion epithelial cell))、骨髓抑制细胞(myeloid suppressor cells)、m2极化巨噬细胞(m2 polarized macrophage)、脂肪细胞(adipocyte)、和内皮细胞(endothelialcell)等。特别感兴趣的细胞系包括人类脐带内皮细胞(human umbilical cordendothelial cells,huvec)、人胚胎肾(human embryonic kideny,hek)细胞、内皮细胞系(例如微血管或淋巴管内皮细胞)、红血球细胞、红血球先驱细胞、软骨细胞、不同来源的间质干细胞(msc)、羊膜细胞、羊膜上皮(ae)细胞、通过羊膜穿刺术获得或来自胎盘的任何细胞、来自气道或肺泡的上皮细胞、纤维母细胞,内皮细胞等。此外,免疫细胞(例如b细胞、t细胞、nk细胞、巨噬细胞、单核细胞、树突细胞(dc))也都在本发明的范围内,并且基本上任何类型的能够产生外泌体的细胞都包括在本发明的范围内。一般来说,外泌体基本上可以来自任何细胞源、原代细胞源或永生细胞系(immortalized cell line)。特别感兴趣的细胞系包括人类脐带内皮细胞(huvec)、人胚胎肾(hek)细胞(例如hek293细胞、hek293t细胞、无血清hek293细胞、悬浮hek293细胞)、内皮细胞系(例如微血管或淋巴管内皮细胞)、红血球细胞、红血球先驱细胞、软骨细胞、不同来源的msc、羊膜细胞、羊膜上皮(ae)细胞、通过羊膜穿刺术所获得或来自胎盘的任何细胞、来自气道或肺泡的上皮细胞、纤维母细胞、内皮细胞等。在一个具体实施方案中,所述生产外泌体的细胞包含哺乳动物细胞。在一个优选的具体实施方案中,所述生产外泌体的细胞包含胚胎肾细胞(embryonic kidney cells)。在一个更优选的具体实施方案中,所述生产外泌体的细胞包含hek293细胞。因此,所述生产外泌体的细胞能够生产出保留外泌体生物特性的外泌体,并且所述外泌体可能有cd9、cd63、cd81和hsp70的表达。
16、在本发明中,在所述生物相容性聚合物材料或所述第一聚合物材料中有多个孔洞。所述多个孔洞被设计成能增加所述生物相容性聚合物材料或所述第一聚合物材料中的拉胀结构的拉胀功能。此外,所述多个孔洞能使培养液流入所述生物相容性聚合物材料或所述第一聚合物材料中以培养细胞。在一个具体实施方案中,所述生物相容性聚合物材料或所述第一聚合物材料包含多个孔洞。此外,所述多个孔洞可以根据拉胀的需要而具有不同的形态。在一个具体实施方案中,所述孔洞的形状包括球形、椭圆形、菱形或纺锤形。在一个优选的实施方案中,所述孔洞的形状为纺锤形。在另一个具体实施方案中,纺锤形孔洞的长度为1至5 mm,宽度为0.1至0.5 mm。在一个优选的具体实施方案中,纺锤形孔洞的长度为2至4 mm,宽度为0.2至0.4 mm。此外,所述多个孔洞被设计成能贯穿所述生物相容性聚合物材料或所述第一聚合物材料的结构。
17、在一些具体实施方案中,所述培养槽内充满培养液,并且所述生物相容性聚合物材料置于所述培养液中。在一个具体实施方案中,所述培养槽包含培养液。
18、在各种具体实施方案中,所述多个拉伸组件施加循环拉伸力。所述多个拉伸组件的循环拉伸力使具有拉胀结构的生物相容性聚合物材料产生形变。在一个具体实施方案中,所述多个拉伸组件所施加的循环拉伸力是2.5至50%的拉伸形变。在一个优选的具体实施方案中,所述多个拉伸组件所施加的循环拉伸力是5至40%的拉伸形变。在一个更优选的具体实施方案中,所述多个拉伸组件所施加的循环拉伸力是10至30%的拉伸形变。在另一个具体实施方案中,所述多个拉伸组件所施加的循环拉伸力的频率为0.1至4 hz。在一个优选的具体实施方案中,所述多个拉伸组件所施加的循环拉伸力的频率为0.2至2 hz。在一个更优选的具体实施方案中,所述多个拉伸组件所施加的循环拉伸力的频率为0.3至1 hz。在一个具体实施方案中,所述多个拉伸组件的循环拉伸力在所述生物相容性聚合物材料上提供循环单轴拉伸力。在另一个具体实施方案中,所述多个拉伸组件的循环拉伸力以与所述生物相容性聚合物材料水平的方向来施力。因此,通过循环拉伸力来处理含有所述生产外泌体的细胞的所述生物相容性聚合物材料以刺激细胞释放外泌体。
19、在本发明中,循环拉伸力施加于所述生物相容性聚合物材料的时间超过一周,然后从所述生物相容性聚合物材料中的所述生产外泌体的细胞收集外泌体。在一个具体实施方案中,所述步骤(c)中收集外泌体是在施加循环拉伸力后约一周、约两周、约三周、约一个月、约两个月或约三个月进行。在一个优选的具体实施方案中,所述步骤(c)中收集外泌体是在施加循环拉伸力后约一至两个月进行。在另一个具体实施方案中,在施加循环力一个月后收集的外泌体的数量在0.1x106/细胞至2x106/细胞之间。在一个优选的具体实施方案中,施加循环力一个月后收集的外泌体的数量在0.5x106/细胞至1.5x106/细胞之间。
20、当对细胞施加循环拉伸力时,细胞会从单细胞变为自组装的三维(3d)细胞球体并表达大量的yes相关蛋白(yes-assocaited protein,yap)。本发明证明循环拉伸力能刺激细胞大量表达yap蛋白,而yap蛋白能使细胞形成3d球体,从而显著的增加外泌体的分泌。在一个具体实施方案中,在循环拉伸力下,所述生产外泌体的细胞的形态变成3d细胞球体。在另一个具体实施方案中,在循环拉伸力下,所述生产外泌体的细胞表达大量的yap蛋白。因此,使用本发明的循环拉伸生物反应器的3d细胞培养方法能够大量生产外泌体。
21、本发明提供一种多核苷酸(polynucleotide),其包含编码融合蛋白的序列,其中所述融合蛋白包含靶向蛋白和外泌体跨膜蛋白,并且所述靶向蛋白包含抗人类白细胞抗原g(human leukocyte antigen g,hla-g)蛋白。
22、此外,所述编码融合蛋白的序列是核酸序列。在一些方面,所述编码融合蛋白的序列包含编码靶向蛋白的第一序列和编码外泌体跨膜蛋白的第二序列。在一个具体实施方案中,所述编码融合蛋白的序列包含seq id no:1。在一个优选的具体实施方案中,所述编码抗hla-g蛋白(靶向蛋白)的第一序列包含seq id no:1。
23、在本发明中,所述外泌体跨膜蛋白是跨膜蛋白或与膜相关的蛋白。在另一个具体实施方案中,所述外泌体跨膜蛋白包含cd9、cd53、cd63、cd81、cd82、cd54、cd50、flot1、flot2、cd49d、cd71、cd133、cd138、cd235a、alix、syntenin-1、syntenin-2、lamp2b、tspan8、syndecan-1、syndecan-2、syndecan-3、syndecan-4、tspan14、cd37、cd82、cd151、cd231、cd102、notch1、notch2、notch3、notch4、dll1、dll4、jag1、jag2、cd49d/itga4、itgb5、itgb6、itgb7、cd11a、cd11b、cd11c、cd18/itgb2、cd41、cd49b、cd49c、cd49e、cd51、cd61、cd104、fc受体、白细胞介素受体(interleukin receptor)、免疫球蛋白、mhc-i、mhc-ii、cd2、cd3ε、cd3ζ、cd13、cd18、cd19、cd30、cd34、cd36、cd40、cd40l、cd44、cd45、cd45ra、cd47、cd86、cd110、cd111、cd115、cd117、cd125、cd135、cd184、cd200、cd279、cd273、cd274、cd362、col6a1、agrn、egfr、gapdh、glur2、glur3、hla-dm、hspg2、l1cam、lamb1、lamc1、arrdc1、lfa-1、lgals3bp、mac-1α、mac-1β、mfge8、slit2、stx3、tcra、tcrb、tcrd、tcrg、vti1a、vti1b或其组合。在一个优选的具体实施方案中,所述外泌体跨膜蛋白包含cd9、cd63或cd81。在一个更优选的具体实施方案中,所述外泌体跨膜蛋白包含cd63。
24、在本发明中,所述多核苷酸进一步包含启动子,所述启动子可操作地连接至所述编码融合蛋白的序列。本文中所用的“启动子”,是指能够赋予、活化或增强核酸在细胞中的表达的合成或天然衍生的分子。启动子可以包含一个或多个特定的转录调节序列以进一步增强表达和/或改变其空间表达和/或时序表达。在一些具体实施方案中,启动子能驱动并且连接到所述编码融合蛋白的序列的上游。能连接的启动子并没有特别的限制,只要能在目标细胞中展现启动子的活性即可。能连接到所述编码融合蛋白的序列的启动子的实施例包含,但不限于,efs启动子、巨细胞病毒(cytomegalovirus,cmv)启动子、ck8启动子、mhc启动子、myod启动子、htert启动子、sralpha启动子、sv40启动子、ltr启动子、cag启动子、劳斯肉瘤病毒(rous sarcoma virus,rsv)启动子等。在一个具体实施方案中,所述多核苷酸还包含用于调节所述编码融合蛋白的序列的启动子。
25、此外,本发明进一步提供一种载体,其中所述载体携带所述多核苷酸。因此,具有所述编码融合蛋白的序列的多核苷酸位于所述载体中。在本发明中,可以使用一种或多种载体,它们可以分别携带不同的序列片段。
26、在一个具体实施方案中,所述载体是质粒载体、非病毒载体或病毒载体。当本发明的载体是质粒载体时,所使用的质粒载体没有特别的限制,可以是任何质粒载体(例如克隆质粒载体和表达质粒载体)。包含本发明的多核苷酸的质粒载体的制备,是通过已知的方法将本发明的多核苷酸插入质粒载体中。在一个优选的具体实施方案中,所述病毒载体包含腺病毒载体(adenovirus vector)、腺相关病毒载体(adeno-associated virus vector,aav vector)、慢病毒载体(lentiviral vector)、逆转录病毒(retrovirus)或仙台病毒(sendaivirus)载体。在本专利说明书中,“病毒载体”还包括其衍生物。包含本发明的多核苷酸的病毒载体能通过已知的方法制备。在另一个具体实施方案中,所述非病毒载体包含脂质体或脂质纳米颗粒。
27、在一些方面,所述生产外泌体的细胞是用带有所述多核苷酸的载体转染。因此,所述生产外泌体的细胞通常包含所述编码融合蛋白的多核苷酸。因此,成功转染的细胞能生产单细胞、双细胞或多细胞的稳定细胞系。单一稳定细胞系有其优势,因为仅需要转染单一多核苷酸,可以简化外泌体的生产。
28、所述生产外泌体的细胞优选的是以所述编码融合蛋白的多核苷酸稳定的转染,由此能产生稳定的细胞系。此优势导致一致性的生产均一质量和产量的外泌体。所述生产外泌体的细胞可以被至少一个多核苷酸基因修饰,基本上任何非病毒或病毒的方法都能将多核苷酸引入细胞。适合将多核苷酸引入所述生产外泌体的细胞的方法包括:使用聚阳离子(例如pei)的转染、基于脂质(例如脂质体(rtm))的转染剂、慢病毒转导(transduction)、crispr-cas引导插入、flp-in系统、转座子(transposon)系统、电穿孔、deae-葡萄聚醣转染和磷酸钙转染。在选择将多核苷酸引入生产外泌体的细胞的方法时,需考虑各种参数,包括细胞来源的选择、载体的性质和特性(例如,如果载体是质粒或微环(minicircle),例如线性dna多核苷酸或mrna)、以及需达到的顺应性和控制的程度。同样地,通过使用细胞系开发领域熟知的技术,包括htert介导的永生化、转录因子永生化、e1/e2永生化或其他病毒介导的永生化技术等,能使所述生产外泌体的细胞永生化以产生稳定的细胞系。因此,成功转染的生产外泌体的细胞能释放出具有融合蛋白的外泌体。
29、在另外的方面,本发明提供一种用于产生包含融合蛋白的外泌体的方法,其包含:(1)将多核苷酸引入生产外泌体的细胞中,其中所述多核苷酸包含编码融合蛋白的序列,所述融合蛋白包含靶向蛋白和外泌体跨膜蛋白,并且所述靶向蛋白包含抗人类白细胞抗原g(hla-g)蛋白;以及(2)使所述生产外泌体的细胞生产所述包含所述融合蛋白的外泌体。
30、在一个具体实施方案中,所述生产外泌体的细胞包含哺乳动物细胞。在一个优选的具体实施方案中,所述生产外泌体的细胞包含胚胎肾细胞。在一个更优选的具体实施方案中,所述生产外泌体的细胞包含hek293细胞。
31、本发明提供一种融合蛋白,其包含靶向蛋白和外泌体跨膜蛋白,其中所述靶向蛋白包含抗hla-g蛋白,并且所述抗hla-g蛋白的序列包括seq id no:2。seq id no:2的肽序列由seq id no:1的核酸序列所产生。
32、本发明进一步提供一种细胞,其包含融合蛋白,其中所述融合蛋白包含靶向蛋白和外泌体跨膜蛋白,所述靶向蛋白包含抗hla-g蛋白,并且所述抗hla-g蛋白的序列包括seqid no:2。在一个具体实施方案中,所述细胞是生产外泌体的细胞。
33、在一些方面,所述靶向蛋白直接与所述外泌体跨膜蛋白连接以形成所述融合蛋白。外泌体跨膜蛋白的使用能将靶向蛋白配置在外泌体膜的外侧。这种配置使靶向蛋白暴露于外部,使靶向蛋白能与组织上的分子结合。适当的外泌体跨膜蛋白可以选自cd63、cd81、cd9、cd82、cd44、cd47、cd55、lamp2b、icam、整合素(integrin)、arrdc1、膜联蛋白(annexin)和任何其他外泌体多肽,以及其任何组合、衍生物、结构域(domain)或区域所组成的群组。一个非限制性实施例可以是例如cd63的蛋白质。
34、本发明进一步提供一种外泌体,其包含融合蛋白,其中所述融合蛋白包含靶向蛋白和外泌体跨膜蛋白,所述靶向蛋白包含抗hla-g蛋白,并且所述抗hla-g蛋白的序列包含seq id no:2。在一个具体实施方案中,所述外泌体跨膜蛋白包含cd9、cd63或cd81。在一个优选的具体实施方案中,所述外泌体跨膜蛋白包含cd63。
35、在一个具体实施方案中,所述外泌体进一步包含治疗剂。在一个优选的具体实施方案中,所述治疗剂包含抗体、抗体片段、抗体衍生物、单域抗体、胞内抗体(intrabody)、单链可变片段、亲和体(affibody)、酵素、转运子(transporter)、肿瘤抑制因子、病毒或细菌抑制剂、细胞成分蛋白、dna及/或rna结合蛋白、dna修复抑制剂、核酸酶、蛋白酶、整合酶(integrase)、转录因子、生长因子、细胞凋亡抑制剂和诱导剂、毒素、结构蛋白、神经营养因子(neurotrophic factors)、膜转运子(membrane transporter)、核苷酸结合蛋白(nucleotide binding protein)、热休克蛋白(heat shock protein)、crispr相关蛋白,及其组合。所述治疗剂能够加载至外泌体内。因此,将治疗剂引入/加载到所述包含融合蛋白的外泌体内来获得治疗性外泌体。
36、在一个具体实施方案中,所述治疗剂包含抗癌剂。在一个优选的具体实施方案中,所述抗癌剂包含化疗剂。在一个更优选的具体实施方案中,所述抗癌剂包含用于治疗癌症的微小rna(microrna,mir)。
37、在另一个具体实施方案中,所述化疗剂包括类克(remicade)、多西紫杉醇(docetaxel)、塞来昔布(celecoxib)、马法兰(melphalan)、地塞米松(dexamethasone,decadron®)、类固醇(steroid)、吉西他滨(gemcitabine)、顺铂(cisplatinum)、替莫唑胺(temozolomide)、依托泊苷(etoposide)、环磷酰胺(cyclophosphamide)、替莫唑胺(temodar)、卡铂(carboplatin)、甲基苄肼(procarbazine)、格立得(gliadel)、他莫昔芬(tamoxifen)、拓普替康(topotecan)、甲氨蝶呤(methotrexate)、arisa®、紫杉醇(taxol)、泰索帝(taxotere)、氟尿嘧啶(fluorouracil)、亚叶酸(leucovorin)、伊立替康(irinotecan)、希罗达(xeloda)、cpt-11、干扰素α(interferon alpha)、聚乙二醇化干扰素α(例如,peg intron-a),卡培他滨(capecitabine)、二氯二氨铂(cisplatin)、赫赛汀(herceptin)、帕捷特(perjeta)、泛艾霉素(epirubicin)、培美曲塞(pemetrexed)、塞替派(thiotepa)、氟达拉滨(fludarabine)、脂质体化柔红霉素(liposomal daunorubicin)、阿糖胞苷(cytarabine)、紫杉醇(pacilitaxel)、长春碱(vinblastine)、il-2、gm-csf、达卡巴嗪(dacarbazine)、长春瑞滨(vinorelbine)、唑来膦酸(zoledronic acid)、帕米磷酸盐(palmitronate)、克拉霉素(biaxin)、白消安(busulphan)、强的松(prednisone)、硼替佐米(bortezomib,velcade®)、二磷酸盐(bisphosphonate)、三氧化二砷(arsenic trioxide)、阿霉素(doxorubicin,doxil®)、更昔洛韦(ganciclovir)、亚德里亚霉素(adriamycin)、雌莫司汀磷酸钠(estrainustine sodium phosphate,emcyt®)、舒林酸(sulindac)、依托泊苷(etoposide)或其组合。在一个优选的具体实施方案中,所述化疗剂包含阿霉素(doxorubicin,dox)、泰索帝(taxotere,taxo)、二氯二氨铂(cisplatin,cisp)、赫赛汀(herceptin)、帕捷特(perjeta)、泛艾霉素(epirubicin,epir)、环磷酰胺(cyclophosphamide,cycl)、卡铂(carboplatin,carb)、吉西他滨(gemcitabine,gemc)、培美曲塞(pemetrexed,peme)或其组合。在一个更优选的具体实施方案中,所述化疗剂包含阿霉素。
38、在另一个具体实施方案中,所述用于治疗癌症的微小rna包含mir-34a、mir-34b、mir-34c、mir-497、mir-145、mir-206、mir-21、mir-99a、mir-30a、mir-30a、mir-9、mir-210、mir-192、mir-494、mir-221、mir-19a、mir-19b、mir-23b-3p、mir-122-5p、mir-193b-3p、mir-141、mir-375、mir-145、mir-196a-5p、mir-200c-3p、mir-1246、mir-1290、mir-21-5p、mir-127-3p、mir-200a、mir-200b、mir-200c、mir-339-5p或mir-409-3p。在另一个具体实施方案中,所述用于治疗癌症的微小rna包含mir-34a。
39、本发明提供一种组合物,其包含包括融合蛋白的外泌体,其中所述融合蛋白包含靶向蛋白和外泌体跨膜蛋白,所述靶向蛋白包含抗hla-g蛋白,并且所述抗hla-g蛋白的序列包含seq id no:2。
40、本发明提供一种治疗患有癌症的个体的方法,其包含施用组合物至所述患有癌症的个体,其中所述组合物包含治疗性外泌体,所述治疗性外泌体包含融合蛋白和抗癌剂,所述融合蛋白包含靶向蛋白和外泌体跨膜蛋白,所述靶向蛋白包含抗hlag蛋白,并且所述抗hla-g蛋白的序列包含seq id no:2。在一个具体实施方案中,所述外泌体跨膜蛋白包含cd9、cd63或cd81。在一个优选的具体实施方案中,所述外泌体跨膜蛋白包含cd63。
41、本发明进一步提供一种组合物在制备用于治疗癌症的药物中的用途,其中所述组合物包含治疗性外泌体,所述治疗性外泌体包含融合蛋白和抗癌剂,所述融合蛋白包含靶向蛋白和外泌体跨膜蛋白,所述靶向蛋白包含抗hla-g蛋白,并且所述抗hla-g蛋白的序列包含seq id no:2。在一个具体实施方案中,所述外泌体跨膜蛋白包含cd9、cd63或cd81。在一个优选的具体实施方案中,所述外泌体跨膜蛋白包含cd63。
42、术语“治疗”包括但不限于降低、抑制或限制癌细胞的生长,降低、抑制或限制癌细胞的转移或癌细胞的侵袭性或是转移,或者降低、抑制或限制一种或多种癌症症状或其转移。如本文所用的,术语“抑制癌细胞的生长”是指任何减缓癌细胞增殖及/或迁移的速率、阻止癌细胞增殖及/或迁移、杀死癌细胞或降低细胞活力以使得癌细胞的生长速率比观察到或预测的未处理的对照组癌细胞的生长速率低。术语“抑制生长”也指癌细胞或肿瘤的大小减小或消失,且其转移潜能也降低。优选地,细胞层面的抑制可以减小肿瘤的大小、阻止其生长并降低肿瘤的存在。
43、如本文所用的,术语“癌症”或“肿瘤”是指或描述哺乳动物中的生理状况,其中细胞群的特征是不受调节的细胞生长。癌症可以是非实体肿瘤或实体肿瘤。癌症的实施例包括但不限于恶性肿瘤、淋巴瘤、胚细胞瘤(blastoma)、肉瘤(sarcoma)和白血病。此类癌症更具体的实施例包括乳腺癌、口腔癌、髓母细胞瘤(medulloblastoma)、前列腺癌、鳞状细胞癌、肺癌、小细胞肺癌、非小细胞肺癌(non-small cell lung cancer)、肺腺癌、肺鳞状细胞癌、腹膜癌、肝细胞癌(hepatocyte carcinoma)、胃肠癌、胰脏癌、神经胶质母细胞瘤(glioblastoma)、子宫颈癌、卵巢癌(ovarian cancer)、卵巢腺癌(ovarianadenocarcinoma)、肝癌、膀胱癌、肝细胞癌(hepatoma)、结肠癌、结直肠癌(colorectalcancer)、胃癌、子宫内膜癌(endometrial carcinoma)或子宫肌瘤癌(uterinecarcinoma)、唾液腺癌(salivary gland carcinoma)、肾脏癌、肝癌、外阴癌(vulvarcarcinoma)、甲状腺癌、肝癌和各种头颈癌、恶性血液病(hematologic malignancies)、急性骨髓性白血病(acute myeloid leukemia)、淋巴癌和白血病、黑色素瘤(melanoma)等。在一个具体实施方案中,所述癌症包含乳腺癌、肺癌、口腔癌、肝癌、结直肠癌、神经胶质母细胞瘤、髓母细胞瘤、膀胱癌、胰脏癌或卵巢癌。在一个优选的实施方案中,所述癌症包含乳腺癌。
44、在一个具体实施方案中,所述个体是动物,优选为哺乳动物,更优选为人类。
45、在另一个具体实施方案中,所述抗癌剂包含化疗剂和/或用于治疗癌症的微小rna(mir)。在一个优选的具体实施方案中,所述化疗剂包含阿霉素(dox)、泰索帝(taxo)、二氯二氨铂(cisp)、赫赛汀、帕捷特、泛艾霉素(epir)、环磷酰胺(cycl)、卡铂(carb)、吉西他滨(gemc)、培美曲塞(peme)或其组合。在一个优选的具体实施方案中,所述化疗剂包括阿霉素。在另一个具体实施方案中,所述用于治疗癌症的微小rna包含mir-34a。
46、在本发明中,所述抗hla-g蛋白是具有抗hla-g功能的蛋白或肽。因此,所述抗hla-g蛋白能够与hla-g分子特异性结合。尤其是,本发明中的seq id no:2的序列对hla-g具有较高的亲和力。在一些方面,hla-g分子表达在癌细胞上。因此,具有抗hla-g蛋白的外泌体能与癌细胞特异性结合,并且可以作为治疗癌症的药物递送工具。
47、在一些具体实施方案中,所述治疗性外泌体与医药上可接受的载体一起施用。术语“医药上可接受的载体”是指与制剂的其他成分相容并且对接受者无害的任何载体、稀释剂或赋形剂。医药上可接受的载体的选择,可根据选择的给药途径和标准用药准则来制定。所述治疗性外泌体可以根据药物制剂领域的标准配制成各种剂型。合适的剂型包含但不限于,例如,溶液、肠胃外溶液、注射液、锭剂、栓剂或悬浮剂。
48、本发明中包含治疗性外泌体的组合物能通过多种途径施用于个体,包括口服、肠胃外、舌下、经皮、直肠、经粘膜、局部、经由吸入、经颊施用(buccal administration)、胸膜内(intrapleural)、静脉、动脉、腹膜、皮下、肌肉内、鼻内、脊髓(intrathecal)、关节内或其组合。在一个优选的具体实施方案中,所述组合物是通过静脉或肠胃外施用的方式给药。在另一个具体实施方案中,所述组合物是以直接注射到肿瘤的方式施用。
49、对于肠胃外给药的方式,活性剂可以与合适的载体或稀释剂混合,例如、但不限于水、油(例如,植物油)、乙醇、生理盐水(例如,磷酸盐缓冲生理盐水或生理盐水)、水性右旋糖(葡萄糖)和相关的糖溶液、甘油或甘醇(例如丙二醇或聚乙二醇)。也可以添加稳定剂、抗氧化剂和防腐剂。合适的抗氧化剂包括、但不限于亚硫酸盐、抗坏血酸、柠檬酸及其盐类、以及乙二胺四乙酸(edta)钠。适当的防腐剂包括、但不限于苯扎氯铵(benzalkoniumchloride)、对羟基苯甲酸甲酯(methyl-paraben)或对羟基苯甲酸丙酯(propyl-paraben)、以及氯丁醇(chlorbutanol)。以肠胃外方式给药的组合物,可以是水性或非水性溶液、分散液、悬浮液或乳液的形式。
50、根据本发明,所述包含治疗性外泌体的组合物的剂量,没有特别的限制,只要是对治疗有效的量即可。可以根据活性成分、剂型、患者的年龄和体重、给药时间表、给药方法等进行适当的变化。所述组合物优选为单位剂型。这种形式时,其制备被分为包括适量活性成分的单位剂量。
51、治疗癌症的方法包含施用有效治疗量的治疗性外泌体,以降低、抑制或限制癌症的生长。术语“有效治疗量”是指足以产生有益或所需的生物及/或临床结果的量。在一个具体实施方案中,“有效治疗量”是与观察的或预测的未治疗对照癌症的生长速率相比,足以抑制、减少或限制癌细胞生长的量。
52、抗癌剂、mir或治疗性外泌体的剂量通常在约0.0001或0.001或0.01毫克/公斤/天至约1000毫克/公斤/天的范围内,但可以更高或更低,视各种因素而定,例如组合物的活性、其生物可利用性、给药方式和上述讨论的各种因素。剂量和间隔时间可以单独调整,以提供足以维持治疗或预防效果的外泌体的局部性及/或全身性浓度。例如,所述组合物可以每周施用一次、每周数次(例如,每隔一天)、每天一次或每天数次,视给药的方式、特定的治疗指示、以及主治医师的判断。本领域技术人员无需过多的实验便能优化有效的局部剂量。在一个具体实施方案中,所述化疗剂的有效治疗量的范围为0.01至10毫克/公斤体重。在另一个具体实施方案中,所述用于治疗癌症的微小rna的有效治疗量的范围为0.01至1毫克/公斤体重。
53、此外,在本发明中,包含融合蛋白的生产外泌体的细胞可以应用于本发明的循环拉伸生物反应器中。作为递送载体,外泌体有其优势,因为它具有多种益处,例如缺乏免疫原性以及有效递送到不同器官的能力。因此,使用本发明的循环拉伸生物反应器的培养方法,适合用于一致且大量生产保留外泌体的生物特性且包含融合蛋白的外泌体,使这些外泌体适合作为药剂(例如治疗剂)的递送工具。
- 还没有人留言评论。精彩留言会获得点赞!