检测海豚链球菌的实时荧光MIRA和MIRA-LFD引物组及检测方法
检测海豚链球菌的实时荧光mira和mira-lfd引物组及检测方法
技术领域
1.本发明属于分子生物学领域,尤其涉及一种检测海豚链球菌的实时荧光mira和mira-lfd引物组及检测方法。
背景技术:
2.海豚链球菌属于芽孢杆菌纲、乳杆菌目、链球菌科、链球菌属,是一种兼性厌氧的革兰氏阳性菌,为球形或卵圆形,有荚膜,无鞭毛,无运动性,不形成芽孢,具有感染宿主广、传染性强、死亡率高等特点。海豚链球菌可以感染包括淡水鱼和海水鱼在内的二十多种鱼类,给水产养殖业造成巨大损失。而在海豚链球菌病的治疗上主要依赖于多种抗生素的使用,大量抗生素的使用不仅导致了菌的耐药性,也破坏水体的稳定性,因此海豚链球菌的早期预防就显得尤为重要。
3.传统的细菌鉴定方法主要是通过细菌生理生化特性进行分类,该方法步骤繁琐、操作复杂且耗时费力。即便是近年来常用的pcr扩增法,也需要依赖于昂贵的实验仪器和熟练地技术人员,从而也导致了这些方法不能应用于基层以及即时检验。
技术实现要素:
4.本发明要解决的技术问题在于提供一种基于多酶恒温快速扩增技术(mira)检测海豚链球菌的实时荧光mira和mira-lfd引物组及检测方法,所述方法以基础的核酸扩增产品能够在15-30min内完成扩增,并有实时荧光型和试纸条型两种检测方法。相较于pcr扩增方法,极大的缩短了扩增时间,提高了扩增效率。相比于琼脂糖凝胶电泳技术进行扩增检测,试纸条型检测方法不仅不需要再依赖于昂贵的凝胶成像仪,而且在检测时间上也大大缩短。相比于实时荧光pcr法,实时荧光mira法所需时间大为缩短,整个时间缩短至20-30min。因此,不论是实验室还是一些条件相对落后的基层都可以实现海豚链球菌的快速鉴定。
5.本发明是通过如下技术方案来实现的:
6.一种检测海豚链球菌的实时荧光mira引物组,其由引物1、引物2和探针1组成;
7.所述引物1为如下(a1)或(a2):
8.(a1)seqidno.1所示的单链dna分子;具体为5
’‑
taaagcattagaagcggctaagaaagaag-3’9.(a2)将seqidno.1经过一个或几个核苷酸的取代和/或缺失和/或添加且与seqidno.1具有相同功能的dna分子;
10.所述引物2为如下(a3)或(a4):
11.(a3)seqidno.2所示的单链dna分子;具体为5
’‑
caatagttgcttcaagttctgctttttca-3’12.(a4)将seqidno.2经过一个或几个核苷酸的取代和/或缺失和/或添加且与seq
idno.2具有相同功能的dna分子;
13.所述探针1为如下(a5)或(a6)
14.(a5)seqidno.3所示的单链dna分子,具体为5
’‑
tttccaattcagcttttgtttctgctagtagtttcaaggtctttag-3’;且探针1的5’端第29个碱基上标记
15.i6famdt//idsp//ibhq1dt;
16.(a6)seqidno.3经过一个或几个核苷酸的取代和/或缺失和/或添加且与seqidno.3具有相同功能的dna分子,且探针5’端第29个碱基上标记i6famdt//idsp//ibhq1dt;
17.本发明还有提供另外一种mira-lfd引物组,所述引物组由引物1和引物2和探针2组成;
18.所述引物1为如下(a1)或(a2):
19.(a1)seqidno.1所示的单链dna分子;具体为5
’‑
taaagcattagaagcggctaagaaagaag-3’20.(a2)将seqidno.1经过一个或几个核苷酸的取代和/或缺失和/或添加且与seqidno.1具有相同功能的dna分子;
21.所述引物2为如下(a3)或(a4)所示序列的5'末端标记biotin:
22.(a3)seqidno.2所示的单链dna分子;具体为5
’‑
caatagttgcttcaagttctgctttttca-3’23.(a4)将seqidno.2经过一个或几个核苷酸的取代和/或缺失和/或添加且与seqidno.2具有相同功能的dna分子;
24.所述探针2为seqidno.3所示的单链dna分子,且在其5'端起第30个碱基上标记idsp,5'末端标记6-fam,3'末端标记为c3spacer。
25.本发明还提供含有上述mira或mira-lfd引物组的试剂盒。
26.上述mira反应体系如下:14.7μl的abuffer,1μl的10μm上游引物,1μl的10μm下游引物,0.5μl的10μm探针,2μl的海豚链球菌dna模板,4.55μl的ddh2o以及1.25μl的bbuffer。
27.进一步,mira扩增反应在温度为42℃,反应时间为20min。
28.上述试剂盒还包括配套检测mira扩增产物的核酸检测试纸条;
29.所述试剂条包括与所述探针标记基团结合的抗体或与所述引物2标记基团结合的抗体。
30.本发明还有一个目的是提供如下方法:
31.本发明提供了一种鉴定或辅助鉴定待测菌是否为海豚链球菌的方法,包括如下步骤:
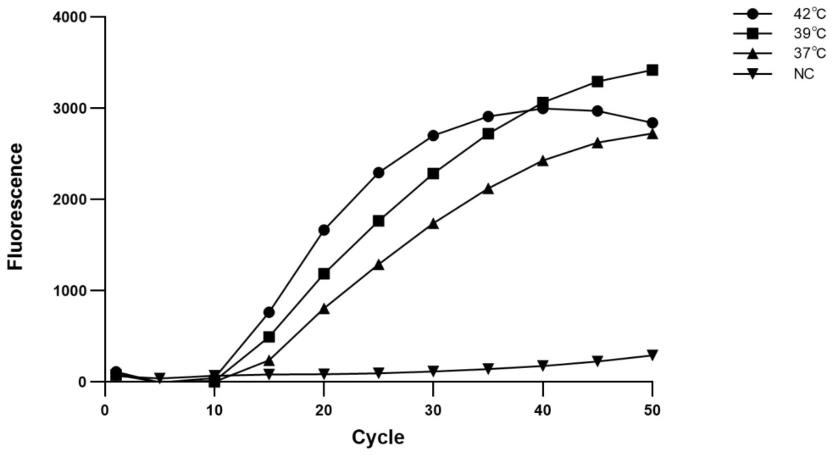
32.用上述引物组对待测菌进行mira扩增,检测mira扩增产物;再用侧流层析试纸条检测扩增产物,所述方法为非诊断目的。
33.本发明提供了一种鉴定或辅助鉴定待测样本是否感染海豚链球菌或含有海豚链球菌的方法,包括如下步骤:用上述引物对待测样本进行mira扩增,检测mira扩增产物;再用侧流层析试纸条检测扩增产物;所述方法为非诊断目的,
34.上述方法中,所述mira扩增的模板为待测菌或待测样本的核酸。
35.本发明提供一种用于海豚链球菌的扩增引物组及快速检测方法,该方法以多酶恒温快速扩增技术(mira)为基础,结合侧流层析试纸,能够快速、灵敏、高特异度地进行海豚链球菌检测,实现肉眼可见检测。
36.本发明的mira-lfd扩增技术的检测灵敏度及特异性进行了实验,灵敏度试验结果表明使用该试剂盒检测海豚链球菌的敏感性为102cfu/ml,并且具有较广的检测范围,至少在10
7-102cfu/ml范围内的样品均能被检测出来。特异性检测结果表明,使用该方法分别检测坎氏弧菌,溶藻弧菌,哈维氏弧菌,副溶血弧菌,轮虫弧菌,表皮葡萄球菌,格氏乳球菌,美人鱼发光杆菌,肺炎克雷伯菌,停乳链球菌,海豚链球菌,结果只有海豚链球菌能够很好的进行扩增,其他菌均不能扩增,因此,说明该试剂盒具有很好的特异性。
37.本发明与现有技术相比的有益效果:
38.(1)能够节约试验时间:mira整个试验过程只需要20min,该时间远远低于qpcr的1.5小时以及lamp的60min。加上样品处理以及准备试验的时间,mira-lfd整个检测过程能够在一个小时之内完成。
39.(2)能够降低反应温度:mira只需要恒温42℃即可完成试验,该温度远远低于qpcr的60℃-95℃以及lamp的64℃。
40.(3)方法更加简单、便于携带:扩增所需的酶和一些其他必要的东西已经冻干保存,能够在常温下长时间放置,扩增时只需要加入水解缓冲液、引物、探针和模板,并加入镁离子起始反应即可,不需要熟练的试验人员。
41.(4)特异性强:因该试验中添加了探针,增加了该方法特异性,基于荧光试剂的lamp方法因为没有探针,特异性相对较差。
附图说明
42.图1为sima基因上游引物与下游引物进行基础mira扩增,扩增结果如图所示,表明能够进行有效的扩增,可以用于后续实验的扩增。
43.图2为mira反应的最适反应温度及反应时间的确定,该反应在37℃、39℃和42℃下进行实时荧光mira扩增,扩增结果显示3个反应温度下均能进行很好的mira扩增,但在42℃下mira扩增的起始时间以及进入扩增平台期的时间最短,因此选用42℃作为后续反应的最适反应温度;同时在40cycle(20min)时,反应基本进入平台期,因此,选用20min作为后续实验扩增的最适反应时间。
44.图3为实时荧光mira的特异性实验,选取坎氏弧菌,溶藻弧菌,哈维氏弧菌,副溶血弧菌,轮虫弧菌,表皮葡萄球菌,格氏乳球菌,美人鱼发光杆菌,肺炎克雷伯菌,停乳链球菌和海豚链球菌11种菌的dna作为模板,在筛选出的最佳条件下进行实时荧光mira扩增检测,结果显示,只有海豚链球菌能够被扩增出目的条带,说明引物有很强的特异性。
45.图4为实时荧光mira的灵敏性实验,选取浓度为10
7-100cfu/ml菌液提取的dna为模板,在42℃下进行实时荧光mira扩增,结果显示,实时荧光mira能检测10
7-102cfu/ml的模板,其中nc代表阴性对照。
46.图5为mira-lfd的特异性实验,选取坎氏弧菌,溶藻弧菌,哈维氏弧菌,副溶血弧菌,轮虫弧菌,表皮葡萄球菌,格氏乳球菌,美人鱼发光杆菌,肺炎克雷伯菌,停乳链球菌和海豚链球菌11种菌的dna作为模板,在筛选出的最佳条件下进行mira-lfd扩增检测,结果
显示,只有海豚链球菌能够进行扩增并被检测。
47.图6为mira-lfd的灵敏性实验,选取浓度为10
7-101cfu/ml菌液提取的dna为模板,在42℃下进行mira-lfd扩增,扩增时间为20min,结果显示,mira-lfd的最低检测限度为102cfu/ml。
48.图7为pcr扩增的灵敏性检测,反应在退火温度为55℃下扩增30个循环后,进行琼脂糖凝胶电泳检测,检测结果显示pcr的最低检测限度为103cfu/ml。
具体实施方式
49.下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
50.实施例1
51.靶向海豚链球菌sima基因mira引物和探针设计
52.根据以ncbi数据库中公布的sima基因序列(genbank:jf330100.1)作为靶向基因,依据mira引物设计原则,用primerpremier5.0设计引物,设计引物序列如下:具体为:
53.sima-fw:5
’‑
taaagcattagaagcggctaagaaagaag-3’,如seqidno.1所示;
54.sima-rv:5
’‑
caatagttgcttcaagttctgctttttca-3’,如seqidno.2所示;
55.扩增结果如如图1,目的片段大小为239bp。测序为海豚链球菌的sima序列。
56.根据sima扩增序列片段进行探针的设计,设计探针序列分别根据实时荧光mira探针设计原则和mira-lfd探针设计原则,
57.分别设计了实时荧光mira探针1和mira-lfd探针2,具体序列为:
58.探针1:
[0059]5’‑
tttccaattcagcttttgtttctgctagt/i6famdt//idsp//ibhq1dt/agtttcaaggtctttag-3’[0060]
探针2:
[0061]5’
6-fam-tttccaattcagcttttgtttctgctagtt/idsp/tagtttcaaggtctttag-c3spacer-3’[0062]
上述引物和探针由生工生物工程(上海)股份有限公司合成。
[0063]
实施例2
[0064]
实时荧光mira检测海豚链球菌反应体系的建立及反应温度和反应时间的确定
[0065]
海豚链球菌dna模板是通过核酸释放剂(苏州先达基因科技有限公司)提取得到的,在后续实验中便于模板的获得,降低时间成本,减少对仪器设备的依赖。
[0066]
用dna恒温快速扩增试剂盒(荧光型)(购自潍坊安普未来生物科技有限公司,产品编号为wln8203kit)进行mira扩增,包括含冻干酶粉的反应单元管、基础缓冲液(含dntp)的abuffer以及280mm的醋酸镁bbuffer。
[0067]
实时荧光mira扩增体系具体如下:先将基础缓冲液(abuffer)14.7μl、上下游引物各1μl、0.5μl的10μm探针、模板dna2μl、无菌去离子水4.55μl配制混匀后加入含冻干酶粉反应单元管,轻轻混匀后在管盖滴加1.25μlbbuffer,实时荧光mira扩增反应体系的
总体积为25μl,离心混匀;
[0068]
各实时荧光mira扩增体系置于bio-rad实时荧光定量pcr仪中分别在37℃、39℃、42℃条件下反应50cycle(25min),根据反应结果图2所示,3个反应温度下均能进行实时荧光mira扩增,但在42℃下mira扩增的起始时间以及进入扩增平台期的时间最早,因此选用42℃作为后续反应的最适反应温度;同时在40cycle(20min)时,反应基本进入平台期,因此,选用20min作为后续实验扩增的最适反应时间。
[0069]
优化的基于实时荧光mira技术检测海豚链球菌的最佳扩增温度为42℃,反应时间为20min(图2)。
[0070]
实施例3
[0071]
实时荧光mira检测海豚链球菌的特异性验证
[0072]
使用实施例2优化得到的海豚链球菌的检测方法,对11种海洋生物致病菌(表1)分别进行检测,对扩增引物进行特异性分析评价;
[0073]
表1用于实时荧光mira检测特异性分析的菌株
[0074]
菌株名称菌株来源vibrio campbellii坎氏弧菌本实验室保存vibrio alginolyticus溶藻弧菌本实验室保存vibrio harveyi哈维氏弧菌本实验室保存vibrio parahemolyticus副溶血弧菌本实验室保存vibrio rotiferianus轮虫弧菌本实验室保存staphylococcus epidermidis表皮葡萄球菌本实验室保存staphylococcus aureus金黄色葡萄球菌本实验室保存klebsiella pneumoniae肺炎克雷伯菌本实验室保存lactococcus garvieae格氏乳球菌本实验室保存streptococcus dysgalactiae停乳链球菌本实验室保存streptococcus iniae海豚链球菌本实验室保存
[0075]
海豚链球菌扩增引物特异性验证结果图如图3所示,除海豚链球菌有扩增条带的出现呈阳性外,其他10株病原菌结果均呈阴性,说明本发明的扩增引物具有良好的特异性。
[0076]
实施例4
[0077]
实时荧光mira检测海豚链球菌的灵敏性验证
[0078]
将海豚链球菌接种于5mlbhi培养基中,28℃过夜培养,对其采用平板计数法计数后用无酶无菌水对纯菌液进行10倍梯度稀释,海豚链球菌初始浓度计数为107cfu/ml,分别稀释至106cfu/ml、105cfu/ml、104cfu/ml、103cfu/ml、102cfu/ml、101cfu/ml。按照实施案例2中海豚链球菌dna提取方法进行dna提取,采取实施案例2中优化得到的海豚链球菌的检测方法进行灵敏性检测。
[0079]
灵敏度的验证结果如图4所示,本实施例的实时荧光mira最低检测限度为102cfu/ml。
[0080]
实施例5
[0081]
mira-lfd检测海豚链球菌的特异性验证
[0082]
使用实施例2优化得到的海豚链球菌的检测方法,对11种海洋生物致病菌(表1)分别进行检测,对扩增引物进行特异性分析评价;
[0083]
海豚链球菌扩增引物特异性验证结果(图5)表明:除海豚链球菌有扩增条带结果呈阳性外,其他10株病原菌结果均呈阴性,这说明本发明的mira-lfd扩增引物具有良好的特异性。
[0084]
实施例6
[0085]
mira-lfd检测海豚链球菌的灵敏性验证
[0086]
选取与实施案例2中灵敏性验证相同的dna作为模板进行mira-lfd的灵敏性验证,扩增反应温度为42℃,扩增时间为20min,扩增结束后用一次性核酸试纸条进行检测。检测结果如图6所示,10
7-102cfu/ml均呈现阳性,因此,mira-lfd检测海豚链球菌的最低检测限度为102cfu/ml。
[0087]
同时以相同浓度的基因组dna为模板,进行常规pcr扩增,比较本发明的两种方法和pcr技术的灵敏度。
[0088]
常规pcr为25μl体系:2
×
taqmastermix(vazyme,p111-01)12.5μl,上下游引物(10μm)各1μl,模板2μl,其余用无菌去离子水补齐。pcr反应程序:95℃,5min;94℃30s,50℃30s,72℃30s,30cycles;72℃,5min。
[0089]
灵敏度的验证结果如图7所示,常规pcr最低检出限时103cfu/ml,结果表明本发明的两种方法均比常规pcr具有更高的灵敏性,其中实时荧光mira和mira-lfd检测海豚链球菌的灵敏性是常规pcr的10倍。
[0090]
经验证,本发明的基于实时荧光mira技术和mira-lfd技术检测海豚链球菌的扩增引物和探针,特异性强,灵敏度高等优点;整个扩增过程不需要依赖于昂贵的实验仪器和复杂的操作步骤,只需要在42℃恒温下扩增20min即可进行检测,简单、快捷、方便、特异性强且灵敏度高,极具应用前景。
[0091]
虽然以上描述了本发明的具体实施方式,但是本领域的技术人员应该理解,这些仅是举例说明,在不违背本发明的原理和实质的前提下,可以对这些实施方式做出多种变更或修改。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1