抗C-C基序趋化因子受体8(CCR8)抗体以及使用方法与流程
背景技术:
1、表达转录因子foxp3的调节性t(treg)细胞对于维持外周免疫耐受和预防自身免疫非常重要。参见,例如,sakaguchi等人,cell(2008)133:775-787。treg细胞还构成实体癌的免疫浸润的主要组分,通过建立免疫抑制肿瘤微环境和抑制抗肿瘤免疫应答来促进肿瘤的发展和进展。参见,例如,plitas和rudensky,annu.rev.cancer biol.(2020)4:459-477。treg细胞也会阻碍免疫疗法的功效。参见,例如,nishikawa和sakaguchi,curr.opin.immunol.(2014)27:1-7。肿瘤浸润淋巴细胞中treg细胞比例的增加与几种癌症适应症的较差结果相关联。参见,例如,fu等人,gastroenterology(2007)132:2328-2339;petersen等人,cancer(2006)107:2866-2872;shang等人,nature-scientific reports(2015)5:15179(9页);shen等人,j.cancer res.clin.oncol.(2010)136:1585-1595;以及tanaka和sakaguchi,eur.j.immunol.(2019)49:1140-1146。
2、在临床前乳腺癌、黑色素瘤和结肠癌模型中,涉及treg细胞消耗或抑制的几种策略已显示出可增强抗肿瘤免疫,并引起肿瘤生长抑制。参见,例如,bos等人,j.exp.med.(2013)2435-2446;klages等人,cancer res.(2010)70:7788-7799;以及pastille等人,cancer res.(2014)74:4258-4269。然而,靶向treg细胞和效应t细胞(诸如cd25)两者上表达的表面受体的策略在所建立的肿瘤中显示出有限的功效,这可能是由于同时消耗了对抗肿瘤免疫至关重要的效应t细胞。参见,例如,onizuka等人cancer res.(1999)59:3128-3133。
3、趋化因子受体ccr8为七跨膜g蛋白偶联受体(gpcr),并通过人/小鼠ccl1以高亲和力连接,并且在肿瘤微环境内由treg细胞选择性且高度表达,但外周treg细胞或效应t细胞基本不表达。treg细胞上的高ccr8表达与患有乳腺癌的患者的晚期疾病阶段和总生存期降低相关联。参见,例如,plitas等人,immunity(2016)45:1122-1134。因此,ccr8代表了癌症治疗中treg细胞消耗的有前途且更安全的靶标。因此,需要识别ccr8的药剂以及使用此类药剂的方法。
技术实现思路
1、本公开提供抗ccr8抗体、组合物及其制备和使用方法。
2、实施方案1.在某些非限制性实施方案中,目前公开的主题提供一种与c-c基序趋化因子受体8(ccr8)结合的单克隆抗体,其中该抗体包含:重链可变结构域(vh),其包含:(a)cdr-h1,其包含seq id no:29或seq id no:30的氨基酸序列,(b)cdr-h2,其包含seq idno:31的氨基酸序列,和(c)cdr-h3,其包含seq id no:32的氨基酸序列;以及轻链可变结构域(vl),其包含:(d)cdr-l1,其包含seq id no:26的氨基酸序列,(e)cdr-l2,其包含seq idno:27的氨基酸序列,和(f)cdr-l3,其包含seq id no:28的氨基酸序列。
3、实施方案2.根据前述实施方案1所述的抗体,其不依赖于ccr8的硫酸化而与ccr8结合。
4、实施方案3.根据前述实施方案1或2所述的抗体,其中该抗体与包含seq id no:106的氨基酸残基2至6中的一者或多者的表位结合。
5、实施方案4.根据前述实施方案1至3中任一项所述的抗体,其包含选自由以下项组成的组的序列:(a)vh序列,其与选自由以下项组成的组的氨基酸序列具有至少约95%、至少约96%、至少约97%、至少约98%或至少约99%同一性:seq id no:35至47;(b)vl序列,其与选自由以下项组成的组的氨基酸序列具有至少约95%、至少约96%、至少约97%、至少约98%或至少约99%同一性:seq id no:48至52;以及(c)如(a)中定义的vh序列和如(b)中定义的vl序列。
6、实施方案5.根据前述实施方案1至4中任一项所述的抗体,其包含:vh序列,其选自由以下项组成的组:seq id no:35至47;以及vl序列,其选自由以下项组成的组:seq idno:48至52。
7、实施方案6.根据前述实施方案1至5中任一项所述的抗体,其包含选自由以下项组成的组的序列:(a)vh序列,其与seq id no:47的氨基酸序列具有至少约95%、至少约96%、至少约97%、至少约98%或至少约99%同一性;(b)vl序列,其与seq id no:48的氨基酸序列具有至少约95%、至少约96%、至少约97%、至少约98%或至少约99%同一性;以及(c)如(a)中定义的vh序列和如(b)中定义的vl序列。
8、实施方案7.根据实施方案1至6中任一项所述的前述抗体,其包含:vh序列,其与seq id no:47的氨基酸序列具有至少约95%、至少约96%、至少约97%、至少约98%或至少约99%同一性;以及vl序列,其与seq id no:48的氨基酸序列具有至少约95%、至少约96%、至少约97%、至少约98%或至少约99%同一性。
9、实施方案8.根据实施方案1至7中任一项所述的前述抗体,其中vl包含v4m突变、p43a突变、f46l突变、c90q突变、或其组合。
10、实施方案9.根据实施方案1至8中任一项所述的前述抗体,其中vh包含g49s突变、k71r突变、s73n突变、或其组合。
11、实施方案10.根据实施方案1至9中任一项所述的前述抗体,其包含seq id no:55的重链氨基酸序列和seq id no:56的轻链氨基酸序列。
12、实施方案11.根据实施方案1至9中任一项所述的前述抗体,其包含seq id no:60的重链氨基酸序列和seq id no:56的轻链氨基酸序列。
13、实施方案12.根据实施方案1至9中任一项所述的前述抗体,其包含seq id no:111的重链氨基酸序列和seq id no:56的轻链氨基酸序列。
14、实施方案13.根据实施方案1至9中任一项所述的前述抗体,其包含seq id no:113的重链氨基酸序列和seq id no:56的轻链氨基酸序列。
15、实施方案14.在某些非限制性实施方案中,目前公开的主题提供一种与ccr8结合的单克隆抗体,所述单克隆抗体包含:vh序列,其选自由以下项组成的组:seq id no:35至47;以及vl序列,其选自由以下项组成的组:seq id no:48至52。
16、实施方案15.在某些非限制性实施方案中,目前公开的主题提供一种与ccr8结合的单克隆抗体,所述单克隆抗体包含seq id no:47的vh序列和seq id no:48的vl序列。
17、实施方案16.在某些非限制性实施方案中,目前公开的主题提供一种与ccr8结合的单克隆抗体,其中所述抗体包含:重链可变结构域(vh),其包含:(a)cdr-h1,其包含seqid no:4或seq id no:5的氨基酸序列,(b)cdr-h2,其包含seq id no:6的氨基酸序列,和(c)cdr-h3,其包含seq id no:7的氨基酸序列;以及轻链可变结构域(vl),其包含:(d)cdr-l1,其包含seq id no:1的氨基酸序列,(e)cdr-l2,其包含seq id no:2的氨基酸序列,和(f)cdr-l3,其包含seq id no:3的氨基酸序列。
18、实施方案17.根据前述实施方案16所述的抗体,其不依赖于ccr8的硫酸化而与ccr8结合。
19、实施方案18.根据实施方案16或17所述的前述抗体,其中所述抗体与包含seq idno:106的氨基酸残基91至104和172至193中的一者或多者的表位结合。
20、实施方案19.根据前述实施方案16至18中任一项所述的抗体,其包含选自由以下项组成的组的序列:(a)vh序列,其与选自由以下项组成的组的氨基酸序列具有至少约95%、至少约96%、至少约97%、至少约98%或至少约99%同一性:seq id no:10至21;(b)vl序列,其与选自由以下项组成的组的氨基酸序列具有至少约95%、至少约96%、至少约97%、至少约98%或至少约99%同一性:seq id no:22至25;以及(c)如(a)中定义的vh序列和如(b)中定义的vl序列。
21、实施方案20.根据前述实施方案16至19中任一项所述的抗体,其包含:vh序列,其选自由以下项组成的组:seq id no:10至21;以及vl序列,其选自由以下项组成的组:seqid no:22至25。
22、实施方案21.根据前述实施方案16至20中任一项所述的抗体,其包含选自由以下项组成的组的序列:(a)vh序列,其与seq id no:21的氨基酸序列具有至少约95%、至少约96%、至少约97%、至少约98%或至少约99%同一性;(b)vl序列,其与seq id no:24的氨基酸序列具有至少约95%、至少约96%、至少约97%、至少约98%或至少约99%同一性;以及(c)如(a)中定义的vh序列和如(b)中定义的vl序列。
23、实施方案22.根据实施方案16至21中任一项所述的前述抗体,其包含:vh序列,其与seq id no:21的氨基酸序列具有至少约95%、至少约96%、至少约97%、至少约98%或至少约99%同一性;以及vl序列,其与seq id no:24的氨基酸序列具有至少约95%、至少约96%、至少约97%、至少约98%或至少约99%同一性。
24、实施方案23.根据实施方案16至22中任一项所述的前述抗体,其中vl包含y2i突变。
25、实施方案24.根据实施方案16至23中任一项所述的前述抗体,其中vh包含s73n突变、v78l突变、t76n突变、f91y突变和p105q突变、或其组合。
26、实施方案25.根据实施方案16至24中任一项所述的前述抗体,其包含seq id no:57的重链氨基酸序列和seq id no:58的轻链氨基酸序列。
27、实施方案26.根据实施方案16至24中任一项所述的前述抗体,其包含seq id no:61的重链氨基酸序列和seq id no:58的轻链氨基酸序列。
28、实施方案27.根据实施方案16至24中任一项所述的前述抗体,其包含seq id no:112的重链氨基酸序列和seq id no:58的轻链氨基酸序列。
29、实施方案28.根据实施方案16至24中任一项所述的前述抗体,其包含seq id no:114的重链氨基酸序列和seq id no:58的轻链氨基酸序列。
30、实施方案29.在某些非限制性实施方案中,目前公开的主题提供一种与ccr8结合的单克隆抗体,所述单克隆抗体包含:vh序列,其选自由以下项组成的组:seq id no:10至21;以及vl序列,其选自由以下项组成的组:seq id no:22至25。
31、实施方案30.在某些非限制性实施方案中,目前公开的主题提供一种与ccr8结合的单克隆抗体,所述单克隆抗体包含seq id no:21的vh序列和seq id no:24的vl序列。
32、实施方案31.在某些非限制性实施方案中,目前公开的主题提供一种与ccr8结合的单克隆抗体,其中所述抗体包含:重链可变结构域(vh),其包含:(a)cdr-h1,其包含seqid no:82或seq id no:83的氨基酸序列,(b)cdr-h2,其包含seq id no:84的氨基酸序列,和(c)cdr-h3,其包含seq id no:85的氨基酸序列;以及轻链可变结构域(vl),其包含:(d)cdr-l1,其包含seq id no:73的氨基酸序列,(e)cdr-l2,其包含seq id no:74的氨基酸序列,和(f)cdr-l3,其包含seq id no:75的氨基酸序列。
33、实施方案32.根据实施方案31所述的前述抗体,其包含选自由以下项组成的组的序列:(a)vh序列,其与seq id no:95的氨基酸序列具有至少约95%、至少约96%、至少约97%、至少约98%或至少约99%同一性;(b)vl序列,其与seq id no:94的氨基酸序列具有至少约95%、至少约96%、至少约97%、至少约98%或至少约99%同一性;以及(c)如(a)中定义的vh序列和如(b)中定义的vl序列。
34、实施方案33.根据实施方案31或32所述的前述抗体,其包含seq id no:95的vh序列和seq id no:94的vl序列。
35、实施方案34.根据实施方案31至33中任一项所述的前述抗体,其包含seq id no:101的重链氨基酸序列和seq id no:100的轻链氨基酸序列。
36、实施方案35.根据实施方案31至33中任一项所述的前述抗体,其包含seq id no:115的重链氨基酸序列和seq id no:100的轻链氨基酸序列。
37、实施方案36.在某些非限制性实施方案中,目前公开的主题提供一种与ccr8结合的单克隆抗体,其中所述抗体包含:重链可变结构域(vh),其包含:(a)cdr-h1,其包含seqid no:86或seq id no:87的氨基酸序列,(b)cdr-h2,其包含seq id no:88的氨基酸序列,和(c)cdr-h3,其包含seq id no:89的氨基酸序列;以及轻链可变结构域(vl),其包含:(d)cdr-l1,其包含seq id no:76的氨基酸序列,(e)cdr-l2,其包含seq id no:77的氨基酸序列,和(f)cdr-l3,其包含seq id no:78的氨基酸序列。
38、实施方案37.根据实施方案36所述的前述抗体,其包含选自由以下项组成的组的序列:(a)vh序列,其与seq id no:97的氨基酸序列具有至少约95%、至少约96%、至少约97%、至少约98%或至少约99%同一性;(b)vl序列,其与seq id no:96的氨基酸序列具有至少约95%、至少约96%、至少约97%、至少约98%或至少约99%同一性;以及(c)如(a)中定义的vh序列和如(b)中定义的vl序列。
39、实施方案38.根据实施方案36或37所述的前述抗体,其包含seq id no:97的vh序列和seq id no:96的vl序列。
40、实施方案39.根据实施方案36至38中任一项所述的前述抗体,其包含seq id no:103的重链氨基酸序列和seq id no:102的轻链氨基酸序列。
41、实施方案40.根据实施方案36至38中任一项所述的前述抗体,其包含seq id no:116的重链氨基酸序列和seq id no:102的轻链氨基酸序列。
42、实施方案41.在某些非限制性实施方案中,目前公开的主题提供一种与ccr8结合的单克隆抗体,其中所述抗体包含:重链可变结构域(vh),其包含:(a)cdr-h1,其包含seqid no:90或seq id no:91的氨基酸序列,(b)cdr-h2,其包含seq id no:92的氨基酸序列,和(c)cdr-h3,其包含seq id no:93的氨基酸序列;以及轻链可变结构域(vl),其包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列,(e)cdr-l2,其包含seq id no:80的氨基酸序列,和(f)cdr-l3,其包含seq id no:81的氨基酸序列。
43、实施方案42.根据实施方案41所述的前述抗体,其包含选自由以下项组成的组的序列:(a)vh序列,其与seq id no:99的氨基酸序列具有至少约95%、至少约96%、至少约97%、至少约98%或至少约99%同一性;(b)vl序列,其与seq id no:98的氨基酸序列具有至少约95%、至少约96%、至少约97%、至少约98%或至少约99%同一性;以及(c)如(a)中定义的vh序列和如(b)中定义的vl序列。
44、实施方案43.根据实施方案41或42所述的前述抗体,其包含seq id no:99的vh序列和seq id no:98的vl序列。
45、实施方案44.根据实施方案41至43中任一项所述的前述抗体,其包含seq id no:105的重链氨基酸序列和seq id no:104的轻链氨基酸序列。
46、实施方案45.根据实施方案41至44中任一项所述的前述抗体,其包含seq id no:117的重链氨基酸序列和seq id no:104的轻链氨基酸序列。
47、实施方案46.在某些非限制性实施方案中,目前公开的主题提供一种与ccr8结合的单克隆抗体,其中所述抗体不依赖于ccr8的硫酸化而与ccr8结合。
48、实施方案47.根据实施方案46所述的前述抗体,其中所述抗体与包含seq id no:106的氨基酸残基2至6中的一者或多者的表位结合。
49、实施方案48.根据实施方案46所述的前述抗体,其中所述抗体与包含seq id no:106的氨基酸残基91至104和172至193中的一者或多者的表位结合。
50、实施方案49.在某些非限制性实施方案中,目前公开的主题提供一种与小鼠ccr8结合的单克隆抗体,其中所述抗体包含:重链可变结构域(vh),其包含:(a)cdr-h1,其包含seq id no:65或seq id no:66的氨基酸序列,(b)cdr-h2,其包含seq id no:67的氨基酸序列,和(c)cdr-h3,其包含seq id no:68的氨基酸序列;以及轻链可变结构域(vl),其包含:(d)cdr-l1,其包含seq id no:62的氨基酸序列,(e)cdr-l2,其包含seq id no:63的氨基酸序列,和(f)cdr-l3,其包含seq id no:64的氨基酸序列。
51、实施方案50.根据实施方案49所述的前述抗体,其包含选自由以下项组成的组的序列:(a)vh序列,其与seq id no:70的氨基酸序列具有至少约95%、至少约96%、至少约97%、至少约98%或至少约99%同一性;(b)vl序列,其与seq id no:69的氨基酸序列具有至少约95%、至少约96%、至少约97%、至少约98%或至少约99%同一性;以及(c)如(a)中定义的vh序列和如(b)中定义的vl序列。
52、实施方案51.根据实施方案49或50所述的前述抗体,其包含seq id no:70的vh序列和seq id no:69的vl序列。
53、实施方案52.根据实施方案49至51中任一项所述的前述抗体,其包含seq id no:72的重链氨基酸序列和seq id no:71的轻链氨基酸序列。
54、实施方案53.根据实施方案1至48中任一项所述的前述抗体,其为人抗体。
55、实施方案54.根据实施方案1至48中任一项所述的前述抗体,其为人源化抗体。
56、实施方案55.根据实施方案1至52中任一项所述的前述抗体,其为嵌合抗体。
57、实施方案56.根据实施方案1至55中任一项所述的前述抗体,其为与ccr8结合的抗体片段。
58、实施方案57.根据实施方案1至56中任一项所述的前述抗体,其为全长抗体。
59、实施方案58.根据实施方案57所述的前述抗体,其为全长igg1抗体。
60、实施方案59.根据实施方案1至58中任一项所述的前述抗体,其包含igg1恒定结构域,所述igg1恒定结构域包含seq id no:53或seq id no:59的氨基酸序列。
61、实施方案60.根据实施方案1至59中任一项所述的前述抗体,其包含κ恒定结构域,所述κ恒定结构域包含seq id no:54的氨基酸序列。
62、实施方案61.根据实施方案1至60中任一项所述的前述抗体,其中所述抗体以约1×10-12m至约1×10-11m的结合亲和力(kd)与ccr8结合。
63、实施方案62.根据实施方案1至48中任一项所述的前述抗体,其中所述ccr8为人ccr8。
64、实施方案63.根据实施方案1至62中任一项所述的前述抗体,其中所述抗体为去岩藻糖基化的。
65、实施方案64.在某些非限制性实施方案中,当前公开的主题提供一种编码根据实施方案1至63中任一项所述的前述抗体的分离的核酸。
66、实施方案65.在某些非限制性实施方案中,当前公开的主题提供一种宿主细胞,其包含根据实施方案64所述的前述核酸。
67、实施方案66.在某些非限制性实施方案中,当前公开的主题提供一种生产与ccr8结合的抗体的方法,所述方法包括在适合表达所述抗体的条件下培养根据实施方案65所述的宿主细胞。
68、实施方案67.根据实施方案66所述的前述方法,其进一步包括从宿主细胞回收抗体。
69、实施方案68.在某些非限制性实施方案中,当前公开的主题提供一种通过实施方案67的前述方法产生的抗体。
70、实施方案69.在某些非限制性实施方案中,当前公开的主题提供一种药物组合物,其包含根据实施方案1至63中任一项所述的前述抗体和药用载体。
71、实施方案70.根据实施方案69所述的前述药物组合物,其进一步包含另外的治疗剂。
72、实施方案71.根据实施方案1至63中任一项所述的前述抗体或根据实施方案69至70中任一项所述的前述药物组合物,其用作药物。
73、实施方案72.根据实施方案1至63中任一项所述的前述抗体或根据权利要求69至70中任一项所述的前述药物组合物,其用于治疗癌症。
74、实施方案73.在某些非限制性实施方案中,当前公开的主题提供根据实施方案1至63中任一项所述的前述抗体或根据实施方案69至70中任一项所述的前述药物组合物在制造于治疗癌症的药物中的用途。
75、实施方案74.在某些非限制性实施方案中,当前公开的主题提供根据实施方案1至63中任一项所述的前述抗体或根据实施方案69至70中任一项所述的前述药物组合物在制造用于消耗调节性t细胞的药物中的用途。
76、实施方案75.在某些非限制性实施方案中,当前公开的主题提供一种治疗有此需要的受试者的癌症的方法,所述方法包括向所述受试者施用有效量的根据实施方案1至63中任一项所述的前述抗体或根据实施方案69至70中任一项所述的前述药物组合物。
77、实施方案76.在某些非限制性实施方案中,当前公开的主题提供一种消耗患有癌症的受试者的肿瘤微环境中的调节性t细胞的方法,所述方法包括向所述受试者施用足以消耗所述肿瘤微环境中的所述调节性t细胞的有效量的根据实施方案1至63中任一项所述的前述抗体或根据实施方案69至70中任一项所述的前述药物组合物。
78、实施方案77.在某些非限制性实施方案中,当前公开的主题提供一种消耗患有癌症的受试者的肿瘤微环境外的调节性t细胞的方法,所述方法包括向所述受试者施用足以消耗所述肿瘤微环境之外的所述调节性t细胞的有效量的根据实施方案1至63中任一项所述的前述抗体或根据实施方案69至70中任一项所述的前述药物组合物。
79、实施方案78.在某些非限制性实施方案中,当前公开的主题提供一种从癌症细胞群中消耗调节性t细胞的体外方法,所述方法包括使所述细胞群与足以从所述细胞群中消耗所述调节性t细胞的量的根据实施方案1至63中任一项所述的前述抗体或根据实施方案69至70中任一项所述的前述药物组合物接触。
80、实施方案79.根据实施方案73至78中任一项所述的前述用途或方法,其中所述癌症选自由以下项组成的组:膀胱癌、母细胞瘤、血癌、骨癌、脑癌、乳腺癌、宫颈癌、结直肠癌、子宫内膜癌、食道癌、胃癌、头颈部癌、肾癌、肝癌、肺癌、卵巢癌、胰腺癌、前列腺癌、肉瘤、皮肤癌、睾丸癌和子宫癌。
81、实施方案80.根据实施方案74、76、78和79中任一项所述的前述用途或方法,其中存在于所述癌症的所述肿瘤微环境中所述调节性t细胞被消耗。
82、实施方案81.根据实施方案74、77、78和79中任一项所述的前述用途或方法,其中所述癌症的所述肿瘤微环境之外的所述调节性t细胞被消耗。
83、实施方案82.根据实施方案73至81中任一项所述的前述用途或方法,其进一步包括施用另外的治疗剂。
84、实施方案83.根据实施方案82所述的前述用途或方法,其中所述另外的治疗剂为抗癌剂。
85、实施方案84.根据实施方案83所述的前述用途或方法,其中所述抗癌剂选自由以下项组成的组:微管破坏剂、抗代谢物、拓扑异构酶抑制剂、dna嵌入剂、烷化剂、激素疗法、激酶抑制剂、受体拮抗剂、肿瘤细胞凋亡激活剂、抗血管生成剂、免疫调节剂、细胞粘附抑制剂、细胞毒性剂或细胞抑制剂、细胞凋亡激活剂、增加细胞对凋亡诱导剂敏感性的药剂、细胞因子、抗癌疫苗或溶瘤病毒、toll样受体(tlr)剂、双特异性抗体、细胞疗法和免疫细胞接合剂。
86、实施方案85.根据实施方案83或84所述的前述用途或方法,其中所述抗癌剂为pd-l1结合拮抗剂。
87、实施方案86.根据实施方案85所述的前述用途或方法,其中所述pd-l1结合拮抗剂为阿特珠单抗。
88、实施方案87.根据实施方案73至85中任一项所述的前述用途或方法,其中所述受试者为人。
89、实施方案88.根据实施方案73至85中任一项所述的前述用途或方法,其中所述受试者为小鼠。
90、实施方案89.在某些非限制性实施方案中,当前公开的主题提供一种对小鼠的疾病进行治疗的方法,所述方法包括向小鼠施用有效量的根据实施方案49至52中任一项所述的前述单克隆抗体以治疗所述疾病。
91、实施方案90.根据实施方案89所述的前述方法,其中所述小鼠包含异种移植物。
92、实施方案91.根据实施方案63所述的前述抗体,其中去岩藻糖基化的比例在约80%至约95%之间。
93、实施方案92.根据实施方案1至15和46至48中任一项所述的前述抗体,其中在第1天静脉内施用单一10mg/kg剂量后的平均清除率历经35天的时间段为约3至约5ml/天/kg。
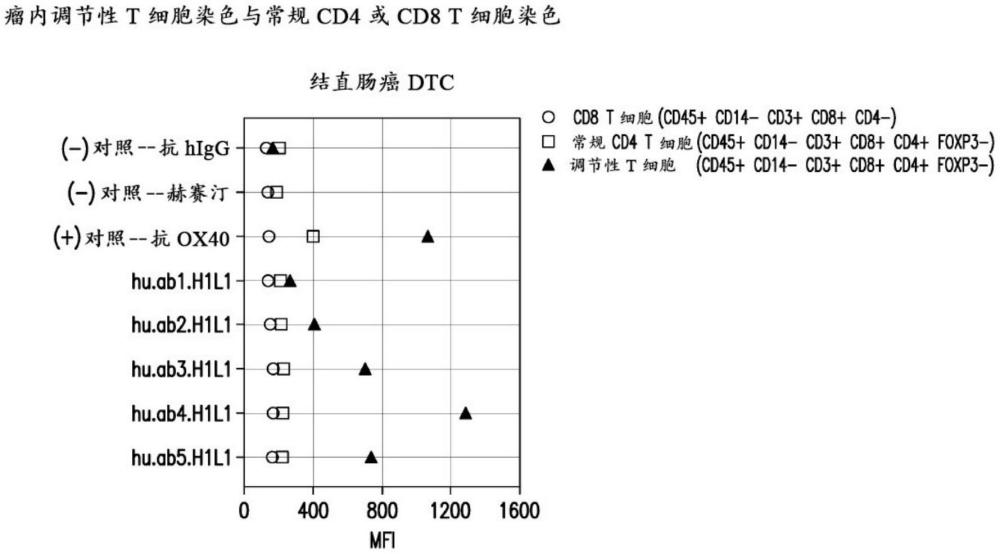
- 还没有人留言评论。精彩留言会获得点赞!