氧代吡啶类化合物的新型制备方法及关键中间体与流程
本发明属于药物化学制备领域,具体涉及到一种氧代吡啶类化合物的新型制备方法及其关键中间体。
背景技术:
1、血栓栓塞病是人类和动物在存活期间,由血管内形成的异常血凝块造成的疾病。fxia靶点的药物可阻断内源性途径并抑制凝血级联反应的放大,从而具有抗血栓形成的作用,该靶点已作为近年来研究抗凝血药热点。其中,以拜耳制药的bay-2433334抗凝血药物为基础,成都施贝康进行了大量结构改造和工艺研究,旨在提供效果更好、更适合工业化放大生产的品种。
2、尤其在如下式(i)所示的抗凝血衍生药物的制备研究过程中发现,采用拜耳制药的化合物专利及其工艺专利方法均难以获得高收率和高纯度原料药。
3、。
4、专利wo 2014/154794和wo 2017/005725披露了该类化合物的合成以2,5-二甲氧基吡啶为起始原料,采用线性合成策略经九步合成目标化合物,不仅路线冗长,而且容易高外消旋化,总收率低,其中粗品合成步收率仅为70%,且为外消旋体,需要繁琐的后处理和纯化程序,并通过hplc或手性超临界流体色谱法(sfc)分离异构体,耗时且昂贵,不适用工业化放大生产。
5、专利cn 111770917 a中公开了聚合式合成策略,主要合成步骤如下所示,分别合成关键中间体式(xvi-cf3)/(xvi-cl)化合物和式(xix)化合物后,经缩合反应生成化合物1/化合物2的粗品,再经化学纯化、正向色谱法分离杂质。总反应经历六步,最长四步,缩短了反应周期,粗品经过滤和蒸发溶剂后以85%ee至93%ee的高ee-值获得非晶形式的原料药粗品。
6、
7、虽然该专利的聚合式合成路线整体优于线性合成策略,但是当r1位置存在取代基的时候,尤其烷基取代的时候,即使采用cn 111770917 a合成思路仍不能通过化学合成的方法得到高手性纯度的产品,仍需要通过色谱柱拆分获得ee-值>98%的产品。综合以上因素,如上式(i)所示的该系列化合物的后续纯化难度和产品质量控制风险仍是目前亟待解决的技术难题。
技术实现思路
1、为了解决现有技术存在的技术问题,提高收率和ee值,更适合工业化生产,本发明公开了一种用于氧代吡啶类化合物的新型制备方法及其关键中间体。
2、一方面,本发明提供了一种式(ii)所示的中间体或其药学上可接受的盐:
3、,其中:
4、r2、r3、r4、r5独立地选自氢、卤素、烷氧基或卤代烷基。
5、x选自卤素原子。
6、进一步地,上述式(ii)所示的中间体或其药学上可接受的盐中:
7、和/或r2、r3、r4、r5独立地选自氢、氟、氯、甲氧基、乙氧基或三氟甲基。
8、更进一步地,上述式(ii)所示的中间体或其药学上可接受的盐中,所述式(ii)中间体包括如下结构:
9、,
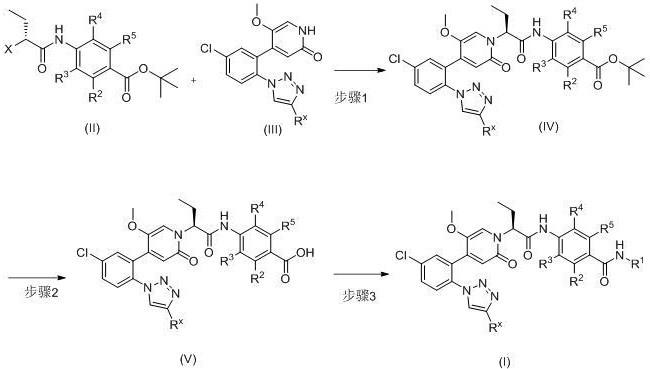
10、其中r2、r3、r4、r5、的定义同上述相应定义。
11、进一步地,上述任一中间体的结构中的氢可被至少1个氘取代。
12、进一步地,上述中间体包括如下化合物:
13、、、、。
14、进一步地,本发明还提供上述任一中间体或其药学上可接受的盐用于标准品、对照品或在制备治疗或预防血管动脉疾病的药物中的应用。
15、另一方面,本发明还提供一种式(ⅰ)所示氧代吡啶类化合物的制备方法,包括如下反应步骤:
16、其中,
17、rx选自氟、氯或三氟甲基;
18、r1选自烷基、环烷基或氘代烷基、环烷基;
19、r2、r3、r4、r5独立地选自氢、卤素、烷氧基或卤代烷基。
20、步骤1:式(ⅱ)所示的中间体或其药学上可接受的盐和式(ⅲ)化合物反应获得式(iv)化合物;
21、步骤2:式(iv)化合物发生水解反应得到式(v)化合物;
22、步骤3:式(v)化合物发生缩合反应得到式(i)化合物。
23、进一步优选地,上述方法中:
24、r1选自甲基或氘代甲基;
25、和/或r2、r3、r4、r5独立地选自氢、氟、氯、甲氧基、乙氧基或三氟甲基。
26、进一步地,上述步骤1包括如下反应条件:
27、所述反应条件包括碱,所述碱选自有机碱或无机碱;优选地,所述碱包括四甲基胍、三乙胺、dbu、dipea、吡啶、碳酸钠、碳酸钾、碳酸铯、碳酸氢钾、碳酸氢钠、氢氧化锂、氢氧化钠、氢氧化钾中的任一种或两种以上混合;更优选地,所述碱包括四甲基胍、三乙胺、dbu、dipea、碳酸钾、碳酸铯中的任一种或两种以上混合;
28、所述反应条件的反应溶剂选自有机溶剂;优选地,所述有机溶剂包括异丙醇、乙醇、丙酮、dmf、四氢呋喃、2-甲基四氢呋喃、二氧六环中的任一种或两种以上混合;
29、任选地,所述步骤1中式(ⅱ)化合物与碱的摩尔比为1:1~3,优选为1:2;
30、任选地,所述步骤1的反应温度为0℃~60℃,优选为20℃~40℃,更优选为26~32℃;
31、任选地,所述步骤1的反应时间为1~10小时,优选为4~6小时。
32、进一步地,上述步骤2包括如下反应条件:
33、所述反应条件包括酸,所述酸选自有机酸或无机酸;优选地,所述酸包括盐酸、三氟乙酸、硫酸、磷酸、醋酸、氢溴酸中的任一种或两种以上混合;更优选地,所述碱包括盐酸、三氟乙酸、硫酸中的任一种或两种以上混合;
34、所述反应条件的反应溶剂选自有机溶剂;优选地,所述有机溶剂包括异四氢呋喃、2-甲基四氢呋喃、二氧六环、丙酮、甲醇、乙醇、异丙醇、dmf中的任一种或两种以上混合;
35、任选地,所述步骤2中式(iv)化合物与酸的摩尔比为1:30,优选为10:20;
36、任选地,所述步骤2的反应温度为-20℃~40℃,优选为-10℃~10℃,更优选为-5℃~5℃;
37、任选地,所述步骤2的反应时间为1~8小时,优选为2~4小时。
38、进一步地,上述步骤3包括如下反应条件:
39、所述反应条件包括碱,所述碱选自有机碱或无机碱;优选地,所述碱包括三乙胺、dbu、dipea、四甲基胍、吡啶、碳酸钠、碳酸钾、碳酸铯、碳酸氢钾、碳酸氢钠、氢氧化锂、氢氧化钠、氢氧化钾中的任一种或两种以上混合;更优选地,所述碱包括三乙胺、dbu、dipea、四甲基胍、碳酸钾、碳酸铯中的任一种或两种以上混合;
40、所述反应条件包括缩合剂和配体;优选地,所述缩合剂及配体包括edci,hobt、hatu、hbtu、dcc、cdi、t3p、dpp-cl、hctu、tbtu、dmap中的任一种或两种以上混合;更优选地,所述碱包括edci,hobt、hatu、hbtu中的任一种或两种以上混合;
41、所述反应条件的反应溶剂选自有机溶剂;优选地,所述有机溶剂包括异四氢呋喃、dcm、2-甲基四氢呋喃、二氧六环、乙腈、丙酮、乙醇、异丙醇、dmf、dmac中的任一种或两种以上混合;
42、任选地,所述步骤3中式(v)化合物与碱的摩尔比为1:1~5,优选为1:3;
43、任选地,所述步骤3的反应温度为0℃~60℃,优选为20℃~40℃,更优选为26~32℃;
44、任选地,所述步骤3的反应时间为1~10小时,优选为4~6小时。
45、术语解释:
46、“烷基”指低级烷基,具体为含有c1-c16饱和支链或直链烷基。“烷基羰基”中的烷基部分作相同解释。
47、“环烷基”指含c3-c10环烷基,优选c3-c6环烷基。
48、“卤素”指氟、氯、溴、碘。
49、“以上”、“以下”包含本数。
50、dbu:1,8-二氮杂二环十一碳-7-烯
51、dipea:异丙基乙胺
52、t3p:1-丙基磷酸环酐
53、dpp-cl:二苯基次膦酰氯
54、edci:1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐
55、hobt:1-羟基苯并三唑
56、hbtu:苯并三氮唑-n,n,n',n'-四甲基脲六氟磷酸盐
57、hatu:2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯
58、dcc: n,n'-二环己基碳二亚胺
59、相对于现有技术,本发明具有以下优势:
60、通过本发明的合成路线,可以在一定程度上提高n-烷基化:o-烷基化的比率,同时,通过对中间体式(v)化合物的化学拆分,获得ee-值高于99%的中间体式(v);最后通过缩合反应得到目标化合物式(i);保持式(i)的ee-值高于99%。使得式(i)化合物的化学拆分方法可以在工艺放大过程应用,无需通过高昂的手性超临界流体色谱法(sfc)拆分。
- 还没有人留言评论。精彩留言会获得点赞!