芯片、门静脉癌栓模型、芯片上热消融模型及其构建方法和应用
本发明涉及器官芯片,特别涉及芯片、门静脉癌栓模型、芯片上热消融模型及其构建方法和应用。
背景技术:
1、结直肠癌是全球第三大常见癌症。肿瘤转移是结直肠癌患者死亡的主要原因。肝门静脉是肠和肝之间物质交换的主要部位,因此肝脏是结直肠癌最常见的转移部位。从原发部位逃逸的结直肠癌细胞很容易通过血流进入肝门静脉。结直肠癌细胞一旦定植门静脉,由于营养供应充足,增殖迅速,最终导致门静脉癌栓(pvtt)。门静脉癌栓后期可造成严重的肝脏损害,甚至患者死亡。
2、传统上,临床标本和动物模型被用来研究pvtt的进展。通过临床标本,发现pvtt的形成与pvtt与相应实质肿瘤组织间的长链非编码rna、mirna表达谱及差异表达蛋白有关。在实践中,pvtt组织样本是稀缺的。此外,其他关于pvtt的研究都是基于动物模型。如wang等人基于肝细胞癌诱导的肿瘤血栓组织建立了人pvtt来源的裸鼠异种移植动物模型,lindsay等人利用猴子转移性肝细胞癌模型揭示了晚期静脉肿瘤血栓的特征,genda等人在小鼠模型中复制了肝肿瘤血栓的肝内转移。这些模型对解决pvtt的特性具有重要的价值,但也存在许多不足。由于结直肠癌诱导的pvtt实验周期长,难以在动物上实现,pvtt动物模型的成功率较低。此外,动物和人类之间也存在物种差异。目前报道的方法也难以揭示结直肠癌诱导pvtt早期的动态进展变化,包括肝脏结构和肝细胞功能。近年来,器官芯片得到了快速发展。其中,肝脏芯片已被用于复现各种人类疾病,但尚未见报道肝脏芯片应用于结直肠癌诱导的pvtt的疾病建模。
3、因此,如何解决pvtt研究中临床标本稀缺和动物模型物种差异的问题,是本领域技术人员目前需要解决的技术问题。
技术实现思路
1、有鉴于此,本发明提供了芯片、门静脉癌栓模型、芯片上热消融模型及其构建方法和应用。本发明提供了芯片、片上门静脉癌栓模型、片上热消融模型、片上门静脉癌栓模型的构建方法、片上热消融模型的构建方法以及芯片、片上门静脉癌栓模型、片上热消融模型在筛选预防和/或治疗门静脉癌栓的药物、检测肿瘤诱导pvtt早期动态进展变化的产品中的应用。本发明通过实验发现本发明癌栓种植成功率高,可视化程度高,可重复性强,为人类门静脉癌栓的进展研究和治疗方案筛选提供了一个新平台。
2、为了实现上述发明目的,本发明提供以下技术方案:
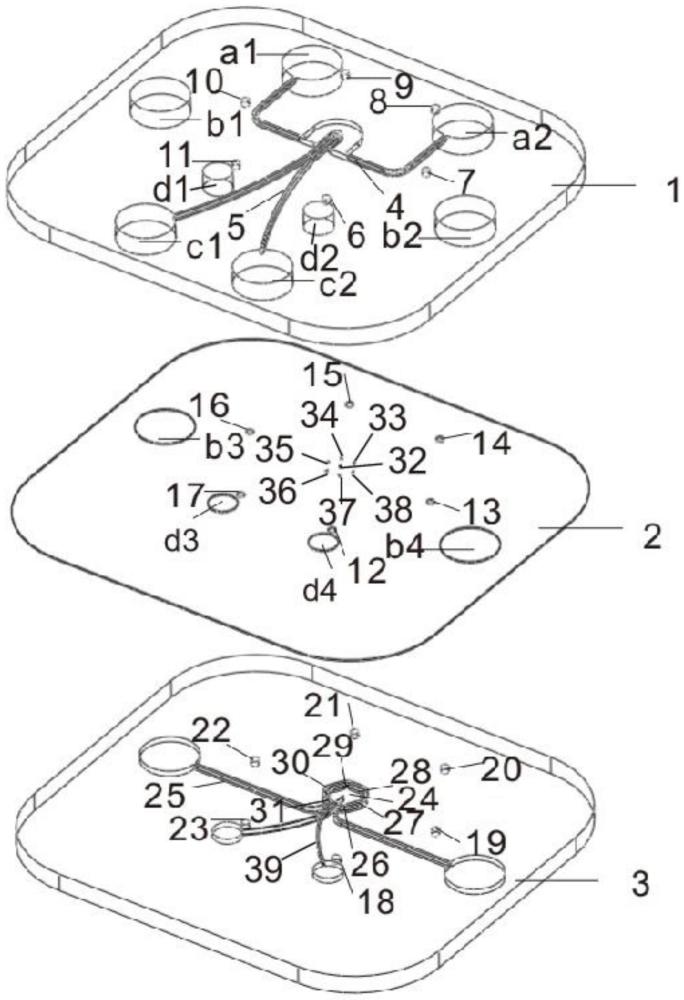
3、本发明提供了芯片,其包括由上至下依次叠置的上层芯片(1)、中层芯片(2)和下层芯片(3);
4、所述上层芯片(1)设置有肝动脉通道(4)、中央静脉通道(5)、连通所述上层芯片(1)顶端和所述上层芯片(1)底端的第一通孔;
5、所述中层芯片(2)设置有连通所述中层芯片(2)顶端和所述中层芯片(2)底端的第二通孔;
6、所述下层芯片(3)设置有热消融点(18)(19)(20)(21)(22)(23)、肝小叶组织区(24)、门静脉通道(25)和细胞通道(39);
7、所述第一通孔包括独立设置的热消融上层通孔(6)(7)(8)(9)(10)(11)、肝动脉上层通孔(a1)(a2)、门静脉上层通孔(b1)(b2)、中央静脉上层通孔(c1)(c2)和细胞上层通孔(d1)(d2);
8、所述第二通孔包括独立设置的热消融中层通孔(12)(13)(14)(15)(16)(17)、门静脉中层通孔(b3)(b4)、细胞中层通孔(d3)(d4)、中央静脉中层通孔(32)和肝动脉中层通孔(33)(34)(35)(36)(37)(38);
9、所述肝动脉通道(4)和所述中央静脉通道(5)独立设置;所述肝动脉通道(4)和所述门静脉通道(25)独立设置;所述肝动脉通道(4)连通所述肝动脉上层通孔(a1)和所述肝动脉上层通孔(a2);所述中央静脉通道(5)连通所述中央静脉上层通孔(c1)和所述中央静脉上层通孔(c2);所述肝动脉通道(4)中间区段的外侧和内侧分别为同方向弯曲的u型结构,所述内侧的u型结构的直径小于所述外侧的u型结构的直径;所述肝动脉通道(4)和所述中央静脉通道(5)为上层芯片(1)底端开口的槽体结构;所述中央静脉通道(5)的中间区段与所述中央静脉中层通孔(32)连通;所述肝小叶组织区(24)和所述门静脉通道(25)为下层芯片(3)顶端开口的槽体结构;
10、所述门静脉通道(25)的一端通过所述门静脉中层通孔(b3)和所述门静脉上层通孔(b1)连通;所述门静脉通道(25)的另一端通过所述门静脉中层通孔(b4)和所述门静脉上层通孔(b2)连通;所述门静脉通道(25)中间区段围绕于所述肝小叶组织区(24)外围,并紧密贴合;所述肝小叶组织区(24)为正六边形,所述肝小叶组织区(24)的折角位置设置有连通所述肝小叶组织区(24)和所述门静脉通道(25)的门静脉物质交换孔(26)(27)(28)(29)(30)(31),所述门静脉通道(25)与所述肝小叶组织区(24)紧密贴合一侧的相应位置设置有门静脉物质交换孔(26’)(27’)(28’)(29’)(30’)(31’);所述肝小叶组织区(24)和所述细胞通道(39)的中间区段连通,所述细胞通道(39)的一端通过所述细胞中层通孔(d3)和所述细胞上层通孔(d1)连通,所述细胞通道(39)的另一端通过所述细胞中层通孔(d4)和所述细胞上层通孔(d2)连通,所述肝小叶组织区(24)通过所述细胞通道(39)和细胞中层通孔(d3)(d4)连通;所述肝小叶组织区(24)通过所述中央静脉中层通孔(32)和所述中央静脉通道(5)连通,所述肝小叶组织区(24)通过所述肝动脉中层通孔(33)(34)(35)(36)(37)(38)和所述肝动脉通道(4)连通;
11、由上至下投影,所述门静脉中层通孔(b3)和所述门静脉上层通孔(b1)重合,所述门静脉中层通孔(b4)和所述门静脉上层通孔(b2)重合,所述细胞中层通孔(d3)和所述细胞上层通孔(d1)重合,所述细胞中层通孔(d4)和所述细胞上层通孔(d2)重合;
12、所述门静脉物质交换孔(26)和所述热消融点(18)、所述门静脉物质交换孔(27)和所述热消融点(19)、所述门静脉物质交换孔(28)和所述热消融点(20)、所述门静脉物质交换孔(29)和所述热消融点(21)、所述门静脉物质交换孔(30)和所述热消融点(22)、所述门静脉物质交换孔(31)和所述热消融点(23)的平面直线距离相等;
13、所述上层芯片(1)、中层芯片(2)和下层芯片(3)的材质为聚二甲基硅氧烷;所述热消融中层通孔(12)(13)(14)(15)(16)(17)与所述热消融点(18)(19)(20)(21)(22)(23)相对齐,确定所述中层芯片(2)和下层芯片(3)的相对位置,所述热消融中层通孔(12)(13)(14)(15)(16)(17)与所述热消融上层通孔(6)(7)(8)(9)(10)(11)相对齐,确定所述上层芯片(1)和中层芯片(2)的相对位置,将所述上层芯片(1)、中层芯片(2)和下层芯片(3)通过等离子体键合紧固连接。
14、在本发明的一些具体实施方案中,所述热消融上层通孔(6)(7)(8)(9)(10)(11)和所述热消融中层通孔(12)(13)(14)(15)(16)(17)的直径包括0.3mm~0.5mm;
15、所述热消融点(18)(19)(20)(21)(22)(23)的中心和所述门静脉物质交换孔(26)(27)(28)(29)(30)(31)的中心的距离包括0.4cm~0.5cm。
16、在本发明的一些具体实施方案中,所述热消融上层通孔(6)(7)(8)(9)(10)(11)和所述热消融中层通孔(12)(13)(14)(15)(16)(17)的直径包括0.4mm;
17、所述热消融点(18)(19)(20)(21)(22)(23)的中心和所述门静脉物质交换孔(26)(27)(28)(29)(30)(31)的中心的距离包括0.45cm。
18、在本发明的一些具体实施方案中,所述热消融上层通孔(6)(7)(8)(9)(10)(11)和所述热消融中层通孔(12)(13)(14)(15)(16)(17)的直径包括0.5mm;
19、所述热消融点(18)(19)(20)(21)(22)(23)的中心和所述门静脉物质交换孔(26)(27)(28)(29)(30)(31)的中心的距离包括0.4cm。
20、在本发明的一些具体实施方案中,所述热消融上层通孔(6)(7)(8)(9)(10)(11)和所述热消融中层通孔(12)(13)(14)(15)(16)(17)的直径包括0.3mm;
21、所述热消融点(18)(19)(20)(21)(22)(23)的中心和所述门静脉物质交换孔(26)(27)(28)(29)(30)(31)的中心的距离包括0.5cm。
22、本发明还提供了所述的芯片在构建门静脉癌栓模型和/或芯片上热消融模型中的应用。
23、本发明还提供了门静脉癌栓模型的构建方法,其包括:
24、a、取肝细胞接种于所述芯片,培养,获得人肝脏微组织;
25、b、获得人结直肠癌肿瘤球;
26、c、取b所述人结直肠癌肿瘤球,经门静脉上层通孔(b1)或门静脉上层通孔(b2)加载入所述芯片中的门静脉通道(25),定植于所述芯片中的任意一个或多个门静脉物质交换孔(26)(27)(28)(29)(30)(31),获得所述门静脉癌栓模型;
27、所述培养包括依靠重力驱动培养基流动,具体包括:
28、调整所述肝动脉上层通孔(a1)(a2)的培养基储存器液面高度为18mm,调整所述门静脉上层通孔(b1)(b2)的培养基储存器液面高度为21mm,调整所述中央静脉上层通孔(c1)(c2)的培养基储存器液面高度为3mm;
29、肝动脉细胞培养基从所述肝动脉上层通孔(a1)(a2)通过所述肝动脉通道(4)经过所述肝动脉中层通孔(33)(34)(35)(36)(37)(38)流入所述肝小叶组织区(24);门静脉细胞培养基从所述门静脉上层通孔(b1)(b2)通过所述门静脉中层通孔(b3)(b4)流入门静脉通道(25)再经所述门静脉物质交换孔(26)(27)(28)(29)(30)(31)流入所述肝小叶组织区(24);流入所述肝小叶组织区(24)的细胞培养基汇聚在肝小叶组织区(24)的中心,通过中央静脉中层通孔(32),流出至所述中央静脉通道(5),最终从所述中央静脉上层通孔(c1)(c2)流出。
30、在本发明的一些具体实施方案中,所述步骤1具体包括:
31、取肝细胞和牛纤维蛋白原溶液,混合均匀,得到细胞悬浮液;取所述细胞悬浮液和凝血酶混合,经细胞上层通孔(d1)或细胞上层通孔(d2)、细胞通道(39)灌入所述芯片中的所述肝小叶组织区(24),静置形成三维微环境,培养,获得人肝脏微组织;
32、所述培养包括依靠重力驱动培养基流动,具体包括:
33、调整所述肝动脉上层通孔(a1)(a2)的培养基储存器液面高度为18mm,调整所述门静脉上层通孔(b1)(b2)的培养基储存器液面高度为21mm,调整所述中央静脉上层通孔(c1)(c2)的培养基储存器液面高度为3mm;
34、肝动脉细胞培养基从所述肝动脉上层通孔(a1)(a2)通过所述肝动脉通道(4)经过所述肝动脉中层通孔(33)(34)(35)(36)(37)(38)流入所述肝小叶组织区(24);门静脉细胞培养基从所述门静脉上层通孔(b1)(b2)通过所述门静脉中层通孔(b3)(b4)流入门静脉通道(25)再经所述门静脉物质交换孔(26)(27)(28)(29)(30)(31)流入所述肝小叶组织区(24);流入所述肝小叶组织区(24)的细胞培养基汇聚在肝小叶组织区(24)的中心,通过中央静脉中层通孔(32),流出至所述中央静脉通道(5),最终从所述中央静脉上层通孔(c1)(c2)流出;或
35、步骤2所述接种的密度包括200个cells/载体;或
36、步骤2所述培养的时间包括4天;或
37、所述人结直肠癌肿瘤球的直径包括100~150μm。
38、在本发明的一些具体实施方案中,牛纤维蛋白原溶液的质量浓度包括6mg/ml;所述肝细胞的悬浮液和牛纤维蛋白原浓度的体积比为1:1;所述凝血酶的浓度包括50u/ml,所述细胞悬浮液和所述凝血酶的体积比为10:0.6。
39、在本发明的一些具体实施方案中,所述静置形成三维微环境的温度包括37℃,所述静置形成三维微环境的时间包括15分钟;所述培养的温度包括37℃,所述培养的时间包括4天。
40、在本发明的一些具体实施方案中,步骤2所述人结直肠癌肿瘤球的直径包括120μm。
41、在本发明的一些具体实施方案中,步骤2所述载体包括96孔圆底超低吸附培养板;步骤2所述接种的密度包括200个cells/孔。
42、本发明还提供了芯片上热消融模型的构建方法,取所述构建方法获得的门静脉癌栓模型,热消融,获得芯片上热消融模型;
43、所述热消融包括:依据所述人结直肠癌肿瘤球定植的门静脉物质交换孔确定热消融点,在所述热消融点对应的所述热消融上层通孔和所述热消融中层通孔填充导电胶,插入消融针进行热消融;
44、所述热消融上层通孔(6)(7)(8)(9)(10)(11)和所述热消融中层通孔(12)(13)(14)(15)(16)(17)的直径包括0.3mm~0.5mm;
45、所述热消融点(18)(19)(20)(21)(22)(23)的中心和所述门静脉物质交换孔(26)(27)(28)(29)(30)(31)的中心的距离包括0.4cm~0.5cm;
46、所述热消融的时间包括2~4分钟。
47、在本发明的一些具体实施方案中,所述人结直肠癌肿瘤球定植于所述门静脉物质交换孔(26),确定所述热消融点为所述热消融点(18);所述人结直肠癌肿瘤球定植于所述门静脉物质交换孔(27),确定所述热消融点为所述热消融点(19);所述人结直肠癌肿瘤球定植于所述门静脉物质交换孔(28),确定所述热消融点为所述热消融点(20);所述人结直肠癌肿瘤球定植于所述门静脉物质交换孔(29),确定所述热消融点为所述热消融点(21);所述人结直肠癌肿瘤球定植于所述门静脉物质交换孔(30),确定所述热消融点为所述热消融点(22);所述人结直肠癌肿瘤球定植于所述门静脉物质交换孔(31),确定所述热消融点为所述热消融点(23)。
48、在本发明的一些具体实施方案中,所述热消融上层通孔(6)(7)(8)(9)(10)(11)和所述热消融中层通孔(12)(13)(14)(15)(16)(17)的直径包括0.4mm;
49、所述热消融点(18)(19)(20)(21)(22)(23)的中心和所述门静脉物质交换孔(26)(27)(28)(29)(30)(31)的中心的距离包括0.45cm;
50、所述热消融的时间包括3分钟。
51、在本发明的一些具体实施方案中,所述热消融上层通孔(6)(7)(8)(9)(10)(11)和所述热消融中层通孔(12)(13)(14)(15)(16)(17)的直径包括0.5mm;
52、所述热消融点(18)(19)(20)(21)(22)(23)的中心和所述门静脉物质交换孔(26)(27)(28)(29)(30)(31)的中心的距离包括0.4cm;
53、所述热消融的时间包括2分钟。
54、在本发明的一些具体实施方案中,所述热消融上层通孔(6)(7)(8)(9)(10)(11)和所述热消融中层通孔(12)(13)(14)(15)(16)(17)的直径包括0.3mm;
55、所述热消融点(18)(19)(20)(21)(22)(23)的中心和所述门静脉物质交换孔(26)(27)(28)(29)(30)(31)的中心的距离包括0.5cm;
56、所述热消融的时间包括4分钟。
57、本发明还提供了所述构建方法获得的门静脉癌栓模型。
58、本发明还提供了所述构建方法获得的芯片上热消融模型。
59、本发明还提供了以下任意项在筛选预防和/或治疗门静脉癌栓的药物、检测肿瘤诱导pvtt早期动态进展变化的产品中的应用:
60、(i)、所述芯片;和/或
61、(ii)、所述门静脉癌栓模型;和/或
62、(iii)、所述芯片上热消融模型。
63、在本发明的一些具体实施方案中,所述肿瘤包括人结直肠癌。
64、在本发明的一些具体实施方案中,所述pvtt早期动态进展变化包括肿瘤指标、肝脏细胞活性中的一种或多种。
65、本发明包括但不限于取得了如下有益效果:
66、(1)构建门静脉癌栓模型,即从肝芯片门静脉通道加载结直肠癌肿瘤球,模拟癌栓对门静脉产生的堵塞影响。这得益于本发明所使用芯片的双供血通道,将门静脉与肝动脉区别开,使构建门静脉相关的疾病模型成为可能。
67、(2)构建芯片上热消融模型,首次验证片上进行热消融的可行性,一定程度上扩展芯片的应用。
68、(3)本发明提供的一种片上门静脉癌栓热消融模型构建技术,癌栓种植成功率高,为人类门静脉癌栓的进展研究和治疗方案筛选提供了一个新平台。
- 还没有人留言评论。精彩留言会获得点赞!