一种N端带有柔性多肽链的蛋白质及其制备方法和应用与流程
本发明涉及单分子磁镊,尤其涉及一种n端带有柔性多肽链的蛋白质及其制备方法和应用。
背景技术:
1、在单分子力谱实验中,需要使用顺磁球(磁镊)、针尖(原子力显微镜)、介质球(光镊)对dna或蛋白质等生物大分子施加拉力,达到操控、测量分子力学性质、测量分子伸长等目的。这就需要在目标分子的两端添加化学标签,例如生物素、巯基、氨基、特定的多肽链等。在光镊实验中,为了尽可能使蛋白质远离光势阱,以及减小两个光势阱之间的干扰,会使用较长的双链dna连接在蛋白质的两端;单分子磁镊技术被广泛的用于测量蛋白质或是dna的力学性质,或生物大分子之间的相互作用,磁镊实验中,也常见在蛋白质样品和磁球之间连接数百纳米长的双链dna,增加磁球与样品基底之间的距离,减小磁球与玻璃表面之间的相互作用。但是制备能够在单分子实验中使用的双链dna较为繁琐,需要使用pcr技术,获得两端含有不同化学的dna手柄。dna手柄在与蛋白质连接时,会降低样品的有效浓度,极大的增加实验困难,增多实验步骤。
2、剑桥大学mark howarth团队发现cnab2蛋白质(pdb:2x5p)内由31号赖氨酸和117号天冬氨酸形成异肽键,并将该蛋白质上含有117号天冬氨酸的13个残基的多肽链截取下来称为spytag,剩余部分称为spycatcher。在溶液环境中,spytag上的天冬氨酸残基会自发的和spycatcher上的赖氨酸残基形成异肽键,从而实现蛋白质之间的共价连接。spytag/spycatcher被广泛的应用于将蛋白质连接实验中,相对于传统的生物素与亲和素的连接主要有两方面的优势:a)spytag和spycatcher之间的连接是共价连接不易发生解离,更加适合单分子力谱等需要稳定连接的实验;b)生物素与蛋白质上的avitag发生共价连接需要生物素连接酶的催化,相对于spytag直接添加基因序列在目标蛋白质上来说增加了实验难度。
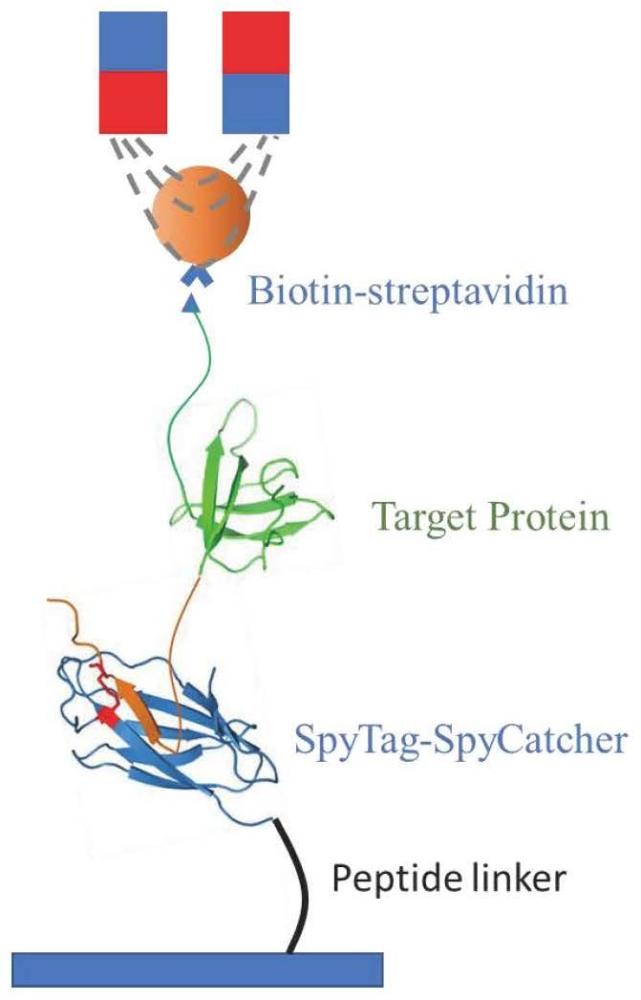
3、在单分子磁镊实验过程中,生物大分子的一端被连接在顺磁球上,另一端带有spytag或dogtag的氨基酸序列,从而和玻璃基板上的spycatcher或dogcatcher发生特异性共价连接。磁镊实验中使用的磁球的直径通常在1~3微米之间,而蛋白质分子的尺寸通常在数纳米至数十纳米之间。首先,磁球和基底表面会有排除体积效应,会降低磁球与基底表面蛋白质连接的成功率。另外,磁球与玻璃表面的单个蛋白质发生结合距玻璃表面仅有数纳米至数十纳米,且磁球具有加大的表面积会和玻璃表面具有非特异性的静电相互作用,从而影响磁球对蛋白质样品施加的拉力准确性。由此,如何增加不同长度的linker在spycatcher的n端起到类似于dna手柄的作用,增加磁球与样品基底之间的距离,减小磁球与玻璃表面之间的相互作用,同时规避制备dna手柄出现的降低样品有效浓度和增多实验步骤等成为本领域技术人员亟待解决的技术问题。
技术实现思路
1、本发明的目的在于提供一种n端带有柔性多肽链的蛋白质及其制备方法和应用,以解决现有技术中存在的问题。
2、为了实现上述发明目的,本发明提供以下技术方案:
3、本发明提供了一种n端带有柔性多肽链的蛋白质,所述n端带有柔性多肽链的蛋白质为fh1(182)-spycatcher、fh1(60)-spycatcehr、elastin(50)-spycatcher、fh1(60)-dogcatcher中的一种;
4、fh1(182)-spycatcher的氨基酸序列为如序列表seq id no:1所示;fh1(60)-spycatcehr的氨基酸序列为如序列表seq id no:2所示;elastin(50)-spycatcher的氨基酸序列为如序列表seq id no:3所示;fh1(60)-dogcatcher的氨基酸序列为如序列表seqid no:4所示。
5、本发明还提供了上述的n端带有柔性多肽链的蛋白质的制备方法,包括以下步骤:
6、步骤1)将n端带有柔性多肽链的蛋白质氨基酸序列对应的基因插入到原核表达载体pqe80l中,构建重组表达载体;
7、步骤2)将重组表达载体导入到感受态大肠杆菌bl21(de3)中,使用含有氨苄青霉素的固体培养基挑选含有目标质粒的菌落,获得表达菌株;
8、步骤3)将表达菌株在含有抗生素的lb培养基中培养至对数生长期,并加入诱导剂iptg,进行诱导表达;
9、步骤4)将诱导后的菌液收集并破碎,离心收集上清液进行分离纯化,即得n端带有柔性多肽链的蛋白质。
10、优选的,所述表达菌株在培养至对数生长期时,大肠杆菌溶液的od值在0.6~0.8之间;所述诱导表达的温度为35~37℃,时间为2~4h,摇床转速为200~250r/min;所述iptg的加入量为1mg/ml。
11、优选的,所述分离纯化的方法包括亲和纯化法;采用镍柱进行亲和纯化。
12、本发明还提供了上述的n端带有柔性多肽链的蛋白质在单分子磁镊技术中的应用。
13、优选的,应用方法包括以下步骤:
14、步骤1)将盖玻片浸泡于aptes溶液中,对盖玻片进行氨基化修饰,得到氨基化的盖玻片;
15、步骤2)将氨基化的盖玻片浸泡于sulfo-smcc溶液中进行修饰,使盖玻片能与权利要求1所述的n端带有柔性多肽链的蛋白连接;
16、步骤3)将盖玻片浸泡在权利要求1所述的n端带有柔性多肽链的蛋白中,得到连接有n端带有柔性多肽链的蛋白的盖玻片;
17、步骤4)将步骤3)的盖玻片浸泡在bsa溶液中,对盖玻片表面进行封闭处理,得到封闭处理后的盖玻片;
18、步骤5)将封闭处理后的盖玻片浸泡于目标蛋白溶液中,进行反应,使目标蛋白与盖玻片表面的n端带有柔性多肽链的蛋白连接;
19、步骤6)向步骤5)中冲入链霉亲和素修饰的顺磁球,静置使磁球与蛋白质发生结合;然后使用双磁铁对磁球施加拉力,通过精确的控制磁铁到蛋白质样品的距离,精确的调控蛋白质上受到的拉力。
20、优选的,所述aptes溶液的的浓度为1%,所述aptes溶液和甲醇的体积比为200μl:20ml;所述步骤1)的浸泡时间为1h,温度为常温;
21、所述sulfo-smcc溶液的浓度为0.01mg/μl;所述sulfo-smcc溶液的用量为0.2mg;所述步骤2)的浸泡时间为20~25min,温度为常温。
22、优选的,在连接n端带有柔性多肽链的蛋白的过程中使用pbs缓冲液将溶液的ph值控制在6~8左右;所述pbs缓冲液的浓度为1x;所述步骤3)的浸泡时间为2h,温度为常温;
23、所述bsa溶液的质量浓度为0.5~2%,bsa溶液的用量为;所述步骤4)的浸泡时间2h,温度为常温。
24、优选的,所述目标蛋白的n端含有生物素修饰,c端有spytag的氨基酸序列;所述目标蛋白包含单个csp结构域蛋白、proteinl4或rrm蛋白质;所述目标蛋白溶液的浓度为0.5~2μmol/l,目标蛋白的用量为100~300μl;所述步骤5)中反应的时间为15~30min,温度为常温。
25、优选的,所述链霉亲和素修饰的顺磁球是与bsa溶液混匀后加入步骤5)中;所述链霉亲和素修饰的顺磁球与bsa溶液的体积比为1:20;所述链霉亲和素修饰的顺磁球的粒径为1~3μm,所述静置时间为1~10min。
26、本发明在spycatcher和dogcatcher的基因序列上游添加fh1或是elastin等柔性多肽链(下文称为linker)的基因序列,并使用大肠杆菌表达这些改造过的蛋白质,最终获得在在n端带有linker的spycatcher和dogcatcher蛋白质。fh1序列全长182个氨基酸残基,可以任意的截断,有研究显示,该序列没有任何二三级结构。elastin是elastin-likepolypeptide linkers的简称,被hermann e.gaub团队用于原子力显微镜测量蛋白质相互作用的实验中,是(vpgvg)5-(vpgag)2-(vpggg)3氨基酸序列的任意次重复。本发明在linker氨基酸序列的n端添加了一个或者两个半胱氨酸用于连接修饰在玻璃基底表面的sulfo-smcc(sangon biotech c100318-0050)。对于linker的长度需要通过具体的单分子实验进行筛选,过长的linker可能会和玻璃基板表面发生非特异性相互作用,影响实验效果;过短无法达到使磁球远离玻璃表面的目的。
27、与现有技术相比,本发明具有如下有益效果:
28、本发明通过对spycatcher和dogcatcher蛋白质的结构进行改造,将60-182个氨基酸的多肽链添加至上述两种蛋白的n端,增加不同长度的linker在spycatcher和dogcatcher的n端可以起到类似于dna手柄的作用,加大磁球与玻璃表面的距离,一方面可以减弱磁球与玻璃表面的排除体积效应,提高磁球与生物大分子连接的成功率;另一方面减弱磁球与玻璃表面的潜在的相互作用的可能性,从而提高实验效率。同时还能规避制备dna手柄出现的降低样品有效浓度和增多实验步骤等问题。
- 还没有人留言评论。精彩留言会获得点赞!