一种线粒体靶向的亚硝酰氢分子荧光探针及其制备方法和应用与流程
本发明涉及一种线粒体靶向的亚硝酰氢分子荧光探针及其制备方法和应用,属于分析化学技术领域。
背景技术:
研究表明,亚硝酰氢(HNO)在生物体内许多生理过程中起着重要的作用。例如HNO可以增强心脏细胞的收缩,可以在肌肉组织中可以增加血管的扩张以及减少血小板的凝聚等效果。在非血管细胞中,HNO是已知的能够阻止脂质过氧化,从而促进血红素氧化酶的表达。此外研究表明,HNO可以通过触发具有电压依赖性的K+通道,促进动脉的松弛。通过动物实验发现,HNO不仅可以增强小鼠心肌肌丝的伸缩能量,同时可以增加Ca2+在小鼠心肌里的吸收。然而HNO在体内含量的异常可能会对机体有较大的损害,例如HNO的氧化产物具有较强的氧化能量,可以破坏细胞内的DNA链。此外,大量的HNO可能会引起神经细胞的凋亡。在细胞内的细胞器水平上,线粒体与HNO有着密切的联系,有文献报道,线粒体中的细胞色素c能够将NO转化成HNO,HNO的产生可能与线粒体的功效有着重要的联系。此外,线粒体中的一些酶的功效可能会被HNO所抑制,因此,对细胞线粒体的HNO的检测十分必要并具有重要的意义。
技术实现要素:
针对目前还没有对细胞线粒体中的HNO进行检测的荧光探针,本发明通过分子设计,合成出一种具有良好选择性以及线粒体体靶向性的HNO荧光探针。
本发明还提供了上述线粒体靶向的亚硝酰氢分子荧光探针的其制备方法和应用。
本发明采用以下技术方案:
一种线粒体靶向的亚硝酰氢分子荧光探针,其特征在于,所述荧光探针的结构式如式(Ⅰ)所示,简记为化合物Mito-HN:
一种上述的亚硝酰氢分子荧光探针的制备方法,其特征在于,它包括以下步骤:
1)将2′,4′-二羟基-2-苯酮苯甲酸与间羟基苯基哌嗪在三氟乙酸中,氮气保护,90℃加热回流,反应24h,反应结束后减压旋干溶剂得粗产品,然后用硅胶柱分离得到化合物MHN-1,结构式如下:
2)将步骤1)所得化合物MHN-1溶于乙腈中,加碳酸氢钠后再加入Fmoc-Cl,氮气保护,室温反应3h,反应完全后萃取、干燥、旋干并用硅胶柱分离得到化合物MHN-2,所述MHN-2和Fmoc-Cl的结构式分别如下:
3)将化合物二苯基磷苯甲酸溶于二氯甲烷中,加入二环己基碳二亚胺和4-二甲氨基吡啶后在室温下搅拌20min后加入化合物MHN-2,在室温下搅拌8h,反应完全后萃取、干燥、旋干并用硅胶柱分离得到化合物MHN-3,结构式如下:
4)将化合物MHN-3溶于乙腈,然后逐滴加入15%的哌啶,在室温下搅拌30min,反应完全后,加入水淬灭反应,然后用二氯甲烷分两次萃取,依次用水、饱和食盐水洗涤后干燥、旋干溶剂,并用硅胶柱进行分离得到化合物MHN-4,结构式如下:
5)将化合物MHN-4溶于DMF中,加入K2CO3后在室温下搅拌10min,加入三苯基膦丁基溴后在室温下反应过夜,用TLC板检测反应,反应完全后分离提纯得到目标探针化合物Mito-HN。
本发明荧光探针的合成路线如下:
所述步骤1)中硅胶柱分离洗脱剂配比为甲醇:二氯甲烷=1:5。
所述步骤2)中萃取剂为乙酸乙酯,干燥剂为无水硫酸钠,硅胶柱洗脱剂配比为甲醇/二氯甲烷=1:30。
所述步骤3)中萃取剂为乙酸乙酯,干燥剂为无水硫酸钠,硅胶柱洗脱剂配比为甲醇:二氯甲烷=1:50。
所述步骤4)中干燥剂为无水硫酸钠,硅胶柱洗脱剂配比为甲醇/二氯甲烷=1:30。
所述步骤5)中分离提纯的具体方法为:将反应产物用乙酸乙酯稀释,水洗2次,饱和食盐水洗涤2次,无水硫酸钠干燥,减压旋干溶剂得粗产品,并用硅胶柱进行分离,洗脱剂配比为甲醇:二氯甲烷=1:20。
本发明HNO探针的用途:该荧光探针可以应用于水环境和生物细胞体系中HNO的传感检测;所述的传感检测包含荧光检测,目视定性检测,细胞成像检测。
本发明的有益效果是:
(1)首次合成针对细胞线粒体中的HNO分子进行检测的荧光探针,该探针的合成相对比较容易,产率较高,且后处理过程相对简单。
(2)本发明实现了HNO分子探针的选择性快速检测,并且选择性好,抗其他分子干扰能力强。
(3)此探针可以应用于检测细胞内线粒体中的HNO的检测,通过与商业化线粒体染料进行比较,发现此荧光探针对线粒体内HNO成像的重合率高,两种染料的共定位系数为0.93,说明此探针可以作为细胞内线粒体内HNO检测探针。基于此探针的特异性且显著的颜色变化,该试剂也可作为显示水溶液中HNO分子存在的专一性指示剂,可进行实时定性及定量的目视比色法检测。故而,本发明是一种简单,快速,灵敏的HNO分子特异性检测试剂,在生物分子检测领域具有广阔的应用前景。
附图说明
图1是实施例1中探针Mito-HN的1H NMR图谱。
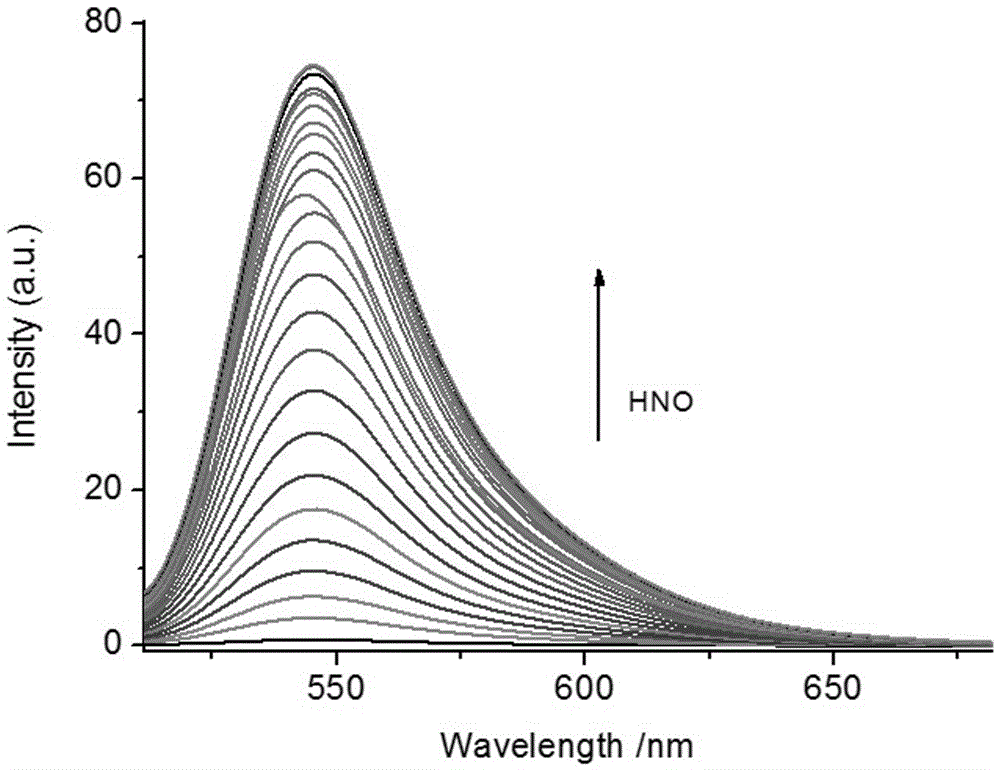
图2是探针Mito-HN随HNO的加入荧光谱图的变化情况。
图3是探针Mito-HN对不同离子和分子的选择性荧光谱图。
图4是探针Mito-HN对不同离子和分子的选择性柱状图数据,其中1、空白;2、Cu2+;3、Al3+;4、Ca2+;5.Fe3+;6、Mg2+;7、Cys;8、GHS;9、HS-;10、S2-;11、HClO;12、H2O2;13、过氧叔丁醇;14、过氧叔丁醚;15、NO;16、NO2-;17、;NO3-;18、HNO。
图5是探针Mito-HN应用与细胞中对外源性HNO进行荧光成像,其中a)只有荧光探针Mito-HN(5μM)的荧光成像明场图;b)只有荧光探针Mito-HN(5μM)绿通道成像图;c)明场与荧光成像图重叠图;d)将探针Mito-HN(5μM)加入到HeLa细胞中培养30min后,加入20μM HNO再培养20min后明场图,e)加入HNO后绿通道荧光成像图;f)明场d与荧光成像e图重叠图。
图6是Mito-HN荧光探针对HNO进行荧光成像图与商业化染料线粒体红的共定位成像图。其中a)探针浓度为5μM与线粒体红加入到HeLa细胞中培养30min后明场图,b),探针分子对HNO的荧光成像图c)线粒体红对细胞内线粒体的荧光成像图,d)明场、绿通道与红通道叠加图,e)绿通道与红通道叠加图,f)绿通道与红通道叠加箭头部分荧光强度比较,g)绿通道与红通道叠加强度散点图。
具体实施方式
下面结合实施例和附图对本发明做进一步说明,但本发明不受下述实施例的限制,实施例中化合物的号码对应上述方案中化合物的号码。
实施例1
目标探针Mito-HN的合成
1)化合物MHN-1的合成:
化合物2′,4′-二羟基-2-苯酮苯甲酸(1.0g,3.88mmol,1eq)与间羟基苯基哌嗪(758.3mg,4.26mmol,1.1eq)溶于20mL三氟乙酸中,90℃加热回流,反应过夜。用TLC板检测反应,反应完全后,减压旋干溶剂三氟乙酸,用1ml乙酸乙酯溶解,并用硅胶柱进行分离,硅胶颗粒大小为200-300目,洗脱剂配比为甲醇/二氯甲烷=1:5。产率为81%。
2)化合物MHN-2的合成:
将化合物MHN-2(1.1g,2.74mmol,1eq),NaHCO3(691mg,8.22mmol,3eq)溶于20mL乙腈中室温反应10min后加入Fmoc-Cl(850mg,3.29mmol,1.2eq),氮气保护下,室温反应3h,用TCL板检测反应,反应完全后加入100mL水猝灭反应,用乙酸乙酯200mL萃取2次,饱和食盐水洗涤2次,无水硫酸钠干燥。减压旋干溶剂得粗产品,并用硅胶柱进行分离,硅胶颗粒大小为200-300目,洗脱剂配比为甲醇/二氯甲烷=1:30。产率为72%。
3)化合物MHN-3的合成:
将化合物,二苯基磷苯甲酸(235mg,0.77mmol,1.2eq),DMAP(586mg,4.8mmol,7.5eq),DCC(192mg,1.92mmol,3eq)溶于20mL二氯甲烷中在室温下反应20min后加入MHN-2(400mg,0.64mmol,1eq)并在氮气保护下,常温反应8h,用TLC板检测反应,反应完全后,加入50mL水猝灭反应,用乙酸乙酯100mL萃取2次,饱和食盐水洗涤2次,无水硫酸钠干燥。减压旋干溶剂得粗产品,并用硅胶柱进行分离,硅胶颗粒大小为200-300目,洗脱剂配比为甲醇/二氯甲烷=1:50。产率为56%。
4)化合物MHN-4的合成:
化合物MHN-3(240mg,0.264mmol,1eq)溶于5mL乙腈中,然后加入15%哌啶,常温搅拌30min,TLC检测反应完全,加入10mL水淬灭反应,用50mL二氯甲烷分两次萃取,用20mL水洗涤后用20mL的饱和食盐水洗涤,无水硫酸钠干燥,减压旋干溶剂得粗产品,并用硅胶柱进行分离,硅胶颗粒大小为200-300目,洗脱剂配比为甲醇/二氯甲烷=1:30,得化合物MHN-4,产率35%。
5)化合物Mito-HN的合成:
化合物MHN-4(60mg,0.087mmol,1eq),碳酸钾(60.2mg,0.435mmol,5eq)溶于5mLDMF中在室温下搅拌反应10min,加入三苯基膦丁基溴(69.3mg,0.174mmol,2eq),氮气保护,室温反应过夜,用TCL板检测反应,反应完全后,用乙酸乙酯稀释,水洗2次,饱和食盐水洗涤2次,无水硫酸钠干燥,减压旋干溶剂得粗产品,并用硅胶柱进行分离,硅胶颗粒大小为200-300目,洗脱剂配比为甲醇/二氯甲烷=1:20。产率为64%。1H NMR(400MHz,DMSO-d6)δ8.25(s,1H),8.05(d,J=7.5Hz,1H),7.89(d,J=6.6Hz,3H),7.86–7.70(m,14H),7.67–7.58(m,2H),7.41(s,5H),7.33(d,J=7.3Hz,1H),7.21(s,4H),7.09(d,J=8.1Hz,1H),6.82(dd,J=17.4,8.6Hz,4H),6.63(d,J=8.8Hz,1H),4.07(s,2H),3.63(s,4H),3.20(s,4H),1.80(s,2H),1.62(s,2H),1.23(s,2H).
实施例2
荧光探针Mito-HN随着HNO加入量的增加荧光谱图的变化
取实施例1制备的Mito-HN亚硝酰氢荧光探针溶于N,N-二甲基甲酰胺(DMF)中,制成1mmol/L储备液。从储备液中取出30μL加入到5mL的离心管当中,用PBS 2mL(0.1mol/L,pH=7.4)进行稀释,然后加入不同当量(0-10eq)的AS盐(HNO供体)标准溶液,用PBS缓冲溶液溶液稀释至3mL,以450nm为激发光测量其荧光性质。荧光光谱如图2所示。由图2可见,随着HNO加入量的增加在545nm处的荧光逐渐增强。
实施例3
化合物Mito-HN亚硝酰氢荧光探针对不同分子或离子的选择性
从实施例2中荧光探针储备液中取出30μL分别加入到18个5mL的离心管当中,用2mLPBS进行稀释后,再分别向16个离心管中加入等摩尔量的竞争分子标准溶液,其中一个什么离子也不加,作为空白样品,另一个加入等摩尔量的HNO标准溶液,15min后检测溶液的荧光发射光谱变化,以450nm为激发光,结果如图3和图4所示。由图3和图4可以发现,其他金属离子、还原性化合物、氧化性化合物等对化合物Mito-HN在545nm处的荧光几乎没有影响,而亚硝酰氢溶液的加入使化合物Mito-HN在545nm处的荧光显著增强。
实施例4
化合物Mito-HN荧光探针在细胞内对亚硝酰氢荧光成像
我们将本发明所得到的荧光探针Mito-HN应用到HeLa细胞中对亚硝酰氢进行荧光成像应用(图5)具体操作步骤如下:将5μM Mito-HN荧光探针的DMSO溶液加入到两个育有HeLa细胞的培养皿中,并对培养皿进行编号。在一号培养皿中什么都不加,二号培养皿中加入20μM亚硝酰氢供体。在二氧化碳培养箱中培养30min后,用共聚焦显微镜进行成像。首先对一号培养皿进行成像。用488nm的激光进行激发,在明场通道可以观看到细胞的轮廓图,而在绿色通道(500nm-550nm)对细胞进行荧光成像时,此时观察不到荧光发射。对二号培养皿进行成像研究发现在绿色通道下可以清醒的看到探针对HNO的荧光成像图。此实验可以说明探针Mito-HN能够在细胞内对HNO进行荧光成像。
实施例5
化合物Mito-HN荧光探针在细胞内对亚硝酰氢荧光成像并与商业线粒体染料共定位比较我们将本发明所得到的荧光探针Mito-HN应用到HeLa细胞中与商业化的线粒体染料进行共定位实验,说明本探针可以定位到线粒体中,并对线粒体内HNO进行荧光成像应用(图6)。具体操作步骤如下:将5μM Mito-HN探针DMSO溶液和商业化线粒体染料-线粒体红10nM加入到育有HeLa细胞的培养皿中,在二氧化碳培养箱中培养30min后,向体系中加入20μM的HNO供体溶液后,再等待20min后用共聚焦显微镜进行成像,此时用(Ex=488nm)进行激发可以通过绿色通道对进行成像,此为Mito-HN探针与HNO响应后发射的光,用光(Ex=561nm)进行激发可以通过红色通道对细胞进行成像,此为商业化染料线粒体红对细胞内的线粒体进行的荧光成像,用软件进行处理可以得出两种染料的共定位系数为0.96。
- 还没有人留言评论。精彩留言会获得点赞!