一种针对高浓高盐制药废水的混合菌种发酵生物预处理方法与流程
本发明涉及水处理领域,尤其涉及一种针对高浓高盐制药废水的混合菌种发酵生物预处理方法。
背景技术:
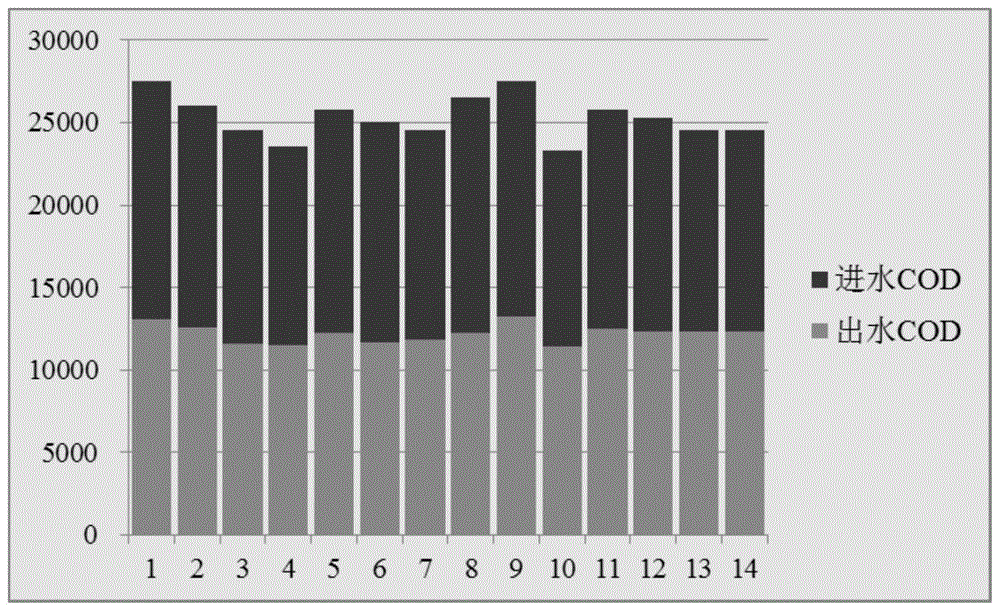
:制药行业因其工艺路线长、原料多样且反应不完全、产品转化率低、溶剂使用量大等因素,废水常呈现高盐、高浓、高毒等特点,且含有许多“三致”类化合物、不可生物降解物或生物抑制物,是一种典型的难降解工业有机废水,难以处理达标。此外,制药行业常采用间歇性生产,且产品种类变化较大,也增加了制药废水的处理难度。据统计,目前制药行业能够达到其行业水污染物排放新标准限值的企业数量相当少,化学合成类、发酵类、制剂类制药废水达标率仅分别为9%、12%和30%。由于废水的特殊性,长期以来受到国家、社会和企业的高度关注,是国内外污水处理届公认的难题。由于高浓高盐制药废水高毒、可生化性差的特点,通常要对其进行预处理,降低生物毒性,提高可生化性后,才能进入常规活性污泥系统处理。目前,常见的废水预处理手段有许多,例如铁碳微电解、芬顿氧化、湿式氧化、电催化等物化手段,合适的物化法虽然立竿见影,但是通常设备投资高、耗能高,而且容易引起二次污染。因此针对高浓制药废水,有必要开发出新的、更为高效低成本的预处理方法。技术实现要素:为了解决上述技术问题,本发明提供了一种针对高浓高盐制药废水的混合菌种发酵生物预处理方法。针对高浓高盐制药废水,本发明选用通用性强、效果好的混合菌种gemb,通过混合发酵的工艺可将有机物降解或转化为单细胞蛋白,快速、经济地将活性污泥无法直接处理的高盐高浓度废水转化成具有更高可生化性的低浓度废水,相较于其他预处理方法成本更低。本发明的具体技术方案为:一种针对高浓高盐制药废水的混合菌种发酵生物预处理方法,所述方法适用于符合以下指标的高浓高盐制药废水:废水中可生化有机碳占总有机碳的比例大于50%,bod5/codcr的比值>0.2,codcr在10000~30000mg/l。所述方法包括以下步骤:所述方法包括以下步骤:s1:选择混合菌种gemb作为初始发酵菌剂。s2:将混合菌种gemb加入废水中,进行发酵处理。s3:废水发酵处理末端出水接入mbr膜处理模块,,并将mbr膜截留的悬浮菌体回流至s2中。s3的作用在于:本发明团队在实践中发现,含盐废水密度大,污泥容易膨胀上浮,污泥解体,故高盐废水中微生物生长容易呈现出悬浮状,但此种状态更容易随着出水而流失,因此在生物处理最后端接入mbr膜以截留悬浮菌体,回流到生物处理池,以补偿及维持生物处理池菌体正常的浓度,保证废水处理效果。s4:系统稳定运行后取发酵废水,提取微生物基因组dna,对发酵废水中的微生物结构进行高通量测序分析,确定最终发酵废水中的菌属比例及优势菌属。s5:依据s4的结果,向废水中添加优势菌属生长所需生长因子以优化预处理效果。生物预处理系统本质上是替代常规的物化预处理,对有一定毒性、生物抑制性的废水进行脱毒,提高可生化性,处理掉废水中常规生化系统难以处理的成分,为后续的常规生化保驾护航。本发明团队在实践中发现,体系随着运行时间的增长,由于废水中有毒物质的积累,废水水质变化的冲击等原因会对体系中的菌种有一定的损伤,当损伤积累到一定程度就会出现菌种活性降低,处理效果下降的情况,需要再次投加菌种。s6:运行过程中,当处理效率降低时,依据s4的菌属比例结果,将接入的混合菌种gemb中各菌属的比例调整为与菌属比例一致。本发明团队在前期研究中发现,多数制药企业的“浓废水调节池”的废水codcr数值通常在10000mgl至30000mg/l范围内。实际上,此类废水有机物的浓度是十分适合微生物发酵的。而且制药企业的废水中虽然组分复杂,但废水中二甲基甲酰胺(dmf)、四氢呋喃(thf)等可以被生物分解利用的有机溶剂贡献了主要污染,只要选择合适的混合菌种,就能够实现浓废水的生物法预处理。生物预处理技术不同于常规活性污泥方法,有机物和总氮主要是通过同化作用被微生物发酵形成细胞体,通过单细胞蛋白的形式排出系统,少量有机物通过呼吸作用被消耗。在发酵的同时,原本“低bod”的组分例如四氢呋喃等被单一工程菌种转化为脂肪酸、蛋白质等“高bod”的成分,出水不仅codcr大幅降低,b/c值更是显著提高,更适合后续常规系统的处理。虽然从工艺和设备外观上生物预处理和常规活性污泥法大同小异,但整个系统的供氧能耗无需根据环境工程规范中codcr的去除量来计算,只需要根据发酵工程设计规范满足发酵呼吸供能的氧气即可(若是厌氧发酵则无需供氧)。通常每吨水去除10gcodcr的综合费用在0.5元左右。利用发酵工程菌种来把“高浓废水”变成“低浓废水”的过程,不仅运行成本低,而且环保效益明显,不会形成二次污染。作为优选,s1中,所述混合菌种gemb的组成为:30-40%的halomonas,26-30%的bacillus,10-14%的desulfurispirillum,13-17%的oligella,3-7%的clostridium,2-4%的idiomarina,1-3的%paenibacillus。本发明团队在前期从海洋、冰川、热泉、盐碱湖、酸湖等地分菌获得了近4万株菌种,其中含有耐盐、耐酸、耐碱、抗药、抗溶剂、耐高温、耐低温等特性的抗性菌种,包含细菌、真菌、放线菌,在经过大量实验后,最终获得了上述适用于医药化工废水中的高盐、有机溶剂和重要医化有机原料的高效混合菌种gemb。上述组成的混合菌种gemb通用性强,效果好,通过混合发酵的工艺将有机物降解或转化为单细胞蛋白,快速、经济地将活性污泥无法直接处理的高浓度废水转化成具有更高可生化性的低浓度废水,极大降低后续常规生化系统的处理负担,基本上可以应对符合本发明水质指标的高浓高盐制药废水。作为优选,s2的具体方法为:将废水泵入水质调节池,投加尿素和磷盐并混合均匀;废水经过水质调节后通向前后串联的生物处理池中,生物处理池中投加有15-25w/v%的混合菌种gemb;前期cdo=5000-10000mg/l低负荷间歇进水,控制do在2-5mg/l、温度在25-30℃;待生物处理池内菌体浓度稳定,菌体对废水codcr的去除率达到40%以上后再进行cdo=10000-30000mg/l高负荷连续进水,进入运行控制阶段;在此阶段每天对进水及生物处理池出水的cod、nh3-n指标进行监测,以检测生物预处理效果,直至废水codcr的去除率为50%以上。本发明先低负荷间歇进水,后期再高负荷连续进水的原因在于:初始投加的混合菌种gemb中各菌属的比例只是一个大概比例,虽然有普适性,但对于特定废水来说肯定不是最优比例,因此初始低负荷间歇进水的作用是养菌,可以让菌种逐步适应废水,起到驯化的作用。待稳定后进行连续进水。作为优选,在s2中,投加尿素和磷盐使废水中c∶n∶p的摩尔比=(190-210)∶(4-6)∶1。作为优选,在s2中,生物处理池的底部设有曝气系统,且废水在生物处理池中底部进水,上部出水;生物处理池侧壁设有排泥口。底部进水,下进上出能起到很好的混流作用,下部进水和曝气的向上的冲击作用与菌体向下的沉降作用达到平衡时菌体会在体系中达到悬浮状态,处理效果最好。作为优选,s2中,在低负荷间歇进水阶段,向废水中投加0.8-1.2kg/吨水的红糖,进入高负荷连续进水阶段后停止投加。红糖相当于碳源,可以促进菌体快速生长,起到快速扩增菌种的作用。作为优选,s3中,采用聚偏氟乙烯中空纤维膜,膜孔径为0.1~0.5微米。作为优选,s4中,所述优势菌属为比例排名最靠前的若干个菌属,优势菌属的丰度总和超过50%。将丰度设定为超过50%,原因是该丰度下可以视作起主要作用的菌种。作为优选,s5中,所述生长因子选自维生素、微量元素和生物素。作为优选,s6中,所述处理效率降低的标志为:对废水codcr的去除率低于40%,或镜检发酵菌液中菌体浓度低于正常处理效率时菌体浓度的50%。与现有技术对比,本发明的有益效果是:针对高浓高盐制药废水,本发明从多年科研累积的菌种库中筛选出通用性强、效果好的混合菌种gemb,通过混合发酵的工艺可将有机物降解或转化为单细胞蛋白,快速、经济地将活性污泥无法直接处理的高盐高浓度废水转化成具有更高可生化性的低浓度废水,生化性可提高3-8倍,并去除污水中50-90%的cod和氨氮,降低后续常规生化系统的处理负担约50-90%。附图说明图1为实施例1中废水处理前后cod近两周降解情况;图2为实施例1中废水处理前后氨氮近两周降解情况。图3为实施例1中s4发酵废水检测所得菌属比例。具体实施方式下面结合实施例对本发明作进一步的描述。总实施例一种针对高浓高盐制药废水的混合菌种发酵生物预处理方法,所述方法适用于符合以下指标的高浓高盐制药废水:废水中可生化有机碳占总有机碳的比例大于50%,bod5/codcr的比值>0.2,codcr在10000~30000mg/l。所述方法包括以下步骤:s1:选择混合菌种gemb作为初始发酵菌剂。所述混合菌种gemb的组成为:30-40%的halomonas,26-30%的bacillus,10-14%的desulfurispirillum,13-17%的oligella,3-7%的clostridium,2-4%的idiomarina,1-3的%paenibacillus。s2:将废水泵入水质调节池,投加尿素和磷盐使废水中c:n:p的摩尔比=(190-210):(4-6):1,混合均匀;废水经过水质调节后通向前后串联的生物处理池中,生物处理池中投加有15-25w/v%的混合菌种gemb;前期cdo=5000-10000mg/l低负荷间歇进水,控制do在2-5mg/l、温度在25-30℃;待生物处理池内菌体浓度稳定,菌体对废水codcr的去除率达到40%以上后再进行cdo=10000-30000mg/l高负荷连续进水,进入运行控制阶段;在此阶段每天对进水及生物处理池出水的cod、nh3-n指标进行监测,以检测生物预处理效果,直至废水codcr的去除率为50%以上。作为优选,在s2中,生物处理池的底部设有曝气系统,且废水在生物处理池中底部进水,上部出水;生物处理池侧壁设有排泥口。作为优选,s2中,在低负荷间歇进水阶段,向废水中投加0.8-1.2kg/吨水的红糖,进入高负荷连续进水阶段后停止投加。s3:对废水进行mbr膜(聚偏氟乙烯中空纤维膜,膜孔径为0.1~0.5微米)处理,并将mbr膜截留的悬浮菌体回流至s2中。s4:系统稳定运行后取发酵废水,提取微生物基因组dna,对发酵废水中的微生物结构进行高通量测序分析,确定最终发酵废水中的菌属比例及优势菌属;所述优势菌属为比例排名最靠前的若干个菌属,优势菌属的丰度总和超过50%。s5:依据s4的结果,向废水中添加优势菌属生长所需生长因子以优化预处理效果。所述生长因子选自维生素、微量元素和生物素等。s6:运行过程中,当处理效率降低时,依据s4的菌属比例结果,将接入的混合菌种gemb中各菌属的比例调整为与菌属比例一致。所述处理效率降低的标志为:对废水codcr的去除率低于40%,或镜检发酵菌液中菌体浓度低于正常处理效率时菌体浓度的50%。实施例1:浙江某企业的头孢制药废水高浓废水的生物预处理的工程实例。项目名称:头孢制药废水的生物预处理废水水质分析:高浓度废水,含有难降解有毒物质如二甲基甲酰胺(dmf)、四氢呋喃(thf)、吡啶、抗生素等,该类水无法直接进入企业现有的生化处理系统,需要与低浓度废水混合稀释到cod低于8000mg/l才能继续处理,因此在环保上限制了企业的产能。大体的水质信息如下:水质指标codnh3-ntptdsph含量25000(mg/l)450(mg/l)2.5(mg/l)3%6通过分析各个车间前段生产工艺和污水收集规律以及结合废水质谱数据,技术团队认为该废水虽然含有抗生素,高硫酸盐,且有机物浓度高,但仍具有发酵的可行性。发酵工艺设计:根据混合菌种的生理特征,设计相应的发酵工艺,菌体分离工艺以及配套的设施设备。最后将高浓废水直接进行混合菌种的生物预处理。具体方法为:s1:选择混合菌种gemb作为初始发酵菌剂。所述混合菌种gemb的组成为:35%的halomonas,28%的bacillus,12%的desulfurispirillum,15%的oligella,5%的clostridium,3%的idiomarina,2的%paenibacillus。s2:将废水泵入水质调节池,投加尿素和磷盐使废水中c∶n∶p的摩尔比=200∶5∶1,混合均匀;废水经过水质调节后通向前后串联的生物处理池中,生物处理池中按20%(w/v)的接菌比加入混合菌种gemb;前期废水用生化出水稀释3倍,稀释至codcr为8000mg/l左右的低负荷间歇进水,控制do在4mg/l左右、温度在28℃;待生物处理池内菌体浓度稳定,菌体对废水codcr的去除率达到40%以上后再进行cod=25000mg/l高负荷原水,并保持连续进出水,进入运行控制阶段;在此阶段每天对进水及生物处理池出水的cod、nh3-n指标进行监测,以检测生物预处理效果,直至废水codcr的去除率为50%以上。其中,生物处理池的底部设有曝气系统,且废水在生物处理池中底部进水,上部出水;生物处理池侧壁设有排泥口。在低负荷间歇进水阶段,向废水中投加1.0kg/吨水的红糖,进入高负荷连续进水阶段后停止投加。s3:废水发酵处理末端出水接入mbr膜处理模块,进行mbr膜(聚偏氟乙烯中空纤维膜,膜孔径为0.2微米)处理,并将mbr膜截留的悬浮菌体回流至s2中。s4:系统稳定运行后取发酵废水,提取微生物基因组dna,对发酵废水中的微生物结构进行高通量测序分析,确定最终发酵废水中的菌属比例及优势菌属见图3;所述优势菌属为比例排名最靠前5个菌属bacillus(43.98)、halomonas(32.13)、oligella(11.22)、desulfurispirillum(4.35)、paenibacillus(3.77),优势菌属的丰度总和超过50%。s5:依据s4的结果,向废水中额外添加优势菌属生长所需生长因子:微量元素钴、钼、铜、锰和生物素以优化预处理效果。s6:运行过程中,当处理效率降低时,依据s4的菌属比例结果,将接入的混合菌种gemb中各菌属的比例调整为与菌属比例一致。所述处理效率降低的标志为:对废水codcr的去除率低于40%,或镜检发酵菌液中菌体浓度低于正常处理效率时菌体浓度的50%。处理后主要指标如下:整体停留时间数天,如图1、图2(图中横坐标为运行时间,天,纵坐标均为mg/l)所示,水质codcr去除率达50%以上,总氮去除率达80%以上,且系统运行非常稳定,波动性小,大大降低了后续系统负担,使整个污水站处理高浓废水的能力提升40%。实施例2s1:选择混合菌种gemb作为初始发酵菌剂。所述混合菌种gemb的组成为:30%的halomonas,30%的bacillus,10%的desulfurispirillum,17%的oligella,7%的clostridium,4%的idiomarina,2的%paenibacillus。s2:将废水泵入水质调节池,投加尿素和磷盐使废水中c∶n∶p的摩尔比=190∶4∶1,混合均匀;废水经过水质调节后通向前后串联的生物处理池中,生物处理池中投加有15w/v%的混合菌种gemb;前期cdo=5000mg/l低负荷间歇进水,控制do在2mg/l、温度在25℃;待生物处理池内菌体浓度稳定,菌体对废水codcr的去除率达到40%以上后再进行cdo=10000mg/l高负荷连续进水,进入运行控制阶段;在此阶段每天对进水及生物处理池出水的cod、nh3-n指标进行监测,以检测生物预处理效果,直至废水codcr的去除率为50%以上。其中,生物处理池的底部设有曝气系统,且废水在生物处理池中底部进水,上部出水;生物处理池侧壁设有排泥口。在低负荷间歇进水阶段,向废水中投加0.8kg/吨水的红糖,进入高负荷连续进水阶段后停止投加。s3:废水发酵处理末端出水接入mbr膜处理模块,进行mbr膜(聚偏氟乙烯中空纤维膜,膜孔径为0.2微米)处理,并将mbr膜截留的悬浮菌体回流至s2中。s4:系统稳定运行后取发酵废水,提取微生物基因组dna,对发酵废水中的微生物结构进行高通量测序分析,确定最终发酵废水中的菌属比例及优势菌属;所述优势菌属为比例排名最靠前的若干个菌属,优势菌属的丰度总和超过50%。s5:依据s4的结果,向废水中添加优势菌属生长所需生长因子以优化预处理效果。所述生长因子选自维生素、微量元素和生物素。s6:运行过程中,当处理效率降低时,依据s4的菌属比例结果,将接入的混合菌种gemb中各菌属的比例调整为与菌属比例一致。所述处理效率降低的标志为:对废水codcr的去除率低于40%,或镜检发酵菌液中菌体浓度低于正常处理效率时菌体浓度的50%。实施例3s1:选择混合菌种gemb作为初始发酵菌剂。所述混合菌种gemb的组成为:40%的halomonas,26%的bacillus,14%的desulfurispirillum,13%的oligella,3%的clostridium,2%的idiomarina,2的%paenibacillus。s2:将废水泵入水质调节池,投加尿素和磷盐使废水中c∶n∶p的摩尔比=210∶6∶1,混合均匀;废水经过水质调节后通向前后串联的生物处理池中,生物处理池中投加有15w/v%的混合菌种gemb;前期cdo=10000mg/l低负荷间歇进水,控制do在5mg/l、温度在30℃;待生物处理池内菌体浓度稳定,菌体对废水codcr的去除率达到40%以上后再进行cdo=30000mg/l高负荷连续进水,进入运行控制阶段;在此阶段每天对进水及生物处理池出水的cod、nh3-n指标进行监测,以检测生物预处理效果,直至废水codcr的去除率为50%以上。其中,生物处理池的底部设有曝气系统,且废水在生物处理池中底部进水,上部出水;生物处理池侧壁设有排泥口。在低负荷间歇进水阶段,向废水中投加1.2kg/吨水的红糖,进入高负荷连续进水阶段后停止投加。s3:废水发酵处理末端出水接入mbr膜处理模块,进行mbr膜(聚偏氟乙烯中空纤维膜,膜孔径为0.2微米)处理,并将mbr膜截留的悬浮菌体回流至s2中。s4:系统稳定运行后取发酵废水,提取微生物基因组dna,对发酵废水中的微生物结构进行高通量测序分析,确定最终发酵废水中的菌属比例及优势菌属;所述优势菌属为比例排名最靠前的若干个菌属,优势菌属的丰度总和超过50%。s5:依据s4的结果,向废水中添加优势菌属生长所需生长因子以优化预处理效果。所述生长因子选自维生素、微量元素和生物素。s6:运行过程中,当处理效率降低时,依据s4的菌属比例结果,将接入的混合菌种gemb中各菌属的比例调整为与菌属比例一致。所述处理效率降低的标志为:对废水codcr的去除率低于40%,或镜检发酵菌液中菌体浓度低于正常处理效率时菌体浓度的50%。本发明中所用原料、设备,若无特别说明,均为本领域的常用原料、设备;本发明中所用方法,若无特别说明,均为本领域的常规方法。以上所述,仅是本发明的较佳实施例,并非对本发明作任何限制,凡是根据本发明技术实质对以上实施例所作的任何简单修改、变更以及等效变换,均仍属于本发明技术方案的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1