微液滴反应编码检测方法及其系统与流程
本发明涉及微液滴生物医学检测领域,特别涉及微液滴反应编码检测方法及其系统。
背景技术:
液滴微流控技术是微流控芯技术的一个重要的组成部分,其特征是在微流道或毛细管中将两种不相容的流体形成微米尺度的液滴。生物医学检测领域中最常见的是“油包水”的液滴。其中,油作为将每个液滴相互隔离的载体。这种微米尺度的液滴也被作为微反应器。也就是说,一个直径几十微米的液滴可以看成是一个传统生化检测中使用的试管,同样可以在微液滴内进行生化反应和用于生物医学中目标分子的检测。相比于传统的试管,微液滴反应的优点包括:(1)微液滴的体积只有皮升级,相当于反应体积缩小了6个数量级。因此,微液滴反应所需的试剂量大大减少,反应成本大幅降低;(2)一次反应中使用的微液滴数量可以高达上千万个,这使得检测通量能够得到极大的提高;(3)由于微液滴体积小,其背景噪声也相应的得到了很大程度的降低,使得检测灵敏度能有很大的提升。因此,微液滴技术是一项很有前景的生化分析检测技术。
基于微液滴的数字PCR(Digital PCR,dPCR)是一种基于单分子PCR方法来对核酸进行绝对精确定量的方法。其原理是将大量稀释后的核酸溶液分散至微液滴中,每个反应器的核酸模板数只有0个和1个两种情况。经过PCR循环之后,有一个核酸分子模板的反应器就会给出荧光信号,没有模板的反应器就没有荧光信号。根据相对比例和反应器的体积,就可以推算出原始溶液的核酸浓度。与传统定量PCR不同,数字PCR通过直接计数的方法,可以实现起始核酸模板的绝对定量。
在传统的多指标检测当中,每一个反应试管里进行一种特定反应。因而需要对每一个试管贴上特定的标签,以标识其管内的反应物。同理,一个微液滴就相当于一个反应试管,那么在多指标检测当中,也需要特殊的“标签”来识别和区分每一个微液滴内的反应物。给微液滴反应贴“标签”的技术,叫做微液滴的编码技术。高通量多指标检测对微液滴的编码技术提出了新的挑战。目前常用的微液滴编码方法包括以下三种:
(1)基于颜色信息的微液滴编码方法。通过在不同的微液滴中加入不同颜色的染料,并通过检测其颜色信息来实现解码。基于颜色信息的微液滴编码方法具有编码直观和无需复杂的检测设备的优势,但是基于颜色信息的编码方法存在编码容量不高、编码染料影响生化反应效率等不足。
(2)基于空间位置信息的微液滴编码方法。在已知空间位置的微结构加入已编号的生化反应信息的液滴,并通过检测其空间位置信息来实现解码。空间位置信息编码的方法具有解码方便、解码速度快等优点。但受到加工工艺和空间体积限制等因素限制,使其编码的容量容易受到限制。同时,在液滴加样环节,也存在一定的挑战,对加工工艺和检测设备都提出了更高的要求。
(3)基于核酸序列的微液滴编码方法。在不同种类的微液滴内加入不同已知的特定核酸序列,并通过对核酸序列的测序来完成微液滴的解码。基于核酸序列的编码方法具有很高的编码容量,但是由于核酸序列测序需要比较复杂的过程,因而这种编码方式只适合一些特定的场合。
由于现有方法编码能力的限制,目前多指标的数字PCR只能实现数个到十数个的不同位点的同步检测。
技术实现要素:
本发明的目的是为了克服前面所说的几种微液滴编码方法的不足,提出一种基于标志液滴的时序编码方法。
在一种实施方式中,本发明提供一种微液滴反应编码检测方法,其特征在于包括以下步骤:不同的试剂按顺序在微流控芯片管道中生成微液滴,并按照先后顺序排成一个队列;带有标记信息的微液滴成为标志液滴,其所在队列中的区域成为编码区;带有生化反应试剂的微液滴成为功能液滴,其所在队列中的区域称为功能区;每个功能区之间都间隔着一个编码区,由这种反应区加编码区的重复结构组成了完整的编码队列;和当编码队列进入检测区时,根据进样的先后顺序以及各个编码区信息,解码每个功能区内包含的功能液滴所对应的反应物。
在一种实施方式中,通过控制外部各个进样器例如注射器的工作顺序,实现不同的试剂按顺序在微流控芯片管道中生成微液滴。
在一种实施方式中,进样器通过配件例如特氟龙卡具与芯片入口相连。
在一种实施方式中,包括二个装载矿物油用于后续液滴生成的注射器,一个装载标志溶液用于生成标志液滴的注射器;和多个装载生化反应试剂用于生成功能液滴的注射器。
在一种实施方式中,标志溶液和各个生化反应试剂按照进样顺序在微流控芯片内“十字”液滴生成区域与矿物油汇合,形成“油包水”的液滴。
在一种实施方式中,在编码时通过控制标志液滴的荧光强度,使得标志液滴与功能液滴相区分。
在一种实施方式中,在编码时通过控制标志液滴体积的不同,从而控制荧光信号持续时间的长短,使标志液滴与功能液滴相区分。
在一种实施方式中,通过控制标志液滴的颜色,使其与功能液滴相区分。
在一种实施方式中,通过控制标志液滴的吸光度的变化,使其与功能液滴相区分。
在一种实施方式中,通过控制标志液滴的反射角度的变化,使其与功能液滴相区分。
在一种实施方式中,标志液滴自身内部的排列组合产生特定顺序和意义,使其与功能液滴相区分。
在一种实施方式中,提供一种在本发明的微液滴反应编码检测方法中应用的系统,所述系统包括进样区、液滴生成区、反应区和检测区。
本发明的微液滴反应编码检测方法及其系统具有以下四个优点:
(1)本发明具有编码容量大,编码容量不受编码方法限制的优点。
普通的液滴编码方法,比如颜色和荧光强度编码方法,编码容量会受到检测系统对于编码特征的分辨能力的限制,比如对颜色差别或荧光强度差别的分辨能力限制,而存在编码能力的上限,限制了微液滴的实际应用。而本发明提供的编码方法,不受系统对编码特征的分辨能力的限制,理论上不存在编码容量的上限,这将使得微液滴的多指标分析能力大大增强。
(2)本发明提供的编码方法,具有编码物质和生化反应在空间上完全隔离的优点。这使得编码物质不会对生化反应产生任何的影响,这对保证高灵敏度的生化检测反应能够正常进行尤为重要。
(3)本发明提供的编码还具有易于解码和解码鲁棒性高的优点。
由于液滴队列中标志液滴和功能液滴在空间上不互相混合,因而不需要同时解码编码信息和读取生化反应的信息,降低对系统读取和处理信息能力的要求。同时,由于液滴队列中各个功能区是相互分隔的,也就是含有不同的生化反应的液滴是被编码区所隔离,解码的时候就不容易发生对生化反应类别判读错误的情况,从而实现高的解码鲁棒性。
(4)本发明提供的编码方法还具有易于集成芯片实验室的优点。
由于编码方法要求液滴保持队列的形式,因此整个过程都是要求在封闭的管道内的,适合集成芯片实验室的特点。
附图说明
为了更清楚地说明本申请实施例中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本申请中记载的一些实施例,对于本领域普通技术人员来说,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
图1是本发明的微液滴反应编码检测方法示意图;
图2是本发明的微液滴反应编码检测系统示意图;
图3是高荧光强度作为标志液滴特征的编码实现多位点的基因检测中经过PCR反应后的阳性液滴与阴性液滴的荧光信号;
图4是高荧光强度作为标志液滴特征的编码实现多位点的基因检测中含有量子点的标志液滴的荧光信号;
图5是具有高荧光强度为特征的标志液滴的编码原理示意图;
图6是以不同体积作为标志液滴特征的编码方法示意图;
图7是以不同颜色作为标志液滴特征的编码方法示意图;
图8是以不同吸光度作为标志液滴特征的编码方法示意图;
图9是以不同反光度作为标志液滴特征的编码方法示意图;和
图10是具有多种特征的标志液滴的编码方法示意图。
具体实施方式
为了使本领域技术领域人员更好地理解本申请中的技术方案,下面将结合本申请实施例中的附图,对本申请实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本申请一部分实施例,而不是全部的实施例。以下实施例中所提到的方位用语,例如:上、下、左、右、前、后等,仅是参考附图的方向;因此使用的方位用语是用来说明并非限制本发明。基于本申请中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都应当属于本申请保护的范围。
实施例一本发明的微液滴反应编码原理
如图1所示,通过控制外部各个注射泵的工作顺序,来实现不同的试剂按特定的顺序在微流控芯片管道中生成微液滴,并按照这样的先后顺序排成一个队列。带有标记信息的微液滴成为标志液滴,其所在队列中的区域成为编码区;带有生化反应试剂的微液滴成为功能液滴,其所在队列中的区域称为功能区,每个功能区之间都间隔着一个编码区。由这种反应区加编码区的重复结构组成了完整的编码“队列”。当编码“队列”进入检测区时,根据进样的先后顺序以及各个编码区信息,能够解码每个功能区内的包含的功能液滴所对应的反应物。
实施例二本发明的微液滴反应编码检测系统
图2为本发明的微液滴反应编码检测系统示意图,该系统分为四个区域:进样区、液滴生成区、反应区和检测区。A1,A2……An是对应着不同的进样口,用注射泵进行进样。A1是用于生成标志液滴的进样口,A2,A3……An是用于生成功能液滴的进样口,在整个系统进行工作时,进样的顺序是A1-A2-A1-A3-A1……即在进样时用标志液滴将功能液滴分隔开。在通过B1,B2相连的交叉点(即液滴生成区),通过油包水的方式生成液滴后,按照一定的先后顺序在反应区内排布并发生一定的生化反应。反应结束后,在C口的检测区域内进行检测时,每一次检测到与功能液滴不同的标志液滴时,便可获知上一功能液滴即将结束,下一功能液滴即将开始通过检测通道。
实施例三以高荧光强度作为标志液滴特征的编码实现多位点的基因检测
步骤1液体试剂进样控制
本发明提出的编码方法,需要液滴在管道中形成编码区和功能区交错的“队列”,因此对不同试剂进样的顺序有一定的要求,而进样的顺序通过控制外部的注射泵的工作顺序来决定。
图2所示的的注射泵采用高精度的注射泵(Harvard Apparatus,PHD Ultra),每个注射泵上固定有一个1ml的注射器,并通过特氟龙管与芯片入口相连。每个注射器内装载有不同的试剂,其中B1和B2对应的注射器内装载的是矿物油,用于后续液滴生成;A1对应的注射器内装载的是浓度为1的M,荧光波长是525nm的水溶性CdSe量子点溶液,用于生成标志液滴;A2,A3,A4对应的注射器都装载了包含50μL的Bio-Rad ddPCR Supermix for Probes,25μL含有20ng基因组DNA的溶液和25μL引物,其中A2、A3和A4包含的引物分别为GJB2基因、MTRNR1基因和MYO7a基因的上下游引物。A2、A3和A4中的溶液用于形成不同的功能液滴。通过控制注射泵的工作,不同试剂按以下顺序进样,A1、A2、A1、A3、A1、A4、A1,每次试剂进样速度为400μL/h,进样时间30秒,其中B1和B2是全程持续进样,进样速度为400μL/h。
步骤2液滴生成
进样试剂会按照进样顺序在芯片内“十字”液滴生成区域与B1和B2中的矿物油汇合,形成“油包水”的液滴。“十字”区域管道深50μm,宽为50μm,按前面所述的液体进样速度,将会生成直径大约为80前面的均一液滴。反应区管道宽度为80μm,深度为50μm,长度为1m。根据管道尺寸,液滴将会被略微压扁,并一一排列在管道中,而反应区管道长度设计能够同时容纳下步骤1中所有进样试剂生成的液滴。反应区内走在最前面的是最先进样的A1编码微液滴,其后面的是之后进样的A2功能液滴,后续的微液滴排列也以此类推。
步骤3 PCR反应
将芯片放入PCR仪进行在片的PCR扩增,PCR循环程序为:95℃10min预变性,95℃10s,55℃20s,72℃25s循环,共40个循环,最后4℃保温。
步骤4液滴解码与反应结果读取
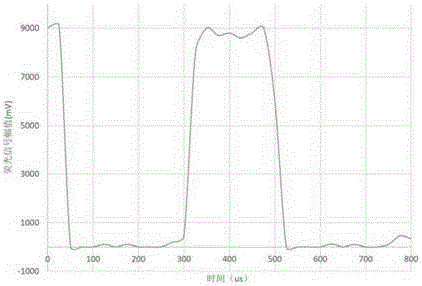
经过温度循环的芯片从PCR仪中取出,并通过注射泵将矿物油通过B1和B2入口进样到芯片内,这样反应区的液滴队列就会继续向出口方向移动,并在到达出口前通过检测区。在检测区内引入液滴荧光激发光源和检测光路,能够实现对液滴荧光的激发和检测。不同类型的液滴具有不同的荧光强度,其中荧光最强的是编码区的液滴,其次是经过PCR反应后,液滴内原本就具有DNA模板并完成了扩增的阳性液滴,还有原本不具有DNA模板因此未完成扩增的阴性液滴,阴性液滴的荧光来自于液滴内探针的背景荧光,荧光检测结果如图3、图4所示。因此,通过识别液滴信号的强度,就能区分标志液滴与功能液滴。
队列中每个液滴会依次经过检测区,根据每个液滴的荧光强度,检测系统也会检测到对应的信号,而这些信号序列将会按先后顺序被系统记录,最后再进行解码和反应结果判读。液滴队列中各个功能区与编码区的排列顺序是由步骤2决定的,是已知的,因此检测队列中各个标志液滴的在整个信号序列中位置,就能解码其相邻的功能液滴所对应的反应。如图5所示,图5是具有高荧光强度为特征的标志液滴的编码原理示意图,其中标志液滴具有高的荧光强度,因而在液滴荧光检测时,通过对荧光强度的判断就能区分出标志液滴与功能液滴。通过确定标志液滴1和标志液滴2所在信号序列中的位置,就能确定夹在他们两者当中的信号序列是属于功能液滴1的,从而完成对功能液滴1信号的提取和识别。同样,通过识别后续的标志液滴,就能完成所有功能区液滴信号的提取和识别,然后再对各个功能区信号进行阴阳性液滴的判读,完成对各个目标分子的精确定量。
图5具有高荧光强度为特征的标志液滴的编码原理示意图,其中标志液滴具有高的荧光强度,因而在液滴荧光检测时,通过对荧光强度的判断就能区分出标志液滴与功能液滴。
实施例四以不同体积作为标志液滴特征的编码实现多位点的基因检测
如图6所示,图6是以不同体积作为标志液滴特征的编码方法示意图;其中标志液滴具有较大的体积,因而在液滴荧光检测时,标志液滴的荧光信号峰宽比较大,通过对信号峰宽的判断就能区分出标志液滴与功能液滴。
本实施例实现多位点的基因检测需要四个步骤。
步骤1与实施例三中的步骤1大体相同,不同的是B1和B2进样速度有两种情况,当A1进样时,B1和B2的进样速度为100μL/h;当A2、A3或A4进样时,B1和B2的进样速度为400μL/h。这样就存在两种油相和水相的流速比,会得到两种大小不一样的液滴,A1进样所生成的标志液滴体积要比A2、A3和A4进样生成的功能液滴要大。
步骤2与实施例三中的步骤2大体相同,不同的是标志液滴直径约为110μm。
步骤3与实施例三中的步骤3相同。
步骤4与实施例三中的步骤4大体相同,不同的是对标志液滴特征的检测方法。由于标志液滴体积比功能液滴的体积要大,因此经过检测区域的时间更长,检测系统将读取到更宽的荧光信号,最后检测系统通过荧光信号峰宽识别标志液滴,如图6所示。
实施例五以不同颜色作为标志液滴特征的编码实现多位点的基因检测
如图7所示,以不同颜色作为标志液滴特征的编码方法示意图,其中标志液滴具有红色的特征,而A、B、C和D为无色透明的不同功能液滴,通过对液滴色彩信息的读取能区分标志液滴与功能液滴。
本实施例实现多位点的基因检测需要四个步骤。
步骤1与实施例三中的步骤1大体相同,不同的是A1对应的注射器内装载的是浓度为100μg/mL的水溶性胭脂红色素溶液,用于生成标志液滴。
步骤2与实施例三中的步骤2相同。
步骤3与实施例三中的步骤3相同。
步骤4与实施例三中的步骤4大体相同,不同的是对标志液滴特征的检测方法。由于标志液滴具有特别的色彩信息,检测系统通过对其特定的色彩信息进行判读来识别标志液滴,如图7所示。
实施例六以不同吸光度作为标志液滴特征的编码实现多位点的基因检测
如图8所示,图8是以不同吸光度作为标志液滴特征的编码方法示意图,其中标志液滴具有较高的吸光度,而A、B为无色透明的不同功能液滴,通过对液滴透射光强度的检测,区分标志液滴与功能液滴。
本实施例实现多位点的基因检测需要四个步骤。
步骤1与实施例三中的步骤1大体相同,不同的是A1对应的注射器内装载的是浓度为100μg/mL的亚甲基蓝溶液,用于生成标志液滴。
步骤2与实施例三中的步骤2相同。
步骤3与实施例三中的步骤3相同。
步骤4与实施例三中的步骤4大体相同,不同的是对标志液滴特征的检测方法。由于标志液滴具有较高的吸光度,检测系统通过对液滴发射相同强度的白光作为入射光,标志液滴的吸光度强,因此从液滴另一侧射出的透射光强度比功能液滴的弱,于是检测透射光的强度能测量液滴的吸光度,通过判别不同的吸光度来识别标志液滴,如图8所示。
实施例七以不同反光度作为标志液滴特征的编码实现多位点的基因检测
如图9所示,图9是以不同反光度作为标志液滴特征的编码方法示意图,其中标志液滴具有较高的反光度,而功能液滴具有较低的反光度,通过检测液滴的透射光与反射光强度来区分标志液滴与功能液滴。
本实施例实现多位点的基因检测需要四个步骤。
步骤1与实施例三中的步骤1大体相同,不同的是A1对应的注射器内装载的是浓度约为107/mL,直径约为10约为的二氧化硅玻璃微珠悬浊液,用于生成标志液滴。
步骤2与实施例三中的步骤2相同。
步骤3与实施例三中的步骤3相同。
步骤4与实施例三中的步骤4大体相同,不同的是对标志液滴特征的检测方法。由于标志液滴具有较高的反光度,检测系统通过对液滴发射相同强度的白光作为入射光,并在光源一侧与对侧分别安装光强传感器。标志液滴的反光度强,因而能在光源侧的光强传感器上检测到较强的反射光信号。而功能液滴反光度低,因而能在非光源侧检测到较强的透射光信息。通过判别不同的结果来识别标志液滴,如图9所示。
实施例八具有多种特征的标志液滴的编码方法
图10具有多种特征的标志液滴的编码方法示意图。其中A、B、C是不同的功能液滴,而编码区的标志液滴具有不同的特征和数量,形成不同的组合,这些特征包括实施例三到七中的一种或多种。
本实施例中液滴队列的生成方式与实施例三中的类似,不同的是编码区的标志液滴可以不止一种,比如标志液滴1是具有较强反射率的特征,而标志液滴2则是具有较强的荧光信号。通过组合不同特征和数量的标志液滴,形成每个编码区都具有独特的编码特征,使得编码信息更加丰富,编码鲁棒性更强,如图10所示。
应该理解到披露的本发明不仅仅限于描述的特定的方法、方案和物质,因为这些均可变化。还应理解这里所用的术语仅仅是为了描述特定的实施方式方案的目的,而不是意欲限制本发明的范围,本发明的范围仅受限于所附的权利要求。
本领域的技术人员还将认识到,或者能够确认使用不超过常规实验,在本文中所述的本发明的具体的实施方案的许多等价物。这些等价物也包含在所附的权利要求中。
- 还没有人留言评论。精彩留言会获得点赞!