一种催化剂的制备方法及其应用
1.本发明属于催化剂技术领域,涉及一种催化剂的制备方法及其应用,具体是涉及一种水煤气中co和h2o转化为co2和h2的催化剂。
背景技术:
2.水煤气变换反应不仅能够有效的除去富氢气中的一氧化碳,而且能够进一步提升氢气的含量,使得该反应成为近年来的研究热点。然而,由于水煤气变换反应是一个放热反应,在热力学上较低的温度有利于反应的正向进行,实现co的深度去除,但在动力学上较低的温度会大大的降低催化剂的反应速率,使得其在应用中难以达到满意的催化活性。因此,在传统的水煤气变换反应催化工艺中通常是将一个低温变换过程与一个高温变换过程进行串联,进而达到高转化率以及高转化速率的目的。但这就不可避免的使得催化装置变得更为复杂,催化过程也变的更为繁琐。因此,迫切需要一种有效的催化剂能够在较低的反应温度下就可以快速的实现较高的水煤气变换反应催化性能。
3.最近几年,出现了一些镍基的催化体系应用于水煤气变换反应的研究,例如ni/tio
x
, ni/ceo
x
,ni/sio2和ni/al2o3等,但在研究中发现了一些共性的问题,例如,(1)水煤气变换反应在镍基催化剂表面会发生明显的副反应,生成大量的甲烷副产物,这不可避免的降低了氢气的纯度,同时也会在表面产生大量的积碳,使得催化剂的活性和稳定性难以得到保证; (2)镍纳米颗粒在反应过程中易发生团聚,大大影响催化剂的活性和稳定性;(3)镍基催化体系在低温下(<250℃)对于水煤气的催化活性普遍较低。
技术实现要素:
4.针对上述技术问题,本发明构筑了ni
‑
zn@zno催化体系,即通过构筑ni
‑
zn合金,来调节金属镍的几何以及电子结构,进而达到抑制甲烷副产物以及实现低温下高活性的目的;通过ni
‑
zn合金周围包裹的氧化锌,抑制镍纳米颗粒团聚,进而增强了该催化体系的稳定性,为其实现工业化打下了基础。
5.具体的,本发明的技术方案是这样的:
6.一种具有ni
‑
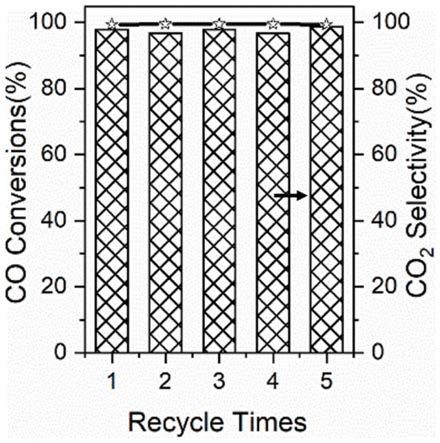
zn@zno核壳结构(zno为壳,ni
‑
zn为核)催化剂的制备方法,将镍盐前驱体和锌盐前驱体混合成水溶液后,在有机碱性物质下进行水热反应,获得粉末前驱体;粉末前驱体在氢气环境下高温还原,即获得本发明的催化剂。
7.本发明的催化剂可以直接应用于水煤气的转化反应,将其中的co和h2o转化为co2和 h2,有效减少了有毒有害的co的含量,提高了h2的含量。
8.本发明的有益效果:
9.(1)本发明的催化剂中,镍纳米颗粒与锌形成合金,有效的调节了金属镍的几何以及电子结构,进而显著的抑制了甲烷副产物的生成,并提升了其低温下的水煤气变换反应催化性能,使得co和h2o在200
‑
350℃可以基本实现完全转化。
10.(2)本发明的催化剂中,镍锌合金周围包裹的氧化锌壳层可以有效地抑制镍纳米颗粒的团聚,增强了该催化体系的稳定性。
11.(3)本发明的催化剂具有优异的低温水煤气变换反应催化活性,在200
‑
350℃下可以将 8%co
‑
20%h2o(g)
‑
72%n2(摩尔比)混合气中的co基本上完全转化,反应充分、反应速率高。
12.(4)本发明的催化剂具有优异的选择性,可以将甲烷副产物的选择性控制在1%以下,甚至达到0.5%。
13.(5)本发明的催化剂具有优异的稳定性和可循环性。本发明的催化剂在经历300℃,70 h的稳定性测试之后,仍然维持较高的活性和选择性;在经历五次的升温(350℃)
‑
降温(150℃) 循环之后,仍然保持较高的活性和选择性。
附图说明
14.所提供附图可对本发明进一步理解,并且构成说明书的一部分,与本发明的实施例一起用于解释本发明,并不构成对本发明的限制。此外,附图数据是描述概要,不是按比例绘制。
15.图1为实施例1催化剂ni
‑
zn@zno(h350)、实施例3催化剂ni
‑
zn@zno(h300)、实施例4催化剂ni
‑
zn@zno(h400)的xrd图。
16.图2为实施例1催化剂ni
‑
zn@zno(h350)的tem图。
17.图3为实施例1催化剂ni
‑
zn@zno(h350)的tem粒径统计图。
18.图4为实施例1催化剂ni
‑
zn@zno(h350)的原位x射线光电子光电子能谱图。
19.图(a)ni0的价态信号,图(b)zn0的信号。
20.图5为实施例1的催化剂ni
‑
zn@zno(h350)的可循环性评价测试结果。
21.图6为实施例1的催化剂ni
‑
zn@zno(h350)的催化稳定性评价测试结果。
具体实施方式
22.下面将结合本发明实施例中的附图,对本发明的技术方案进行描述,显然,所描述的实施例是本技术一部分实施例,而不是全部的实施例。基于本技术中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本技术保护的范围。
[0023][0024]
本发明提出这样的技术方案,
[0025]
一种催化剂的制备方法,所述催化剂的结构为ni
‑
zn@zno,包括以下步骤,
[0026]
s1、将镍前驱体和锌前驱体加入到水中,充分搅拌分散,获得镍锌溶液;
[0027]
本步骤中,水更选优使用超纯水;
[0028]
s2、在步骤s1的镍锌溶液中加入有机碱性物质,搅拌至有机碱性物质溶解,进行水热反应;水热反应结束后降温、洗涤、干燥、研磨,获得粉末前驱体;
[0029]
本步骤中,降温无特别的限制,降温至60℃以下的温度都可以,更方便的是,降温至室温,比如15
‑
25℃;本发明中,洗涤所用的溶剂无特别的限制,但更优选无水乙醇和超纯水的组合,比如无水乙醇和超纯水按体积比5∶5、6∶4、7∶3、8∶2或9∶1的组合;本发明中,干燥
的温度和时间无特别的限制,只要能达到充分干燥就行,干燥温度可以60℃、50℃或40℃,干燥时间可以是2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时或10小时,或者更长的时间,干燥可以在常压下进行,也可以在负压下进行。本发明中,研磨的目的是促使干燥后的粉体的粒径更低(比如,平均粒径在10μm
‑
1mm),有利于后续的还原反应,如果水热反应后获得粉体的平均粒径较小(比如,平均粒径在10μm
‑
1mm),也可以无需研磨的步骤。
[0030]
s3、步骤s2获得的粉末前驱体在氢气环境下加热还原处理,获得所述催化剂。
[0031]
本步骤中,氢气环境可以是纯氢气,也可以是氢气与惰性气体(比如氩气、氦气)的混合气体;如果氢气环境是氢气与惰性气体的混合气体,其中氢气的体积比不低于50%,更优选的是,不低于70%。
[0032]
在本发明一个优选的实施例中,步骤s1中所述镍前驱体为水可溶性镍盐,选自硝酸镍、六水合硝酸镍、氯化镍、六水合氯化镍、硫酸镍和六水合硫酸镍中的至少一种;所述锌前驱体为水可溶性锌盐,选自硝酸锌、六水合硝酸锌、氯化锌、六水合氯化锌、硫酸锌和六水合硫酸锌中的至少一种;
[0033]
镍前驱体和锌前驱体的摩尔比为0.4
‑
3。更优选的,镍前驱体和锌前驱体的摩尔比为0.5
‑
2,更具体的,摩尔比可以是0.5、0.8、1、1.2、1.5或2。
[0034]
在本发明一个优选的实施例中,步骤s1中所述水的加入量以使镍前驱体的浓度为 0.1
‑
5mol/l。更优选的,水的加入量以使镍前驱体的浓度为0.3
‑
3mol/l,更具体的,浓度可以是0.3mol/l、0.5mol/l、0.7mol/l、1mol/l、1.2mol/l、1.5mol/l、2mol/l、2.5mol/l或3mol/l。
[0035]
在本发明一个优选的实施例中,步骤s2中所述有机碱性物质选自尿素、双氰胺和三聚氰胺中的至少一种,所述有机碱性物质的摩尔量为步骤s1中所述镍前驱体和锌前驱体摩尔量之和的1.5
‑
6倍。本发明中采用尿素、双氰胺、三聚氰胺等有机碱性物质,在加热的条件下会缓慢分解,逐渐产生碱性环境,使得水热反应后获得的产物在结构上更均匀。更优选的,有机碱性物质的摩尔量为镍前驱体和锌前驱体摩尔量之和的2
‑
4倍,更具体的,可以是2倍、2.5 倍、3倍、3.5倍和4倍。
[0036]
在本发明一个优选的实施例中,步骤s2中所述水热反应的温度是80
‑
150℃,时间是3
‑
8 小时。在更优选的实施例中,水热反应的温度是100
‑
130℃,时间是4
‑
6小时。
[0037]
在本发明一个优选的实施例中,步骤s3中所述氢气环境的压力为1
‑
10个大气压。更优选的,氢气环境压力为2
‑
7个大气压,具体的,氢气环境压力为2个大气压、3个大气压、4 个大气压、5个大气压、6个大气压或7个大气压。
[0038]
在本发明一个优选的实施例中,步骤s3中所述加热还原处理的温度为200
‑
500℃,时间为1
‑
4小时。更优选的,加热还原处理的温度为300
‑
400℃,时间为2
‑
3小时,更具体的,加热还原处理的条件可以为300℃
×
2.5小时、300℃
×
3小时、350℃
×
2小时、350℃
×
2.5小时、 350℃
×
3小时、400℃
×
2小时或400℃
×
2.5小时。
[0039]
本发明还提出一种上述任一实施方案所述的制备方法制备获得的催化剂的应用方法,应用于水煤气变换反应的催化。
[0040]
在本发明一个优选的实施例中,具体步骤为,将所述催化剂置于反应器中,加热至 150
‑
350℃,通入预热至150
‑
250℃的水煤气进行反应。在本发明中,水煤气的组成无特别的限制,但更优选的,水煤气中co的摩尔含量为1
‑
10%、h2o的摩尔含量为15
‑
30%,剩余的组
分可以是惰性气体,比如氩气,也可以是氮气、二氧化碳或者氢气,或者这些气体的组合。
[0041]
在本发明中,更优选的,反应器的加热温度为200
‑
350℃,更具体的,可以是200℃、250℃、 300℃或350℃。
[0042]
在本发明一个优选的实施例中,所述水煤气的变换反应为,co和h2o转换为co2和h2。
[0043]
在本发明一个优选的实施例中,所述水煤气的通入压力为0.5
‑
10个大气压。更优选的,通入压力为1
‑
10个大气压,具体的,可以是1个大气压、2个大气压、3个大气压、4个大气压、5个大气压、6个大气压、7个大气压、8个大气压、9个大气压或10个大气压。
[0044]
下面以具体实施例进一步说明书本发明的特点。
[0045]
实施例1
[0046]
(1)室温下,将0.1mol ni(no3)2·
6h2o和0.1mol zn(no3)2·
6h2o加入到100ml超纯水中,搅拌20min,形成均匀的镍锌混合盐溶液;
[0047]
(2)将0.4mol尿素加入到上述步骤(1)的溶液中,继续搅拌直至尿素完全溶解,形成透明的混合溶液;
[0048]
(3)将上述步骤(2)的溶液转移到水热釜中,置于110℃的烘箱中,加热反应5h;反应结束后降温至室温,取出固体产物用乙醇和超纯水的混合液(醇水体积比8:2)洗涤3遍,然后置于60℃真空干燥箱中干燥3h,研磨,获得粉末前驱体;
[0049]
(4)将上述步骤(3)的粉末前驱体在350℃,3个大气压的氢气气氛中还原处理2h,即获得本发明的催化剂,表示为ni
‑
zn@zno(h350)。
[0050]
图2是实施例1催化剂ni
‑
zn@zno(h350)的tem图,可以看出催化剂整体呈现出核壳型结构,核是ni
‑
zn合金,壳是zno,即形成了ni
‑
zn@zno的核壳结构。
[0051]
图3是实施例1催化剂ni
‑
zn@zno(h350)的tem粒径统计图,显示出催化剂 ni
‑
zn@zno(h350)的平均粒径为7.35nm。
[0052]
图4是实施例1催化剂ni
‑
zn@zno(h350)的原位x射线光电子光电子能谱图。图(a) ni 2p可以检测到ni0的价态信号,图(b)zn lmm可以检测到zn0的信号,再次证实了ni
‑
zn 合金的形成。
[0053]
实施例2
[0054]
(1)室温下,将0.15mol nicl2·
6h2o和0.3mol zncl2·
6h2o加入到200ml超纯水中,搅拌15min,形成均匀的镍锌混合盐溶液;
[0055]
(2)将1.35mol双氰胺加入到上述步骤(1)的溶液中,继续搅拌直至双氰胺完全溶解,形成透明的混合溶液;
[0056]
(3)将上述步骤(2)的溶液转移到水热釜中,置于120℃的烘箱中,加热反应4h;反应结束后降温至室温,取出固体产物用乙醇和超纯水的混合液(醇水体积比8:2)洗涤3遍,然后置于60℃真空干燥箱中干燥5h,获得粉末前驱体;
[0057]
(4)将上述步骤(3)的粉末前驱体在350℃,3个大气压的氢气和氩气按体积比3∶1组成的混合气体中还原处理3h,即获得本发明的催化剂。
[0058]
实施例3
[0059]
(1)室温下,将0.2mol ni(no3)2·
6h2o和0.1mol zn(no3)2·
6h2o加入到150ml超纯水中,搅拌20min,形成均匀的镍锌混合盐溶液;
[0060]
(2)将0.6mol尿素加入到上述步骤(1)的溶液中,继续搅拌直至尿素完全溶解,形成透明的混合溶液;
[0061]
(3)将上述步骤(2)的溶液转移到水热釜中,置于120℃的烘箱中,加热反应5h;反应结束后降温至室温,取出固体产物用乙醇和超纯水的混合液(醇水体积比8∶2)洗涤3遍,然后置于50℃真空干燥箱中干燥5h,研磨,获得粉末前驱体;
[0062]
(4)将上述步骤(3)的粉末前驱体在300℃,4个大气压的氢气气氛中还原处理2.5h,即获得本发明的催化剂,表示为ni
‑
zn@zno(h300)。
[0063]
实施例4
[0064]
实施例3中步骤(3)的粉末前驱体在400℃,2个大气压的氢气气氛中还原处理2h,即获得本发明的催化剂,表示为ni
‑
zn@zno(h400)。
[0065]
图1为实施例1催化剂ni
‑
zn@zno(h350)、实施例3催化剂ni
‑
zn@zno(h300)、实施例4催化剂ni
‑
zn@zno(h400)的xrd图,显示本发明的催化剂主要存在氧化锌的晶相和金属镍的晶相,且可以看出,经过还原处理后,金属镍对应的ni(111)晶面明显向zn(101)偏移,证明了ni
‑
zn合金的形成,且还原温度越高偏移的越明显。
[0066]
实施例5
[0067]
(1)室温下,将0.1mol nicl2·
6h2o和0.1mol zncl2·
6h2o加入到200ml超纯水中,搅拌20min,形成均匀的镍锌混合盐溶液;
[0068]
(2)将0.8mol三聚氰胺加入到上述步骤(1)的溶液中,继续搅拌直至三聚氰胺完全溶解,形成透明的混合溶液;
[0069]
(3)将上述步骤(2)的溶液转移到水热釜中,置于110℃的烘箱中,加热反应4h;反应结束后降温至室温,取出固体产物用乙醇和超纯水的混合液(醇水体积比9∶1)洗涤3遍,然后置于50℃真空干燥箱中干燥5h,研磨,获得粉末前驱体;
[0070]
(4)将上述步骤(3)的粉末前驱体在350℃,4个大气压的氢气和氩气按体积比4∶1组成的混合气体中还原处理3h,即获得本发明的催化剂。
[0071]
实施例6
[0072]
(1)室温下,将0.4mol nicl2·
6h2o和0.3mol zncl2·
6h2o加入到200ml超纯水中,搅拌20min,形成均匀的镍锌混合盐溶液;
[0073]
(2)将1.4mol尿素加入到上述步骤(1)的溶液中,继续搅拌直至尿素完全溶解,形成透明的混合溶液;
[0074]
(3)将上述步骤(2)的溶液转移到水热釜中,置于110℃的烘箱中,加热反应6h;反应结束后降温至室温,取出固体产物用乙醇和超纯水的混合液(醇水体积比9∶1)洗涤3遍,然后置于50℃真空干燥箱中干燥5h,研磨,获得粉末前驱体;
[0075]
(4)将上述步骤(3)的粉末前驱体在350℃,4个大气压的氢气气氛中还原处理2.5h,即获得本发明的催化剂。
[0076]
对比例1
[0077]
实施例1中将尿素替换为碳酸钠,其余步骤保持不变,获得催化剂,表示为cat
‑
1。
[0078]
对比例2
[0079]
实施例1中将0.4mol尿素替换为0.2mol氢氧化钠,其余步骤保持不变,获得催化剂,表示为cat
‑
2。
[0080]
对比例3
[0081]
按照中国专利公开号cn111659404a中实施例1步骤(1)
‑
(3)的制备方法,获得催化剂,表示为cat
‑
3。
[0082]
对比例4
[0083]
参考中国专利公开号cn111659404a中实施例1步骤(1)
‑
(3)的制备方法,省去加入 al2o3的步骤。具体步骤为:
[0084]
(1)室温下,将0.05mol ni(no3)2·
6h2o和0.05mol zn(no3)2·
6h2o加入到50ml超纯水中,搅拌20min,形成均匀的镍锌混合盐溶液,在室温下自然干燥12h,再在80
‑
100℃下完全干燥,获得固体;
[0085]
(2)将上述(1)得到的固体在600℃空气气氛下焙烧3h,再在600℃的2个大气压的氢气气氛下还原1h,获得催化剂,表示为cat
‑
4。
[0086]
对比例5
[0087]
(1)室温下,将0.1mol ni(no3)2·
6h2o和0.1mol zn(no3)2·
6h2o加入到100ml超纯水中,搅拌20min,形成均匀的镍锌混合盐溶液;
[0088]
(2)在上述步骤(1)的溶液中加入20g氧化铝载体,超声分散,继续加入0.4mol尿素,继续搅拌直至尿素完全溶解;
[0089]
(3)将上述步骤(2)的溶液转移到水热釜中,置于110℃的烘箱中,加热反应5h;反应结束后降温至室温,取出固体产物用乙醇和超纯水的混合液(醇水体积比8∶2)洗涤3遍,然后置于60℃真空干燥箱中干燥3h,研磨,获得粉末前驱体;
[0090]
(4)将上述步骤(3)的粉末前驱体在350℃,3个大气压的氢气气氛中还原处理2h,获得催化剂,表示为cat
‑
5。
[0091]
对水煤气变换反应效果的测试
[0092]
变换反应:
[0093]
水煤气组成(摩尔含量):8%co、20%h2o(g)和72%n2;
[0094]
测试方法:将一定重量的待测催化剂置于反应器中,加热至一定温度,通入预热至170℃的1.0个大气压的水煤气进行反应。结果如下表1所示。
[0095]
表1
[0096][0097][0098]
由上表可以看出,本发明的催化剂对于水煤气的变换反应具有较好的催化活性,co转化率高,ch4的选择性低;而且采用有机碱性物质(比如尿素)比无机碱性物质(比如碳
酸钠、氢氧化钠)获得的催化剂的催化性能更好;同时,加入氧化铝载体对本发明的催化剂有不利的影响,反而降低的催化活性。
[0099]
催化剂可循环性评价测试:将50mg实施例1的催化剂ni
‑
zn@zno(h350)按照上述测试方法在350℃进行测试,测试完,降温至150℃;然后再升温至350℃进行第二次测试,测试完,降温至150℃;再次升温至350℃进行第三次测试,测试完,降温至150℃;再次升温至 350℃进行第四次测试,测试完,降温至150℃;再升温至350℃进行第五次测试。5次的循环性能测试如图5所示。
[0100]
从图5可以看出,经历过5次的低温(150℃)至高温(350℃)的循环性测试,催化剂 ni
‑
zn@zno(h350)活性和选择性均未出现明显的下降,表明本发明的催化剂有着优异的可循环性能,存在工业化的潜力。
[0101]
采用对比例3的cat
‑
3按照上述催化剂可循环性评价测试方法进行测试,在第二次测试时,co的转化率降低到60.7%;第三次测试时,co的转化率降低到52.9%。表明这种催化剂对于水煤气变换反应的催化可循环性较差。
[0102]
催化剂催化稳定性评价测试:取10mg(如果催化剂的重量较高,co转化一直处于较为完全的状态,体现不出催化活性随时间的变化)实施例1的催化剂ni
‑
zn@zno(h350)按照上述测试方法在300℃的反应条件下进行70h的催化剂稳定性评价实验,结果如图6所示。
[0103]
图6显示,经历300℃
×
70h的催化稳定性测试,催化剂ni
‑
zn@zno(h350)的活性和选择性均未出现明显的下降。表明本发明的催化剂具有较好的催化稳定性,存在工业化的潜力。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1