免疫检测套组的制作方法
本发明涉及免疫层析的技术领域,尤其是由释出试剂片、反应试剂片与缓冲稀释液所构成的一种免疫检测套组。
背景技术:
免疫层析检测(immunochromatographic test)是近年来极受重视的一种检测方式,其检测试纸具有构造简单且成本低廉等优点;更重要的是,免疫层析检测最高灵敏度可达10-12g/ml(ppm)。目前,免疫层析检测已广泛地应用于下列各方面:
(1)临床上的应用:如过敏、毒品、传染性疾病、内分泌疾病、肿瘤标志等检测;
(2)农业上的应用:如食物安全、农作物疾病等检测;
(3)环境上的应用:如生物污染、环境污染等检测;
(4)兽医的应用:如动物的各项疾病等检测。
侧流式免疫分析法(Lateral Flow Immunoassay)是一种常用于液态样品的检测方法。请参见图1,为现有的一种侧流式免疫分析试纸的结构图。如图1所示,现有的侧流式免疫分析试纸1’包括:支撑底材11’、薄膜(membrane)12’、结合垫(conjugated pad)13’、样品垫(sample pad)14’、以及吸收垫(absorption pad)15’。
在现有的侧流式免疫分析试纸1’中,薄膜12’的功能是用以将抗体、抗原、DND或RNA与待测样品予以键结。并且,根据所选用的侧流式免疫分析法(竞争型或三明治型)的不同,形成在薄膜12’上的测试线(test line)12T’与控制线(control line)12C’的成分也有所不同。当选用三明治型的侧流式免疫分析法时,载有标志物的第一抗体设置在结合垫13’上;同时,薄膜12’上的测试线12T’由第二抗体所形成,且控制线12C’由第一抗体的二级抗体(secondary antibody)所形成。
进行三明治型的侧流式免疫分析法时,是将待测样品(或称检体) 滴入该样品垫14’上。基于毛细现象的作用,待测样品中的抗原会朝向结合垫13’移动进而与已标志的第一抗体结合。接着,抗原与结合至抗原一端的第一抗体继续地移动至薄膜12’;此时,第二抗体会抓住抗原的另一端,使得测试线12T’显现颜色。进一步地,未与第二抗体结合的抗原及第一抗体继续地往控制线12C’移动;此时,控制线12C’因为第一抗体与二级抗体的结合而显现颜色。必须补充说明的是,三明治型检测方法的定性分析是以测试线12T’显色与否为基准;简单的说,测试线12T’显色表示为阳性反应,反之则为阴性。
另一方面,当选用竞争型的侧流式免疫分析法时,载有标志物的抗体设置在结合垫13’上;同时,竞争抗原(competing antigen)设置在该薄膜12’上以形成测试线12T’,且该抗体的二级抗体设置在该薄膜12’上以形成控制线12C’。进行竞争型的侧流式免疫分析法时,是将待测样品滴入样品垫14’上。基于毛细现象的作用,待测样品中的抗原会朝向结合垫13’移动进而与载有标志物的抗体结合。接着,抗原与抗体继续地移动至薄膜12’;此时,由于抗体已经与抗原结合,因此抗体不会与所述的竞争抗原进一步结合。继续地,与抗原结合的抗体继续地往控制线12C’移动,此时该控制线12C’因为抗体与二级抗体的结合而显现颜色。必须补充说明的是,竞争型检测方法的定性分析是以测试线12T’显色与否为基准;简单的说,测试线12T’显色表示为阴性反应,反之则为阳性。
常见的标志物有乳胶与胶体金两种。目前,试纸厂商将结合垫13’以微孔材料制成,使得载有标志物的抗体能够相对容易地自结合垫13’移动至薄膜12’上的测试线12T’与/或控制线12C’,通过此方式提升侧流式免疫分析试纸的敏感度。
即便如此,现有的侧流式免疫分析试纸1’仍旧在实务使用过程中被发现了如下的缺陷:
(1)由微孔材料制成的结合垫13’制造成本较高;此外,微孔材料制成的结合垫13’需要以4℃的温度进行低温保存,且其保存期限最多只有1年左右。
(2)市售的(竞争型)侧流式免疫分析试纸1’因为无法有效抑制测试线12T’的显色,因此必须透过比色法判断控制线12C’与测试线12T’的色度;其中,颜色的改变可用肉眼判定(定性法),也可使用仪器自动侦测其亮度的变化(定量法);然而,由比色法判断的敏感度最高只能够达到0.5ppb。
技术实现要素:
本发明的主要目的,在于提供一种免疫检测套组,其主要是由释出试剂片与反应试剂片所构成。不同于现有的侧流式免疫分析试纸,使用本发明的免疫检测套组对待测样品进行竞争型或三明治型的侧流式免疫分析时,要先将该释出试剂片置入该样品液中,使得释出试剂片所承载结合有标志物的抗体被释入样品液中,进而与样品液中的目标检测物相互结合;最后,再将该反应试剂片置入样品液中,使得样品液与反应试剂片上的测试线所承载的抗体相互结合,通过测试线的显色与否来判断检测结果为阳性或者阴性。
因此,为了达成上述本发明的主要目的,本发明提供了免疫检测套组的第一实施例,用以对待测样品中的目标检测物进行竞争型侧流式免疫分析,该免疫检测套组包括:
释出试剂片,其上设置有结合着标志物的第一抗体,或设置有抗生素;其中,该第一抗体与该抗生素能够与该目标检测物结合;以及
反应试剂片,其上设置有薄膜,且该薄膜上还设置有对照线与测试线;其中,该对照线由第二抗体所形成,且该测试线由特定抗原与生物分子的共轭物所形成;其中,该第一抗体能够与该目标检测物结合,且所述特定抗原为该目标检测物的抗原;
其中,当使用所述免疫检测套组对待测样品进行竞争型侧流式免疫分析时,需先将该待测样品(如为固体或浓稠液体时)与适量的缓冲稀释液进行混合;接着,再将该释出试剂片置入该待测样品与该缓冲稀释液的混合液中,使得结合有标志物的第一抗体释入混合液中;最后,再取出释出试剂片并将反应试剂片置入混合液中。并且,当待测 样品含有目标检测物时,反应试剂片上的对照线会产生呈色反应,而测试线不会产生呈色反应。
此外,为了达成上述本发明的主要目的,本发明还提供了免疫检测套组的第二实施例,用以对待测样品中的目标检测物进行三明治型侧流式免疫分析,该免疫检测套组包括:
释出试剂片,其上设置有结合着标志物的第一抗体;其中,该第一抗体系能够与目标检测物结合;以及
反应试剂片,其上设置有薄膜,且该薄膜上还设置有对照线与测试线;其中,对照线由第二抗体所形成,且测试线由第三抗体所形成;其中,第二抗体与第三抗体能够与目标检测物结合;
其中,当使用所述免疫检测套组对待测样品进行所述三明治型侧流式免疫分析时,需先将待测样品(如为固体或浓稠液体时)与适量的缓冲稀释液进行混合;接着,再将该释出试剂片置入待测样品与该缓冲稀释液的混合液中,使得结合着标志物的第一抗体释入混合液中;最后,再取出释出试剂片并将该反应试剂片置入该混合液中。并且,当待测样品含有目标检测物时,该反应试剂片上的对照线与测试线会同时产生呈色反应。
附图说明
图1是现有的一种侧流式免疫分析试纸的结构图;
图2是本发明提供的一种免疫检测套组的第一实施状态示意图;
图3是反应试剂片的实测影像图;
图4是A厂牌的片式黄曲毒素试纸的实测影像图;
图5是B厂牌的片式黄曲毒素试纸的实测影像图;
图6是本发明提供的一种免疫检测套组的第二实施状态示意图;
图7是本发明提供的一种免疫检测套组的第三实施状态示意图。
附图符号说明:
1 免疫检测套组
11 释出试剂片
12 反应试剂片
110 支撑底材
111 结合垫
120 支撑底材
121 薄膜
12C 对照线
12T 测试线
122 样品垫
123 吸收垫
13 处理试剂片
130 支撑底材
131 承载垫
1’ 侧流式免疫分析试纸
11’ 支撑底材
12’ 薄膜
13’ 结合垫
14’ 样品垫
15’ 吸收垫
12C’ 控制线
12T’ 测试线
具体实施方式
为了能够更清楚地描述本发明所提出的一种免疫检测套组,以下将配合示图,详尽说明本发明的较佳实施例。
黄曲毒素(Aflatoxin)是作物(如玉米、花生、米、麦、坚果类)发霉时常见的毒性污染物质,具有极强烈的肝毒性及致癌性;国际癌症研究中心将黄曲毒素列为第I类的绝对致癌物质,主要有B1、B2、G1、G2四型,其中又以黄曲毒素B1最常见。当人类或动物误食受黄曲毒素B1污染的食品或饲料,会在体内代谢成黄曲毒素M1,而对肝脏造成伤 害。因此,若哺乳动物食用了受污染的饲料,乳汁中就会含有黄曲毒素M1。故美国食品药物管理局及中国台湾食品药物管理署均规范乳品及乳制品中黄曲毒素M1的含量不得高于0.5ppb。
本发明实施例即提供用以检测黄曲毒素M1或麸麦的一种免疫检测套组,适用于对含有黄曲毒素M1或麸麦的待测样品进行免疫层析检测。在此,所述待测样品可以是尿液、组织液、肉汁、汤品、液态乳品、使固态检体溶于溶剂后所得的液态检体、或经萃取后的液态检体;其中,所述溶剂为水或者样品缓冲液,且该样品缓冲液可以是磷酸盐溶液或高浓度磷酸盐溶液。
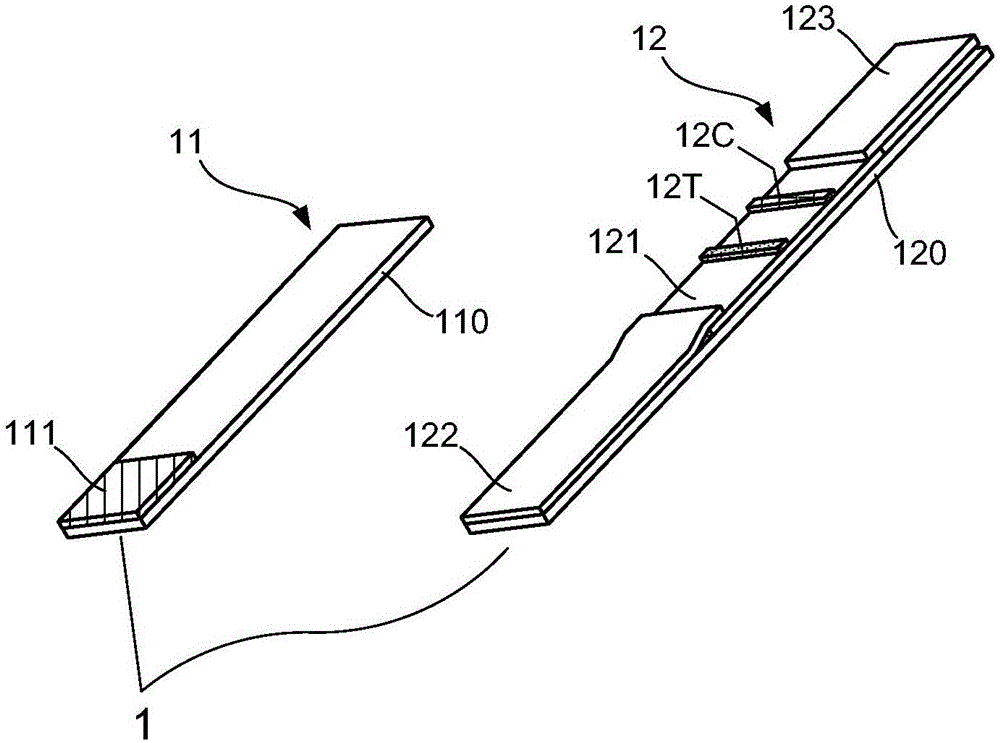
请参见图2,是本发明提供的一种免疫检测套组的第一实施状态示意图。如图2所示,本发明实施例的免疫检测套组1的基础构件包括:释出试剂片11以及反应试剂片12。其中,释出试剂片11的主体为支撑底材110,且该支撑底材110的一侧前端设置有结合垫(conjugated pad)111。在本发明实施例中,结合垫111由微孔材料所制成。
继续说明免疫检测套组1的构件。如图2所示,反应试剂片12的主体也为支撑底材120,且薄膜121设置在该支撑底材120上;其中,薄膜121上设置有对照线12C与测试线12T。此外,样品垫(sample pad)122与吸收垫(absorption pad)123设置在支撑底材120上,并分别连接薄膜121的前端侧与后端侧。在本发明实施例中,薄膜121可以是硝化纤维薄膜(Nitrocellulos,NC)、聚偏氟乙烯薄膜(polyvinylidene difluoride,PVDF)、或者尼龙薄膜(Nylon);并且,样品垫122的制造材料为聚乙烯(Polyethylene,PE)或玻璃纤维(glass fiber)。
上述说明是为了事先介绍关于图2所示的免疫检测套组1的基础构件。接着,基于图2所示的免疫检测套组1的基础构件,以下将进一步介绍说明该免疫检测套组1的第一实施例。
第一实施例
免疫检测套组1的第一实施例是基于实现竞争型侧流式免疫分析法所设计的。请参考图2,在免疫检测套组1的第一实施例中,释出试剂片11的结合垫111上设置有结合着标志物的第一抗体,且第一抗体为 兔子的抗黄曲毒素的抗体C(或老鼠的抗黄曲毒素的抗体)。另外,必须特别说明的是,本发明并不特别限制标志物的种类,因此标志物可以是胶体金(colloidal gold)、胶体硒(colloidal selenium)、乳胶(latex)、奈米银、或奈米碳(nano carbon)。相对于结合垫111设有第一抗体,对照线12C由第二抗体所形成,且第二抗体为山羊抗兔子免疫球蛋白G(Immunoglobulin G,IgG)、或兔子抗小鼠免疫球蛋白G、或山羊抗小鼠免疫球蛋白G。此外,该测试线12T由抗原与生物分子的共轭物所形成;其中,所述抗原为黄曲毒素的抗原,且所述生物分子可以是牛血清白蛋白(Bovine serum albumin,BSA)、鸡卵清白蛋白(Ovalbumin,OVA)、或胆碱单氧化物酶(Choline monooxygenase,CMO)。
在此,必须特别说明的是,上述所称抗体并无特别限制必须为单株抗体或多株抗体。并且,上述关于第一实施例的有关设计是为了使得免疫检测套组1能够快速、有效地检测出待测样品中的黄曲毒素M1;然而,不应以此限制本发明的免疫检测套组1所适用的目标检测物。本发明的主要技术特征在于:免疫检测套组1包括释出试剂片11以及反应试剂片12;在这个基础下,相信熟悉免疫层析试片制造技术的工程人员都可以根据经验而适当地变换、替换抗体与/或抗原的种类,进而使得本发明的免疫检测套组1适用于检测任何的目标检测物,例如:抗原、病毒、蛋白质、DNA、RNA、或小分子物质;其中,所述小分子物质可以为:毒素、抗生素、毒品、或上述任一种的相关衍生物。更进一步地说明,所述毒素例如黄曲毒素M1、黄曲毒素B1、或总黄曲霉毒素。并且,抗生素为β-内酰胺类(β-lactam)抗生素,例如:青霉素、青霉素的衍生物、头孢子菌素、单酰胺环类、碳青霉烯、或青霉烯类酶抑制剂。
当然,本发明的免疫检测套组1也同时适用液态状的待测样品或者固态状的待测样品;其中,液态状的待测样品,例如:生乳、经灭菌处理的全脂乳、低脂乳、保久乳、含有乳成分的饮料、或乳品的衍生产品;并且,固态状的待测样品,例如:奶粉、调和奶粉、或饲料。
进一步地,为了证实上述所说明的免疫检测套组1的第一实施例的 可行性,以下将提供相关实验结果加以证实。
实验一:对液态乳品进行竞争型侧流式免疫分析
实验一是以液态乳品为待测样品,其中,所述液态乳品为市售全脂牛乳、市售奶粉(即,固态状的待测样品)依厂商建议比例冲泡成牛奶、以及市售酸奶。其中,由于市售奶粉依厂商建议比例冲泡成牛奶必须冷却至室温,且酸奶因属于浓稠液态检体,所以必须先经由以下步骤完成萃取动作:
步骤(A):将16mL酸奶加入盛有16mL乙酸乙酯的第一试管中,接着上下轻柔翻转该试管,历时30秒;
步骤(B):将第一试管置于离心机上,在室温下对第一试管进行3000rpm的离心程序,历时10分钟;
步骤(C):将试管内的上层液体(10mL)移入第二试管,并使用氮气将该上层液体吹至干燥;
步骤(D):依序加入2mL的正己烷与1mL的样品缓冲液(Phosphate-buffered saline,PBS)到第二试管中,并将第二试管震荡混匀30秒;
步骤(E):将第二试管置于离心机上,在室温下对第二试管进行3000rpm的离心程序,历时10分钟;
步骤(F):移除第二试管中的上层液体,即获得经萃取后的液态检体。
继续地,确认液态乳品的待测样品(即,液态检体)的温度回复至室温后,便以第一滴管分别吸取3滴液态检体,加至小试管中,之后用第二滴管吸取3滴缓冲稀释液(此处为磷酸盐溶液),加至小试管中。接着,将释出试剂片11的前端(即,结合垫111)插入所述小试管中,小幅度旋转搅拌至少30秒,直到释出试剂片11所承载的结合有标志物的第一抗体与小试管之中的样品液混合均匀;此时,小试管中的样品液将呈现特定颜色(例如淡粉红色)。将小试管静置3分钟后,若样品液中含有黄曲毒素M1时,则黄曲毒素M1会与结合有标志物的第一抗体(在此为抗黄曲毒素M1的抗体)相互结合。
在取出释出试剂片11后,接着将反应试剂片12前端置入小试管中,使得样品垫122浸在样品液中,静置10-15分钟。由于反应试剂片12上的测试线12T是固定有黄曲毒素抗原与生物分子BSA的共轭物,因此该共轭物会与对固定在对照线12C上的第二抗体(IgG)一起竞争样品液中的黄曲毒素M1体,通过此方式完成竞争型侧流式免疫分析。
请参见图3,是反应试剂片的实测影像图。如图3所示的反应试剂片的实测影像(a)、(b)与(c)所示,若样品液中含有黄曲毒素M1,则测试线12T上的抗原与生物分子的共轭物(即黄曲毒素M1-CMO)会与样品液中的黄曲毒素M1相互竞争第一抗体,因此,如果样品液中含有黄曲毒素M1,则测试线12T上的抗原无法与第一抗体结合,最后只有对照线12C会有呈色反应。简单的说,当检测结果为阳性时,仅有对照线12C会显色。相对地,若样品液不包含黄曲毒素M1(或含量太低),则测试线12T上的抗原也会与黄曲毒素M1相互结合,使得对照线12C与测试线12T上同时产生呈色反应。进一步地,将市售片式的黄曲毒素试纸与本发明的免疫检测套组1做了比较测试实验,以验证本发明的免疫检测套组1是否相对于市售片式的黄曲毒素试纸具有进步性。比较测试实验的实验数据整理在下表(一)中。
表(一)
请参见表(一)所示的实验数据,并同时参见图4与图5,分别为A厂牌与B厂牌的片式黄曲毒素试纸的实测影像图。如此,根据表(一)所载的实验数据、图3的实测影像图、图4的实测影像图、以及图5的实测影像图,可以发现,A厂牌与B厂牌的片式黄曲毒素试纸可检出黄曲毒素M1的最低浓度分别为0.5ppb与0.2ppb,然而本发明的免疫检测套组1可检出黄曲毒素M1的最低浓度为0.05ppb;也就是说,本发明的免疫检测套组1的敏感度高于现有的黄曲毒素试纸至少10倍之多。不同于现有片式的试纸是由肉眼判定检测结果为阳性或阴性,当C/T数值差异小于10时无法以肉眼区分差异;如A厂牌在0.2ppb时C/T数值为47.12/45.92肉眼无法区分差异,所以敏感性定在0.5ppb。相同B厂牌也是。本发明可用肉眼判断也可配合判断仪判断反应试剂片12的T读值。在此,当T读值大于5时(肉眼可见弱线),表示检测结果为阴性;相反地,当T读值小于5之时(肉眼看不见T线),表示检测结果为阳性。
上述已清楚、完整地说明本发明的免疫检测套组1的第一实施例及其可行性验证实验。继续地,以下将进一步介绍说明该免疫检测套组1的第二实施例。
所述免疫检测套组1的第二实施例用以检测麸麦(麸质蛋白)。麸麦,又称麸质蛋白、麦胶、面筋、面筋蛋白、谷胶蛋白,是存在于大麦、小麦、燕麦、黑麦等谷物中的一种谷蛋白。根据研究显示,乳糜泻的病者的免疫系统中存在过多的麸朊抗体;其中,麸朊抗体与醇溶谷蛋白产生反应,使得小肠绒毛因受到损害而无法吸收食物中的营养,导致引起腹泻等肠病症状。另外,根据统计数据显示,少数人(约1%)吃了麸质食物会产生麸质过敏症(celiac disease),这些人应选择无麸质饮食。由上述可知,对麸质过敏的人应建议采用无麸质饮食(gluten free diet)。美国食品药物管制局(FDA)于2013年8月2日发表 新的食品规范,强烈要求业者必须标注「无麸质食品」,其麸质的成分含量不可以超过百万分之二十(20parts per million,20ppm)。
第二实施例
请参见图2,免疫检测套组1的第二实施例是基于实现三明治型侧流式免疫分析法所设计的。在免疫检测套组1的第二实施例中,释出试剂片11的结合垫111上设置结合着标志物的第一抗体,且第一抗体为抗麸麦(麸质蛋白)的抗体Ab2。相对于结合垫111设有的第一抗体,对照线12C由第二抗体所形成,且测试线12T由第三抗体所组成。在此,所述第二抗体为山羊抗兔子免疫球蛋白G(Immunoglobulin G,IgG)、兔子抗小鼠免疫球蛋白G、或山羊抗小鼠免疫球蛋白G;并且,所述第三抗体为抗麸麦(麸质蛋白)的抗体Ab1。在此,必须特别说明的是,上述所称抗体并无特别限制必须为单株抗体或多株抗体。
上述关于第二实施例的有关设计是为了使得该免疫检测套组1能够快速、有效地检测出待测样品中的麸麦或麸质蛋白;然而,不应以此限制本发明的免疫检测套组1所适用的目标检测物(麸麦或麸质蛋白)。本发明的主要技术特征在于:免疫检测套组1包括有释出试剂片11以及反应试剂片12;在这个基础下,相信熟悉免疫层析试纸制造技术的工程人员都可以根据经验而适当地变换、替换抗体与抗原的种类,进而使得本发明的免疫检测套组1适用于检测任何的目标检测物,例如:抗原、病毒、蛋白质、DNA、RNA、或细菌等。
为了证实上述所说明的免疫检测套组1的第二实施例的可行性,以下将提供相关实验结果加以证实。
实验二:对液态乳品进行三明治型侧流式免疫分析
实验二同样是以液态食品为待测样品。经确认液态乳品的待测样品(即,液态检体)的温度回复至室温后,便可以用第一滴管分别吸取15滴液态检体,加至含有萃取液A的瓶中,上下摇动至少30秒,使其混合均匀后静置1分钟。之后用第二滴管自瓶中吸取3滴萃取液A,加至含有稀释液B的小试管中,并摇动使之混合均匀。接着,将释出试剂片11的前端(即,结合垫111)插入所述小试管中,小幅度旋转搅拌至少30秒, 直到释出试剂片11所承载的结合有标志物的第一抗体(即,抗麸麦(麸质蛋白)的抗体Ab2)与小试管中的样品液混合均匀;此时,小试管中的样品液将呈现特定颜色(例如淡粉红色)。将小试管静置3分钟后,若样品液中含有麸麦时,则麸麦会与结合有标志物的第一抗体(在此为抗麸麦的抗体Ab2)相互结合。
在取出释出试剂片11后,接着将反应试剂片12前端置入该小试管中,使得样品垫122浸于样品液中,并静置10-15分钟。由于反应试剂片12上的测试线12T是固定有第三抗体(即,抗麸麦(麸质蛋白)的抗体Ab1),因此第三抗体会与样品液中的麸麦相互结合,使得测试线12T产生呈色反应。同时,由于反应试剂片12的对照线12C上固定有第二抗体(在此为IgG),因此第二抗体也会与释出试剂片上的抗体相互结合,使得对照线12C产生呈色反应。简单的说,当检测结果为阳性时,测试线12T与对照线12C会同时显色。相对地,当样品液中不含麸麦(麸质蛋白)时,则测试线12T不可能与麸麦相互结合,是以测试线12T不会显色,仅有对照线12C会显色。
进一步地,将市售片式的麸质蛋白试纸与本发明的免疫检测套组1做了比较测试实验,以验证本发明的免疫检测套组1是否相对于市售片式的麸质蛋白试纸具有进步性。比较测试实验的实验数据整理于下表(二)中。
表(二)
C厂牌为市售生产的片式的麸质蛋白试纸,其采用T读值判定检测结果为阳性或阴性。根据表(二)所载的实验数据,可以发现,C厂牌的片式的麸质蛋白试纸可检出麸麦的最低浓度为1.0ppm,然而本发明的免疫检测套组1可检出麸麦的最低浓度为0.1ppm;也就是说,本发明的免疫检测套组1的敏感度高于现有片式的麸质蛋白试纸至少10倍之多。
如此,已完整且清楚地揭露本发明的一种免疫检测套组1;总的来说,本发明的免疫检测套组1具有以下的优点:
(1)本发明主要是以释出试剂片11与反应试剂片12构成所谓的免疫检测套组1。不同于现有的侧流式免疫分析试纸,使用本发明的免疫检测套组对待测样品进行竞争型或三明治型的侧流式免疫分析时,先将释出试剂片11置入样品液中使得释出试剂片11所承载的结合着标志物的抗体被释入样品液中,进而与样品液中的目标检测物相互结合;最后,再将反应试剂片12置入样品液中,使得样品液与反应试剂片12上的测试线12T所承载的抗体相互竞争(或结合),通过测试线12T的显色与否来判断检测结果为阳性或者阴性。
(2)承上述第(1)点,实验一与实验二的实验数据是证实本发明的免疫检测套组1对于目标检测物的检测敏感度高于市售的检测试纸至少10倍之多。
(3)值得说明的是,为了增加分析试纸的敏感度,现有的侧流式免疫分析试纸1’中(如图1所示)的结合垫13’通常以高成本的微孔材料制成;此外,微孔材料制成的结合垫13’制程繁琐需要进行低温保存,且其保存期限最多只有1年左右。然而,本发明的反应试剂片12上并没有设置任何以微孔材料制成的结合垫,因此制造成本相对低廉,同时可保存在室温中,期限可达两年也相对较长。
在此,必须特别补充说明的是,由于上述实验一与实验二是对液态乳品进行检测,因此检测过程中使用了缓冲液对待测样品进行了萃取(或稀释)。然而,若待测样品为尿液(或液体),则进行免疫分析检测时便不需要使用任何稀释液,可直接将释出试剂片11置入尿液中,待完成反映之后再将反应试剂片12置入尿液中,由此完成尿液的免疫 分析检测。
继续地,请参见图6,是本发明提供的一种免疫检测套组的第二实施状态示意图。如图6所示,免疫检测套组1的第二实施状态同样是由释出试剂片11以及反应试剂片12所构成。然而,不同于上述图2所示的免疫检测套组1的第一实施状态的是,第二实施状态的反应试剂片12上并未设有样品垫;取而代之的是,支撑底材120上的薄膜121延伸至支撑底材120的前端。
进一步地,请参见图7,是本发明提供的一种免疫检测套组的第三实施状态示意图。如图7所示,免疫检测套组1的第三实施状态同样基础包括释出试剂片11以及反应试剂片12所构成。然而,不同于上述图2与图6所示的免疫检测套组1,免疫检测套组1的第三实施状态还包括处理试剂片13;其中,该处理试剂片13的主体为支撑底材130,且该支撑底材130上设置有承载垫131,而承载垫131上载有药品处理物。
举例而言,当使用本发明的免疫检测套组1检测牛奶中是否含有抗生素酶(例如B-内酰胺类抗生素酶)时,必须先对该B-内酰胺类抗生素酶进行前置处理;也就是说,必须先将所述处理试剂片13的前端侧置入待测牛奶中,使得承载垫131上的药品处理物(如氨苄青霉素)释入待测牛奶中。进一步地,将释出试剂片11的前端置入待测牛奶中,再将结合垫111所载的青霉素酶抗体-标志物的结合物释入待测牛奶中;此时,假设牛奶中含有青霉素酶,则氨苄青霉素则被水解,那么牛奶中就没有可以跟青霉素酶抗体结合的青霉素酶。最后,当反应试剂片12被置入牛奶中,则青霉素抗体-标志物的结合物会与反应试剂片12的测试线12T上的抗原结合,使得测试线12T产生呈色反应。简单地说,当检测结果为阳性时,测试线12T会显色。
必须加以强调的是,上述的详细说明是针对本发明可行实施例的具体说明,惟该实施例并非用以限制本发明的专利范围,凡未脱离本发明技艺精神所为的等效实施或变更,均应包含在本发明的专利范围中。
- 还没有人留言评论。精彩留言会获得点赞!