反应性标记化合物及其用途的制作方法
本发明主张2014年3月27日申请的美国临时申请案第61/971,313号的优先权。其内容以引用的方式并入本文中。
技术领域
本发明涉及反应性标记化合物及其用途。本发明涉及环辛炔稠合的荧光探针、迭氮基-BODIPY化合物及荧光裂解探针的三唑形成用于含炔或含迭氮化物生物分子的诊断及成像的领域。本发明涉及在迭氮化物-炔环加成(AAC)之后的荧光增强策略。
背景技术:
铜催化迭氮化物-炔1,3-偶极环加成(CuAAC)已在化学生物学中获得广泛使用,其用于诸如标记复杂混合物中的生物分子及对固定细胞及组织进行成像的应用。(Kolb等人,Angew.Chem.Int.Ed.2001,40,2004;Rostovtsev等人,Angew.Chem.Int.Ed.2002,41,2596;Wu and Fokin,Aldrichimica Acta 2007,40,7)。将荧光探针并入到蛋白质、DNA、RNA、脂质及聚醣中(在其天然细胞环境内)为成像及理解其活体内作用提供机会。(Best,Biochemistry 2009,48,6571)。
举例而言,蛋白质中的聚醣在细胞表面上显示牵涉多种生理及病理过程。通常在病理病状,诸如炎症及癌转移中观测到患病细胞表面上的异常醣基化。特定言之,被认为由唾液酸转移酶及海藻醣基转移酶的表达位置及表达量的变化产生的改变的末端唾液酸化及海藻醣基化与恶性肿瘤相关。探究附接至蛋白质或脂质的作为癌症生物标记的聚醣的生物信息内容的能力已变为醣组学研究的主要课程。(Hsu等人,Proc.Nat.Acad.Sci.U.S.A.,2007,104,2614;Sawa等人,Proc.Nat.Acad.Sci.U.S.A.,2006,103,12371。)
分析活系统中的醣基化模式的变化现在为可能的。(Prescher及Bertozzi,Nat.Chem.Bio.2005,1,13。)将含有充当生物正交化学报导子的独特官能基的非天然碳水化合物代谢并入到细胞生物合成机制中起始所述过程。接着在细胞表面上处理及构建经修饰的聚醣。与装备有互补生物正交官能基的可侦测荧光探针的后续反应使得能够侦测并入的非天然聚醣。(Sletten及Bertozzi,Angew.Chem.Int.Ed.2009,48,2)。
生物正交化学报导子的概念已应用于蛋白质中的醣基化的蛋白组分析及活系统中的细胞表面的化学重塑。生物正交化学反应亦已用于其他应用,诸如蛋白质标记、基于活性的蛋白质折迭、靶蛋白识别、转译后修饰及细胞增殖监测。经由生物正交化学报导子策略标记活细胞上的特定官能基已在细胞生物学中变得日益强大。在过去几年,已在生物正交化学、尤其展示活系统中的生物兼容性及选择性的彼生物正交化学方面取得巨大进展。由于这些方法的内在选择性及可调电子学,其通常基于作为理想生物正交反应的环加成。然而,所述领域特定言的自细胞及生物体应用的视角仍面临许多挑战。举例而言,大部分生物正交报导子策略必然伴有使用荧光团标记的反应物搭配物的多步程序,其通常产生难以自细胞内环境或组织移除的高背景荧光噪声。另外,这些方法需要高浓度的试剂及催化剂以获得可侦测信号。
近期一些努力已集中于在与非荧光炔或迭氮化物的CuAAC反应的后设计非荧光或弱荧光探针,其可接合以得到高荧光三唑复合物(图2)。(Zhou及Fahrni,J.Am.Chem.Soc.2004,126,8862;Sivakumar等人,Org.Lett.2004,24,4603;Sawa等人,Proc.Nat.Acad.Sci.U.S.A.,2006,103,12371;Xie等人,Tetrahedron 2008,64,2906;Li等人,Org.Lett.2009,11,3008;Le Droumaguet等人,Chem.Soc.Rev.2010,39,1223;Qi等人,Bioconjugate Chem.2011,22,1758;Chao等人,Sci.China Chemistry 2012,55,125;Herner等人,Org.Biomol.Chem.2013,11,3297。)由于在无起始物质的背景荧光噪声的情况下形成三唑的独特荧光特性,以高效率发生的此类型的CuAAC反应将在细胞生物学及功能蛋白组学的新兴领域中具有广泛应用。然而,这些迭氮基官能化及炔基官能化探针通常需要在UV区域中激发且发射在水溶液中具有差量子产率的蓝光;此类光学特性对于生物应用不为理想的。
通过高效CuAAC反应诱导的独特荧光增强将在细胞生物学及功能蛋白组学的新兴领域中具有广泛应用(Le Droumaguet,C.;Wang,C.;Wang,Q.Chem.Soc.Rev.2010,39,1233-1239;Sawa,M.;Hsu,T.-L.;Itoh,T.;Sugiyama,M.;Hanson,S.R.;Vogt,P.K.;Wong,C.-H.Proc.Natl.Acad.Sci.U.S.A.2006,103,12371-12376;Shie,J.-J.;Liu,Y.-C.;Lee,Y.-M.;Lim,C.;Fang,J.-M.;Wong,C.-H.J.Am.Chem.Soc.2014,136,9953-9961;Hsu,T.-L.;Hanson,S.R.;Kishikawa,K.;Wang,S.-K.;Sawa,M.;Wong,C.-H.Proc.Natl.Acad.Sci.U.S.A.2007,104,2614-2619;Tsai,C.-S.;Liu,P.-Y.;Yen,H.-Y.;Hsu,T.-L.;Wong C.-H.Chem.Commun.2010,46,5575-5577。)然而,铜(I)的毒性已阻碍在活系统中使用CuAAC。
为了避开与金属催化剂相关的细胞毒性问题,已开发环应变促进的迭氮化物-炔环加成(SPAAC)作为替代策略(Jewett,J.C.;Bertozzi,C.R.Chem.Soc.Rev.2010,39,1272-1279;Debets,M.F.;van Berkel,S.S.;Dommerholt,J.;Dirks,A.T.J.;Rutjes,F.P.J.T.;van Delft,F.L.Acc.Chem.Res.2011,44,805-815。)通常将环辛炔部分作为茎结构并入到诸如二氟化环辛炔(DIFO)及衍生物的SPAAC试剂中(Agard,N.J.;Prescher,J.A.;Bertozzi,C.R.J.Am.Chem.Soc.2004,126,15046-15047;Codelli,J.A.;Baskin,J.M.;Agard,N.J.;Bertozzi,C.R.J.Am.Chem.Soc.2008,130,11486-11493。)为了增加环应变,环辛炔部分可与其他环稠合以得到具有较高反应性的SPAAC试剂,诸如二苄基环辛炔(DIBO)(Ning,X.;Guo,J.;Wolfert,M.A.;Boons,G.-J.Angew.Chem.Int.Ed.2008,47,2253-2255;Poloukhtine,A.A.;Mbua,N.E.;Wolfert,M.A.;Boons,G.-J.;Popik,V.V.J.Am.Chem.Soc.2009,131,15769-15777;H.;Neves,A.A.;Stairs,S.;Ireland-Zecchini,H.;Brindle,K.M.;Leeper,F.J.Chem.Sci.2011,2,932-936;Friscourt,F.;Ledin,P.A.;Mbua,N.E.;Flanagan-Steet,H.R.;Wolfert,M.A.;Steet,R.;Boons,G.-J.J.Am.Chem.Soc.2012,134,5381-5389)、二芳基氮杂环辛炔酮(BARAC)(Jewett,J.C.;Sletten,E.M.;Bertozzi,C.R.J.Am.Chem.Soc.2010,132,3688-3690)及双环壬炔(BCN)(Dommerholt,J.;Schmidt,S.;Temming,R.;Hendriks,L.J.A.;Rutjes,F.P.J.T.;van Hest,J.C.M.;Lefeber,D.J.;Friedl,P.;van Delft,F.L.Angew.Chem.Int.Ed.2010,49,9422-9425)。携带收缩七元环的四甲基噻环庚炔(TMTH)亦在与迭氮化物的环加成反应中展现反应性(de Almeida,G.;Sletten,E.M.;Nakamura,H.;Palaniappan,K.K.;Bertozzi,C.R.Angew.Chem.Int.Ed.2012,51,2443-2447;King,M.,Baati,R.;Wagner,A.Chem.Commun.2012,48,9308-9309)。两个基于环辛炔的荧光探针CoumBARAC(Jewett,J.C.;Bertozzi,C.R.Org.Lett.2011,13,5937-5939)及Fl-DIBO(Friscourt,F.;Fahrni,C.J.;Boons,G.-J.J.Am.Chem.Soc.2012,134,18809-18815)已分别由Bertozzi组及Boons组描述。
4,4-二氟基-4-硼杂-3a,4a-二氮杂-s-二环戊二烯并苯(亦称为BODIPY)染料为用于许多生物应用的类型的普遍荧光团。BODIPY染料具有多种优点,包括大的化学及光物理稳定性、相对高的莫耳吸收系数及荧光量子产率(Φfl)、在可见光谱区域中的激发/发射波长(比500nm更长)及具有高峰强度的窄发射带宽。(Loudet及Burgess,Chem.Rev.2007,107,4891;Ulrich等人,Angew.Chem.Int.Ed.2008,47,1184;Boens等人,Chem.Soc.Rev.2012,41,1130;Kamkaew等人,Chem.Soc.Rev.2013,42,77。)
已开发一些迭氮基-BODIPY衍生物用于在CuAAC反应的后进行荧光标记。(Li等人,J.Org.Chem.2008,73,1963。)具体言之,已展示低荧光3-迭氮基-BODIPY衍生物经历CuAAC反应以得到具有增强的荧光的相应三唑。虽然所述三唑产物提供与迭氮基-BODIPY相比300倍增加的发射,但其展现低荧光量子产率(Φfl<0.03)且未反应的迭氮基-BODIPY化合物不稳定且未能与炔基生物分子在生理条件下反应,使得其与许多生物应用不兼容。(Wang等人,Sci.China Chemistry 2012,55,125;Chauhan等人Tetrahedron Lett.2014,55,244。)
技术实现要素:
因此,需要切合细胞环境的分子探针的新颖设计用于细胞标记、侦测及/或目测生物分子在细胞中的定位。
因此,本发明涉及一种含有切合细胞环境的发射绿色BODIPY架构的新颖系列的迭氮基-BODIPY化合物。BODIPY架构用作其有吸引力的合成及荧光特征的起始模块。例示性BODIPY易于在8-位置处经修饰。此位置处的芳基化对吸收及发射波长不具有实质性影响,因为芳基部分及BODIPY核心扭转且共轭非偶合。
这些例示性化合物适用于在无冲洗过程的情况下标记炔官能化蛋白,且适合于通过共焦显微镜目测炔标志醣基共轭物在细胞中的定位。此外,炔基-醣修饰的细胞可溶解且通过使用AzBOCEt标记在SDS-PAGE上进行分析,用于直接侦测在无富集的情况下的探针标记醣蛋白。
本发明亦关于能够对炔官能化部分有反应的基于环辛炔的荧光探针。在一些态样中,基于环辛炔的荧光探针可存在于细胞中。在一些态样中,基于环辛炔的荧光探针可用于侦测细胞中的迭氮化物-醣共轭物。
本发明亦关于通过使样品与式(I)的迭氮基-BODIPY化合物及/或式(IV)的基于环辛炔的荧光探针在双成像模式下接触进行迭氮基官能化醣共轭物及炔基官能化醣共轭物的双成像。
本发明亦关于使用经设计以形成与酶的活性位点的共价键的探针来量测酶的活性,其中这些探针包含炔部分用于通过含迭氮化物荧光探针进行进一步侦测。酶可为唾液酸酶。荧光唾液酸酶探针可基于作为基于机制的抑制剂的3-氟唾液酸氟化物。
因此,本发明涉及经历迭氮化物-炔环加成(AAC)的式(I)的例示性新颖迭氮基-BODIPY化合物。迭氮化物-炔环加成(AAC)可为应力或催化剂(金属或有机物)促进的。在一些实施例中,催化剂为金属催化剂。在某些实施例中,金属催化剂为铜(I)。
本文所描述的例示性迭氮基-BODIPY化合物可与炔化合物反应,产生具有增强的荧光的稳定三唑产物以便于侦测。所提供的例示性化合物表示在无冲洗过程的情况下细胞成像的显着进步且适用于在SDS-PAGE之后自细胞溶解物进行炔标志醣蛋白的直接凝胶内侦测。
本发明的一个态样涉及一种式(I)的迭氮基-BODIPY化合物:
或其医药学上可接受的盐、溶剂合物或水合物,且其中G1、G2、G3、G4a、G4b、G5、G6、G7及G8及n如本文所描述。
在另一态样中,本发明提供制备迭氮基-BODIPY化合物的合成方法。本发明亦表明本文所描述的迭氮基-BODIPY化合物可与有机炔反应以形成具有增强的荧光的三唑产物。
在另一态样中,本发明提供一种式(III)的三唑基-BODIPY化合物:
或其医药学上可接受的盐、溶剂合物或水合物,且其中G1、G2、G3、G4a、G4b、G5、G6、G7、G8及n如本文所描述。靶分子包括(但不限于)生物分子,诸如DNA、RNA、蛋白质及聚醣。
迭氮化物-炔环加成(AAC)可为应力或催化剂(金属或有机物)促进的。在一些实施例中,催化剂为金属催化剂。在某些实施例中,金属催化剂为铜(I)。
在又一态样中,本发明涉及对生物分子进行侦测及/或成像的方法。
在某些实施例中,本发明提供一种对含炔分子进行成像的方法,所述方法包含
(a)在允许如本文所描述的化合物接合至含炔分子的炔基的条件下用含有所述分子的样品培育所述化合物以形成三唑产物;及
(b)侦测自所述三唑产物释放的荧光信号。
在某些实施例中,本发明提供一种侦测样品中的含炔分子的方法,所述方法包含:
(a)使如本文所描述的化合物与疑似具有含炔分子的样品接触;
(b)侦测自所述样品释放的荧光信号的位准,及
(c)确定所述样品中含炔分子的存在,
其中,相比于在分子不存在下的荧光信号位准,增强的荧光信号指示含炔分子的存在。
在另一态样中本发明提供一种式(IV)的基于环辛炔的荧光探针:
或其医药学上可接受的盐、溶剂合物或水合物,且其中:
G9、G10、G11、G12、G13、G14、G15、G16、G17及G18在各种情况下独立地为氢、视情况经取代的C1-6烷基、视情况经取代的C1-6烯基、视情况卤素、视情况亚硝基、视情况经取代的C1-6炔基、视情况经取代的芳基、视情况经取代的酰基、-ORA、-CH2ORA、-OC(O)RA、-SRA、-N(RB)2、-N(RA)C(O)RA、-C(O)N(RB)2、-CN、-NO2、-C(O)RA、-C(O)ORA、-S(O)RA、-SO2RA、-SO3RA、-SO2N(RB)2及-NHSO2RB;
R在各种情况下独立地选自氢、卤素、视情况经取代的烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基、视情况经取代的酰基、-ORA、-CH2ORA、-OC(O)RA、-SRA、-N(RB)2、-N(RA)C(O)RA、-C(O)N(RB)2、-CN、-NO2、-C(O)RA、-C(O)ORA、-S(O)RA、-SO2RA、-SO3RA、-SO2N(RB)2及-NHSO2RB;
各RA独立地选自氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基及视情况经取代的芳基;及
各RB独立地选自氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基及视情况经取代的芳基,或两个RB与中间的氮结合在一起形成杂环;
G9及G10在各种情况下为氢、氟基、氯基、溴基、碘基、亚硝基、烷基、烷氧基、芳氧基或炔基,及
其中烷基及烷氧基为非分支链、饱和的且具有1-4个碳原子;芳基及芳氧基的芳基可为碳环芳基或杂环芳基;碳环芳基具有总共6-20个碳原子,包括取代基的碳原子;杂环芳基具有总共5-20个碳原子,包括取代基的碳原子;烷氧羰基为羧酸的烷基酯,其中烷基如上文所定义;各烷基、芳基、烷氧基、芳氧基、苯并及烷氧羰基独立地可不经取代或经一或多个取代基取代;烷基取代基为卤基、羟基、胺基或芳基;芳基取代基为卤基、羟基、胺基、烷基、芳基、硝基或羧基;及卤基取代基为氟基或氯基;
m为1;
n为0、1、2、3或4。
在某些实施例中,本发明提供一种对含迭氮化物分子进行成像的方法,所述方法包含
(a)在允许式(IV)化合物接合至含迭氮化物分子的迭氮基的条件下用含有所述分子的样品培育所述化合物以形成三唑产物;及
(b)侦测自所述三唑产物释放的荧光信号。
在某些实施例中,本发明提供一种侦测样品中的含迭氮化物分子的方法,所述方法包含:
(a)使式(IV)化合物与疑似具有含迭氮化物分子的样品接触;
(b)侦测自所述样品释放的荧光信号的位准,及
(c)确定所述样品中含迭氮化物分子的存在,
其中,相比于在分子不存在下的荧光信号位准,增强的荧光信号指示含迭氮化物分子的存在。
在另一态样中,本发明涉及式(V)化合物:
其中L选自由以下组成的群:卤素、烷氧基、苯氧基、五氟苯氧基、4-硝基苯氧基、伞形酮基、烷酸酯、苯甲酸酯、三氟甲磺酸酯、甲磺酸酯或甲苯磺酸酯。
在某些实施例中,本发明提供一种对唾液酸酶的活性位点进行成像的方法,所述方法包含:
(a)使如申请专利范围第41项的化合物与疑似包含唾液酸酶的样品在将所述化合物接合至所述唾液酸酶的活性位点的条件下接触以形成共价键产物,
(b)使所述共价键产物与如本文所描述的含迭氮化物荧光探针接触以形成荧光三唑产物,
(c)量测自所述三唑产物释放的荧光信号。
在某些实施例中,本发明提供一种侦测样品中的唾液酸酶的活性位点的方法,其包含:
(a)使如申请专利范围第44项的化合物与疑似具有唾液酸酶分子的样品接触;
(b)量测自样品混合物中的苄丙酮香豆素钠(coumadin)释放的荧光信号的位准,及
(c)确定样品中的唾液酸酶分子的存在,
其中,相比于在分子不存在下的荧光信号位准,增强的荧光信号指示含迭氮化物分子的存在。
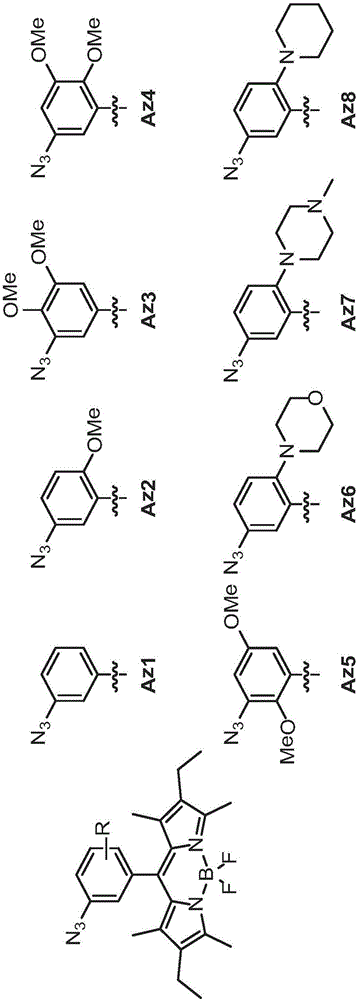
附图说明
图1展示用于经由CuAAC反应筛检荧光的经迭氮基取代的BODIPY衍生物Az1-Az8的结构。
图2展示在微量滴定板中在UV灯激发(λex=365nm)下Az1-Az8的CuAAC反应的荧光筛检,得到相应三唑衍生物T1-T8。化合物Az1至Az8及T1至T8以芳基部分的电子密度的递增次序进行分类。
图3展示通过与4-戊炔-1-醇的CuAAC反应获得的胺基-BODIPY Am10、迭氮基-BODIPY Az2、Az9-Az11及相应三唑基-BODIPY T2、T9-T11的结构。
图4展示三唑基-BODIPY T10、迭氮基-BODIPY Az10及胺基-BODIPY Am10在乙醇溶液(12μM)中在25℃下的吸收及正规化发射光谱。插图:T10、Az10及Am10在乙醇溶液(120μM)中的影像。黄色Az10溶液至绿色T10溶液的变化是显而易见的。
图5展示标记有AzBOCEt(Az10)的炔官能化BSA。通过荧光成像(λex=488nm;λem=526nm)分析凝胶。通过库马斯蓝(Coomassie blue)染色揭示总蛋白含量。
图6展示标记有AzBOCEt(Az10)且通过共焦显微镜成像的细胞荧光。(A)说明使用Ac4ManNAl、Ac4GalNAl及Az10的细胞标记实验。将CL1-5细胞用100μM Ac4ManNAl、Ac4GalNAl或对照糖(Ac4ManNAc及Ac4GalNAc)培育3天,且接着用0.1μM Az10在CuAAC条件下处理1h。(B)荧光、明视场及重迭影像。比例尺:75μm。(C)表达的醣基共轭物在CL1-5细胞中的定位。用荧光探针Az10(绿色)、抗GRASP65(高尔基体(Golgi)标记)随后Cy3共轭抗兔(红色)及赫斯特(Hoechst)(蓝色,细胞核标记)标记这些醣基共轭物。比例尺:10μm。
图7展示通过来自细胞溶解物的AzBOCEt(Az10)使用CuAAC进行炔标志醣蛋白的直接凝胶内荧光侦测。通过荧光成像(λex=488nm;λem=526nm)及库马斯蓝染色分析凝胶以显示总蛋白含量。
图8展示标记有AzBOCEt(Az10)且通过共焦显微镜成像的细胞荧光。CL1-5细胞用Ac4GlcNAl或Ac4GlcNAc培育3天且接着用0.1μM Az10在CuAAC条件下处理1h。(A)荧光、明视场及重迭影像。比例尺:75μm。(B)表达的葡糖基共轭物在CL1-5肺细胞中的定位。用荧光探针Az10(绿色)、抗GRASP65(高尔基体标记)随后Cy3共轭抗兔(红色)及赫斯特(蓝色,细胞核标记)标记这些葡糖基共轭物。比例尺:10μm。
图9展示使用细胞中的CuAAC的AzBOCEt进行运输的聚醣的荧光成像。将CL1-5细胞用500μM Ac4ManNAl培育1h且随后用PBS缓冲液洗涤以移除过量Ac4ManNAl。将糖处理过的细胞在培养基中分别培育1h、7h、14h及21h,且接着用0.1μM Az10在CuAAC条件下标记1h。
图10展示基于SPAAC的荧光形成探针、比较探针及比较探针的三唑产物。
图11展示唾液酸酶探针的结构。
图12展示基于活性的探针的一般结构。
图13展示唾液酸酶的机制及过渡状态。
图14展示唾液酸酶活性位点的x射线晶体结构。
图15展示用于识别唾液酸酶的荧光反应。
图16A、16B展示在荧光探针的反应期间的吸收及发射光谱及时间过程。
图17展示逆荧光探针浓度随101及模型迭氮化物分子的反应时间而变的曲线图。
图18展示逆荧光探针浓度随101及模型含迭氮化物聚醣的反应时间而变的曲线图。1/[101]对比化合物101与N-迭氮基乙酰甘露糖胺在CD3OD-D2O溶液(5:1,v/v)中的反应时间的曲线图如由1H-NMR监测。
图19展示用200μM Ac4ManNAz培育且用100μM探针101标记的活CL1-5细胞在无洗涤及无固定条件下的延时荧光及重迭影像。
图20展示如通过共焦显微镜目测的探针标记唾液酸醣共轭物在CL1-5细胞中的定位。
图21展示使用细胞中的SPAAC的coumOCT(101)进行运输的醣共轭物的高对比度度荧光成像。
图22展示用200μM Ac4ManNAz培育且用100μM探针101标记的活CL1-5细胞的延时荧光及重迭影像。
图23展示使用细胞中的SPAAC的coumOCT(101)进行运输的醣共轭物的荧光成像。
图24A、24B展示细胞中标记有coumOCT(1)、AzBOCEt且通过共焦显微镜成像的双荧光。细胞中标记有coumOCT(1)、AzBOCEt且通过共焦显微镜成像的双荧光。(A)说明使用Ac4ManNAl、Ac4GlcNAz、101及AzBOCEt的细胞标记实验。将CL1-5细胞用100μM Ac4ManNAl及Ac4GlcNAz或对照糖(Ac4ManNAc及Ac4GlcNAc)培育3天,用100μM探针101在SPAAC条件下处理0.5h,且接着用0.1μM AzBOCEt在CuAAC条件下培育1h。(B)CL1-5细胞中的双荧光成像。这些醣共轭物用探针101(青色)(对于含迭氮基醣共轭物)及AzBOCEt(绿色)(对于含炔醣共轭物)标记(比例尺:10μm)。
图25展示化合物101与3-巯基丙酸的CDCl3中的1H-NMR光谱。
图26展示化合物111与3-巯基丙酸的CDCl3中的1H-NMR光谱。
具体实施方式
以下更详细地描述特定官能基及化学术语的定义。化学元素是根据CAS版本,化学与物理学手册(Handbook of Chemistry and Physics),第75版,内封面的元素周期表(Periodic Table of the Elements)来识别,且特定官能基一般如其中所描述来定义。另外,有机化学的一般原理以及特定官能部分及反应性描述于以下各者中:Organic Chemistry,Thomas Sorrell,University Science Books,Sausalito,1999;Smith and March March's Advanced Organic Chemistry,第5版,John Wiley&Sons,Inc.,New York,2001;Larock,Comprehensive Organic Transformations,VCH Publishers,Inc.,New York,1989;及Carruthers,Some Modern Methods of Organic Synthesis,第3版,Cambridge University Press,Cambridge,1987。
本文所描述的化合物可包含一或多个不对称中心,且因此可以各种立体异构形式,例如对映异构体及/或非对映异构体存在。举例而言,本文所描述的化合物可呈个别对映异构体、非对映异构体或几何异构体形式,或可呈立体异构体的混合物的形式,包括外消旋混合物及富集一或多种立体异构体的混合物。可使用包括对掌性高压液相层析法(HPLC),及形成对掌性盐且使其结晶的方法使异构体自混合物分离;或可通过不对称合成来制备优选异构体。参见例如Jacques等人,Enantiomers,Racemates and Resolutions(Wiley Interscience,New York,1981);Wilen等人,Tetrahedron 33:2725(1977);Eliel,E.L.Stereochemistry of Carbon Compounds(McGraw-Hill,NY,1962);及Wilen,S.H.Tables of Resolving Agents and Optical Resolutions第268页(E.L.Eliel,Ed.,Univ.of Notre Dame Press,Notre Dame,IN 1972)。本发明另外涵盖呈实质上不含其他异构体的个别异构体形式的化合物,且替代地,呈各种异构体的混合物形式。
当列出值的范围时,意欲涵盖所述范围内的各值及子范围。举例而言,「C1-6烷基」意欲涵盖C1、C2、C3、C4、C5、C6、C1-6、C1-5、C1-4、C1-3、C1-2、C2-6、C2-5、C2-4、C2-3、C3-6、C3-5、C3-4、C4-6、C4-5及C5-6烷基。
如本文所用,「烷基」是指具有1至10个碳原子的直链或分支链饱和烃基的基团(「C1-10烷基」)。在一些实施例中,烷基具有1至9个碳原子(「C1-9烷基」)。在一些实施例中,烷基具有1至8个碳原子(「C1-8烷基」)。在一些实施例中,烷基具有1至7个碳原子(「C1-7烷基」)。在一些实施例中,烷基具有1至6个碳原子(「C1-6烷基」)。在一些实施例中,烷基具有1至5个碳原子(「C1-5烷基」)。在一些实施例中,烷基具有1至4个碳原子(「C1-4烷基」)。在一些实施例中,烷基具有1至3个碳原子(「C1-3烷基」)。在一些实施例中,烷基具有1至2个碳原子(「C1-2烷基」)。在一些实施例中,烷基具有1个碳原子(「C1烷基」)。在一些实施例中,烷基具有2至6个碳原子(「C2-6烷基」)。C1-6烷基的实例包括甲基(C1)、乙基(C2)、正丙基(C3)、异丙基(C3)、正丁基(C4)、第三丁基(C4)、第二丁基(C4)、异丁基(C4)、正戊基(C5)、3-戊基(C5)、戊基(C5)、新戊基(C5)、3-甲基-2-丁基(C5)、第三戊基(C5)及正己基(C6)。烷基的额外实例包括正庚基(C7)、正辛基(C8)及其类似基团。除非另外说明,否则烷基在各种情况下独立地为未经取代(「未经取代的烷基」)或经一或多个取代基取代(「经取代的烷基」)。在某些实施例中,烷基为未经取代的C1-10烷基(例如,-CH3)。在某些实施例中,烷基为经取代的C1-10烷基。
如本文所用,「烯基」是指具有2至10个碳原子及一或多个碳-碳双键(例如,1、2、3或4个双键)的直链或分支链烃基的基团。在一些实施例中,烯基具有2至9个碳原子(「C2-9烯基」)。在一些实施例中,烯基具有2至8个碳原子(「C2-8烯基」)。在一些实施例中,烯基具有2至7个碳原子(「C2-7烯基」)。在一些实施例中,烯基具有2至6个碳原子(「C2-6烯基」)。在一些实施例中,烯基具有2至5个碳原子(「C2-5烯基」)。在一些实施例中,烯基具有2至4个碳原子(「C2-4烯基」)。在一些实施例中,烯基具有2至3个碳原子(「C2-3烯基」)。在一些实施例中,烯基具有2个碳原子(「C2烯基」)。一或多个碳-碳双键可为内部(诸如在2-丁烯基中)或末端(诸如在1-丁烯基中)的。C2-4烯基的实例包括乙烯基(C2)、1-丙烯基(C3)、2-丙烯基(C3)、1-丁烯基(C4)、2-丁烯基(C4)、丁二烯基(C4)及其类似基团。C2-6烯基的实例包括前述C2-4烯基以及戊烯基(C5)、戊二烯基(C5)、己烯基(C6)及其类似基团。烯基的额外实例包括庚烯基(C7)、辛烯基(C8)、辛三烯基(C8)及其类似基团。除非另外说明,否则烯基在各种情况下独立地为未经取代(「未经取代的烯基」)或经一或多个取代基取代(「经取代的烯基」)。在某些实施例中,烯基为未经取代的C2-10烯基。在某些实施例中,烯基为经取代的C2-10烯基。
如本文所用,「炔基」是指具有2至10个碳原子及一或多个碳-碳参键(例如,1、2、3或4个参键)的直链或分支链烃基的基团(「C2-10炔基」)。在一些实施例中,炔基具有2至9个碳原子(「C2-9炔基」)。在一些实施例中,炔基具有2至8个碳原子(「C2-8炔基」)。在一些实施例中,炔基具有2至7个碳原子(「C2-7炔基」)。在一些实施例中,炔基具有2至6个碳原子(「C2-6炔基」)。在一些实施例中,炔基具有2至5个碳原子(「C2-5炔基」)。在一些实施例中,炔基具有2至4个碳原子(「C2-4炔基」)。在一些实施例中,炔基具有2至3个碳原子(「C2-3炔基」)。在一些实施例中,炔基具有2个碳原子(「C2炔基」)。一或多个碳-碳参键可为内部(诸如在2-丁炔基中)或末端(诸如在1-丁炔基中)的。C2-4炔基的实例包括(但不限于)乙炔基(C2)、1-丙炔基(C3)、2-丙炔基(C3)、1-丁炔基(C4)、2-丁炔基(C4)及其类似基团。C2-6烯基的实例包括前述C2-4炔基以及戊炔基(C5)、己炔基(C6)及其类似基团。炔基的额外实例包括庚炔基(C7)、辛炔基(C8)及其类似基团。除非另外说明,否则炔基在各种情况下独立地为未经取代(「未经取代的炔基」)或经一或多个取代基取代(「经取代的炔基」)。在某些实施例中,炔基为未经取代的C2-10炔基。在某些实施例中,炔基为经取代的C2-10炔基。
如本文所用,「碳环基」或「碳环」是指在非芳环系统中具有3至10个环碳原子(「C3-10碳环基」)及0个杂原子的非芳族环烃基的基团。在一些实施例中,碳环基具有3至8个环碳原子(「C3-8碳环基」)。在一些实施例中,碳环基具有3至7个环碳原子(「C3-7碳环基」)。在一些实施例中,碳环基具有3至6个环碳原子(「C3-6碳环基」)。在一些实施例中,碳环基具有4至6个环碳原子(「C4-6碳环基」)。在一些实施例中,碳环基具有5至6个环碳原子(「C5-6碳环基」)。在一些实施例中,碳环基具有5至10个环碳原子(「C5-10碳环基」)。例示性C3-6碳环基包括(但不限于)环丙基(C3)、环丙烯基(C3)、环丁基(C4)、环丁烯基(C4)、环戊基(C5)、环戊烯基(C5)、环己基(C6)、环己烯基(C6)、环己二烯基(C6)及其类似基团。例示性C3-8碳环基包括(但不限于)前述C3-6碳环基以及环庚基(C7)、环庚烯基(C7)、环庚二烯基(C7)、环庚三烯基(C7)、环辛基(C8)、环辛烯基(C8)、双环[2.2.1]庚基(C7)、双环[2.2.2]辛基(C8)及其类似基团。例示性C3-10碳环基包括(但不限于)前述C3-8碳环基以及环壬基(C9)、环壬烯基(C9)、环癸基(C10)、环癸烯基(C10)、八氢-1H-茚基(C9)、十氢萘基(C10)、螺[4.5]癸基(C10)及其类似基团。如前述实例说明,在某些实施例中,碳环基为单环(「单环碳环基」)或多环(例如,含有稠合、桥联或螺环系统,诸如双环系统(「双环碳环基」)或三环系统(「三环碳环基」))且可为饱和的或可含有一或多个碳-碳双键或参键。「碳环基」亦包括其中如上文所定义的碳环基环与一或多个芳基或杂芳基稠合的环系统,其中附接点在碳环基环上,且在这些情况下,碳原子数目继续指示碳环系统中的碳原子数目。除非另外说明,否则碳环基在各种情况下独立地为未经取代(「未经取代的碳环基」)或经一或多个取代基取代(「经取代的碳环基」)。在某些实施例中,碳环基为未经取代的C3-10碳环基。在某些实施例中,碳环基为经取代的C3-10碳环基。
如本文所用,「杂环基」或「杂环」是指具有环碳原子及1至4个环杂原子的3至14元非芳环系统的基团,其中各杂原子独立地选自氮、氧及硫(「3-14员杂环基」)。在含有一或多个氮原子的杂环基中,在价数容许时,附接点可为碳或氮原子。杂环基可为单环(「单环杂环基」)或多环(例如,稠合、桥联或螺环系统,诸如双环系统(「双环杂环基」)或三环系统(「三环杂环基」)),且可为饱和的或可含有一或多个碳-碳双键或参键。杂环基多环系统可在一个或两个环中包括一或多个杂原子。「杂环基」亦包括其中如上文所定义的杂环基环与一或多个碳环基稠合的环系统,其中附接点在碳环基或杂环基环上;或其中如上文所定义的杂环基与一或多个芳基或杂芳基稠合的环系统,其中附接点在杂环基环上,且在这些情况下,环成员的数目继续指示杂环基环系统中的环成员的数目。除非另外说明,否则杂环基在各种情况下独立地为未经取代(「未经取代的杂环基」)或经一或多个取代基取代(「经取代的杂环基」)。在某些实施例中,杂环基为未经取代的3-14员杂环基。在某些实施例中,杂环基为经取代的3-14员杂环基。
如本文所用,「芳基」是指芳环系统中提供有6-14个环碳原子及0个杂原子的单环或多环(例如,双环或三环)4n+2芳环系统(例如在环状数组中共享6、10或14个π电子)的基团(「C6-14芳基」)。在一些实施例中,芳基具有6个环碳原子(「C6芳基」;例如,苯基)。在一些实施例中,芳基具有10个环碳原子(「C10芳基」;例如,萘基,诸如1-萘基及2-萘基)。在一些实施例中,芳基具有14个环碳原子(「C14芳基」;例如,蒽基)。「芳基」亦包括其中如上文所定义的芳基环与一或多个碳环基或杂环基稠合的环系统,其中附接基团或附接点在芳基环上,且在这些情况下,碳原子数目继续指示芳基环系统中的碳原子数目。除非另外说明,否则芳基在各种情况下独立地为未经取代(「未经取代的芳基」)或经一或多个取代基取代(「经取代的芳基」)。在某些实施例中,芳基为未经取代的C6-14芳基。在某些实施例中,芳基为经取代的C6-14芳基。
如本文所用,「杂芳基」是指芳环系统中提供有环碳原子和1-4个环杂原子(其中各杂原子独立地选自氮、氧及硫)的5-14员单环或多环(例如,双环、三环)4n+2芳环系统(例如,在环状数组中共享6、10或14个π电子)的基团(「5-14员杂芳基」)。在含有一或多个氮原子的杂芳基中,在价数容许时,附接点可为碳或氮原子。杂芳基多环系统可在一个或两个环中包括一或多个杂原子。「杂芳基」包括其中如上文所定义的杂芳基环与一或多个碳环基或杂环基稠合的环系统,其中附接点在杂芳基环上,且在这些情况下,环成员的数目继续指示杂芳基环系统中的环成员的数目。「杂芳基」亦包括其中如上文所定义的杂芳基环与一或多个芳基稠合的环系统,其中附接点在芳基或杂芳基环上,且在这些情况下,环成员的数目指示稠合多环(芳基/杂芳基)环系统中的环成员的数目。其中一个环不含杂原子的多环杂芳基(例如,吲哚基、喹啉基、咔唑基及其类似基团),附接点可在任一环上,亦即,在携带杂原子的环上(例如,2-吲哚基)或在不含杂原子的环上(例如,5-吲哚基)。
如自上文所理解,如本文所定义的烷基、烯基、炔基、杂烷基、杂烯基、杂炔基、碳环基、杂环基、芳基及杂芳基在某些实施例中为视情况经取代的。视情况经取代是指可经取代或未经取代的基团(例如,「经取代」或「未经取代」的烷基、「经取代」或「未经取代」的烯基、「经取代」或「未经取代」的炔基、「经取代」或「未经取代」的杂烷基、「经取代」或「未经取代」的杂烯基、「经取代」或「未经取代」的杂炔基、「经取代」或「未经取代」的碳环基、「经取代」或「未经取代」的杂环基、「经取代」或「未经取代」的芳基或「经取代」或「未经取代」的杂芳基)。一般而言,术语「经取代」意谓至少一个存在于基团上的氢经容许取代基置换,例如,在取代的后导致稳定化合物的取代基,例如,不通过诸如重排、环化、消除或其他反应自发地经历转化的化合物。除非另外指示,否则「经取代」的基团在基团的一或多个可取代位置处具有取代基,且当任何既定结构中的一个以上位置经取代时,取代基在各位置处相同或不同。术语「经取代」预期包括经有机化合物的所有容许取代基、导致稳定化合物形成的本文所描述的任何取代基取代。本发明涵盖任何及所有此类组合以便获得稳定化合物。出于本发明的目的,杂原子(诸如氮)可具有氢取代基及/或满足杂原子价数且导致稳定部分形成的如本文所描述的任何适合取代基。
例示性碳原子取代基包括(但不限于)卤素、-CN、-NO2、-N3、-SO2H、-SO3H、-OH、-ORaa、-ON(Rbb)2、-N(Rbb)2、-N(Rbb)3+X-、-N(ORcc)Rbb、-SH、-SRaa、-SSRcc、-C(=O)Raa、-CO2H、-CHO、-C(ORcc)2、-CO2Raa、-OC(=O)Raa、-OCO2Raa、-C(=O)N(Rbb)2、-OC(=O)N(Rbb)2、-NRbbC(=O)Raa、-NRbbCO2Raa、-NRbbC(=O)N(Rbb)2、-C(=NRbb)Raa、-C(=NRbb)ORaa、-OC(=NRbb)Raa、-OC(=NRbb)ORaa、-C(=NRbb)N(Rbb)2、-OC(=NRbb)N(Rbb)2、-NRbbC(=NRbb)N(Rbb)2、-C(=O)NRbbSO2Raa、-NRbbSO2Raa、-SO2N(Rbb)2、-SO2Raa、-SO2ORaa、-OSO2Raa、-S(=O)Raa、-OS(=O)Raa、-Si(Raa)3、-OSi(Raa)3-C(=S)N(Rbb)2、-C(=O)SRaa、-C(=S)SRaa、-SC(=S)SRaa、-SC(=O)SRaa、-OC(=O)SRaa、-SC(=O)ORaa、-SC(=O)Raa、-P(=O)2Raa、-OP(=O)2Raa、-P(=O)(Raa)2、-OP(=O)(Raa)2、-OP(=O)(ORcc)2、-P(=O)2N(Rbb)2、-OP(=O)2N(Rbb)2、-P(=O)(NRbb)2、-OP(=O)(NRbb)2、-NRbbP(=O)(ORcc)2、-NRbbP(=O)(NRbb)2、-P(Rcc)2、-P(Rcc)3、-OP(Rcc)2、-OP(Rcc)3、-B(Raa)2、-B(ORcc)2、-BRaa(ORcc)、C1-10烷基、C1-10全卤烷基、C2-10烯基、C2-10炔基、C1-10杂烷基、C2-10杂烯基、C2-10杂炔基、C3-14碳环基、3-14员杂环基、C6-14芳基及5-14员杂芳基,其中各烷基、烯基、炔基、杂烷基、杂烯基、杂炔基、碳环基、杂环基、芳基及杂芳基独立地经0、1、2、3、4或5个Rdd基团取代;
或碳原子上的两个成对氢经基团=O、=S、=NN(Rbb)2、=NNRbbC(=O)Raa、=NNRbbC(=O)ORaa、=NNRbbS(=O)2Raa、=NRbb或=NORcc置换;
Raa在各种情况下独立地选自C1-10烷基、C1-10全卤烷基、C2-10烯基、C2-10炔基、C1-10杂烷基、C2-10杂烯基、C2-10杂炔基、C3-10碳环基、3-14员杂环基、C6-14芳基及5-14员杂芳基,或两个Raa基团连接以形成3-14员杂环基或5-14员杂芳基环,其中各烷基、烯基、炔基、杂烷基、杂烯基、杂炔基、碳环基、杂环基、芳基及杂芳基独立地经0、1、2、3、4或5个Rdd基团取代;
Rbb在各种情况下独立地选自氢、-OH、-ORaa、-N(Rcc)2、-CN、-C(=O)Raa、-C(=O)N(Rcc)2、-CO2Raa、-SO2Raa、-C(=NRcc)ORaa、-C(=NRcc)N(Rcc)2、-SO2N(Rcc)2、-SO2Rcc、-SO2ORcc、-SORaa、-C(=S)N(Rcc)2、-C(=O)SRcc、-C(=S)SRcc、-P(=O)2Raa、-P(=O)(Raa)2、-P(=O)2N(Rcc)2、-P(=O)(NRcc)2、C1-10烷基、C1-10全卤烷基、C2-10烯基、C2-10炔基、C1-10杂烷基、C2-10杂烯基、C2-10杂炔基、C3-10碳环基、3-14员杂环基、C6-14芳基及5-14员杂芳基,或两个Rbb基团连接以形成3-14员杂环基或5-14员杂芳基环,其中各烷基、烯基、炔基、杂烷基、杂烯基、杂炔基、碳环基、杂环基、芳基及杂芳基独立地经0、1、2、3、4或5个Rdd基团取代;
Rcc在各种情况下独立地选自氢、C1-10烷基、C1-10全卤烷基、C2-10烯基、C2-10炔基、C1-10杂烷基、C2-10杂烯基、C2-10杂炔基、C3-10碳环基、3-14员杂环基、C6-14芳基及5-14员杂芳基,或两个Rcc基团连接以形成3-14员杂环基或5-14员杂芳基环,其中各烷基、烯基、炔基、杂烷基、杂烯基、杂炔基、碳环基、杂环基、芳基及杂芳基独立地经0、1、2、3、4或5个Rdd基团取代;
Rdd在各种情况下独立地选自卤素、-CN、-NO2、-N3、-SO2H、-SO3H、-OH、-ORee、-ON(Rff)2、-N(Rff)2、-N(Rff)3+X-、-N(ORee)Rff、-SH、-SRee、-SSRee、-C(=O)Ree、-CO2H、-CO2Ree、-OC(=O)Ree、-OCO2Ree、-C(=O)N(Rff)2、-OC(=O)N(Rff)2、-NRffC(=O)Ree、-NRffCO2Ree、-NRffC(=O)N(Rff)2、-C(=NRff)ORee、-OC(=NRff)Ree、-OC(=NRff)ORee、-C(=NRff)N(Rff)2、-OC(=NRff)N(Rff)2、-NRffC(=NRff)N(Rff)2、-NRffSO2Ree、-SO2N(Rff)2、-SO2Ree、-SO2ORee、-OSO2Ree、-S(=O)Ree、-Si(Ree)3、-OSi(Ree)3、-C(=S)N(Rff)2、-C(=O)SRee、-C(=S)SRee、-SC(=S)SRee、-P(=O)2Ree、-P(=O)(Ree)2、-OP(=O)(Ree)2、-OP(=O)(ORee)2、C1-6烷基、C1-6全卤烷基、C2-6烯基、C2-6炔基、C1-6杂烷基、C2-6杂烯基、C2-6杂炔基、C3-10碳环基、3-10员杂环基、C6-10芳基、5-10员杂芳基,其中各烷基、烯基、炔基、杂烷基、杂烯基、杂炔基、碳环基、杂环基、芳基及杂芳基独立地经0、1、2、3、4或5个Rgg基团取代,或两个成对Rdd取代基可连接以形成=O或=S;
Ree在各种情况下独立地选自C1-6烷基、C1-6全卤烷基、C2-6烯基、C2-6炔基、C1-6杂烷基、C2-6杂烯基、C2-6杂炔基、C3-10碳环基、C6-10芳基、3-10员杂环基及3-10员杂芳基,其中各烷基、烯基、炔基、杂烷基、杂烯基、杂炔基、碳环基、杂环基、芳基及杂芳基独立地经0、1、2、3、4或5个Rgg基团取代;
Rff在各种情况下独立地选自氢、C1-6烷基、C1-6全卤烷基、C2-6烯基、C2-6炔基、C1-6杂烷基、C2-6杂烯基、C2-6杂炔基、C3-10碳环基、3-10员杂环基、C6-10芳基及5-10员杂芳基,或两个Rff基团连接以形成3-14员杂环基或5-14员杂芳基环,其中各烷基、烯基、炔基、杂烷基、杂烯基、杂炔基、碳环基、杂环基、芳基及杂芳基独立地经0、1、2、3、4或5个Rgg基团取代;及
Rgg在各种情况下独立地为卤素、-CN、-NO2、-N3、-SO2H、-SO3H、-OH、-OC1-6烷基、-ON(C1-6烷基)2、-N(C1-6烷基)2、-N(C1-6烷基)3+X-、-NH(C1-6烷基)2+X-、-NH2(C1-6烷基)+X-、-NH3+X-、-N(OC1-6烷基)(C1-6烷基)、-N(OH)(C1-6烷基)、-NH(OH)、-SH、-SC1-6烷基、-SS(C1-6烷基)、-C(=O)(C1-6烷基)、-CO2H、-CO2(C1-6烷基)、-OC(=O)(C1-6烷基)、-OCO2(C1-6烷基)、-C(=O)NH2、-C(=O)N(C1-6烷基)2、-OC(=O)NH(C1-6烷基)、-NHC(=O)(C1-6烷基)、-N(C1-6烷基)C(=O)(C1-6烷基)、-NHCO2(C1-6烷基)、-NHC(=O)N(C1-6烷基)2、-NHC(=O)NH(C1-6烷基)、-NHC(=O)NH2、-C(=NH)O(C1-6烷基)、-OC(=NH)(C1-6烷基)、-OC(=NH)OC1-6烷基、-C(=NH)N(C1-6烷基)2、-C(=NH)NH(C1-6烷基)、-C(=NH)NH2、-OC(=NH)N(C1-6烷基)2、-OC(NH)NH(C1-6烷基)、-OC(NH)NH2、-NHC(NH)N(C1-6烷基)2、-NHC(=NH)NH2、-NHSO2(C1-6烷基)、-SO2N(C1-6烷基)2、-SO2NH(C1-6烷基)、-SO2NH2、-SO2C1-6烷基、-SO2OC1-6烷基、-OSO2C1-6烷基、-SOC1-6烷基、-Si(C1-6烷基)3、-OSi(C1-6烷基)3-C(=S)N(C1-6烷基)2、C(=S)NH(C1-6烷基)、C(=S)NH2、-C(=O)S(C1-6烷基)、-C(=S)SC1-6烷基、-SC(=S)SC1-6烷基、-P(=O)2(C1-6烷基)、-P(=O)(C1-6烷基)2、-OP(=O)(C1-6烷基)2、-OP(=O)(OC1-6烷基)2、C1-6烷基、C1-6全卤烷基、C2-6烯基、C2-6炔基、C1-6杂烷基、C2-6杂烯基、C2-6杂炔基、C3-10碳环基、C6-10芳基、3-10员杂环基、5-10员杂芳基;或两个成对Rgg取代基可连接以形成=O或=S;其中X-为相对离子。
如本文所用,术语「卤基」或「卤素」是指氟(氟基,-F)、氯(氯基,-Cl)、溴(溴基,-Br)或碘(碘基,-I)。
在某些实施例中,存在于氮原子上的取代基为氮保护基(在本文中亦称为「胺基保护基」)。氮保护基包括(但不限于)-OH、-ORaa、-N(Rcc)2、-C(=O)Raa、-C(=O)N(Rcc)2、-CO2Raa、-SO2Raa、-C(=NRcc)Raa、-C(=NRcc)ORaa、-C(=NRcc)N(Rcc)2、-SO2N(Rcc)2、-SO2Rcc、-SO2ORcc、-SORaa、-C(=S)N(Rcc)2、-C(=O)SRcc、-C(=S)SRcc、C1-10烷基(例如,芳烷基、杂芳烷基)、C2-10烯基、C2-10炔基、C1-10杂烷基、C2-10杂烯基、C2-10杂炔基、C3-10碳环基、3-14员杂环基、C6-14芳基及5-14员杂芳基,其中各烷基、烯基、炔基、杂烷基、杂烯基、杂炔基、碳环基、杂环基、芳烷基、芳基及杂芳基独立地经0、1、2、3、4或5个Rdd基团取代,且其中Raa、Rbb、Rcc及Rdd如本文所定义。氮保护基包括详细地描述于以引用的方式并入本文中的Protecting Groups in Organic Synthesis,T.W.Greene及P.G.M.Wuts,第3版,John Wiley&Sons,1999中的彼等氮保护基。
举例而言,氮保护基,诸如酰胺基(例如,-C(=O)Raa),包括(但不限于)甲酰胺、乙酰胺、氯乙酰胺、三氯乙酰胺、三氟乙酰胺、苯基乙酰胺、3-苯基丙酰胺、吡啶酰胺、3-吡啶基甲酰胺、N-苯甲酰基苯丙胺酰基衍生物、苯甲酰胺、对苯基苯甲酰胺、邻硝基苯基乙酰胺、邻硝基苯氧基乙酰胺、乙酰乙酰胺、(N'-二硫苄氧基酰胺基)乙酰胺、3-(对羟苯基)丙酰胺、3-(邻硝基苯基)丙酰胺、2-甲基-2-(邻硝基苯氧基)丙酰胺、2-甲基-2-(邻苯基偶氮基苯氧基)丙酰胺、4-氯丁酰胺、3-甲基-3-硝基丁酰胺、邻硝基肉桂酰胺、N-乙酰基蛋胺酸衍生物、邻硝基苯甲酰胺及邻(苯甲酰氧基甲基)苯甲酰胺。
氮保护基,诸如胺基甲酸酯基(例如,-C(=O)ORaa),包括(但不限于)胺基甲酸甲酯、胺基甲酸乙酯、胺基甲酸9-茀基甲酯(Fmoc)、胺基甲酸9-(2-磺基)茀基甲酯、胺基甲酸9-(2,7-二溴)茀基甲酯、胺基甲酸2,7-二-第三丁基-[9-(10,10-二侧氧基-10,10,10,10-四氢噻吨基)]甲酯(DBD-Tmoc)、胺基甲酸4-甲氧基苯甲酰甲酯(Phenoc)、胺基甲酸2,2,2-三氯乙酯(Troc)、胺基甲酸2-三甲基硅烷基乙酯(Teoc)、胺基甲酸2-苯基乙酯(hZ)、胺基甲酸1-(1-金刚烷基)-1-甲基乙酯(Adpoc)、胺基甲酸1,1-二甲基-2-卤乙酯、胺基甲酸1,1-二甲基-2,2-二溴乙酯(DB-t-BOC)、胺基甲酸1,1-二甲基-2,2,2-三氯乙酯(TCBOC)、胺基甲酸1-甲基-1-(4-联苯基)乙酯(Bpoc)、胺基甲酸1-(3,5-二-第三丁基苯基)-1-甲基乙酯(t-Bumeoc)、胺基甲酸2-(2'-吡啶基及4'-吡啶基)乙酯(Pyoc)、胺基甲酸2-(N,N-二环己基甲酰胺基)乙酯、胺基甲酸第三丁酯(BOC)、胺基甲酸1-金刚烷酯(Adoc)、胺基甲酸乙烯酯(Voc)、胺基甲酸烯丙酯(Alloc)、胺基甲酸1-异丙基烯丙酯(Ipaoc)、胺基甲酸桂皮酯(Coc)、胺基甲酸4-硝基桂皮酯(Noc)、胺基甲酸8-喹啉酯、胺基甲酸N-羟基哌啶酯、胺基甲酸烷基二硫酯、胺基甲酸苄酯(Cbz)、胺基甲酸对甲氧基苄酯(Moz)、胺基甲酸对硝基苄酯、胺基甲酸对溴苄酯、胺基甲酸对氯苄酯、胺基甲酸2,4-二氯苄酯、胺基甲酸4-甲基亚磺酰基苄酯(Msz)、胺基甲酸9-蒽基甲酯、胺基甲酸二苯基甲酯、胺基甲酸2-甲基硫乙酯、胺基甲酸2-甲基磺酰基乙酯、胺基甲酸2-(对甲苯磺酰基)乙酯、胺基甲酸[2-(1,3-二噻烷基)]甲酯(Dmoc)、胺基甲酸4-甲基噻吩酯(Mtpc)、胺基甲酸2,4-二甲基噻吩酯(Bmpc)、胺基甲酸2-磷鎓基乙酯(Peoc)、胺基甲酸2-三苯基磷鎓基异丙酯(Ppoc)、胺基甲酸1,1-二甲基-2-氰基乙酯、胺基甲酸间氯-对酰氧基苄酯、胺基甲酸对(二羟基硼基)苄酯、胺基甲酸5-苯并异恶唑基甲酯、胺基甲酸2-(三氟甲基)-6-色酮基甲酯(Tcroc)、胺基甲酸间硝基苯酯、胺基甲酸3,5-二甲氧基苄酯、胺基甲酸邻硝基苄酯、胺基甲酸3,4-二甲氧基-6-硝基苄酯、胺基甲酸苯基(邻硝基苯基)甲酯、胺基甲酸第三戊酯、硫代胺基甲酸S-苄酯、胺基甲酸对氰苄酯、胺基甲酸环丁酯、胺基甲酸环己酯、胺基甲酸环戊酯、胺基甲酸环丙基甲酯、胺基甲酸对癸氧基苄酯、胺基甲酸2,2-二甲氧酰基乙烯酯、胺基甲酸邻(N,N-二甲基甲酰胺基)苄酯、胺基甲酸1,1-二甲基-3-(N,N-二甲基甲酰胺基)丙酯、胺基甲酸1,1-二甲基丙炔酯、胺基甲酸二(2-吡啶基)甲酯、胺基甲酸2-呋喃基甲酯、胺基甲酸2-碘乙酯、胺基甲酸异冰片酯、胺基甲酸异丁酯、胺基甲酸异烟碱酯、胺基甲酸对(p'-甲氧苯基偶氮基)苄酯、胺基甲酸1-甲基环丁酯、胺基甲酸1-甲基环己酯、胺基甲酸1-甲基-1-环丙基甲酯、胺基甲酸1-甲基-1-(3,5-二甲氧苯基)乙酯、胺基甲酸1-甲基-1-(对苯偶氮基苯基)乙酯、胺基甲酸1-甲基-1-苯基乙酯、胺基甲酸1-甲基-1-(4-吡啶基)乙酯、胺基甲酸苯酯、胺基甲酸对(苯偶氮基)苄酯、胺基甲酸2,4,6-三-第三丁基苯酯、胺基甲酸4-(三甲基铵)苄酯及胺基甲酸2,4,6-三甲基苄酯。
氮保护基,诸如磺酰胺基(例如,-S(=O)2Raa),包括(但不限于)对甲苯磺酰胺(Ts)、苯磺酰胺、2,3,6,-三甲基-4-甲氧基苯磺酰胺(Mtr)、2,4,6-三甲氧基苯磺酰胺(Mtb)、2,6-二甲基-4-甲氧基苯磺酰胺(Pme)、2,3,5,6-四甲基-4-甲氧基苯磺酰胺(Mte)、4-甲氧基苯磺酰胺(Mbs)、2,4,6-三甲基苯磺酰胺(Mts)、2,6-二甲氧基-4-甲基苯磺酰胺(iMds)、2,2,5,7,8-五甲基色满-6-磺酰胺(Pmc)、甲烷磺酰胺(Ms)、β-三甲基硅烷基乙烷磺酰胺(SES)、9-蒽磺酰胺、4-(4',8'-二甲氧基萘基甲基)苯磺酰胺(DNMBS)、苄基磺酰胺、三氟甲基磺酰胺及苯甲酰甲基磺酰胺。
其他氮保护基包括(但不限于)啡噻嗪基-(10)-酰基衍生物、N'-对甲苯磺酰基胺酰基衍生物、N'-苯基胺基硫酰基衍生物、N-苯甲酰基苯基丙胺酰基衍生物、N-乙酰基蛋胺酸衍生物、4,5-二苯基-3-恶唑啉-2-酮、N-邻苯二甲酰亚胺、N-二硫杂丁二酰亚胺(Dts)、N-2,3-二苯基顺丁烯二酰亚胺、N-2,5-二甲基吡咯、N-1,1,4,4-四甲基二硅烷基氮杂环戊烷加合物(STABASE)、5-取代1,3-二甲基-1,3,5-三氮杂环己-2-酮、5-取代1,3-二苄基-1,3,5-三氮杂环己-2-酮、1-取代3,5-二硝基-4-吡啶酮、N-甲胺、N-烯丙胺、N-[2-(三甲基硅烷基)乙氧基]甲胺(SEM)、N-3-乙酰氧基丙胺、N-(1-异丙基-4-硝基-2-侧氧基-3-吡咯啉-3-基)胺、四级铵盐、N-苄胺、N-二(4-甲氧苯基)甲胺、N-5-二苯并环庚胺、N-三苯基甲胺(Tr)、N-[(4-甲氧苯基)二苯基甲基]胺(MMTr)、N-9-苯基茀基胺(PhF)、N-2,7-二氯-9-茀基亚甲基胺、N-二茂铁基甲基胺基(Fcm)、N-2-吡啶甲基胺基N'-氧化物、N-1,1-二甲基硫亚甲基胺、N-亚苄基胺、N-对甲氧基亚苄基胺、N-二苯基亚甲基胺、N-[(2-吡啶基)2,4,6-三甲苯基]亚甲基胺、N-(N',N'-二甲基胺基亚甲基)胺、N,N'-异亚丙基二胺、N-对硝基亚苄基胺、N-亚柳基胺、N-5-氯亚柳基胺、N-(5-氯-2-羟苯基)苯基亚甲基胺、N-亚环己基胺、N-(5,5-二甲基-3-侧氧基-1-环己烯基)胺、N-硼烷衍生物、N-二苯基硼酸衍生物、N-[苯基(五酰基铬-或钨)酰基]胺、N-铜螯合剂、N-锌螯合剂、N-硝基胺、N-亚硝基胺、N-氧化胺、二苯基膦酰胺(Dpp)、二甲基硫膦酰胺(Mpt)、二苯基硫膦酰胺(Ppt)、胺基磷酸二烷酯、胺基磷酸二苄酯、胺基磷酸二苯酯、苯亚磺酰胺、邻硝基苯亚磺酰胺(Nps)、2,4-二硝基苯亚磺酰胺、五氯苯亚磺酰胺、2-硝基-4-甲氧基苯亚磺酰胺、三苯基甲基亚磺酰胺及3-硝基吡啶亚磺酰胺(Npys)。
在某些实施例中,存在于氧原子上的取代基为氧保护基(在本文中亦称为「羟基保护基」)。氧保护基包括(但不限于)-Raa、-N(Rbb)2、-C(=O)SRaa、-C(=O)Raa、-CO2Raa、-C(=O)N(Rbb)2、-C(=NRbb)Raa、-C(=NRbb)ORaa、-C(=NRbb)N(Rbb)2、-S(=O)Raa、-SO2Raa、-Si(Raa)3、-P(Rcc)2、-P(Rcc)3、-P(=O)2Raa、-P(=O)(Raa)2、-P(=O)(ORcc)2、-P(=O)2N(Rbb)2及-P(=O)(NRbb)2,其中Raa、Rbb及Rcc如本文所定义。氧保护基包括详细地描述于以引用的方式并入本文中的Protecting Groups in Organic Synthesis,T.W.Greene及P.G.M.Wuts,第3版,John Wiley&Sons,1999中的彼等氧保护基。
例示性氧保护基包括(但不限于)甲基、甲氧基甲基(MOM)、甲硫甲基(MTM)、第三丁基硫甲基、(苯基二甲基硅烷基)甲氧基甲基(SMOM)、苄氧基甲基(BOM)、对甲氧基苄氧基甲基(PMBM)、(4-甲氧基苯氧基)甲基(对AOM)、愈创木酚甲基(GUM)、第三丁氧基甲基、4-戊烯氧基甲基(POM)、硅烷氧基甲基、2-甲氧基乙氧基甲基(MEM)、2,2,2-三氯乙氧基甲基、双(2-氯乙氧基)甲基、2-(三甲基硅烷基)乙氧基甲基(SEMOR)、四氢哌喃基(THP)、3-溴四氢哌喃基、四氢硫哌喃基、1-甲氧基环己基、4-甲氧基四氢哌喃基(MTHP)、4-甲氧基四氢硫哌喃基、4-甲氧基四氢硫哌喃基S,S-二氧化物、1-[(2-氯-4-甲基)苯基]-4-甲氧基哌啶-4-基(CTMP)、1,4-二恶烷-2-基、四氢呋喃基、四氢噻吩基、2,3,3a,4,5,6,7,7a-八氢-7,8,8-三甲基-4,7-甲醇苯并呋喃-2-基、1-乙氧基乙基、1-(2-氯乙氧基)乙基、1-甲基-1-甲氧基乙基、1-甲基-1-苄氧基乙基、1-甲基-1-苄氧基-2-氟乙基、2,2,2-三氯乙基、2-三甲基硅烷基乙基、2-(苯基氧硒基)乙基、第三丁基、烯丙基、对氯苯基、对甲氧苯基、2,4-二硝基苯基、苄基(Bn)、对甲氧基苄基、3,4-二甲氧基苄基、邻硝基苄基、对硝基苄基、对卤基苄基、2,6-二氯苄基、对氰苄基、对苯基苄基、2-吡啶甲基、4-吡啶甲基、3-甲基-2-吡啶甲基N-氧离子基、二苯基甲基、p,p'-二硝基二苯甲基、5-二苯并环庚基、三苯基甲基、α-萘基二苯基甲基、对甲氧苯基二苯基甲基、二(对甲氧苯基)苯基甲基、三(对甲氧苯基)甲基、4-(4'-溴苯甲酰氧基苯基)二苯基甲基、4,4',4”-参(4,5-二氯苯二甲酰亚胺基苯基)甲基、4,4',4”-参(菊芋醣基氧基苯基)甲基、4,4',4”-参(苯甲酰氧基苯基)甲基、3-(咪唑-1-基)双(4',4”-二甲氧苯基)甲基、1,1-双(4-甲氧苯基)-1'-芘基甲基、9-蒽基、9-(9-苯基)基、9-(9-苯基-10-侧氧基)蒽基、1,3-苯并二硫杂环戊烷-2-基、苯并异噻唑基S,S-二氧离子基、三甲基硅烷基(TMS)、三乙基硅烷基(TES)、三异丙基硅烷基(TIPS)、二甲基异丙基硅烷基(IPDMS)、二乙基异丙基硅烷基(DEIPS)、二甲基第三己基硅烷基、第三丁基二甲基硅烷基(TBDMS)、第三丁基二苯基硅烷基(TBDPS)、三苯甲基硅烷基、三-对二甲苯基硅烷基、三苯基硅烷基、二苯基甲基硅烷基(DPMS)、第三丁基甲氧苯基硅烷基(TBMPS)、甲酸酯、苯甲酰基甲酸酯、乙酸酯、氯乙酸酯、二氯乙酸酯、三氯乙酸酯、三氟乙酸酯、甲氧基乙酸酯、三苯基甲氧基乙酸酯、苯氧基乙酸酯、对氯苯氧基乙酸酯、3-苯基丙酸酯、4-侧氧基戊酸酯(乙酰丙酸酯)、4,4-(伸乙基二硫)戊酸酯(乙酰丙酰基二硫缩醛)、特戊酸酯、金刚酸酯、巴豆酸酯、4-甲氧基巴豆酸酯、苯甲酸酯、苯甲酸对苯酯、苯甲酸2,4,6-三甲酯(2,4,6-三甲苯酯)、碳酸甲酯、碳酸9-茀基甲酯(Fmoc)、碳酸乙酯、碳酸2,2,2-三氯乙酯(Troc)、碳酸2-(三甲基硅烷基)乙酯(TMSEC)、碳酸2-(苯磺酰基)乙酯(Psec)、碳酸2-(三苯基磷鎓基)乙酯(Peoc)、碳酸异丁酯、碳酸乙烯酯、碳酸烯丙酯、碳酸第三丁酯(BOC)、碳酸对硝基苯酯、碳酸苄酯、碳酸对甲氧基苄酯、碳酸3,4-二甲氧基苄酯、碳酸邻硝基苄酯、碳酸对硝基苄酯、硫代碳酸S-苄酯、碳酸4-乙氧基-1-萘酯、二硫代碳酸甲酯、2-碘苯甲酸酯、4-迭氮基丁酸酯、4-硝基-4-甲基戊酸酯、邻(二溴甲基)苯甲酸酯、2-甲酰基苯磺酸酯、2-(甲基硫甲氧基)乙基、4-(甲基硫甲氧基)丁酸酯、2-(甲基硫甲氧基甲基)苯甲酸酯、2,6-二氯-4-甲基苯氧基乙酸酯、2,6-二氯-4-(1,1,3,3-四甲基丁基)苯氧基乙酸酯、2,4-双(1,1-二甲基丙基)苯氧基乙酸酯、氯二苯基乙酸酯、异丁酸酯、单丁二酸酯、(E)-2-甲基-2-丁烯酸酯、邻(甲氧基酰基)苯甲酸酯、α-萘甲酸酯、硝酸酯、N,N,N',N'-四甲基磷二酰胺酸烷酯、N-苯基胺基甲酸烷酯、硼酸酯、二甲基膦基亚硫酰基、2,4-二硝苯基亚磺酸烷酯、硫酸酯、甲烷磺酸酯(甲磺酸酯)、苯甲基磺酸酯及甲苯磺酸酯(Ts)。
在某些实施例中,存在于硫原子上的取代基为硫保护基(亦称为「硫醇保护基」)。硫保护基包括(但不限于)-Raa、-N(Rbb)2、-C(=O)SRaa、-C(=O)Raa、-CO2Raa、-C(=O)N(Rbb)2、-C(=NRbb)Raa、-C(=NRbb)ORaa、-C(=NRbb)N(Rbb)2、-S(=O)Raa、-SO2Raa、-Si(Raa)3、-P(Rcc)2、-P(Rcc)3、-P(=O)2Raa、-P(=O)(Raa)2、-P(=O)(ORcc)2、-P(=O)2N(Rbb)2及-P(=O)(NRbb)2,其中Raa、Rbb及Rcc如本文所定义。硫保护基包括详细地描述于以引用的方式并入本文中的Protecting Groups in Organic Synthesis,T.W.Greene及P.G.M.Wuts,第3版,John Wiley&Sons,1999中的彼等硫保护基。
如本文所用,当两个实体彼此「共轭」或「接合」时,其通过直接或间接共价或非共价相互作用连接。在某些实施例中,缔合为共价的。在其他实施例中,缔合为非共价的。非共价相互作用包括氢键结、凡得瓦尔力(van der Waals)相互作用、疏水性相互作用、磁力相互作用、静电相互作用等。在某些实施例中,两个实体视情况经由连接基团共价连接。
如本文所用,术语「盐」是指任何及所有盐,包括医药学上可接受的盐,其是指在合理医学判断范围内、适合用于与人类及低级动物的组织接触而无异常毒性、刺激、过敏反应及其类似者且与合理的效益/风险比相匹配的彼等盐(参见Berge等人在J.Pharmaceutical Sciences(1977)66:1-19中详细地描述医药学上可接受的盐)。医药学上可接受的无毒酸式盐的实例为胺基与诸如盐酸、氢溴酸、磷酸、硫酸及高氯酸的无机酸或与诸如乙酸、草酸、顺丁烯二酸、酒石酸、柠檬酸、丁二酸或丙二酸的有机酸形成的盐;或通过使用此项技术中所用的诸如离子交换的其他方法形成的盐。其他医药学上可接受的盐包括己二酸盐、海藻酸盐、抗坏血酸盐、天冬胺酸盐、苯磺酸盐、苯甲酸盐、硫酸氢盐、硼酸盐、丁酸盐、樟脑酸盐、樟脑磺酸盐、柠檬酸盐、环戊烷丙酸盐、二葡糖酸盐、十二烷基硫酸盐、乙烷磺酸盐、甲酸盐、反丁烯二酸盐、葡庚糖酸盐、甘油磷酸盐、葡糖酸盐、半硫酸盐、庚酸盐、己酸盐、氢碘酸盐、2-羟基-乙烷磺酸盐、乳糖酸盐、乳酸盐、月桂酸盐、月桂基硫酸盐、苹果酸盐、顺丁烯二酸盐、丙二酸盐、甲烷磺酸盐、2-萘磺酸盐、烟碱酸盐、硝酸盐、油酸盐、草酸盐、棕榈酸盐、双羟萘酸盐、果胶酸盐、过硫酸盐、3-苯基丙酸盐、磷酸盐、苦味酸盐、特戊酸盐、丙酸盐、硬脂酸盐、丁二酸盐、硫酸盐、酒石酸盐、硫氰酸盐、对甲苯磺酸盐、十一烷酸盐、戊酸盐及其类似盐。衍生自适当碱的医药学上可接受的盐包括碱金属、碱土金属、铵及N+(C1-4烷基)4盐。代表性碱金属或碱土金属盐包括钠、锂、钾、钙、镁及其类似盐。在适当时,其他医药学上可接受的盐包括使用诸如卤离子、氢氧根、羧酸根、硫酸根、磷酸根、硝酸根、低碳烷基磺酸根及芳基磺酸根的相对离子形成的无毒铵、四级铵及胺阳离子。
所投与的「个体」预期包括(但不限于)人类(亦即,任何年龄组的男性或女性,例如儿科个体(例如,婴儿、儿童、青少年)或成人个体(例如,年轻人、中年人或老年人))及/或其他非人类动物,例如哺乳动物(例如,灵长类动物(例如,食蟹猕猴、恒河猴);商业相关的哺乳动物,诸如牛、猪、马、羊、山羊、猫及/或狗)及鸟类(例如,商业相关的鸟类,诸如鸡、鸭、鹅及/或火鸡)。在某些实施例中,动物为哺乳动物。动物可为雄性或雌性且处于任何发育阶段。非人类动物可为转基因动物。
如本文所用,术语「病状」、「疾病」及「病症」可互换使用。
如本文所用,「抑制(inhibition/inhibiting/inhibit)」及「抑制剂」及其类似者是指化合物减少、减缓、停止或阻止特定生物过程的活性的能力。
如本文所用,本发明术语「细胞」意谓涵盖任何属或种类的真核及原核细胞,其中哺乳动物细胞备受关注。「细胞」亦意谓涵盖正常细胞及患病细胞(例如癌细胞)。在某些实施例中,本文所描述的细胞为活细胞。
如本文所用,术语「样品」包括任何化学样品或生物样品。化学样品是指任何化学混合物或化合物。生物样品包括(但不限于)细胞培养物或其萃取物;自动物(例如哺乳动物)获得的活检材料或其提取物;及血液、唾液、尿液、粪便、精液、泪液或其他体液或其提取物。举例而言,术语「生物样品」是指自任何活生物体获得、由其排泄或分泌的任何固体或流体样品,活生物体包括单细胞微生物(诸如细菌及酵母)及多细胞生物体(诸如植物及动物,例如脊椎动物或哺乳动物,且特定言之健康或明显健康的人类个体或受待诊断或研究的病状或疾病影响的人类患者)。生物样品可呈任何形式,包括固体材料,诸如组织、细胞、细胞集结粒、细胞提取物、细胞匀浆或细胞部份;或活检体,或生物流体。生物流体可自任何部位(例如血液、唾液(或含有颊内细胞的口腔洗液)、泪液、血浆、血清、尿液、胆液、脑脊髓液、羊膜液、腹膜液及胸膜液,或来自其的细胞,水状液或玻璃状液,或任何身体分泌物)、渗出液、分泌液(例如自脓肿或感染或炎症的任何其他部位获得的流体)或自关节(例如正常关节或受诸如类风湿性关节炎、骨关节炎、痛风性或败血性关节炎的疾病影响的关节)获得的流体获得。生物样品可自任何器官或组织(包括活检或尸检标本)获得或可包含细胞(无论主要细胞或培养细胞)或经任何细胞、组织或器官调节的培养基。生物样品亦可包括组织切片,诸如出于组织学目的采集的冷冻切片。生物样品亦包括通过部分或完全分馏细胞或组织匀浆而产生的包括蛋白质、脂质、碳水化合物及核酸的生物分子的混合物。虽然样品优选取自人类个体,但生物样品可来自任何动物、植物、细菌、病毒、酵母等。如本文所用,术语动物是指处于任何发育阶段的人类以及非人类动物,包括例如哺乳动物、鸟类、爬行动物、两栖动物、鱼、蠕虫及单细胞。细胞培养物及活组织样品被视为动物中的多数。在某些例示性实施例中,非人类动物为哺乳动物(例如,啮齿动物、小鼠、大鼠、兔、猴、狗、猫、绵羊、牛、灵长类动物或猪)。动物可为转基因动物或人类纯系。若需要,生物样品可经受初步处理,包括初步分离技术。
术语「生理条件」意谓涵盖与活细胞兼容的彼等条件,例如,与活细胞兼容的温度、pH、盐度等的主要水性条件。
本发明是基于新颖系列的反应性标记化合物的设计及化学合成。化合物可为含有与细胞环境切合的发射绿色BODIPY架构的迭氮基-BODIPY化合物。BODIPY架构用作其有吸引力的合成及荧光特征的起始模块。BODIPY易于在8-位置处修饰。此位置处的芳基化对吸收及发射波长不具有实质性影响,因为芳基部分及BODIPY核心扭转且共轭非偶合。
本文所描述的为在催化剂存在下经历与含炔分子的迭氮化物-炔环加成(AAC)以形成展现增强的荧光的三唑基产物以便于侦测分子的迭氮基-BODIPY化合物。迭氮基-BODIPY化合物表示在无冲洗过程的情况下细胞成像的进步且适用于在SDS-PAGE之后自细胞溶解物进行炔标志醣蛋白的直接凝胶内侦测。
反应性标记化合物亦可为基于环辛炔的荧光探针。基于环辛炔的荧光探针可进一步包含与香豆素部分相关的环辛炔。此外,本文所描述的为在催化剂存在下经历与含迭氮化物分子的迭氮化物-炔环加成(AAC)以形成展现增强的荧光的三唑基产物以便于侦测分子的基于环辛炔的荧光探针化合物。
本文所描述的为使用迭氮基-BODIPY及基于环辛炔的荧光探针用于对活细胞中的含迭氮基醣共轭物及含炔基醣共轭物进行成像的方法。
本文所描述的为化合物及使用这些化合物共轭至酶活性位点的方法。在一些实施例中,酶为唾液酸酶。在一些实施例中,化合物为含炔基化合物。在一些实施例中,化合物与唾液酸酶的活性位点形成共价键。
迭氮基-BODIPY化合物
迭氮基-BOBIPY化合物为式(I):
或其医药学上可接受的盐、溶剂合物或水合物,且其中:
G1、G2、G3、G5、G6、G7及G8在各种情况下独立地为氢、视情况经取代的C1-6烷基、视情况经取代的C1-6烯基、视情况经取代的C1-6炔基、视情况经取代的芳基、视情况经取代的酰基、-ORA、-CH2ORA、-OC(O)RA、-SRA、-N(RB)2、-N(RA)C(O)RA、-C(O)N(RB)2、-CN、-NO2、-C(O)RA、-C(O)ORA、-S(O)RA、-SO2RA、-SO3RA、-SO2N(RB)2及-NHSO2RB;
R在各种情况下独立地选自氢、卤素、视情况经取代的烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基、视情况经取代的酰基、-ORA、-CH2ORA、-OC(O)RA、-SRA、-N(RB)2、-N(RA)C(O)RA、-C(O)N(RB)2、-CN、-NO2、-C(O)RA、-C(O)ORA、-S(O)RA、-SO2RA、-SO3RA、-SO2N(RB)2及-NHSO2RB;
各RA独立地选自氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基及视情况经取代的芳基;及
各RB独立地选自氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基及视情况经取代的芳基,或两个RB与中间的氮结合在一起形成杂环。
G4a及G4b在各种情况下为氟基、烷基、烷氧基、芳氧基或炔基,及
其中烷基及烷氧基为非分支链、饱和的且具有1-4个碳原子;芳基及芳氧基的芳基可为碳环芳基或杂环芳基;碳环芳基具有总共6-20个碳原子,包括取代基的碳原子;杂环芳基具有总共5-20个碳原子,包括取代基的碳原子;烷氧羰基为羧酸的烷基酯,其中烷基如上文所定义;各烷基、芳基、烷氧基、芳氧基、苯并及烷氧羰基独立地可不经取代或经一或多个取代基取代;烷基取代基为卤基、羟基、胺基或芳基;芳基取代基为卤基、羟基、胺基、烷基、芳基、硝基或羧基;及卤基取代基为氟基或氯基;
n为0、1、2、3或4。
如本文一般所定义,G1独立地选自氢、卤素、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基、视情况经取代的杂芳基、-ORA、-CH2ORA、-OC(O)RC、-SRA、-N(RB)2、-N(RA)C(O)RC、-C(O)N(RB)2、-CN、-NO2、-C(O)RC、-C(O)ORA、-S(O)RC、-SO2RA、-SO2N(RB)2、=O、=NOH、=N-ORA、=N-NH2、=N-NHRA、=N-N(RB)2及-NHSO2RA。在某些实施例中,G1为H。在某些实施例中,G1为卤素。在某些实施例中,G1为视情况经取代的C1-C6烷基。在某些实施例中,G1为甲基、乙基或正丙基。在某些实施例中,G1为-ORA,其中RA独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基、视情况经取代的杂芳基或氧保护基(当附接至氧时)或硫保护基(当附接至硫时)。在某些实施例中,G1为-OH。在某些实施例中,G1为-ORA,其中RA为视情况经取代的C1-C6烷基。在某些实施例中,G1为-OCH3或-OC2H5。在某些实施例中,G1为-ORA,其中RA为氧保护基。在某些实施例中,G1为-N(RB)2,其中RB在各种情况下独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基及视情况经取代的芳基或氮保护基,或两个RB与中间的氮结合在一起形成杂环。在某些实施例中,G1为NH2。在某些实施例中,G1为NHRB,其中RB为视情况经取代的C1-C6烷基。在某些实施例中,G1为NHCH3或NHC2H5。在某些实施例中,G1为NHRB,其中RB为氮保护基。
如本文一般所定义,G2独立地选自氢、卤素、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基、视情况经取代的杂芳基、-ORA、-CH2ORA、-OC(O)RC、-SRA、-N(RB)2、-N(RA)C(O)RC、-C(O)N(RB)2、-CN、-NO2、-C(O)RC、-C(O)ORA、-S(O)RC、-SO2RA、-SO2N(RB)2、=O、=NOH、=N-ORA、=N-NH2、=N-NHRA、=N-N(RB)2及-NHSO2RA。在某些实施例中,G2为H。在某些实施例中,G2为卤素。在某些实施例中,G2为视情况经取代的C1-C6烷基。在某些实施例中,G2为甲基、乙基或正丙基。在某些实施例中,G7为-ORA,其中RA独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基或氧保护基(当附接至氧时)或硫保护基(当附接至硫时)。在某些实施例中,G2为-OH。在某些实施例中,G2为-ORA,其中RA为视情况经取代的C1-C6烷基。在某些实施例中,G2为-OCH3或-OC2H5。在某些实施例中,G2为-ORA,其中RA为氧保护基。在某些实施例中,G2为-N(RB)2,其中RB在各种情况下独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基及视情况经取代的芳基或氮保护基,或两个RB与中间的氮结合在一起形成杂环。在某些实施例中,G2为NH2。在某些实施例中,G2为NHRB,其中RB为视情况经取代的C1-C6烷基。在某些实施例中,G2为NHCH3或NHC2H5。在某些实施例中,G2为NHRB,其中RB为氮保护基。
如本文一般所定义,G3独立地选自氢、卤素、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基、视情况经取代的杂芳基、-ORA、-CH2ORA、-OC(O)RC、-SRA、-N(RB)2、-N(RA)C(O)RC、-C(O)N(RB)2、-CN、-NO2、-C(O)RC、-C(O)ORA、-S(O)RC、-SO2RA、-SO2N(RB)2、=O、=NOH、=N-ORA、=N-NH2、=N-NHRA、=N-N(RB)2及-NHSO2RA。在某些实施例中,G3为H。在某些实施例中,G3为卤素。在某些实施例中,G3为视情况经取代的C1-C6烷基。在某些实施例中,G3为甲基、乙基或正丙基。在某些实施例中,G7为-ORA,其中RA独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基或氧保护基(当附接至氧时)或硫保护基(当附接至硫时)。在某些实施例中,G3为-OH。在某些实施例中,G3为-ORA,其中RA为视情况经取代的C1-C6烷基。在某些实施例中,G3为-OCH3或-OC2H5。在某些实施例中,G3为-ORA,其中RA为氧保护基。在某些实施例中,G3为-N(RB)2,其中RB在各种情况下独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基及视情况经取代的芳基或氮保护基,或两个RB与中间的氮结合在一起形成杂环。在某些实施例中,G3为NH2。在某些实施例中,G3为NHRB,其中RB为视情况经取代的C1-C6烷基。在某些实施例中,G3为NHCH3或NHC2H5。在某些实施例中,G3为NHRB,其中RB为氮保护基。
如本文一般所定义,G5独立地选自氢、卤素、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基、视情况经取代的杂芳基、-ORA、-CH2ORA、-OC(O)RC、-SRA、-N(RB)2、-N(RA)C(O)RC、-C(O)N(RB)2、-CN、-NO2、-C(O)RC、-C(O)ORA、-S(O)RC、-SO2RA、-SO2N(RB)2、=O、=NOH、=N-ORA、=N-NH2、=N-NHRA、=N-N(RB)2及-NHSO2RA。在某些实施例中,G5为H。在某些实施例中,G5为卤素。在某些实施例中,G5为视情况经取代的C1-C6烷基。在某些实施例中。G5为甲基、乙基或正丙基。在某些实施例中,G5为-ORA,其中RA独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基或氧保护基(当附接至氧时)或硫保护基(当附接至硫时)。在某些实施例中,G5为-OH。在某些实施例中,G5为-ORA,其中RA为视情况经取代的C1-C6烷基。在某些实施例中,G5为-OCH3或-OC2H5。在某些实施例中,G5为-ORA,其中RA为氧保护基。在某些实施例中,G5为-N(RB)2,其中RB在各种情况下独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基及视情况经取代的芳基或氮保护基,或两个RB与中间的氮结合在一起形成杂环。在某些实施例中,G5为NH2。在某些实施例中,G5为NHRB,其中RB为视情况经取代的C1-C6烷基。在某些实施例中,G5为NHCH3或NHC2H5。在某些实施例中,G5为NHRB,其中RB为氮保护基。
如本文一般所定义,G6独立地选自氢、卤素、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基、视情况经取代的杂芳基、-ORA、-CH2ORA、-OC(O)RC、-SRA、-N(RB)2、-N(RA)C(O)RC、-C(O)N(RB)2、-CN、-NO2、-C(O)RC、-C(O)ORA、-S(O)RC、-SO2RA、-SO2N(RB)2、=O、=NOH、=N-ORA、=N-NH2、=N-NHRA、=N-N(RB)2及-NHSO2RA。在某些实施例中,G6为H。在某些实施例中,G6为卤素。在某些实施例中,G6为视情况经取代的C1-C6烷基。在某些实施例中,G6为甲基、乙基或正丙基。在某些实施例中,G6为-ORA,其中RA独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基或氧保护基(当附接至氧时)或硫保护基(当附接至硫时)。在某些实施例中,G6为-OH。在某些实施例中,G6为-ORA,其中RA为视情况经取代的C1-C6烷基。在某些实施例中,G6为-OCH3或-OC2H5。在某些实施例中,G6为-ORA,其中RA为氧保护基。在某些实施例中,G6为-N(RB)2,其中RB在各种情况下独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基及视情况经取代的芳基或氮保护基,或两个RB与中间的氮结合在一起形成杂环。在某些实施例中,G6为NH2。在某些实施例中,G6为NHRB,其中RB为视情况经取代的C1-C6烷基。在某些实施例中,G6为NHCH3或NHC2H5。在某些实施例中,G6为NHRB,其中RB为氮保护基。
如本文一般所定义,G7独立地选自氢、卤素、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基、视情况经取代的杂芳基、-ORA、-CH2ORA、-OC(O)RC、-SRA、-N(RB)2、-N(RA)C(O)RC、-C(O)N(RB)2、-CN、-NO2、-C(O)RC、-C(O)ORA、-S(O)RC、-SO2RA、-SO2N(RB)2、=O、=NOH、=N-ORA、=N-NH2、=N-NHRA、=N-N(RB)2及-NHSO2RA。在某些实施例中,G7为H。在某些实施例中,G7为卤素。在某些实施例中,G7为视情况经取代的C1-C6烷基。在某些实施例中,G7为甲基、乙基或正丙基。在某些实施例中,G7为-ORA,其中RA独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基或氧保护基(当附接至氧时)或硫保护基(当附接至硫时)。在某些实施例中,G7为-OH。在某些实施例中,G7为-ORA,其中RA为视情况经取代的C1-C6烷基。在某些实施例中,G7为-OCH3或-OC2H5。在某些实施例中,G7为-ORA,其中RA为氧保护基。在某些实施例中,G7为-N(RB)2,其中RB在各种情况下独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基及视情况经取代的芳基或氮保护基,或两个RB与中间的氮结合在一起形成杂环。在某些实施例中,G7为NH2。在某些实施例中,G7为NHRB,其中RB为视情况经取代的C1-C6烷基。在某些实施例中,G7为NHCH3或NHC2H5。在某些实施例中,G7为NHRB,其中RB为氮保护基。
如本文一般所定义,G8独立地选自氢、卤素、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基、视情况经取代的杂芳基、-ORA、-CH2ORA、-OC(O)RC、-SRA、-N(RB)2、-N(RA)C(O)RC、-C(O)N(RB)2、-CN、-NO2、-C(O)RC、-C(O)ORA、-S(O)RC、-SO2RA、-SO2N(RB)2、=O、=NOH、=N-ORA、=N-NH2、=N-NHRA、=N-N(RB)2及-NHSO2RA。在某些实施例中,G8为H。在某些实施例中,G8为卤素。在某些实施例中,G8为视情况经取代的C1-C6烷基。在某些实施例中,G8为甲基、乙基或正丙基。在某些实施例中,G8为-ORA,其中RA独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基或氧保护基(当附接至氧时)或硫保护基(当附接至硫时)。在某些实施例中,G8为-OH。在某些实施例中,G8为-ORA,其中RA为视情况经取代的C1-C6烷基。在某些实施例中,G8为-OCH3或-OC2H5。在某些实施例中,G8为-ORA,其中RA为氧保护基。在某些实施例中,G8为-N(RB)2,其中RB在各种情况下独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基及视情况经取代的芳基或氮保护基,或两个RB与中间的氮结合在一起形成杂环。在某些实施例中,G8为NH2。在某些实施例中,G8为NHRB,其中RB为视情况经取代的C1-C6烷基。在某些实施例中,G8为NHCH3或NHC2H5。在某些实施例中,G8为NHRB,其中RB为氮保护基。
在某些实施例中,彼此相邻的两个G8基团与其中间的原子结合在一起以形成视情况经取代的碳环或杂环。在某些实施例中,彼此相邻的两个G8基团与其中间的原子结合在一起以形成视情况经取代的碳环。在某些实施例中,彼此相邻的两个G8基团与其中间的原子结合在一起以形成视情况经取代的5员碳环。在某些实施例中,彼此相邻的两个G8基团与其中间的原子结合在一起以形成视情况经取代的6员碳环。在某些实施例中,彼此相邻的两个G8基团与其中间的原子结合在一起以形成视情况经取代的苯基。在某些实施例中,彼此相邻的两个G8基团与其中间的原子结合在一起以形成未经取代的苯基。在某些实施例中,彼此相邻的两个G8基团与其中间的原子结合在一起以形成视情况经取代的杂环。在某些实施例中,彼此相邻的两个G8基团与其中间的原子结合在一起以形成具有S、N或O的一个杂原子的视情况经取代的5员杂环。在某些实施例中,彼此相邻的两个G8基团与其中间的原子结合在一起以形成具有各独立地选自S、N及O的群的两个杂原子的视情况经取代的5员杂环。在某些实施例中,彼此相邻的两个G8基团与其中间的原子结合在一起以形成具有S、N或O的一个杂原子的视情况经取代的6员碳环。在某些实施例中,彼此相邻的两个G8基团与其中间的原子结合在一起以形成具有各独立地选自由S、N及O组成的群的两个杂原子的视情况经取代的6员碳环。
在一些实施例中,G1、G3、G5及G7中的至少两者为C1-C6烷基。在某些实施例中,G1、G3、G5及G7中的至少两者为甲基、乙基或正丙基。在一些实施例中,G1、G3、G5及G7中的每一者为C1-C6烷基。在某些实施例中,G1、G3、G5及G7中的每一者为甲基、乙基或正丙基。在某些实施例中,G1、G3、G5及G7中的每一者为甲基。在某些实施例中,本发明涉及一种式(II)化合物:
或其医药学上可接受的盐、溶剂合物或水合物,其中G2、G4a、G4b、G6、G8及n如本文所描述。
在某些实施例中,具有式:
如本文所用,R8在各种情况下独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的杂环基、视情况经取代的芳基、视情况经取代的杂芳基或氧保护基。在某些实施例中,R8为氢。在某些实施例中,R8为视情况经取代的C1-C6烷基。在某些实施例中,R8为甲基或乙基。在某些实施例中,R8为氧保护基。
在某些实施例中,具有式:
如本文所用,R9在各种情况下独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的杂环基、视情况经取代的芳基、视情况经取代的杂芳基或氧保护基(在附接至氧时)。在某些实施例中,R9为氢。在某些实施例中,R9为视情况经取代的C1-C6烷基。在某些实施例中,R9为甲基或乙基。在某些实施例中,R9为氧保护基。
G4a及G4b在各种情况下为氟基、烷基、烷氧基、芳氧基或炔基,
在某些实施例中,取代基可有助于化合物的光学异构及/或立体异构。亦关注化合物的盐、溶剂合物、水合物及前药形式。本发明涵盖所有此类形式。因此,本文所描述的化合物包括其盐、溶剂合物、水合物、前药及异构体形式,包括其医药学上可接受的盐、溶剂合物、水合物、前药及异构体。在某些实施例中,化合物可代谢成医药学上活性衍生物。
例示性式(I)及式(II)的化合物展示于表1中:
表1例示性式(I)及式(II)的化合物。
例示性迭氮基-BODIPY化合物用于侦测炔化合物,包括炔基随附的生物分子。在与炔化合物的AAC反应的后,三唑环的形成释放荧光淬灭,且导致荧光增强现象。化合物T2及T9-T11为经历与迭氮化物的AAC以得到荧光三唑产物的所述种类型的探针的实例。
含炔分子
本发明中所描述的含炔分子具有式:
例示性含炔靶分子包括(但不限于)氨基酸及氨基酸残基、多肽(包括肽及蛋白质)、糖或糖残基及其类似者,其含有至少一个炔或经修饰以含有至少一个炔。
例示性靶分子包括(但不限于)生物分子,诸如DNA、RNA、蛋白质或聚醣,且其可为天然存在的,或可以合成方式或以重组方式产生,且可经分离、实质上经纯化,或存在于含炔靶分子所基于的未修饰分子的原生环境内(例如,在细胞表面上或在细胞内,包括在宿主动物,例如哺乳动物(诸如鼠科宿主(例如大鼠、小鼠)、仓鼠、犬、猫、牛、猪及其类似动物)内)。在一些实施例中,靶分子在无细胞反应中存在于活体外。在其他实施例中,靶分子存在于细胞中及/或展示在细胞表面上。在许多所关注的实施例中,靶分子在活细胞中;在活细胞表面上;在活生物体中,例如在活的多细胞生物体中。适合活细胞包括为活的多细胞生物体的一部分的细胞;自多细胞生物体分离的细胞;永生化细胞株;及其类似细胞。
当靶分子为多肽时,多肽可由D-氨基酸、L-氨基酸或二者组成,且可进一步以天然、合成或重组方式修饰以包括其他部分。举例而言,多肽可为脂蛋白、醣蛋白或其他此类经修饰的蛋白质。
一般而言,有用的靶分子包含至少一个炔用于与根据本发明的修饰迭氮基-BODIPY反应,但可包含2个或2个以上、3个或3个以上、5个或5个以上、10个或10个以上的炔。可存在于适合靶分子中的炔数目将根据反应的最终产物的吾人所欲应用、靶分子自身的性质及对通常熟习实施如本文所揭示的本发明的技术者而言将易为显而易见的其他考虑因素而变化。
本发明的此实施例特别适用于活体内靶分子修饰。在此实施例中,靶受质经修饰以在需要连接至修饰迭氮基-BODIPY的点处包含炔基。举例而言,当靶受质为多肽时,多肽经修饰以含有N端炔。当靶受质为醣蛋白时,醣蛋白的糖残基可经修饰以含有炔。未经炔修饰但待经炔修饰的靶分子在本文中称为「靶受质」。经修饰具有炔的靶分子在本文中称为「炔修饰的靶分子」或「含炔靶分子」。
靶受质可在活体外产生且接着引入细胞中(例如,经由显微注射、脂质体或脂质体介导的递送、电穿孔等),这些方法将根据待靶向修饰的受质的性质变化且可由通常熟习此项技术者容易且适当地选择。最终靶受质亦可通过采用宿主细胞的天然生物合成机制在活体内产生。举例而言,细胞可具有用于合成所需靶分子的受质的生物兼容性炔衍生物,所述受质经细胞处理以提供所需最终靶受质的炔衍生物。举例而言,当靶受质为细胞表面醣蛋白时,细胞可具有在醣蛋白内发现的糖残基的炔衍生物,所述糖残基随后经由天然生物合成过程经细胞处理以产生具有包含可获得的炔基的至少一个修饰糖部分的修饰醣蛋白。
亦可使用方法在活体内产生靶受质。举例而言,可将具有炔的非天然氨基酸并入在大肠杆菌(E.coli)中表达的重组多肽中(参见,例如Kiick等人(2000)Tetrahedron 56:9487)。此类以重组方式产生的多肽可选择性地与根据本发明的修饰迭氮基-BODIPY反应。
在一个实例中,对于所需生物聚合物靶受质,通过使细胞(例如,使生物聚合物醣基化的真核细胞,诸如蛋白质)具有合成构建块将炔基并入靶分子中。举例而言,细胞可具有包含炔基的糖分子以提供炔基并入醣蛋白中。在一些实施例中,醣蛋白在细胞表面上表达。替代地,炔基可并入氨基酸中,氨基酸随后并入由细胞合成的肽或多肽中。几种方法可用于将非天然构建块并入生物聚合物中;吾人不必限于将细胞表面寡醣作为靶分子。参见,例如vanHest等人(1998)FEBS Lett.428:68;及Nowak等人(1995)Science 268:439。
在一个实施例中,靶分子为含碳水化合物分子(例如醣蛋白;多醣;等),且使用合成受质将炔基引入靶分子中。在一些实施例中,合成受质为用于产生醣基化分子的糖的炔衍生物。在一些实施例中,合成受质为用于例如以醣蛋白生物合成路径产生细胞表面分子的糖的炔衍生物。举例而言,宿主细胞可具有合成唾液酸炔基衍生物,将其并入唾液酸生物合成路径中,最终导致合成糖残基并入醣蛋白中。在一些实施例中,醣蛋白展示于细胞表面上。
在一个实例中,合成受质为以下通式的甘露糖胺的炔基衍生物:
其中n为0至7、一般1至4、更通常1至2,且R1、R2、R3及R4独立地为氢或乙酰基。在一些实施例中,受质为N-3-丁炔酰基甘露糖胺(n=0)或其乙酰化衍生物,或为N-4-戊炔酰基甘露糖胺(n=1)或其乙酰化形式。
在另一实施例中,合成受质为例如以下通式的炔基糖衍生物:
其中任一者可并入唾液酸生物合成路径中,且其中n为1至6、一般1至4、更通常1至2,且R2、R3及R4独立地为氢或乙酰基。
在另一实施例中,合成受质为例如以下通式的炔基糖衍生物:
其中R1、R2、R3及R4独立地为氢或乙酰基,且其中将合成受质并入涉及海藻醣的生物合成路径中。
在另一实施例中,合成受质为例如以下通式的炔基糖衍生物:
其中n为1至6、一般1至4、更通常1至2,且R1、R2、R3及R4独立地为氢或乙酰基,且将其并入涉及半乳醣的生物合成路径中。
在一些实施例中,本发明方法用于修饰细胞的表面。因此,在一个态样中,本发明的特征为一种在活体外或活体内修饰细胞表面的方法。所述方法一般包括使包含炔基的靶分子中的炔基与修饰迭氮基-BODIPY反应以提供在细胞表面处的化学选择性接合。在许多实施例中,所述方法包含在细胞表面上用炔基修饰靶分子;及使靶分子中的炔基与修饰迭氮基-BODIPY反应。举例而言,如以上所描述,向活细胞提供炔基糖,将所述炔基糖并入在细胞表面上展示的醣蛋白中。
本发明修饰迭氮基-BODIPY化合物及本发明修饰方法适用于各种应用,包括研究应用及诊断应用。
在一些实施例中,本发明修饰迭氮基-BODIPY化合物及本发明修饰方法适用于研究应用。所关注的应用包括研究应用,例如探究受体的功能及物理特征;蛋白组学;代谢组学;及其类似应用。研究应用亦包括药物发现或其他筛检应用。
蛋白组学旨在侦测、识别及定量蛋白质以获得生物相关信息。代谢组学为代谢物及其他小分子(诸如脂质及碳水化合物)的侦测、识别及定量。Fiehn(2001)Comparative and Functional Genomics 2:155-168;及美国专利第6,873,914号。
药物发现应用包括(但不限于)识别抑制癌细胞存活力及/或生长的试剂。因此,在一些实施例中,本发明提供识别抑制癌细胞存活力及/或生长的试剂的方法。所述方法一般包括修饰细胞的组分以包含含炔的第一反应性搭配物;使细胞在测试剂存在下与包含修饰迭氮基-BODIPY的第二反应性搭配物接触,所述接触是在生理条件下;其中所述接触导致第一反应性搭配物的炔基与第二反应性搭配物的迭氮基-BODIPY化合物的间的反应,进而以合成方式及共价地修饰细胞组分;及确定测试剂对具有第二反应性搭配物的细胞的修饰程度的影响(若存在)。
其中癌细胞为产生比相同细胞类型的正常(非癌性)细胞更高量的碳水化合物的细胞,所述方法提供识别减少癌细胞生长及/或存活力的试剂。
所关注的应用亦包括诊断应用,例如,侦测癌症;及其类似者,其中包含可侦测标记的本发明修饰环炔用于标记炔修饰靶分子,例如存在于癌细胞上的炔标志靶分子。所关注的应用亦包括治疗应用,其中使用包含共价连接药物或其他治疗剂的本发明修饰迭氮基-BODIPY化合物将药物或其他治疗剂递送至炔修饰靶分子。
本发明的某些实施例用于活体内成像例如来确定生物体(例如个体)中的细胞的代谢或其他状态。作为一个非限制性实例,本发明方法可应用于个体(例如哺乳动物,包括啮齿动物、兔类动物、猫科动物、犬科动物、马科动物、牛科动物、绵羊类动物、山羊类动物、非人类灵长类动物及人类)中的癌细胞的活体内成像。
本发明迭氮化物-炔环加成的一个例示性、非限制性应用为侦测在细胞改变其表型时细胞中发生的代谢变化。作为一个实例,改变的醣基化模式为肿瘤表型的标志,由天然存在的聚醣的不足表达及过度表达以及在胚胎发育期间通常限制表达的聚醣的呈现组成。与转型细胞相关的常见抗原的实例为唾液酸刘易斯(Lewis)a、唾液酸刘易斯x、唾液酸T、唾液酸Tn及聚唾液酸(PSA)。等人(1995)Cancer Res.55,1817-1819;Sell(1990)Hum.Pathology 21,1003-1019;Taki等人(1988)J.Biochem.103,998-1003;Gabius(1988)Angew.Chem.Int.Ed.Engl.27,1267-1276;Feizi(1991)Trends Biochem.Sci.16,84-86;Taylor-Papadimitriou及Epenetos(1994)Trends Biotech.12,227-233;Hakomori及Zhang(1997)Chem.Biol.4,97-104;Dohi等人(1994)Cancer 73,1552。这些抗原共享一个重要特征——其各自含有末端唾液酸。PSA为长度高达50个单位的唾液酸残基的均聚物。唾液酸的较高位准与许多癌症中的转型表型高度相关,癌症包括胃癌(Dohi等人(1994)Cancer 73,1552;及Yamashita等人(1995)J.Natl.Cancer Inst.87,441-446)、结肠癌(Yamashita等人(1995)J.Natl.Cancer Inst.87,441-446;Hanski等人(1995)Cancer Res.55,928-933;Hanski等人(1993)Cancer Res.53,4082-4088;Yang等人(1994)Glycobiology 4,873-884;Saitoh等人(1992)J.Biol.Chem.267,5700-5711)、胰脏癌(Sawada等人(1994)Int.J.Cancer 57,901-907)、肝癌(Sawada等人(1994)J.Biol.Chem.269,1425-1431)、肺癌(Weibel等人(1988)Cancer Res.48,4318-4323)、前列腺癌(等人(1995)Cancer Res.55,1817-1819)、肾癌(Roth等人(1988)Proc.Natl.Acad.Sci.USA 85,2999-3000)及乳癌(Cho等人(1994)Cancer Res.54,6302-6305)以及几种类型的白血病(Joshi等人(1987)Cancer Res.47,3551-3557;Altevogt等人(1983)Cancer Res.43,5138-5144;Okada等人(1994)Cancer 73,1811-1816)。亦已在几种不同肿瘤类型中观测到细胞表面唾液酸的位准与转移潜能之间的强烈相关性(Kakeji等人(1995)Brit.J.Cancer 71,191-195;Takano等人(1994)Glycobiology 4,665-674)。多个唾液酸化抗原在单个癌细胞上的集体展示可解释以下事实:如此多的不同肿瘤类型共享高唾液酸表型而不一定表达相同的抗原补体(前述Roth等人(1988))。因此,基于唾液酸位准靶向细胞的诊断或治疗策略对许多癌症具有广泛适用性。
将非天然炔基糖(ManNAl、GalNAl)引入及并入活动物中提供对代谢状态的变化的侦测。经由附接适当的抗原决定基标志,修饰迭氮基-BODIPY化合物标记活生物体中的这些细胞,且因此侦测代谢状态的变化。致瘤细胞的早期侦测及后续干预降低严重程度且增加癌症患者的存活率。
三唑基-BODIPY化合物
通过使迭氮基-BODIPY化合物与含炔分子经由迭氮化物-炔环加成(AAC)的反应形成三唑基-BODIPY化合物。三唑基-BODIPY化合物与相应迭氮基-BODIPY化合物相比展现增强的荧光。本发明中所描述的三唑基-BODIPY化合物具有式(III):
或其医药学上可接受的盐、溶剂合物或水合物,
其中:
G1、G2、G3、G5、G6、G7及G8在各种情况下独立地为氢、视情况经取代的C1-6烷基、视情况经取代的C1-6烯基、视情况经取代的C1-6炔基、视情况经取代的芳基、视情况经取代的酰基、-ORA、-CH2ORA、-OC(O)RA、-SRA、-N(RB)2、-N(RA)C(O)RA、-C(O)N(RB)2、-CN、-NO2、-C(O)RA、-C(O)ORA、-S(O)RA、-SO2RA、-SO3RA、-SO2N(RB)2及-NHSO2RB;
R在各种情况下独立地选自氢、卤素、视情况经取代的烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基、视情况经取代的酰基、-ORA、-CH2ORA、-OC(O)RA、-SRA、-N(RB)2、-N(RA)C(O)RA、-C(O)N(RB)2、-CN、-NO2、-C(O)RA、-C(O)ORA、-S(O)RA、-SO2RA、-SO3RA、-SO2N(RB)2及-NHSO2RB;
各RA独立地选自氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基及视情况经取代的芳基;及
各RB独立地选自氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基及视情况经取代的芳基,或两个RB与中间的氮结合在一起形成杂环。
G4a及G4b在各种情况下为氟基、烷基、烷氧基、芳氧基或炔基,及
其中烷基及烷氧基为非分支链、饱和的且具有1-4个碳原子;芳基及芳氧基的芳基可为碳环芳基或杂环芳基;碳环芳基具有总共6-20个碳原子,包括取代基的碳原子;杂环芳基具有总共5-20个碳原子,包括取代基的碳原子;烷氧羰基为羧酸的烷基酯,其中烷基如上文所定义;各烷基、芳基、烷氧基、芳氧基、苯并及烷氧羰基独立地可不经取代或经一或多个取代基取代;烷基取代基为卤基、羟基、胺基或芳基;芳基取代基为卤基、羟基、胺基、烷基、芳基、硝基或羧基;及卤基取代基为氟基或氯基;
n为0、1、2、3或4。
如本文一般所定义,G1独立地选自氢、卤素、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基、视情况经取代的杂芳基、-ORA、-CH2ORA、-OC(O)RC、-SRA、-N(RB)2、-N(RA)C(O)RC、-C(O)N(RB)2、-CN、-NO2、-C(O)RC、-C(O)ORA、-S(O)RC、-SO2RA、-SO2N(RB)2、=O、=NOH、=N-ORA、=N-NH2、=N-NHRA、=N-N(RB)2及-NHSO2RA。在某些实施例中,G1为H。在某些实施例中,G1为卤素。在某些实施例中,G1为视情况经取代的C1-C6烷基。在某些实施例中,G1为甲基、乙基或正丙基。在某些实施例中,G1为-ORA,其中RA独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基、视情况经取代的杂芳基或氧保护基(当附接至氧时)或硫保护基(当附接至硫时)。在某些实施例中,G1为-OH。在某些实施例中,G1为-ORA,其中RA为视情况经取代的C1-C6烷基。在某些实施例中,G1为-OCH3或-OC2H5。在某些实施例中,G1为-ORA,其中RA为氧保护基。在某些实施例中,G1为-N(RB)2,其中RB在各种情况下独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基及视情况经取代的芳基或氮保护基,或两个RB与中间的氮结合在一起形成杂环。在某些实施例中,G1为NH2。在某些实施例中,G1为NHRB,其中RB为视情况经取代的C1-C6烷基。在某些实施例中,G1为NHCH3或NHC2H5。在某些实施例中,G1为NHRB,其中RB为氮保护基。
如本文一般所定义,G2独立地选自氢、卤素、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基、视情况经取代的杂芳基、-ORA、-CH2ORA、-OC(O)RC、-SRA、-N(RB)2、-N(RA)C(O)RC、-C(O)N(RB)2、-CN、-NO2、-C(O)RC、-C(O)ORA、-S(O)RC、-SO2RA、-SO2N(RB)2、=O、=NOH、=N-ORA、=N-NH2、=N-NHRA、=N-N(RB)2及-NHSO2RA。在某些实施例中,G2为H。在某些实施例中,G2为卤素。在某些实施例中,G2为视情况经取代的C1-C6烷基。在某些实施例中,G2为甲基、乙基或正丙基。在某些实施例中,G7为-ORA,其中RA独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基或氧保护基(当附接至氧时)或硫保护基(当附接至硫时)。在某些实施例中,G2为-OH。在某些实施例中,G2为-ORA,其中RA为视情况经取代的C1-C6烷基。在某些实施例中,G2为-OCH3或-OC2H5。在某些实施例中,G2为-ORA,其中RA为氧保护基。在某些实施例中,G2为-N(RB)2,其中RB在各种情况下独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基及视情况经取代的芳基或氮保护基,或两个RB与中间的氮结合在一起形成杂环。在某些实施例中,G2为NH2。在某些实施例中,G2为NHRB,其中RB为视情况经取代的C1-C6烷基。在某些实施例中,G2为NHCH3或NHC2H5。在某些实施例中,G2为NHRB,其中RB为氮保护基。
如本文一般所定义,G3独立地选自氢、卤素、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基、视情况经取代的杂芳基、-ORA、-CH2ORA、-OC(O)RC、-SRA、-N(RB)2、-N(RA)C(O)RC、-C(O)N(RB)2、-CN、-NO2、-C(O)RC、-C(O)ORA、-S(O)RC、-SO2RA、-SO2N(RB)2、=O、=NOH、=N-ORA、=N-NH2、=N-NHRA、=N-N(RB)2及-NHSO2RA。在某些实施例中,G3为H。在某些实施例中,G3为卤素。在某些实施例中,G3为视情况经取代的C1-C6烷基。在某些实施例中,G3为甲基、乙基或正丙基。在某些实施例中,G7为-ORA,其中RA独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基或氧保护基(当附接至氧时)或硫保护基(当附接至硫时)。在某些实施例中,G3为-OH。在某些实施例中,G3为-ORA,其中RA为视情况经取代的C1-C6烷基。在某些实施例中,G3为-OCH3或-OC2H5。在某些实施例中,G3为-ORA,其中RA为氧保护基。在某些实施例中,G3为-N(RB)2,其中RB在各种情况下独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基及视情况经取代的芳基或氮保护基,或两个RB与中间的氮结合在一起形成杂环。在某些实施例中,G3为NH2。在某些实施例中,G3为NHRB,其中RB为视情况经取代的C1-C6烷基。在某些实施例中,G3为NHCH3或NHC2H5。在某些实施例中,G3为NHRB,其中RB为氮保护基。
如本文一般所定义,G5独立地选自氢、卤素、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基、视情况经取代的杂芳基、-ORA、-CH2ORA、-OC(O)RC、-SRA、-N(RB)2、-N(RA)C(O)RC、-C(O)N(RB)2、-CN、-NO2、-C(O)RC、-C(O)ORA、-S(O)RC、-SO2RA、-SO2N(RB)2、=O、=NOH、=N-ORA、=N-NH2、=N-NHRA、=N-N(RB)2及-NHSO2RA。在某些实施例中,G5为H。在某些实施例中,G5为卤素。在某些实施例中,G5为视情况经取代的C1-C6烷基。在某些实施例中,G5为甲基、乙基或正丙基。在某些实施例中,G5为-ORA,其中RA独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基或氧保护基(当附接至氧时)或硫保护基(当附接至硫时)。在某些实施例中,G5为-OH。在某些实施例中,G5为-ORA,其中RA为视情况经取代的C1-C6烷基。在某些实施例中,G5为-OCH3或-OC2H5。在某些实施例中,G5为-ORA,其中RA为氧保护基。在某些实施例中,G5为-N(RB)2,其中RB在各种情况下独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基及视情况经取代的芳基或氮保护基,或两个RB与中间的氮结合在一起形成杂环。在某些实施例中,G5为NH2。在某些实施例中,G5为NHRB,其中RB为视情况经取代的C1-C6烷基。在某些实施例中,G5为NHCH3或NHC2H5。在某些实施例中,G5为NHRB,其中RB为氮保护基。
如本文一般所定义,G6独立地选自氢、卤素、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基、视情况经取代的杂芳基、-ORA、-CH2ORA、-OC(O)RC、-SRA、-N(RB)2、-N(RA)C(O)RC、-C(O)N(RB)2、-CN、-NO2、-C(O)RC、-C(O)ORA、-S(O)RC、-SO2RA、-SO2N(RB)2、=O、=NOH、=N-ORA、=N-NH2、=N-NHRA、=N-N(RB)2及-NHSO2RA。在某些实施例中,G6为H。在某些实施例中,G6为卤素。在某些实施例中,G6为视情况经取代的C1-C6烷基。在某些实施例中,G6为甲基、乙基或正丙基。在某些实施例中,G6为-ORA,其中RA独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基或氧保护基(当附接至氧时)或硫保护基(当附接至硫时)。在某些实施例中,G6为-OH。在某些实施例中,G6为-ORA,其中RA为视情况经取代的C1-C6烷基。在某些实施例中,G6为-OCH3或-OC2H5。在某些实施例中,G6为-ORA,其中RA为氧保护基。在某些实施例中,G6为-N(RB)2,其中RB在各种情况下独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基及视情况经取代的芳基或氮保护基,或两个RB与中间的氮结合在一起形成杂环。在某些实施例中,G6为NH2。在某些实施例中,G6为NHRB,其中RB为视情况经取代的C1-C6烷基。在某些实施例中,G6为NHCH3或NHC2H5。在某些实施例中,G6为NHRB,其中RB为氮保护基。
如本文一般所定义,G7独立地选自氢、卤素、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基、视情况经取代的杂芳基、-ORA、-CH2ORA、-OC(O)RC、-SRA、-N(RB)2、-N(RA)C(O)RC、-C(O)N(RB)2、-CN、-NO2、-C(O)RC、-C(O)ORA、-S(O)RC、-SO2RA、-SO2N(RB)2、=O、=NOH、=N-ORA、=N-NH2、=N-NHRA、=N-N(RB)2及-NHSO2RA。在某些实施例中,G7为H。在某些实施例中,G7为卤素。在某些实施例中,G7为视情况经取代的C1-C6烷基。在某些实施例中,G7为甲基、乙基或正丙基。在某些实施例中,G7为-ORA,其中RA独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基或氧保护基(当附接至氧时)或硫保护基(当附接至硫时)。在某些实施例中,G7为-OH。在某些实施例中,G7为-ORA,其中RA为视情况经取代的C1-C6烷基。在某些实施例中,G7为-OCH3或-OC2H5。在某些实施例中,G7为-ORA,其中RA为氧保护基。在某些实施例中,G7为-N(RB)2,其中RB在各种情况下独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基及视情况经取代的芳基或氮保护基,或两个RB与中间的氮结合在一起形成杂环。在某些实施例中,G7为NH2。在某些实施例中,G7为NHRB,其中RB为视情况经取代的C1-C6烷基。在某些实施例中,G7为NHCH3或NHC2H5。在某些实施例中,G7为NHRB,其中RB为氮保护基。
如本文一般所定义,G8独立地选自氢、卤素、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基、视情况经取代的杂芳基、-ORA、-CH2ORA、-OC(O)RC、-SRA、-N(RB)2、-N(RA)C(O)RC、-C(O)N(RB)2、-CN、-NO2、-C(O)RC、-C(O)ORA、-S(O)RC、-SO2RA、-SO2N(RB)2、=O、=NOH、=N-ORA、=N-NH2、=N-NHRA、=N-N(RB)2及-NHSO2RA。在某些实施例中,G8为H。在某些实施例中,G8为卤素。在某些实施例中,G8为视情况经取代的C1-C6烷基。在某些实施例中,G8为甲基、乙基或正丙基。在某些实施例中,G8为-ORA,其中RA独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基或氧保护基(当附接至氧时)或硫保护基(当附接至硫时)。在某些实施例中,G8为-OH。在某些实施例中,G8为-ORA,其中RA为视情况经取代的C1-C6烷基。在某些实施例中,G8为-OCH3或-OC2H5。在某些实施例中,G8为-ORA,其中RA为氧保护基。在某些实施例中,G8为-N(RB)2,其中RB在各种情况下独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基及视情况经取代的芳基或氮保护基,或两个RB与中间的氮结合在一起形成杂环。在某些实施例中,G8为NH2。在某些实施例中,G8为NHRB,其中RB为视情况经取代的C1-C6烷基。在某些实施例中,G8为NHCH3或NHC2H5。在某些实施例中,G8为NHRB,其中RB为氮保护基。
在某些实施例中,彼此相邻的两个G8基团与其中间的原子结合在一起以形成视情况经取代的碳环或杂环。在某些实施例中,彼此相邻的两个G8基团与其中间的原子结合在一起以形成视情况经取代的碳环。在某些实施例中,彼此相邻的两个G8基团与其中间的原子结合在一起以形成视情况经取代的5元碳环。在某些实施例中,彼此相邻的两个G8基团与其中间的原子结合在一起以形成视情况经取代的6元碳环。在某些实施例中,彼此相邻的两个G8基团与其中间的原子结合在一起以形成视情况经取代的苯基。在某些实施例中,彼此相邻的两个G8基团与其中间的原子结合在一起以形成未经取代的苯基。在某些实施例中,彼此相邻的两个G8基团与其中间的原子结合在一起以形成视情况经取代的杂环。在某些实施例中,彼此相邻的两个G8基团与其中间的原子结合在一起以形成具有S、N或O的一个杂原子的视情况经取代的5元杂环。在某些实施例中,彼此相邻的两个G8基团与其中间的原子结合在一起以形成具有各独立地选自S、N及O的群的两个杂原子的视情况经取代的5元杂环。在某些实施例中,彼此相邻的两个G8基团与其中间的原子结合在一起以形成具有S、N或O的一个杂原子的视情况经取代的6元碳环。在某些实施例中,彼此相邻的两个G8基团与其中间的原子结合在一起以形成具有各独立地选自由S、N及O组成的群的两个杂原子的视情况经取代的6元碳环。
本发明的一或多个实施例的功效阐述于以下描述中。本发明的其他特征或优点将自以下几个实施例的附图及实施方式且亦自所附申请专利范围为显而易见的。
基于环辛炔的荧光探针
基于环辛炔的荧光探针为式(IV):
或其医药学上可接受的盐、溶剂合物或水合物,且其中:
G9、G10、G11、G12、G13、G14、G15、G16、G17及G18在各种情况下独立地为氢、视情况经取代的C1-6烷基、视情况经取代的C1-6烯基、视情况卤素、视情况亚硝基、视情况经取代的C1-6炔基、视情况经取代的芳基、视情况经取代的酰基、-ORA、-CH2ORA、-OC(O)RA、-SRA、-N(RB)2、-N(RA)C(O)RA、-C(O)N(RB)2、-CN、-NO2、-C(O)RA、-C(O)ORA、-S(O)RA、-SO2RA、-SO3RA、-SO2N(RB)2及-NHSO2RB;
R在各种情况下独立地选自氢、卤素、视情况经取代的烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基、视情况经取代的酰基、-ORA、-CH2ORA、-OC(O)RA、-SRA、-N(RB)2、-N(RA)C(O)RA、-C(O)N(RB)2、-CN、-NO2、-C(O)RA、-C(O)ORA、-S(O)RA、-SO2RA、-SO3RA、-SO2N(RB)2及-NHSO2RB;
各RA独立地选自氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基及视情况经取代的芳基;及
各RB独立地选自氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基及视情况经取代的芳基,或两个RB与中间的氮结合在一起形成杂环;
G9及G10在各种情况下为氢、氟基、氯基、溴基、碘基、亚硝基、烷基、烷氧基、芳氧基或炔基,及
其中烷基及烷氧基为非分支链、饱和的且具有1-4个碳原子;芳基及芳氧基的芳基可为碳环芳基或杂环芳基;碳环芳基具有总共6-20个碳原子,包括取代基的碳原子;杂环芳基具有总共5-20个碳原子,包括取代基的碳原子;烷氧羰基为羧酸的烷基酯,其中烷基如上文所定义;各烷基、芳基、烷氧基、芳氧基、苯并及烷氧羰基独立地可不经取代或经一或多个取代基取代;烷基取代基为卤基、羟基、胺基或芳基;芳基取代基为卤基、羟基、胺基、烷基、芳基、硝基或羧基;及卤基取代基为氟基或氯基;
m为1。
如本文一般所定义,G9独立地选自氢、卤素、亚硝基、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基、视情况经取代的杂芳基、-ORA、-CH2ORA、-OC(O)RC、-SRA、-N(RB)2、-N(RA)C(O)RC、-C(O)N(RB)2、-CN、-NO2、-C(O)RC、-C(O)ORA、-S(O)RC、-SO2RA、-SO2N(RB)2、=O、=NOH、=N-ORA、=N-NH2、=N-NHRA、=N-N(RB)2及-NHSO2RA。在某些实施例中,G9为H。在某些实施例中,G9为卤素。在某些实施例中,G9为视情况经取代的C1-C6烷基。在某些实施例中,G9为甲基、乙基或正丙基。在某些实施例中,G9为-ORA,其中RA独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基、视情况经取代的杂芳基或氧保护基(当附接至氧时)或硫保护基(当附接至硫时)。在某些实施例中,G9为氟基。
如本文一般所定义,G10独立地选自氢、卤素、亚硝基、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基、视情况经取代的杂芳基、-ORA、-CH2ORA、-OC(O)RC、-SRA、-N(RB)2、-N(RA)C(O)RC、-C(O)N(RB)2、-CN、-NO2、-C(O)RA、-C(O)ORA、-S(O)RA、-SO2RA、-SO2N(RB)2、=O、=NOH、=N-ORA、=N-NH2、=N-NHRA、=N-N(RB)2及-NHSO2RA,其中RA独立地为氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基、视情况经取代的芳基或氧保护基(当附接至氧时)或硫保护基(当附接至硫时),其中RB在各种情况下独立地选自氢、视情况经取代的C1-C6烷基、视情况经取代的烯基、视情况经取代的炔基、视情况经取代的杂环基及视情况经取代的芳基或氮保护基,或两个RB与中间的氮结合在一起形成杂环。在某些实施例中,G10为氟基。
在某些实施例中,本发明涉及一种101化合物:
本文描述一种通过稠合环辛炔与香豆素荧光团所设计的新颖荧光形成探针101,用于在无洗涤及无固定以及无催化剂条件下进行活细胞中的含迭氮基醣共轭物的实时成像。此探针为细胞可渗透有低细胞毒性且在三唑形成之后产生荧光,因此实现醣蛋白定位的细胞内成像及运输有良好的荧光信号。此外,101与本文所描述的迭氮基-BODIPY探针的组合允许在双标记实验中的活细胞中形成三唑之后分别侦测两种不同的代谢并入的含迭氮基及含炔醣共轭物。
已展示低荧光7-炔基香豆素102经历CuAAC反应,由于三唑环的供电子特性得到具有增强的荧光的三唑103。6c因此,环辛炔并入香豆素部分101可能降低荧光,但101与迭氮化物的SPAAC反应可产生高荧光三唑产物用于敏感侦测。在本发明中,吾人报导基于SPAAC的荧光形成探针101(图10),即coumOCT,其可以用于在无洗涤及无固定的条件下进行活细胞中的迭氮基标志聚醣的时间过程成像。
图10.设计在三唑形成之后展示高荧光的基于SPAAC的荧光形成探针101,用于活细胞中的含迭氮基醣共轭物的成像。为了比较,7-炔基香豆素102为经历与迭氮化物的CuAAC反应以形成高荧光三唑103的弱荧光探针。
基于活性的酶探针
本发明描述一系列由作为基于机制的抑制剂的3-氟唾液酸氟化物制备且通过并入炔基用于报导子接合的基于活性的唾液酸酶探针DFSA(501)及CoumFSA(601)。DFSA(501)为所有测试唾液酸酶的活性位点失活剂。在此报导中,吾人已描述基于活性的唾液酸酶探针CoumFSA(601)与DFSA(501)的化学合成。
图11.唾液酸酶探针DFSA 501及CoumFSA 601的结构。
流程500.CoumFSA的化学合成。
流程600.DFSA(501)的化学合成。
在一些实施例中,一系列基于活性的酶探针可通过改变添加至化合物206的离去基L来合成。如流程700中所示,任何选择的弱酸的盐(钠盐如所示,但可使用任何阳离子相对离子)可用作可接受的离去基。举例而言,L可为烷氧基、苯氧基、五氟苯氧基、4-硝基苯氧基、香豆素、烷酸盐、苯甲酸盐、三氟甲磺酸盐、甲磺酸盐或甲苯磺酸盐。
流程700.通过选择离去基盐L-Na+进行化合物209的变体的变体的化学合成。
图12描绘基于活性的酶探针(ABP)的一般结构。ABP含有反应性基团、间隔基或结合基团及报导子标志。反应性基团基于酶靶的催化机制进行设计,且其可含有可与酶活性位点中的亲核残基反应以形成共价加合物的亲电子试剂。各种报导子标志可用于酶可视化及富集,包括荧光团及生物素,以及「可点击的」柄状物,诸如迭氮化物及乙炔。
本发明描述基于活性的酶探针,具体言的唾液酸酶的设计。3-氟唾液酸氟化物根据动力学模型以时间依赖的方式使野生型反式-唾液酸酶失活。因为强拉电子基团,氟可使积极改变的侧氧基-碳离子不稳定,如过渡状态(图801),进而减缓共价中间物的形成及水解。
图13.作用于受质的唾液酸酶的机制及过渡状态。
本发明人已认识到唾液酸酶的晶体结构支撑神经胺酸苷酶与3-氟唾液酸氟化物的共价复合物,其可经进一步修饰以将新颖化学官能基并入活性位点。如图802中所示,神经胺酸苷酶(唾液酸酶)活性位点处的Tyr406在3-氟唾液酸氟化物受质上对C-2进行亲核攻击(Nat.Commun.2013,4,1491)。因此,用离去基修饰C-2将在Tyr406与3-氟唾液酸氟化物受质之间产生共价键。进一步修饰3-氟唾液酸氟化物受质以包括烷基官能基使得共价结合受质能够通过含迭氮化物荧光探针(诸如本文所描述的彼等化合物)侦测。
图14.具有3-氟唾液酸氟化物受质的神经胺酸苷酶(唾液酸酶)活性位点的晶体结构。
在一些实施例中,本文所描述的基于活性的探针(ABP)可用于侦测及识别唾液酸酶。如图26所描绘,ABP可与唾液酸酶的活性位点反应,形成共价键。细胞可视情况溶解。ABP可进一步与含迭氮化物报导子分子(例如,本文所描述的含迭氮化物荧光探针)反应以形成三唑复合物。可接着侦测(例如通过质谱分析、荧光、发光、吸收光谱法)三唑复合物。
图15.用于识别唾液酸酶的荧光反应。
实例
实例1:迭氮基-BODIPY化合物的合成
材料
除非另外指示,否则所有试剂均为市售的且未经进一步纯化即使用。除非另外指示,否则所有溶剂均为无水级的。除非另外说明,否则所有非水性反应均在氩气微正压下在烘干的玻璃器皿中进行。反应经磁力搅拌且通过硅胶上的薄层层析监测。在粒度为40-63μm的硅胶上进行管柱层析。报导光谱纯化合物的产率。
仪器
在Electrothermal1101D熔点装置上记录熔点且不经校正。在Bruker AVANCE 600光谱仪(600MHz)上记录NMR光谱。以相对于四甲基硅烷(TMS)的δ值给出化学位移;以Hz给出偶合常数J。1H-NMR光谱的内标准为CDCl3(δH=7.24),13C-NMR光谱的内标准为CDCl3(δc=77.0)。分裂模式报导为s(单重峰)、d(双重峰)、t(三重峰)、q(四重峰)、m(多重峰)、br(宽峰)及dd(双二重峰)。在Bruker Daltonics光谱仪上记录高分辨率ESI质谱。在Perkin Elmer Lambda 35紫外可见光(UV-Visible)分光亮度计上记录吸收光谱。在AMINCO-Bowman系列2发光光谱仪上记录荧光光谱。所有相片均收集在Leica TCS-SP5共焦雷射扫描显微镜上。
本文揭示一种用于合成迭氮基-BODIPY化合物Az1、Az2、Az3、Az4、Az5、Az6、Az7及Az8的方便途径。所述制备使用关键硝基中间物1、2、3、4、5、6、7及8,其被有效地转化成相应迭氮基-BODIPY化合物。迭氮基-BODIPY化合物Az1、Az2、Az3、Az4、Az5、Az6、Az7及Az8的结构展示于图1中。合成途径中的试剂及步骤如下。
步骤1.进行2,4-二甲基-3-乙基吡咯与经取代的硝基苯甲醛的酸催化缩合,随后在温和条件下用DDQ氧化,得到二吡咯亚甲基中间物,其经BF3·OEt2处理以产生相应硝基-BODIPY 1-8。
步骤2.根据先前报导的方法,通过在10%Pd/C存在下用肼还原硝基-BODIPY获得呈合理产率的胺基-BODIPY Am1-Am8。在温和条件下用三氟甲磺酰基迭氮化物(TfN3)处理时,将胺基-BODIPY转化成靶迭氮基-BODIPY Az1-Az8。(Li,L.;Han,J.;Nguyen,B.;Burgess,K.J.Org.Chem.2008,73,1963-1970。)
本文揭示一种用于合成迭氮基-BODIPY化合物Az9、Az10及Az11的方便途径。所述制备使用关键硝基中间物9、10及11,其被有效地转化成相应迭氮基-BODIPY化合物。迭氮基-BODIPY化合物Az9、Az10及Az11的结构展示于图3中。合成途径中的试剂及步骤为如下。
步骤1.进行2,4-二甲基-3-取代的吡咯与2-甲氧基-5-硝基苯甲醛的酸催化缩合,随后在温和条件下用DDQ进行氧化,得到二吡咯亚甲基中间物,其经BF3·OEt2处理以产生相应硝基-BODIPY 9-11。
步骤2.根据先前报导的方法,通过在10%Pd/C存在下用肼还原硝基-BODIPY获得呈合理产率的胺基-BODIPY Am9-Am11。在温和条件下用三氟甲磺酰基迭氮化物(TfN3)处理时,将胺基-BODIPY转化成靶迭氮基-BODIPY Az9-Az11。(Li,L.;Han,J.;Nguyen,B.;Burgess,K.J.Org.Chem.2008,73,1963-1970。)
实例2:三唑基-BODIPY化合物的合成
本文揭示一种用于合成三唑基-BODIPY化合物T2、T9、T10及T11的方便途径。三唑基-BODIPY化合物T2、T9、T10及T11的结构展示于图3中。合成途径中的试剂及步骤为如下。
通过迭氮基-BODIPY化合物Az2、Az9、Az10及Az11与4-戊炔-1-醇在含有CuSO4、抗坏血酸钠及由三炔丙基胺与迭氮乙酸乙酯制备的tris-三唑配位体的CuAAC条件下的1,3-偶极环加成获得呈合理产率的三唑基-BODIPY化合物T2、T9、T10及T11。(Zhou,Z.;Fahrni,C.J.J.Am.Chem.Soc.2004,126,8862-8863。)
硝基-BODIPY的一般合成程序及产物特征化.
将经取代的硝基苯甲醛(3mmol)及3-取代的2,4-二甲基吡咯(6mmol)在Ar氛围下溶解于无水CH2Cl2(400mL)中。添加TFA(1滴),且将所得溶液在室温下搅拌隔夜。在如由TLC分析所示在12-18h内完全消耗反应物之后,一次性添加2,3-二氯-5,6-二氰基-1,4-苯醌(DDQ,3mmol)。将反应混合物在室温下搅拌1h,且接着用盐水(400mL)洗涤。有机溶离份经MgSO4干燥,过滤且浓缩。在短氧化铝管柱(CH2Cl2)上纯化粗化合物,得到二吡咯亚甲基的棕色固体。将粗二吡咯亚甲基产物及N,N-二异丙基乙胺(DIEA)(40mmol)溶解于无水甲苯(150mL)中且在室温下搅拌10min。缓慢地添加BF3·OEt2(55mmol),且继续搅拌1h。用水(3×50mL)及盐水(50mL)洗涤反应混合物,经MgSO4干燥,过滤且浓缩。通过在硅胶上通过用CH2Cl2/己烷或EtOAc/己烷溶离进行管柱层析来纯化粗产物,得到相应硝基-BODIPY产物1-11。
2,6-二乙基-4,4-二氟基-8-(3-硝基苯基)-1,3,5,7-四甲基-4-硼杂-3a,4a-二氮杂-s-二环戊二烯并苯(1).
以三个步骤自2,4-二甲基-3-乙基吡咯及3-硝基苯甲醛制备呈15%产率的化合物1。C23H26BF2N3O2,暗红色固体,熔点246-248℃;TLC(EtOAc/己烷,1:4)Rf=0.38;1H NMR(600MHz,CDCl3)δ8.36-8.34(1H,m),8.20(1H,t,J=1.7Hz),7.70-7.64(2H,m),2.52(6H,s),2.28(4H,q,J=7.6Hz),1.23(6H,s),0.96(6H,t,J=7.6Hz);13C NMR(150MHz,CDCl3)δ155.0,148.6,137.6,136.3,134.8,133.5,130.4,130.2,123.89,123.85,17.0,14.5,12.6,12.1;C23H27BF2N3O2的HRMS计算值:426.2164,实验值:m/z 426.2167[M+H]+。
2,6-二乙基-4,4-二氟基-8-(2-甲氧基-5-硝基苯基)-1,3,5,7-四甲基-4-硼杂-3a,4a-二氮杂-s-二环戊二烯并苯(2).
以三个步骤自2,4-二甲基-3-乙基吡咯及2-甲氧基-5-硝基苯甲醛制备呈51%产率的化合物2。C24H28BF2N3O3,暗红色固体,熔点210-212℃;TLC(EtOAc/己烷,1:4)Rf=0.33;1H NMR(600MHz,CDCl3)δ8.42(1H,dd,J=9.1,2.5Hz),8.15(1H,d,J=2.5Hz),7.11(1H,d,J=9.1Hz),3.93(3H,s),2.56(6H,s),2.32(4H,q,J=7.6Hz),1.36(6H,s),1.02(6H,t,J=7.6Hz);13C NMR(150MHz,CDCl3)δ162.0,154.4,141.8,137.1,133.5,133.0,130.4,126.8,126.1,125.6,110.9,56.6,17.0,14.6,12.6,11.5;C24H29BF2N3O3的HRMS计算值:456.2270,实验值:m/z 456.2267[M+H]+。
2,6-二乙基-4,4-二氟基-8-(3,4-二甲氧基-5-硝基苯基)-1,3,5,7-四甲基-4-硼杂-3a,4a-二氮杂-s-二环戊二烯并苯(3).
以三个步骤自2,4-二甲基-3-乙基吡咯及3,4-二甲氧基-5-硝基苯甲醛制备呈45%产率的化合物3。C25H30BF2N3O4,暗红色固体,熔点190-192℃;TLC(EtOAc/己烷,1:3)Rf=0.5;1H NMR(600MHz,CDCl3)δ7.28(1H,s),7.02(1H,s),4.04(3H,s),3.89(3H,s),2.51(6H,s),2.30(4H,q,J=7.5Hz),1.38(6H,s),0.98(6H,t,J=7.5Hz);13C NMR(150MHz,CDCl3)δ154.9,145.3,143.2,137.7,136.4,133.4,131.4,130.4,116.16,116.12,62.5,56.8,17.0,14.5,12.6,12.0;C25H31BF2N3O4的HRMS计算值:486.2376,实验值:m/z 486.2377[M+H]+。
2,6-二乙基-4,4-二氟基-8-(2,3-二甲氧基-5-硝基苯基)-1,3,5,7-四甲基-4-硼杂-3a,4a-二氮杂-s-二环戊二烯并苯(4).
以三个步骤自2,4-二甲基-3-乙基吡咯及2,3-二甲氧基-5-硝基苯甲醛制备呈41%产率的化合物4。C25H30BF2N3O4,暗红色固体,熔点185-187℃;TLC(EtOAc/己烷,1:4)Rf=0.35;1H NMR(600MHz,CDCl3)δ7.88(1H,d,J=2.3Hz),7.76(1H,d,J=2.3Hz),4.00(3H,s),3.83(3H,s),2.51(6H,s),2.29(4H,q,J=7.6Hz),1.38(6H,s),0.97(6H,t,J=7.6Hz);13C NMR(150MHz,CDCl3)δ154.5,152.8,151.8,143.8,137.1,133.4,133.2,130.3,129.5,117.8,108.1,60.8,56.4,17.0,14.6,12.6,11.6;C25H31BF2N3O4的HRMS计算值:486.2376,实验值:m/z 486.2378[M+H]+。
2,6-二乙基-4,4-二氟基-8-(2,5-二甲氧基-3-硝基苯基)-1,3,5,7-四甲基-4-硼杂-3a,4a-二氮杂-s-二环戊二烯并苯(5).
以三个步骤自2,4-二甲基-3-乙基吡咯及2,5-二甲氧基-3-硝基苯甲醛制备呈36%产率的化合物5。C25H30BF2N3O4,暗红色固体,熔点181-183℃;TLC(CH2Cl2/己烷,3:7)Rf=0.5;1H NMR(600MHz,CDCl3)δ7.41(1H,d,J=3.1Hz),6.98(1H,d,J=3.1Hz),3.83(3H,s),3.71(3H,s),2.52(6H,s),2.30(4H,q,J=7.6Hz),1.44(6H,s),0.98(6H,t,J=7.6Hz);13C NMR(150MHz,CDCl3)δ155.6,154.8,145.0,144.3,137.3,133.4,133.2,132.9,130.3,120.7,110.4,62.2,56.2,17.1,14.6,12.6,11.7;C25H31BF2N3O4的HRMS计算值:486.2376,实验值:m/z 486.2378[M+H]+。
2,6-二乙基-4,4-二氟基-8-(2-吗啉基-5-硝基苯基)-1,3,5,7-四甲基-4-硼杂-3a,4a-二氮杂-s-二环戊二烯并苯(6).
以三个步骤自2,4-二甲基-3-乙基吡咯及2-吗啉基-5-硝基苯甲醛制备呈38%产率的化合物6。C27H33BF2N4O3,暗红色固体,熔点179-181℃;TLC(EtOAc/己烷,3:7)Rf=0.25;1H NMR(600MHz,CDCl3)δ8.24(1H,dd,J=9.1,2.6Hz),8.02(1H,d,J=2.6Hz),6.96(1H,d,J=9.1Hz),3.84(4H,t,J=4.3Hz),3.24(4H,t,J=4.3Hz),2.52(6H,s),2.31(4H,q,J=7.6Hz),1.42(6H,s),0.99(6H,t,J=7.6Hz);13C NMR(150MHz,CDCl3)δ155.1,154.9,141.1,137.1,136.0,133.5,129.8,127.4,126.2,126.1,117.4,66.6,50.4,17.1,14.6,12.6,12.1;C27H34BF2N4O3的HRMS计算值:511.2692,实验值:m/z 511.2695[M+H]+。
2,6-二乙基-4,4-二氟基-8-[2-(4-甲基哌嗪基)-5-硝基苯基]-1,3,5,7-四甲基-4-硼杂-3a,4a-二氮杂-s-二环戊二烯并苯(7).
以三个步骤自2,4-二甲基-3-乙基吡咯及2-(4-甲基哌嗪基)-5-硝基苯甲醛制备呈48%产率的化合物7。C28H36BF2N5O2,暗红色固体,熔点175-177℃;TLC(EtOAc/己烷,3:7)Rf=0.25;1H NMR(600MHz,CDCl3)δ8.21(1H,dd,J=9.2,2.8Hz),8.00(1H,d,J=2.8Hz),6.93(1H,d,J=9.2Hz),3.29(4H,t,J=4.7Hz),2.52(6H,s),2.32(4H,q,J=7.6Hz),2.19(4H,t,J=4.7Hz),2.15(3H,s),1.42(6H,s),0.99(6H,t,J=7.6Hz);13C NMR(150MHz,CDCl3)δ155.1,154.6,140.6,137.2,136.4,133.4,129.9,127.4,126.1,125.5,117.5,54.7,49.8,45.9,17.1,14.7,12.6,12.1;C28H37BF2N5O2的HRMS计算值:524.3008,实验值:m/z 524.3010[M+H]+。
2,6-二乙基-4,4-二氟基-8-(2-哌啶基-5-硝基苯基)-1,3,5,7-四甲基-4-硼杂-3a,4a-二氮杂-s-二环戊二烯并苯(8).
以三个步骤自2,4-二甲基-3-乙基吡咯及2-哌啶基-5-硝基苯甲醛制备呈40%产率的化合物8。C28H35BF2N4O2,暗红色固体,熔点201-203℃;TLC(EtOAc/己烷,1:9)Rf=0.38;1H NMR(600MHz,CDCl3)δ8.19(1H,dd,J=9.2,2.8Hz),7.97(1H,d,J=2.8Hz),6.91(1H,d,J=9.2Hz),3.23(4H,t,J=5.3Hz),2.52(6H,s),2.30(4H,q,J=7.6Hz),1.48-1.44(2H,m),1.43(6H,s),1.37-1.34(4H,m),0.98(6H,t,J=7.6Hz);13C NMR(150MHz,CDCl3)δ156.0,154.3,139.9,137.2,137.0,133.2,130.0,127.5,126.1,125.1,117.3,51.3,25.8,23.9,17.1,14.6,12.6,12.1;C28H36BF2N4O2的HRMS计算值:509.2899,实验值:m/z 509.2901[M+H]+。
4,4-二氟基-8-(2-甲氧基-5-硝基苯基)-1,3,5,7-四甲基-4-硼杂-3a,4a-二氮杂-s-二环戊二烯并苯(9).
以三个步骤自2,4-二甲基吡咯及2-甲氧基-5-硝基苯甲醛制备呈39%产率的化合物9。C20H20BF2N3O3,暗红色固体,熔点178-180℃;TLC(EtOAc/己烷,1:4)Rf=0.31;1H NMR(600MHz,CDCl3)δ8.42(1H,dd,J=9.1,2.7Hz),8.17(1H,d,J=2.7Hz),7.12(1H,d,J=9.1Hz),6.02(2H,s),3.93(3H,s),2.59(6H,s),1.46(6H,s);13C NMR(150MHz,CDCl3)δ161.7,156.1,141.9,135.0,131.1,126.9,126.0,124.8,121.5,118.9,111.0,56.7,14.6,14.2;C20H21BF2N3O3的HRMS计算值:400.1644,实验值:m/z 400.1640[M+H]+。
2,6-二乙氧羰基-4,4-二氟基-8-(2-甲氧基-5-硝基苯基)-1,3,5,7-四甲基-4-硼杂-3a,4a-二氮杂-s-二环戊二烯并苯(10).
以三个步骤自2,4-二甲基-4-乙氧羰基吡咯及2-甲氧基-5-硝基苯甲醛制备呈60%产率的化合物10。C26H28BF2N3O7,橙红色固体,熔点181-183℃;TLC(CH2Cl2/己烷,7:3)Rf=0.18;1H NMR(600MHz,CDCl3)δ8.43(1H,dd,J=9.2,2.8Hz),8.09(1H,d,J=2.8Hz),7.11(1H,d,J=9.2Hz),4.26(4H,q,J=7.1Hz),3.89(3H,s),2.82(6H,s),1.71(6H,s),1.31(6H,t,J=7.1Hz);13C NMR(150MHz,CDCl3)δ164.0,161.4,160.0,146.4,142.2,139.2,131.1,127.6,125.5,124.3,122.7,111.3,60.3,56.8,15.1,14.2,13.2;C26H29BF2N3O7的HRMS计算值:544.2067,实验值:m/z 544.2061[M+H]+。
2,6-二氰基-4,4-二氟基-8-(2-甲氧基-5-硝基苯基)-1,3,5,7-四甲基-4-硼杂-3a,4a-二氮杂-s-二环戊二烯并苯(11).
以三个步骤自3-氰基-2,4-二甲基吡咯S7及2-甲氧基-5-硝基苯甲醛制备呈13%产率的化合物11。C22H18BF2N5O3,红色固体,熔点278-280℃;TLC(CH2Cl2/己烷,7:3)Rf=0.18;1H NMR(600MHz,CDCl3)δ8.49(1H,dd,J=9.1,2.6Hz),8.10(1H,d,J=2.6Hz),7.19(1H,d,J=9.1Hz),3.93(3H,s),2.72(6H,s),1.63(6H,s);13C NMR(150MHz,CDCl3)δ160.9,160.2,148.2,142.2,140.6,131.2,128.3,125.1,122.2,113.2,111.8,106.8,57.1,13.9,13.7;C22H19BF2N5O3的HRMS计算值:450.1549,实验值:m/z 450.1546[M+H]+。
迭氮基-BODIPY(Az1-Az11)的一般合成程序及产物特征化.
将硝基-BODIPY 1-11(0.5mmol)于EtOH(20mL)与THF(20mL)的混合溶剂中的溶液用Ar吹扫10min。添加单水合肼(0.3mL)及10%Pd/C(60mg,0.1当量)。将反应混合物加热至回流历时30min,且接着通过真空过滤移除Pd/C。在蒸发溶剂之后,通过在硅胶上的管柱层析纯化残余物,得到胺基-BODIPY的红色固体。将胺基-BODIPY Am1-Am11的粗产物在50mL圆底烧瓶中溶解于CH2Cl2(20mL)中。将三乙胺(Et3N,1.5mmol)及CuSO4(25μmol于0.1mL水中)溶液添加至烧瓶。接着添加新制备的三氟甲磺酰基迭氮化物(TfN3)溶液(1.5mmol于3mL CH2Cl2中),且通过添加甲醇(0.5mL)使混合物达到均匀性。在室温下搅拌3h之后,将混合物倾入NaHCO3饱和水溶液(10mL)中且用CH2Cl2(3×10mL)萃取。合并的有机萃取物经MgSO4干燥,过滤且浓缩。通过在硅胶上通过用CH2Cl2/己烷、EtOAc/己烷或MeOH/CH2Cl2溶离进行管柱层析来纯化残余物,得到相应迭氮基-BODIPY产物Az1-Az11。
8-(5-胺基-2-甲氧苯基)-2,6-二乙氧羰基-4,4-二氟基-1,3,5,7-四甲基-4-硼杂-3a,4a-二氮杂-s-二环戊二烯并苯(Am10).
自化合物10制备呈83%产率的化合物Am10。C26H30BF2N3O5,暗红色固体,熔点188-190℃;TLC(EtOAc/己烷,3:7)Rf=0.23;1H NMR(600MHz,CDCl3)δ6.82-6.77(2H,m),6.45(1H,d,J=2.5Hz),4.25(4H,q,J=7.1Hz),3.66(3H,s),3.52(2H,br s),2.79(6H,s),1.82(6H,s),1.30(6H,t,J=7.1Hz);13C NMR(150MHz,CDCl3)δ164.4,158.9,148.8,147.3,143.4,141.4,131.5,123.7,122.0,117.4,115.6,112.8,60.1,56.0,14.9,14.3,12.9;C26H31BF2N3O5的HRMS计算值:514.2325,实验值:m/z 514.2327[M+H]+。
8-(3-迭氮苯基)-2,6-二乙基-4,4-二氟基-1,3,5,7-四甲基-4-硼杂-3a,4a-二氮杂-s-二环戊二烯并苯(Az1).
以两个步骤自化合物1制备呈47%产率的化合物Az1。C23H26BF2N5,暗红色固体,熔点151-153℃(分解);TLC(EtOAc/己烷,1:9)Rf=0.38;1H NMR(600MHz,CDCl3)δ8.01(1H,d,J=7.9Hz),7.85(1H,s),7.75(1H,t,J=7.7Hz),7.65(1H,d,J=7.1Hz),2.52(6H,s),2.27(4H,q,J=7.4Hz),1.22(6H,s),0.95(6H,t,J=7.4Hz);13C NMR(150MHz,CDCl3)δ165.0,154.7,137.7,137.4,137.1,135.3,133.3,130.5,130.2,121.2,121.0,17.0,14.5,12.6,12.1;C23H27BF2N5的HRMS计算值:422.2328,实验值:m/z422.2330[M+H]+。
8-(5-迭氮基-2-甲氧苯基)-2,6-二乙基-4,4-二氟基-1,3,5,7-四甲基-4-硼杂-3a,4a-二氮杂-s-二环戊二烯并苯(Az2).
以两个步骤自化合物2制备呈59%产率的化合物Az2。C24H28BF2N5O,暗红色固体,熔点163-165℃(分解);TLC(EtOAc/己烷,1:4)Rf=0.52;1H NMR(600MHz,CDCl3)δ7.08(1H,d,J=8.7Hz),6.95(1H,d,J=8.7Hz),6.84(1H,s),3.74(3H,s),2.50(6H,s),2.28(4H,q,J=7.4Hz),1.36(6H,s),0.97(6H,t,J=7.4Hz);13C NMR(150MHz,CDCl3)δ154.1,153.7,137.6,135.5,133.4,132.6,130.6,126.2,120.5,112.4,56.0,17.1,14.6,12.5,11.2;C24H29BF2N5O的HRMS计算值:452.2433,实验值:m/z 452.2429[M+H]+。
8-(3-迭氮基-4,5-二甲氧苯基)-2,6-二乙基-4,4-二氟基-1,3,5,7-四甲基-4-硼杂-3a,4a-二氮杂-s-二环戊二烯并苯(Az3).
以两个步骤自化合物3制备呈51%产率的化合物Az3。C25H30BF2N5O2,橙红色固体,熔点156-158℃(分解);TLC(EtOAc/己烷,1:4)Rf=0.41;1H NMR(600MHz,CDCl3)δ7.09(1H,d,J=1.4Hz),5.85(1H,d,J=1.4Hz),4.64(3H,s),3.95(3H,s),2.49(6H,s),2.26(4H,q,J=7.5Hz),1.26(6H,s),0.94(6H,t,J=7.5Hz);13C NMR(150MHz,CDCl3)δ160.4,155.2,154.56,154.53,137.6,137.3,133.1,130.4,128.4,118.2,100.6,65.6,56.9,17.0,14.5,12.5,12.0;C25H31BF2N5O2的HRMS计算值:482.2539,实验值:m/z 482.2542[M+H]+。
8-(5-迭氮基-2,3-二甲氧苯基)-2,6-二乙基-4,4-二氟基-1,3,5,7-四甲基-4-硼杂-3a,4a-二氮杂-s-二环戊二烯并苯(Az4).
以两个步骤自化合物4制备呈54%产率的化合物Az4。C25H30BF2N5O2,暗红色固体,熔点158-160℃(分解);TLC(EtOAc/己烷,1:4)Rf=0.48;1H NMR(600MHz,CDCl3)δ8.18(1H,s),6.82(1H,s),3.94(3H,s),3.88(3H,s),2.54(6H,s),2.29(4H,q,J=7.6Hz),1.43(6H,s),0.97(6H,t,J=7.6Hz);13C NMR(150MHz,CDCl3)δ163.1,154.4,153.1,152.9,137.3,134.1,133.2,130.6,129.3,125.1,97.6,60.8,56.1,17.1,14.6,12.6,11.7;C25H31BF2N5O2的HRMS计算值:482.2539,实验值:m/z 482.2541[M+H]+。
8-(3-迭氮基-2,5-二甲氧苯基)-2,6-二乙基-4,4-二氟基-1,3,5,7-四甲基-4-硼杂-3a,4a-二氮杂-s-二环戊二烯并苯(Az5).
以两个步骤自化合物5制备呈54%产率的化合物Az5。C25H30BF2N5O2,暗红色固体,熔点150-152℃(分解);TLC(CH2Cl2/己烷,1:4)Rf=0.45;1H NMR(600MHz,CDCl3)δ7.16(1H,d,J=3.2Hz),5.81(1H,d,J=3.2Hz),4.42(3H,s),3.72(3H,s),2.55(6H,s),2.32(4H,q,J=7.6Hz),1.52(6H,s),0.99(6H,t,J=7.6Hz);13C NMR(150MHz,CDCl3)δ160.0,156.7,154.7,154.4,137.3,134.1,133.1,133.0,130.6,126.0,90.7,66.1,55.8,17.1,14.6,12.6,11.8;C25H31BF2N5O2的HRMS计算值:482.2539,实验值:m/z 482.2543[M+H]+。
8-(5-迭氮基-2-吗啉基苯基)-2,6-二乙基-4,4-二氟基-1,3,5,7-四甲基-4-硼杂-3a,4a-二氮杂-s-二环戊二烯并苯(Az6).
以两个步骤自化合物6制备呈62%产率的化合物Az6。C27H33BF2N6O,暗红色油状物;TLC(EtOAc/己烷,1:4)Rf=0.4;1H NMR(600MHz,CDCl3)δ7.06(1H,dd,J=8.7,2.7Hz),7.01(1H,d,J=8.7Hz),6.81(1H,d,J=2.7Hz),3.48(4H,t,J=4.4Hz),2.94(4H,t,J=4.4Hz),2.51(6H,s),2.30(4H,q,J=7.6Hz),1.39(6H,s),0.97(6H,t,J=7.6Hz);13C NMR(150MHz,CDCl3)δ153.8,147.3,137.4,134.9,132.9,131.0,130.2,121.1,120.6,120.5,67.1,51.6,17.1,14.6,12.6,11.7;C27H34BF2N6O的HRMS计算值:507.2855,实验值:m/z 507.2858[M+H]+。
8-[5-迭氮基-2-(4-甲基哌嗪基)苯基]-2,6-二乙基-4,4-二氟基-1,3,5,7-四甲基-4-硼杂-3a,4a-二氮杂-s-二环戊二烯并苯(Az7).
以两个步骤自化合物7制备呈72%产率的化合物Az7。C28H36BF2N7,暗红色泡沫;TLC(MeOH/CH2Cl2,1:19)Rf=0.33;1H NMR(600MHz,CDCl3)δ7.06-7.01(2H,m),6.80(1H,s),2.99(4H,br s),2.51(6H,s),2.32-2.26(8H,m),2.18(3H,s),1.38(6H,s),0.97(6H,t,J=7.4Hz);13C NMR(150MHz,CDCl3)δ153.8,146.8,137.4,135.3,133.0,131.2,130.2,121.4,121.0,120.5,54.7,50.1,45.0,17.1,14.7,12.6,11.7;C28H37BF2N7的HRMS计算值:520.3172,实验值:m/z 520.3177[M+H]+。
8-(5-迭氮基-2-哌啶基苯基)-2,6-二乙基-4,4-二氟基--1,3,5,7-四甲基-4-硼杂-3a,4a-二氮杂-s-二环戊二烯并苯(Az8).
以两个步骤自化合物8制备呈69%产率的化合物Az8。C28H35BF2N6,暗红色油状物;TLC(EtOAc/己烷,1:4)Rf=0.67;1H NMR(600MHz,CDCl3)δ7.07(1H,dd,J=8.7,2.6Hz),7.03(1H,d,J=8.7Hz),6.82(1H,d,J=2.6Hz),2.94(4H,t,J=5.2Hz),2.56(6H,s),2.34(4H,q,J=7.6Hz),1.44(6H,s),1.43-1.38(6H,m),1.02(6H,t,J=7.6Hz);13C NMR(150MHz,CDCl3)δ153.3,148.9,138.2,137.5,133.8,132.6,130.7,130.4,121.0,120.8,120.3,52.6,26.2,24.1,17.1,14.6,12.5,11.7;C28H36BF2N6的HRMS计算值:505.3063,实验值:m/z 505.3066[M+H]+。
8-(5-迭氮基-2-甲氧苯基)-4,4-二氟基-1,3,5,7-四甲基-4-硼杂-3a,4a-二氮杂-s-二环戊二烯并苯(Az9).
以两个步骤自化合物9制备呈71%产率的化合物Az9。C20H20BF2N5O,暗红色固体,熔点152-154℃(分解);TLC(EtOAc/己烷,1:4)Rf=0.51;1H NMR(600MHz,CDCl3)δ7.08(1H,d,J=8.7Hz),6.96(1H,d,J=8.7Hz),6.84(1H,s),5.95(2H,s),3.74(3H,s),2.53(6H,s),1.46(6H,s);13C NMR(150MHz,CDCl3)δ155.4,153.8,142.3,137.1,133.5,131.2,125.3,121.1,120.7,120.3,112.5,56.0,14.6,13.9;C20H21BF2N5O的HRMS计算值:396.1807,实验值:m/z 396.1805[M+H]+。
8-(5-迭氮基-2-甲氧苯基)-2,6-二乙氧羰基-4,4-二氟基-1,3,5,7-四甲基-4-硼杂-3a,4a-二氮杂-s-二环戊二烯并苯(Az10).
自化合物Am10制备呈58%产率的化合物Az10。C26H28BF2N5O5,红色固体,熔点86-88℃;TLC(EtOAc/己烷,3:7)Rf=0.41;1H NMR(600MHz,CDCl3)δ7.14(1H,dd,J=8.8,2.8Hz),6.99(1H,d,J=8.8Hz),6.79(1H,d,J=2.8Hz),4.26(4H,q,J=7.1Hz),3.75(3H,s),2.80(6H,s),1.76(6H,s),1.31(6H,t,J=7.1Hz);13C NMR(150MHz,CDCl3)δ164.3,159.4,153.5,146.9,141.4,134.2,131.3,124.7,122.3,121.4,119.8,112.7,60.2,56.1,15.0,14.3,13.0;C26H29BF2N5O5的HRMS计算值:540.2230,实验值:m/z 540.2227[M+H]+。
8-(5-迭氮基-2-甲氧苯基)-2,6-二氰基-4,4-二氟基-1,3,5,7-四甲基-4-硼杂-3a,4a-二氮杂-s-二环戊二烯并苯(Az11).
以两个步骤自化合物11制备呈61%产率的化合物Az11。C22H18BF2N7O,红色固体,熔点141-143℃(分解);TLC(CH2Cl2/己烷,7:3)Rf=0.31;1H NMR(600MHz,CDCl3)δ7.21(1H,dd,J=8.9,2.3Hz),7.06(1H,d,J=8.9Hz),6.77(1H,d,J=2.3Hz),3.77(3H,s),2.70(6H,s),1.67(6H,s);13C NMR(150MHz,CDCl3)δ158.6,151.9,147.7,141.8,133.6,130.4,121.6,121.2,118.2,112.5,112.1,105.4,55.3,12.9,12.4;C22H19BF2N7O的HRMS计算值:446.1712,实验值:m/z 446.1714[M+H]+。
迭氮基-BODIPY与4-戊炔-1-醇的铜(I)催化的迭氮化物-炔环加成反应的程序.
将迭氮基-BODIPY(Az2或Az9-Az11,0.1mmol)及4-戊炔-1-醇(0.1mmol)溶解于THF(5mL)中。添加新制备的1M抗坏血酸钠溶液(0.2mmol于0.2mL水中),随后添加铜(II)五水合物(0.005mmol于0.1mL水中)。通过添加甲醇(0.5mL)使混合物达到均匀性,且接着在室温下搅拌12h。TLC监测展示反应物在12h内完全消耗。在蒸发溶剂之后,通过在硅胶上通过用EtOAc/己烷溶离进行管柱层析来纯化残余物,得到相应三唑产物T2及T9-T11。
2,6-二乙基-4,4-二氟基-8-{3-[4-(3-羟丙基)-1H-1,2,3-三唑-1-基]-2-甲氧苯基}-1,3,5,7-四甲基-4-硼杂-3a,4a-二氮杂-s-二环戊二烯并苯(T2).
自化合物Az2制备呈71%产率的化合物T2。C29H36BF2N5O2,红色固体,熔点180-182℃;TLC(EtOAc/己烷,1:1)Rf=0.15;1H NMR(600MHz,CDCl3)δ7.89(1H,dd,J=8.9,2.7Hz),7.66(1H,s),7.46(1H,d,J=2.7Hz),7.10(1H,J=8.9Hz),3.83(3H,s),3.73(2H,t,J=6.1Hz),2.88(2H,t,J=7.3Hz),2.51(6H,s),2.28(4H,q,J=7.5Hz),1.98-1.96(2H,m),1.38(6H,s),0.97(6H,t,J=7.5Hz);13C NMR(150MHz,CDCl3)δ156.8,154.0,148.3,137.5,134.7,132.8,131.3,130.5,125.9,122.6,121.9,119.1,112.0,61.8,56.1,31.8,22.0,17.0,14.6,12.5,11.4;C29H37BF2N5O2的HRMS计算值:536.3008,实验值:m/z 536.3005[M+H]+。
4,4-二氟基-8-{3-[4-(3-羟丙基)-1H-1,2,3-三唑-1-基]-2-甲氧苯基}-1,3,5,7-四甲基-4-硼杂-3a,4a-二氮杂-s-二环戊二烯并苯(T9).
自化合物Az9制备呈79%产率的化合物T9。C25H28BF2N5O2,红色固体,熔点165-167℃;TLC(EtOAc/己烷,7:3)Rf=0.23;1H NMR(600MHz,CDCl3)δ7.88(1H,d,J=8.8Hz),7.66(1H,s),7.49(1H,s),7.11(1H,d,J=8.8Hz),5.97(2H,s),3.83(3H,s),3.73(2H,q,J=5.3Hz),2.88(2H,t,J=7.3Hz),2.54(6H,s),1.99-1.95(2H,m),1.47(6H,s);13C NMR(150MHz,CDCl3)δ156.5,155.7,148.4,142.2,136.3,131.3,131.2,125.0,122.7,121.7,121.2,119.0,112.1,61.7,56.1,31.8,22.0,14.6,14.1;C25H29BF2N5O2的HRMS计算值:480.2382,实验值:m/z 480.2379[M+H]+。
2,6-二乙氧羰基-4,4-二氟基-8-{3-[4-(3-羟丙基)-1H-1,2,3-三唑-1-基]-2-甲氧苯基}-1,3,5,7-四甲基-4-硼杂-3a,4a-二氮杂-s-二环戊二烯并苯(T10).
自化合物Az10制备呈90%产率的化合物T10。C31H36BF2N5O6,红色固体,熔点157-159℃;TLC(EtOAc/己烷,4:1)Rf=0.32;1H NMR(600MHz,CDCl3)δ7.91(1H,dd,J=8.9,2.6Hz),7.67(1H,s),7.49(1H,d,J=2.6Hz),7.14(1H,d,J=8.9Hz),4.26(4H,q,J=7.1Hz),3.84(3H,s),3.73(2H,q,J=5.8Hz),2.88(2H,t,J=7.3Hz),2.81(6H,s),1.99-1.94(2H,m),1.79(6H,s),1.31(6H,t,J=7.1Hz);13C NMR(150MHz,CDCl3)δ164.2,159.6,156.3,148.5,146.7,140.6,131.7,131.3,124.5,123.3,122.5,121.4,119.0,112.3,61.6,60.3,56.3,31.8,21.9,15.0,14.2,13.1;C31H37BF2N5O6的HRMS计算值:624.2805,实验值:m/z 624.2801[M+H]+。
2,6-二氰基-4,4-二氟基-8-{3-[4-(3-羟丙基)-1H-1,2,3-三唑-1-基]-1,3,5,7-四甲基-4-硼杂-3a,4a-二氮杂-s-二环戊二烯并苯(T11).
自化合物Az11制备呈78%产率的化合物T11。C27H26BF2N7O2,红色固体,熔点175-177℃(分解);TLC(EtOAc)Rf=0.42;1H NMR(600MHz,CDCl3)δ7.90(1H,dd,J=9.0,2.3Hz),7.71(1H,s),7.58(1H,d,J=2.3Hz),7.20(1H,d,J=9.0Hz),3.86(3H,s),3.73(2H,t,J=6.1Hz),2.89(2H,t,J=7.3Hz),2.71(6H,s),1.99-1.95(2H,m),1.69(6H,s);13C NMR(150MHz,CDCl3)δ159.9,155.7,148.7,148.6,142.0,131.9,131.4,123.7,122.5,121.0,118.9,113.4,112.6,106.5,61.7,56.5,31.8,22.0,13.9,13.6;C27H27BF2N7O2的HRMS计算值:530.2287,实验值:m/z 530.2289[M+H]+。
实例3:生物分子侦测及成像
光谱量测
在25±0.1℃下使用路径长度为1-cm的光析槽在乙醇中进行胺基-BODIPY Am10、迭氮基-BODIPY Az2及Az9-Az11以及相应三唑基-BODIPY T2及T9-T11的所有光谱量测。所有溶液在量测之前在氩气下脱气几分钟。对于各实验,激发及发射的狭缝宽度为2.0nm。在0.07至0.7的吸收率范围内(l=10cm)量测吸收光谱。在荧光计及UV-Vis仪器上进行荧光量子产率量测。通过比较校正发射光谱下的面积获得相对量子效率。所报导的量子产率根据以下方程序计算为4个点的平均值:
Φ样品=Φ标准(A标准/A样品)(F样品/F标准)(n样品/n标准)2
其中「Φ」为量子产率,「A」为在激发频率处的吸收率,「F」为发射曲线下的积分面积,且「n」为所用溶剂的折射率。0.1M NaOH水溶液中的荧光素(Φf=0.85)及乙醇中的若丹明(Rhodamine)6G(Φf=0.95)为荧光标准。(Parker,C.A.;Rees,W.T.Analyst 1960,85,587-600;Kubin,R.F.;Fletcher,A.N.J.Luminescence 1982,27,455-462。)
微量滴定盘中的CuAAC反应的荧光筛检的程序.
96孔黑色底部微量滴定盘用于实验,且使用Molecular Devices Spectramax M5光谱仪进行荧光量测。在上方列中,各孔含有于EtOH/水(1:1)中的200μL迭氮基-BODIPY(Az1-Az8)(15μM)。在下方列中,各孔中的总体积为200μL,含有迭氮基-BODIPY(Az1-Az8)(15μM)、4-戊炔-1-醇(75μM)、CuSO4(150μM)、抗坏血酸钠(300μM)及tris-三唑配位体(150μM)于EtOH/水(1:1)中的溶液。如通过TLC或MS分析监测,盘在室温下培育6h,且接着当场进行荧光量测(λex=488nm)。可在365nm下用UV灯照射之后辨别荧光或非荧光三唑化合物的形成(图2)。
标记有AzBOCEt(Az10)的蛋白质
对于蛋白质标记实验,将60μg/mL炔基官能化BSA及90:10pH 7.4PBS/DMSO中的未修饰BSA用100μM tris-三唑配位体、1mM CuSO4、2mM新制备的抗坏血酸钠及0至100μM Az10在室温下在暗处培育1h。将各混合物(30μL)与含有5%β-巯基乙醇的10μL(4×)SDS负载染料混合,且将40μL各混合物逐渐载到4%至12%Bis-Tris凝胶上。使凝胶在100V下运行2.5h。凝胶使用Typhoon 9400可变模式影像器(Amersham BioScience)成像(λex=488nm;λem=526nm)且用库马斯蓝染色(图5)。
细胞中的荧光标记的显微镜分析
将CL1-5细胞接种于腔室载片上(1×104个细胞/1mL/孔),且在培养基(补充有10%FBS、100U/mL青霉素、100μg/mL链霉素、1mM L-麸酰胺酸及1mM丙酮酸钠的RPMI-1640)中用100μM各别炔基糖或对照物培育3天。炔基糖包括全乙酰化炔基-N-乙酰甘露糖胺(Ac4ManNAl)、全乙酰化炔基-N-乙酰半乳糖胺(Ac4GalNAl)及全乙酰化炔基-N-乙酰葡糖胺(Ac4GlcNAl)。对照糖包括全乙酰化N-乙酰甘露糖胺(Ac4ManNAc)、全乙酰化N-乙酰半乳糖胺(Ac4GalNAc)及全乙酰化N-乙酰葡糖胺(Ac4GlcNAc)。
为了侦测AzBOCEt(Az10)对糖类似物处理过的细胞的标记,将糖处理过的细胞用PBS洗涤,在室温下用3%多聚甲醛在PBS中固定20min,在室温下用0.2%Triton X-100在PBS中透化20min,且在室温下用3%牛血清白蛋白在PBS中阻断30min。为了观测细胞中的荧光标记炔标志醣基共轭物,用具有50%乙醇的PBS缓冲液中的0.1μM AzBOCEt(Az10)、100μM tris-三唑配位体、1mM CuSO4及2mM抗坏血酸钠将细胞在室温下培育1h。通过使用共焦雷射扫描显微镜在496-nm激发下获取细胞的荧光影像。为了识别炔基-聚醣的位置,进一步用抗GRASP65随后Cy3共轭抗兔(对于高尔基体)及赫斯特(对于细胞核)染色探针标记细胞(图6)。
细胞提取物中的炔标志唾液酸醣蛋白的侦测及识别
将自经100μM Ac4ManNAc或Ac4ManNAl处理3天的CL1-5细胞收获的细胞提取物(20μg)用指定浓度的Az10、100μM tris-三唑配位体、S3 1mM CuSO4及2mM抗坏血酸钠在室温下培育1h,进行CuAAC反应。进一步通过SDS-PAGE分离反应提取物且用Typhoon 9400可变模式影像器(Amersham BioScience)侦测荧光信号(λex=488nm;λem=526nm)。用库马斯蓝染色的蛋白质条带表示内参考物(图7)。
将含有标记有荧光信号的蛋白质的指定12个条带切除且切成小片。用50mM NH4HCO3/CH3CN 1:1(v/v)使凝胶片脱色,且接着用25mM NH4HCO3中的10mM二硫苏糖醇(DTT)在56℃下再水合45min。移除过量DTT且在室温下在暗处添加25mM NH4HCO3中的55mM碘乙酰胺(IAA)历时30min从而烷基化。移除过量IAA且将凝胶用50mM NH4HCO3/CH3CN 1:1(v/v)洗涤两次,且在使用真空离心干燥的后经CH3CN干燥。将新制备的胰蛋白酶溶液(5ng/μL于25mM NH4HCO3中,40μL)添加至各凝胶片,且将凝胶片升温至37℃后维持18h。用含有50%CH3CN(50μL)之1%三氟乙酸(TFA)水溶液将消化的肽在音波处理10min下提取两次。使用真空离心将合并的提取物及洗涤液浓缩3h以移除挥发物。如表2中所示分析消化肽且用混合线性离子阱四极傅里叶(fourier)-转移(LTQ-FT)质谱仪识别。
表2.通过质谱分析识别细胞提取物中的唾液酸醣蛋白。通过寄存编号对蛋白质列表且列出彼等蛋白质发现的肽编号(肽编号(#of Pep.))。
细胞中的双荧光标记的显微镜分析
将CL1-5细胞接种于腔室载片上(2.5×104个细胞/0.5mL/孔),且在培养基(补充有10%FBS、100U/mL青霉素、100μg/mL链霉素、1mM L-麸酰胺酸及1mM丙酮酸钠的RPMI-1640)中用100μM炔基糖(全乙酰化炔基-N-乙酰甘露糖胺,Ac4ManNAl)或迭氮基糖(全乙酰化迭氮基-N-乙酰葡糖胺,Ac4GlcNAz)或两者培育3天或无糖作为阴性对照。将细胞用PBS洗涤三次且接着在37℃下用100μM coumOCT在具有10%DMSO的PBS中培育30min。在用具有10%DMSO的PBS洗涤三次之后,随后在室温下用3%多聚甲醛在PBS中固定20min,在室温下将细胞用0.1μM AzBOCEt(Az10)、100μM配位体、1mM CuSO4及2mM抗坏血酸钠在具有50%乙醇的PBS中培育1h且使用共焦显微镜(TCS-SP5-MP-SMD,Leica)完成细胞的荧光影像(图9)。
实例4:环辛炔官能化荧光探针101的合成:
流程100展示使用1-苯并环庚酮作为起始材料进行化合物101的合成。根据先前所报导的程序,12 1-苯并环庚酮在8-位置处经受区域选择性硝化。接着还原硝基,随后在酸性条件下进行重氮化及羟基化,得到醇104。在以苄基醚形式保护羟基之后,通过在BF3·OEt2存在下用TMS-重氮甲烷处理使环酮105经历扩环,得到呈73%产率的环辛酮产物106。用NaBH4还原羰基,随后硅烷化,得到呈96%产率的硅烷基醚107。通过氢化移除107中的苄基,且用过量多聚甲醛在Et3N及MgCl2存在下处理酚中间物以形成柳醛108。通过用新制备的亚烯酮基三苯基磷烷处理108来建构109的香豆素架构。在去硅烷化及氧化之后,获得呈78%产率的酮110。将化合物110中的羰基转化成烯醇三氟甲磺酸酯,随后用强碱NaHMDS处理以呈现消除反应,得到coumOCT探针101。
流程100.基于SPAAC的荧光形成探针101及相应三唑111及112的合成。
试剂及条件:(a)浓H2SO4、KNO3,0℃,1.5h,72%;(b)Sn、浓盐酸、C2H5OH,回流,50min,82%;(c)10%H2SO4水溶液、NaNO2,0℃至室温,72h,76%;(d)BnBr、K2CO3、DMF,室温,24h,98%;(e)TMSCHN2、BF3·OEt2、CH2Cl2,0℃,12h,73%;(f)NaBH4、CH3OH,0℃,1h;(g)TIPSOTf、2,6-二甲基吡啶、CH2Cl2,室温,1h,两个步骤96%;(h)H2、Pd/C、CH3OH、EtOAc,1h;(i)多聚甲醛、MgCl2、Et3N、CH3CN,回流,12h,两个步骤87%;(j)Ph3P=C=C=O、甲苯,90℃,1.5h,83%;(k)TBAF、THF,0℃至室温,1h;(l)(COCl)2、DMSO、Et3N、CH2Cl2,-78℃至室温,1h,两个步骤78%;(m)NaHMDS、Tf2NPh,-78℃至室温,2h,44%;(n)BnN3(1.5当量)、CH3CN,室温,2h,95%;(o)N-迭氮基乙酰甘露糖胺(1.5当量)、MeOH、H2O,室温,2h,92%。
3-硝基-6,7,8,9-四氢苯并环庚烯-5-酮(A).
将1-苯并环庚酮(4.0g,25mmol)于浓H2SO4(28mL)中的溶液在0℃下冷却,且历经30min时段逐滴添加KNO3(2.8g,27.7mmol)于浓H2SO4(7.5mL)中的溶液。将混合物在0℃下搅拌额外1h,且接着倾入碎冰中。过滤沈淀物,用水洗涤且风干,产生黄色固体。通过硅胶上管柱层析(EtOAc/己烷,1:4)纯化粗产物,得到纯硝基产物A(3.69g,72%)。C11H11NO3,白色针状物,熔点90-92℃(文献S2熔点89-90℃);TLC(EtOAc/己烷,1:4)Rf=0.31;1H NMR(600MHz,CDCl3)δ8.53(1H,d,J=2.5Hz),8.22(1H,dd,J=8.3,2.5Hz),7.37(1H,d,J=8.3Hz),3.01(2H,t,J=6.4Hz),2.77(2H,t,J=6.1Hz),1.94-1.90(2H,m),1.85-1.81(2H,m);13C NMR(150MHz,CDCl3)δ203.4,148.0,147.0,139.8,131.0,126.2,123.9,40.4,32.4,24.7,20.5;C11H12NO3的HRMS计算值:206.0812,实验值:m/z 206.0814[M+H]+。
3-胺基-6,7,8,9-四氢苯并环庚烯-5-酮(B).
将硝基化合物A(2.05g,10mmol)及Sn(8.31g,70mmol)于浓盐酸(45mL)及乙醇(25mL)中的混合物在回流下加热50min。将混合物冷却到室温,且用30%NaOH水溶液碱化。经由硅藻土垫过滤混合物,且用乙醇洗涤。用EtOAc(5×50mL)萃取滤液。合并的有机萃取物用盐水(100mL)洗涤,经MgSO4干燥,过滤且在减压下浓缩,得到分析纯胺基产物B(1.44g,82%)。C11H13NO,淡黄色固体,熔点102-104℃(文献S2熔点103-105℃);TLC(EtOAc/己烷,3:7)Rf=0.29;1H NMR(600MHz,CDCl3)δ7.02(1H,d,J=2.6Hz),6.96(1H,d,J=8.0Hz),6.72(1H,dd,J=8.0,2.6Hz),3.65(2H,br s,NH),2.79(2H,t,J=5.5Hz),2.67(2H,t,J=6.6Hz),1.81-1.74(4H,m);13C NMR(150MHz,CDCl3)δ206.2,144.9,139.3,131.6,130.7,118.8,114.5,40.8,31.5,25.4,20.9;C11H14NO的HRMS计算值:176.1070,实验值:m/z 176.1069[M+H]+。
3-羟基-6,7,8,9-四氢苯并环庚烯-5-酮(104).
向胺基化合物B(1.45g,8.3mmol)于H2SO4(40mL于10%水溶液中)中的冷(0℃)溶液中小心地添加水(3mL)中的NaNO2水溶液(687mg,9.96mmol)。将反应混合物在0℃下搅拌30min,且接着添加胺磺酸以破坏过量亚硝酸。过滤悬浮液且将滤液倾入10%H2SO4水溶液(100mL)及甲苯(50mL)中。将混合物在室温下搅拌3天。接着分离各层且用EtoAc(5×30mL)萃取水层。用盐水(100mL)洗涤合并的有机萃取物,经MgSO4干燥,过滤且在减压下浓缩。通过硅胶上管柱层析(EtOAc/己烷,1:4)纯化粗产物,得到分析纯醇产物104(1.11g,76%)。C11H12O2,黄色固体,熔点98-100℃(文献S3熔点96-99℃);TLC(EtOAc/己烷,3:7)Rf=0.37;1H NMR(600MHz,CDCl3)δ7.33(1H,d,J=2.8Hz),7.07(1H,d,J=8.2Hz),6.94(1H,dd,J=8.2,2.8Hz),6.27(1H,s,OH),2.84(2H,t,J=5.7Hz),2.72(2H,t,J=6.4Hz),1.86-1.76(4H,m);13C NMR(150MHz,CDCl3)δ206.7,154.7,139.2,133.9,131.3,119.8,114.9,40.8,31.6,25.3,20.8;C11H13O2的HRMS计算值:177.0910,实验值:m/z 177.0911[M+H]+。
3-苄氧基-6,7,8,9-四氢苯并环庚烯-5-酮(105).
用苄基溴(1mL,8.4mmol)及碳酸钾(2.1g,15.2mmol)处理醇化合物104(1.25g,7.1mmol)于无水DMF(10mL)中的溶液。将悬浮液在室温下剧烈搅拌24h。将混合物倾入水(20mL)中且用Et2O(4×30mL)萃取,用水(3×20mL)及盐水(100mL)洗涤合并的有机萃取物,经MgSO4干燥,过滤且在减压下浓缩。通过硅胶上管柱层析(EtOAc/己烷,1:9)纯化粗产物,得到纯苄氧基产物105(1.85g,98%)。C18H18O2,浅黄色油状物;TLC(EtOAc/己烷,1:9)Rf=0.37;1H NMR(600MHz,CDCl3)δ7.41(2H,d,J=7.2Hz),7.37-7.35(3H,m),7.31(1H,d,J=7.4Hz),7.10(1H,d,J=8.3Hz),7.02(1H,dd,J=8.3,2.9Hz),5.06(2H,s),2.86(2H,t,J=5.8Hz),2.71(2H,t,J=6.2Hz),1.84-1.78(4H,m);13C NMR(150MHz,CDCl3)δ205.6,157.4,139.5,136.7,134.2,131.0,128.5(2×),127.9,127.5(2×),119.7,113.2,70.1,40.7,31.6,25.3,20.8;C18H19O2的HRMS计算值:267.1380,实验值:m/z 267.1383[M+H]+。
3-苄氧基-7,8,9,10-四氢-5H-苯并环辛烯-6-酮(106).
历经1h时段在0℃下将(三甲基硅烷基)重氮甲烷(5mL,约2M己烷溶液,10mmol)于CH2Cl2(10mL)中的搅拌溶液逐滴添加至化合物105(1.6g,6mmol)及BF3·OEt2(820μL,10mmol)于CH2Cl2(20mL)中的搅拌溶液中。将混合物在0℃下搅拌12h,且接着倾入碎冰中。用CH2Cl2(3×20mL)萃取水层。用盐水(50mL)洗涤合并的有机萃取物,经MgSO4干燥且浓缩,得到橙色油状物,其通过硅胶上管柱层析(EtOAc/己烷,1:19)纯化,得到纯环辛酮产物106(1.23g,73%)。C19H20O2,无色油状物;TLC(EtOAc/己烷,1:9)Rf=0.29;1H NMR(600MHz,CDCl3)δ7.40(2H,d,J=7.4Hz),7.37-7.34(2H,m),7.31-7.29(1H,m),7.09(1H,d,J=8.4Hz),6.84(1H,dd,J=8.4,2.7Hz),6.75(1H,d,J=2.7Hz),5.01(2H,s),3.72(2H,s),2.74(2H,t,J=5.8Hz),2.31(2H,t,J=5.3Hz),1.81-1.77(2H,m),1.72-1.68(2H,m);13C NMR(150MHz,CDCl3)δ211.8,157.4,136.9,134.7,133.4,131.2,128.5(2×),127.9,127.5(2×),116.0,114.4,70.0,48.8,41.0,32.3,31.5,24.7;C19H21O2的HRMS计算值:281.1536,实验值:m/z 281.1539[M+H]+。
3-苄氧基-6-三异丙基甲硅烷氧基-5,6,7,8,9,10-六氢苯并环辛烯(107).
用NaBH4(970mg,25.7mmol)处理化合物106(4.8g,17.1mmol)于甲醇(40mL)中的冷(0℃)溶液。将混合物在0℃下搅拌1h,且接着在减压下浓缩。将残余物溶解于CH2Cl2(80mL)中,且用1M盐酸水溶液(50mL)及盐水(50mL)洗涤。有机层经MgSO4干燥,过滤且浓缩,提供呈无色泡沫状的粗醇产物(4.8g),其不经进一步纯化即用于下一步骤。
将以上制备的醇(4.8g,17.0mmol)及2,6-二甲基吡啶(8mL,68.7mmol)溶解于无水CH2Cl2(50mL)中,且冷却至0℃。历经3min时段将三氟甲烷磺酸三异丙基硅烷酯(9.2mL,34.2mmol)逐滴添加至混合物中。将混合物在室温下搅拌1h,且接着用CH2Cl2(100mL)稀释。用NaHCO3(50mL)饱和水溶液、1M盐酸水溶液(50mL)及盐水(50mL)洗涤溶液。有机层经MgSO4干燥,过滤且在减压下浓缩。通过硅胶上管柱层析(EtOAc/己烷,1:9)纯化残余物,得到纯硅烷基醚产物107(7.2g,两个步骤96%)。C28H42O2Si,无色浆状物;TLC(EtOAc/己烷,1:9)Rf=0.51;1H NMR(600MHz,CDCl3)δ7.41(2H,d,J=7.4Hz),7.37-7.34(2H,m),7.31-7.28(1H,m),6.99(1H,dd,J=6.6,2.5Hz),6.75-6.74(2H,m),5.01(2H,s),3.96-3.93(1H,m),2.91-2.83(2H,m),2.77-2.72(1H,m),2.65-2.61(1H,m),1.76-1.72(1H,m),1.71-1.64(1H,m),1.50-1.41(3H,m),1.18-1.15(1H,m),1.07-1.05(21H,m);13C NMR(150MHz,CDCl3)δ156.8,138.5,137.3,134.1,130.1,128.5(2×),127.8,127.5(2×),116.7,112.5,73.8,70.0,40.9,34.5,32.3,32.0,20.8,18.2(6×),12.4(3×);C28H43O2Si的HRMS计算值:439.3032,实验值:m/z 439.3022[M+H]+。
3-羟基-6-三异丙基甲硅烷氧基-5,6,7,8,9,10-六氢苯并环辛烯-2-甲醛(108).
在氢气氛围下用Pd/C(100mg)处理化合物107(7.1g,16.2mmol)于甲醇(50mL)及EtOAc(20mL)中的溶液。在搅拌1h之后,经由硅藻土过滤混合物,且用EtOAc冲洗。在减压下浓缩滤液,得到淡棕色浆状物(5.6g),将其溶解于无水乙腈(150mL)中且用无水MgCl2(4.64g,48.6mmol)、三乙胺(13.5mL,97.2mmol)及多聚甲醛(4.86g,162mmol)处理。将悬浮液在回流下加热12h。将混合物冷却至室温,且用1M盐酸水溶液(200mL)使深黄色悬浮液酸化。用EtOAc(5×150mL)萃取溶液。用盐水(200mL)洗涤合并的有机萃取物,经MgSO4干燥,过滤且在减压下浓缩。通过硅胶上管柱层析(EtOAc/己烷,1:19)纯化粗产物,得到纯柳醛产物108(5.3g,两个步骤87%)。C22H36O3Si,浅黄色浆状物;TLC(EtOAc/己烷,1:9)Rf=0.71;1H NMR(600MHz,CDCl3)δ10.77(1H,s),9.79(1H,s),7.24(1H,s),6.76(1H,s),4.03-3.99(1H,m),2.94-2.88(2H,m),2.81-2.76(1H,m),2.71-2.67(1H,m),1.80-1.75(1H,m),1.72-1.66(1H,m),1.52-1.46(2H,m),1.43-1.38(1H,m),1.24-1.16(1H,m),1.07-1.05(21H,m);13C NMR(150MHz,CDCl3)δ195.9,159.5,148.2,133.8,133.7,119.5,118.8,73.2,41.0,34.4,32.2,32.1,20.6,18.1(6×),12.4(3×);C22H37O3Si的HRMS计算值:377.2506,实验值:m/z 377.2511[M+H]+。
6,7,8,9,10,11-六氢-10-三异丙基甲硅烷氧基-环辛[g]烯-2(2H)-酮(109)
亚烯酮基三苯基磷烷的制备:在0℃下向乙氧羰基亚甲基三苯基磷烷(10g,30mmol)于无水甲苯(200mL)中的搅拌溶液中逐滴添加六甲基二硅烷胺化钠(17.5mL,2M THF溶液,35mmol)溶液。一旦完成添加,将混合物在60℃下加热24h。接着使反应物冷却至室温且过滤出。在减压下浓缩滤液,且接着倾入乙醚(200mL)中。过滤沈淀物,用乙醚洗涤且风干,得到呈浅黄色固体状的亚烯酮基三苯基磷烷(5.8g,64%)。
在室温下向柳醛108(4.3g,11.42mmol)于无水甲苯(100mL)中的搅拌溶液中添加新制备的亚烯酮基三苯基磷烷(5.2g,17.2mmol)。将混合物在90℃下加热1.5h,且接着在减压下浓缩。通过硅胶上管柱层析(EtOAc/己烷,1:9)纯化残余物,得到纯香豆素产物109(3.8g,83%)。C24H36O3Si,无色固体,熔点103-105℃;TLC(EtOAc/己烷,1:9)Rf=0.25;1H NMR(600MHz,CDCl3)δ7.61(1H,d,J=9.5Hz),7.18(1H,s),7.10(1H,s),6.33(1H,d,J=9.5Hz),4.02(1H,dd,J=11.9,5.5Hz),3.00-2.94(2H,m),2.86-2.81(1H,m),2.76-2.72(1H,m),1.80-1.73(1H,m),1.69-1.64(1H,m),1.60-1.55(1H,m),1.47-1.43(2H,m),1.20-1.13(1H,m),1.11-1.03(21H,m);13C NMR(150MHz,CDCl3)δ161.3,152.3,143.3,142.4,138.4,127.8,118.1,117.3,115.7,73.3,40.8,34.5,32.4,32.0,20.6,18.1(6×),12.4(3×);C24H37O3Si的HRMS计算值:401.2506,实验值:m/z 401.2511[M+H]+。
6,7,8,9-四氢-11H-10-侧氧基-环辛[g]烯-2(2H)-酮(110)
用四丁基氟化铵(10mL,1M THF溶液,10mmol)处理化合物109(3.0g,7.5mmol)于THF(20mL)中的冷(0℃)溶液。在室温下搅拌1h之后,在减压下浓缩混合物。经由硅胶短垫(EtOAc/己烷,1:4)过滤残余油状物且浓缩滤液,得到无色固体(1.67g)。
在-78℃下在氮气氛围下将DMSO(1.5mL,21.2mmol)于无水CH2Cl2(10mL)中的溶液逐滴添加至乙二酰氯(0.89mL,10.3mmol)于无水CH2Cl2(10mL)中的搅拌溶液中。将混合物在-78℃下搅拌30min,且逐滴添加以上制备的无水CH2Cl2(10mL)中的醇(1.67g)。将混合物在-78℃下搅拌额外30min,且添加三乙胺(7.1mL,50.4mmol)。使混合物升温至0℃后维持30min,且接着倾入(40mL)水中。用CH2Cl2(5×50mL)萃取水层。用水(100mL)及盐水(100mL)洗涤合并的有机萃取物,经MgSO4干燥,过滤且在减压下浓缩。通过硅胶上管柱层析(EtOAc/己烷,1:4)纯化粗产物,得到所要产物110(1.45g,两个步骤78%)。C15H14O3,无色固体,熔点127-129℃;TLC(EtOAc/己烷,3:7)Rf=0.32;1H NMR(600MHz,CDCl3)δ7.63(1H,d,J=9.5Hz),7.29(1H,s),7.09(1H,s),6.34(1H,d,J=9.5Hz),3.82(2H,s),2.84(2H,t,J=5.7Hz),2.31(2H,t,J=5.6Hz),1.86-1.84(2H,m),1.73-1.71(2H,m);13C NMR(150MHz,CDCl3)δ209.9,160.7,152.6,142.8,138.2,137.7,129.0,118.4,117.7,116.6,48.8,41.1,32.3,31.4,24.5;C15H15O3的HRMS计算值:243.1016,实验值:m/z 243.1016[M+H]+。
6,7,8,9-四氢-10,11-二脱氢-环辛[g]烯-2(2H)-酮(101)
历经5min时段经由注射器向化合物110(245mg,1mmol)及N-苯基双(三氟甲基磺酰亚胺)(393mg,1.1mmol)于无水THF(10mL)中的冷(-78℃)溶液中添加六甲基二硅烷胺化钠溶液(0.55mL,2M THF溶液,1.1mmol)。将混合物在-78℃下搅拌1h,且添加另一批六甲基二硅烷胺化钠(0.55mL,2M THF溶液,1.1mmol)。使混合物升温至0℃,搅拌额外1h,且接着用甲醇(1mL)淬灭。在减压下浓缩混合物,得到黄色浆状物,其通过硅胶上管柱层析(EtOAc/己烷,1:9)纯化,得到靶产物101(72mg,44%)。C15H12O2,淡黄色固体,熔点98-100℃;TLC(EtOAc/己烷,3:7)Rf=0.42;1H NMR(600MHz,CDCl3)δ7.60(1H,d,J=9.5Hz),7.23(1H,s),7.06(1H,s),6.35(1H,d,J=9.5Hz),2.81(2H,br s),2.61(2H,t,J=56.7Hz),2.13(2H,br s),1.74(2H,br s);13C NMR(150MHz,CDCl3)δ161.1,152.6,147.4,143.3,128.6,127.1,117.5,117.4,116.1,113.9,92.5,38.3,33.5,25.5,20.5;C15H13O2的HRMS计算值:225.0910,实验值:m/z 225.0910[M+H]+。
10-苄基-6,7,8,9-四氢-环辛三唑并[5,4-g]烯-2(2H)-酮(111)
用苄基迭氮化物(44μL,0.33mmol)处理化合物101(50mg,0.22mmol)于CH3CN(5mL)中的溶液。在室温下搅拌2h之后,在减压下浓缩混合物。通过硅胶上管柱层析(EtOAc/己烷,3:7)纯化残余物,得到所要三唑产物111(75mg,95%)。C22H19N3O2,无色固体,熔点60-62℃;TLC(EtOAc/己烷,1:1)Rf=0.35;1H NMR(600MHz,CDCl3)δ7.75(1H,s),7.65(1H,d,J=9.4Hz),7.37-7.32(3H,m),7.24(1H,s),7.20-7.19(2H,m),6.39(1H,d,J=9.4Hz),5.50(2H,s),2.69-2.67(2H,m),2.65-2.63(2H,m),1.79-1.75(2H,m),1.67-1.64(2H,m);13C NMR(150MHz,CDCl3)δ161.0,152.4,143.1,136.1,135.3,135.0,134.4,129.0(2×),128.7,128.4,128.1,127.1(2×),126.9,116.7,116.4,51.9,30.8,30.6,23.9,20.0;C22H20N3O2的HRMS计算值:358.1550,实验值:m/z 358.1548[M+H]+。
N-[2-(11-侧氧基-4,6,7,11-四氢烯并[7',6':3,4]环辛[1,2-d][1,2,3]三唑-3(5H)-基)]乙酰胺基-2-脱氧-α,β-D-哌喃甘露糖(112)
用N-迭氮基乙酰甘露糖胺(142mg,0.33mmol)处理化合物101(50mg,0.22mmol)于MeOH(5mL)及水(1mL)中的溶液。在室温下搅拌2h之后,在减压下浓缩混合物。通过硅胶上管柱层析(MeOH/CH2Cl2,1:9)纯化残余物,得到所要三唑产物112(98mg,92%)。C23H26N4O8,无色固体,熔点170-172℃(分解);TLC(MeOH/CH2Cl2,1:8)Rf=0.25;1H NMR(600MHz,DMSO-d6)δ8.04(1H,d,J=9.5Hz),7.59(1H,s),7.52(1H,s),6.48(1H,d,J=9.5Hz),5.15(1H,d,J=2.9Hz),5.11(1H,d,J=6.9Hz),4.98-4.85(1H,m),4.89-4.81(2H,m),4.44-4.38(1H,m),3.61-3.59(3H,m),3.53-3.45(2H,m),3.42-3.37(1H,m),3.16-3.14(2H,m),2.86-2.82(2H,m),2.72-2.70(2H,m),1.78(2H,br s),1.61(2H,br t,J=5.5Hz);13C NMR(150MHz,DMSO-d6)δ165.2,160.1,151.9,143.8,140.6,137.0,135.9,134.7,128.8,118.6,116.1,115.2,92.5,90.4,72.9,72.1,71.0,70.5,68.2,67.5,61.5,61.0,54.7,54.2,50.0,49.9,30.6,29.9,22.8,19.6;C23H27N4O8的HRMS计算值:487.1829,实验值:m/z 487.1827[M+H]+。
实例5:模型受质上使用的环辛炔稠合荧光探针的量测反应范围及动力学
为了评估化合物101作为基于SPAAC的荧光标记的试剂的可行性,首先研究使用苄基迭氮化物作为模型受质的其反应范围及动力学。101与苄基迭氮化物在乙腈中的SPAAC反应在室温下在2h内完成,得到呈95%产率的三唑111(流程100)。通过对1H-NMR光谱中的多个化学位移进行积分确定101与苄基迭氮化物(1:1)在CD3CN中的反应性,在25℃下产生二阶速率常数0.012M-1s-1。吾人亦观测101与N-迭氮基乙酰甘露糖胺(ManNAz)之间的环加成反应,类似地进行,在25℃下在CD3OD-D2O溶液(5:1,v/v)中产生二阶速率常数为0.010M-1s-1的三唑112(图17及图18)。
表3展示在模拟生理条件(含有10%DMSO的PBS缓冲液,pH 7.4)下所记录的101、111及112的吸收及荧光数据。三唑111及112的形成伴随荧光强度的显着增加,其中对于香豆素发射,其中大的斯托克位移(Stokes shift)在标准范围内(图16a)。在330nm处激发后,探针101产生中心位于405nm处的具有低量子产率(Φf=0.011)的弱发射频带,然而三唑111及112均在435nm处展现强荧光,其中量子产率分别为0.23及0.21。
为了探测在对于生物分子标记而言将为更典型的条件下的SPAAC反应,吾人研究101与ManNAz反应的荧光响应及时间过程。实验指示大于90%的ManNAz在40分钟内被消耗,且荧光强度在小于1h内达到平稳阶段(图16b)。
表3.探针101及三唑111、112的光谱特性
a消光系数:在340nm处针对101量测,且在330nm处针对111及112量测。
b荧光量子产率:使用硫酸奎宁(Φf=0.54±0.03)作为标准。
图16描述(a)101(黑色)、111(蓝色)及112(红色)的吸收及荧光发射光谱(λex=330nm)(45μM,含有10%DMSO的PBS缓冲液,pH 7.4)。(b)在435nm(λex=330nm)处用于101(30μM)与N-迭氮基乙酰甘露糖胺(30μM)在含有10%DMSO的PBS缓冲液中的接合反应的正规化荧光强度的时间过程。
部分A:将化合物101及苄基迭氮化物预溶解于CD3CN中,且接着以20mM等莫耳浓度混合。历经1h时段通过1H-NMR分析监测所述反应。基于初始化合物101的浓度,通过对1H-NMR光谱中的多个化学位移进行积分来确定各组分的浓度。通过绘制1/[101](M-1)对比时间(秒)的曲线图,使用线性回归分析测定以M-1s-1为单位的二阶速率常数。此程序重复3次,其中浓缩为20mM,在25℃下得到速率常数0.012M-1s-1(图17)。
图17描述如通过1H-NMR监测的化合物101与苄基迭氮化物在CD3CN中的反应的1/[101]对比时间的曲线图。
部分B:将化合物101及N-迭氮基乙酰甘露糖胺预溶解于CD3OD/D2O(5:1,v/v)中,且接着以20mM等莫耳浓度混合。历经1h时段通过1H-NMR分析监测所述反应。基于初始化合物101的浓度,通过对1H-NMR光谱中的多个化学位移进行积分来确定各组分的浓度。通过绘制1/[101](M-1)对比时间(秒)的曲线图,使用线性回归分析测定以M-1s-1为单位的二阶速率常数。此程序重复3次,其中浓缩为20mM,在25℃下得到速率常数0.010M-1s-1(图18)。
图18描述如通过1H-NMR监测的化合物101与N-迭氮基乙酰甘露糖胺在CD3OD-D2O溶液(5:1,v/v)中的反应的1/[101]对比时间的曲线图。
实例6:使用环辛炔稠合荧光探针101进行染色样品的活细胞成像:
评估101在活细胞成像中的效能。出于此目的,将高度唾液酸化肺癌细胞CL1-5在全乙酰化N-迭氮基乙酰甘露糖胺(Ac4ManNAz)存在下培养3天以代谢产生迭氮基-唾液酸表达的细胞。作为阴性对照,CL1-5细胞在全乙酰化N-乙酰甘露糖胺(Ac4ManNAc)存在下生长。通过在无洗涤及无固定的条件下以30-min间隔使细胞暴露来进行时间过程实验(图19、图22)。Ac4ManNAz处理过的细胞展示荧光强度的时间依赖性增加(上方列:青色,下方列:蓝色)且接着培育1.5h达到饱和。相比之下,对照细胞展现几乎无荧光染色,支持背景标记为可忽略的。此外,通过共焦显微镜目测到含迭氮基醣共轭物在活细胞中的定位。随后,用抗GRASP65随后FITC共轭抗兔(对于高尔基体)及碘化丙锭(PI,核标记)染色由探针101标记的细胞。来源于香豆素探针的蓝色荧光信号在不添加Ac4ManNAc的情况下明显展示于Ac4ManNAz处理过的细胞中(图20)。使用coumOCT探针(蓝色荧光)在细胞溶质中目测到标记的唾液酸化醣共轭物,且与高尔基体(绿色染色)显着重迭,但不在细胞核(红色染色)中。
图19描述在无洗涤及无固定的条件下用200μM Ac4ManNAz培育且用100μM探针101标记的活CL1-5细胞的延时荧光及重迭影像:细胞的荧光影像(上方列)及细胞的明视场重迭影像(下方列)。对照物:用Ac4ManNAc培育的细胞。(比例尺:10μm)
图20描述如通过共焦显微镜目测的探针标记唾液酸醣共轭物在CL1-5细胞中的定位。用200μM Ac4ManNAz或Ac4ManNAc培育的细胞经100μM 101(蓝色)标记且经抗GRASP65随后FITC共轭抗兔(对于高尔基体,绿色)及碘化丙锭(对于细胞核,红色)染色。(比例尺:10μm)
出人意料地,在延时实验中不仅在细胞表面上且亦在细胞内观测到蓝色荧光。因此,吾人检查coumOCT 101是否可为可用于活细胞中的直接细胞内标记的细胞可渗透探针。朝向此目标,将CL1-5细胞用Ac4ManNAz培育1h且随后移除过量Ac4ManNAz。吾人接着进行成像来监测唾液酸化醣共轭物的运输。如图21中所示,唾液酸化醣共轭物容易通过使用coumOCT成像且在初始阶段与高尔基体(红色)显着重迭。然而,在5h之后在细胞表面上侦测到蓝色荧光信号的出现。荧光强度随时间增加,且在8h下达到饱和(图21及图23)。吾人的结果指示coumOCT不仅为细胞可渗透探针且亦特异于活细胞中的内源性含迭氮基醣共轭物的直接标记。
图21描述使用细胞中的SPAAC的coumOCT(1)运输的醣共轭物的荧光成像。将CL1-5细胞用500μM Ac4ManNAz培育1h且随后用PBS缓冲液洗涤以移除过量Ac4ManNAz。将糖处理过的细胞在培养基中分别培育3h、5h及8h,且接着在SPAAC条件下用100μM探针101标记0.5h。将高尔基体用抗GRASP65随后Cy3共轭抗兔标记。(比例尺:5μm)
通过荧光光谱法进行时间过程量测.
将探针101(0.075μmol)及N-迭氮基乙酰甘露糖胺(0.075μmol)于含10%DMSO的PBS缓冲液(2.5mL)混合物中的溶液在37℃下培育。以5分钟间隔监测在330nm处激发后在435nm处的荧光发射强度。对于各点,历经5秒时段量测荧光强度且对总共3个点取平均值。在对照实验中,除了将N-乙酰甘露糖胺(0.075μmol)添加至溶液中以外,使用相同条件。
活细胞中的荧光标记的延时显微镜分析.
为了观测细胞中的荧光标记迭氮基-醣共轭物,将CL1-5细胞接种于腔室载片(2.5×104个细胞/0.5mL/孔)上且在培养基(补充有10%FBS、100U/mL青霉素、100μg/mL链霉素、1mM L-麸酰胺酸及1mM丙酮酸钠的RPMI-1640)中用200μM对照糖(全乙酰化N-乙酰甘露糖胺,Ac4ManNAc)或迭氮基糖(全乙酰化N-迭氮基乙酰甘露糖胺,Ac4ManNAz)培育3天。
对于活细胞的延时成像,使用装备有培育箱以将细胞保持于培养条件下的共焦显微镜(TCS-SP5-MP-SMD,Leica)进行实验。将预洗涤细胞用100μM探针101在具有10%DMSO的PBS中培育且历经1.5h进行来自先前实验的活细胞的荧光成像。在450nm发射处且以5-min为间隔获取影像。
为了比较迭氮基-醣共轭物的定位,将探针标记细胞用PBS洗涤,在室温下用3%多聚甲醛在PBS中固定20min,在室温下用0.2%Triton X-100在PBS中透化20min,且在室温下用3%牛血清白蛋白在PBS中阻断30min。将细胞用抗GRASP65随后FITC共轭抗兔(对于高尔基体)及碘化丙锭(PI)(对于细胞核)染色。
图22描述在无洗涤及无固定的条件下用200μM Ac4ManNAz培育且用100μM探针101标记的活CL1-5细胞的延时荧光及重迭影像:细胞的荧光影像(上方列)及细胞的明视场重迭影像(下方列)。对照物:用Ac4ManNAc培育的细胞。(比例尺:25μm)
通过活细胞中的荧光标记进行运输的唾液酸共轭物的显微镜分析。
为了观测依赖于不同时间的细胞中荧光标记唾液酸共轭物,将CL1-5细胞接种于腔室载片(2.5×104个细胞/0.5mL/孔)上且在培养基(补充有10%FBS、100U/mL青霉素、100μg/mL链霉素、1mM L-麸酰胺酸及1mM丙酮酸钠的RPMI-1640)中用500μM迭氮基糖(全乙酰化N-迭氮基乙酰甘露糖胺,Ac4ManNAz)培育1h。将细胞用PBS洗涤三次且接着在培养基中培育。在3h、5h及8h之后,在37℃下将细胞用100μM coumOCT(101)在具有10%DMSO的PBS中培育30min。对于活细胞的荧光成像,使用装备有培育箱以将细胞保持于培养条件下的共焦显微镜(TCS-SP5-MP-SMD,Leica)进行实验。
为了比较唾液酸共轭物的定位,将探针标记细胞用PBS洗涤,在室温下用3%多聚甲醛在PBS中固定20min,在室温下用0.2%Triton X-100在PBS中透化20min,且在室温下用3%牛血清白蛋白在PBS中阻断30min。将细胞进一步用抗GRASP65随后Cy3共轭抗兔(对于高尔基体)染色。
图23描述使用细胞中的SPAAC的coumOCT(101)进行运输的醣共轭物的荧光成像。将CL1-5细胞用500μM Ac4ManNAz培育1h且随后用PBS缓冲液洗涤以移除过量Ac4ManNAz。将糖处理过的细胞在培养基中分别培育3h、5h及8h,且接着在SPAAC条件下用100μM探针101标记0.5h。将高尔基体用抗GRASP65随后Cy3共轭抗兔标记。(比例尺:10μm)
实验7:双标记实验
使用SPAAC与CuAAC的组合对两种不同代谢并入醣共轭物的并发的荧光标记进行双标记实验。全乙酰化N-乙酰甘露糖胺(Ac4ManNAc)及全乙酰化N-乙酰葡糖胺(Ac4GlcNAc)用作对照糖。将ManNAc代谢转化成唾液酸,其经发现为细胞中的醣蛋白及醣脂的末端单醣,然而GlcNAz为富含在内质网及高尔基体中产生的N-连接聚醣及O-连接聚醣的内部单醣。将CL1-5细胞在含炔糖(Ac4ManNAl)及含迭氮基糖(Ac4GlcNAz)存在下培育三天。将细胞通过SPAAC用coumOCT(对于迭氮基糖)、随后通过CuAAC用AzBOCEt6j(对于炔基糖)染色,且通过共焦显微镜进行研究(图24)。
迭氮基糖及炔基糖处理过的细胞均在两个荧光信道中展示独特图案(图24a、图24b、图24c),然而,任一糖的遗漏导致相应信道中无标记(图24d、图24e、图24f及图24g、图24h、图24i)。有趣的是,成像实验显示ManNAl及GlcNAz标记物质在相同定位处、可能在高尔基体中显着展现。另外,在细胞表面上且部分地在关于AzBOCEt标记的细胞溶质中清楚地观测到所表达的炔基标记唾液酸化醣共轭物,然而,仅在使用coumOCT探针的细胞溶质中展示GlcNAz标记聚醣。虽然通常通过末端醣基化将唾液酸附接至N-连接聚醣及O-连接聚醣,但将非天然GlcNAz并入醣蛋白中可能影响醣基转移酶用于进一步醣基化的特异性及效率。因此,可将不成熟的异常醣蛋白输送至细胞溶质用于降解。这些发现验证coumOCT及AzBOCEt可用作荧光形成探针,用于通过SPAAC及CuAAC三唑形成化学反应同时侦测单个细胞内的迭氮基标记及炔标记代谢并入的醣共轭物。
图24A、24B展示细胞中标记有coumOCT(1)、AzBOCEt且通过共焦显微镜成像的双荧光。(A)说明使用Ac4ManNAl、Ac4GlcNAz、101及AzBOCEt的细胞标记实验。将CL1-5细胞用100μM Ac4ManNAl及Ac4GlcNAz或对照糖(Ac4ManNAc及Ac4GlcNAc)培育3天,用100μM探针101在SPAAC条件下处理0.5h,且接着用0.1μM AzBOCEt在CuAAC条件下培育1h。(B)CL1-5细胞中的双荧光成像。这些醣共轭物用探针101(青色)(对于含迭氮基醣共轭物)及AzBOCEt(绿色)(对于含炔醣共轭物)标记。(比例尺:10μm)
细胞中的双荧光标记的显微镜分析
将CL1-5细胞接种于腔室载片上(2.5×104个细胞/0.5mL/孔),且在培养基(补充有10%FBS、100U/mL青霉素、100μg/mL链霉素、1mM L-麸酰胺酸及1mM丙酮酸钠的RPMI-1640)中用100μM炔基糖(全乙酰化炔基-N-乙酰甘露糖胺,Ac4ManNAl)或迭氮基糖(全乙酰化N-迭氮基乙酰葡糖胺,Ac4GlcNAz)或两者培育3天或无糖作为阴性对照。将细胞用PBS洗涤三次且接着在37℃下用100μM coumOCT(101)在具有10%DMSO的PBS中培育30min。在用具有10%DMSO的PBS洗涤三次之后,随后在室温下用3%多聚甲醛在PBS中固定20min,在室温下将细胞用0.1μM AzBOCEt、100μM配位体、1mM CuSO4及2mM抗坏血酸钠在具有50%乙醇的PBS中培育1h且使用共焦显微镜(TCS-SP5-MP-SMD,Leica)完成细胞的荧光影像。
实验8:化合物(101)及化合物(111)在3-巯基丙酸存在下的稳定性
环辛炔的潜在难以解决的副反应为蛋白质或内源性硫醇与相应乙烯硫醚的加成。为了测试101及相应三唑111的潜在非特定染色是否可能由于蛋白质或内源性硫醇的SH基团与三键或双键的加成而发生,通过用3-巯基丙酸在CDCl3中培育101及111进行实验(图25及图26)。NMR光谱分析表明101及111对用3-巯基丙酸进行硫醇-炔或硫醇-烯加成失活。这些结果展示应用101作为荧光形成探针允许出人意料地侦测活细胞中的代谢并入的醣共轭物,而无需通过硫醇-炔加成进行非特定染色,且所形成的三唑将不经历硫醇-烯加成以淬灭荧光。
在室温(25℃)下用3-巯基丙酸溶液(32mM于CDCl3中)培育化合物101及化合物111的溶液(25mM于CDCl3中)。历经24h通过1H-NMR分析监测所述反应。1H-NMR分析表明化合物101及化合物111在硫醇存在下具有高稳定性,因为通过1H-NMR分析,3-巯基丙酸对化合物101及化合物111无取代效应(图25及图26)。
图25展示单独的化合物101及3-巯基丙酸于CDCl3中的1H-NMR光谱,且在25℃下将化合物101的1H-NMR光谱用3-巯基丙酸处理0h、2h及24h。
图26展示单独的化合物111及3-巯基丙酸于CDCl3中的1H-NMR光谱,且在25℃下将化合物111的1H-NMR光谱用3-巯基丙酸处理24h。
本发明描述一种新颖的基于SPAAC的荧光形成探针coumOCT(101),其用于在无洗涤及无固定的条件下进行活细胞中的实时成像。分别以0.012M-1s-1速率常数在CD3CN中及以0.010M-1s-1速率常数在CD3OD-D2O溶液(5:1,v/v)中进行101与苄基迭氮化物及N-迭氮基乙酰甘露糖胺的SPAAC反应。三唑产物111及112与未反应的101相比展示量子产率增加20倍(Φf=0.23及Φf=0.21)。此外,本发明确定101为用于使活细胞中的含迭氮基醣共轭物成像的荧光接通探针。SPAAC反应为自发的且不需要冲洗步骤。此外,探针101为无毒且细胞可渗透的而无背景标记问题,允许在CuAAC下同时标记两种不同糖与AzBOCEt的组合。本发明代表细胞成像的显着进步,且应潜在地适用于活体内生物化学事件的实时侦测。
实例9:CoumFSA(601)的合成.
用乙酰氯处理唾液酸(Neu5Ac),根据1H NMR分析得到呈大于90%产率的氯化物中间物。将粗产物溶解于吡啶中且加热至50℃,随后浓缩且研磨以移除吡啶盐酸盐,自唾液酸得到具有78%总产率的烯糖201。通过用Boc2O处理化合物201以产生N-乙酰基-N-Boc保护的产物202,其在Zemplén条件下去乙酰随后乙酰化提供N-Boc保护的化合物203自化合物201合成Neu5Boc2en 203。203与N-溴丁二酰亚胺(NBS)及水在MeCN中在80℃下的溴羟基化得到溴醇204a及204b(91%;204a/204b=3.1:1)。用1,8-二氮杂双环[5.4.0]十一-7-烯(DBU)处理204a,得到环氧化物205(86%)。自205制备在C-3处具有羟基的醣基溴化物206。通过甲基伞形酮钠在无水DMF中获得呈52%产率的α-醣苷207。在用三氟乙酸(TFA)在水中移除207的Boc基团之后,将所得胺盐在碱DIPEA及偶合剂HBTU存在下用4-戊炔酸在DMF中处理,得到炔基产物208。通过将208转化成三氟甲磺酸酯,使其与二氟三甲基硅酸参(二甲胺基)锍(TASF)在回流THF中反应完成氟化合物209。在逆相管柱上纯化之后,在碱性条件下使209去保护,产生呈75%产率的CoumFSA(601)。
实例10:DFSA(501)的合成.
化合物203与选择性氟试剂(Selectfluor)在MeNO2水溶液中在室温下的氟羟基化得到氟醇210a及210b(59%;210a/210b=1.3:1)。用三氟化二乙胺基硫(DAST)处理210a,得到二氟化合物211a及211b(75%;211a/211b=5.3:1)。在用三氟乙酸(TFA)在水中移除211a的Boc基团之后,将所得胺盐在碱DIPEA及偶合剂HBTU存在下用4-戊炔酸在DMF中处理,得到炔基产物212。在逆相管柱上纯化之后,在碱性条件下使212去保护,产生呈55%产率的DFSA(501)。
在申请专利范围中,除非相反地指示或另外从上下文显而易见,否则诸如「一(a/an)」及「所述」的冠词可意谓一个或大于一个。除非相反地指示或另外从上下文显而易见,否则若一个、大于一个或所有群组成员存在于、用于给定产物或方法中或另外与给定产物或方法相关,则在群组的一或多个成员之间包括「或」的申请专利范围或描述被视为满足。本发明包括恰好一个群组成员存在于、用于给定产物或方法中或另外与给定产物或方法相关的实施例。本发明包括大于一个或所有群组成员存在于、用于给定产物或方法中或另外与给定产物或方法相关的实施例。
此外,本发明涵盖所有变化、组合及排列,其中将来自所列的申请专利范围中的一或多项的一或多个限制、要素、条款及描述性术语引入另一申请专利范围中。举例而言,依附于另一申请专利范围的任何申请专利范围可经修改以包括在依附于同一基本申请专利范围的任何其他申请专利范围中可见的一或多个限制。其中,要素如所列呈现,例如呈马库什(Markush)组格式,亦揭示要素的各子组,且可自所述组移除任何要素。应理解,一般而言,当本发明或本发明的态样称为包含特定要素及/或特征时,本发明的某些实施例或本发明的态样由此类要素及/或特征组成或基本上由其组成。出于简单的目的,彼等实施例尚未具体地以词语阐述在本文中。亦应注意,术语「包含」及「含有」意欲为开放的且容许包括额外要素或步骤。当给出范围时,包括端点。此外,除非另外指示或另外从上下文及一般技术者的理解显而易见,否则表示为范围的值可在本发明的不同实施例中采用所述范围内的任何特定值或子范围,除非上下文另外明确规定,否则达到所述范围下限的单位的十分之一。
本申请案提及各种颁予的专利、公开的专利申请案、期刊文章及其他出版物,以上所有者均以引用的方式并入本文中。若任何并入的参考文献与本说明书之间存在冲突,则应以本说明书为准。另外,本发明的属于先前技术的任何特定实施例可明确地自申请专利范围中的任何一或多项排除。因为此类实施例被认为是一般技术者所已知的,其可经排除,即使未在本文中明确地阐述所述排除。本发明的任何特定实施例可出于任何原因自任何申请专利范围排除,无论是否与先前技术的存在相关。
熟习此项技术者最多使用常规实验将认识到或能够确定本文所描述的特定实施例的许多等效物。本文所描述的本发明实施例的范围并不意欲限于以上描述,但实际上如所附申请专利范围中所阐述。一般技术者将了解,可在不脱离如以下申请专利范围所定义的本发明的精神或范围的情况下对本说明书进行各种改变及修改。
参考文献
Rostovtsev,V.V.;Green,L.G.;Fokin,V.V.;Sharpless,K.B.“A stepwise Huisgen cycloaddition process:copper(I)-catalyzed regioselective“ligation”of azides and terminal alkynes.”Angew.Chem.Int.Ed.2002,41,2596-2599.
Zhou,Z.;Fahrni,C.J.A“Fluorogenic probe for the copper(I)-catalyzed azide-alkyne ligation reaction:Modulation of the fluorescence emission via 3(n,π*)-1(π,π*)Inversion.”J.Am.Chem.Soc.2004,126,8862-8863.
Sivakumar,K.;Xie,F.;Cash,B.M.;Long,S.;Barnhill,H.N.;Wang,Q.“A fluorogenic 1,3-dipolar cycloaddition reaction of 3-azidocoumarins and acetylenes.”Org.Lett.2004,24,4603-4606.
Prescher,J.A.;Bertozzi,C.R.“Chemistry in living systems.”Nat.Chem.Biol.2005,1,13-21.
Sawa,M.;Hsu,T.-L.;Itoh,T.;Sugiyama,M.;Hanson,S.R.;Vogt,P.K.;Wong,C.-H.“Glycoproteomic probes for fluorescent imaging of fucosylated glycans in vivo.”Proc.Nat.Acad.Sci.U.S.A.,2006,103,12371-12376.
Hsu,T.-L.;Hanson,S.R.;Kishikawa,K.;Wang,S.-K.;Sawa,M.;Wong,C.-H.“Alkynyl sugar analogs for the labeling and visualization of glycoconjugates in cells.”Proc.Natl.Acad.Sci.U.S.A.2007,104,2614-2619.
Loudet,A.;Burgess,K.“BODIPY dyes and their derivatives:syntheses and spectroscopic properties.”Chem.Rev.2007,107,4891-4932.
Wu,P.;Fokin,V.V.“Catalytic azide-alkyne cycloaddition:reactivity and Applications.”Aldrichim.Acta 2007,40,7-17.
Ulrich,G.;Ziessel,R.;Harriman,A.“The chemistry of fluorescent bodipy dyes:
Versatility unsurpassed.”Angew.Chem.Int.Ed.2008,47,1184-1201.
Li,L.;Han,J.;Nguyen,B.;Burgess,K.“Syntheses and spectral properties of functionalized,water-soluble BODIPY derivatives.”J.Org.Chem.2008,73,1963-1970.
Xie,F.;Sivakumar,K.;Zeng,Q.B.;Bruckman,M.A.;Hodges,B.;Wang,Q.“A fluorogenic'click'reaction of azidoanthracene derivatives.”Tetrahedron 2008,64,2906-2914.
Baskin,J.M.;Amacher,S.L.;Bertozzi,C.R.”In vivo imaging of membrane-associated glycans in developing zebrafish.”Science 2008,320,664-667.
Best,M.D.“Click chemistry and bioorthogonal reactions:unprecedented selectivity in the labeling of biological molecules.”Biochemistry 2009,48,6571-6584.
Sletten,E.M.;Bertozzi,C.R.“Bioorthogonal chemistry:fishing for selectivity in a sea of Functionality.”Angew.Chem.Int.Ed.2009,48,6974-6998.
Li,J.;Hu,M.;Yao,S.Q.“Rapid synthesis,screening,and identification of xanthone and xanthene-based fluorophores using click chemistry.”Org.Lett.2009,11,3008-3011.
Le Droumaguet,C.;Wang,C.;Wang,Q.“Fluorogenic click reaction.”Chem.Soc.Rev.2010,39,1233-1239.
Qi,J.;Han,M.-S.;Chang,Y.-C.;Tung,C.-H.“Developing visible fluorogenic'click-on'dyes for cellular imaging.”Bioconjugate Chem.2011,22,1758-1762.
Chao,W.;Fang,X.;Nisaraporn,S.;Jian,S.;Qian,W.“Tuning the optical properties of BODIPY dye through Cu(I)catalyzed azide-alkyne cycloaddition(CuAAC)reaction.”Sci.China Chemistry 2012,55,125-130.
Boens,N.;Leen,V.;Dehaen,W.“Fluorescent indicators based on BODIPY.”Chem.Soc.Rev.2012,41,1130-1172.
Shieh,P.;Hangauer,M.J.;Bertozzi,C.R.“Fluorogenic azidofluoresceins for biological imaging.”J.Am.Chem.Soc.2012,134,17428-17431.
Kamkaew,A.;Lim,S.H.;Lee,H.B.;Kiew,L.V.;Chung,L.Y.;Burgess,K.“BODIPY dyes in photodynamic therapy.”Chem.Soc.Rev.2013,42,77-88.
Herner,A.;I.;Kállay,M.;Lemke,E.A.;Kele,P.“A new family of bioorthogonally applicable fluorogenic labels.”Org.Biomol.Chem.2013,11,3297-3306.
Chauhan,D.P.;Saha,T.;Lahiri,M.;Talukdar,P.“BODIPY based'click on'fluorogenic dyes:application in live cell imaging.”Tetrahedron Lett.2014,55,244-247.
- 还没有人留言评论。精彩留言会获得点赞!