一种多聚联苄化合物及其制备方法与用途与流程
本发明涉及一种多聚联苄化合物及其制备方法与用途。
背景技术:
现有文献报道了如下所示的联苄类化合物,具有抑制被动皮肤过敏反应(passive cutaneous anaphylaxis)以及抑制RBL-2H3细胞(嗜碱性细胞白血病细胞)释放β-己糖胺酶的药效和用途(见:Matsuda H et al.Antiallergic Phenanthrenes and…Planta Med 2004;70:847-855):
目前,未见有本发明式Ⅰ所示多聚联苄化合物的研究报道,更未见有本发明式Ⅰ所示多聚联苄化合物用于制备抗肿瘤药物的研究报道。
技术实现要素:
本发明的目的在于提供一种结构和药用价值都不同的新的多聚联苄化合物:式Ⅰ所示的化合物。
本发明提供的式Ⅰ所示的化合物或其药学上可接受的盐、晶型、溶剂合物:
其中,
R1、R2、R3、R4、R5、R6、R7、R8分别独立地选自H、羟基、巯基、C1~C4烷基或C1~C4烷氧基。
进一步的,R1、R3、R5、R8分别独立地选自C1~C4烷基或C1~C4烷氧基;R2、R4、R6、R7分别独立地选自H、羟基或巯基。
进一步的,R1、R3、R5、R8分别独立地选自甲氧基、乙氧基、正丙氧基或异丙氧基;R2、R4、R6、R7分别独立地选自羟基或巯基。
进一步的,所述的化合物为
本发明提高了一种制备化合物Y的方法,它包括以下步骤:
i、取白及,用乙醇提取,得到乙醇提取液;
ii、取乙醇提取液,浓缩,得到流浸膏;
iii、将流浸膏用水分散,依次用乙酸乙酯、正丁醇萃取,合并乙酸乙酯部分,回收溶剂,得到乙酸乙酯浸膏;
iv、取乙酸乙酯浸膏,采用硅胶柱色谱,依次以石油醚-丙酮=100:1、50:1、30:1为洗脱剂进行梯度洗脱,得到石油醚-丙酮=30:1时的洗脱液Fr.16;
v、Fr.16上反相聚苯乙烯型树脂柱,依次以乙醇-水=10:90、30:70、50:50、70:30、90:10、100:0为洗脱剂进行梯度洗脱,得到乙醇-水=100:0时的Fr.16-j;
vi、Fr.16-j上葡聚糖凝胶色谱柱,以二氯甲烷-甲醇=1:1为洗脱剂,依次洗脱0.8倍柱体积、2.2倍柱体积,分别得到Fr.16-j-1、Fr.16-j-2;
vii、Fr.16-j-2经过硅胶柱色谱,依次以二氯甲烷-甲醇=1:0、200:1、100:1为洗脱剂,分别洗脱3个柱体积,回收溶剂,收集二氯甲烷-甲醇=100:1时的Fr.16-j-2c;
viii、Fr.16-j-2c经过制备薄层色谱,以二氯甲烷-丙酮=20:1为展开剂,Rf=0.60,得到样品,然后用反相高效液相色谱进行分离,以甲醇-水=78:22为洗脱剂进行洗脱,在210nm波长下进行检测,收集28min的组分,得到化合物Y。
进一步的,
步骤iv中,所述乙酸乙酯浸膏的量为155~165g,梯度洗脱的条件如下:
步骤v中,所述Fr.16的量为15~20g,梯度洗脱的条件如下:
本发明还提供了上述的化合物或其药学上可接受的盐、晶型、溶剂合物在制备治疗和/或预防肿瘤的药物中的用途。
进一步的,所述的肿瘤为肺癌和/或急性白血病。
本发明还提供了一种治疗和/或预防肿瘤的药物组合物,它是以上述化合物或其药学上可接受的盐、晶型、溶剂合物为活性成分,加上药学上常用的辅料制备得到的制剂。
进一步的,所述的肿瘤为肺癌和/或急性白血病。
本发明的多聚联苄化合物,与现有的联苄类化合物相比,在结构上差异很大;并且,本发明多聚联苄化合物具有新的药效:对肿瘤细胞具有很好的抑制作用,特别是,对肺癌细胞具有很好的抑制作用,此外,本发明多聚联苄化合物还对急性单白血病细胞的增殖具有显著的抑制活性;同时,本发明多聚联苄化合物的制备方法简便,反应条件温和,便于操作和控制,能耗小,产率高,成本低,非常适合产业化生产。
本发明中提供的化合物和衍生物可以根据IUPAC(国际纯粹与应用化学联合会)或CAS(化学文摘服务社,Columbus,OH)命名系统命名。
关于本发明的使用术语的定义:除非另有说明,本文中基团或者术语提供的初始定义适用于整篇说明书的该基团或者术语;对于本文没有具体定义的术语,应该根据公开内容和上下文,给出本领域技术人员能够给予它们的含义。
“取代”是指分子中的氢原子被其它不同的原子或分子所替换。
碳氢基团中碳原子含量的最小值和最大值通过前缀表示,例如,前缀Ca~Cb烷基表明任何包含“a”至“b”个碳原子的烷基。因此,例如,C1~C4烷基是指包含1~4个碳原子的烷基,换句话说,C1~C4烷基包括甲基、乙基、丙基、异丙基、正丁基、异丁基、叔丁基。
术语“药学上可接受的”是指某载体、运载物、稀释剂、辅料,和/或所形成的盐通常在化学上或物理上与构成某药物剂型的其它成分相兼容,并在生理上与受体相兼容。
术语“盐”和“可药用的盐”是指上述化合物或其立体异构体,与无机和/或有机酸和碱形成的酸式和/或碱式盐,也包括两性离子盐(内盐),还包括季铵盐,例如烷基铵盐。这些盐可以是在化合物的最后分离和纯化中直接得到。也可以是通过将上述化合物,或其立体异构体,与一定数量的酸或碱适当(例如等当量)进行混合而得到。这些盐可能在溶液中形成沉淀而以过滤方法收集,或在溶剂蒸发后回收而得到,或在水介质中反应后冷冻干燥制得。本发明中所述盐可以是化合物的盐酸盐、硫酸盐、枸橼酸盐、苯磺酸盐、氢溴酸盐、氢氟酸盐、磷酸盐、乙酸盐、丙酸盐、丁二酸盐、草酸盐、苹果酸盐、琥珀酸盐、富马酸盐、马来酸盐、酒石酸盐或三氟乙酸盐。
本发明化合物或药物组合物的施用方式没有特别限制,代表性的施用方式包括(但并不限于):口服、肠胃外(静脉内、肌肉内或皮下)、和局部给药。
用于口服给药的固体剂型包括胶囊剂、片剂、丸剂、散剂和颗粒剂。在这些固体剂型中,活性化合物与至少一种常规惰性赋形剂(或载体)混合,如柠檬酸钠或磷酸二钙,或与下述成分混合:(a)填料或增容剂,例如,淀粉、乳糖、蔗糖、葡萄糖、甘露醇和硅酸;(b)粘合剂,例如,羟甲基纤维素、藻酸盐、明胶、聚乙烯基吡咯烷酮、蔗糖和阿拉伯胶;(c)保湿剂,例如,甘油;(d)崩解剂,例如,琼脂、碳酸钙、马铃薯淀粉或木薯淀粉、藻酸、某些复合硅酸盐、和碳酸钠;(e)缓溶剂,例如石蜡;(f)吸收加速剂,例如,季胺化合物;(g)润湿剂,例如鲸蜡醇和单硬脂酸甘油酯;(h)吸附剂,例如,高岭土;和(i)润滑剂,例如,滑石、硬脂酸钙、硬脂酸镁、固体聚乙二醇、十二烷基硫酸钠,或其混合物。胶囊剂、片剂和丸剂中,剂型也可包含缓冲剂。
固体剂型如片剂、糖丸、胶囊剂、丸剂和颗粒剂可采用包衣和壳材制备,如肠衣和其它本领域公知的材料。它们可包含不透明剂,并且,这种组合物中活性化合物或化合物的释放可以延迟的方式在消化道内的某一部分中释放。可采用的包埋组分的实例是聚合物质和蜡类物质。必要时,活性化合物也可与上述赋形剂中的一种或多种形成微胶囊形式。
用于口服给药的液体剂型包括药学上可接受的乳液、溶液、悬浮液、糖浆或酊剂。除了活性化合物外,液体剂型可包含本领域中常规采用的惰性稀释剂,如水或其它溶剂,增溶剂和乳化剂,例知,乙醇、异丙醇、碳酸乙酯、乙酸乙酯、丙二醇、1,3-丁二醇、二甲基甲酰胺以及油,特别是棉籽油、花生油、玉米胚油、橄榄油、蓖麻油和芝麻油或这些物质的混合物等。
除了这些惰性稀释剂外,组合物也可包含助剂,如润湿剂、乳化剂和悬浮剂、甜味剂、矫味剂和香料。
除了活性化合物外,悬浮液可包含悬浮剂,例如,乙氧基化异十八烷醇、聚氧乙烯山梨醇和脱水山梨醇酯、微晶纤维素、甲醇铝和琼脂或这些物质的混合物等。
用于肠胃外注射的组合物可包含生理上可接受的无菌含水或无水溶液、分散液、悬浮液或乳液,和用于重新溶解成无菌的可注射溶液或分散液的无菌粉末。适宜的含水和非水载体、稀释剂、溶剂或赋形剂包括水、乙醇、多元醇及其适宜的混合物。
用于局部给药的本发明化合物的剂型包括软膏剂、散剂、贴剂、喷射剂和吸入剂。活性成分在无菌条件下与生理上可接受的载体及任何防腐剂、缓冲剂,或必要时可能需要的推进剂一起混合。
本发明所述药学上可接受的辅料,是指除活性成分以外包含在剂型中的物质。
本发明所述药学上可接受的辅助性成分,它具有一定生理活性,但该成分的加入不会改变上述药物组合物在疾病治疗过程中的主导地位,而仅仅发挥辅助功效,这些辅助功效仅仅是对该成分已知活性的利用,是医药领域惯用的辅助治疗方式。若将上述辅助性成分与本发明药物组合物配合使用,仍然属于本发明保护的范围。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
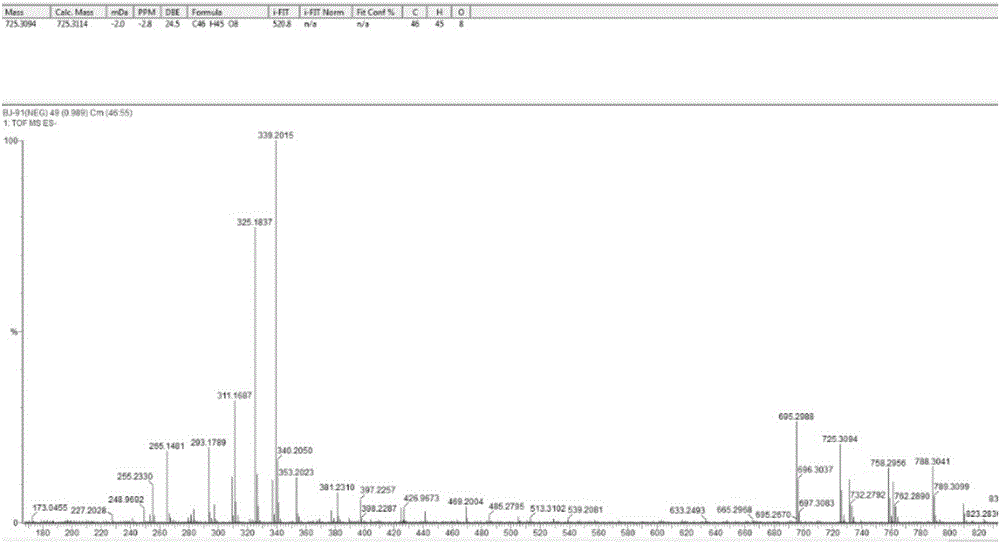
图1为本发明实施例1所得化合物Y的HR-ESI-MS谱。
图2为本发明实施例1所得化合物Y的1H NMR谱。
图3为本发明实施例1所得化合物Y的13C NMR谱。
具体实施方式
本发明具体实施方式中使用的原料、设备均为已知产品,通过购买市售产品获得。
实验材料:
①试剂
柱层析硅胶,200~300目(试剂级),购于青岛海洋硅胶干燥剂厂;
薄层层析硅胶G、GF254和H(化学纯),购于青岛海洋硅胶干燥剂厂;
MCI gel CHP 20P,75~150μm,为反相聚苯乙烯型树脂,购于日本三菱化学公司;
Sephadex LH-20葡聚糖凝胶,购于瑞典Amersham公司;
GF254硅胶制备薄层,购于烟台江友硅胶开发有限公司;
95%乙醇(成都科龙化工试剂厂);
甲醇(成都科龙化工试剂厂);
二氯甲烷(成都科龙化工试剂厂);
二甲基亚砜(成都科龙化工试剂厂);
二甲基亚砜(色谱级)(Sigma公司);
IMDM(Gibco公司生成);
1640培养基、胎牛血清(Hyclone公司生产);
胰蛋白酶(Gibco公司);
MTT(Amresco公司);
所用其它试剂均为分析纯。
②实验仪器
Waters Synapt G2HDMS高分辨飞行时间质谱(美国Waters);
Bruker-AV-600核磁共振仪(瑞士Bruker);
BP211D十万分之一电子天平(瑞士Sartorius);
R-210旋转蒸发器(瑞士BUCHI);
DZG-6050型真空干燥箱(上海森信);
酶标仪(Thermo 3001,Thermo Fisher Scientific公司);
电子天平(ESJ120-4型,沈阳龙腾电子称量仪器有限公司);
超净台(MCV-B161F(T),日本SANYO公司);
显微镜(Primo Vert,AxioCam ERc 5s,ZEISS公司);
CO2培养箱(HH.CP-T,上海齐欣科学仪器有限公司)。
③细胞
肺癌细胞A549、人急性淋巴髓单核细胞白血病细胞MV4-11均来源于美国ATCC公司。
实施例1、本发明多聚联苄化合物的提取以及结构鉴定
(1)药材的提取:
干燥的白及药材粗粉(3kg),以95%乙醇回流提取3次(30L×3),每次2h;
(2)成分的分离纯化:
①、乙醇提取液(90L)经减压浓缩干燥得半固体流浸膏510g;
②、将半固体流浸膏(500g)用水(5L)分散,依次用乙酸乙酯(20L)、正丁醇(20L)萃取,合并乙酸乙酯部分,减压回收溶剂,得乙酸乙酯浸膏160g;
③、采用硅胶柱色谱对乙酸乙酯浸膏(160g)进行分离,石油醚:丙酮进行梯度洗脱,洗脱液经薄层色谱法检测,得到石油醚:丙酮=30:1时的洗脱液Fr.16;
梯度洗脱的条件如下:
④、Fr.16组分(18g)经过MCI处理以10%-100%v/v的乙醇水进行梯度洗脱,并结合薄层色谱进行检测,分别得到10个组分Fr.16-a~Fr.16-j;
梯度洗脱的条件如下:
⑤、Fr.16-j组分(3.0g)经过凝胶LH-20色谱柱,以二氯甲烷-甲醇=1:1为洗脱剂,进行洗脱,Fr.16-j-1、Fr.16-j-2、Fr.16-j-3分别为洗脱0.8倍柱体积、2.2倍柱体积、3倍柱体积时依次收集的组分,其中Fr.16-j-2组分为联苄化合物的集中部位;
⑥、Fr.16-j-2组分(1.8g)经过硅胶柱色谱,分别以二氯甲烷-甲醇=1:0、200:1、100:1、50:1进行洗脱,每个比例洗脱剂洗脱3个柱体积,减压回收溶剂,收集100:1洗脱部位Fr.16-j-2c;
⑦、Fr.16-j-2c组分(390mg)以制备薄层色谱(展开剂为二氯甲烷-丙酮=20:1,Rf=0.60)进行分离,再将薄层板制备得到的样品用反相高效液相色谱进行分离,以78%甲醇-水进行洗脱,以210nm波长进行检测,收集28min洗脱得到的色谱峰,得到本发明化合物Y;
薄层色谱显色时,喷以10%硫酸乙醇试液,于105℃下显色3min多显黄色、橘红色至微红色斑点,可以用于联苄的追踪检测;
本发明化合物Y的分子式C46H46O8,高分辨质谱数据:HR-ESI-MS m/z 725.3094[M-H]-(C46H45O8的计算值为725.3114),不饱和度为24;
该化合物的核磁共振氢谱(1H-NMR)和核磁共振碳谱(13C-NMR)由Bruker-AV-600核磁共振仪测定,具体数据见表1;
表1、本发明化合物Y的1H NMR(600MHz)和13C NMR(150MHz)in CD3COCD3的数据
由上述波谱学数据,结合HSQC、COSY、HMBC二维核磁共振数据,确定本发明化合物Y为3,3′-双(对羟基苄基)-4,6′-二甲氧基-2,2′-双(3-甲氧基苯乙基)-(1,1′-联苯)-6,4′-二醇,其结构如下:
实施例2、本发明多聚联苄化合物的抗肺癌A549活性试验
①细胞接种
用0.25%胰酶消化对数生长期的细胞。用含10%FBS的细胞培养基培养配成单细胞悬液。采用细胞计数板计数,将状态良好的A549肿瘤细胞接种于96孔板,使细胞密度为4×103个/mL,每孔加入细胞悬液100μL,置于37℃,5%CO2培养箱内培养24h。
②药物处理
每个样品从10μg/mL开始,用培养基梯度稀释样品,2倍稀释,设置5个药物浓度,每个浓度做复孔测试。以浓度为10、5、2.5、1.25、0.625μg/mL每孔加药100μL,每个浓度设3个复孔,重复3次。阴性对照组为含有适量DMSO的培养基溶液,空白对照组为不含细胞的培养基和溶媒。将96孔板放回培养箱,37℃作用72h。
③显色及IC50的计算
72h作用完毕后,避光条件下每孔加入MTT溶液(5g/L)20μL,继续温育培养4h后,弃掉上清液,每孔加入150μL DMSO,置于摇床上慢速振摇10min,使甲瓒充分溶解后,用酶标仪测量570nm波长处的OD值。
采用改良寇氏法IC50=log-1[Xm-i(∑P-0.5)]进行计算,其中Xm:设计的最大浓度的对数值;i:各浓度倍比浓度的对数值;ΣP:各组生长抑制率之和;0.5:经验常数。通过重复三次试验,计算得到3个IC50值(保留两位小数),求平均值,得到本发明实施例1所得化合物Y的IC50值为0.9μM。
上述结果表明,本发明的多聚联苄化合物,对肺癌细胞的增殖具有显著的抑制活性,能够用于治疗和/或预防肺癌,具有良好的临床应用前景。
实施例3、本发明多聚联苄化合物的抗急性单白血病MV4-11活性试验
①细胞接种
用0.25%胰酶消化对数生长期的细胞。用含10%FBS的细胞培养基培养配成单细胞悬液。采用细胞计数板计数,将状态良好的MV4-11细胞接种于96孔板,使细胞密度为2×104个/mL,每孔加入细胞悬液100μL,置于37℃,5%CO2培养箱内培养24h。
②药物处理
每个样品从20μg/mL开始,用培养基梯度稀释样品,2倍稀释,设置5个药物浓度,每个浓度做复孔测试。以浓度为20、10、5、2.5、1.25μg/mL每孔加药100μL,每个浓度设3个复孔,重复3次。阴性对照组为含有适量DMSO的培养基溶液,空白对照组为不含细胞的培养基和溶媒。将96孔板放回培养箱,37℃作用72h。
③显色及IC50的计算
72h作用完毕后,避光条件下每孔加入MTT溶液(5g/L)20μL,继续温育培养4h后,弃掉上清液,每孔加入150μL DMSO,置于摇床上慢速振摇10min,使甲瓒充分溶解后,用酶标仪测量570nm波长处的OD值。
采用改良寇氏法IC50=log-1[Xm-i(∑P-0.5)]进行计算,其中Xm:设计的最大浓度的对数值;i:各浓度倍比浓度的对数值;ΣP:各组生长抑制率之和;0.5:经验常数。通过重复三次试验,计算得到3个IC50值(保留两位小数),求平均值,得到本发明实施例1所得化合物Y的IC50值为13.2μM。
上述结果表明,本发明的多聚联苄化合物,同时还对急性单白血病细胞的增殖具有显著的抑制活性,能够用于治疗和/或预防急性白血病,具有良好的临床应用前景。
综上所述,本发明的多聚联苄化合物,与现有的联苄类化合物相比,在结构上差异很大;并且,本发明多聚联苄化合物具有新的药效:对肿瘤细胞具有很好的抑制作用,特别是,对肺癌细胞具有很好的抑制作用,此外,本发明多聚联苄化合物还对急性单白血病细胞的增殖具有显著的抑制活性;同时,本发明多聚联苄化合物的制备方法简便,反应条件温和,便于操作和控制,能耗小,产率高,成本低,非常适合产业化生产。
- 还没有人留言评论。精彩留言会获得点赞!